一种拟穴青蟹抗病因子SpALF6单核苷酸突变体及其制备方法和应用与流程
本发明属水产动物新型天然药物与饲料添加剂开发和应用技术领域,特别涉及一种拟穴青蟹抗病因子spalf6单核苷酸突变体spalf6-m,及其制备方法和应用。
背景技术:
拟穴青蟹(scyllaparamamosain)是我国乃至世界重要的海水经济蟹类。拟穴青蟹又称青蟹,属节肢动物门、甲壳纲、十足目、青蟹属,在我国主要分布于东南沿海近海海域,目前在长江口区域如崇明岛也有养殖,属我国传统海洋渔业资源和海水养殖蟹类,具有重要经济价值。青蟹具有生长快、体型大、肉味鲜美等优点,深受消费者青睐。青蟹养殖主要分布在东南沿海区域,近年来,养殖区域已扩大到长江口流域,经形成了较大的养殖规模,养殖青蟹年产量一直稳定在10万吨以上,保持了稳定的发展势头。
目前,病害是制约青蟹养殖业发展的重要瓶颈。培育抗病能力强的青蟹新品种是促进青蟹养殖业健康发展的一个重要任务。抗脂多糖因子(anti-lipopolysaccharidefactor,alf)首次发现于鲎体内,因该因子具有抗凝血作用,能够抑制细菌脂多糖(lps)引发的凝集反应,故命名为抗脂多糖因子。最早发现的鲎lalf对r-型革兰氏阴性菌具有强烈的抑制作用。随后对alf的分子结构进一步研究表明,alf对lps具有高亲和力,能够结合lps类脂a并中和其生物学活性。目前,多种甲壳动物alf在对虾、螯虾、蟹等动物体内相继被鉴定。该类蛋白对革兰氏阴性和革兰氏阳性细菌、真菌及wssv等具有不同程度的杀灭或抑制作用,表明alf是动物体内重要的抗病因子。
目前水产养殖动物中细菌耐药现象较为普遍,常规药物使用经常达不到预期效果,不但药物使用浪费,还不能挽回因病害带来的经济损失,因此开发新型抗耐药菌药物也是水产病害防治的一个重要课题。在创制本发明过程中,我们发现该蛋白对常见水产动物病原具有广谱抗菌活性,特别是对耐药性溶藻弧菌、副溶血弧菌和哈维氏弧菌也具有显著抑制效果,因此该蛋白在制备抗水产动物饲料添加剂方面具有光明的应用前景。此外,spalf6的单氨基酸突变体spalf6-m对真菌抑菌活性显著增强,特别是对白色念珠球菌生长抑制活性。虽然目前的研究显示alf家族蛋白具有较为广谱的抗微生物活性,但该类蛋白抗白色念珠球菌活性的报道却很少,鉴于白色念珠球菌是包括人在内高等动物病原,通过一定的途径获取spalf6-m蛋白可以作为新型抗真菌药物。
此外,大肠杆菌表达系统是制备蛋白产品有效方法,由于该方法产量大、成本低、制备过程相对简单,是目前大量获取外源蛋白的主要途径。在创制本发明专利过程中,发现spalf6-m可在本研究构建的大肠杆菌表达系统中可溶性表达。与蛋白表达过程中形成不可溶的包涵体相比,生产工艺和成本会显著降低,因此本发明所创制的spalf6-m制备方法为新型药物和水产饲料添加剂的开发和推广应用创造了条件。
技术实现要素:
本发明的目的在于提供一种拟穴青蟹抗病因子spalf6单核苷酸突变体spalf6-m,及其制备方法和应用。
为了实现上述目的,本发明采用了以下技术方案:
本发明的第一方面,提供一种拟穴青蟹抗病因子spalf6,其全长cdna的核苷酸序列如seqidno:1所示。
spalf6的全长cdna(seqidno:1)为681bp,其中第79位至第426位的核苷酸为编码氨基酸序列的开放阅读框(seqidno:5),全长348bp。
所述的拟穴青蟹抗病因子spalf6的全长氨基酸序列如seqidno:2所示。spalf6全长含115个氨基酸,其中第22个至第115个氨基酸为成熟肽序列,成熟肽前端还有21个氨基酸的信号肽序列。
本发明的第二方面,提供一种拟穴青蟹抗病因子spalf6单核苷酸突变体(spalf6-m),其全长核苷酸序列如seqidno:3所示。所述的spalf6-m是在spalf6核苷酸序列的基础上,从5’端起第215个核苷酸由a突变为g。
所述的拟穴青蟹抗病因子spalf6单核苷酸突变体(spalf6-m)的全长氨基酸序列如seqidno:4所示。spalf6-m全长也含115个氨基酸,其中第22个至第115个氨基酸为成熟肽序列,成熟肽前端还有21个氨基酸的信号肽序列。所述的spalf6-m是在spalf6氨基酸序列的基础上,从5’端起第46个氨基酸(组氨酸)由his突变为arg(精氨酸)。
本发明的第三方面,提供一种上述拟穴青蟹抗病因子spalf6单核苷酸突变体spalf6-m的制备方法,包括以下步骤:
(a)根据氨基酸序列seqidno:4,设计引物通过融合pcr扩增含有单核苷酸突变位点的成熟肽对应核酸序列;
(b)构建青蟹抗病因子spalf6单核苷酸突变体的重组表达载体pet30a/spalf6-m;
(c)将步骤(b)所获得重组表达载体导入宿主细胞rosetta(de3),诱导宿主细胞表达,经亲和层析纯化获得spalf6-m。
不同于常规基因组snp分子标记,基因组snp位点通常需要与特定的性状关联才有意义。csnp定位于cdna序列,本csnp位点的碱基可以直接决定对应蛋白抗微生物功能大小,并影响青蟹抗病性状。为明确该csnp位点如何影响蛋白的功能,需要制备spalf6以及单核苷酸突变体spalf6-m,具体包括以下步骤:
(a)首先,在获取血细胞cdna的基础上,根据seqidno:2的成熟肽序列,也即是第22个至第115个氨基酸序列,设计引物扩增成熟肽序列对应核酸片段;所述的上游引物spalf6ef:5′-tactcagaattcttcgtgaaggaactactct-3′(seqidno:6);下游引物spalf6er:5′-tactcactcgagctattctaagaagagtcg-3′(seqidno:7)。
(b)将上述扩增的核酸片段连入表达载体pet30a,构建pet30a/spalf6重组表达载体;构建载体采用常规双酶切核酸片段和载体,然后使用dna连接酶进行连接的方法进行。
(c)将步骤(b)所获得重组表达载体通过转化大肠杆菌感受态细胞rosetta(de3),并通过诱导宿主细胞表达,获得含spalf6蛋白的粗产物。采用常规方法转化大肠杆菌,并通过iptg诱导蛋白表达。
(d)由于spalf6是可溶性表达,将步骤(c)所获得表达产物经亲和层析纯化后,即可获取重组蛋白。由于pet30a载体携带组氨酸标签,蛋白可以和组氨酸标签融合表达,因此可以通过亲和层析方法获取表达的spalf6蛋白。
(d)构建spalf6-m原核表达载体,需要先通过融合pcr获取氨基酸序列seqidno:4第22个至第115个氨基酸序列对应的核苷酸序列。具体方法如下,首先通过融合pcr获取含有突变位点spalf6-m成熟肽对应的dna序列。以引物spalf6ef和spalf6mr:5′-tactcggtagttacagacacggtc-3′(seqidno:8)配对,利用spalf6的cdna为模板,通过pcr获取含突变位点的上游核酸片段;以spalf6mf:5′-tccttgaccgtgtctgtaactac-3′(seqidno:9)和引物spalf6er配对,利用spalf6的cdna为模板,通过pcr获取含突变位点的下游核酸片段。各取上述两个pcr产物0.5μl进行混合,作为pcr模板,以spalf6ef和spalf6er为配对引物,通过pcr获取spalf6-m成熟肽区对应的dna序列。最后与spalf6全长序列对比,进行补充拼接即可获取spalf6-m全长序列。
(e)由于spalf6和spalf6-m仅有一个氨基酸差异,后续载体构建过程与pet30a/spalf6相同。
本发明的第四方面,提供上述spalf6-m在制备抗菌药物中的应用,所述的抗菌药物为抗真菌药物或抗病原性细菌的药物。
优选的,所述的真菌为白色念珠球菌。
优选的,所述的病原性细菌为溶藻弧菌、副溶血弧菌、哈维氏弧菌、气单胞菌、大肠杆菌、或金黄色葡萄球菌。
病原性弧菌,包括溶藻弧菌、副溶血弧菌、哈维氏弧菌是本实验室从养殖池塘分离的耐药菌株,均具有不同的耐药性,为水产常见耐药弧菌,具体耐药情况:溶藻弧菌对环丙沙星/诺氟沙星/氨苄西林/氯霉素/氟苯尼考/强力霉素/利福平/复方新诺明/土霉素/新霉素/磺胺甲基异恶唑表现出不同程度耐药;副溶血弧菌对头孢吡肟/氨苄西林/庆大霉素/红霉素/新霉素/磺胺甲基异恶唑表现出不同程度耐药;哈维氏弧菌对氨苄西林/氟苯尼考/庆大霉素/红霉素/利福平/新霉素/磺胺甲基异恶唑表现出不同程度耐药。
本发明的第五方面,提供上述spalf6-m在制备动物抗病原微生物饲料添加剂中的应用。
优选的,所述的病原微生物为真菌或病原性细菌,所述的真菌为白色念珠球菌;所述的病原性细菌为溶藻弧菌、副溶血弧菌、哈维氏弧菌、气单胞菌、大肠杆菌、或金黄色葡萄球菌。
本发明的第六方面,提供一种拟穴青蟹抗病性状spalf6基因的csnp分子标记,所述的csnp分子标记为在genbank登录号为ky113349的核苷酸序列(seqidno:1)的第215位核苷酸由a突变为g。
本发明的第七方面,提供上述拟穴青蟹抗病性状spalf6基因的csnp分子标记在拟穴青蟹抗病力早期预测或拟穴青蟹抗病育种中的应用。
所述的拟穴青蟹抗病性状spalf6基因的分子标记基于spalf6和其变异体spalf6-v序列和功能比较,其中spalf6的cdna序列第215位核苷酸a与spalf6-v核苷酸序列第222位核苷酸g互为非无意义突变位点。
spalf6第215位核苷酸a对应的密码子cat编码his,是spalf6蛋白序列的第46位氨基酸。spalf6-v的第222位核苷酸g对应的密码子cgt编码arg,是spalf6-v蛋白序列的第46位氨基酸。
spalf6第215位核苷酸a突变为g,其编码的氨基酸由his突变为arg,蛋白由spalf6变为单氨基酸突变体spalf6-m,蛋白的pi由6.79变为7.98,蛋白性质将由酸性变为碱性,并且spalf6-m将与spalf6-v拥有相同的pi值。
spalf6第46位氨基酸his和spalf6-v的第46位氨基酸r,均紧邻各自核心结构域,对蛋白功能影响较大。
与spalf6蛋白相比,由单核苷酸突变形成的spalf6-m蛋白具有更强抗微生物活性和细菌多糖结合活性。
鉴于spalf6-m和spalf6-v具有类似蛋白性质,携带spalf6-v基因的青蟹相比含有spalf6的青蟹,拥有更强的抗病能力,如表1和图5所示。
此csnp分子标记包含一套共两种不同的核苷酸a和g,在cdna水平,如果检测到a,则该青蟹携带spalf6,具有相对较弱的抗病力,如果检测到g,则该青蟹携带spalf6-v,具有相对较强的抗病力。
常规基因组snp检测过程中,因杂合基因的存在,同一只个体的pcr检测常会出现2个或2个以上检测结果,而基于此csnp的cdna水平pcr检测,我们对30只青蟹个体进行检测,发现每只青蟹只有一种检测结果,说明这种检测方法这降低了实验难度,减少了工作量,并提高了检测效果。
本发明的第八方面,提供一种检测拟穴青蟹抗病性状的试剂盒,所述的试剂盒检测上述的csnp分子标记,所述的试剂盒包括:
检测spalf6基因的上述csnp分子标记的一个正向引物和一个反向引物;所述的正向引物f:5’-ttcgtgaaggaactactcttc-3’(seqidno:11);所述的反向引物r:5’-ctattctaagaagagtcgg-3’(seqidno:12)。
所述的试剂盒还包括一条用于反转录的引物oligo-t(18),其序列如下:5’-tttttttttttttttttt-3’(seqidno:10)。
本发明的第九方面,提供一种拟穴青蟹抗病性状spalf6基因的csnp分子标记的rt-pcr检测方法,包括以下步骤:
(a)从血细胞中提取总rna,经dnasei消化,去除组织dna对样品的污染;
(b)反转录时,加入反转录引物oligo-t(18),反应条件:42℃水浴60min;
(c)pcr反应体系加入上述正向引物f(seqidno:11)和反向引物r(seqidno:12);反应条件为:反应起始94℃3min;随后为29循环的目的片段的扩增阶段,反应参数为94℃变性30s,53℃退火30s,72℃延伸20s;最后为72℃延伸10min;
(d)上述pcr扩增产物通过琼脂糖凝胶电泳初步确认,然后通过核酸序列测序最终确认csnp位点的碱基。csnp位点碱基是g的青蟹拥有更强的抗病能力。
具体步骤如下:
(a)由于spalf6主要表达在血细胞,需从血细胞中提取的总rna,检测效果最佳;为去除组织dna对样品的污染,需经过dnasei消化总rna样品;
(b)反转录时,除加入反转录酶、rnase抑制剂外,为保证反转录效果,加入反转录引物oligo-t(18)效果要优于随机引物,并且在反应条件为42℃水浴60min时,效果较好。
(c)pcr过程中,反应体系中除加入高保真taq酶、dntps等常规组分外,需加入一对特异引物,也即是上述正向引物f和反向引物r。其中,正向引物f和反向引物r分别位于该csnp位点的两侧,扩增片段包含csnp位点在内的一段核酸序列,该对引物扩增片段也能应满足普通电泳检测下线。
(d)pcr反应条件为:反应起始94℃3min;随后为29循环的目的片段的扩增阶段,反应参数为94℃变性30s,53℃退火30s,72℃延伸20s;最后为72℃延伸10min。
(e)通过琼脂糖凝胶电泳初步观察上述pcr扩增产物片段大小,然后通过核酸序列测序最终确认csnp位点碱基是a还是g,从而明确青蟹是携带spalf6还是spalf6-v,携带spalf6-v的青蟹拥有更强的抗病能力。
本发明的第十方面,提供一种预测拟穴青蟹抗病力大小的方法,所述的方法为采用上述的方法检测csnp位点的碱基,若检测到csnp位点的碱基为a,则该青蟹携带spalf6,具有相对较弱的抗病力,若检测到csnp位点的碱基为g,则该青蟹携带spalf6-v,具有相对较强的抗病力。
本发明的有益效果在于:
本发明提供了一种预测拟穴青蟹抗病力大小的方法,在预测青蟹抗病能力和分子辅助抗病育种方面有重要的应用价值。
本发明获得了基因工程重组表达载体pet30a/spalf6和pet30a/spalf6-m,并在大肠杆菌rosetta(de3)内成功重组表达且获得了基因工程产品,确认了spalf6和spalf6-m的抗真菌及抗细菌活性,为其作为新药或新型饲料添加剂的开发奠定了良好的基础。
与spalf6相比,spalf6-m核酸序列虽然只有一个碱基发生改变,但其蛋白pi值和抗菌活性都有显著增加;而spalf6-v和spalf6-m拥有相同的pi,并且只有一个非活性区氨基酸(由ala110突变为arg110)的改变,提示spalf6-v和spalf6-m具有相似抗微生物活性,即spalf6-v抗菌活性强于spalf6。
值得注意的是,根据本实施例的数据,spalf6-m表现出较强的抗白色念珠球菌功能,表明spalf6-m是一种稀有的抗真菌型alf。白色念珠球菌是高等哺乳动物的真菌性病原,可用于高等哺乳动物如人等抗真菌药物的开发。相比其它抗菌肽,本发明所获得抗菌肽spalf6-m对3种常见水产耐药性弧菌(溶藻弧菌、副溶血弧菌、哈维氏弧菌)具有明显抑制活性和杀伤作用,表明其在抗微生物感染新药和新型抗病饲料添加剂的开发和应用方面具有非常诱人的应用前景,可应用水产耐药菌的控制。
本发明在鉴定出拟穴青蟹抗病因子spalf6的基础上,通过进行序列比较,发现spalf6的cdna序列第215位核苷酸a与其变异体spalf6-v第222位核苷酸g互为非无意义突变位点。将spalf6第215位核苷酸由a突变为g,构建单核苷酸突变体spalf6-m,编码的氨基酸his将突变为arg,并且蛋白由酸性变为碱性。比较spalf6-m和spalf6蛋白的抗微生物功能和细菌多糖结合活性,发现spalf6-m蛋白抗菌活性和细菌多糖结合力增强,表明携带spalf6-v的青蟹具有更强的抗病力。因此,上述非无意义突变位点可作为青蟹抗病性状的csnp分子标记。本发明以此突变位点为基础,建立了方便、实用分子标记检测试剂盒并提供配套的rt-pcr检测方法,检测结果可以作为判断青蟹抗病力大小的一个重要指标,在青蟹抗病力预测和分子辅助抗病育种方面具有重要意义。
附图说明
图1为spalf6、spalf6-v和spalf6-m三者之间的蛋白序列比较图。spalf6-v和spalf6相比,产生了两个非无意义突变位点,分别将spalf6第46位组氨酸(密码子cat)和第110位丙氨酸(密码子gcc)突变为spalf6-v的第46位精氨酸(密码子cgt)和第110位脯氨酸(密码子ccc)。spalf6-m和spalf6相比,在spalf6基础上将第46位组氨酸(密码子cat)突变为精氨酸(密码子cgt)。
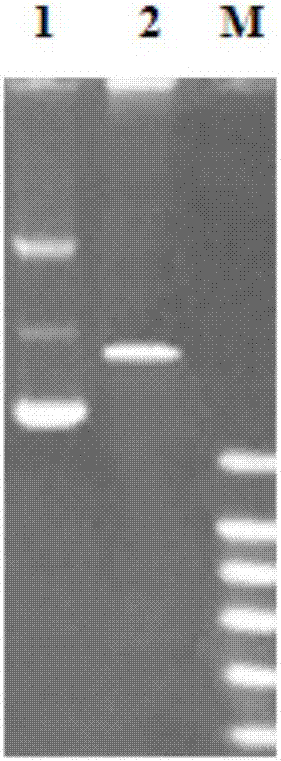
图2为pet30a载体双酶切前后电泳图谱。1为酶切前电泳条带;2为酶切后电泳条带;m为dnamarker。
图3为扩增spalf6成熟肽对应dna序列全长。m为dnamarker,1~4为扩增片段。
图4左图为含pet30a/spalf6重组表达系统诱导前、诱导后及纯化spalf6的蛋白电泳图谱。1为诱导前大肠杆菌rosetta(de3)蛋白表达情况;2为诱导后大肠杆菌rosetta(de3)蛋白表达情况;3为纯化后spalf6蛋白样品;m为蛋白marker。
图4右图为含pet30a/spalf6-m重组表达系统诱导前、诱导后及纯化spalf6-m的蛋白电泳图谱。4为诱导前大肠杆菌rosetta(de3)蛋白表达情况;5为诱导后大肠杆菌rosetta(de3)蛋白表达情况;6为纯化后spalf6-m蛋白样品;m为蛋白marker。
图5为重组蛋白spalf6和spalf6-m与细菌多糖组分结合实验结果。结果显示:spalf6-m比spalf6具有更强的结合lta的能力。
具体实施方式
下面结合实施例对本发明提供的具体实施方式作详细说明。
实施例1:拟穴青蟹抗病因子spalf6全长核酸序列和氨基酸序列的获得
提取拟穴青蟹血细胞样品总rna,经检测符合要求后,经转录组测序及数据分析,获得了大量基因的cdna序列。利用在线软件blastx对其中一个全长756bp序列进行分析,发现该序列与genbank据库中三疣梭子蟹ptalf6的同源性高达78%,表明该序列为拟穴青蟹alf家族的新成员,命名为spalf6,其核苷酸序列及预测氨基酸序列分别如seqidno:1和seqidno:2所示。
其中,spalf6全长cdna(seqidno:1)含681bp,其中第79位至第426位的核苷酸为编码氨基酸序列的开放阅读框(seqidno:5),全长348bp。
spalf6(seqidno:2)全长含有115个氨基酸,其中第22个至第115个氨基酸为成熟肽序列,成熟肽前端还有21个氨基酸的信号肽序列。
实施例2:spalf6单核苷酸突变体spalf6-m序列的获取
通过融合pcr技术获取单核苷酸突变体spalf6-m的dna序列。以引物spalf6ef:5′-tactcagaattcttcgtgaaggaactactct-3′(seqidno:6)和spalf6mr:5′-tactcggtagttacagacacggtc-3′(seqidno:8)配对,利用spalf6核酸序列为模板,通过pcr获取突变位点(含)上游核酸片段;以spalf6mf:5′-tccttgaccgtgtctgtaactac-3′(seqidno:9)和引物spalf6er:5′-tactcactcgagctattctaagaagagtcg-3′(seqidno:7)配对,利用spalf6核酸序列为模板,通过pcr获取突变位点(含)下游核酸片段;各取上述两个pcr产物0.5μl,混合后作为后续pcr模板,并以spalf6ef和spalf6er为配对引物,通过pcr获取spalf6-m成熟肽区对应的核酸序列。最后与spalf6全长序列对比,进行补充拼接即可获取spalf6-m全长序列,如序列seqidno:3,其氨基酸序列如seqidno:4。
实施例3:spalf6和spalf6-m原核表达载体的构建
以上游引物spalf6ef和下游引物spalf6er扩增spalf6成熟肽所对应dna序列。pcr反应条件为:95℃预变性3min,95℃变性30s,53℃退火45s,72℃延伸45s,共35个循环,最后72℃延伸5min。pcr产物通过1.5%琼脂糖凝胶电泳进行分析并回收阳性片段。
将上述纯化回收的核酸片段与表达载体pet30a分别用内切酶ecorⅰ和xhoⅰ酶切,37℃酶切3h后,取1μl酶切产物经1%琼脂糖凝胶电泳,检测酶切效果。纯化回收的核酸片段与表达载体(pet30a)双酶切后的电泳结果见图2和3。
将酶切后的目标核酸片段与酶切后的载体分别使用胶回收试剂盒回收、纯化,按常规方法配制连接反应液,混匀16℃过夜连接。将上述过夜连接液转化大肠杆菌dh5α感受态细胞,筛选阳性克隆,测序验证,确保构建重组表达载体读码框正确无误。
由于spalf6-m和spalf6仅有一个氨基酸差异。后续载体构建过程与pet30a/spalf6载体构建过程相同。
实施例4:重组表达载体在大肠杆菌rosetta(de3)中的诱导表达
将构建的重组表达载体pet30a/spalf6和pet30a/spalf6-m分别转化大肠杆菌rosetta(de3)感受态细胞;对筛选的阳性克隆少量培养,并加入终浓度为0.1mm的iptg诱导试表达目的蛋白;收集诱导前和诱导后菌液,分别制作蛋白样品,经聚丙烯酰胺凝胶电泳(胶浓度15%)检测目的蛋白的表达情况;蛋白电泳结果(图4左图和图4右图)显示:与诱导前相比,含有重组表达载体的大肠杆菌分别多出现一条明显的蛋白条带,与预测理论分子量大小一致,表明多出条带是重组蛋白分别为spalf6和spalf6-m。
实施例5:重组蛋白spalf6和spalf6-m的纯化
根据试表达实验结果,选择在28℃的条件下规模培养(培养基体积300ml)上述两种表达菌株,并使用终浓度为0.1mm的iptg诱导蛋白表达。将诱导后菌液离心去除上清,1×pbs(140mmnacl,2.7mmkcl,10mmna2hpo4,1.8mmkh2po4,ph7.4)重悬。冰浴超声破碎后,12,000rpm离心20min(4℃)分离上清和沉淀。经电泳检测蛋白表达在上清中,spalf6和spalf6-m均可溶性表达。最后对收集上清进行亲和层析(ni-ntahisbindresin,qiagen,germany),收集洗脱液,透析洗脱液并浓缩后即可获得目的蛋白。
实施例6:重组蛋白spalf6-m比spalf6拥有更强的抗微生物活性
利用bsa标准品制备蛋白曲线,通过bradford法测定spalf6和spalf6-m蛋白浓度。根据液体抑菌敏感试验的最小抑菌浓度(mic)法测定两种重组蛋白的抗微生物活性。具体操作如下:重组蛋白经过滤除菌后,使用用10mm磷酸钠缓冲液(ph7.4)倍比稀释于96孔平板上(每孔含100μl蛋白样品);pet30a载体蛋白(阴性对照)也作同样处理;随后取100μl含大约1×105cfu细菌的lb培养基加入到相应的蛋白稀释溶液中,37℃孵育16h。选取的细菌和真菌种类包括:溶藻弧菌、副溶血弧菌、哈维氏弧菌、嗜水气单胞菌、大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌、巨大芽孢杆菌、酵母菌和白色念珠球菌。实验组和对照组情况:空白对照组:加入100μl磷酸盐缓冲液和100μllb培养基;阴性对照组:加入100μl含pet30a载体蛋白的磷酸盐缓冲液和100μllb培养基;实验组1:加入100μl含spalf6蛋白的磷酸盐缓冲液和100μllb培养基;实验组2:加入100μl含spalf6-m蛋白的磷酸盐缓冲液和100μllb培养基;
mic在这里定义为在最高稀释浓度条件下细菌生长悬浊液的浓度(od值)与阴性对照组存在明显可视性变化(显著差异)。
实验结果显示:重组蛋白spalf6和spalf6-m对受试的大多数革兰氏阴性菌的抑制活性没有显著差异,但spalf6-m对革兰氏阳性细菌如金黄色葡萄球菌、枯草芽孢杆菌、巨大芽孢杆菌和真菌如酵母菌和白色念珠球菌表现出更强抑制性活性,具体参见表1。mic值越小,抑制细菌生长能力或杀菌能力更强。
表1
实施例7:革兰氏阳性菌细胞壁组分脂磷壁酸(lta)结合活性实验
通过酶联免疫吸附实验(elisa)比较spalf6和spalf6-m对细菌糖组分lta结合活性的差异。具体操作步骤如下:先将20μg/mllta溶液100μl加入96孔板中,室温放置至蒸发完全;每孔加入200μl1mg/mlbsa进行封闭2h,然后tbs洗涤4次;将蛋白按一定比例稀释后每孔加入100μl,室温孵育3h;然后tbs洗涤4次;将稀释后的辣根过氧化物酶标记特异抗(1:5000)100μl加入每孔,37℃孵育1-2h;tbs洗涤4次后,每孔加入100μl配制的tmb发色液,根据实验情况(约5分钟),加入2mh2so450μl,终止反应,在405nm波长测定od值。载体蛋白pet30a作为实验对照组。根据实验结果绘制图5。结果表明:与spalf6相比,突变体蛋白spalf6-m与细菌多糖组分lta具有更强结合能力,抗菌活性增强与细菌多糖结合有关。本实施例结果进一步解释了实施例6的结果。
实施例8:血细胞总rna提取和cdna合成
血细胞收集方法如下:取健康青蟹冰中麻醉10min,用无菌注射器先抽取一定量的预冷抗凝剂,然后从青蟹腹肢基部按一定比例抽取血淋巴(抗凝剂与血淋巴比例为2:1),混匀后低温(4℃)800g离心10min,收集血细胞。
提取总rna步骤如下:按5-10×106个血细胞/mltrizol试剂的量加入细胞,冰浴中匀浆;将匀浆液转入灭菌1.5ml离心管中,4℃,12,000rpm离心10min去除沉淀,上清转入新的1.5ml离心管中,15-30℃室温静置5min,充分裂解核蛋白复合体;按0.2ml氯仿/mltrizol试剂加入0.2ml氯仿,剧烈振荡15s,15-30℃室温放置2-3min,低温12,000rpm离心15min;转移上层水相于新的1.5ml离心管中,按0.5ml异丙醇/mltrizol试剂加异丙醇0.5ml,充分缓慢混匀溶液,15-30℃室温静置10min沉淀rna;低温12,000rpm离心10min,去除上清,按1ml70%乙醇/mltrizol试剂洗rna沉淀,用涡旋震荡器短暂涡旋数秒,4℃,7,500rpm离心5min;最后去除上清,室温风干rna沉淀,加入depc处理的水溶解rna沉淀,55-60℃孵育10min,分装后-80℃保存备用。
去除dna污染方法如下:向一无rna酶的ep管中依次加入上述rna,按1u/μgrna加入dnasei(1u/μl),37℃孵育30分钟;随后加入1μl25mmedta,并65℃孵育10分钟以失活dnasei。
cdna合成过程如下:在一个rnase-free离心管中加入4μl总rna(1-5μg)和1μl引物oligo-t(18)(100μm),轻轻混匀,瞬时离心;70℃水浴5min,冰上冷却2min;瞬时离心,使各成分集中于管底,在冰上30s,继续向管中加如下表2试剂:
表2
将总体积25μl的反应液轻轻混匀,瞬时离心,42℃水浴60min,最后70℃水浴15min终止反应,冰上冷却。
实施例9:csnp分子标记的pcr检测
含有csnp位点核酸片段pcr扩增:将上述一系列引物与其它组分按比例混合成pcr反应体系,具体见下表3:
表3
对上述反应体系进行pcr循环,pcr循环条件见下表:反应起始94℃3min;随后为29循环的目的片段的扩增阶段,反应参数为94℃变性30s,53℃退火30s,72℃延伸20s;最后为72℃延伸10min。
对上述dna扩增后的产物进行凝胶电泳,根据电泳条带大小初步判定扩增结果。
对凝胶电泳结果初步判定为阳性的,进一步送上海生工生物工程有限公司测序,测序结果与spalf6序列第142位到427位序列一致,表明上述青蟹携带spalf6,如果测序结果不一致,且spalf6序列第215位核苷酸为g,表明青蟹携带spalf6-v,该青蟹具有更强的抗病力。
以上已对本发明创造的较佳实施例进行了具体说明,但本发明创造并不限于所述实施例,熟悉本领域的技术人员在不违背本发明创造精神的前提下还可做出种种的等同的变型或替换,这些等同的变型或替换均包含在本申请权利要求所限定的范围内。
sequencelisting
<110>中国水产科学研究院东海水产研究所
<120>一种拟穴青蟹抗病因子spalf6单核苷酸突变体及其制备方法和应用
<130>/
<160>12
<170>patentinversion3.3
<210>1
<211>681
<212>dna
<213>拟穴青蟹(scyllaparamamosain)
<400>1
ggtatcaacgcagagtacatggggagtcctggtttgggcagcagtaagagaaagttactt60
ccagagccggccatcagcatggcacgcgtgtcgctgctacttatcgtgctatccattgcc120
ttggttacccccagccaaggcttcgtgaaggaactactcttcaggaaagtgaaagatact180
ctgcttgaggatggcaccactgagatccttgaccatgtctgtaactaccgagtaacaccc240
ctcttgcagaactcagaactatacttcaagggagacgtgtggtgccccagctggacagtc300
atcaagggagaatccctgactcgcagcaggactagagtggtgaacagggctatcgcagac360
ttcgccagaaaagctctcgctgagggcctcgtcacgcaagaggacgcccgactcttctta420
gaatagcctggacctacaaatagtgtgccaaagaggtgcaaagacaggatgatctcttca480
gtgtattcaccctcccgtgattcccacaccgcaccgccacccaacctcgctcagccaaca540
ccatcttccttattcttctgttgtcattcttatccacaattcacgatatctaaaactcat600
ctgtcggttacatatgtatgtcatcaataactgtagtacaacaattattataaacacatc660
aacagaaaaaaaaaaaaaaaa681
<210>2
<211>115
<212>prt
<213>拟穴青蟹(scyllaparamamosain)
<400>2
metalaargvalserleuleuleuilevalleuserilealaleuval
151015
thrproserglnglyphevallysgluleuleuphearglysvallys
202530
aspthrleuleugluaspglythrthrgluileleuasphisvalcys
354045
asntyrargvalthrproleuleuglnasnsergluleutyrphelys
505560
glyaspvaltrpcysprosertrpthrvalilelysglygluserleu
65707580
thrargserargthrargvalvalasnargalailealaasppheala
859095
arglysalaleualagluglyleuvalthrglngluaspalaargleu
100105110
pheleuglu
115
<210>3
<211>681
<212>dna
<213>人工序列
<400>3
ggtatcaacgcagagtacatggggagtcctggtttgggcagcagtaagagaaagttactt60
ccagagccggccatcagcatggcacgcgtgtcgctgctacttatcgtgctatccattgcc120
ttggttacccccagccaaggcttcgtgaaggaactactcttcaggaaagtgaaagatact180
ctgcttgaggatggcaccactgagatccttgaccgtgtctgtaactaccgagtaacaccc240
ctcttgcagaactcagaactatacttcaagggagacgtgtggtgccccagctggacagtc300
atcaagggagaatccctgactcgcagcaggactagagtggtgaacagggctatcgcagac360
ttcgccagaaaagctctcgctgagggcctcgtcacgcaagaggacgcccgactcttctta420
gaatagcctggacctacaaatagtgtgccaaagaggtgcaaagacaggatgatctcttca480
gtgtattcaccctcccgtgattcccacaccgcaccgccacccaacctcgctcagccaaca540
ccatcttccttattcttctgttgtcattcttatccacaattcacgatatctaaaactcat600
ctgtcggttacatatgtatgtcatcaataactgtagtacaacaattattataaacacatc660
aacagaaaaaaaaaaaaaaaa681
<210>4
<211>115
<212>prt
<213>人工序列
<400>4
metalaargvalserleuleuleuilevalleuserilealaleuval
151015
thrproserglnglyphevallysgluleuleuphearglysvallys
202530
aspthrleuleugluaspglythrthrgluileleuaspargvalcys
354045
asntyrargvalthrproleuleuglnasnsergluleutyrphelys
505560
glyaspvaltrpcysprosertrpthrvalilelysglygluserleu
65707580
thrargserargthrargvalvalasnargalailealaasppheala
859095
arglysalaleualagluglyleuvalthrglngluaspalaargleu
100105110
pheleuglu
115
<210>5
<211>348
<212>dna
<213>拟穴青蟹(scyllaparamamosain)
<400>5
atggcacgcgtgtcgctgctacttatcgtgctatccattgccttggttacccccagccaa60
ggcttcgtgaaggaactactcttcaggaaagtgaaagatactctgcttgaggatggcacc120
actgagatccttgaccatgtctgtaactaccgagtaacacccctcttgcagaactcagaa180
ctatacttcaagggagacgtgtggtgccccagctggacagtcatcaagggagaatccctg240
actcgcagcaggactagagtggtgaacagggctatcgcagacttcgccagaaaagctctc300
gctgagggcctcgtcacgcaagaggacgcccgactcttcttagaatag348
<210>6
<211>31
<212>dna
<213>人工序列
<400>6
tactcagaattcttcgtgaaggaactactct31
<210>7
<211>30
<212>dna
<213>人工序列
<400>7
tactcactcgagctattctaagaagagtcg30
<210>8
<211>24
<212>dna
<213>人工序列
<400>8
tactcggtagttacagacacggtc24
<210>9
<211>23
<212>dna
<213>人工序列
<400>9
tccttgaccgtgtctgtaactac23
<210>10
<211>18
<212>dna
<213>人工序列
<400>10
tttttttttttttttttt18
<210>11
<211>21
<212>dna
<213>人工序列
<400>11
ttcgtgaaggaactactcttc21
<210>12
<211>19
<212>dna
<213>人工序列
<400>12
ctattctaagaagagtcgg19
- 还没有人留言评论。精彩留言会获得点赞!