在用人胎儿肝干细胞注射的免疫缺陷动物中产生抗体的方法与流程
本申请是申请人于2007年5月9日提交的题为“在用人胎儿肝干细胞注射的免疫缺陷动物中产生抗体的方法”的中国专利申请200780008799.7的分案申请。
本发明涉及产生抗体的方法、抗体生成细胞的组合物、它们的生产方法及其用途。
发明背景
长期以来认为单克隆抗体(mab)是癌症的免疫疗法、感染或自身免疫病等的妙方。然而,由于人抗小鼠的免疫应答,人类中使用的第一代鼠抗体很不成功。
人抗体大部分来自携带有受限的一组人类ig基因的转基因小鼠或使用噬菌体展示、酵母展示或类似重组技术选自多数人工抗体库。这些策略已经被设计用来消除针对人类背景中的单克隆抗体的任何免疫反应。人抗体可以在转基因动物(例如小鼠)中产生,所述转基因动物经免疫后能够在没有内源性免疫球蛋白产生的情况下产生人抗体。在此类种系转基因小鼠中转移人类种系免疫球蛋白基因阵列导致抗原攻击时产生人抗体(见,例如,vandijk,m.a.和vandewinkel,j.g.,curr.opin.chem.biol.5(2001)368-374;jakobovits,a.,等人,proc.natl.acad.sci.usa90(1993)2551-2555;jakobovits,a.,等人,nature362(1993)255-258;bruggemann,m.,等人,yearimmunol.7(1993)33-40)。人抗体也可在噬菌体展示文库中产生(hoogenboom,h.r.和winter,g.,j.mol.biol.227(1992)381-388;marks,j.d.,等人,j.mol.biol.222(1991)581-597)。cole等人和boerner等人的技术也适用于人单克隆抗体的制备(cole等人,monoclonalantibodiesandcancertherapy,alanr.liss,p.77(1985);和boerner,p.,等人,j.immunol.147(1991)86-95)。然而此类转基因小鼠只能提供具有受限的一组人类ig基因的抗体-由转染的免疫球蛋白基因阵列引起的那些。
基于对人类免疫球蛋白基因转基因的小鼠的方法学已经允许产生来自人类种系序列的抗体,根据报道所述抗体与鼠类的或小鼠-人嵌合抗体相比已经降低所获抗体药物的免疫原性。然而,来自转基因小鼠的人抗体与天然人类免疫所有组成成分相比在它们的多样性、亲和力及特异性上有限。
类似地,基于噬菌体或酵母展示的组合文库方法的主要缺点是抗体重链和轻链的随机配对。为鉴定具有高亲和力的重链和轻链对,原始抗体重链和轻链对——非同源对的解离需要筛选多数克隆。此外,此类非同源对可能呈现与人类自身抗原不想要的交叉反应性。最后,由于固有的选择偏倚,通过组合文库的选择和筛选鉴定的靶特异性抗体的遗传多样性通常受限。
traggai,e.等人,science304(2004)104-107描述了在移植了人类脐血细胞的rag2-/-γc-/-小鼠中开发人类免疫系统的方法,其可用作评估对疫苗或活体感染性病原体的应答和靶定人类免疫系统的药学化合物的临床前模型。已表明重建并随后接种病原体的小鼠可产生低水平的破伤风类毒素特异性抗体应答。
发明概述
本发明包含从免疫缺陷型非人类动物中产生人单克隆抗体的方法,所述方法包括使新生免疫缺陷型非人类动物与人类胎儿肝干细胞(fl细胞)接触来产生免疫移植的非人类动物(重建动物),随后使所述重建动物与抗原接触,从所述重建动物中收集产生针对所述抗原的人抗体的人细胞,并从所述抗体产生细胞中分离所述抗体。
本发明优选包括本发明的方法,其特征在于通过转化方法或细胞融合方法建立所述抗体产生细胞,优选无限增殖的抗体产生细胞。优选地所述无限增殖细胞能够保持活力至少50代。
优选地,所述非人类动物是啮齿类动物并更优选为小鼠、大鼠或兔。进一步优选所述小鼠是rag2-/-γc-/-、裸rag2-/-、nod(nod指根据本发明优选nod.cg-rag1tm1momprf1tm1sdz/szj)或scid米色小鼠并且大鼠是裸大鼠。
本发明包括本发明的方法,其特征在于所述fl细胞是人类造血胎儿肝干细胞(hfl细胞),优选cd133+、cd117+、cd31+和/或cd34+。
在另一实施方案中,所述方法优选地特征在于所述fl细胞是hfl细胞和人类非造血胎儿肝干细胞的组合。
本发明包括本发明的方法,其特征在于所述抗体产生细胞是人类b细胞。
本发明包括本发明的方法,其特征在于所述fl细胞经腹膜内、皮下或肝内注射到动物中用于接触。
本发明包括本发明的方法,其特征在于所述抗原是多肽、mhc/肽复合体或dna。
本发明包括本发明的方法,其特征在于所述抗原作为抗原、抗原片段、编码抗原的dna和/或抗原携带细胞与重建动物接触。
本发明包括本发明的方法,其特征在于所述免疫缺陷非人类动物与fl细胞接触前接受亚致死照射。
本发明包括本发明的方法,其特征在于所述小鼠与所述fl细胞接触后5到18周小鼠第一次与抗原接触。
本发明包括本发明的方法,其特征在于所述小鼠与抗原接触高达10次。
本发明包括本发明的方法,其特征在于所述收集的细胞是人cd19+或cd22+细胞。
本发明包括本发明的方法,其特征在于所述细胞通过杂交瘤技术建立。
本发明包括本发明的方法,其特征在于融合伴侣细胞系是mfp-2、hk-128、k6h6/b5或karpas707细胞系。
本发明包括用于产生多数人类b细胞的方法,所述b细胞产生完全多数的针对抗原的人抗体,所述方法的特征在于使新生免疫缺陷的非人类动物与fl细胞接触来产生免疫重建动物,随后使所述重建动物与抗原接触,收集所述人类b细胞,产生所述完全多数的抗体。
本发明包括非人类动物用于产生本发明的产生抗原的无限增殖细胞的用途。如果所述无限增殖细胞是杂交瘤细胞,用于杂交瘤产生的一种融合伴侣是来自所述移植并重建动物的人类b细胞,另一种融合伴侣是例如来自人、啮齿动物或其它动物的骨髓瘤细胞。或者通过ebv转化产生无限增殖的移植并重建的b细胞。
本发明包含多数的人类b细胞,所述人类b细胞产生完全多数的针对人类蛋白质的人抗体。
本发明包含无限增殖细胞的组合物,其提供完全多数的针对人类蛋白质的人抗体。
本发明包含重建动物用于产生多数无限增殖b细胞的用途,所述b细胞产生完全多数的针对人类蛋白质的人抗体。
本发明包括在非人类动物中发生并产生单克隆人抗体的方法,所述抗体针对人类蛋白质(包括片段),其与所述非人类动物的对应蛋白质有至少80%(blast)的同源性。此实例是cxcr5。人和鼠的cxcr5有84%的同源性。本发明因此提供方法来产生针对高保守蛋白质或蛋白质区的人抗体,即使所述蛋白质或其片段在人和所述非人类动物间具有至少95%或更高的同源性或甚至100%的同源性。
因此本发明的另一目标是对人类蛋白质特异的单克隆人抗体,所述人类蛋白质与非人类动物,优选小鼠、大鼠和/或兔的对应蛋白质具有至少95%,优选98%并甚至100%同源性(blast)。本发明的优选目标是对人蛋白特异的单克隆人抗体,所述人类蛋白质与对应鼠类(小鼠)蛋白质具有至少95%,更优选98%并甚至100%同源性(blast)。
本发明包括用于重组产生抗体的方法,其特征在于使新生免疫缺陷的非人类动物与fl细胞接触,随后使所述非人类动物与抗原接触,从所述非人类动物中收集产生针对所述抗原的人抗体的人细胞,并分离所述抗体,将可变区测序,构建编码重链和/或轻链至少cdrs的与人恒定链组合的表达载体,在合适的宿主细胞中表达所述载体并从所述宿主细胞或发酵上清液中分离所述抗体(免疫活性蛋白)。
本发明包含用于重组产生抗体的方法,其特征在于使新生免疫缺陷的非人类动物与fl细胞接触,随后使所述非人类动物与抗原接触,从所述非人类动物中收集产生针对所述抗原的人抗体的人细胞,并从产生人抗体的所述人细胞中分离mrna,产生抗体特异性cdna(例如通过使用免疫球蛋白特异的引物),构建编码重链和/或轻链至少cdrs与人恒定链组合的表达载体,在合适的宿主细胞中表达所述载体并从所述宿主细胞或发酵上清液中分离所述抗体(免疫活性蛋白)。
本发明包括用于选择产生人抗体的无限增殖细胞的方法,所述人抗体显示出特异性结合抗原,所述方法的特征在于提供来自非人类动物脾的产生完全多数人抗体的多数人类b细胞,将所述细胞或其亚群与无限增殖的骨髓瘤细胞融合或通过ebv转化使所述b细胞或亚群无限增殖,并选择产生人抗体的杂交瘤细胞,所述人抗体特异性结合所述抗原。
本发明包括用于选择产生抗体的无限增殖细胞的方法,所述抗体以至少1.5μg/ml的量对抗原显示出至少10-6mol/l的特异结合亲和力,所述方法的特征在于提供来自非人类动物脾的产生完全多数人抗体的多数人类b细胞,将所述细胞或其亚群与无限增殖的骨髓瘤细胞融合或通过ebv转化使所述b细胞或亚群无限增殖,并选择产生抗体的杂交瘤细胞,所述抗体对抗原显示出至少10-6mol/l的特异结合亲和力。
优选地分离的抗体的量是至少1.5μg/ml。
优选地所述抗体对所述抗原显示出至少10-9mol/l的特异结合亲和力。
发明描述
术语完全多数的人抗体或人免疫球蛋白基因指抗体或免疫球蛋白基因,其包含或编码
-来自2号染色体(76个基因,其中31到35个是有功能的)上2p11中至少20个,优选31到33个κ基因的κ链,
-来自22号染色体22q11位置中至少20个,优选29到33个λ基因和j基因的λ链;(有4到5个功能性λ链基因,λj基因在每种基因之前),和
-来自14号染色体(11个重链基因,其中9个是有功能的并且分别对应9个重链同种型μ、δ、γ1、γ2、γ3、γ4、α1、α2和ε)上14q32中的至少5个,优选9个重链基因的重链。
例如,抗原可以是来自人类的物质,像人类蛋白质、激素、肿瘤相关的糖脂(例如us5,091,178)或参与天然发生的人类代谢的另一物质。抗原也可以是健康人类耐受的来自非人类的物质,使得此人类不以可检测到的方式产生针对此类抗原的抗体。
术语人类蛋白质(其包括多肽)指人类的任意蛋白质,其是天然耐受的或在自身免疫疾病中被攻击的。术语人类蛋白质根据本领域技术人员的知识也包括所述蛋白质的片段,其能够在本发明合适的非人类动物中诱导对此类人类蛋白质特异的抗体。此类片段可以包括在例如更大蛋白质中,例如众所周知可以用来自另一物种像小鼠的同源蛋白质通过免疫来诱导针对人类蛋白质的抗体。人类蛋白质优选为耐受性人类蛋白质。
术语耐受性人类蛋白质指人类的蛋白质,其为天然耐受性的并在自身免疫疾病像古德帕斯丘综合征、胰岛素依赖型糖尿病(iddm)、免疫性溶血性贫血、免疫性血小板减少性紫癜、重症肌无力(mg)、多发性硬化(ms)、类风湿性关节炎、系统性红斑狼疮(sle)或甲状腺毒症(格雷夫斯病)中不受攻击的。
例如,人类蛋白质可以是跨膜分子(例如受体)或配体如生长因子。示例性抗原包括分子如肾素;生长激素,生长激素释放因子;甲状旁腺素;促甲状腺激素;脂蛋白;α-1-抗胰蛋白酶;胰岛素a链;胰岛素b链;胰岛素原;促滤泡素;降钙素;黄体生成素;胰高血糖素;凝血因子如因子viii、因子ix、组织因子(tf),和血管性血友病因子;抗凝血因子如c蛋白;心钠素;肺表面活性物质;纤溶酶原激活物,如尿激酶或人尿或组织型纤溶酶原激活物(t-pa);铃蟾肽;凝血酶;造血生长因子;肿瘤坏死因子α和β;脑咖啡酶;rantes(激活时受调节,通常t细胞表达和分泌);人类巨噬细胞炎性蛋白质(mip-1-α);血清清蛋白如人血清清蛋白;muellerian抑制物质;松弛素a链;松弛素b链;前松弛素;小鼠促性腺激素相关肽;微生物蛋白质,如β内酰胺酶;dna酶;ige;细胞毒性t淋巴细胞相关抗原(ctla),如ctla-4;抑制素;激活蛋白;血管内皮生长因子(vegf);激素或生长因子受体;a蛋白或d蛋白;类风湿因子;神经营养因子如骨衍生的神经营养因子(bdnf)、神经营养蛋白-3、-4、-5或-6(nt-3、nt-4、nt-5或nt-6),或神经生长因子如ngf-b;血小板衍生生长因子(pdgf);成纤维细胞生长因子如afgf和bfgf;表皮生长因子(egf);转化生长因子(tgf)如tgf-α和tgf-β,包括tgf-b1、tgf-b2、tgf-b3、tgf-b4或tgf-b5;肿瘤坏死因子(tnf)如tnf-α或tnf-β;胰岛素样生长因子i和ii;胰岛素样生长因子结合蛋白;cd蛋白如cd3、cd4、cd8、cd19、cd20、cd22和cd40;促红细胞生成素;骨诱导因子;免疫毒素;骨形态发生蛋白(bmp);干扰素如干扰素α、β和γ;集落刺激因子(csfs),例如m-csf、gm-csf和g-csf;白细胞介素(ils),例如il-1、il-2、il-3、il-4、il-5、il-6、il-7、il-8、il-9和il-10;超氧化物歧化酶;t细胞受体;表面膜蛋白质;衰变加速因子;病毒抗原例如,aids外壳的部分;转运蛋白;归巢受体;地址素;调节蛋白;整联蛋白如cd11a、cd11b、cd11c、cd18、icam、vla-4和vcam;肿瘤相关的抗原如her2、her3或her4受体,和任何上面列出蛋白质的片段。其它人类蛋白质是erbb受体家族的成员如egf受体、her2、her3或her4受体;肿瘤坏死受体超家族的成员,包括dr5;前列腺干细胞抗原(psca);细胞黏着分子如lfa-1、mac1、p150.95、vla-4、icam-1、vcam、α4/β7整联蛋白,和αv/β3整联蛋白包括其α或β亚基(例如抗cd11a、抗cd18或抗cd11b抗体);组织因子(tf);α干扰素(αifn);白细胞介素,如il-8;ige;血型抗原;flk2/flt3受体;肥胖症(ob)受体或mp1受体。
术语无限增殖细胞指杂交瘤细胞或通过其它方法,像edv转化、端粒酶置换或逆转录病毒无限增殖化使其无限增殖的细胞。
如此处所用的术语动物指非人类动物,优选啮齿类动物并尤其优选小鼠或大鼠。
优选地,所述非人类动物是啮齿类动物并更优选地是小鼠、大鼠或兔。进一步优选的是所述小鼠是rag2-/-γc-/-、裸rag2-/-、nod或scid米色小鼠并且所述大鼠是裸大鼠。
scid米色是携带scid突变的双突变小鼠,所述scid突变由于v(d)j重组中的缺陷引起t和b淋巴细胞的缺失。它也携带米色突变,其导致细胞毒性t细胞和巨噬细胞缺陷及nk细胞功能的选择性缺损。scid米色小鼠是接受人类造血细胞的潜在改良模型。
优选的nod小鼠是nod.cg-rag1tm1momprf1tm1sdz/szj、nod.cg-prkdcscidil2rgtm1wjl/szj、nod.129s7(b6)-rag1tm1mom/j、nod.cg-prkdcscidb2mtm1unc/j和nod.cb17-prkdcscid/szj。每一品种缺少成熟的t和b细胞并且没有可检测的nk细胞毒素活性。品种支持用人类造血细胞增强移植,具有相对较长的寿命并且显著地对辐射更有抵抗力。
rag2对在t和b细胞中产生功能性抗原受体的v(d)j基因重排是必要的;纯合的rag2-/-突变体没有成熟的有功能的t和b细胞。常见的γ(γc)ko小鼠缺少许多细胞因子包括il-2、il-4、il-7、il-9和il-15的功能受体。结果淋巴细胞发育受到很大损害。所述小鼠缺少自然杀伤(nk)细胞并仅产生少量的t和b细胞。
如此所用,术语人抗体包括具有可变和恒定区(结构域)的抗体,所述可变和恒定区因为它们与确定的人类种系免疫球蛋白序列具有高序列相似性或同一性,所以可以被分配到这些种系序列。人抗体包括抗体的多种形式,优选单克隆抗体,包括但不局限于完整抗体、单个重链或轻链、抗体片段、类别改变的抗体和遗传改造的抗体(变体或突变抗体),只要保留了本发明的特征性性质。尤其优选的是重组人抗体。如此处所用的术语“单克隆抗体”指所有具有基本上相同氨基酸序列的抗体分子制剂。
如此处所用,术语“重组人抗体”旨在包括通过重组方法制备、表达、产生或分离的所有人抗体,如从宿主细胞如ns0、hek293或cho细胞中分离的抗体,所述宿主细胞包含能够表达所述抗体的重链和/或轻链的重组表达载体并且该载体能被转染到此类宿主细胞中。此类重组人抗体具有重排形式的可变和恒定区。本发明的重组人抗体已经在体内进行了体细胞高变。因此,重组抗体vh和vl区的氨基酸序列是可以分配给特定人类种系vh和vl序列的序列,但在体内可以不天然存在于人抗体种系所有组成成分中。
如此处所用“可变区”(轻链(vl)的可变区,重链(vh)的可变区)表示直接参与抗体与抗原结合的每一对轻链和重链。可变的人轻链和重链结构域具有相同的一般结构并且每一结构域包含4个构架区(fr),其序列高度保守,连接有3个“高变区”(或互补性决定区,cdrs)。构架区采取β片层构象并且cdrs可以形成连接所述β-层结构的环。每一条链中的cdrs通过构架区保持在它们三维结构中并与来自其它链的cdrs一起形成抗原结合位点。抗体重链和轻链cdr3区,优选重链cdr3在本发明抗体的结合特异性/亲和力中起特别重要的作用,并因此提供了本发明的另一目标。
当在此处使用时,术语“高变区”或“抗体的抗原结合部分”指负责抗原结合的抗体的氨基酸残基。高变区包含来自“互补性决定区”或“cdrs”的氨基酸残基。“构架”或“fr”区是除了如此处定义的高变区残基之外的那些可变结构域区。因此,抗体的轻链和重链包含从n-到c-末端的结构域fr1、cdr1、fr2、cdr2、fr3、cdr3和fr4。根据kabat等人,sequencesofproteinsofimmunologicalinterest,5thed.,publichealthservice,nationalinstitutesofhealth,bethesda,md(1991)的标准定义来确定cdr和fr区。
“恒定结构域”不直接参与抗体与抗原的结合,但是显示出多种效应功能。根据它们重链恒定区的氨基酸序列,抗体或免疫球蛋白被分为如下类别:iga、igd、ige、igg和igm,并且这些的若干可以进一步分为亚类(同种型),例如igg1、igg2、igg3和igg4,iga1和iga2。对应不同类免疫球蛋白的重链恒定区分别被称作μ、δ、γ、α和ε。提供以下实施例、参考文献、序列表和图来帮助理解本发明,在所附权利要求中给出的其真实范围。应理解可以在不背离本发明精神的情况下对提出的方法进行修改。
从抗体产生细胞、腹水和/或上清液中分离抗体可以根据本领域中已知的方法像层析或透析来进行。例如可以使用选自免疫亲和纯化、硫酸铵沉淀、a蛋白/g蛋白纯化、离子交换层析、凝胶过滤和/或硫酸铵沉淀的一种或更多种方法来纯化抗体。此类方法在nau,d.r.,optimizationofmonoclonalantibodypurification,in:techniquesinproteinchemistry,hugli,t.(编辑),academicpress,newyork,1989,页339-347;coligan,j.e.等人(编辑),currentprotocolsinimmunology,johnwiley&sons,inc.(2005)中有描述。
除了杂交瘤产生,可以使用备选方法产生本发明的抗体。此类方法例如基于抗体的核酸序列的鉴定。通常鉴定可变区、cdr区或甚至仅重链cdr3区的序列就足够了。优选地,从抗体产生细胞库中分离mrna并用于在合适表达载体中构建编码此类区域的cdna库。将cdna文库转染到宿主细胞如ns0或cho中并筛选特异性抗体的产生并鉴定和分离特异的克隆并用于在没有杂交瘤产生的情况下产生抗体。
fl细胞是能够发育成多种血细胞类型例如b细胞、t细胞、粒细胞、血小板和红细胞的干细胞。人类造血胎儿肝干细胞通常表达表面抗原cd31、cd34、cd117(c-kit)和/或cd133。根据本发明优选使用表达cd133的fl细胞。也可以使用前体细胞(即胚胎干细胞)作为fl细胞,,所述前体细胞用细胞因子处理后发育成为fl细胞。
表达cd133的fl细胞可以从人类胎儿肝脏中分离并通过cd133谱系,优选通过免疫磁性分离方法例如miltenyi“
在x染色体上携带细胞因子受体共有γ链(γc)无效突变的小鼠已经由disanto,j.p.等人,proc.natl.acad.sci.usa92(1995)377–381描述。γc-/-雌性可以与突变纯合的雄性杂交,所述突变破坏了rag2基因(shinkai,y.等人,cell68(1992)855–867)。rag2缺失杂合及γc缺失半合子的f1雄性可以与γc-/-rag2+/+雌性回交。所获后代的rag2基因型可以通过taildnapcr来确定(horton,r.m.等人,biotechniques19(1995)690–691)。将rag2杂合子育种来产生γc-/-rag2-/-雌性和γc-/yrag2-/-雄性小鼠(γc-/rag2-)。这些小鼠具有129ola、balb/c和c57bl/6的混合背景。
本发明的免疫重建通过将合适量的人fl细胞移植到新生的并预照射的免疫缺陷型动物例如小鼠或大鼠的肝脏中发生。
可以用纯化的或浓缩的抗原制剂、编码所述抗原的核酸和/或表达所述抗原的细胞,通过免疫本发明免疫重建的非人类动物,优选免疫重建的啮齿类动物,最优选地免疫重建的大鼠或小鼠来产生本发明的人单克隆抗体。然后获得所述动物的b细胞(例如脾的b细胞)并将其与合适的人融合伴侣,像骨髓瘤细胞融合来形成无限增殖的杂交瘤细胞,其通过与合适的人融合伴侣,像骨髓瘤细胞融合或通过用例如ebv将所述细胞无限增殖化来分泌针对抗原的人单克隆抗体。例如,可溶性抗原或其片段任选缀合到其它分子上,并用作产生抗体的免疫原。对于跨膜分子,如受体,这些受体的片段(例如受体的胞外结构域)可以用作免疫原。或者,表达跨膜分子的细胞可以用作免疫原。此类细胞可以来自天然来源(例如癌细胞系)或可以是通过重组技术转化过而表达跨膜分子的细胞。用于制备抗体的其它抗原和其形式对本领域的技术人员是显而易见的。
优选地,免疫重建的非人类动物在第一次免疫时将是6-16周龄。例如,编码目的抗原(例如cd20或her3抗原)的dna的纯化或浓缩制剂可以用于经肌内免疫本发明免疫重建的非人类动物。可以用眶后取血获得的血浆样品在免疫方案过程中监测免疫反应。血浆可以通过elisa来筛选,并且免疫重建的非人类可以用于对应b细胞的无限增殖化,所述免疫重建的非人类具有针对所述抗原的足够效价的抗体。在处死并除去脾脏和淋巴结和外周血前用目的抗原经静脉内对小鼠进行加强。发现每一种抗原需要进行2-3次融合。若干小鼠将用每一种抗原免疫。
可以分离小鼠淋巴细胞并基于标准方案使用peg或电融合与人类的或异源骨髓瘤细胞融合来产生杂交瘤。电融合基于细胞膜可逆的结构变化,其由电场效应引起并应用于多种细胞,用于相同或不同来源的两个或更多细胞的融合,包括它们的完整结构(核、膜、细胞器、细胞质)来产生新的有活力的细胞。
然后筛选得到的杂交瘤用于产生抗原特异性抗体。例如,将来自免疫小鼠的脾和淋巴结衍生淋巴细胞的单细胞悬浮液融合到k6h6/b5非分泌型异源骨髓瘤细胞(atcc、crl1823)。将约2x105的细胞涂布在平底微量滴定板中,随后在选择培养基上进行约两周的温育。
然后通过elisa筛选各孔中针对抗原的人单克隆抗体(例如igg)。通常10-14天后,一旦大范围的杂交瘤生长出现,就分析培养基。将分泌抗体的杂交瘤重新涂布,再次筛选,并且如果对针对抗原的人单克隆抗体仍然呈现阳性,可以通过有限稀释进行亚克隆至少两次。然后在体外培养稳定的亚克隆以在组织培养基中产生抗体用于表征。
抗原可以通过任何合适的方法引入动物中。优选地,单独或与合适免疫调节剂(例如cfa)组合经脾内、静脉内、腹膜内、皮内、肌内、皮下免疫动物。每一种抗原的剂量优选在1-500μg的范围内。
优选地,本发明的方法包括在最后一次注射后7-28天提供给动物抗原1-500μg的加强剂量的额外步骤。优选地,加强所述动物1到5次。
动物的免疫可以在有或没有药物载体的情况下进行。合适载体是例如ifa、al3(oh)4、abisco。
此外,这些载体可以作为免疫刺激剂(“佐剂”)起作用。除了药物载体,动物的免疫可以在有或没有佐剂的情况下进行。
增强组合物有效性的优选佐剂包括但不局限于:例如cfa、ifa、al3(oh)4、abisco。
用于本发明的优选的抗体产生细胞包括b细胞。可以通过从动物中去除免疫系统中任何合适的细胞组分来回收用于本发明的这些抗体产生细胞。优选地,通过从动物中去除脾脏、淋巴结、外周血或骨髓或其部分来回收抗体产生细胞。
附图说明
图1在移植后第15周对重建小鼠外周血的流式细胞分析。
人类造血细胞移植。直方图显示的是三种代表性动物的活的门控外周血细胞的覆盖图,所述代表性动物在重建后15周用抗人cd45-fitcmab染色(填充区域),或同一动物用同种型相匹配的、无关的对照mab(暗线)的背景染色,其中所述对照mab用作产生覆盖直方图统计的标准直方图。统计代表指定区域(m1、m2)中事件相比于门内事件总数目的数目和百分比。显示了平均荧光强度。
a:
分子直方图
文件:probe.002
x参数:抗人cd45-fitc
标准直方图
文件:probe.001
x参数:抗人cd45-fitc
b:
分子直方图
文件:probe.004
x参数:抗人cd45-fitc
标准直方图
文件:probe.003
x参数:抗人cd45-fitc
c:
分子直方图
文件:probe.006
x参数:抗人cd45-fitc
标准直方图
文件:probe.005
x参数:抗人cd45-fitc
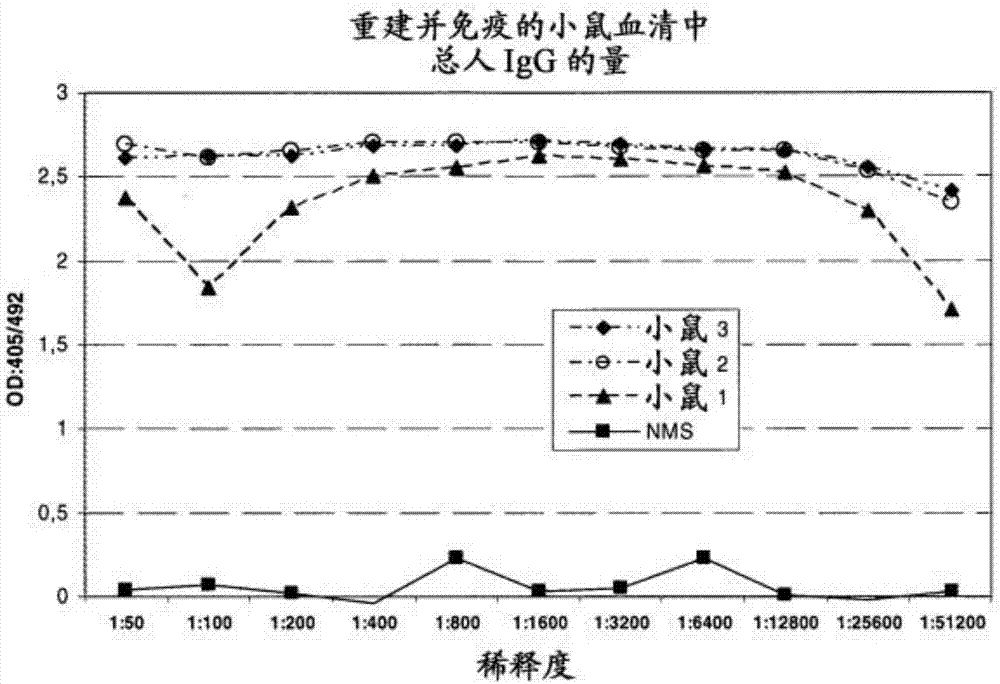
图2人抗体在重建小鼠中产生能力的检测。
图3免疫后第7周在重建小鼠的外周血中对人抗原特异性抗体的流式细胞术分析。
显示的是一只代表性重建并免疫的小鼠用不同血清稀释(1/20(c)和1/150(d))染色的抗原阳性细胞相比于作为阴性对照的对照小鼠(nms)的正常血清(第二个直方图(b))或相比于作为阳性对照的纯化的抗原特异性抗体(上方直方图(a))的比率(%)。统计代表指定区域(m2和m1标签显示的是分别对抗原染色呈阳性或阴性的细胞)中事件相比于门内事件总数的数目和百分比。显示了平均荧光强度。
a:阳性对照
分子直方图
总事件:6764
标准直方图
总事件:7072
b:阴性对照nms
分子直方图
总事件:7093
标准直方图
总事件:7072
c:血清小鼠1(1/20)对nms
分子直方图
总事件:15544
标准直方图
总事件:7093
d:血清小鼠1(1/150)对nms
分子直方图
总事件:7102
标准直方图
总事件:7093
图4重建小鼠中人类cxcr5抗体产生能力的检测
图5第三次免疫后重建小鼠中人类cxcr5特异抗体产生能力的检测。
实施例
材料与方法
小鼠:按照ich、aaalac和eudirectiveonanimalwelfare,86/609的指导方针在无特异病原体的情况下饲养和维持balb/c背景的rag2-/-γc-/-小鼠。
新生鼠再增殖测定:出生当日,新生小鼠在3-4小时间隔内以滴定为亚致死的剂量2gy/分钟接受来自铯137源(biobeam8000,stsgmbh,braunschweig,德国)的2x2gy照射。照射后4-12小时,使用30号针头(hamiltonbonaduzag,bonaduz,瑞士)向小鼠肝脏(i.h.)移植例如单独的cd133+fl细胞或与25μlpbs中非造血cd133-肝脏细胞的组合或与生长因子的组合。新生鼠始终接受来自单个供体的细胞。小鼠在3周龄时断奶。小鼠的分析:为获得外周血细胞和血浆,乙醚麻醉后从小鼠眶后静脉窦采血。
流式细胞术分析及细胞分选:对于facs分析和细胞分选,使用生物素化或缀合有fitc、pe或apc的针对以下抗原的单克隆抗体:cd3(ucht1)、cd4(13b8.2)、cd8(b9.11)、cd40(mab89)、cd80(mab104)、cd83(hb15a)、cd86(ha5.2b7)(均为imunotech/beckmancoulter,marseille,法国)、cd19(hib19)、cd20(2h7)、cd34(581)、il-3ra/cd123(9f5)、cd11c(b-ly6)cd14(m5e2)(均为bdpharmingen,sandiego,ca)、cd45(hi30)、cd45ra(mem56)、hla-dr(tu36)(均为caltag,burlingame,ca)、tlr2(tl2.1)、tlrr4(hta125)、tcrab(ip26)、(均为ebioscience,sandiego,ca)、bdca-1、bdca-2、bdca-4、cd25(4e3)(均为miltenyibiotec)、igm(jacksonimmunoresearch,westgrove,pa)、ccr7(3d12,m.lipp提供,berlin,德国)。iotestbetamark用于vbanalysis(imunotech/beckmancoulter)。链霉抗生物素蛋白缀合的fitc、pe或apc(均为bdpharmingen)用于生物素化抗体的显影。通过碘化丙锭染色排除死亡细胞。合适的同种型匹配的无关对照mabs用于确定背景染色的水平。使用facscalibur分析细胞并用facsvantagese(bectondickinsonimmunocytometrysystems,mountainview,ca)分选细胞。
胎儿肝细胞。胎儿肝细胞来源:cambrexcorp.usa和stemcelltechnologiescorp.usa。
实施例1
重建小鼠的免疫方法
用100μg编码人类her3蛋白的质粒dna对三只rag2-/-γc-/-小鼠(3只雌性)进行免疫。经肌内(i.m.)进行共高达六次免疫。当发现抗her3的血清效价足够时,在融合前3、2和1天用100μlpbs中的30μg纯化的her3蛋白质静脉内(i.v.)额外加强小鼠三次。
实施例2
移入后第15周重建小鼠的外周血的流式细胞术分析
异氟烷麻醉小鼠然后从眼眶静脉丛收集外周血用于通过使用流式细胞仪检测人类血细胞的阳性率。收集的血液立刻与edta-2na充分混合并在室温保存直至分析。加入最适量fitc缀合的抗人类cd45抗体并与50μl全血在室温下反应20分钟。随后,使用facs溶液完成溶血及固定并用facscalibur测定比例。图1显示的是在三只受测小鼠外周血中人类cd45阳性细胞的比率(%)。
实施例3
重建小鼠中人类her3抗体产生能力的检测
通过elisa测定重建小鼠的外周血中总人类igg的量。将稀释的小鼠血包被在maxisorb96孔板(nunc)上并在室温下温育1小时。室温下用2%croteinc溶液封闭1小时后进行洗涤并随后加入过氧化物酶缀合的抗人类igg单克隆抗体。室温下温育45分钟后进行洗涤并加入abts底物溶液在室温下反应10分钟。然后在405nm测定吸光度(图2)。参照标准曲线计算igg浓度。
实施例4
免疫后第7周重建小鼠外周血中人类her3抗体的流式细胞术分析
重建后17周,用目的人蛋白质免疫小鼠。用25-100μg/小鼠的编码目的人类蛋白质的dna与作为佐剂用于加强免疫应答的细胞因子混合物经肌内共同进行免疫。每四周进行同样的免疫并取血清用于通过facs测定人类蛋白质特异性抗体。短暂地向人类蛋白质表达细胞中加入稀释的抗血清并在室温下温育20分钟。洗涤后加入最适量fitc缀合的抗人抗体并与细胞在室温下进一步反应20分钟。此后使用facscalibur测定染色的人类蛋白质表达细胞的阳性率。图3显示的是与作为阴性对照的正常小鼠血清(nms)或作为阳性对照的纯化的人类蛋白质特异性抗体相比,一只重建并免疫的小鼠中用不同的血清稀释液(1/20和1/150)染色的人类蛋白质阳性细胞的比率(%)。
实施例5
使用
按照标准dynal方案
-向例如2.5x107制备的细胞中加入25μl
-在2-8℃下轻微倾斜并旋转温育20分钟
-将管放置于磁铁上2分钟
-弃去上清液并温和洗涤珠结合的细胞4次,使用如下步骤:
-每1x107
-将管放置于磁铁上1分钟并弃去上清液
-在缓冲液/培养基中重悬浮细胞用于下游应用
实施例6
用于杂交瘤产生的电融合
将分离的cd19+细胞计数并经电融合方案(eppendorf的electrofusionno.58应用)进行融合:
-通过离心(200xg,室温10分钟)收集分离的cd19+细胞和融合伴侣例如k6h6/b5
-在生长培养基中重悬浮沉淀并测定细胞数目
-将每个融合伴侣的细胞数目设定为例如每次融合3x105
-将两种伴侣移液在一起并在室温以200xg离心10分钟
-在电融合缓冲液中洗涤沉淀两次,如上描述离心
-每次融合在200μl电融合缓冲液中重悬浮沉淀
-填充融合室并立刻融合(见fusionapparat的应用方案,eppendorf)
-融合后,允许融合室在室温下保持10分钟
-用培养基冲洗融合室并转移融合细胞至克隆平板
-经24小时培育(5%co2,37℃)后加入hat选择培养基
-经7-21天培育后计数并分析杂种。
融合后14天,在建立的elisa中分析生长的人类杂交瘤(40个克隆)的总igg及人类蛋白质特异性igg并检测到至少6个克隆为阳性。
实施例7
重建小鼠的免疫方法
三只rag2-/-γc-/-小鼠(4只雌性)用100μg编码人类cxcr5蛋白质的质粒dna进行免疫。经肌内(i.m.)进行共高达六次免疫。
小鼠的加强
当发现抗cxcr5的血清效价足够时,在融合前3、2和1天用100μlpbs中的5x106个cxcr5表达细胞静脉内(i.v.)额外加强小鼠三次。
实施例8
重建小鼠中人类cxcr5抗体产生能力的检测
通过elisa测定重建小鼠外周血中总人类igg的量。将稀释的小鼠血清包被在maxisorb96孔板(nunc)上并在室温下温育1小时。室温下用2%croteinc溶液封闭1小时后进行洗涤并随后加入过氧化物酶缀合的抗人类igg单克隆抗体。室温下温育45分钟后进行洗涤并加入abts底物溶液在室温下反应10分钟。然后在405nm下测定吸光度(图4)。参照标准曲线(250μg/ml总人类igg)计算igg浓度。
实施例9
第三次免疫后重建小鼠中人类cxcr5抗体的分析
通过cxcr5特异elisa测定重建小鼠血清中人类cxcr5特异igg的量(图5)。将稀释的小鼠血清包被在maxisorb96孔板(nunc)上并在室温下温育1小时。室温下用2%croteinc溶液封闭1小时后进行洗涤并随后加入过氧化物酶缀合的抗人类igg单克隆抗体。室温下温育45分钟后进行洗涤并加入abts底物溶液在室温下反应10分钟。然后在405nm下测定吸光度。
- 还没有人留言评论。精彩留言会获得点赞!