一种具有表面多样性的金纳米颗粒系列化合物的制作方法
本发明涉及一种金纳米颗粒系列化合物,尤其涉及一种具有表面多样性的金纳米颗粒系列化合物;属纳米材料表面的功能化修饰
技术领域:
。
背景技术:
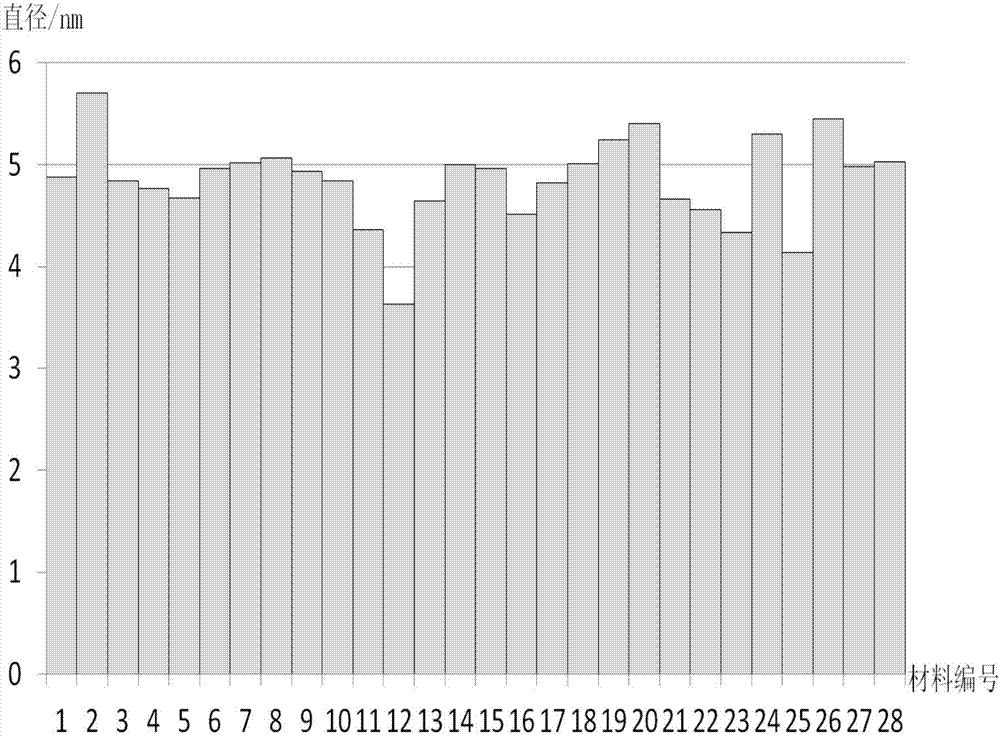
:纳米材料因其所具有的小尺寸效应,表面和界面效应以及量子尺寸效应等特性,在生活生产和生物医药领域发挥着日趋重要的作用,如纳米生物标记物、纳米成像剂和纳米药物载体等。随着纳米材料在各个领域的广泛应用,它可能对人类健康带来的潜在危害逐渐引起人们的高度关注。在纳米材料与生物系统作用过程中,其表面性质诸如亲疏水性,电荷,氢键,π-键,空间位阻结构等因素扮演着重要角色,在不同程度上影响其毒性、摄取途径、引发细胞自噬、在动物内体内器官分布等性质。为研究表面化学与材料生物效应之间的关系,已有许多具有单一连续变化特性的材料阵列见诸报道,如π键密度连续变化,空间结构连续变化,亲疏水性连续变化的一维纳米阵列。借助这些阵列来研究材料的生物效应已有许多进展,如有研究证实,材料表面亲疏水性质会影响其被细胞的识别和摄取,进而造成其在生物体内的差异化分布。然而,单一变化的阵列无法将多种不同表面性质置于同一维度上进行筛选和比较。经检索,同时将具有不同π键密度和空间结构的小分子与具有不同亲疏水性的小分子以组合化学理念将其两两组合修饰在金纳米颗粒表面,以得到一个具有表面多样性的金纳米颗粒系列化合物,以实现在二维的角度系统研究纳米材料与细胞间的相互作用中表面多种性质的协同影响的文献及专利还未见报道。技术实现要素:针对现有纳米材料表面化学修饰存在的问题,本发明的目的在于提供一种具有表面多样性的金纳米颗粒系列化合物。本发明所述的具有表面多样性的金纳米颗粒系列化合物,是通过改变赖氨酰胺类化合物配位体的结构,并使所述配位体分子与金纳米颗粒连接后制得;其特征在于:所述改变赖氨酰胺类化合物配位体结构的方法是:以如式(Ⅰ)所示的赖氨酰胺类化合物为母核,R1分别选取芳香酸类化合物,环脂肪酸类化合物,直链脂肪酸类化合物,取代芳香酸类化合物;R2分别选取芳香胺类化合物,环脂肪胺类化合物,直链脂肪胺类化合物,氨基酸类化合物,杂环胺类化合物,脂肪胺类化合物,葡糖胺类化合物;其中,所述芳香酸类化合物选苯甲酸(a),环脂肪酸类化合物选环己酸(b),直链脂肪酸类化合物选正丁酸(c),取代芳香酸类化合物选对三氟甲基苯甲酸(d),芳香胺类化合物选3,4-二甲氧基苯乙胺(e),环脂肪胺类化合物选环己胺(f),直链脂肪胺类化合物选正丁胺(g),氨基酸类化合物选对羟基苯甘氨酸(h),杂环胺类化合物选四氢糠胺(i),脂肪胺类化合物选1,1-二甲基-1,3-丙二胺(j),葡糖胺类化合物选葡糖胺(k)。上述方式制得的不同结构氨酰胺类化合物配位体分子分别与粒径为5nm±0.2nm的球形金纳米颗粒连接后得到的具有表面多样性的金纳米颗粒系列化合物由28种化合物组成,以GNP1~GNP28命名,分别是:式(Ⅰ)所示的赖氨酰胺类化合物母核与苯甲酸和3,4-二甲氧基苯乙胺连接,得到的配位体分子如式(Ⅱ)所示,该配位体分子通过金硫键的共价作用与金纳米颗粒连接制得的化合物,命名为GNP1;式(Ⅰ)所示的赖氨酰胺类化合物母核与环己酸和3,4-二甲氧基苯乙胺连接,得到的配位体分子如式(Ⅲ)所示,该配位体分子通过金硫键的共价作用与金纳米颗粒连接制得的化合物,命名为GNP2;式(Ⅰ)所示的赖氨酰胺类化合物母核与正丁酸和3,4-二甲氧基苯乙胺连接,得到的配位体分子如式(Ⅳ)所示,该配位体分子通过金硫键的共价作用与金纳米颗粒连接制得的化合物,命名为GNP3;式(Ⅰ)所示的赖氨酰胺类化合物母核与对三氟甲基苯甲酸和3,4-二甲氧基苯乙胺连接,得到的配位体分子如式(Ⅴ)所示,该配位体分子通过金硫键的共价作用与金纳米颗粒连接制得的化合物,命名为GNP4;式(Ⅰ)所示的赖氨酰胺类化合物母核与苯甲酸和环己胺连接,得到的配位体分子如式(Ⅵ)所示,该配位体分子通过金硫键的共价作用与金纳米颗粒连接制得的化合物,命名为GNP5;式(Ⅰ)所示的赖氨酰胺类化合物母核与环己酸和环己胺连接,得到的配位体分子如式(Ⅶ)所示,该配位体分子通过金硫键的共价作用与金纳米颗粒连接制得的化合物,命名为GNP6;式(Ⅰ)所示的赖氨酰胺类化合物母核与正丁酸和环己胺连接,得到的配位体分子如式(Ⅷ)所示,该配位体分子通过金硫键的共价作用与金纳米颗粒连接制得的化合物,命名为GNP7;式(Ⅰ)所示的赖氨酰胺类化合物母核与对三氟甲基苯甲酸和环己胺连接,得到的配位体分子如式(Ⅸ)所示,该配位体分子通过金硫键的共价作用与金纳米颗粒连接制得的化合物,命名为GNP8;式(Ⅰ)所示的赖氨酰胺类化合物母核与苯甲酸和正丁胺连接,得到的配位体分子如式(Ⅹ)所示,该配位体分子通过金硫键的共价作用与金纳米颗粒连接制得的化合物,命名为GNP9;式(Ⅰ)所示的赖氨酰胺类化合物母核与环己酸和正丁胺连接,得到的配位体分子如式(Ⅺ)所示,该配位体分子通过金硫键的共价作用与金纳米颗粒连接制得的化合物,命名为GNP10;式(Ⅰ)所示的赖氨酰胺类化合物母核与正丁酸和正丁胺连接,得到的配位体分子如式(Ⅻ)所示,该配位体分子通过金硫键的共价作用与金纳米颗粒连接制得的化合物,命名为GNP11;式(Ⅰ)所示的赖氨酰胺类化合物母核与对三氟甲基苯甲酸和正丁胺连接,得到的配位体分子如式(ⅩⅢ)所示,该配位体分子通过金硫键的共价作用与金纳米颗粒连接制得的化合物,命名为GNP12;式(Ⅰ)所示的赖氨酰胺类化合物母核与苯甲酸和对羟基苯甘氨酸连接,得到的配位体分子如式(ⅩⅣ)所示,该配位体分子通过金硫键的共价作用与金纳米颗粒连接制得的化合物,命名为GNP13;式(Ⅰ)所示的赖氨酰胺类化合物母核与环己酸和对羟基苯甘氨酸连接,得到的配位体分子如式(ⅩⅤ)所示,该配位体分子通过金硫键的共价作用与金纳米颗粒连接制得的化合物,命名为GNP14;式(Ⅰ)所示的赖氨酰胺类化合物母核与正丁酸和对羟基苯甘氨酸连接,得到的配位体分子如式(ⅩⅥ)所示,该配位体分子通过金硫键的共价作用与金纳米颗粒连接制得的化合物,命名为GNP15;式(Ⅰ)所示的赖氨酰胺类化合物母核与对三氟甲基苯甲酸和对羟基苯甘氨酸连接,得到的配位体分子如式(ⅩⅦ)所示,该配位体分子通过金硫键的共价作用与金纳米颗粒连接制得的化合物,命名为GNP16;式(Ⅰ)所示的赖氨酰胺类化合物母核与苯甲酸和四氢糠胺连接,得到的配位体分子如式(ⅩⅧ)所示,该配位体分子通过金硫键的共价作用与金纳米颗粒连接制得的化合物,命名为GNP17;式(Ⅰ)所示的赖氨酰胺类化合物母核与环己酸和四氢糠胺连接,得到的配位体分子如式(ⅩⅨ)所示,该配位体分子通过金硫键的共价作用与金纳米颗粒连接制得的化合物,命名为GNP18;式(Ⅰ)所示的赖氨酰胺类化合物母核与正丁酸和四氢糠胺连接,得到的配位体分子如式(ⅩⅩ)所示,该配位体分子通过金硫键的共价作用与金纳米颗粒连接制得的化合物,命名为GNP19;式(Ⅰ)所示的赖氨酰胺类化合物母核与对三氟甲基苯甲酸和四氢糠胺连接,得到的配位体分子如式(ⅩⅩⅠ)所示,该配位体分子通过金硫键的共价作用与金纳米颗粒连接制得的化合物,命名为GNP20;式(Ⅰ)所示的赖氨酰胺类化合物母核与苯甲酸和1,1-二甲基-1,3-丙二胺连接,得到的配位体分子如式(ⅩⅩⅡ)所示,该配位体分子通过金硫键的共价作用与金纳米颗粒连接制得的化合物,命名为GNP21;式(Ⅰ)所示的赖氨酰胺类化合物母核与环己酸和1,1-二甲基-1,3-丙二胺连接,得到的配位体分子如式(ⅩⅩⅢ)所示,该配位体分子通过金硫键的共价作用与金纳米颗粒连接制得的化合物,命名为GNP22;式(Ⅰ)所示的赖氨酰胺类化合物母核与正丁酸和1,1-二甲基-1,3-丙二胺连接,得到的配位体分子如式(ⅩⅩⅣ)所示,该配位体分子通过金硫键的共价作用与金纳米颗粒连接制得的化合物,命名为GNP23;式(Ⅰ)所示的赖氨酰胺类化合物母核与对三氟甲基苯甲酸和1,1-二甲基-1,3-丙二胺连接,得到的配位体分子如式(ⅩⅩⅤ)所示,该配位体分子通过金硫键的共价作用与金纳米颗粒连接制得的化合物,命名为GNP24;式(Ⅰ)所示的赖氨酰胺类化合物母核与苯甲酸和葡糖胺连接,得到的配位体分子如式(ⅩⅩⅥ)所示,该配位体分子通过金硫键的共价作用与金纳米颗粒连接制得的化合物,命名为GNP25;式(Ⅰ)所示的赖氨酰胺类化合物母核与环己酸和葡糖胺连接,得到的配位体分子如式(ⅩⅩⅦ)所示,该配位体分子通过金硫键的共价作用与金纳米颗粒连接制得的化合物,命名为GNP26;式(Ⅰ)所示的赖氨酰胺类化合物母核与正丁酸和葡糖胺连接,得到的配位体分子如式(ⅩⅩⅧ)所示,该配位体分子通过金硫键的共价作用与金纳米颗粒连接制得的化合物,命名为GNP27;式(Ⅰ)所示的赖氨酰胺类化合物母核与对三氟甲基苯甲酸和葡糖胺连接,得到的配位体分子如式(ⅩⅩⅨ)所示,该配位体分子通过金硫键的共价作用与金纳米颗粒连接制得的化合物,命名为GNP28;上述具有表面多样性的金纳米颗粒系列化合物命名及相应配位体对照表:本发明所述具有表面多样性的金纳米颗粒系列化合物在研究纳米颗粒材料与细胞间相互作用中的应用。为了更好地理解本发明的实质和它的利用价值,下面用金纳米颗粒的制备实验及其表征结果来说明本发明所述表面多样性金纳米颗粒系列化合物在研究纳米颗粒材料与细胞间相互作用的应用。1、所述表面多样性金纳米颗粒系列化合物的制备。上述R1、R2分别取代的赖氨酰胺类配体化合物,当R1、R2均≠H时,以如下步骤制备:(a)将酰氯R1-COCl(1)与N-Boc-L-赖氨酸(2)反应生成相应的R1取代N-Boc-L-赖氨酰胺(3);(b)R1取代N-Boc-L-赖氨酰胺(3)与胺R2–NH2(4)反应生成相应的R1、R2分别取代的N-Boc-L-赖氨酰胺(5);(c)R1、R2分别取代的N-Boc-L-赖氨酰胺(5)与三氟乙酸(6)进行反应,生成相应的R1、R2分别取代的NH2-L-赖氨酰胺(7);(d)R1、R2分别取代的NH2-L-赖氨酰胺(7)与硫辛酸(8)进行反应,生成相应的R1、R2分别取代的赖氨酰胺类配体化合物(9)上述R1、R2分别取代的赖氨酰胺类配体化合物制备的化学反应式如下:将上述R1、R2分别取代的赖氨酰胺类配体化合物溶于DMF中,将氯金酸加到此溶液中并在室温下搅拌30分钟。硼氢化钠的水溶液滴加入其中。在室温下继续搅拌4小时,得到表面连接目标配位体的金纳米颗粒溶液。所得溶液用离心洗涤的方法进行纯化。其反应过程如下所示:2、所述金纳米颗粒系列化合物的表征。对所述金纳米颗粒系列化合物中的GNP1~GNP28进行表征和分析。在透视电子显微镜下观察所述GNP1~GNP28金纳米颗粒的形貌,观察得到金纳米颗粒呈近似圆形,平均粒径在4.8nm左右,如图1、图2所示;将所述金纳米颗粒系列化合物进行动态光散射粒径分析,得到金纳米颗粒的动态水合粒径约为200~300nm不等,如图3所示;将所述金纳米颗粒系列化合物进行Zeta电位分析,得到其表面均带负电,Zeta电位约为-20~-40mV不等,每种材料的表面环境均处于较稳定的状态,如图4所示。用元素分析方法对所述金纳米颗粒系列化合物表面的配体上载量进行定量分析,计算每个金纳米颗粒表面连接的配体个数,以GNP2、GNP3、GNP5、GNP9、GNP13、GNP14、GNP19、GNP25、GNP28为例,因配位体性质不同造成其上载量存在一定区别,约在100~300个配位体/金纳米球之间。表面配体上载量具体结果如下表所示:表面配体上载量对所述金纳米颗粒系列化合物表面亲疏水性进行分析,用油水分配系数LogP进行区分,所述系列中化合物部分呈亲水性,部分呈疏水性,研究表明,材料表面亲疏水性会影响其细胞摄入程度:表面疏水的材料更易被细胞摄取,而表面亲水的材料摄入量相比较低,系列化合物的LogP分布如图5所示,LogP值为-2.548~1.28不等。本发明公开的具有表面多样性的金纳米颗粒系列化合物由28种纳米材料组成,由于这些纳米材料表面化学环境不同,因而在同细胞发生相互作用时表现出不同的作用,可用于研究纳米颗粒表面性质与细胞之间作用的关系的模型,还可以指导作为靶向载运药物、生物显影、疾病诊断及基因治疗等应用于生物医学领域的载体的设计。附图说明图1:所述金纳米颗粒系列化合物中GNP3、6、7、8、9、10、16、20的透视电子显微镜图。其中所示的金纳米颗粒呈近似圆形。图2:所述金纳米颗粒系列化合物的平均粒径统计图。其平均粒径在4.8nm左右;图3:上图是所述金纳米颗粒系列化合物的动态光散射粒径分布,下图为其粒径折线统计图。显示材料的动态水合粒径约为200~300nm不等。图4:上图是所述金纳米颗粒系列化合物的表面Zeta电位分布,下图为其电位折线统计图。显示颗粒表面均带负电,Zeta电位约为-20~-40mV不等。图5:所述金纳米颗粒系列化合物的表面LogP统。显示材料部分呈亲水性,部分呈疏水性,LogP值为-2.548~1.28不等。具体实施方式实施例1金纳米颗粒系列化合物的合成:以所述赖氨酰胺类化合物母核与苯甲酸和环己胺连接,再与金纳米颗粒结合生成GNP5的过程为例:冰浴下,将100mLH2O与8.0g(200mmol)NaOH配成氢氧化钠水溶液。称取9.85g(40mmol)N-Boc-L-赖氨酸,溶于100mL氢氧化钠水溶液中。在剧烈搅拌下,将4.7mL(40mmol)苯甲酰氯缓慢滴加入上述氢氧化钠水溶液中。反应4~6小时,TLC监测反应。反应结束后,有大量白色固体析出。抽滤后,用10%盐酸溶液,氯化钠饱和溶液,水依次洗涤,晾干。得到(1)苯甲酸取代的中间产物。将苯甲酸取代的中间产物3.5g(10mmol)溶于20mLTHF中,搅拌条件下,加入HATU3.8g(10mmol)。冰浴下,加入三乙胺5mL。在剧烈搅拌下,将1.10mL(10mmol)环己胺缓慢滴加入上述四氢呋喃溶液中。然后在室温下反应12个小时,TLC检测反应。反应结束后,出现沉淀。将反应液过滤,固体用少许乙醇洗涤。合并滤液。滤液减压蒸馏浓缩后,倾入氯化钠饱和溶液中,析出大量沉淀。抽滤后,用水反复洗涤粗产物,粗产物在乙酸乙酯中重结晶,得到(2)苯甲酸和环己胺取代的中间产物。将苯甲酸和环己胺取代的中间产物2.20g(5mmol)溶于20mLDCM中,冰浴冷却至0℃,在剧烈搅拌下,将1.00mL(mmol)三氟乙酸缓慢滴加入上述二氯甲烷溶液中。反应2h后,将反应液用10%碳酸氢钠溶液,氯化钠饱和溶液,水依次洗涤,干燥,减压蒸馏旋干溶剂。得到产物(3)苯甲酸和环己胺取代的赖氨酰胺类化合物。将硫辛酸1.01g(5mmol)溶于20mLTHF中,搅拌条件下,加入HATU1.9g(5mmol)。冰浴下,加入三乙胺2.5mL。在剧烈搅拌下,将上步1.66g(5mmol)溶解于10mL四氢呋喃中缓慢滴入。然后在室温下反应12个小时,TLC检测反应。反应结束后,出现沉淀。将反应液过滤,固体用少许乙醇洗涤。合并滤液。滤液减压蒸馏浓缩后,倾入氯化钠饱和溶液中,析出大量沉淀。抽滤后,用水反复洗涤粗产物,粗产物在乙酸乙酯-石油醚中重结晶,得到(4)苯甲酸和环己胺取代的赖氨酰胺类化合物配位体。反应途径如下图所示。产物苯甲酸和环己胺取代的赖氨酰胺类化合物配位体为淡黄色粉末,收率53.09%;1HNMR(500MHz,DMSO-d6)δ(ppm)=8.45(s,1H),8.05(s,2H),7.9~7.5(m,5H),4.53(m,1H),3.34(m,1H),3.01(t,1H),2.6(m,3H),2.1~1.1(m,27H),C27H41N3O3S2,ESI-MS:m/z520.2(M+1)+。将配位体分子(0.064mmol)溶于DMF(20mL)中,然后将氯金酸(25.0mg,0.064mmol)加到此溶液中并在室温下搅拌30分钟。硼氢化钠(7.2mg,0.19mmol)的水溶液(12mL)滴加入其中。在室温下继续搅拌过夜。所得的金纳米颗粒溶液用离心管离心分离纯化,转速10000转/min。得到的固体颗粒为GNP5化合物,分散于水中储存。化学反应式如下:GNP1~GNP4及GNP6~GNP28制备方法类似于GNP5化合物的制备。实施例2用透视电子显微镜对金纳米颗粒系列化合物进行形貌分析:将GNP1~GNP28金纳米材料溶液置于超声破碎仪中超声5min,取出50μL溶液加入洁净小管内,用高纯水稀释至1mL,再次超声5min,使材料分散均匀。用10μL移液枪取8μL材料小心滴至铜网上,在红外灯下烘干至少30分钟。使用JEM1011低分辨透射电子显微镜,在80KV电压条件下使用AMT2kCCD镜头对金纳米颗粒的形貌进行观察。观察得到金纳米颗粒呈近似圆形,平均粒径在4.8nm左右,如图1、图2所示。实施例3对金纳米颗粒系列化合物进行水合粒径分析:将GNP1~GNP28金纳米材料溶液用高纯水稀释成浓度为50μg/mL的金纳米溶液,置于超声破碎仪中超声5min,使用移液枪取1mL左右的待测样品溶液注入MalvernNanoZetasizer仪器的Sizer样品池中,通过动态光散射(DynamicLightScattering,DLS)方法测量待测金纳米粒子在高纯水中的粒径分布,测量条件为25℃,平行三次取其平均值。得到金纳米颗粒的动态水合粒径约为200~300nm不等,如图3所示。实施例4对金纳米颗粒系列化合物进行表面Zeta电位分析:将GNP1~GNP28金纳米材料溶液用高纯水稀释成浓度为50μg/mL的金纳米溶液,置于超声破碎仪中超声5min,使用1mL的去针头注射器吸取将待测金纳米材料溶液,将其注入MalvernNanoZetasizer仪器的Zeta电位样品池中,注入过程应尽可能缓慢小心,避免样品池中产生气泡影响测量。于25℃条件下依次检测金纳米粒子的Zeta电位,平行三次取其平均值。得到其表面均带负电,Zeta电位约为-20~-40mV不等,每种材料的表面环境均处于较稳定的状态,如图4所示。实施例5对金纳米颗粒系列化合物进行表面亲疏水性分析:1)将等体积的去离子水和正辛醇溶液混合搅拌24hrs。静置混合溶液,待其分层后,上层是已将溶液中所含的水饱和的正辛醇溶液,下层是已将溶液中所含的正辛醇饱和的水溶液,分离两相,分开保存备用。2)加入一定体积预先用正辛醇饱和过的水溶液,再分别取0.3mg的GNP1~GNP28金纳米颗粒至总体积为1mL,上下颠倒待其混匀后,加入等体积的1mL预先用高纯水饱和过的正辛醇溶液,放于摇床振摇24hrs。3)振摇结束后,将离心管取下,静置一段时间至两相分离界限清晰。用移液器取出一定体积的两相溶液,分别转移到不同10mL的比色管中。于120℃,真空条件下,干燥4h至溶液挥发完全。向比色管中加入500μL新配王水,消解12h。再加入高纯水定容至10mL。4)配制金标准曲线:利用金标准液(1000ppm)配制一系列浓度梯度的金标准溶液,配制方法如下表所示。标准工作曲线配制方法列表:标准溶液浓度取上级溶液体积加入水的体积10ppm1000ppm标准液100μL9.9mL200ppb10ppm标准液200μL9.8mL150ppb10ppm标准液150μL9.85mL100ppb200ppb标准液5mL5mL50ppb5mL5mL20ppb4mL6mL10ppb5mL5mL5ppb5mL5mL0ppb-10mL用ICP-MS对正辛醇相和水相中金的含量进行检测。将得到的浓度,代入如下公式计算金纳米材料的辛醇-水脂水分配系数。LogP=Log(Co/Cw)系列化合物的LogP分布如图5所示,LogP值为-2.548~1.28不等。实施例6对金纳米颗粒系列化合物进行表面配体上载量分析:采用元素分析方法对金纳米颗粒表面的配体上载量进行定量分析。分别取含约3mg金纳米材料的GNP2、GNP3、GNP5、GNP9、GNP13、GNP14、GNP19、GNP25、GNP28金纳米溶液,置于洁净离心管中,-80℃条件下预冻4小时,预冻完成后取出,去盖并用封口膜封住瓶口,用针头在封口膜上扎若干小孔,避免冻干过程中压差过大造成固体迸出。处理后的离心管放置在冻干机中冻干过夜,得到固体粉末状的金纳米颗粒。进行元素分析,所得的元素含量数据经过计算,得出金纳米颗粒表面的配体上载量。因配位体性质不同造成其上载量存在一定区别,约在100~300个配位体/金纳米球之间。实施例7所述金纳米颗粒系列化合物的细胞毒性:将处在对数生长期的THP-1细胞接种于96孔板中,用PMA刺激贴壁48h后弃去培养液,用不含巯基乙醇的1640培养液清洗两次,加入含100μg/mL和200μg/mL纳米材料GNP1~GNP28且不含巯基乙醇的1640培养基,孵育24h,弃去培养液,用不含巯基乙醇的1640清洗后,加入50μL不含巯基乙醇的1640培养液和50μL的CellTiter-避光条件下,将96孔板放到水平摇床上摇晃2min后,离心使纳米材料沉在孔底,移取80μL上清液至到白色不透光的96孔细胞培养板中,利用多功能酶标仪测定化学发光,计算细胞活力。对结果进行分析可知,经不同金纳米颗粒处理后的细胞活力存在差异,即所述金纳米颗粒系列化合物对细胞具有不同毒性,且这种毒性与其表面多样性有关。这预示着所述金纳米颗粒系列化合物在研究表面性质与材料生物效应的关系中存在一定研究意义,在研究纳米材料的细胞摄取、氧化应激、细胞自噬等其他多种生物效应时具有潜在的应用价值。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1