一种增强TRPV4‑KCa2.3复合体耦联度的化合物及其在抗高血压中的应用的制作方法
本发明涉及抗高血压药物技术领域,尤其是涉及一种增强内皮细胞离子通道复合体trpv4-kca2.3空间耦联度的化合物在抑制高血压中的应用。
背景技术:
中国产业信息网发布的《2014-2019年中国抗高血压药物市场运营监测与发展前景研究报告》指出:高血压是一个终身疾病,一般病人需要终身每天服药。高血压药物发展经历了几个时代,60年代推出利尿剂,70年代推出β-受体阻滞剂,80年代推出钙通道拮抗剂和血管紧张素转化酶抑制剂(acei)等,90年代又开发出更具有特异性的血管紧张素ii受体拮抗剂(沙坦类),之后相继有多个单方和复方制剂获美国fda批准上市,成为高血压治疗的一线药物。
抗高血压单药发展相对成熟,根据机理大致可分为五类:
(1)利尿剂:如氢氯噻嗪、布美他尼、吲达帕胺及利尿剂类复方制剂等;
(2)钙离子通道拮抗剂:如硝苯地平、氨氯地平、地尔硫卓、维拉帕米等;
(3)β受体阻滞剂:如普萘洛尔、阿替洛尔、美托洛尔、拉贝洛尔等;
(4)血管紧张素转化酶抑制剂:如卡托普利、依那普利、贝那普利、赖诺普利等;
(5)血管紧张素ii受体拮抗剂:如氯沙坦、缬沙坦、替米沙坦、奥美沙坦等。
不同机制的高血压药品因为其作用靶点的差异,均有各自的优劣势,在高血压治疗中需要选择适合病人的药品,大部分患者在一种药物达不到治疗效果后,往往采取联合治疗的方式。
瞬时感受器电位离子通道香草素受体家族4(ransientreceptorpotentialvanilloid4,trpv4)是trp通道香草素受体亚家族的成员,是一种非选择性阳离子通道。trpv4通道具有六个跨膜α螺旋结构域,分别为s1-s6,在s5和s6之间有一个调控离子通过的孔环区域,其n末端和c末端均在细胞内。trpv4通道在信号的转导作用必须形成功能性的同聚或异聚四聚体方可发挥作用。trpv4通道的n末端包含至少三个锚蛋白结合部位,锚蛋白可以与trpv4通道相互作用,可以抑制ip3受体从而调节细胞内ca2+的释放。trpv4通道具有非常高的ca2+通透性,大量表达于血管内皮细胞中,其作为ca2+通道,参与内皮细胞的信号传导。
小电导钙激活钾离子通道skca分为三类kca2.1、kca2.2、kca2.3,其中kca2.3主要表达分布在神经元和胶质细胞以及血管平滑肌细胞和内皮细胞其中,kca2.3在人体的生理活动中起重要的作用,尤其是在平滑肌的松弛过程中。kca2.3的持续激活导致了血管内皮细胞的膜电位持续超级化,然后连接到附近的平滑肌。阻断或抑制kca2.3会大大增加血管阻力,产生血管外周阻力,增加血压。
研究表明trpv4和kca2.3在血管内皮细胞上存在物理相互作用,ca2+通过trp通道进入细胞激活这些钾离子通道,然后引起血管的舒张。但是,其具体的相互作用位点仍未研究清楚,通过寻找其相互作用位点并发现作用于其位点的化合物对于高血压药物的研发具有重大的意义。
技术实现要素:
针对现有技术存在的上述问题,本申请人提供了一种增强内皮细胞离子通道复合体trpv4-kca2.3空间耦联度的化合物抑制高血压的应用。本发明通过寻找内皮细胞离子通道复合体trpv4-kca2.3的相互作用位点的结构域,制备了能同时作用于这两个作用位点的特异性化合物,发现该化合物能增强trpv4-kca2.3复合体的空间耦联度,并对高血压药物的研发具有重大的意义。
本发明的技术方案如下:
本申请人提供了一种增强内皮细胞离子通道复合体trpv4-kca2.3空间耦联度的化合物,所述内皮细胞离子通道复合体trpv4-kca2.3的相互作用位点的结构域为trpv4蛋白的ar2结构域及kca2.3蛋白的17c结构域,所述化合物为通式(1)所示化合物,该化合物编号为jnc-440:
所述的增强内皮细胞离子通道复合体trpv4-kca2.3空间耦联度的化合物的制备方法具体步骤如下:
(1)丙二胺首先经叔丁氧羰基保护单个氨基:
(2)将另一裸露的氨基与二苯基乙酰氯成酰胺:
(3)酰胺产物在酸性条件下脱除叔丁氧羰基保护:
(4)脱除氨基保护的化合物再与4-喹唑啉酮-2-甲酸乙酯发生胺酯交换得到目的化合物:
本申请人还提供了所述的化合物的应用,所述化合物能作用于trpv4和kca2.3相互作用位点的结构域,从而增强复合体trpv4-kca2.3的空间耦联度。
本申请人还提供了另一种所述的化合物的应用,所述化合物能抑制高血压。
本申请人还提供了所述的内皮细胞离子通道复合体trpv4-kca2.3的相互作用位点的trpv4蛋白的ar2结构域及kca2.3蛋白的17c结构域在抑制高血压中的应用。
本发明有益的技术效果在于:
本发明首先通过结构域位点突变的方法寻找trpv4蛋白和kca2.3蛋白的相互作用位点结构域,然后筛选能增强trpv4-kca2.3复合体空间耦联度的化合物,并研发新的制备该化合物的方法,最后将该化合物作用于高血压小鼠模型,检测其对高血压的疗效。
经本发明人研究发现,trpv4的结构域ar2和kca2.3的结构域17c是其相互作用的作用位点,制备同时作用于这两个作用位点的化合物,通过作用高血压小鼠模型发现该化合物通过增强trpv4-kca2.3复合体空间耦联度从而起到抑制高血压的效果。本发明对于高血压药物的研发具有重大的意义。
附图说明
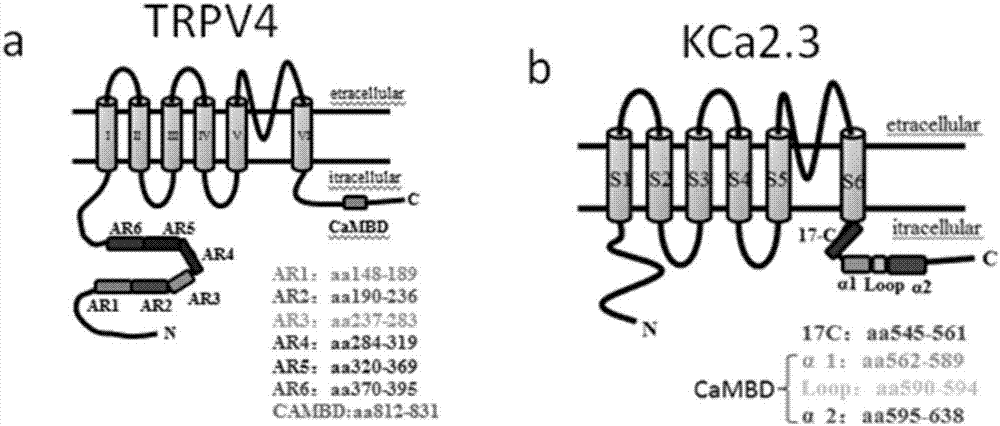
图1为trpv4蛋白和kca2.3蛋白的三维结构及其功能区域简图;
图2为本发明实施例2中运用荧光共振能量转移和随机光学重构显微技术寻找trpv4蛋白和kca2.3蛋白相互作用位点的结果图;
图3为实施例1制备的化合物的双靶点免疫共沉淀结果图;
图4为本发明实施例3中运用荧光共振能量转移技术检测实施例1制备的化合物作用于高血压小鼠模型后trpv4-kca2.3复合体耦联度变化的结果图;
图5为实施例1制备的化合物作用于三种高血压小鼠模型后,检测其血压变化的结果图。
具体实施方式
下面结合附图和实施例,对本发明进行具体描述。
以下实施例所使用实验材料如下:
细胞系:hek293细胞购自中科院上海细胞库。
实验动物:8周龄c57bl/6j雄性小鼠,spf级,购自常州卡文斯实验动物有限公司。
质粒和引物:含cfp-trpv4全基因或yfp-kca2.3全基因的质粒模板由香港中文大学罗桂祥生物医学院赠送;引物均购自上海生工生物工程有限公司
短肽:
ar2:ygrkkrrqrrrtgktclpkallnlsngrndtipvlldiaertgnmrefinspfrdiyy;
17c:ygrkkrrqrrrrkleltkaekhvhnfmm均购自上海生工生物工程有限公司。
试剂:一抗goatanti-trpv4(sc-47527),购自santacruz公司;一抗rabbitanti-kca2.3(apc-025),购自alomone公司;二抗alexafluor647和alexafluor488购自invitrogen公司。
点突变试剂盒quickchangetm购自stratagene公司;dna产物纯化试剂盒和质粒提取试剂盒均购自北京天根生化科技有限公司;dh5α感受态细胞购自北京天根生化科技有限公司;
生物素化jnc-440合成步骤如下:
(1)化合物jnc-440在三氯氧磷的作用下得到羰基的氯化产物:
(2)氯代产物与5-氨基-1-戊醇发生亲核取代反应:
(3)生物素与上一步的产物发生酯化反应得到生物素化的jnc-440:
8%高盐饲料(tp6032-s8)购自南通特洛菲饲料科技有限公司;l-name(nitro-l-arginine)(n5501-5g)购自sigma公司;血管紧张素2(ang-2)(a107852)购自上海阿拉丁生化科技股份有限公司;
其它所有化学试剂均购自国药集团化学试剂有限公司。
实验仪器:大小鼠血压测量仪(bp98a),购自sinsi公司;osmoticpumps(植入式胶囊渗透压泵)购自alzet公司;凝胶成像系统购自gene公司;激光共聚焦显微镜购自leica公司;
实施例1:化合物的制备方法
(1)将化合物1-丙烯二胺(30g,405mmol,1eq)溶解于150ml二氯甲烷中,冰浴搅拌;将2-叔丁基碳酸氢钠(16.1g,73mmol,0.18eq)溶解并稀释于50ml二氯甲烷中;将混合物缓慢倒入烧瓶中,室温搅拌3小时;反应完全后用薄层色谱法(tlc)检测,用50ml二氯甲烷稀释并用水洗涤数次,再用饱和nacl溶液洗涤,之后用无水na2so4进行干燥,浓缩后获得化合物2(19g,27%);
(2)化合物2(10g,57mmol,1eq)和三乙胺(tea)(8.7g,86mmol,1.5eq)溶解于100ml二氯甲烷并于冰浴搅拌;二苯基乙酰氯(13.1g,57mmol,1eq)溶解于30ml二氯甲烷中,并缓慢倒入烧瓶内,室温搅拌2.5小时;反应完全后使用tlc检测,进行粗制品浓缩;柱层析法分离(20:1二氯甲烷/甲醇)获得化合物3(13.2g,63%);
(3)化合物3(8g,22mmol,1eq)溶解于混合溶剂中(40ml:二氯甲烷:三氟乙酸=4:1),混合物油浴加热至35℃,1小时;完全反应后使用tlc检测,用氨水调节体系ph至8-9,直至产生固体沉淀;过滤干燥后获得化合物4(5.3g,90%);
(4)将化合物4(2g,7mmol,2eq)和4-喹唑啉酮-2-甲酸乙酯(0.8g,3.5mmol,1eq)溶解于6ml乙醇中,置于微波反应器中100℃反应45分钟;完全反应后tlc检测,自然冷却溶液获得白色固体沉淀,过滤干燥后获得化合物5。该化合物5即本发明所述的作用于高血压的化合物。
实施例2:寻找trpv4蛋白和kca2.3蛋白相互作用位点的结构域
实验方法:根据trpv4蛋白和kca2.3蛋白的三维结构及其功能特点选择可能的结合位点(如图1所示),所选择的结构域均主要用于调节蛋白质-蛋白质之间的关系,是蛋白质交互的平台。突变所选择的结合位点,使结合位点缺失,所用引物如表1所示。
表1
所用pcr反应体系为:模板(cfp-trpv4全基因或yfp-kca2.3全基因)0.5μl,primstarhs25μl,上下游引物各0.5μl,加h2o补足至50μl。pcr反应程序为:预变性95℃2min,变性95℃30s,退火55℃30s,延伸68℃5min,循环30次,充分延伸68℃10min。pcr结束后用pcr产物纯化试剂盒进行纯化,纯化后产物用dpni酶进行酶切,酶切反应体系为:dpni酶0.4μl,pcr纯化产物5μl,10×buffer2μl,ddh2o12.6μl。酶切条件为37℃1h,灭活条件为80℃,20min。将酶切产物转化dh5a感受态细胞,将筛选出的单克隆细胞扩培后用质粒提取试剂盒提取质粒,送样进行基因测序。
将突变质粒转染至hek293细胞中,将转染后的细胞铺共聚焦小皿,24小时后通过激光共聚焦显微镜的fretab模式检测突变前后两种蛋白的耦联情况。
按照上述基因突变的方法构建trpv4-△ar2h和kca2.3△17c质粒,转染至hek293细胞中,24小时后细胞用含有3%多聚甲醛和0.1%戊二醛的pbs溶液固定,然后用pbs稀释的0.1%硼氢化钠清洗。细胞在封闭液(在pbs中加入3%bsa和0.2%tritonx-100)中经过封闭、渗透化处理,用一抗4度孵育过夜后,清洗三次,然后在室温下用二抗孵育45分钟。使用goatanti-trpv4和rabbitanti-kca2.3作为一抗,二抗是alexafluor647和alexafluor488。同时通过随机光学重构显微技术(storm)将两种蛋白共定位,从而进一步验证fret结果的准确性。同上方法制备样品,在干净的共聚焦小皿中心处加入大约4μl的成像缓冲液,缓冲液中包含了5%(w/v)葡萄糖,100mm半胱胺酸,0.8mg/ml葡糖氧化酶和40μg/ml过氧化氢酶,溶解在ph为7.5或8的tris-hcl。在该storm成像缓冲液中呈现光谱分辨单分子图像。
实验结果:图2a显示,与其它突变位点相比,突变trpv4的ar2结构域或kca2.3的17c结构域时,fret现象均明显下降。图2b的超高清成像实验进一步验证。表明trpv4的结构域ar2和kca2.3的结构域17c为两个蛋白的结合位点。
图2a中由蓝色-绿色-黄色-红色,fret效率依次升高。
图2b中红色表示trpv4蛋白,绿色表示kca2.3蛋白,黄色表示绿色和红色重叠。
实施例3:实施例1所制备的化合物以trpv4的结构域ar2和kca2.3的结构域17c为靶点。
实验方法:
原代分离c57bl/6j老鼠肠系膜内皮细胞,置于细胞恒温培养箱培养,加入生物素化jnc-440(10μm/l)或者短肽和生物素化jnc-440(10μm/l),与细胞共培养96小时。用ripa裂解得到细胞蛋白,蛋白上清加入10μl链霉亲和素化磁珠,4℃孵育过夜。用磁力架吸附孵育后的悬液,得到亲和素化磁珠-生物素化jnc-440-蛋白复合物。用50μl1xloadingbuffer重悬复合物,沸水浴煮沸5分钟。样品通过sds-page进行分离,转移蛋白至pvdf膜上,5%bsa室温封闭4h,一抗4度孵育过夜,二抗室温孵育2h,加入ecl显色剂,用蛋白成像系统进行检测分析。
实验结果:
实验结果如图3显示,生物素化jnc-440能结合trpv4及kca2.3蛋白;当加入短肽ar2后,生物素化jnc-440结合trpv4蛋白能力显著下降。另一方面,相比对照组,当加入短肽17c后,生物素化jnc-440结合kca2.3蛋白能力显著下降。结果提示生物素化jnc-440能结合trpv4和kca2.3,并且结合区域为ar2及17c。
实施例4:实施例1所制备的化合物能增强内皮细胞离子通道复合体trpv4-kca2.3的空间耦联度
实验方法:
选用8周龄雄性c57bl/6j小鼠,自由饮食预适应一周后,分四组,分别是8%高盐组、l-name组、ang-2组和对照组。先对4组小鼠进行基础血压测量,确定小鼠血压基线。对照组条件不改变,每天测量血压;高盐组饲喂8%高盐饲料,后每天测量血压;l-name组饮用5%的l-name溶液,后每天测量血压;ang-2组先4%水合氯醛进行麻醉,通过背部埋泵对小鼠进行手术,每个泵注射2.88mg/mlang-2溶液200ul,埋入后缝合待痊愈,约3天后开始测量血压持续测量约4周。高盐组血压稳定在120mmhg,l-name和ang-2组血压稳定在130mmhg左右,持续一周左右,血压不再上升即可认为建模成功。
原代分离高血压模型老鼠的肠系膜内皮细胞,置于细胞恒温培养箱培养,加入jnc-440(10μm),与细胞共培养96小时。根据实施例2所述的免疫染色方法进行染色,然后通过激光共聚焦显微镜的fretab模式检测突变前后两种蛋白的耦联情况。
实验结果:如图4所示,化合物作用于三种不同的的高血压小鼠模型的内皮细胞后,trpv4和kca2.3蛋白的空间耦联度发生了明显的提高。表明此化合物能增强离子通道复合体trpv4-kca2.3的空间耦联度。
实施例5:实施例1所制备的化合物对三种高血压模型小鼠的影响
实验方法:根据实施例4所述的方法构建3种高血压老鼠模型。建模成功后,通过尾静脉注射jnc-440(1mg/kg),后对小鼠血压进行测量观察。
实验结果:如图5所示,化合物作用于三种不同的的高血压小鼠模型后,其血压发生了明显下降,说明该化合物对该高血压模型有明显的降压作用。
- 还没有人留言评论。精彩留言会获得点赞!