一种具有蜡酯合成活性和甘油三酯合成活性的双功能酶及其编码基因和应用的制作方法
本发明涉及生物技术领域,具体而言,涉及一种具有蜡酯合成活性和甘油三酯合成活性的双功能酶及其编码基因与应用。
背景技术:
甘油三酯(triacylglyceride、tag)与蜡酯(waxester、we)是一类中性油脂,分别由脂肪醇,二酰基甘油与长链脂肪酸酯化作用形成。蜡酯的组成部分碳链长度一般为中长链或长链,例如c16,c18,c20或者更长的碳链。
蜡酯在自然界的来源广泛,种类繁多。并以其良好的性能广泛应用于各个领域,例如在在食品营养方面,工业,化妆品业以及制药行业都有着很重要的应用价值。
在植物,动物,微生物体等体内蜡酯广泛存在,并且在生物体内以及生物活动中有着重要功能。首先蜡酯以储存能量的形式存在于许多微生物以及原核生物体内。在植物,一些昆虫的体内的蜡酯能保护植物防止其水分挥发导致的干旱,过强的紫外线照射造成的伤害以及病原微生物入侵。植物表面的角质层的蜡酯成分,含量也因环境的变化而发生变化。在抹香鲸体内提取的鲸油也存在着蜡酯和甘油三酯等中性油脂,鲸通过改变其中蜡酯以及甘油三酯的混合物的密度的变化从而有效改变其在水中的浮力;蜡酯在鲸鱼的声音传递过程中也起到重要作用。抹香鲸可以加热或者冷却头部鼻腔中的蜡酯来调节浮力。一般生活在两极的深海中的海生生物体内蜡酯含量最为丰富,如鲑鱼,珊瑚虫等。很多海洋浮游动物能够利用海洋浮游植物为食,合成蜡酯。
蜡酯通常以固态以及液态两种形态存在,昆虫中的动物蜡,如白蜡虫分泌坚硬的白色动物蜡以及蜂蜡都是以长碳链的饱和的脂肪酸与脂肪醇形成的多为固态蜡酯。而碳链长度低,饱和度高的碳链形成的蜡酯则是液态,流动性较好。
液体蜡酯是一种经济油脂,在工业中也有着重要应用价值,例如食品行业,化妆品,医药以及化工产品,例如润滑油多以蜡酯为原料,一般来自于石油的蜡脂多为饱和的长链单酯这使得其在低温下流动性差,不饱和长链单酯的流动性较好,热稳定性与氧化稳定性也高于长链饱和蜡酯。但由于天然蜡酯产物主要来自于动植物及矿石,其中作为不饱和蜡酯的主要来源就是加州西蒙德木种子,主要由多为长碳链的c20,c22,c24等多不饱和脂肪酸与脂肪醇形成。鲸鱼体内提取蜡酯也是获得液体蜡酯的一种传统方式,但自然资源十分有限,工业等需求量巨大,使其应用受到了很大的限制,而液体蜡酯也被称为液体黄金。目前,使用化学法合成蜡酯的成本十分高昂。
在当今面临着能源匮乏,石化资源枯竭,环境恶化等问题与挑战。因此开发新型来源,可再生的生物能源具有重要意义。微生物生产功能油脂是生物柴油开发的重要组成,利用微生物生产蜡酯具有众多优势,例如:生产周期短,发酵原料丰富等。利用分子生物学技术对微生物在蜡酯合成的方面作出有针对性的改良,产生新型,高产,可再生的蜡酯满足工业需求是十分必要的。
技术实现要素:
本发明的目的在于提供一种具有蜡酯合成活性和甘油三酯合成活性的双功能酶,该双功能酶来海洋原生生物破囊壶菌(thraustochytriumroseum),在底物存在的条件下,能够催化底物合成蜡酯和/或甘油三酯。
本发明的另一目的在于提供编码上述双功能酶的基因。
本发明的另一目的在于提供含有上述基因的载体。
本发明的另一目的在于提供含有上述载体的重组细胞。
本发明的另一目的在于提供上述基因在生产蜡酯和/或甘油三酯中的应用。
本发明的另一目的在于提供上述双功能酶或上述基因在生产蜡酯和/或甘油三酯中的应用。
本发明是这样实现的:
一种具有蜡酯合成活性和甘油三酯合成活性的双功能酶,所述双功能酶来自破囊壶菌(thraustochytriumroseum),其氨基酸序列如seqidno:1或seqidno:3所示。
编码上述双功能酶的基因。
含有上述基因的载体。
含有上述载体的重组细胞。
上述基因在生产蜡酯和/或甘油三酯中的应用。
上述双功能酶在生产蜡酯和/或甘油三酯中的应用。
一种生产蜡酯和/或甘油三酯的方法,其特征在于,用上述双功能酶催化底物。
与现有技术相比,本发明的有益效果是:
本发明提供的具有蜡酯合成活性和甘油三酯合成活性的双功能酶,来自海洋原生生物破囊壶菌(thraustochytriumroseum),其氨基酸序列如seqidno:1或seqidno:3所示。本发明的研究显示seqidno:1所示的双功能酶(trwsd4)和seqidno:3所示的双功能酶(trwsd5)均是一种新的兼具蜡酯合成酶和甘油三酯合成酶活性的酶,二者均能合成蜡酯和和/或甘油三酯,其为蜡酯合成酶类的基础研究提供了新的思路。此外,本发明提供的相应的编码基因能够在宿主细胞进行表达,表达出双功能酶,转化该编码基因的宿主能够重新合成蜡酯,为后期进行基因工程改造以及工业应用生产蜡酯和/或甘油三酯奠定了基础和提供了新的手段和思路。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
图1为本发明实施例1提供的pet-23(b+)::trwsd4载体转化大肠杆菌rossettade3中的菌落pcr检测结果;
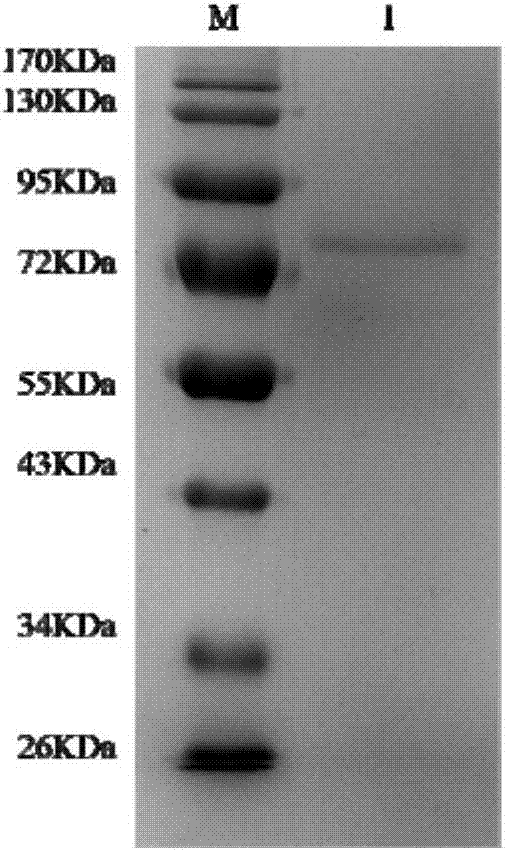
图2为本发明实施例2提供的trwsd4酶溶液的sds-page分析图;
图3为本发明实施例3提供的trwsd4酶对于不同碳链长度的脂肪酰基辅酶a的米氏方程曲线图;
图4为本发明实施例4提供的温度和盐浓度对trwsd4酶活力的影响结果;
图5为本发明实施例4提供的trwsd4酶的ws活性与dgat活性比较结果;
图6为本发明实施例1提供的pmbpc::trwsd5载体转化大肠杆菌中的菌落pcr检测结果和实施例5提供的trwsd5酶溶液的sds-page分析结果;
图7为本发明实施例6提供的trwsd5酶对于不同碳链长度的脂肪酰基辅酶a的米氏方程曲线图;
图8为本发明实施例7提供的温度和盐浓度对trwsd5酶活力的影响结果;
图9为本发明实施例7提供的trwsd5酶的ws活性与dgat活性比较结果;
图10为本发明实施例7提供的转化trwsd4基因和trwsd5基因的酵母总油脂的薄层层析结果;
图11为本发明实施例1提供的pet-23(b+)::trwsd4载体的结构示意图;
图12为本发明实施例1提供的pmbpc::trwsd5载体的结构示意图;
图13为本发明实施例8提供的pesc-ura::trwsd4载体的结构示意图;
图14为本发明实施例8提供的pesc-ura::trwsd5载体的结构示意图;
图15为本发明实施例8提供的trwsd4酵母转化子产生的蜡酯的gc-ms分析结果图;
图16为本发明实施例8提供的trwsd5酵母转化子产生的蜡酯的gc-ms分析结果图。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
下面对本发明实施例的一种具有蜡酯合成活性和甘油三酯合成活性的双功能酶及其编码基因和应用进行具体说明。
蜡酯合成酶以及脂酰辅酶a:二酰基甘油酰基转移酶ws/dgat首次是在贝氏不动杆菌中发现。蜡酯合成酶以及脂酰辅酶a:二酰基甘油酰基转移酶ws/dgat能够催化蜡酯以及甘油三酯形成的终反应,蜡酯合成酶以及脂酰辅酶a:二酰基转移酶分别以长链脂肪酸以及长链脂肪醇或者二酰基甘油为底物,通过转酯反应生成蜡酯以及甘油三酯。
真核生物与原核生物的油脂甘油三酯(tag)以及蜡酯(waxesters,we)生物合成过程不同。这些油脂在微生物体内的主要功能是能量存储以及作为碳源,当细胞内的游离脂肪酸含量较高时,合成油脂,例如利用产生蜡酯这种无毒的物质来存储能量能够利用游离脂肪酸,从而减少其对于细胞膜的破坏作用。
破囊壶菌(thraustochytriumroseum)是一种海洋类原生生物,异养,常分布于海洋,红树林根部。属于不等毛门,网黏菌纲,破囊壶菌目,破囊壶菌科。破囊壶菌的含油量尤为丰富,其自身的含油量占细胞干重的比例的50%,而在破囊壶菌中主要富含两种脂肪酸,长链多不饱和脂肪酸dha(c22:6)与棕榈酸(c16:0),其中dha占到了总脂肪酸含量的60%以上。而这些脂肪酸大多是以甘油三酯tag的形式存在。dha具有较高的商业利用价值,在保健品的开发利用方面有着巨大的潜力。因此,破囊壶菌相对于其他dha来源,具有较多的优势,比如生长速度快,dha含量较高易于得到纯品等。
本发明的发明人在长期的研究过程中,以油脂含量丰富的海洋原生生物来自于破囊壶菌科的菌株基因组为模板,测得全基因序列,分析预测其基因组可能存在ws/dgat双功能酶的基因,预测具有蜡酯合成以及甘油三酯合成的双功能酶。通过创造性劳动,本发明的发明人惊奇地发现,该菌存在蜡酯合成酶/脂酰辅酶a:二脂酰甘油酰基转移酶(ws/dgats,也就是具有蜡酯合成活性和甘油三酯合成活性的双功能酶)的基因有两个,在现有文献并未有见相关报道,将其分别命名trwsd4基因(编码trwsd4酶)和trwsd5基因(编码trwsd5酶)。并通过实验,验证了上述的trwsd4酶和trwsd5酶的蜡酯合成活性和甘油三酯合成活性的双功能。
基于此,一方面,本发明提供了一种具有蜡酯合成活性和甘油三酯合成活性的双功能酶,上述双功能酶来自破囊壶菌(thraustochytriumroseum),其氨基酸序列如seqidno:1或seqidno:3所示。trwsd4酶的氨基酸序列如seqidno:1所示,trwsd5酶的氨基酸序列如seqidno:3所示。
基于此,另一方面,本发明提供了编码上述双功能酶的基因。
根据密码子的简并性,在氨基酸序列清楚的情况下,相应的编码上述双功能酶的基因序列可有多种情况,其均属于本发明的保护范围。
可选地,本发明的一些实施方案中,上述基因的核苷酸序列如seqidno:2、seqidno:4、seqidno:5或seqidno:6所示。用于编码trwsd4酶的trwsd4基因的核苷酸序列如seqidno:2所示;用于编码trwsd5酶的trwsd5基因的核苷酸序列如seqidno:4、seqidno:5或seqidno:6所示;其中,seqidno:5是在seqidno:4的基础上优化后的适于在大肠杆菌中表达的编码序列,seqidno:6是在seqidno:4的基础上优化后的适于在酵母细胞中表达的编码序列。
另一方面,本发明提供了含有上述基因的载体。
可选地,本发明的一些实施方案中,上述载体为pmbpc载体、pmd-19t-simple载体、pet-23(b+)表达载体以及pesc-ura表达载体中的一种。
另一方面,本发明提供了含有上述载体的重组细胞。
可选地,本发明的一些实施方案中,上述重组细胞为酵母菌或大肠杆菌。
另一方面,本发明提供了一种制备上述双功能酶的方法,其包括:培养上述重组细胞。
另一方面,本发明提供了上述基因在生产蜡酯和/或甘油三酯中的应用。
例如,将trwsd4和trwsd5两个基因分别构建到用于酿酒酵母的表达载体pesc-ura上,并将表达载体分别通过电击转化到酿酒酵母saccharomvcescerevisiae-h1246中,h1246是一株甘油三酯以及蜡酯合成的缺陷型酵母。经培养、诱导表达后,提取酵母胞内油脂,并且通过薄层层析tlc分析发现缺该陷型酵母产生了蜡酯。说明trwsd4与trwsd5两个基因都能够合成蜡酯,发挥功能,为后续有效利用微生物产生蜡酯奠定了基础。
此外,在本发明实施例中,将这两个基因trwsd4与trwsd5分别在大肠杆菌中进行异源表达,并且通过层析纯化后得到相应目的蛋白(trwsd4酶和trwsd5酶),在体外测定两种蛋白的酶活性,结果显示这两种蛋白都表现出了较高的蜡酯合成酶活性和较低的二酰基甘油酰基转移酶活性(即甘油三酯合成酶活性)。
另一方面,本发明提供了上述基因在具有蜡酯合成活性和甘油三酯合成活性的双功能酶中的应用。
另一方面,本发明提供了上述双功能酶在生产蜡酯和/或甘油三酯中的应用。
可选地,本发明的一些实施方案中,用上述双功能酶接触底物。
可选地,本发明的一些实施方案中,上述底物包括碳链长度为8-20的偶数碳链酰基coa,例如c8:0-coa,c10:0-coa,c12:0-coa,c14:0-coa,c16:0-coa,c18:0-coa。
可选地,本发明的一些实施方案中,上述底物为碳链长度为10的饱和酰基coa(c10:0-coa)或者为碳链长度为12的饱和酰基coa(c12:0-coa)。
体外活性实验显示:本发明提供的trwsd4酶和trwsd5酶可以催化不同碳链长度的酰基coa和脂肪醇例如棕榈醇底物形成蜡酯和/或甘油三酯。
trwsd4对于碳链长度为12的饱和酰基coa(c12:0-coa)的km值最低,并且酶催化效率参数kcat/km值最大,trwsd4对于中长链饱和酰基coa均表现出较高的底物亲和性。
trwsd4的最适反应盐浓度测试结果显示:以37℃,0mmnacl时测得的酶反应初速率为100%,在nacl浓度为400mm时,其相对酶活力接近100%,当盐浓度范围超过400mm时,相对酶活力逐渐降低,当盐浓度为1600mm时,相对酶活力降低至30%左右,当反应体系中的nacl浓度过高时,会对该酶活力影响较大。trwsd4酶的最适盐浓度为0-400mm。
trwsd4的最适反应温度测试结果显示:以37℃测得的酶反应初速率为100%,在温度范围为7℃~47℃时,相对酶活力随着温度的增加而增加;在47℃时,相对酶活力达到最高;当温度大于47℃时,为57℃时,酶活力降低,相对酶活力可仅为50%多左右;trwsd4的最适温度为47℃。
trwsd5对于碳链长度为10的饱和酰基coa(c10:0-coa)的km值最低,并且酶催化效率参数kcat/km值最大,表明trwsd5对于c10:0-coa表现出最强的底物亲和性。
trwsd5的最适反应盐浓度测试结果显示:以0mmnacl酶活力为100%,在nacl浓度为400mm时,其相对酶活力高于100%,当盐浓度范围400mm-1200mm时,相对酶活力逐渐增加,当盐浓度为1600mm时,相对酶活力降低至60%左右。当反应体系中的nacl浓度范围为400mm至1200mm时,促进了trwsd5的催化反应,利于酶催化反应进行。在反应体系中nacl的浓度为800mm时,相对酶活力最高,800mm的nacl浓度为trwsd5的最适盐浓度。
trwsd5的最适反应温度测试结果显示:以设置37℃的反应条件下的反应速率为100%,其他条件下测得的酶活力以相对酶活力来表示;在温度范围为7℃~47℃时,相对酶活力随着温度的增加而增加。当反应温度在37℃,相对酶活力达到最大,47℃时,相对酶活力为98%左右,相对酶活力并未发生较大的变化。当反应温度为57℃时酶活力降低,相对酶活力可达到50%多左右,trwsd5的最适温度为37℃。
以下结合实施例对本发明的特征和性能作进一步的详细描述。
实施例1
trwsd4基因和trwsd5基因的克隆
1.1trwsd4基因的克隆
1.1.1提取破囊壶菌(thraustochytriumroseum,atcc28210)的rna,经rt-pcr得到cdna模板。
1.1.2以trwsd4-for与trwsd4-rev为引物(序列见表1),以得到的cdna为模板,用高保真酶(phusionhigh-fidelitydnapolymerase;thermo)进行pcr,50μlpcr反应体系:5×hfbuffer10μl,dntp(10mm)1μl,trwsd4pet-23b-for(10mm)1μl,trwsd4pet-23b-rev(10mm)1μl,phusiondnapolymerase1μl,cdna2μl,ddh2o补齐至50μl。
反应程序设定参照phusionhigh-fidelitydnapolymerase进行,如下:98℃30s,98℃10s、55℃30s、72℃30s、30个循环,72℃10min。
表1
1.1.3取pcr扩增产物3μl,进行琼脂糖凝胶电泳检测条带是否正确目的片段(trwsd4基因),trwsd4基因的核苷酸序列如seqidno:2,长度为1611bp,其编码出的trwsd4酶的氨基酸序列如seqidno:1所示,分子量为64.3kda。待检测正确后,使用dna纯化回收试剂盒回收pcr产物,得到含目的片段的胶回收液。具体操作参照琼脂糖凝胶回收试剂盒说明书进行。
1.1.4将得到的目的片段连接到pmd-19t-simple克隆载体上
(1)将目的片段与datp连接,50μl反应体系:胶回收液35μl,10×taqbuffer5μl,10mmdatp2μl,mgcl24μl,taq酶0.5μl,ddh2o3.5μl;pcr反应条件:72℃,20min;12℃,5min。
(2)反应结束后,进行连接反应,连接体系:10×buffer1μl,t4-dna连接酶0.5μl,pmd-19t-simple0.5μl,插入片段(即步骤(1)的连接产物)6μl,ddh2o2μl;反应条件:22℃-25℃,反应30min~60min,得到连接产物,含有trwsd4基因的克隆载体,命名为pmd-19t-simple::trwsd4。
1.1.5将连接产物转化大肠杆菌trans5α感受细胞,在lb培养基(含有氨苄抗生素)上挑选转化子,经菌落pcr验证后,挑取阳性转化子,送武汉擎科创新生物有限公司进行测序。
1.1.6参照康为世纪有限公司质粒小提试剂盒的说明,对测序正确的转化子,提质粒(即trwsd4-pmd-19t-simple),然后进行双酶切(bamhi+xholi),酶切后的产物进行琼脂糖凝胶电泳检测,回收trwsd4基因片段,将其连接至经同样双酶切后的pet-23(b+)表达载体上。得到含trwsd4基因片段的表达载体,命名为pet-23(b+)::trwsd4,如图11所示。
1.1.7将连接产物pet-23(b+)::trwsd4转化大肠杆菌trans5α感受细胞,在lb培养基上培养,然后挑选转化子,进行菌落pcr验证,结果如图1所示(图中:m为dl5000dnamarker;1、2、3、4为菌落pcr产物)。从图1可看出,1、2、3、4泳道上在1600bp位置有条带,说明1、2、3、4为阳性的trwsd4重组菌株。
1.1.8挑取相应的阳性转化子,摇菌培养后送武汉擎科创新生物有限公司进行测序。
1.2trwsd5基因的克隆
1.2.1以trwsd5原始基因序列(seqidno:4所示)为基础,对基因序列进行了易于大肠杆菌为宿主表达的密码子优化,并化学合成优化后的trwsd5基因(seqidno:5所示,其编码seqidno:3所示的trwsd5酶),将其构建至puc-57载体上,得到质粒载体puc-57::trwsd5。trwsd5原始基因的核苷酸序列如seqidno:4所示,长度为1488bp,其编码出的trwsd5酶的氨基酸序列如seqidno:3所示,分子量为99kda。
1.2.2以trwsd5-pmbpc-for与trwsd5-pmbpc-rev为引物(序列见表1),以puc-57::trwsd5为模板,采用高保真酶(phusionhigh-fidelitydnapolymerase;thermo),对trwsd5基因进行pcr扩增。50μl反应体系:5×hfbuffer10μl,dntp(10mm)1μl,trwsd5-pmbpc-for(10mm)1μl,trwsd5-pmbpc-rev(10mm)1μl,phusiondnapolymerase1μl,puc-57::trwsd52μl,ddh2o补齐至50μl。反应程序设定参照phusionhigh-fidelitydnapolymerase进行,如下所示:98℃30s,98℃10s、55℃30s、72℃30s、30个循环,72℃10min。
1.2.3取pcr扩增产物3μl,进行琼脂糖凝胶电泳检测条带是否正确。待检测正确后,使用dna纯化回收试剂盒回收pcr产物。具体操作参照琼脂糖凝胶回收试剂盒说明书进行。
1.2.4将回收得到的trwsd5基因片段,用限制性内切酶bamhi与ecori进行酶切;将其连接至经同样双酶切后的pmbpc载体,得到连接产物(含trwsd5基因片段的表达载体,命名为pmbpc::trwsd5,如图12所示)。
1.2.5将连接产物pmbpc::trwsd5转化大肠杆菌感受细胞,在lb培养基上培养,然后挑选转化子,进行菌落pcr验证,用引物trwsd5-for和trwsd5-rev(序列见表1)进行菌落pcr反应。结果如图6中的a所示(图6的a显示了pmbpc::trwsd5载体转化大肠杆菌中的菌落pcr检测结果,图6的a中:m为trans2kplusiidnamarker;1、2、3为trwsd5重组菌株的pcr检测)。
1.2.6挑取相应的阳性转化子,摇菌培养后送武汉擎科创新生物有限公司进行测序。
实施例2
trwsd4酶和trwsd5酶的表达和纯化
2.1trwsd4酶的表达和纯化
2.1.1将重组表达载体pet-23(b+)::trwsd4转化大肠杆菌rosettade3,转化方法参照transettade3感受态细胞的说明书进行。得到含pet-23(b+)::trwsd4载体的大肠杆菌(trwsd4阳性表达菌株),将其接种于lb液体培养基(含amp)中,37℃培养过夜,以1%的接种量转接入100ml的lb+amp中进行扩大培养,至其菌体浓度生长至od600值0.6时,加入1mmiptg诱导trwsd4酶表达(trwsd4蛋白的c端表达有his-tag标签,his-tag标签的作用在与ni柱中的ni2+结合有利于后续纯化)。再置于28℃,120rpm条件下诱导培养6h。
2.1.2在4000rpm、4℃条件下,离心收集菌体,-80℃存储。
2.1.3在冰上解冻菌体,并用预冷的25mm的缓冲液溶解菌体,用超声波细胞破碎仪对菌体破碎处理,并使细胞处于冰浴的状态,以超声2s,停3s的方式,至菌体溶液澄清,透亮。
2.1.4将破碎细胞于高速12000rpm离心15min后,用0.45μm的滤膜对离心后的液体进行过滤,并添加与bindingbuffer(ph7.4,25mmtris-hcl,500mmnacl,30mm咪唑)中相同的咪唑浓度,转移溶液到离心管中,使其置于冰浴状态。
2.1.5取一定量去离子水,经过超声后去除其中气泡。将histrapff与紫外检测器(hd-3000型,上海嘉鹏公司)蠕动泵相连接,并调节紫外检测器至280nm处。用去气泡后的水润洗管道,并低流速连接histrapff,以避免空气进入柱体当中,后续调节流速至1ml/min。在去离子水润洗柱子5个体积后。关闭泵阀,将进液管换至bindingbuffer,同样以1ml/min洗脱5个体积。此时,调节吸光值a为0。
2.1.6将样品置于冰浴环境中,准备上样。将流速调节至0.5ml/min,随着上样量增大,观察检测器吸光值是否逐渐增大至一定值后,保持不变。直至上样结束,吸光值保持在某个特定值处。更换bindingbuffer,洗脱柱子,使吸光值降低至0左右。此时,更换elutionbuffer(ph7.4,25mmtris-hcl,500mmnacl,500mm咪唑)洗脱,并观察吸光值出峰处,用离心管收集,每管收集0.5ml-1ml。待吸光值将至不变值后,再用elutionbuffer洗脱5ml左右。最后用去离子水冲洗柱子,得到trwsd4酶溶液。
2.1.7对所收集的trwsd4酶溶液用12%sds-page检测,结果如图2所示(图中:m为蛋白质marker;1为纯化的trwsd4酶溶液)。
trwsd4酶分子量预测值约为77kda,从图2可看出,在75kda左右位置有条带,与预测值接近,且条带较为单一。
实施例3
3.1trwsd4酶对9种不同碳链长度的脂肪酰基辅酶a酶动力学参数测定以及底物偏好性分析
酶活力测定原理:ws/dgat属于转移酶,对酯键上的羟基进行亲核攻击,以便将脂肪酰转移,该酶能将脂肪醇中的羟基去质子,以便于催化乙酰基团转移。释放的游离coa与dtnb(5,5’-二硫代双(2-硝基苯甲酸))反应生成ntb2-,该离子为黄色,在412nm存在吸光值,依据其od值随反应时间变化,测得相应酶学数据。
trwsd4酶(或trwsd5酶)的酶活力测定反应体系包括:磷酸缓冲液,dtnb,棕榈醇(c16alcohol),脂肪酰基辅酶a(c8:0-coa,c10:0-coa,c12:0-coa,c14:0-coa,c16:0-coa,c18:0-coa,c18:3-coa,c20:5-coa以及c20:4-coa中的一种),酶溶液(含trwsd4酶或trwsd5酶)。
在酶标板的反应孔中,依次加入15μl1mg/mldtnb(溶于dmso),5μl1mg/ml棕榈醇(溶于dmso),用枪头吸打混合均匀,再加入相应体积的1mg/ml的脂肪酰基辅酶a(每种脂肪酰基辅酶a均设置终浓度为15μm,30μm,45μm,60μm,75μm,90μm的检测体系,脂肪酰基辅酶a的加入体积根据终浓度确定),加入10μg浓度为200μg/ml的trwsd4酶溶液(实施例2得到的),加入20mm的磷酸缓冲液补齐至200μl的酶活力测定反应体系;混合均匀,避免产生气泡,放入酶标仪(spectramaxm2e,购自moleculardevices)中。在37℃条件下,412nm处测定连续吸光值。并根据ntb2-的摩尔吸光系数14150m-1·cm-1,计算释放游离辅酶a含量,以此计算每个反应的初始反应速率vo(单位:nmol/minpermg,每毫克蛋白每分钟产生多少纳摩尔的游离辅酶a)。根据得到的vo与底物浓度[s]按照米氏方程,计算每种底物的km,vmax,kcat等值,结果如表2和图3所示(图中:a为c8:0-coa和c10:0-coa的米氏方程曲线,b为c12:0-coa和c14:0-coa的米氏方程曲线,c为c16:0-coa和c18:0-coa的米氏方程曲线,d为c18:3-coa、c20:4-coa和c20:5-coa的米氏方程曲线)。
表2
从表2中可以看出,trwsd4酶对于c12:0-coa的km值(0.14)最小,kcat/km值最大(1.46×105),kcat/km值可以比较同一种酶催化不同底物的催化效率。从表2中根据相关酶动力学参数比较,综合kcat/km与km值可以看出,trwsd4酶对短链到中长度的碳链的脂肪酰基辅酶a如(c8-coa,c10:0-coa,c14:0-coa,c16:0-coa,c18:0-coa)的底物具有较高的亲和性,对较长链的多不饱和酯酰辅酶a如c18:3-coa,c20:4-coa和c20:5-coa,亲和性都较差。
实施例4
trwsd4酶的酶学性质检测
4.1trwsd4酶的最适温度测定
设置每个反应体系中不同的温度梯度为7℃,17℃,27℃,37℃,47℃,57℃,其中以c10:0-coa,棕榈醇为固定底物。将整个反应体系置于不同的温度条件下温浴,在412nm处测定吸光值,以37℃测得的酶反应初速率为100%,其他的温度条件下测定的酶反应速率以相对酶活力(relativeenzymeactivity)表示。
结果如图4中的a所示(图4的a显示了温度对trwsd4酶活力的影响结果,图4的b中:横坐标代表温度,纵坐标代表相对酶活力,单位为%),在温度范围为7℃~47℃时,相对酶活力随着温度的增加而增加,在47℃时,相对酶活力达到最高,当温度为57℃时酶活力降低,相对酶活力为50%左右,由此可见,trwsd4酶的最适温度为47℃。
4.2trwsd4酶最适盐浓度测定
设置每个反应体系中不同的nacl浓度梯度为0mm,400mm,800mm,1200mm,1600mm,其中以c10:0-coa和棕榈醇为固定底物。将整个反应体系置于不同的盐终浓度下,在412nm处测定吸光值,以37℃,0mmnacl时测得的酶反应初速率为100%,其他的盐浓度条件下测定的酶反应速率以相对酶反应速率表示。
结果如图4中的b所示(图4的b显示盐浓度对trwsd4酶活力的影响结果,图4的b中:横坐标代表不同的盐浓度,纵坐标代表相对酶活力,单位为%),在nacl浓度为400mm时,其相对酶活力接近100%,当盐浓度范围超过400mm时,相对酶活力逐渐降低,当盐浓度为1600mm时,相对酶活力降低至30%左右,由此可见,当反应体系中的nacl浓度过高时,会对该酶活力影响较大,trwsd4酶的最适盐浓度为0-400mm。
4.3trwsd4酶对于蜡酯合成酶(ws)活性与脂酰辅酶a:二酰基甘油酰基转移酶(dgat)活性比较
反应体系设置同上述,测定dgat的活性时,用dag(1-棕榈酸-3-油酸甘油二酯),购自larodan公司)以及c10:0-coa为底物,测定ws活性则以c10:0-coa与棕榈醇为底物。在412nm处测定吸光值,以37℃测得的酶反应速率。其中以测得的ws活性为100%,其中dgat活性以相对酶活力表示。
结果如图5所示,dgat的酶活性仅为ws活性的50%,trwsd4具有较高的蜡酯合成酶活性。通过trwsd4对于dag的活性测定,表明本发明提供的trwsd4酶是具有蜡酯合成酶以及酰基转移酶的双功能酶,其具有合成蜡酯和甘油三酯功能。
实施例5
trwsd5酶的表达和纯化
将构建成功的载体pmbpc::trwsd5转入大肠杆菌中异源表达,在菌体od600值为0.6时,加入0.8mmiptg诱导trwsd5酶表达。trwsd5酶的纯化方法可参考上述的trwsd4酶的纯化步骤。用12%sds-page电泳检测目的蛋白trwsd5酶,结果如图6中的b所示(图6中的b显示了trwsd5酶溶液的sds-page分析图,图6的b中:m为蛋白质marker;1为纯化的trwsd5酶条带)。
trwsd5酶分子量预测值约为99kda,从图6的b中可看出,在99kda左右位置有条带,与预测值接近。
实施例6
参考实施例3的方法,检测trwsd5酶对9种不同碳链长度的脂肪酰基辅酶a酶动力学参数测定以及底物偏好性分析,结果如表3和图7所示(图7中:a为c8:0-coa和c10:0-coa的米氏方程曲线,b为c12:0-coa、c14:0-coa和c16:0-coa的米氏方程曲线,c为c18:0-coa的米氏方程曲线,d为c18:3-coa的米氏方程曲线,e为c20:4-coa和c20:5-coa的米氏方程曲线)。
表3
从表3中可以看出,trwsd5酶对于c10:0-coa的km值最小(0.96),kcat/km值最大(9.83×104),kcat/km值可以比较同一种酶催化不同底物的催化效率。此外,从表3中根据相关酶动力学参数比较可以看出,trwsd5酶对短链以及中长碳链的脂肪酰基辅酶a如c8:0-coa,c10:0-coa,c14:0-coa,c16:0-coa,c18:0-coa的底物具有较高的亲和性,而对于较长的多不饱和碳链c18:3-coa,c20:5-coa,c20:4-coa亲和性都较差。但对于长链多不饱和碳链c20:5-coa的亲和性则高于c18:3-coa,c20:4-coa。
实施例7
trwsd5酶的酶学性质检测
7.1trwsd5酶的最适温度测定
设置每个反应体系中不同的温度梯度为7℃,17℃,27℃,37℃,47℃,57℃,其中以c10:0-coa,棕榈醇为固定底物。将整个反应体系置于不同的温度条件下温浴,在412nm处测定吸光值,以37℃测得的酶反应初速率为100%,其他的温度条件下测定的酶反应速率以相对酶反应速率表示。结果图8中的a所示(图8中的a显示温度对trwsd5酶活力的影响结果,图8中的b显示了盐浓度对trwsd5酶活力的影响结果)。
从图8的a中可看出,在温度范围为7℃~47℃时,相对酶活力随着温度的增加而增加。当反应温度在37℃,相对酶活力达到最大,47℃时,相对酶活力为98%左右,相对酶活力并未发生较大的变化。当反应温度为57℃时酶活力降低,相对酶活力可达到50%多左右,由此可见该酶的最适温度为37℃。
7.2trwsd5酶最适盐浓度测定
设置每个反应体系中不同的nacl浓度梯度为0mm,400mm,800mm,1200mm,1600mm,其中以c10:0-coa,棕榈醇为固定底物。将整个反应体系置于不同的温度条件下温浴,在412nm处测定吸光值,以37℃,0mmnacl时测得的酶反应初速率设定为100%,其他的盐浓度条件下下测定的酶反应速率以相对酶反应速率表示。结果如图8中的b所示。
从图8的b中可看出,当反应体系中的nacl浓度范围为400mm至1200mm时,促进了trwsd5的催化反应,利于酶催化反应进行。由在反应体系中nacl的浓度为800mm时,相对酶活力最高,因此,800mm的nacl浓度为trwsd5的最适盐浓度。
7.3trwsd5酶对于蜡酯合成酶活性与二酰甘油酰基转移酶活性比较
反应体系设置同上述,测定dgat的活性时,用dag以及c10:0-coa为底物,测定ws活性则以c10:0-coa与棕榈醇为底物。在412nm处测定吸光值,以37℃测得的酶反应速率。其中以测得的ws活性为100%,其中dgat活性以相对酶活力表示。结果如图9所示。
从图9看出,trwsd5酶的dgat酶活性仅为ws活性的25%,表明trwsd5以蜡酯合成酶活性较高。通过trwsd5对于dag的活性测定,表明了trwsd5是具有蜡酯合成酶以及酰基转移酶双功能的酶。
实施例8
trwsd4基因与trwsd5基因在酿酒酵母突变株中的表达
8.1将trwsd4基因(seqidno:2)和在seqidno:4的基础上密码子优化后的trwsd5基因(seqidno:6所示,该序列适于在酵母中表达,其编码的trwsd5酶的氨基酸序列如seqidno:3所示)分别连接至pesc-ura载体上,得到重组载体pesc-ura::trwsd4(如图13所示)和pesc-ura::trwsd5(如图14所示),具体构建方法可参考实施例1。
8.2将pesc-ura::trwsd4和pesc-ura::trwsd5分别转化酿酒酵母saccharomvcescerevisiae-h1246(一株甘油三酯以及蜡酯合成的缺陷型酵母,酿酒酵母缺陷株-h1246无法合成甘油三酯,甾醇酯以及蜡酯,是被广泛用于验证具有dgat功能的基因的表达宿主),挑取阳性转化子,接入sc-ura培养基(缺尿嘧啶)进行扩大培养后,以乳糖为碳源诱导gal1启动子转录起始,并添加wsd酶的两种底物棕榈醇以及棕榈酸,添加量均为0.1%(w/v)。培养结束后,收集菌体,提取酵母细胞总油脂,通过薄层层析的方法检测是否有蜡酯产生。以转化空载体作为阴性对照,以蜡酯标准品为阳性对照,结果图10所示(图中:a为转化pesc-ura::trwsd4载体的酵母细胞总油脂的薄层层析结果,1、2、3为pesc-ura空载体对照,4、5、6为转入pesc-ura::trwsd4的酵母总油脂,7为蜡酯标准品(waxesters),8为甘油三酯标准品(tag);b为转化pesc-ura::trwsd5载体的酵母细胞总油脂的薄层层析结果,1、2、3为pesc-ura空载体对照,4、5、6为转入pesc-ura::trwsd5的酵母总油脂,7为蜡酯标准品,8为甘油三酯标准品)。
从图10中可看出,与转化空载体的酵母阴性对照相比,转入trwsd4基因的酵母和转入trwsd5基因的酵母均有蜡酯的合成。说明了在酿酒酵母缺陷株h1246中转入trwsd4与trwsd5两个基因后,在添加酵母细胞中外源脂肪醇时,酵母细胞能够在酵母胞内合成蜡酯。
8.3gc-ms分析酵母转化子产生的蜡酯
将转入pesc-ura::trwsd4,pesc-ura::trwsd5的阳性转化子挑取接入sc-ura培养基扩大培养后,再进行诱导培养,同时添加棕榈酸,棕榈醇为底物。通过薄层层析tlc的方法分离纯化蜡酯,将薄层层析板上产生蜡酯条带的位置,用小刀刮下,装入白盖瓶,用3ml的氯仿洗脱两次。在氮气下吹干氯仿,最后用10μl氯仿复溶得到的得到纯品蜡酯。用安捷伦气象色谱以及质谱联用仪gc7890a-5795c,测定每种蜡酯混合物中的蜡酯成分。质谱条件如下:色谱柱应用hp-5石英毛细管柱(0.25mm×30m;膜层厚,250nm;aglienttechnologies,unitedstates);1μl进样,不分流;以氦气(恒流,1.0ml/min)为载气,进样口和检测器的温度为280℃,升温程序为在柱温40℃下恒温2min;然后,以20℃/min的速度升温至300℃,恒温15min。质谱条件为:四极杆温度150℃,离子源电子轰击温度230℃,电子能量70ev。结果如图15和图16所示。
图15显示了trwsd4酵母转化子产生的蜡酯的gc-ms分析结果(图中:a为十四烷酸十六烷醇酯,b为十六烷酸十六烷醇酯),由图15可知,以棕榈醇与棕榈酸为添加底物时,trwsd4酵母转化子产生的蜡酯成分有十四烷酸-十六烷醇酯;十六烷酸-十六烷醇酯。
图16显示了trwsd5酵母转化子产生的蜡酯的gc-ms分析结果(图中:a为十二烷酸十六烷醇酯,b为十四烷酸十六烷醇酯,c为十六烷酸十六烷醇酯),由图16可知,trwsd5酵母转化子产生的蜡酯成分有十四烷酸-十六烷醇酯;十六烷酸-十六烷醇酯;十二烷酸-十六烷醇酯。
综上,本发明提供的具有蜡酯合成活性和甘油三酯合成活性的双功能酶,来自海洋原生生物破囊壶菌,其氨基酸序列如seqidno:1或seqidno:3所示。seqidno:1所示的双功能酶和seqidno:3所示的双功能酶是一种新的兼具蜡酯合成酶和甘油三酯合成酶活性的酶,二者均能合成蜡酯和甘油三酯,其为蜡酯合成酶类的基础研究提供了新的思路。其相应的编码基因(如seqidno:2,seqidno:4-6所示)能够在宿主细胞进行表达,转化该编码基因的酶能够重新合成蜡酯,对其进行基因工程改造以及工业应用生产蜡酯和甘油三酯奠定了理论基础。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
序列表
<110>中国农业科学院油料作物研究所
<120>一种具有蜡酯合成活性和甘油三酯合成活性的双功能酶及其编码基因与应用
<160>6
<170>patentinversion3.5
<210>1
<211>537
<212>prt
<213>破囊壶菌(thraustochytriumroseum)
<400>1
metalagluasnasnasnhisleuaspglualavalvalaspgluala
151015
glnarggluglnaspvalgluvalgluglugluvalgluglugluglu
202530
glugluglugluglugluglugluglualavalvalgluaspvallys
354045
alathrleualaaspglyproalaglulysserprolysvalalapro
505560
lysglnthrlysarglysglyargargvallyshisargalaserval
65707580
thrthrargleuileglyasnleuglnargglualaglnserlysser
859095
sertrpvalvalglyleuleuphephelysseraspproglypheglu
100105110
alavalarggluthrvalglylysargleuleuglnileproargphe
115120125
argserlysleuthralaargargpheproalalysmetglupheval
130135140
gluleuaspaspaspgluileaspmetasptyrhispheargglnala
145150155160
pheglnaspargthralathrleuaspgluvalaspgluphevalgly
165170175
sermetpheaspglypheasnhisprometasplysproleutrpgln
180185190
ilethrtyrileprolysleugluaspglyargalavalleuilethr
195200205
asnileserhisilevalglyaspglyilealaglnvalgluvalleu
210215220
metargleuleuaspprovallysgluserlysglyglulysvalgln
225230235240
lysproargthrglyalaasnlyslysarglysproproalaleugly
245250255
prophethrlysalalysvalphemetglyglyvaltrpgluglyphe
260265270
pheservalileserserproasplyslysasnthrleuargleulys
275280285
aspvalasnlysproserprothrlysargcysthrphesergluthr
290295300
ileproleuasplysvallysgluleulysasnmettyrgluglyala
305310315320
thrleuasnaspvalleuvalthrleuleuthrleuthrleuargala
325330335
tyrphearggluvalglyasplysglyalaleuargasnlysvalarg
340345350
alaglnpheproileasnileargserlyssergluglyprophearg
355360365
asnaspasnproargasnlysphethrtyrglyphemetprophehis
370375380
valserglyasnargaspalaseralathrphetrpargthrlysarg
385390395400
thrleuasplysilelysserserproserprovalvalglnhisgln
405410415
valglylysvalileserasnilemetproleulysalaleuasnala
420425430
glnleuleuasnleualaalalysalathralaglnvalserasnval
435440445
proglyproglnaspalavalthrvalalaglythrgluvalaspasp
450455460
metargpheleuleutyrserproleuserphetyrvalglyleuleu
465470475480
thrtyrasnglyasnleuseralaserphecysileaspseralaleu
485490495
alaaspproargleuileserlyshistrpleuproglupheglulys
500505510
phetyralahisalalysglualaalaglygluserglyleuilearg
515520525
lysproargsercysleuaspcysleu
530535
<210>2
<211>1611
<212>dna
<213>破囊壶菌(thraustochytriumroseum)
<400>2
atggcggagaacaacaaccacttggacgaggcggttgtggacgaggcccagcgggagcaa60
gacgtcgaggtggaagaagaggtcgaagaagaagaagaagaagaggaggaggaggaggag120
gaggccgtggtcgaagatgtcaaggcaacattggcggacgggccggccgagaagagcccc180
aaggttgcaccaaagcagacgaagcgcaaagggcgaagggtcaagcaccgcgcgagcgtt240
actacgaggctgatcggcaacctgcaacgcgaagcacaatcgaagagctcgtgggtcgtg300
gggctcctctttttcaagtcggacccgggctttgaagcggtgcgcgagacggttggcaag360
cgactcctgcagatcccccgttttcggtcgaagctgacggcccggcggttcccggccaaa420
atggagtttgtcgagctcgacgacgacgagatcgacatggactaccactttcgccaggcg480
ttccaggatcgcactgcgactctcgacgaggtggacgagttcgtgggcagcatgttcgac540
gggttcaaccacccgatggacaagccgctgtggcagatcacctacattcccaagctggaa600
gacggccgggccgtgctgatcacaaacatctcccacatcgtgggtgacggcatcgcgcag660
gtggaggtcctgatgcggctcttggaccctgtcaaggaaagcaagggcgagaaggtacaa720
aagccgcggaccggcgccaacaagaagcgcaagccccccgcacttggccccttcaccaag780
gccaaggtgttcatgggcggcgtgtgggagggcttcttctccgtcatcagcagtcctgac840
aagaagaacacgctgcgcctcaaggacgtcaacaagccgagccccaccaagcggtgcacg900
ttcagcgagacgatccccctggacaaggtcaaggagctgaaaaacatgtacgagggcgcc960
acgctgaacgacgtgctcgtcacgctgctcacgctcacgctccgcgcctactttcgcgag1020
gtgggcgacaaaggggcgcttcgcaacaaggtgcgcgcgcagttcccaatcaacattcgc1080
tccaagtcggaggggcccttccgcaacgacaatccgcgcaacaaattcacgtacgggttt1140
atgccgttccacgtctcgggcaaccgcgacgcctccgccacgttttggcgcacaaagcgc1200
acgctcgacaagatcaagagcagcccctccccggtcgttcagcaccaggtcggcaaggtt1260
atctctaacatcatgccgctcaaggccctcaacgcgcagctcctcaacctcgctgccaag1320
gcgactgcccaagtctccaacgtccctggcccgcaggacgccgtcactgtggcaggcacc1380
gaggttgacgacatgcgcttccttctctactcgccgctcagtttctacgtcggcttgctc1440
acctacaacggcaacctttccgcctcgttttgcatcgacagcgcgctggcggacccgcgc1500
ctcatcagcaagcactggctccccgagttcgaaaagttttatgcgcacgccaaggaggct1560
gccggcgagagcggtctcatccgcaagccgcgctcctgcctggactgcctt1611
<210>3
<211>495
<212>prt
<213>破囊壶菌(thraustochytriumroseum)
<400>3
metglyserglylysserprolysargvallysalaaspthrpheser
151015
hisleumethisleuglyserargasppheglualaglylysleuasp
202530
alalysproilethrthrmetglytrpphetyrphealagluproval
354045
aspmetgluvalleuargasngluvalhisglulysleuvalasplys
505560
valpheargtyrargalavalproarggluarglysglytrpthrtyr
65707580
trpgluglualaglyproileaspaspalatyrhispheglnhishis
859095
alaglyphegluaspgluglnhistrpglnglutyrleuglnglnleu
100105110
valaspaspglyleuasptyrserlysprotrptrpargtyrvalval
115120125
valasplysleuprocysglyargalaalavalileglyilealaasp
130135140
histhrhisalaaspglyalaseralavalseralaleuleusermet
145150155160
cysgluglyglnglyaspasnprovalpheserlyslysthrserser
165170175
glyalaglyserlyslysglylysargalaalaglyargglyarglys
180185190
leuserglytyrgluargleuvalalaleutrpgluglyvaltrpgly
195200205
proilesergluglnileleualaasnaspvalglnserargleulys
210215220
glnproserglylyspheprolyshistrpargphealathrthrpro
225230235240
proglygluhisleuaspvallysmetleulysgluilelysasparg
245250255
valproglyalathrvalasnaspvalmetleualaleuthralaleu
260265270
glyilelysglutyrtyrlysserileasnaspproilemetglngly
275280285
thralaaspleuargglythrleualaalaasnvalargprosergly
290295300
valasptyrleuserasplystrppheglyasnhisilevalvalgln
305310315320
thralaargtyrproleuhisgluglyargvalgluthrleuleuser
325330335
pheargaspglnserargmetarglysalaserproaspmetileval
340345350
argargtyrleumetglualametsertyrleuproargasplysval
355360365
valgluilevalvalglualaasnalalyspheserilemetileser
370375380
asnvalleupheserleuthrlysleuserleupheglyglngluile
385390395400
gluaspvalargphevalalacysserproleuglyphetyralagly
405410415
alaalathrtyrvalasplysvalserpheglyleuvalalathrglu
420425430
aspvallysthraspproservalmetleuproleupheargserglu
435440445
cysglulysleuhislysgluvalmetalaleuaspproasptyrphe
450455460
glulysglnasplysproleualavalserproalaleuvalserala
465470475480
leualaalaleuleuvalalaileleuleuservalleuleuleu
485490495
<210>4
<211>1488
<212>dna
<213>破囊壶菌(thraustochytriumroseum)
<400>4
atggggagcgggaagagccccaagagggtcaaggcggacacgttttcgcacctgatgcac60
ctcgggtcgagggactttgaggcaggcaagctggacgccaagcccatcacgacgatgggg120
tggttttactttgcggagcccgtggacatggaggtgctgcgcaacgaggtgcacgaaaag180
ctggtggacaaagtattcaggtaccgagcggtcccccgcgagcgcaagggctggacctac240
tgggaggaggcgggccccatcgacgacgcgtaccactttcagcaccacgccggctttgag300
gacgagcaacactggcaggaatacctgcagcagctcgtcgacgacgggctcgactacagc360
aagccgtggtggcggtatgtcgtcgtggacaagctcccatgcgggcgcgcagcggtgatc420
gggatcgccgaccacacgcatgccgacggcgccagcgcggtcagcgcgctactgagcatg480
tgcgagggccagggcgacaaccccgtgttttcaaaaaagacctcgtcgggcgccgggtcg540
aagaagggcaagcgtgcggcggggcgcggccgcaagctctctgggtacgagcgcctggtg600
gccctctgggagggcgtgtgggggccgatcagcgagcagatcctggctaacgacgtgcaa660
agcaggctcaagcagccaagcggcaaatttcccaagcactggcggttcgccacgacgccg720
cccggcgagcacctcgacgtcaagatgctcaaagagatcaaggaccgggtgccgggcgcc780
accgtgaacgacgtgatgctggcgctcacggcgcttggcatcaaggaatactacaagtcg840
atcaacgacccgattatgcagggcacggcggacctgcgcgggacgctggccgccaacgtg900
cggcccagtggcgttgactacttgtcggacaagtggtttgggaaccacatcgttgtgcag960
accgcgcggtatccgctgcatgagggccgcgtggagacgctcttgtcgttccgggaccag1020
agccgcatgcgcaaggcttcgccggacatgatcgtgcgccgctacttgatggaggcgatg1080
agctatctgccgcgcgacaaggtcgtcgagattgtggtggaggcgaacgccaagttttcc1140
atcatgatcagcaacgtattgttcagcctgaccaagctgagcctgttcgggcaggagatt1200
gaggacgtgcggttcgtggcctgcagcccgctcgggttttacgcgggggcggccacgtac1260
gtcgacaaggtctcgtttggcctggtggccacggaggacgtcaaaaccgacccgagcgtg1320
atgcttccgctgttccggtcggagtgcgaaaagctgcacaaggaggtgatggcgctcgat1380
ccggactactttgagaagcaggacaagcctctcgctgtctctcctgcgctcgtctcggcg1440
cttgcggccctgctcgttgcgatcttgctctctgttctcctgctttaa1488
<210>5
<211>1419
<212>dna
<213>人工序列
<400>5
atgggcagcggtaaaagccctaaacgcgtgaaagccgacaccttcagccacctgatgcat60
ctgggtagccgcgatttcgaagccggcaaactggatgcaaagccgattaccaccatgggc120
tggttctacttcgcagagccggttgacatggaggttctgcgcaatgaggtgcacgagaag180
ctggtggacaaagtgtttcgctatcgtgcagtgccgcgcgagcgtaagggttggacctat240
tgggaggaagccggcccgattgatgacgcataccacttccagcaccacgcaggttttgag300
gacgaacagcactggcaggaatacctgcagcaactggtggacgatggcctggactattct360
aaaccgtggtggcgctatgtggtggttgataaactgccgtgcggccgcgcagccgttatc420
ggtattgccgaccatacacatgccgacggtgcaagcgccgttagtgccctgctgagtatg480
tgtgagggccagggcgataacccggtgttcagcaaaaagacaagcagcggcgcaggtagc540
aagaaaggcaaacgtgcagccggtcgtggtcgcaaactgagcggctatgaacgcctggtt600
gccctgtgggaaggtgtttggggtcctattagcgagcagattctggccaacgacgttcag660
agccgcctgaaacagccgagcggcaaatttccgaagcattggcgctttgccacaaccccg720
ccgggcgaacatctggatgttaaaatgctgaaagaaatcaaagaccgcgtgccgggtgca780
accgtgaacgacgtgatgctggcactgacagccctgggtatcaaagaatattacaagagc840
atcaatgatcctatcatgcagggcaccgcagatctgcgtggtaccctggccgccaatgtt900
cgtccgagtggcgtggattatctgagcgacaagtggttcggcaatcacatcgtggtgcaa960
accgcacgttatccgctgcacgaaggtcgtgtggagaccctgctgagttttcgtgatcag1020
agccgcatgcgcaaagccagtccggatatgattgtgcgtcgctacctgatggaagccatg1080
agttacctgcctcgcgataaggtggtggagatcgttgttgaggccaacgccaagttcagc1140
atcatgattagcaatgttctgtttagtctgaccaaactgagcttattcggccaggagatt1200
gaggatgtgcgctttgtggcctgcagcccgctgggtttttatgccggcgcagccacctat1260
gtggataaggtgagctttggcctggtggccaccgaagatgtgaaaaccgaccctagcgtg1320
atgctgccgctgtttcgcagcgagtgcgaaaaactgcacaaagaagttatggccctggac1380
ccggattattttgagaagcaagataagccgttactgtaa1419
<210>6
<211>1485
<212>dna
<213>人工序列
<400>6
atgggttctggtaagtctccaaagagagttaaggctgacactttctctcacttgatgcac60
ttgggttctcgtgacttcgaagctggtaagttggacgctaagccaatcactactatgggt120
tggttctacttcgctgaaccagttgacatggaagttttgagaaacgaagttcacgaaaag180
ttggttgacaaggttttcagatacagagctgttccaagagaaagaaagggttggacttac240
tgggaagaagctggtccaatcgacgacgcttaccacttccaacaccacgctggtttcgaa300
gacgaacaacactggcaagaatacttgcaacaattggttgacgacggtttggactactct360
aagccatggtggagatacgttgttgttgacaagttgccatgtggtagagctgctgttatc420
ggtatcgctgaccacactcacgctgacggtgcttctgctgtttctgctttgttgtctatg480
tgtgaaggtcaaggtgacaacccagttttctctaagaagacttcttctggtgctggttct540
aagaagggtaagagagctgctggtagaggtagaaagttgtctggttacgaaagattggtt600
gctttgtgggaaggtgtttggggtccaatctctgaacaaatcttggctaacgacgttcaa660
tctcgtttgaagcaaccatctggtaagttcccaaagcactggagattcgctactactcca720
ccaggtgaacacttggacgttaagatgttgaaggaaatcaaggacagagttccaggtgct780
actgttaacgacgttatgttggctttgactgctttgggtatcaaggaatactacaagtct840
atcaacgacccaatcatgcaaggtactgctgacttgagaggtactttggctgctaacgtt900
agaccatctggtgttgactacttgtctgacaagtggttcggtaaccacatcgttgttcaa960
actgctagatacccattgcacgaaggtagagttgaaactttgttgtctttcagagaccaa1020
tctcgtatgagaaaggcttctccagacatgatcgttagaagatacttgatggaagctatg1080
tcttacttgccaagagacaaggttgttgaaatcgttgttgaagctaacgctaagttctct1140
atcatgatctctaacgttttgttctctttgactaagttgtctttgttcggtcaagaaatc1200
gaagacgttagattcgttgcttgttctccattgggtttctacgctggtgctgctacttac1260
gttgacaaggtttctttcggtttggttgctactgaagacgttaagactgacccatctgtt1320
atgttgccattgttcagatctgaatgtgaaaagttgcacaaggaagttatggctttggac1380
ccagactacttcgaaaagcaagacaagccattggctgtttctccagctttggtttctgct1440
ttggctgctttgttggttgctatcttgttgtctgttttgttgttg1485
- 还没有人留言评论。精彩留言会获得点赞!