经修饰的亮氨酸脱氢酶的制作方法
本发明是基于申请日为2013年3月27日,申请号为“201380018064.8”(国际申请号为pct/jp2013/059124),发明名称为“经修饰的亮氨酸脱氢酶”的专利申请的分案申请。本发明涉及经修饰的亮氨酸脱氢酶,以及利用所述经修饰的亮氨酸脱氢酶分析总分支氨基酸的方法,等等。
背景技术:
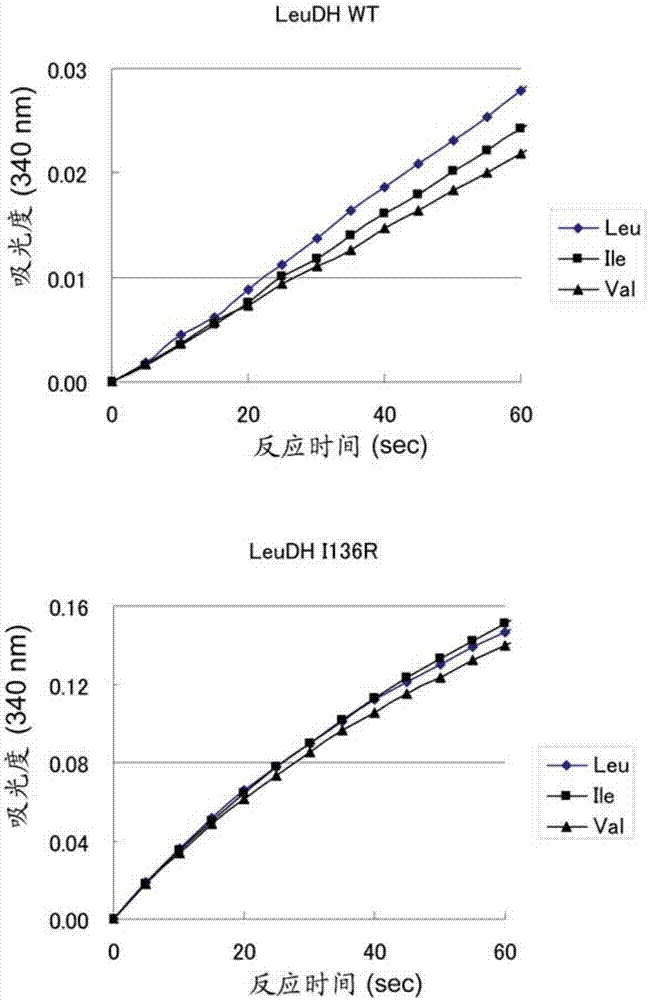
:已知有些氨基酸可成为健康状况的指标。尤其是,支链氨基酸(bcaa:l-亮氨酸,l-异亮氨酸和l-缬氨酸)是在各种生物样品或食品或饮料中大量存在重要氨基酸。所述支链氨基酸在活体肌肉中大量存在,已知作为蛋白质营养物的标记。已知在患有肝硬化和肝性脑病的患者中,血液中支链氨基酸的浓度降低,fisher比值和btr值之类的指标用作肝脏健康状况的指标以及随后观察的指标。利用分析仪器的方法,包括高效液相层析(hplc)和lc-ms方法,被广泛地用作氨基酸分析方法。在总支链氨基酸的测定中,应用了利用亮氨酸脱氢酶测定btr值的酶试剂盒(例如专利文献1),以及利用亮氨酸脱氢酶通过电化学法测定总支链氨基酸的生物传感器(例如专利文献2)。现有技术文献专利文献专利文献1:japanesepatentapplicationlaid-openpublicationno.jp2007-289096-a专利文献2:internationalpublicationno.wo2005/075970技术实现要素:本发明所要解决的技术问题在利用亮氨酸脱氢酶对总支链氨基酸的浓度的测定中,有几个方面有待改善。例如,总支链氨基酸的浓度是利用酶试剂盒中的亮氨酸脱氢酶测定的。但是,在该方法中,应用的是直到全部的底物反应了才进行测定的终点法(endpointmethod)。这是由于亮氨酸脱氢酶对l-亮氨酸,l-异亮氨酸和l-缬氨酸的底物特异性(反应速度)不同。野生型的亮氨酸脱氢酶,对于l-异亮氨酸和l-缬氨酸的底物特异性比对l-亮氨酸的底物特异性低,并且对l-异亮氨酸和l-缬氨酸的反应速度比对l-亮氨酸的反应速度慢。因此,以利用亮氨酸脱氢酶的酶试剂盒测定总支链氨基酸的浓度具有反应时间长的缺点。此外,当存在多种作为亮氨酸脱氢酶底物的氨基酸时,应用所述的生物传感器不能单独测定每种支链氨基酸的浓度。这是因为亮氨酸脱氢酶不仅与l-亮氨酸反应,其还与l-异亮氨酸和l-缬氨酸反应。在上述情况下,一般也不能测定出几种支链氨基酸的总的浓度,这是因为亮氨酸脱氢酶对l-亮氨酸、l-异亮氨酸和l-缬氨酸的底物特异性(反应速度)不同。解决技术问题的手段作为本发明锐意研究的结果,本发明的发明人设想,为了快速地测定总支链氨基酸的浓度,通过提高亮氨酸脱氢酶对支链氨基酸中的每种氨基酸,特别是l-异亮氨酸和l-缬氨酸,的活性等,来改善亮氨酸脱氢酶对支链氨基酸的底物特异性,利用速度法(初始速度法(initialratemethod))测定总支链氨基酸的浓度,由此,为改善亮氨酸脱氢酶对支链氨基酸的底物特异性,成功地开发出了经修饰的亮氨酸脱氢酶。本发明的发明人还成功地改善了与总支链氨基酸的浓度测定相关的亮氨酸脱氢酶的其他特性,并由此完成了本发明。因此,本发明如下:[1]经修饰的酶,其中的至少一个氨基酸残基被突变,以改善选自下述的、亮氨酸脱氢酶一种或多种特性:(a)亮氨酸脱氢酶对总支链氨基酸的底物特异性;(b)亮氨酸脱氢酶对任意支链氨基酸的活性;和(c)亮氨酸脱氢酶的热稳定性。[2][1]的经修饰的酶,其中所述的突变是,亮氨酸脱氢酶氨基酸序列中的tgi基序中的异亮氨酸的取代。[3][2]的经修饰的酶,其中所述的tgi基序中的异亮氨酸被甲硫氨酸,精氨酸,组氨酸,苯丙氨酸,亮氨酸,赖氨酸,半胱氨酸,酪氨酸,丙氨酸,甘氨酸,丝氨酸,天冬酰胺,或色氨酸取代。[4][1]-[3]中任一项的经修饰的酶,其中所述的突变是亮氨酸脱氢酶的氨基酸序列中的gvi基序中的异亮氨酸的取代。[5][4]的经修饰的酶,其中所述的gvi基序中的异亮氨酸被苯丙氨酸,组氨酸,天冬酰胺,酪氨酸,亮氨酸,赖氨酸,谷胺酰胺,精氨酸,天冬氨酸,苏氨酸,谷氨酸,丝氨酸,半胱氨酸,丙氨酸,甘氨酸,缬氨酸,色氨酸,或甲硫氨酸取代。[6][1]-[5]中任一项的经修饰的酶,其中所述的亮氨酸脱氢酶来自嗜热脂肪土芽孢杆菌(geobacillusstearothermophilus)。[7][1]-[6]中任一项的经修饰的酶,其是以下(1)或(2)的蛋白质:(1)蛋白质,其包含在seqidno:2的氨基酸序列的tgi基序中的异亮氨酸和/或gvi基序中的异亮氨酸被下述(i)和/或(ii)的氨基酸残基取代的氨基酸序列:(i)tgi基序中的异亮氨酸被甲硫氨酸,精氨酸,组氨酸,苯丙氨酸,亮氨酸,赖氨酸,半胱氨酸,酪氨酸,丙氨酸,甘氨酸,丝氨酸,天冬酰胺,或色氨酸取代;和/或(ii)gvi基序中的异亮氨酸被苯丙氨酸,组氨酸,天冬酰胺,酪氨酸,亮氨酸,赖氨酸,谷胺酰胺,精氨酸,天冬氨酸,苏氨酸,谷氨酸,丝氨酸,半胱氨酸,丙氨酸,甘氨酸,缬氨酸,色氨酸,或甲硫氨酸取代;或(2)蛋白质,其包含在seqidno:2的氨基酸序列的tgi基序中的异亮氨酸和/或gvi基序中的异亮氨酸被上述(i)和/或(ii)的氨基酸残基取代的氨基酸序列中,具有一个或数个附加的氨基酸残基突变的氨基酸序列,并具有选自下述的、一个或以上被改善的特性:(a)亮氨酸脱氢酶对总支链氨基酸的底物特异性;(b)亮氨酸脱氢酶对任意支链氨基酸的活性;和(c)亮氨酸脱氢酶的热稳定性。[8]总支链氨基酸的分析方法,其包括利用[1]-[7]中任一项的经修饰的酶测定试验样品中所包含的总支链氨基酸。[9][8]的方法,其包括将试验样品与烟酰胺腺嘌呤二核苷酸(nad+)混合,并检测在所述的经修饰的酶的作用下由nad+形成的nadh。[10]支链氨基酸衍生物的生产方法,其包括利用[1]-[7]中任一项的经修饰的酶形成来自支链氨基酸的衍生物。[11]编码[1]-[7]中任一项的经修饰的酶的多核苷酸。[12]包含[11]的多核苷酸的表达载体。[13]包含[12]的表达载体的转化体。[14]经修饰的酶的生产方法,该经修饰的酶中至少一个氨基酸残基被突变以改善与总支链氨基酸测定相关的亮氨酸脱氢酶的特性,所述方法包括利用[13]的转化体形成该经修饰的酶。[15]分析总支链氨基酸的试剂盒,其包含[1]-[7]中任一项的经修饰的酶。[16][15]的分析总支链氨基酸的试剂盒,其还包含反应缓冲液和缓冲盐、缓冲液和缓冲盐、以及烟酰胺腺嘌呤二核苷酸(nad+)中的至少一种。[17]用于分析总支链氨基酸的酶传感器,其包括(a)检测用电极,和(b)固定于或保持在所述检测用电极上的、[1]-[7]中任一项的经修饰的酶。发明效果由于本发明的经修饰的酶的底物特异性得到改善,其不仅可通过终点法还可以通过速度法(初始速度法)用于快速测定总支链氨基酸的浓度。鉴于本发明的经修饰的酶对支链氨基酸的活性被增强,其也可用于任意支链氨基酸的测定和/或生产任意支链氨基酸的衍生物(例如2-氧代-衍生物)。由于本发明的经修饰的酶在水溶液中具有优异的热稳定性,其稳定性极佳。因此,本发明的经修饰的酶尤其适合用作液体试剂。本发明的分析方法可用于,诸如肝硬化,肝性脑病之类的疾病诊断。附图简述图1显示每种野生型的亮氨酸脱氢酶对每种支链氨基酸(l-亮氨酸,l-异亮氨酸和l-缬氨酸)的底物特异性;图2显示每种支链氨基酸(l-亮氨酸,l-异亮氨酸和l-缬氨酸)与野生型的酶或经修饰的酶i136r反应时,吸光度随时间的变化(n=3的平均值);图3显示在吸光度变化(n=3的平均值)过程中,野生型的酶或经修饰的酶i136r对不同浓度下的每种支链氨基酸(l-亮氨酸,l-异亮氨酸和l-缬氨酸)的活性,并显示出由这些值制备的标准曲线;和图4显示通过酶法和氨基酸分析仪测定的大鼠血浆样品中总bcaa的浓度(n=3的平均值)。实施本发明的具体方案本发明提供经修饰的酶。本发明的经修饰的酶可以是,为改善与总支链氨基酸测定相关的亮氨酸脱氢酶的特性,其中的至少一个氨基酸残基被突变的亮氨酸脱氢酶。氨基酸残基突变的示例可包括取代,缺失,添加和插入,优选取代。被突变的氨基酸残基是l-丙氨酸(a),l-天冬酰胺(n),l-半胱氨酸(c),l-谷胺酰胺(q),甘氨酸(g),l-异亮氨酸(i),l-亮氨酸(l),l-甲硫氨酸(m),l-苯丙氨酸(f),l-脯氨酸(p),l-丝氨酸(s),l-苏氨酸(t),l-色氨酸(w),l-酪氨酸(y),l-缬氨酸(v),l-天冬氨酸(d),l-谷氨酸(e),l-精氨酸(r),l-组氨酸(h)或l-赖氨酸(k),其是天然的l-α-氨基酸。当所述的突变是取代,添加或插入时,被取代,添加或插入的氨基酸残基和上述被突变的氨基酸残基相同。所述的支链氨基酸(bcaa)指l-亮氨酸,l-异亮氨酸或l-缬氨酸,其是天然的l-α-氨基酸中具有支链作为侧链的l-α-氨基酸。在总支链氨基酸的测定中,全部的支链氨基酸(即,l-亮氨酸,l-异亮氨酸和l-缬氨酸)被测定。所述的亮氨酸脱氢酶是催化下述反应的氧化还原酶(ec1.4.1.9)。l-亮氨酸+h2o+nad+→4-甲基-2-羟戊酸(oxopentanoicacid)+nh3+nadh+h+已知,尽管野生型的亮氨酸脱氢酶不仅作用于l-亮氨酸,也作用于l-异亮氨酸和l-缬氨酸,其对l-异亮氨酸和l-缬氨酸的活性比对l-亮氨酸的活性低。图1中显示,来自芽孢杆菌(bacillussp.)和嗜热脂肪土芽孢杆菌的野生型的亮氨酸脱氢酶对l-亮氨酸,l-异亮氨酸和l-缬氨酸的底物特异性,其以对l-亮氨酸的相对活性为100的相对活性表示。如图1所示,野生型的亮氨酸脱氢酶的活性对l-亮氨酸之外的支链氨基酸相对低,特别是相对于对l-亮氨酸的活性,其对l-异亮氨酸的相对活性为75以下。作为本发明的经修饰的酶的来源的亮氨酸脱氢酶可以是来源于任意生物(例如微生物,如细菌,放线菌和真菌,以及昆虫,鱼类,动物和植物)的酶。所述的亮氨酸脱氢酶的示例包括来自属于芽孢杆菌属以及相关的属的生物的酶。与芽孢杆菌属相关的属的示例可包括土芽孢杆菌属(geobacillus),类芽孢杆菌属(paenibacillus)和海洋芽孢杆菌属(oceanobacillus)。所述与芽孢杆菌属相关的属,是与芽孢杆菌属同属于芽孢杆菌科的属。属于芽孢杆菌属及与之相关的属的微生物可包括球形芽孢杆菌(bacillussphaericus),蜡状芽孢杆菌(bacilluscereus),地衣芽孢杆菌(bacilluslicheniformis),芽孢杆菌(bacillussp.),以及嗜热脂肪土芽孢杆菌(geobacillusstearothermophilus)。向亮氨酸脱氢酶中导入突变的位点,优选地是位于亮氨酸脱氢酶活性中心附近的氨基酸残基。本领域的普通技术人员能够将来自嗜热脂肪土芽孢杆菌的亮氨酸脱氢酶的氨基酸序列与另一种亮氨酸脱氢酶的氨基酸序列比对(align),由此容易地确定来自嗜热脂肪土芽孢杆菌之外的生物的亮氨酸脱氢酶中位于活性中心附近的氨基酸残基。此外,有关亮氨酸脱氢酶的三维结构的分析结果已有报道(参见,例如bakeretal.,structure3:693-705(1995))。因此,基于所述三维结构分析结果,本领域的普通技术人员也可以容易地确定来自嗜热脂肪土芽孢杆菌之外的生物的亮氨酸脱氢酶中位于活性中心附近的氨基酸残基。在优选的具体实施方案中,与总支链氨基酸测定相关的、以改善亮氨酸脱氢酶的特性的突变是野生型亮氨酸脱氢酶的氨基酸序列中tgi基序中的异亮氨酸(i)的取代。所述的tgi基序由三个连续的氨基酸残基,苏氨酸(t)-甘氨酸(g)-异亮氨酸(i)组成。根据酶来源的不同,所述野生型亮氨酸脱氢酶氨基酸序列中的tgi基序的位置可能不同。但是,本领域的普通技术人员能够适当地确定所述野生型亮氨酸脱氢酶氨基酸序列中的tgi基序的位置,由此确定待被取代的异亮氨酸(i)的位置。通常,在所述野生型亮氨酸脱氢酶的氨基酸序列中,所述的tgi基序位于第134-138位氨基酸的区域内,所述的异亮氨酸(i)位于第136-138位(参见,例如表1)。表1.亮氨酸脱氢酶中tgi基序的位置在另一个优选的具体实施方案中,与总支链氨基酸测定相关的、以改善所述亮氨酸脱氢酶的特性的突变是,所述野生型亮氨酸脱氢酶的氨基酸序列的中gvi基序中异亮氨酸(i)的取代。所述的gvi基序由三个连续的氨基酸残基,甘氨酸(g)-缬氨酸(v)-异亮氨酸(i)组成。根据酶来源的不同,所述野生型亮氨酸脱氢酶氨基酸序列中的gvi基序的位置可能不同。但是,本领域的普通技术人员能够适当地确定所述野生型亮氨酸脱氢酶氨基酸序列中的gvi基序的位置,由此确定待被取代的异亮氨酸(i)的位置。通常,在所述野生型亮氨酸脱氢酶的氨基酸序列中,所述gvi基序位于第290–294位的氨基酸区域,异亮氨酸(i)位于第292–294位(参见,例如表2)。作为与总支链氨基酸测定相关的、以改善所述亮氨酸脱氢酶的特性的突变,本发明的经修饰的酶在gvi基序中的异亮氨酸(i)取代以外,还可以包含上述tgi基序中的异亮氨酸(i)取代。表2.亮氨酸脱氢酶中gvi基序的位置与总支链氨基酸测定相关的亮氨酸脱氢酶的特性可包括:(a)亮氨酸脱氢酶对总支链氨基酸的底物特异性;(b)亮氨酸脱氢酶对任意支链氨基酸的活性;和(c)亮氨酸脱氢酶的热稳定性。本发明的经修饰的酶可以仅具有一种前面所提到的特性,或者可以具有两种或三种前面所提到的特性的组合。对于tgi基序中的异亮氨酸(i),用以改善选自(a)-(c)中至少一种特性的突变可包括,被取代为例如,甲硫氨酸(m),精氨酸(r),组氨酸(h),苯丙氨酸(f),亮氨酸(l),赖氨酸(k),半胱氨酸(c),酪氨酸(y),丙氨酸(a),甘氨酸(g),丝氨酸(s),天冬酰胺(n)和色氨酸(w)。对于gvi基序中的异亮氨酸(i),用以改善选自(a)-(c)中至少一种特性的突变可包括,被取代为例如,苯丙氨酸(f),组氨酸(h),天冬酰胺(n),酪氨酸(y),亮氨酸(l),赖氨酸(k),谷胺酰胺(q),精氨酸(r),天冬氨酸(d),苏氨酸(t),谷氨酸(e),丝氨酸(s),半胱氨酸(c),丙氨酸(a),甘氨酸(g),缬氨酸(v),色氨酸(w)和甲硫氨酸(m)。本发明的经修饰的酶可以在任何ph条件下使用,并适宜在中性条件和/或碱性条件下使用。适于应用本发明的经修饰的酶的中性条件指ph6.0以上、ph8.0以下范围内的任意ph条件。优选地,所述中性条件是ph7.0以上、ph8.0以下(例如ph7.0,ph7.5或ph8.0)的任意ph条件。适于应用本发明的经修饰的酶的碱性条件指ph8.0以上、ph11.0以下范围内的任意ph条件。优选地,所述碱性条件ph范围的上限优选地是10.5以下,更优选地10.0以下。特别优选地,所述碱性条件ph8.5以上、ph9.5以下(例如ph9.0)范围内的任意ph条件。在一个具体实施方案中,所述亮氨酸脱氢酶对总支链氨基酸的底物特异性,作为与总支链氨基酸测定相关的亮氨酸脱氢酶的特性被改善。所述亮氨酸脱氢酶对总支链氨基酸的底物特异性的改善,并非旨在增强亮氨酸脱氢酶对某种支链氨基酸的底物特异性,而是对全部支链氨基酸(即,l-亮氨酸,l-异亮氨酸和l-缬氨酸)的底物特异性(反应速度)更均衡。具体而言,亮氨酸脱氢酶对总支链氨基酸的底物特异性的改善可通过下述方式实现,即,当以亮氨酸脱氢酶对亮氨酸的相对活性为100时,相比于野生型的酶对异亮氨酸和缬氨酸各自的相对活性,经修饰的酶对异亮氨酸和缬氨酸各自的相对活性更接近100。关于亮氨酸脱氢酶对总支链氨基酸的底物特异性,当以亮氨酸脱氢酶对亮氨酸的相对活性为100时,亮氨酸脱氢酶对异亮氨酸和缬氨酸的相对活性优选地为80以上、120以下,更优选地为85以上、115以下,更加优选地为90以上、110以下,特别优选地为95以上、105以下。当以亮氨酸脱氢酶对亮氨酸的相对活性为100时,亮氨酸脱氢酶对异亮氨酸和缬氨酸的相对活性为80以上、120以下的本发明的经修饰的酶中的修饰的示例可包括1)适合于改善碱性条件下的底物特异性的、以下述的氨基酸残基对tgi基序中的异亮氨酸(i)的取代和/或以下述的氨基酸残基对gvi基序中的异亮氨酸(i)的取代,以及2)适合于改善中性条件下的所述特性的、以下述的氨基酸残基对tgi基序中的异亮氨酸(i)的取代和/或以下述的氨基酸残基对gvi基序中的异亮氨酸(i)的取代。1)适合于改善碱性条件下的底物特异性的取代(a)第136位被取代后的氨基酸残基(碱性条件)甲硫氨酸(m),精氨酸(r),苯丙氨酸(f),赖氨酸(k),半胱氨酸(c),酪氨酸(y),丙氨酸(a),甘氨酸(g)或丝氨酸(s)。(b)第292位被取代后的氨基酸残基(碱性条件)苯丙氨酸(f),组氨酸(h),天冬酰胺(n),酪氨酸(y),赖氨酸(k),谷胺酰胺(q),谷氨酸(e)或甘氨酸(g)。2)适合于改善中性条件下的底物特异性的取代(c)第136位被取代后的氨基酸残基(中性条件)丙氨酸(a),甘氨酸(g),组氨酸(h),赖氨酸(k),亮氨酸(l),丝氨酸(s)或酪氨酸(y)。(d)第292位被取代后的氨基酸残基(中性条件)丙氨酸(a),半胱氨酸(c),天冬氨酸(d),甘氨酸(g),赖氨酸(k),亮氨酸(l),甲硫氨酸(m),精氨酸(r),丝氨酸(s),苏氨酸(t)或缬氨酸(v)。在另一具体实施方案中,作为与总支链氨基酸测定相关的亮氨酸脱氢酶的特性,亮氨酸脱氢酶对任意支链氨基酸的活性被改善。所述亮氨酸脱氢酶对任意支链氨基酸的活性的改善指,相比于野生型的酶,所述经修饰的酶对选自l-亮氨酸,l-异亮氨酸和l-缬氨酸的一个或以上的氨基酸的活性提高了。具体而言,所述亮氨酸脱氢酶对任意支链氨基酸的活性的改善可通过下述方式实现,即,当以野生型的亮氨酸脱氢酶对选自l-亮氨酸,l-异亮氨酸和l-缬氨酸的一个或以上的氨基酸的活性为100时,所述经修饰的酶对所述氨基酸的活性高于100。此种经修饰的酶可以快速地测定单个的支链氨基酸,并因此对测定总支链氨基酸有用。经修饰的酶活性的增强水平,优选地是野生型的酶的1.3倍以上,更优选地是1.5倍以上,更加优选地是1.7倍以上,特别优选地是2.0倍以上。相比于野生型的酶,活性增强1.3倍以上的本发明的经修饰的酶中的修饰的示例包括1)适合于改善碱性条件下的活性的、以下述的氨基酸残基对tgi基序中的异亮氨酸(i)的取代,和/或以下述的氨基酸残基对gvi基序中的异亮氨酸(i)的取代,以及2)适合于改善中性条件下的活性的、以下述的氨基酸残基对tgi基序中的异亮氨酸(i)的取代,和/或以下述的氨基酸残基对gvi基序中的异亮氨酸(i)的取代。1)适合于改善中性条件下的活性的取代1-1)第136位被取代后的氨基酸残基(碱性条件)(i)对l-亮氨酸的活性的增强(碱性条件)甲硫氨酸(m),精氨酸(r),组氨酸(h),苯丙氨酸(f),亮氨酸(l),赖氨酸(k),半胱氨酸(c),酪氨酸(y),丙氨酸(a),甘氨酸(g),丝氨酸(s),天冬酰胺(n),或色氨酸(w)。(ii)对l-异亮氨酸的活性的增强(碱性条件)甲硫氨酸(m),精氨酸(r),组氨酸(h),苯丙氨酸(f),亮氨酸(l),赖氨酸(k),半胱氨酸(c),酪氨酸(y),丙氨酸(a),甘氨酸(g),丝氨酸(s),天冬酰胺(n),或色氨酸(w)。(iii)对l-缬氨酸的活性的增强(碱性条件)甲硫氨酸(m),精氨酸(r),组氨酸(h),苯丙氨酸(f),亮氨酸(l),赖氨酸(k),半胱氨酸(c),酪氨酸(y),丙氨酸(a),甘氨酸(g),丝氨酸(s),天冬酰胺(n),或色氨酸(w)。1-2)第292位被取代后的氨基酸残基(碱性条件)(iv)对l-亮氨酸活性的增强(碱性条件)苯丙氨酸(f),组氨酸(h),天冬酰胺(n),酪氨酸(y),亮氨酸(l),赖氨酸(k),谷胺酰胺(q),精氨酸(r),天冬氨酸(d),苏氨酸(t),谷氨酸(e),丝氨酸(s),半胱氨酸(c),丙氨酸(a),或甘氨酸(g)。(v)对l-异亮氨酸的活性的增强(碱性条件)苯丙氨酸(f),组氨酸(h),天冬酰胺(n),酪氨酸(y),亮氨酸(l),赖氨酸(k),谷胺酰胺(q),精氨酸(r),天冬氨酸(d),苏氨酸(t),谷氨酸(e),丝氨酸(s),半胱氨酸(c),丙氨酸(a),甘氨酸(g),缬氨酸(v),或色氨酸(w)。(vi)对l-缬氨酸的活性的增强(碱性条件)苯丙氨酸(f),组氨酸(h),天冬酰胺(n),酪氨酸(y),亮氨酸(l),赖氨酸(k),谷胺酰胺(q),精氨酸(r),天冬氨酸(d),苏氨酸(t),谷氨酸(e),丝氨酸(s),半胱氨酸(c),丙氨酸(a),甘氨酸(g),或缬氨酸(v)。2)适合于改善中性条件下活性的取代2-1)第136位被取代后的氨基酸残基(中性条件)(i')对l-亮氨酸的活性的增强(中性条件)丙氨酸(a),半胱氨酸(c),苯丙氨酸(f),甘氨酸(g),组氨酸(h),赖氨酸(k),亮氨酸(l),甲硫氨酸(m),天冬酰胺(n),精氨酸(r),丝氨酸(s),色氨酸(w),或酪氨酸(y)。(ii')对l-异亮氨酸的活性的增强(中性条件)丙氨酸(a),半胱氨酸(c),苯丙氨酸(f),甘氨酸(g),组氨酸(h),赖氨酸(k),亮氨酸(l),甲硫氨酸(m),天冬酰胺(n),精氨酸(r),丝氨酸(s),色氨酸(w),或酪氨酸(y)。(iii')对l-缬氨酸的活性的增强(中性条件)丙氨酸(a),半胱氨酸(c),苯丙氨酸(f),甘氨酸(g),组氨酸(h),赖氨酸(k),亮氨酸(l),甲硫氨酸(m),天冬酰胺(n),谷胺酰胺(q),精氨酸(r),丝氨酸(s),色氨酸(w),或酪氨酸(y)。2-2)第292位被取代后的氨基酸残基(中性条件)(iv')对l-亮氨酸的活性的增强(中性条件)丙氨酸(a),半胱氨酸(c),天冬氨酸(d),谷氨酸(e),苯丙氨酸(f),甘氨酸(g),组氨酸(h),赖氨酸(k),亮氨酸(l),甲硫氨酸(m),天冬酰胺(n),谷胺酰胺(q),精氨酸(r),丝氨酸(s),苏氨酸(t),缬氨酸(v),色氨酸(w),或酪氨酸(y)。(v')对l-异亮氨酸的活性的增强(中性条件)丙氨酸(a),半胱氨酸(c),天冬氨酸(d),谷氨酸(e),苯丙氨酸(f),甘氨酸(g),组氨酸(h),赖氨酸(k),亮氨酸(l),甲硫氨酸(m),天冬酰胺(n),谷胺酰胺(q),精氨酸(r),丝氨酸(s),苏氨酸(t),色氨酸(w),或酪氨酸(y)。(vi')对l-缬氨酸的活性的增强(中性条件)丙氨酸(a),半胱氨酸(c),天冬氨酸(d),谷氨酸(e),苯丙氨酸(f),甘氨酸(g),组氨酸(h),赖氨酸(k),亮氨酸(l),甲硫氨酸(m),天冬酰胺(n),谷胺酰胺(q),精氨酸(r),丝氨酸(s),苏氨酸(t),缬氨酸(v),色氨酸(w),或酪氨酸(y)。在又一具体实施方案中,作为与总支链氨基酸测定相关的亮氨酸脱氢酶的特性,亮氨酸脱氢酶的热稳定性被改善。所述亮氨酸脱氢酶的热稳定性的改善的意思是相对于野生型的酶,所述经修饰的酶的热稳定性进一步增强。具体而言,所述亮氨酸脱氢酶的热稳定性的增强可通过下述方式实现,即,当将所述的酶在60℃的水溶液中处理1小时,所述的经修饰的酶的残留活性高于野生型的酶的残留活性。水溶液中的亮氨酸脱氢酶热稳定性(特别是液态稳定性)试验作为评价所述经修饰酶的热稳定性的加速试验具有重要意义。因此,当所述的经修饰的酶在水溶液中的热稳定性高时,所述经修饰的酶的稳定性(特别是液态稳定性)也倾向于较高。表现出高液态稳定性的酶可以液态形式长时间保存,因此,这种经修饰的酶,作为液体试剂可用于测定总支链氨基酸。所述的热稳定性增强的程度,优选地是野生型的酶的热稳定性的1.1倍以上,更优选地1.2倍以上。相对于野生型的酶热稳定性增强1.1倍以上的、本发明的经修饰的酶的修饰,可包括以下述的氨基酸残基对tgi基序中的异亮氨酸(i)的取代,和/或以下述的氨基酸残基对gvi基序中的异亮氨酸(i)的取代。第136位被取代后的氨基酸残基甲硫氨酸(m),精氨酸(r),苯丙氨酸(f),或赖氨酸(k)。第292位被取代后的氨基酸残基苯丙氨酸(f)本发明的经修饰的酶还可以在c-末端或n-末端具有另外的肽组分(例如标签部分)所述可以添加到本发明的经修饰的酶的另外的肽组分的示例可以包括,可使得目标蛋白更易于纯化的肽组分(例如标签部分,如组氨酸标签和strep-标签ii;如谷胱甘肽-s-转移酶和麦芽糖结合蛋白等用于纯化目标蛋白的蛋白),增强所述目标蛋白质可溶性的肽组分(例如nus-标签),起伴侣蛋白作用的肽组分(例如触发因子),以具有其他功能的蛋白质或其结构域,或是作为接头将它们连接起来的肽组分。本发明的经修饰的酶,在保有前面所提到的特性的条件下,在具有上述突变的亮氨酸脱氢酶的氨基酸序列中还可以具有一个或数个氨基酸残基的附加突变(例如取代,缺失,插入和添加)。被导入所述附加突变的氨基酸残基的数目,例如,1–100个,优选地1–50个,更优选地1–40个,更加优选地1–30个,最优选地1–20个和1–10个(例如1,2,3,4或5个)。本领域的普通技术人员能够适当地制备保有前面所提到的特性的这种经修饰的酶。因此,本发明的经修饰的酶可能是下述的(i)或(ii):(i)蛋白质,其包含在亮氨酸脱氢酶的氨基酸序列的tgi基序中和/或gvi基序中的异亮氨酸(i)突变(例如取代)的氨基酸序列,并具有与总支链氨基酸测定相关的亮氨酸脱氢酶的特性的改善;或(ii)蛋白质,其包含,在具有亮氨酸脱氢酶的氨基酸序列的tgi基序中的和/或gvi基序中的异亮氨酸(i)突变(例如取代)的氨基酸序列中,具有一个或数个氨基酸残基的附加突变的氨基酸序列,并具有与总支链氨基酸测定相关的亮氨酸脱氢酶的特性的改善。本发明的经修饰的酶还可以,由于前面提到的突变和附加突变,包含与其突变前的(野生型)亮氨酸脱氢酶具有至少90%以上序列同一性的氨基酸序列。氨基酸序列同一性的百分比优选地可以是92%以上,更优选95%以上,更加优选97%以上,最优选98%以上或99%以上。氨基酸序列之间的同一性可以通过,例如,利用karlin和altschul的算法blast(pro.natl.acad.sci.usa,90,5873(1993))和pearson的fasta(methodsenzymol.,183,63(1990))确定。已基于算法blast开发出了称作blastp的程序(参见http://www.ncbi.nlm.nih.gov)。因此,氨基酸序列之间的同一性可利用这些程序在默认设置下计算出来。也可以使用,例如,采用lipman-pearson方法的、genetyx公司的软件genetyxver.7.09,以unitsizetocompare=2的设定,利用在orf中编码的全长多肽部分,计算出百分比形式的同一性,以由此所获得的数值用作氨基酸序列之间的同一性。可将来自这些计算方法的值中的最低值用作所述氨基酸序列间的同一性。在氨基酸序列中,可以被导入附加突变的氨基酸残基的位置,对本领域的普通技术人员而言是显而易见的。例如,可以参照所述氨基酸序列的比对引入所述的附加突变。具体而言,本领域的普通技术人员可以(1)比较多个同系物(homologs)(例如seqidno:2所示的氨基酸序列和其他同系物的氨基酸序列)的氨基酸序列,(2)证明相对保守的区域和相对不保守的区域,而后(3)由相对保守的区域和相对不保守的区域,分别地预测出能对功能起重要作用的区域,以及不能对功能起重要作用的区域,由此认识结构与功能之间的相关性。如上所述,亮氨酸脱氢酶的三维结构的分析结果已有报道。由此,本领域的普通技术人员能够基于所述的三维结构分析结果在保持前面所提到的特性的前体下引入所述的附加突变。当所述氨基酸残基的附加突变是取代时,所述氨基酸残基的取代可以是保守取代。术语"保守取代"指用具有类似侧链的氨基酸残基取代给定的氨基酸残基。具有类似侧链的氨基酸残基家族是本领域已知的。此类家族的示例可包括具有碱性侧链的氨基酸(例如赖氨酸,精氨酸,组氨酸),具有酸性侧链的氨基酸(例如天冬氨酸,谷氨酸),具有不带电荷的极性侧链的氨基酸(例如精氨酸,谷胺酰胺,丝氨酸,苏氨酸,酪氨酸,半胱氨酸),具有非极性侧链的氨基酸(例如甘氨酸,丙氨酸,缬氨酸,亮氨酸,异亮氨酸,脯氨酸,苯丙氨酸,甲硫氨酸,色氨酸),在β位具有分支侧链的氨基酸(例如苏氨酸,缬氨酸,异亮氨酸),具有芳香族侧链的氨基酸(例如酪氨酸,苯丙氨酸,色氨酸,组氨酸),具有含羟基(例如醇式的和酚式的)侧链的氨基酸(例如丝氨酸,苏氨酸,酪氨酸),和具有含硫侧链的氨基酸(例如半胱氨酸,甲硫氨酸)。优选地,所述氨基酸的保守取代可以是天冬氨酸和谷氨酸之间的取代,精氨酸,赖氨酸和组氨酸之间的取代,色氨酸和苯丙氨酸之间的取代,苯丙氨酸和缬氨酸之间的取代,亮氨酸,异亮氨酸和丙氨酸之间的取代,以及甘氨酸和丙氨酸之间的取代。可以利用表达本发明的经修饰的酶的、本发明的转化体,或者利用无细胞系统,制备本发明的经修饰的酶。本发明的转化体可通过下述方式制备,例如通过制备本发明的经修饰的酶的表达载体,并将所述表达载体引入到宿主细胞中。例如,通过制备已引入了本发明的多核苷酸的表达载体,并将所述表达载体引入到合适的宿主细胞中,由此来获得本发明的转化体。多种原核细胞,包括属于埃希氏杆菌属(escherichia)(例如大肠杆菌(escherichiacoli)),棒杆菌属(corynebacterium)(例如谷氨酸棒杆菌(corynebacteriumglutamicum))和芽孢杆菌属(bacillus)(例如枯草芽孢杆菌(bacillussubtilis))的细菌,和多种真核细胞,包括来自属于酵母属(saccharomyces)(例如酿酒酵母(saccharomycescerevisiae)),毕赤氏酵母属(pichia)(例如具柄毕赤氏酵母(pichiastipitis)和曲霉属(aspergillus)(例如米曲霉(aspergillusoryzae)的真菌的细胞,可用作表达本发明的经修饰的酶的宿主。缺失了特定基因的菌株可用作所述的宿主。所述转化体的示例可包括,在其细胞质中保留有所述载体的转化体,以及在其基因组中整合了目的基因的转化体。可利用给定的培养设备(例如试管,烧瓶和摇瓶发酵器),在具有下述组分的培养基中培养本发明的转化体。可适当地确定培养条件。具体而言,培养温度可以是25-37℃,ph值可以是6.5-7.5,培养时间可以在1-100小时。也可以在控制溶氧浓度的情况下进行培养。在该种情况下,溶氧浓度(do值)可用作控制指标。可控制通风/搅拌条件以使得,在空气中的氧浓度为21%时,相对溶氧浓度,do值不低于1-10%例如,优选不低于3-8%。所述的培养可以是分批培养或补料-分批培养。在补料-分批培养的情况下,可随后向培养液中连续地或非连续地添加糖原和含磷酸的溶液,以使得所述的培养连续进行。以上描述了待转化的宿主,下面对大肠杆菌进行详细描述,所述的宿主可以选自大肠杆菌k12亚种的,大肠杆菌jm109菌株,dh5α菌株,hb101菌株,bl21(de3)菌株,等等。实施转化的方法和选择转化体的方法已在molecularcloning:alaboratorymanual,3rdedition,coldspringharborpress(2001/01/15),等文献中进行了描述。以下,制备经转化的大肠杆菌的方法以及用其生产预定的酶的方法将作为一个实施例进行具体描述。用于在大肠杆菌中生产外源蛋白质的启动子一般可以作为表达本发明的多核苷酸的启动子。例如,phoa,phoc,t7启动子,lac启动子,trp启动子,trc启动子,tac启动子,λ噬菌体的pr和pl启动子,和t5启动子等强力启动子(potentpromoter),优选phoa,phoc和lac启动子。可用作载体的例如,puc(例如puc19,puc18),pstv,pbr(例如pbr322),phsg(例如phsg299,phsg298,phsg399,phsg398),rsf(例如rsf1010),pacyc(例如pacyc177,pacyc184),pmw(例如pmw119,pmw118,pmw219,pmw218),pqe(例如pqe30)及其衍生物。其他的载体,可以使用来自噬菌体dna的载体。此外,还可以使用包含启动子,并能表达插入的dna序列的表达载体。优选地,所述的载体可以是puc,pstv,或pmw。再有,作为转录终止序列的终止子可以连接到本发明的多核苷酸的下游。此类终止子的示例可包括t7终止子,fd噬菌体终止子,t4终止子,四环素抗性基因的终止子,以及大肠杆菌trpa基因的终止子。用于将本发明的多核苷酸引入到大肠杆菌中的载体,优选地是所谓的多拷贝型(multicopytype)载体,其示例可包括具有来自cole1的复制起点的质粒,如puc-系质粒,pbr322-系质粒,及其衍生物。此处的"衍生物"指那些通过碱基的取代,缺失,插入和/或添加对给定的质粒进行修饰的那些。此处所指的"修饰"还包括利用诱变剂,uv辐射等通过诱变,以及天然存在的突变进行的修饰。为了选择转化体,所述载体优选地具有标记,例如氨苄青霉素抗性基因。具有强力启动子的表达载体可通过商业途径获得,如质粒(例如puc-系(可由takarabioinc.获得),pprok-系(可由clontech获得),pkk233-2-系(可由clontech获得))。利用所得的本发明的表达载体转化大肠杆菌并培养所述的大肠杆菌,由此可获得本发明的经修饰的酶。作为培养基,可以使用通常用于培养大肠杆菌的培养基,例如m9/水解酪蛋白氨基酸培养基和lb培养基。所述的培养基可包含预定的碳源,氮源,和辅酶(例如盐酸吡哆醇)。具体而言,可以使用蛋白胨,酵母提取物,nacl,葡萄糖,mgso4,硫酸铵,磷酸二氢钾,硫酸铁,硫酸锰,等等。培养条件和生产诱导条件,根据载体中的标记和启动子的类型以及所使用的宿主适当地选择。本发明的经修饰的酶可通过下述方法回收。通过收集并随后粉碎(例如超声或匀浆)或裂解(例如通过溶菌酶处理)微生物细胞,以粉碎物或经裂物的形式获得本发明的经修饰的酶。通过抽提,沉淀,过滤和柱层析等技术,由所述粉碎物或经裂物获得本发明的经修饰的酶。本发明还提供分析总支链氨基酸的方法。本发明的所述分析方法可包括利用本发明的经修饰的酶测定试验样品中所包含的总支链氨基酸。所述的试验样品并没有特别的限定,只要所述样品被怀疑含有任意支链氨基酸(优选总支链氨基酸)即可,所述样品的示例可包括生物样品(例如血液,尿,唾液,泪液,等等)以及食品和饮料(例如营养饮料和氨基酸饮料)。本发明的分析方法没有特别的限定,只要能利用本发明的经修饰的酶测定总支链氨基酸即可。例如,通过在碱性条件或中性条件下,优选碱性缓冲液中将试验样品与烟酰胺腺嘌呤二核苷酸(nad+)混合,然后使所述的混合样品与本发明的经修饰的酶进行酶反应,最后检测在本发明的经修饰的酶的作用下由nad+形成的nadh,由此测定总支链氨基酸。具体而言,烟酰胺腺嘌呤二核苷酸(nad+)存在下,使经修饰的酶作用于碱性缓冲液中的试验样品,由烟酰胺腺嘌呤二核苷酸(nad+)形成还原形式(nadh),同时生物样品中所含底物的氨基被氧化脱氨。由此,通过吸光度(340nm)等检测nadh,来定量所述的总支链氨基酸。基于此类方法论的氨基酸测定方法是本领域已知的(参见例如ueatrongchitt,asanoy,analbiochem.,2011mar1;410(1):44-56)。也可以通过所生成的nadh对染料的还原,由吸光度等检测还原性染料的显色来定量总支链氨基酸。此外,还可以通过电化学技术检测nadh。例如,使所述经修饰的酶在碱性或中性条件下作用于试验样品,通过电化学氧化所形成的nadh,测定其氧化电流,或者用所生成的nadh还原与之共存的电子介质,测定所述还原型电子介质的电化学氧化电流,由此可以测定总支链氨基酸。nadh和所述电子介质之间的电子转移可由催化剂介导。优选地,通过速度法(初始速度法)测定总支链氨基酸。本发明的经修饰的酶不与支链氨基酸之外的氨基酸反应,或与支链氨基酸之外的氨基酸反应性低。因此,即使不仅支链氨基酸,还有其他氨基酸包含于试验样品中,也可以利用本发明的经修饰的酶测定试验样品中支链氨基酸的量。再有,本发明还包括用于分析总支链氨基酸的试剂盒,其包含本发明的经修饰的酶。本发明的试剂盒还可以包含反应用缓冲溶液或缓冲盐,以及烟酰胺腺嘌呤二核苷酸(nad+)中的至少一种。使用反应用缓冲溶液或缓冲盐来维持适合于目的酶反应的反应溶液中的ph值。所述反应用缓冲溶液或缓冲盐是碱性的或中性的,优选碱性。当本发明的试剂盒包含烟酰胺腺嘌呤二核苷酸(nad+)时,本发明的所述试剂盒还可以包含有待被nadh还原的染料。在这种情况下,通过本发明的经修饰的酶的作用由nad+形成的nadh还原所述染料,可通过吸光度等检测由被还原的染料的显色。所述染料的还原可能涉及起电子介质作用的物质。本发明还提供用于分析支链氨基酸的酶传感器,其包含(a)检测用电极,和(b)固定于或保持在所述检测用电极上的、本发明的经修饰的酶可直接或间接地固定于或保持在所述检测用电极上。还可以使用直接或间接检测通过本发明的经修饰的酶作为检测用电极,由总支链氨基酸形成的产品或副产品(nh3+nadh+h+)的生物传感器。更具体而言,检测用电极的示例包括应用本发明的经修饰的酶和烟酰胺腺嘌呤二核苷酸(nad+)的检测用电极。那些在internationalpublicationno.wo2005/075970和internationalpublicationno.wo00/57166等文献中所描述的也可以用作所述检测用电极。具体地,本发明涉及:1.经修饰的酶,其中至少一个氨基酸残基被突变,以改善亮氨酸脱氢酶的(选自下组的)一种或多种的特性:(a)所述亮氨酸脱氢酶对总支链氨基酸的底物特异性;(b)所述亮氨酸脱氢酶对任意支链氨基酸的活性;和(c)所述亮氨酸脱氢酶的热稳定性。2.项1的经修饰的酶,其中所述的突变是亮氨酸脱氢酶的氨基酸序列中的tgi基序中的异亮氨酸的取代。3.项2的经修饰的酶,其中所述的tgi基序中的异亮氨酸被甲硫氨酸,精氨酸,组氨酸,苯丙氨酸,亮氨酸,赖氨酸,半胱氨酸,酪氨酸,丙氨酸,甘氨酸,丝氨酸,天冬酰胺天冬酰胺,或色氨酸取代。4.项1-3中任一项的经修饰的酶,其中所述的突变是亮氨酸脱氢酶的氨基酸序列中的gvi基序中的异亮氨酸的取代。5.项4的经修饰的酶,其中所述的gvi基序中的异亮氨酸被苯丙氨酸,组氨酸,天冬酰胺,酪氨酸,亮氨酸,赖氨酸,谷胺酰胺,精氨酸,天冬氨酸,苏氨酸,谷氨酸,丝氨酸,半胱氨酸,丙氨酸,甘氨酸,缬氨酸,色氨酸,或甲硫氨酸取代。6.项1-5中任一项的经修饰的酶,其中所述的亮氨酸脱氢酶来自嗜热脂肪土芽孢杆菌(geobacillusstearothermophilus)。7.项1-6中任一项的经修饰的酶,其是以下(1)或(2)的蛋白质:(1)蛋白质,其包含在seqidno:2的氨基酸序列的tgi基序中的异亮氨酸和/或gvi基序中的异亮氨酸被下述(i)和/或(ii)的氨基酸残基取代的氨基酸序列:(i)tgi基序中的异亮氨酸被甲硫氨酸,精氨酸,组氨酸,苯丙氨酸,亮氨酸,赖氨酸,半胱氨酸,酪氨酸,丙氨酸,甘氨酸,丝氨酸,天冬酰胺,或色氨酸取代;和/或(ii)gvi基序中的异亮氨酸被苯丙氨酸,组氨酸,天冬酰胺,酪氨酸,亮氨酸,赖氨酸,谷胺酰胺,精氨酸,天冬氨酸,苏氨酸,谷氨酸,丝氨酸,半胱氨酸,丙氨酸,甘氨酸,缬氨酸,色氨酸,或甲硫氨酸取代;或(2)蛋白质,其包含在seqidno:2的氨基酸序列的tgi基序中的异亮氨酸和/或gvi基序中的异亮氨酸被上述(i)和/或(ii)的氨基酸残基取代的氨基酸序列中,具有一个或数个附加的氨基酸残基突变的氨基酸序列,并具有选自下组的、一种或多种被改善的特性:(a)亮氨酸脱氢酶对总支链氨基酸的底物特异性;(b)亮氨酸脱氢酶对任意支链氨基酸的活性;和(c)亮氨酸脱氢酶的热稳定性。8.一种分析总支链氨基酸的方法,其包括利用项1-7中任一项的经修饰的酶测定试验样品中所包含的总支链氨基酸。9.项8的方法,其包括将试验样品与烟酰胺腺嘌呤二核苷酸(nad+)混合,并检测在所述经修饰的酶的作用下由nad+形成的nadh。10.一种生产支链氨基酸衍生物的方法,其包括利用项1-7中任一项的经修饰的酶形成来自支链氨基酸的衍生物。11.编码项1-7中任一项的经修饰的酶的多核苷酸。12.包含项11的多核苷酸的表达载体。13.包含项12的表达载体的转化体。14.一种生产经修饰的酶的方法,该经修饰的酶中至少一个氨基酸残基被突变以改善与总支链氨基酸测定相关的亮氨酸脱氢酶的特性,所述方法包括利用项13的转化体形成该经修饰的酶。15.一种分析总支链氨基酸的试剂盒,其包含1-7中任一项的经修饰的酶。16.项15的分析总支链氨基酸的试剂盒,其还包含反应缓冲液和缓冲盐、以及烟酰胺腺嘌呤二核苷酸(nad+)中的至少一种。17.一种用于分析总支链氨基酸的酶传感器,其包括(a)检测用电极,和(b)固定于或保持在所述检测用电极上的、项1-7中任一项的经修饰的酶。实施例参照下述实施例详细描述本发明,但本发明并不限于所述实施例。(酶定量法)在l-亮氨酸,l-异亮氨酸和l-缬氨酸的酶定量法中,使亮氨酸脱氢酶在烟酰胺腺嘌呤二核苷酸(nad+)存在下作用于碱性缓冲液中的生物样品(例如血浆),生物样品中包含的底物的氨基被氧化脱氨,由烟酰胺腺嘌呤二核苷酸(nad+)形成还原产物(nadh)。用微量培养板读数器(spectramaxm2e,moleculardevices制)测定nadh的生成量。实施例1:经修饰的酶(i136r)的生产(1)ldh基因模板的制备(a)培养以及染色体dna的纯化将由nationalinstituteoftechnologyandevaluation,biologicalresourcecenter(nbrc)获得的嗜热脂肪土芽孢杆菌nbrc12550的冻干颗粒(lyophilizedpellet)悬浮于生长培养基702中,然后将其涂布于生长培养基802的琼脂培养基上,于50℃过夜培养。将所得的克隆接种于5ml生长培养基702中,于50℃下静置培养30小时。由这5ml细胞培养物纯化染色体dna,用于下述试验。培养基制备的详细内容如下述表3所示。表3.培养基组成生长培养基702生长培养基802(b)质粒的制备利用invisorbspin质粒minikit(invitek制),依照制造商的建议,从带有载体的重组大肠杆菌(e.colijm109/puc18his)的培养基中纯化,根据biosci.biotechnol.biochem.2009;73:729-732中所描述的方法制备的puc18his质粒。接下来,将7μl经纯化的质粒puc18his的载体dna,2.5μl10×k缓冲液(takarabioinc.制)和各0.8μl的psti和bamhi混合,加入灭菌的超纯水使得反应液的总体积为25μl,然后于37℃下,用限制酶处理3小时。再然后,将2μl来自于虾的碱性磷酸酶(roche制)和5μlof×10碱性磷酸酶缓冲液添加到所述25μl反应液中,并加入灭菌的超纯水使得反应液的总体积为50μl,使所述混合物于37℃下反应1小时。通过苯酚/氯仿抽提、乙醇沉淀纯化所述反应溶液,得到20μl溶于te溶液中的脱磷酸化的puc18his载体dna。(c)亮氨酸脱氢酶基因的扩增以嗜热脂肪土芽孢杆菌染色体dna用作模板,利用含bamhi识别位点序列的合成的寡核苷酸引物1:5’-ccggatccgatggaattgttcaaatatatggaaac-3’(seqidno:11)(hokkaidosystemscienceco.,ltd制)和含psti识别位点序列的合成的寡核苷酸引物2:5’-actgcagttatattgccgaagcacc-3’(seqidno:12)(hokkaidosystemscienceco.,ltd制),扩增来自嗜热脂肪土芽孢杆菌ifo12550的亮氨酸脱氢酶基因,所述的寡核苷酸引物均是基于来自嗜热脂肪土芽孢杆菌ifo12550的亮氨酸脱氢酶基因(序列表1;biochemistry,27,9056(1988))制备的。将50ng染色体dna,100pmol/μl合成的寡核苷酸引物各1μl,5μlextaq×10缓冲液(takarabioinc.制),5μl2.5mmdntp混合物(takarabioinc.制),和1μltakaraextaqdna聚合酶(takarabioinc.制)相混合,加入灭菌的超纯水使得反应液的总体积为灭菌的超纯水50μl,由此制备反应溶液。用ptc-200peltier热循环仪(mjresearchjapan制)进行pcr,所述的反应于94℃30秒,55℃30秒,72℃下2分钟,进行30个反应循环。电泳pcr产物,在紫外线照射下切出两种扩增产物(约1400bp和1900bp),利用凝胶提取试剂盒gel-mtmgelextractionkit(viogene制)提取并纯化,获得50μl的纯化产物。接下来,向4μl纯化的产物中添加6μl10×k缓冲液(takarabioinc.制)和各1μl的psti和bamhi,加入灭菌的超纯水使得反应液的总体积为灭菌的超纯水60μl。使反应溶液于37℃下反应3小时,对经纯化的pcr产物的两端进行处理。使所述反映溶液在60℃下温育15分钟,灭活所述限制酶。然后,通过乙醇沉淀纯化插入片段。(d)连接和转化将1μl的上述脱磷酸化的质粒,5μl的纯化插入片段,和6μl的连接混合物(takarabioinc.制)混合,使反应溶液的总体积为12μl,在16℃下进行连接反应,过夜。然后,将用6μl连接反应后的反应溶液转化的大肠杆菌jm109,涂布含50μg/ml氨苄青霉素的lb琼脂培养基,于37℃培养10小时。将所得的克隆接种到主平板(masterplate)上,培养,将新形成的克隆接种到含50μg/ml氨苄青霉素的lb琼脂培养基,继续培养过夜。由培养物中纯化质粒dna,用abiprism310遗传分析仪(appliedbiosystems制)分析其核苷酸序列。经确认具有正确的来自嗜热脂肪土芽孢杆菌的亮氨酸脱氢酶基因的核苷酸序列的克隆被命名为大肠杆菌jm109/puchisldh。(2)制备来自嗜热脂肪土芽孢杆菌的亮氨酸脱氢酶的经修饰的酶quikchangelightning定点诱变试剂盒(agilenttechnologies),依照产品所附的说明书,通过向puchisldh中引入定点诱变,制备经修饰的酶(i136r)的表达质粒。届时,序列:5’-gactatgtcaccggccgttcgcccgaattcgg-3’(seqidno:9)和序列:5’-ccgaattcgggcgaacggccggtgacatagtc-3’(seqidno:10)分别用作含突变密码子的正义引物和反义引物,与转化,培养,质粒提取,等相关的试验操作根据标准方法进行。经鉴定具有目的核苷酸序列的克隆被命名为大肠杆菌jm109/puchisldh突变体,用于以下的试验。(3)经修饰的酶的表达和纯化如前述构建的经修饰的酶的表达和纯化如下所示。用含编码经修饰的酶(大肠杆菌jm109/puchisldh突变体)的基因的质粒puchisldh突变体转化的重组的大肠杆菌克隆,于含50μg/ml氨苄青霉素盐的5mllb培养基的试管中,在37℃下振荡培养16小时。将这一培养物接种到装有100ml含50μg/ml氨苄青霉素盐的lb培养基的0.5升sakaguchi烧瓶中,于37℃下振荡培养至o.d.达到1.0。然后,加入1m异丙基-β-d-半乳糖苷(iptg,nacalaitesqueinc.制)至终浓度1mm,继续振荡培养5小时。离心(8,000rpm,15分钟,4℃;hitachi高速冷却离心机,himaccr21ghitachiltd.制)所得的培养液,沉淀所培养的菌体,弃上清。将所得的菌体重悬于含300mmnacl和10mm咪唑的50mmnah2po4缓冲液(ph8.0)中。然后,用超声破碎装置(kubotainsonatormodel201m,kubotacorporation制)在4℃下以180w处理15分钟破碎菌体,提取酶。离心(8,000rpm,15分钟,4℃;hitachi高速冷冻离心机,himaccr21ghitachiltd.制)细胞裂解液,上清用作纯化酶蛋白的无细胞提取溶液。所述无细胞提取溶液应用于填充有1mlni-nta树脂并经缓冲液(含300mmnacl和10mm咪唑的50mmnah2po4缓冲液(ph8.0))平衡的柱子(qiagen制)。用5ml洗涤缓冲液(50mm含1mnacl和20mm咪唑的nah2po4缓冲液(ph6.5))洗所述的树脂,接下来用5ml洗脱缓冲液(含300mmnacl和250mm咪唑的50mmnah2po4缓冲液(ph8.0))将结合的酶蛋白洗脱出来。用超滤膜(例如vivaspin6100kdamwco,gehealthcare制)浓缩所述洗脱组分。利用microbcaproteinassaykit(thermofisherscientific制)基于利用预定浓度的牛血清白蛋白制备的标准曲线测定蛋白质浓度。利用十二烷基硫酸钠/聚丙烯酰胺凝胶电泳确定经纯化的酶的纯度。实施例2:底物特异性评价根据asano等的方法(eur.j.biochem.(1987)168(1),153-159),用也可以应用比色皿的微量培养板读数器(spectramaxm2e,moleculardevices制),在具有1cm光通道长度的比色皿(bio-rad制)中测定亮氨酸脱氢酶的活性。反应溶液的组分如下。0.5ml的0.2m甘氨酸-kcl-koh缓冲液(ph9.0),0.04ml的25mmnad+溶液(sigma制),和0.1ml的0.1ml-亮氨酸(sigma制)或l-异亮氨酸(sigma制)或l-缬氨酸(sigma制)溶液,添加适量的酶溶液使反应溶液的体积为1.0ml。酶反应在室温下进行1分钟,测定340nm下的吸光度变化。结果如图2中所示。以野生型(wt)为模板导入了突变的经修饰的酶(i136r)对各bcaa的相对活性均得以改善。下文中,野生型有时缩写作wt。实施例3:经修饰的酶(i136r)对bcaa的反应的标准曲线的制备0.5ml的0.2m甘氨酸-kcl-koh缓冲液(ph9.0),0.04ml的25mmnad+溶液(sigma制),与已知浓度的l-亮氨酸或l-异亮氨酸或l-缬氨酸水溶液混合,添加milliq水使总体积为0.96ml。将所述混合物添加到比色皿中。向所述溶液中添加0.04ml0.5mg/ml的酶溶液使总体达1ml,将所得的溶液颠倒混合。酶反应在室温下进行1分钟。酶反应在室温下进行1分钟,测定340nm下的吸光度变化。上述测定的结果如图3中所示。当bcaa浓度在140-560μm(在140,280,420和560μm四个点测定)时,leu,ile和val的标准曲线与wt的大不相同,这是由于wt对各bcaa的活性是不同的。另一方面leu,ile和val与所述经修饰的酶i136r的反应的标准曲线几乎相同,这是由于所述经修饰的酶对各bcaa的活性几乎相同。以上结果揭示出,根据经修饰的酶i136r,在含有混合了leu,ile和val中的任意两种或其全部的样品中的bcaa浓度,可视为leu,ile和val中任意一种的浓度。实施例4:用经修饰的酶i136r定量试验样品中的总bcaa大鼠血浆样品(sd菌株,雌性,20周龄,charlesriverlaboratoriesjapan,inc.提供)用作实际样品,利用leudhwt和leudhi136r测定所述样品中的总bcaa。通过将用酶法计算的总bcaa测定值与用氨基酸分析仪l-8900(hitachihightechnologiescorporation制)测定的总bcaa测定值相比较,对所述测定进行评估。用酶法对总bcaa进行定量通过以下程序进行。将0.5ml的0.2m甘氨酸-kcl-koh缓冲液(ph9.0),0.04ml25mmnad+溶液(sigma制),和0.04ml或0.02ml已知浓度的l-缬氨酸水溶液或大鼠血浆相混合,加入milliq水使得总体积为0.96ml。将这一混合物加入比色皿中。向所述溶液中添加,0.04ml的0.5mg/ml酶溶液使得总体积为1ml,将所得的溶液颠倒混合。酶反应在室温下进行1分钟,测定340nm下的吸光度变化。通过利用l-缬氨酸水溶液制备的标准曲线定量血浆样品中的总bcaa。氨基酸分析仪测定用大鼠血浆样品,通过磺基水杨酸去蛋白处理。比较分别由酶法和氨基酸分析仪获得的大鼠血浆中总bcaa浓度的测定值的图标如图4中所示。结果,利用酶法获得实际样品中的总bcaa浓度测定值,与由氨基酸分析仪获得的总bcaa测定值几乎相同。已知野生型的亮氨酸脱氢酶对支链氨基酸以外的氨基酸几乎没有催化活性。在含多种氨基酸的血浆样品中的bcaa可用这一试验进行定量。因此,预计本发明的经修饰的酶保有对支链氨基酸以外的氨基酸几乎没有催化活性,这一野生型的酶的特性。以上证明了本发明的经修饰的酶可用于特异性地测定实际样品中的总bcaa。实施例5:利用无细胞系合成经修饰的酶以及经修饰的酶的纯化以野生型基因或目的突变体基因为模板,通过两步pcr法将组氨酸亲和标签和蛋白酶识别位点融合到n末端侧,制备具有导入了目的突变的构建体的线性dna。利用上述dna为模板,在来自大肠杆菌的无细胞合成反应系统中合成蛋白质。利用1ml反应规模(reactionscale),以透析法合成6小时所得的产物离心后的上清组分用对ni亲和性,进行纯化,收获洗脱组分。接下来,通过sds-page以及syproorange蛋白质凝胶染色(lifetechnologiesjapanltd.)确认作为目的酶的蛋白质的存在。以bsa作为标准物质,通过bradford法定量所得的洗脱组分中的蛋白质浓度,根据需要调节目的蛋白质的浓度,以备用于下述的评价。以上述相同的方式对于野生型的酶进行,线性dna的制备,无细胞合成,以及酶的纯化和分析。利用野生型的基因用作模板,通过pcr制备的酶如表4中所示。利用导入了目的突变的基因为模板,通过pcr制备的酶如表5和表6中所示。用于纯化的树脂和缓冲液如下。树脂:nisepharosehighperformance(gehealthcarejapan)缓冲液:结合缓冲液(nacl750mm,napi20mm,ph8.0),洗涤缓冲液(nacl750mm,napi20mm,ph8.0)收集和测定缓冲液(nacl300mm,napi50mm,edta34mm,ph7.0,10%d2o,0.01%nan3)实施例6:活性和底物特异性的评价根据实施例2中的方法评估了野生型的酶和实施例5中合成的经修饰的酶的活性和相对活性。结果如表4,5和6中所示。表4和5中,来自3个野生型样品的结果的平均值用作野生型的值。表6中的结果是对相同的样品进行3次试验所计算出的平均值。对于被导入了多个突变的经修饰的酶,每一个被导入的突变用”/”彼此分隔开、以连续的形式表示。例如,突变体i136r/i292f代表具有两个突变i136r和i292f的经修饰的酶。通过引入所述的突变,与wt相比,所述经修饰的酶的活性进一步增强和/或对每种bcaa更加均衡。与引入一种突变的情况相比,引入与wt相比使得对每种bcaa的活性的相对值更均衡的两种突变,使所述的相对值更加均衡。表4.相对于wt经修饰的酶的活性的相对值(左),以及酶对每种bcaa的活性的相对值(右)(1)。表5.相对于wt经修饰的酶的活性的相对值(左),以及酶对每种bcaa的活性的相对值(右)(2)。表6.相对于wt经修饰的酶的活性的相对值(左),以及酶对每种bcaa的活性的相对值(右)(3)。以96-孔微孔板替代具有1cm光通道长度的比色皿,在下述反应溶液中,于30℃下进行1分钟酶反应,测定340nm下的吸光度变化。所使用的酶是,如实施例5所述,以野生型的基因为模板制备的线性dna合成并纯化的。所述的反应溶液是通过,混合150μl的缓冲液(0.2mhepes,0.28m氯化钠,8.4mm磷酸氢二钠,ph7.0或7.5或8.0),30μl25mmnad+水溶液,1.5μl1m氯化钾水溶液,3μl10mml-亮氨酸或l-异亮氨酸或l-缬氨酸水溶液,以及100.5μl的milliq水,并另外添加15μl的1mg/ml酶溶液,制备的。所得结果如表7和8中所示。针对i136k和i136r的每个值是由一次试验获得的,针对其他酶的其他值是对相同样品的两次试验计算所得的平均值。表7显示,相对于wt,经修饰的酶的活性的相对值,表8显示所述的酶对于每种bcaa的活性的相对值。表7.相对于wt,经修饰的酶的活性的相对值表8.酶对每种bcaa的活性的相对值实施例7:热稳定性的评估实施例5中合成的leudhwt和下述经修饰的酶的5种酶溶液,以60,70和80℃热处理1小时,随后进行活性测定。经过热处理后的每种酶溶液所保留的活性如表9中所示。经60℃或70℃热处理后的每种经修饰酶的保留活性高于wt的保留酶活性。表9.以处理前的活性为100,以所示反应温度进行热处理后的相对活性wti292fi136ki136fi136ri136m60℃74928690919670℃58626774757480℃000001产业应用本发明的经修饰的酶可用于快速地测定总的支链氨基酸的浓度。本发明的经修饰的酶还可以用于任意支链氨基酸的测定和/或用于制备任意支链氨基酸的衍生物。本发明的经修饰的酶还可以用作液体试剂。本发明的分析方法可用于肝硬化和肝性脑病之类的疾病的诊断。序列表<110>味之素株式会社<120>经修饰的亮氨酸脱氢酶<130>pama-25042<150>jp2012-082777<151>2012-03-30<160>10<170>patentinversion3.5<210>1<211>1104<212>dna<213>嗜热脂肪土芽孢杆菌<400>1atggaattgttcaaatatatggaaacttacgattatgagcaagtgctgttttgccaagat60aaagaatcgggtttgaaagcgatcattgccattcatgacacaacgctcggcccggcgctc120ggcgggacgcgcatgtggatgtacaattcggaagaagaagcgcttgaagacgccttgcgc180ctcgcccgcggcatgacgtacaaaaacgcggccgccggcctcaacttgggcgggggcaaa240acggtcatcatcggcgacccgcgcaaagataaaaacgaagcgatgttccgggcgttcggc300cgcttcattcaagggctgaacggccgctacatcacggcggaagacgtcggcacgaccgtc360gccgatatggatatcatctatcaagaaaccgactatgtcaccggcatttcgcccgaattc420ggctcatccggcaacccatcgccggcgaccgcctacggcgtataccgcggcatgaaggcg480gcggcaaaagaggcgttcggcagcgattcgctcgaaggaaaagtcgtcgccgtccaagga540gtcggcaatgtcgcgtatcatttgtgccgccatttgcacgaagaaggagcgaaactcatc600gtgactgacatcaacaaggaagtggtggcgcgcgcggtcgaggaattcggagcgaaagcg660gtcgacccgaacgacatttacggcgtggagtgcgacatttttgctccatgcgcgctcggc720ggcatcatcaacgatcaaacgattccgcaactgaaagcgaaagtgatcgccggatcggca780gacaaccagctgaaagagccgcgccatggcgacatcatccatgaaatgggcatcgtctat840gccccggattatgtgatcaacgccggcggcgtcatcaacgtcgcggacgaactgtacggc900tacaatcgggaacgggcgatgaaaaaaatcgagcaaatttatgacaacatcgaaaaagtg960tttgccatcgccaagcgcgacaacattccaacgtatgtggccgccgaccggatggcggaa1020gaacggattgaaacgatgcgcaaagcgcgcagtccatttttgcaaaatggtcaccatatt1080ttaagccgccgtcgcgcccgctaa1104<210>2<211>367<212>prt<213>嗜热脂肪土芽孢杆菌<400>2metgluleuphelystyrmetgluthrtyrasptyrgluglnvalleu151015phecysglnasplysgluserglyleulysalaileilealailehis202530aspthrthrleuglyproalaleuglyglythrargmettrpmettyr354045asnserglugluglualaleugluaspalaleuargleualaarggly505560metthrtyrlysasnalaalaalaglyleuasnleuglyglyglylys65707580thrvalileileglyaspproarglysasplysasnglualametphe859095argalapheglyargpheileglnglyleuasnglyargtyrilethr100105110alagluaspvalglythrthrvalalaaspmetaspileiletyrgln115120125gluthrasptyrvalthrglyileserproglupheglysersergly130135140asnproserproalathralatyrglyvaltyrargglymetlysala145150155160alaalalysglualapheglyseraspserleugluglylysvalval165170175alavalglnglyvalglyasnvalalatyrhisleucysarghisleu180185190hisglugluglyalalysleuilevalthraspileasnlysgluval195200205valalaargalavalgluglupheglyalalysalavalaspproasn210215220aspiletyrglyvalglucysaspilephealaprocysalaleugly225230235240glyileileasnaspglnthrileproglnleulysalalysvalile245250255alaglyseralaaspasnglnleulysgluproarghisglyaspile260265270ilehisglumetglyilevaltyralaproasptyrvalileasnala275280285glyglyvalileasnvalalaaspgluleutyrglytyrasnargglu290295300argalametlyslysilegluglniletyraspasnileglulysval305310315320phealailealalysargaspasnileprothrtyrvalalaalaasp325330335argmetalaglugluargilegluthrmetarglysalaargserpro340345350pheleuglnasnglyhishisileleuserargargargalaarg355360365<210>3<211>1095<212>dna<213>球形赖氨酸芽孢杆菌<400>3atggaaatcttcaagtatatggaaaagtatgattatgaacaattggtattttgccaagac60gaagcatctgggttaaaagcgattatcgctatccatgacacaacacttggaccagcatta120ggtggtgctcgtatgtggacctacgcgacagaagaaaatgcgattgaggatgcattaaga180ttagcacgcgggatgacatataaaaatgcagctgctggtttaaaccttggcggtggaaaa240acggtcattattggggacccatttaaagataaaaacgaagaaatgttccgtgctttaggt300cgtttcattcaaggattaaacggtcgctatattaccgctgaagatgttggtacaaccgta360acagatatggatttaatccatgaggaaacaaattacgttacaggtatatcgccagcgttt420ggttcatcgggtaatccttcaccagtaactgcttatggcgtttatcgtggcatgaaagca480gcggcgaaagaagcatttggtacggatatgctagaaggtcgtactatatcggtacaaggg540ctaggaaacgtagcttacaagctttgcgagtatttacataatgaaggtgcaaaacttgta600gtaacagatattaaccaagcggctattgatcgtgttgtcaatgattttggcgctacagca660gttgcacctgatgaaatctattcacaagaagtcgatattttctcaccgtgtgcacttggc720gcaattttaaatgacgaaacgattccgcaattaaaagcaaaagttattgctggttctgct780aataaccaactacaagattcacgacatggagattatttacacgagctaggcattgtttat840gcacctgactatgtcattaatgcaggtggtgtaataaatgtcgcggacgaattatatggc900tataatcgtgaacgagcgttgaaacgtgtagatggtatttacgatagtattgaaaaaatc960tttgaaatttccaaacgtgatagtattccaacatatgttgcggcaaatcgtttggcagaa1020gaacgtattgctcgtgtagcgaaatcgcgtagtcagttcttaaaaaatgaaaaaaatatt1080ttgaacggccgttaa1095<210>4<211>364<212>prt<213>球形赖氨酸芽孢杆菌<400>4metgluilephelystyrmetglulystyrasptyrgluglnleuval151015phecysglnaspglualaserglyleulysalaileilealailehis202530aspthrthrleuglyproalaleuglyglyalaargmettrpthrtyr354045alathrglugluasnalailegluaspalaleuargleualaarggly505560metthrtyrlysasnalaalaalaglyleuasnleuglyglyglylys65707580thrvalileileglyaspprophelysasplysasngluglumetphe859095argalaleuglyargpheileglnglyleuasnglyargtyrilethr100105110alagluaspvalglythrthrvalthraspmetaspleuilehisglu115120125gluthrasntyrvalthrglyileserproalapheglysersergly130135140asnproserprovalthralatyrglyvaltyrargglymetlysala145150155160alaalalysglualapheglythraspmetleugluglyargthrile165170175servalglnglyleuglyasnvalalatyrlysleucysglutyrleu180185190hisasngluglyalalysleuvalvalthraspileasnglnalaala195200205ileaspargvalvalasnasppheglyalathralavalalaproasp210215220gluiletyrserglngluvalaspilepheserprocysalaleugly225230235240alaileleuasnaspgluthrileproglnleulysalalysvalile245250255alaglyseralaasnasnglnleuglnaspserarghisglyasptyr260265270leuhisgluleuglyilevaltyralaproasptyrvalileasnala275280285glyglyvalileasnvalalaaspgluleutyrglytyrasnargglu290295300argalaleulysargvalaspglyiletyraspserileglulysile305310315320phegluileserlysargaspserileprothrtyrvalalaalaasn325330335argleualaglugluargilealaargvalalalysserargsergln340345350pheleulysasnglulysasnileleuasnglyarg355360<210>5<211>1101<212>dna<213>蜡状芽孢杆菌<400>5atgacattagaaatcttcgaatacttagaaaaatatgattatgagcaagtagtattttgt60caagataaagaatctggtttaaaagcaattattgcaattcatgatacaacacttggaccg120gctcttggtggaacaagaatgtggacatatgattctgaagaagcggcgattgaagatgca180ttgcgtcttgcaaaagggatgacatacaaaaacgcagcagctggtttaaacttaggtggt240gcgaaaacagtaattatcggtgatcctcgtaaagataagagcgaagcaatgttccgtgca300ctaggacgttatatccaaggactaaacggacgttacattacagctgaagatgttggtaca360acagtagatgatatggatattatccatgaagaaactgactttgtaacaggtatctcacca420tcattcggttcttctggtaacccatctccggtaactgcatacggtgtttaccgtggtatg480aaagcagctgcaaaagaagctttcggtactgacaatttagaaggaaaagtaattgctgtt540caaggcgttggtaacgtagcatatcacctatgcaaacatttacacgctgaaggagcaaaa600ttaattgttacagatattaataaagaagctgtacaacgtgctgtagaagaattcggtgca660tcagcagttgaaccaaatgaaatttacggtgttgaatgcgatatttacgcaccatgtgca720ctaggcgcaacagttaatgatgaaactattccacaacttaaagcaaaagtaatcgcaggt780tctgcgaataaccaattaaaagaagatcgtcatggtgacatcattcatgaaatgggtatt840gtatacgcaccagattatgtaattaatgcaggtggcgtaattaacgtagcagacgaatta900tatggatacaatagagaacgtgcactaaaacgtgttgagtctatttatgacacgattgca960aaagtaatcgaaatttcaaaacgcgatggcatagcaacttatgtagcggcagatcgtcta1020gctgaagagcgcattgcaagcttgaagaattctcgtagcacttacttacgcaacggtcac1080gatattattagccgtcgctaa1101<210>6<211>366<212>prt<213>蜡状芽孢杆菌<400>6metthrleugluilepheglutyrleuglulystyrasptyrglugln151015valvalphecysglnasplysgluserglyleulysalaileileala202530ilehisaspthrthrleuglyproalaleuglyglythrargmettrp354045thrtyraspsergluglualaalailegluaspalaleuargleuala505560lysglymetthrtyrlysasnalaalaalaglyleuasnleuglygly65707580alalysthrvalileileglyaspproarglysasplyssergluala859095metpheargalaleuglyargtyrileglnglyleuasnglyargtyr100105110ilethralagluaspvalglythrthrvalaspaspmetaspileile115120125hisglugluthraspphevalthrglyileserproserpheglyser130135140serglyasnproserprovalthralatyrglyvaltyrargglymet145150155160lysalaalaalalysglualapheglythraspasnleugluglylys165170175valilealavalglnglyvalglyasnvalalatyrhisleucyslys180185190hisleuhisalagluglyalalysleuilevalthraspileasnlys195200205glualavalglnargalavalgluglupheglyalaseralavalglu210215220proasngluiletyrglyvalglucysaspiletyralaprocysala225230235240leuglyalathrvalasnaspgluthrileproglnleulysalalys245250255valilealaglyseralaasnasnglnleulysgluasparghisgly260265270aspileilehisglumetglyilevaltyralaproasptyrvalile275280285asnalaglyglyvalileasnvalalaaspgluleutyrglytyrasn290295300arggluargalaleulysargvalgluseriletyraspthrileala305310315320lysvalilegluileserlysargaspglyilealathrtyrvalala325330335alaaspargleualaglugluargilealaserleulysasnserarg340345350serthrtyrleuargasnglyhisaspileileserargarg355360365<210>7<211>1095<212>dna<213>地衣芽孢杆菌<400>7atggaactatttcgatatatggaacagtatgactacgagcaattggtattttgccaagat60aaacagtccggtttaaaagcgatcatcgcgattcatgatacgacgctcgggccggctctc120ggcggcacaagaatgtggacatacgaaagtgaagaagccgcaattgaagatgcgctgcgc180cttgcgcggggaatgacctacaaaaatgcggcggccggactgaacctcggaggaggcaaa240accgttattatcggagatccgcgcaaagataaaaacgaagaaatgttccgcgctttcggc300cgctacattcaaggcttgaacggcagatacatcacagccgaagacgtcggtacaaccgtt360gaagatatggacatcattcatgacgaaaccgatttcgttacaggcatttcacctgctttc420ggttcatcaggaaatccttctccggtaacagcttacggggtatataaagggatgaaggcg480gcggcgaaagcggcattcggaacggattcgcttgaaggcaaaaccgttgcggttcaaggc540gtcggaaacgtggcctacaacctgtgccggcacctccacgaagaaggcgcgaaactgatc600gtgaccgacatcaacaaagaagcagttgaacgtgcagtcgccgaattcggcgcccgcgcc660gtcgatccggatgatatttattcgcaggaatgcgatatatatgcgccgtgtgccctcgga720gcgacaatcaacgatgatacgattccgcagctgaaagccaaagtgattgccggggcagcc780aacaaccagctgaaagaaacccgccacggtgatcaaatccacgacatgggcatcgtttat840gccccggactatgtcatcaatgccggcggcgtcatcaatgtcgctgacgagctttacggc900tataattcggagcgcgcgctgaagaaagtcgaaggcatctacggaaacattgaacgcgtc960cttgaaatttcgaagcgcgaccgcattccgacatacttggccgcagaccgtctggcggaa1020gaacgaattgagcgcatgcgccaatcgagaagccaatttttgcaaaacggccatcacatt1080ttaagcagacgttaa1095<210>8<211>364<212>prt<213>地衣芽孢杆菌<400>8metgluleupheargtyrmetgluglntyrasptyrgluglnleuval151015phecysglnasplysglnserglyleulysalaileilealailehis202530aspthrthrleuglyproalaleuglyglythrargmettrpthrtyr354045glusergluglualaalailegluaspalaleuargleualaarggly505560metthrtyrlysasnalaalaalaglyleuasnleuglyglyglylys65707580thrvalileileglyaspproarglysasplysasngluglumetphe859095argalapheglyargtyrileglnglyleuasnglyargtyrilethr100105110alagluaspvalglythrthrvalgluaspmetaspileilehisasp115120125gluthraspphevalthrglyileserproalapheglysersergly130135140asnproserprovalthralatyrglyvaltyrlysglymetlysala145150155160alaalalysalaalapheglythraspserleugluglylysthrval165170175alavalglnglyvalglyasnvalalatyrasnleucysarghisleu180185190hisglugluglyalalysleuilevalthraspileasnlysgluala195200205valgluargalavalalaglupheglyalaargalavalaspproasp210215220aspiletyrserglnglucysaspiletyralaprocysalaleugly225230235240alathrileasnaspaspthrileproglnleulysalalysvalile245250255alaglyalaalaasnasnglnleulysgluthrarghisglyaspgln260265270ilehisaspmetglyilevaltyralaproasptyrvalileasnala275280285glyglyvalileasnvalalaaspgluleutyrglytyrasnserglu290295300argalaleulyslysvalgluglyiletyrglyasnilegluargval305310315320leugluileserlysargaspargileprothrtyrleualaalaasp325330335argleualaglugluargilegluargmetargglnserargsergln340345350pheleuglnasnglyhishisileleuserargarg355360<210>9<211>32<212>dna<213>人工序列<220><223>用于制备经突变的亮氨酸脱氢酶的上游引物<400>9gactatgtcaccggccgttcgcccgaattcgg32<210>10<211>32<212>dna<213>人工序列<220><223>用于制备经突变的亮氨酸脱氢酶的下游引物<400>10ccgaattcgggcgaacggccggtgacatagtc32当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1