一种重组mGM-CSF与GRP6融合蛋白的基因工程菌的构建的制作方法
在基因工程领域,本发明公开了一种新型蛋白重组工程菌及其构建方法,以及该融合蛋白的纯化。
背景技术:
重组质粒是指在基因工程的领域,将目的基因和载体结合成一个具有自我复制能力的dna分子,继而转化或转染入宿主菌株或细胞,筛选出含目的基因的重组子。
基因工程(geneticengineering)是以分子遗传学为理论基础,以分子生物学和微生物学的现代方法为手段,将不同来源的基因按预先设计的蓝图,在体外构建杂种dna分子,然后导入活细胞,以改变生物原有的遗传特性、获得新品种、生产新产品,通过基因工程技术可构建和表达具有多种功能的新型目的蛋白。
肿瘤细胞会表达肿瘤相关抗原或肿瘤特异性抗原,针对这些抗原发展起来的肿瘤特异性免疫治疗,是肿瘤生物治疗的重要方法。
肿瘤相关抗原(tumor-associatedantigen,taa):指并非某一种肿瘤所特有,在其他肿瘤细胞或正常细胞上也存在的抗原分子。正常细胞与肿瘤细胞仅在增殖中有量的差异,因此称为相关抗原。
肿瘤疫苗按抗原成分的类型可分为肿瘤细胞型疫苗、肿瘤抗原多肽及蛋白疫苗、dna疫苗和树突状细胞疫苗等。无论何种类型的肿瘤疫苗,其研制的关键都在于选择合适的针对肿瘤的靶抗原和提高免疫原性。
鼠源粒细胞巨噬细胞集落刺激因子(mousegranulocyte-macrophagecolonystimulatingfactor,mgm-csf)属于造血因子家族,与人源gm-csf有56%的同源性,临床上常作为免疫治疗佐剂。mgm-csf是含有124个氨基酸和两个二硫键的单链糖蛋白,可以诱导髓样细胞分化为树突状细胞(dendriticcell,dc),并促进dc的增殖和成熟。可以通过诱导粒细胞、单核细胞及nk细胞的抗体依赖的细胞毒作用(adcc),从而促进th1型细胞因子的分泌,达到抗肿瘤效果。
蛙皮素(bombesin,bn)是一种含14个氨基酸残基的生物活性多肽,它最初于1971年由anastasi和erspamer从欧洲铃蟾皮肤中提取出来。之后在哺乳动物中发现了与之对应具有相似功能的肽,包括胃泌素释放肽(grp,gastric-releasingpeptide)、神经介素b(nmb,neuromedinb)、神经介素c(nmc,neuromedinc)。这些肽在c端部分都是非常保守的,而其c端部分正是其发挥生物活性的重要部位。蛙皮素及其样肽的氨基酸序列如下:
bombesin(14aa):r-gly-asn-gln-trp-ala-val-gly-his-leu-met-nh2
h-grp(27aa):r’-tyr-pro-arg-gly-asn-his-trp-ala-val-gly-his-leu-met-nh2
h-nmb(32aa):r”-his-ser-arg-gly-asn-leu-trp-ala-thr-gly-his-phe-met-nh2
h-nmc(10aa):gly-asn-his-trp-ala-val-gly-his-leu-met-nh2
r=glp-gln-arg-leu
r’=val-pro-leu-pro-ala-gly-gly-gly-thr-val-leu-thr-lys-met
r”=ala-pro-leu-ser-trp-asp-leu-pro-glu-pro-arg-ser-arg-ala-ser-lys-ile-arg-val
胃泌素释放肽(gastrin-releasingpeptide,grp)是哺乳动物中的蛙皮素同系物,是一种胃肠道神经激素,含有27个氨基酸,具有生长因子样作用。其生理功能主要是作为中枢神经系统的神经递质,刺激各种胃肠激素的释放,刺激消化道正常粘膜组织的生长等。研究证实grp与肿瘤关系密切,在多种肿瘤细胞中,grp及其受体存在过表达。通过自分泌或旁分泌途径,grp可以刺激肿瘤细胞的生长,参与肿瘤新生血管的生成,促进肿瘤的转移等。有研究表明grp是肿瘤特异性治疗的理想靶分子,已有grp受体拮抗剂和抗grp单克隆抗体用于抗肿瘤实验研究,取得了不错的结果。通过免疫途径阻断grp对肿瘤细胞的效应可能会成为肿瘤治疗的另一途径,我们选择人蛙皮素样肽grp的c端十肽(grp-10)作为特异性的抗原,并将这10肽重复串联排列,以增加疫苗分子中抗原表位的浓度。
由于单独用mgm-csf或grp6免疫原性相对较低,且从多个位点共同作用于肿瘤已经成为趋势。本发明将mgm-csf基因同grp6基因连接起来,组建第一章pet28a-mgm-csf-grp6重组质粒,诱导表达融合蛋白,将其作为疫苗刺激机体产生主动免疫,打破免疫耐受,产生针对mgm-csf和grp特异性肽段的抗体,从而抑制肿瘤的生长。
技术实现要素:
本发明公开一种表达重组mgm-csf和grp6融合蛋白的基因工程菌。
本发明的一个目的是提供该重组菌的制备方法,方法简便,易于操作。
本发明的另一个目的是公开该重组蛋白的纯化方法。
在本发明的第一个方面,该大肠杆菌菌株命名为escherichiacolibl21/pet28a-mg6:pet28a-mgm-csf-grp6,菌株已提交中国典型培养物保藏中心,保藏地址:中国、武汉、武汉大学。保藏日期:2017年1月10日,保藏编号为cctccno:m2017021,分类命名为escherichiacolibl21/pet28a-mg6:pet28a-mgm-csf-grp6,其细胞中含有重组质粒pet28a-mgm-csf-grp6,质粒中含有seqidno.1所示的重组mgm-csf-grp6基因序列。
在本发明的第二个方面,提供了该重组质粒的制备方法,其技术路线详述如下:
1.重组质粒pet28a-mgm-csf-grp6及相应基因工程菌的构建
根据本实验室已有的关于重组质粒pet-28a-mgm-csf-x(10)-βhcgctp37的序列信息,利用引物设计软件primer5和oligo7来设计引物v1、v2。上游引物v1中引入ncoi,下游引物v2中引入nhei酶切位点以及柔性肽dptgg。采用pcr技术从pet-28a-mgm-csf-x(10)-βhcgctp37质粒中克隆得到基因mgm-csf。通过酶切、酶连反应将目的基因mgm-csf插入pet28a-vegfi-m2-grp6质粒载体的相应酶切位点中,得到重组质粒pet28a-mgm-csf-grp6,将重组质粒转化大肠杆菌e.colibl21获得需要的重组基因的工程菌。
2.融合蛋白的诱导表达
将重组工程菌进行活化,接种至含硫酸卡那霉素的lb培养基中震荡培养过夜,按1∶100转接于新鲜lb培养液中,37℃培养至od600值为0.5-0.8时,加入乳糖(终浓度7mm)进行诱导表达,6h后离心收取菌体沉淀,进行15%sds-page分析,观察目的蛋白条带位置和表达量。
3.融合蛋白的分离纯化
收集菌体,每克湿菌体加入10ml菌体裂解缓冲液溶解,菌体超声裂解,离心收集沉淀。沉淀重悬于含2m尿素的包涵体洗涤液中,离心收集沉淀溶于含6m盐酸胍的包涵体裂解液中,通过稀释复性至不含盐酸胍,离心后上清液过阴离子交换柱deae-cellulose做进一步纯化,用浓度梯度为0-1mnacl层析缓冲液梯度洗脱,收集洗脱峰,检测合并目的蛋白峰组分,蒸馏水充分透析后冻干保存。
附图说明
图1重组质粒构建原理示意图。
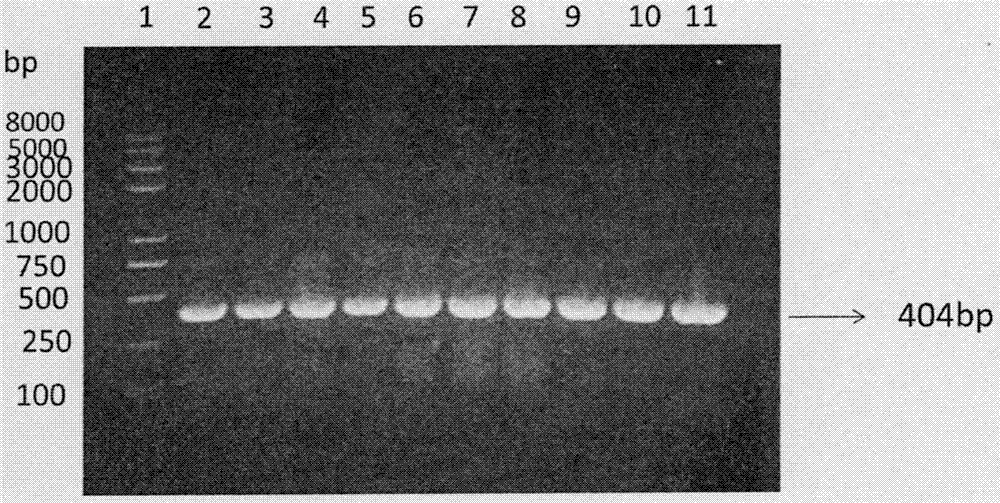
图20.8%琼脂糖凝胶电泳检测pcr产物mgm-csf基因图。
lane1:dnamarker,
lane2-11:在58℃,59℃,60℃,61℃,62℃,63℃,64℃,65℃,66℃,67℃退火温度下mgm-csf的pcr产物
图30.8%琼脂糖凝胶电泳检测mgm-csf-grp6目的基因图。
lane1:proteinmarker,lane2:重组质粒mgm-csf-grp6的菌落pcr产物
图40.8%琼脂糖凝胶电泳重组质粒限制性酶切酶验证图。
lane1:proteinmarker,lane2:ncoi单酶切验证,
lane3:ncoi、hindiii双酶切得到mg6基因
图5重组质粒pet28a-mgm-csf-grp6基因的正向测序图。
图615%sds-page电泳检测重组菌经乳糖诱导表达融合蛋白的诱导曲线。
lane1:proteinmarker,lane2:诱导前的全菌蛋白样品,
lane3-10:诱导后1-8h每个小时的全菌蛋白样品
图715%sds-page电泳检测融合蛋白破碎后图。
lane1:proteinmarker,lane2:诱导前全菌蛋白,
lane3:诱导后6h全菌蛋白,lane4:超声破碎后离心上清,
lane5:超声破碎后沉淀
图815%sds-page电泳检测尿素洗涤浓度图。
tane1:proteinmarker
lane3,5,7,9:0.5m,1m,1.5m,2m尿素洗涤后的沉淀,
lane2,4,6,8:0.5m,1m,1.5m,2m尿素洗涤后的上清
图915%sds-page电泳检测mgm-csf-grp6蛋白纯化图。
lane1:proteinmarker,lane2:纯化后的mgm-csf-grp6蛋白
具体实施方式
材料
(1)菌株
载体pet-28a-mgm-csf-x(10)-βhcgctp37,escherichiacolibl21,菌株pet28a-vegfi-m2-grp6均为本实验室保存。
(2)工具酶和试剂
分子克隆工具酶为fermentas公司产品;质粒抽提试剂盒为上海捷瑞生物科技有限公司;产物纯化试剂盒以及pcr胶回收试剂盒为上海生工生物科技有限公司的产品。
(3)培养基
lb培养基,配方见参考文献sambrookj,fristshef,maniatist.molecularcloning;alaboratorymanual2nded.ny:coldspringharborlaboratorypress,1989。
本说明书所提及的方法中质粒提取、pcr反应、内切酶酶切、pcr产物的回收、连接酶连接和转化大肠杆菌,这些都是基因工程研究领域的常规操作方法,具体参见sambrookj,fristshef,maniatist.molecularcloning;alaboratorymanual2nded.ny:coldspringharborlaboratorypress,1989,pp.16-340。
实施例1mgm-csf基因的克隆
根据本实验室已构建的关于pet-28a-mgm-csf-x(10)-βhcgctp37的序列信息,利用引物设计软件primer、oligo分别设计两对引物v1、v2:
v1:5′-catgccatggcacccacccgct-3′22bp
v2:5′-cggctagcgccaccagtcggatctt-3′25bp
上游引物v1中引入酶切位点ncoi,下游v2中引入酶切位点nhei以及柔性肽dptgg。用质粒提取试剂盒提取质粒pet-28a-mgm-csf-x(10)-βhcgctp37。利用引物v1、v2克隆mgm-csf基因,pcr反应体系见表1,反应参数见表2。
表1mgm-csf-dptggpcr反应体系
表2mgm-csf-dptggpcr反应参数
0.8%琼脂糖凝胶电泳鉴定pcr产物,条带位置与预期的404bp一致。(参见说明书附图2)
通过切胶回收获得目的片段mgm-csf-dptgg,将目的片段和pet28a-vegfi-m2-grp6载体质粒分别经ncoi、nhei双酶切,双酶切反应体系见表3、表4。
表3mgm-csf-dptgg基因双酶切反应体系
表4pet28a-vegfi-m2-grp6双酶切反应体系
酶切产物通过pcr产物纯化试剂盒纯化,琼脂糖凝胶电泳分别回收目的基因片段与载体基因片段后用e.colidna连接酶4℃连接,用冷cacl2法制备大肠杆菌bl21的感受态细胞,将酶连产物转化感受态细胞后涂布到含卡那霉素的lb固体培养基上,37℃过夜培养后挑取单菌落,将单菌落接种至lb液体培养基中,培养过夜,提取质粒,分别通过pcr、单酶切和双酶切等方法初筛阳性克隆,并送至生工测序公司进行测序,测序结果经软件比对后完全正确。(参见说明书附图3,附图4,附图5)
实施例2mgm-csf-grp6基因在大肠杆菌中的表达及培养
重组菌以1%接种量在液体lb培养基试管中37℃振荡培养过夜,再以1%的接种量转接摇瓶大批培养,培养4h后加入终浓度为7mm乳糖诱导表达,诱导6h后收集菌体,留样进行sds-page分析。融合蛋白在诱导后6h达到稳定的最大表达量,通过bandscan软件分析融合蛋白的表达量可达菌体总蛋白量的54.3%。(参见说明书附图6)
实施例3融合蛋白的初步分离纯化
挑选高表达量菌株,接种于lb培养基中,37℃过夜培养;过夜培养液转接入lb培养基,37℃扩大培养,选取最优发酵条件获得发酵菌体。5000r/min离心15min,上清及沉淀均留样。将沉淀用配制好的菌体裂解液(10ml/g菌体)溶解,超声裂解菌体。12000r/min离心20min,收集上清及沉淀均留样标记。sds-page电泳结果显示目的蛋白主要存在于菌体沉淀中,故可判断融合蛋白为包涵体表达。(参见说明书附图7)
实施例4包涵体的溶解及复性
取重组菌裂解液离心后沉淀重悬于含有0.5m、1m、1.5m、2m尿素的包涵体洗涤液(含20mmtris-hcl,1mmedta,ph8.0)中,搅拌1h后,12000r/min离心10min,上清和沉淀进行sds-page检测。包涵体用双蒸水洗涤两次,离心后取沉淀复溶于含有6m盐酸胍的包涵体溶解液(含20mmtris-hcl,1mmedta,ph8.0)中,4℃磁力搅拌过夜,12000r/min离心15min,收集上清。将收集的上清用复性缓冲液(含ph8.0tris-hcl20mmol/l,edta5mmol/l)进行稀释复性,复性缓冲液中加入含氧化型谷胱甘肽和还原型谷胱甘肽至终浓度分别为0.1mmol/l和1mmol/l,依次将盐酸胍的浓度梯度降低至4、2、1、0.5mol/l,最后用ph8.0tris-hcl20mmol/l缓冲液透析过夜,离心取上清,获得复性后的目的蛋白。(参见说明书附图8)
实施例5deae-52阴离子交换层析
本实验采用的deae52是弱酸型阴离子交换剂,将deae-52用naoh、hcl和naoh分别处理后用蒸馏水将其洗至中性,再将deae-52装入层析柱中,层析柱上端进液口连接恒流泵,下出口连接核酸蛋白检测仪,利用离子交换缓冲液(ph8.0,20mmtris-hcl)进行层析柱的平衡,平衡完毕后以1ml/min的速度进行蛋白溶液的上样操作,上样后重复平衡操作,再用nacl(0-1m)进行梯度洗脱,收集洗脱峰留样,进行sds-page电泳分析。
实施例6脱盐冻干
收集蛋白纯度较高的洗脱液,4℃对ro水其用透析过夜,将透析后的洗脱液在冻干机中冻干,刮取蛋白干粉冷冻保存并进行sds-page电泳分析。(参见说明书附图9)
除上述事实外,本发明还可以有其他实施方式,凡采用等同替换或等效变换性的技术方案,均落于本发明要求的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!