利用合成气或其它气态碳源和甲醇的方法和有机体与流程
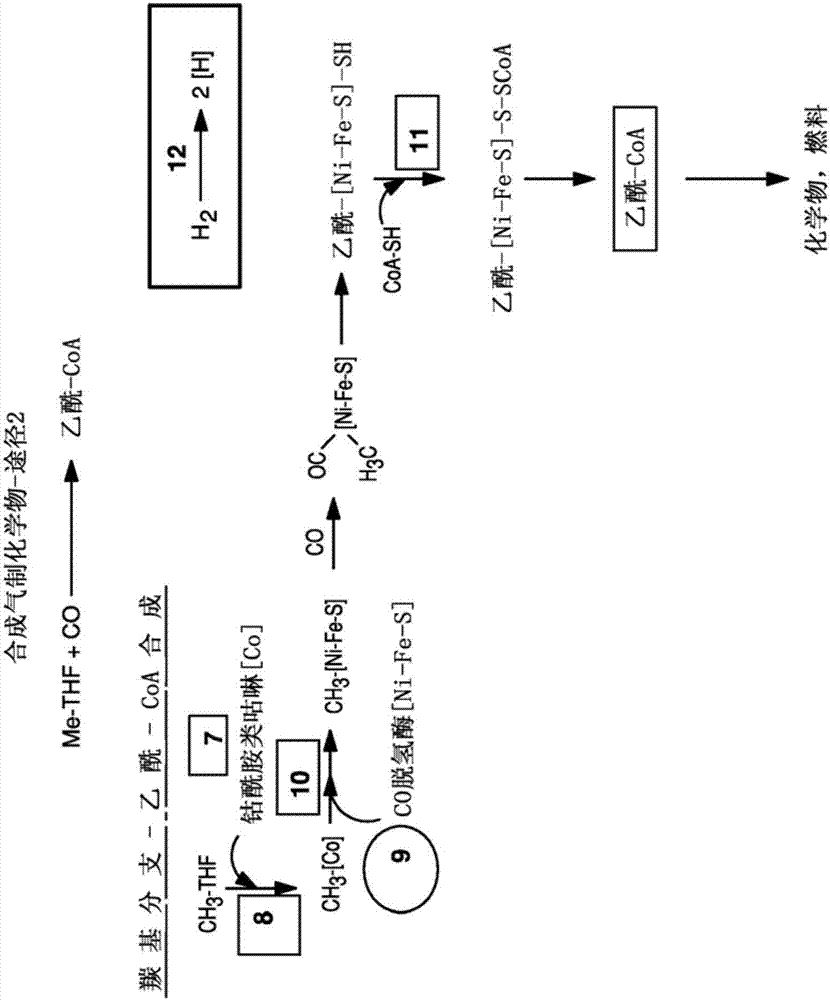
本申请是申请日为2009年1月22日、申请人为基因组股份公司、发明名称为“利用合成气或其它气态碳源和甲醇的方法和有机体”的中国专利申请200980110100.7的分案申请。本申请案主张2008年1月22日申请的美国临时申请案第61/022,804号和2008年6月5日申请的美国临时申请案第61/059,256号的优先权,其全部内容各自以引用的方式并入本文。本发明一般涉及生物合成方法,且更特定地涉及能够使用合成气或其它气态碳源和甲醇的有机体。
背景技术:
:合成气体(合成气)是主要由h2和co组成的混合物,可经由气化任何有机进料,例如煤、煤油、天然气、生物质或有机废物来获得。已经开发出众多气化方法,且大部分设计是基于在高温(500-1500℃)下部分氧化(其中限制氧气含量以避免完全燃烧)有机物质以提供作为0.5:1-3:1h2/co混合物的合成气。有时候添加蒸汽以增加氢气含量,这通常伴随着经水煤气变换反应增加co2产量。现今,煤是用于工业制造合成气的主要基质,而合成气传统上用于加热和供能,并且用作甲醇和液态烃的费托合成(fischer-tropschsynthesis)的原料。许多大型化学和能源公司大规模地利用煤气化方法,并在工业上应用这种技术。除煤以外,许多类型的生物质也用于产生合成气。例如合成气和co2等气态基质代表着可用于以生物学方法制造再生化学物和燃料的最廉价且取材最灵活的原料。在第二次世界大战期间,有超过一百万个的小规模生物质气化装置投入运行,主要是在欧洲,用于驱动小汽车、卡车、轮船和公共汽车。目前有至少3种主要的生物质气化技术已被验证在工业规模下(>20,000,000磅生物质/年)有效或正处在被验证的过程中。生物质气化技术正在进行商业实践,尤其用于热量和能量产生。生物质气化技术与燃料或化学物制造的整合还在开发中,且尚未被证明以商业规模广泛应用。总的来说,在几乎世界上任何地点,从包括煤、生物质、废物、聚合物等在内的众多物质节省成本地产生合成气的技术当前是存在的。因为可以从包括生物质在内的大多数有机物质产生合成气,所以使用合成气的好处包括取材灵活。另一个好处在于合成气很便宜,每百万英热单位的成本为≤$6,表示每磅产物的原料成本为≤$0.10。另外,还存在有效利用合成气的已知途径,正如在例如梭菌属(clostridiumspp.)等有机体所发现的。虽然可以获得利用合成气的有机体,但一般来说,已知有机体的特征不清楚且不是非常适用于商业开发。举例来说,梭菌和相关细菌是严格厌氧菌,无法耐受高浓度的某些产物(例如丁醇),因此限制了滴定度和商业化潜力。梭菌还产生很多种产物,这在获得期望产物方面带来了分离问题。最后,用于操作梭菌基因的灵巧基因工具的开发尚处在初期;因此,它们不能容易地经受基因工程以便改进期望产物的产率或生产特征。因此,需要开发可利用合成气或其它气态碳源来产生期望化学物和燃料的微生物和其使用方法。更特定地说,需要开发用于合成气利用的微生物,其还具有现有的有效基因工具,使其能够经受快速工程改造以便以有用的速率和数量产生有价值产物。本发明满足此项需求且提供相关优势。技术实现要素:本发明提供一种非天然存在的微生物有机体,其具有乙酰-coa途径且能够利用合成气或合成气和甲醇。在一实施方案中,本发明提供一种非天然存在的微生物,其包含一种或多种赋予所述微生物将co、co2和/或h2转化为乙酰辅酶a(乙酰-coa)、甲基四氢叶酸(甲基-thf)或其它期望产物的途径的外源蛋白质,其中在不存在所述一种或多种外源蛋白质的情况下,所述微生物缺乏将co或co2和h2转化为乙酰-coa或甲基四氢叶酸的能力。举例来说,微生物有机体可含有至少一种编码乙酰-coa途径中的酶或蛋白质的外源核酸。微生物有机体能单独利用包含co、co2和/或h2的合成气或组合利用合成气和甲醇以产生乙酰-coa。本发明另外提供一种产生乙酰-coa的方法,例如通过培养产生乙酰-coa的微生物有机体,其中所述微生物有机体在用于产生乙酰-coa的条件和足够时间下足量表达至少一种编码乙酰-coa途径酶或蛋白质的外源核酸以产生乙酰-coa。附图说明图1显示利用合成气作为碳源的示例性wood-ljungdahl途径。描绘甲基分支,其显示利用合成气产生甲基-四氢叶酸(me-thf)。所述甲基分支所涉及的酶依据图中所示编号分别为:1.铁氧还蛋白氧化还原酶、2.甲酸脱氢酶、3.甲酰四氢叶酸合成酶、4.次甲基四氢叶酸环化脱水酶、5.亚甲基四氢叶酸脱氢酶、和6.亚甲基四氢叶酸还原酶。图2显示利用合成气作为碳源的示例性wood-ljungdahl途径。描绘羰基分支,其显示利用合成气产生乙酰辅酶a(乙酰-coa)。氢化酶(12)是合成气的氢转化为还原当量所必需的,而还原当量是许多所述反应所必需的。所述羰基分支所涉及的酶依据图中所示编号分别是:7.钴酰胺类咕啉/铁硫蛋白、8.甲基转移酶、9.一氧化碳脱氢酶、10.乙酰-coa合成酶、11.乙酰-coa合成酶二硫键还原酶、和12.氢化酶。图3显示代谢途径图解,其描绘wood-ljungdahl和丁醇产生途径的整合。能利用合成气生长的有机体典型地独有的转化有:1)co脱氢酶,2)氢化酶,3)能量守恒氢化酶(ech),和4)双功能co脱氢酶/乙酰-coa合成酶。图4a和图4b显示描绘利用合成气产生丁醇的过程的图解。图4a显示合成气产丁醇过程的方块流程图。图4b显示气化器的细节。asu代表气体分离单元。图5显示建议的对深红红螺菌(rhodospirillumrubrum)的聚羟基丁酸(phb)途径的改造,以便形成1-丁醇。粗体箭头指示经由异源表达形成丙酮丁醇梭菌(clostridiumacetobutylicum/c.acetobutylicum)的1-丁醇途径的4-基因操纵子而引入的反应步骤。所用的缩写有:phb,聚β-羟基丁酸;phbc,phb合成酶;crt,巴豆酸酶;bcd,丁酰辅酶a脱氢酶;etf,电子传递黄素蛋白;adhe2,醛/醇脱氢酶。图6显示完全wood-ljungdahl途径,其允许包含co、co2和/或h2的气体转化为乙酰-coa,乙酰-coa随后可被转化为例如乙醇或乙酸等细胞物质和产物。可经工程改造为生产宿主中的示例性的特异性酶促转化被编号。缩写:10fthf,10-甲酰四氢叶酸;5mthf,5-甲基四氢叶酸;actp,乙酰磷酸;for,甲酸;methf,亚甲基四氢叶酸;mlthf,次甲基四氢叶酸;thf,四氢叶酸。所述途径所涉及的酶依据图中所示编号分别为:1)甲酸脱氢酶、2)甲酰四氢叶酸合成酶、3)次甲基四氢叶酸环化水解酶、4)亚甲基四氢叶酸脱氢酶、5)亚甲基四氢叶酸还原酶、6)甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse)、7)类咕啉铁硫蛋白(acsd)、8)镍蛋白装配蛋白(acsf&cooc)、9)铁氧还蛋白(orf7)、10)乙酰-coa合成酶(acsb&acsc)、11)一氧化碳脱氢酶(acsa)、12)丙酮酸铁氧还蛋白氧化还原酶(por)、和13)氢化酶(hyd)。图7显示合成代谢途径,其允许包含co、co2和/或h2的气体和甲醇转化为乙酰-coa。可经工程改造为生产宿主的特异性酶促转化被编号。其它缩写:meoh,甲醇。所述途径所涉及的酶依据图中所示编号分别为:1)甲醇甲基转移酶(mtab)、2)类咕啉蛋白(mtac)、3)甲基四氢叶酸:类咕啉蛋白甲基转移酶(mtaa)、4)甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse)、5)类咕啉铁硫蛋白(acsd)、6)镍蛋白装配蛋白(acsf&cooc)、7)铁氧还蛋白(orf7)、8)乙酰-coa合成酶(acsb&acsc)、9)一氧化碳脱氢酶(acsa)、10)丙酮酸铁氧还蛋白氧化还原酶(por)、和11)氢化酶(hyd)。图8显示将甲醇、co和co2转化为细胞物质(cellmass)和发酵产物的途径(目标1)。图9显示10μgacs90(泳道1)、acs91(泳道2)、mta98/99(泳道3和4)的细胞提取物、大小标准物(泳道5)和热乙酸穆尔氏菌(m.thermoacetica)codh(moth_1202/1203)或mtr(moth_1197)蛋白的对照(50、150、250、350、450、500、750、900和1000ng)的western印迹。图10显示co氧化分析结果。培养细胞(具有codh/acs操纵子的热乙酸穆尔氏菌或大肠杆菌;acs90或acs91或空白载体pza33s)并制备提取物。在55℃在提取物制备当天的各个时间点执行分析。历经120秒的时间,在578nm下跟踪甲基紫精的还原。图11显示合成代谢途径,其用于将包含co、co2和/或h2的气体和甲醇转化为乙酰-coa并进一步转化为4-羟基丁酸。其中所述途径所涉及的酶依据图中所示编号分别为:1)甲醇甲基转移酶(mtab)、2)类咕啉蛋白(mtac)、3)甲基四氢叶酸:类咕啉蛋白甲基转移酶(mtaa)、4)甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse)、5)类咕啉铁硫蛋白(acsd)、6)镍蛋白装配蛋白(acsf&cooc)、7)铁氧还蛋白(orf7)、8)乙酰-coa合成酶(acsb&acsc)、9)一氧化碳脱氢酶(acsa)、10)丙酮酸铁氧还蛋白氧化还原酶(por)、11)氢化酶(hyd)、12)乙酰乙酰-coa硫解酶(atob)、13)3-羟基丁酰-coa脱氢酶(hbd)、14)巴豆酸酶(crt)、15)巴豆酰-coa水合酶(4-budh)、16)4-羟基丁酰-coa转移酶、17)磷酸转-4-羟基丁酰酶、和18)4-羟基丁酸激酶。图12显示合成代谢途径,其用于将包含co、co2和/或h2的气体和甲醇转化为乙酰-coa并进一步转化为1,4-丁二醇。其中所述途径所涉及的酶依据图中所示编号分别为:1)甲醇甲基转移酶(mtab)、2)类咕啉蛋白(mtac)、3)甲基四氢叶酸:类咕啉蛋白甲基转移酶(mtaa)、4)甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse)、5)类咕啉铁硫蛋白(acsd)、6)镍蛋白装配蛋白(acsf&cooc)、7)铁氧还蛋白(orf7)、8)乙酰-coa合成酶(acsb&acsc)、9)一氧化碳脱氢酶(acsa)、10)丙酮酸铁氧还蛋白氧化还原酶(por)、11)氢化酶(hyd)、12)乙酰乙酰-coa硫解酶(atob)、13)3-羟基丁酰-coa脱氢酶(hbd)、14)巴豆酸酶(crt)、15)巴豆酰-coa水合酶(4-budh)、16)4-羟基丁酰-coa还原酶(醇形成型)、17)4-羟基丁酰-coa还原酶(醛形成型)、和18)1,4-丁二醇脱氢酶。图13显示合成代谢途径,其用于将包含co、co2和/或h2的气体转化为乙酰-coa并进一步转化为4-羟基丁酸。其中所述途径所涉及的酶依据图中所示编号分别为:1)甲酸脱氢酶、2)甲酰四氢叶酸合成酶、3)次甲基四氢叶酸环化水解酶、4)亚甲基四氢叶酸脱氢酶、5)亚甲基四氢叶酸还原酶、6)甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse)、7)类咕啉铁硫蛋白(acsd)、8)镍蛋白装配蛋白(acsf&cooc)、9)铁氧还蛋白(orf7)、10)乙酰-coa合成酶(acsb&acsc)、11)一氧化碳脱氢酶(acsa)、12)丙酮酸铁氧还蛋白氧化还原酶(por)、13)氢化酶(hyd)、14)乙酰乙酰-coa硫解酶(atob)、15)3-羟基丁酰-coa脱氢酶(hbd)、16)巴豆酸酶(crt)、17)巴豆酰-coa水合酶(4-budh)、18)4-羟基丁酰-coa转移酶、19)磷酸转-4-羟基丁酰酶、和20)4-羟基丁酸激酶。图14显示合成代谢途径,其用于将包含co、co2和/或h2的气体转化为乙酰-coa并进一步转化为1,4-丁二醇。其中所述途径所涉及的酶依据图中所示编号分别为:1)甲酸脱氢酶、2)甲酰四氢叶酸合成酶、3)次甲基四氢叶酸环化水解酶、4)亚甲基四氢叶酸脱氢酶、5)亚甲基四氢叶酸还原酶、6)甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse)、7)类咕啉铁硫蛋白(acsd)、8)镍蛋白装配蛋白(acsf&cooc)、9)铁氧还蛋白(orf7)、10)乙酰-coa合成酶(acsb&acsc)、11)一氧化碳脱氢酶(acsa)、12)丙酮酸铁氧还蛋白氧化还原酶(por)、13)氢化酶(hyd)、14)乙酰乙酰-coa硫解酶(atob)、15)3-羟基丁酰-coa脱氢酶(hbd)、16)巴豆酸酶(crt)、17)巴豆酰-coa水合酶(4-budh)、18)4-羟基丁酰-coa还原酶(醇形成型)、19)4-羟基丁酰-coa还原酶(醛形成型)、和20)1,4-丁二醇脱氢酶。具体实施方式本发明涉及开发和使用能够利用合成气或其它气态碳源产生期望产物的微生物。本发明另外涉及扩展利用合成气的微生物的产物范围和产生能够利用合成气产生期望产物且优化产物的产量、滴定度和生产率的重组有机体。可有效利用合成气作为生长和化学制备的基质的重组有机体,例如大肠杆菌(escherichiacoli)或其它适合于商业规模化的有机体的研制为产生可再生的化学物和燃料提供了具有成本优势的方法。这些有机体可经优化且以合理的成本快速测试。合成气用作进料的巨大潜力在于其能够有效且节省成本地转化为目的化学物和燃料。合成气转化的两种主要技术是费托法和发酵法。费托(f-t)技术自从第二次世界大战就已被开发出来,其涉及基于无机物和金属的催化剂,从而允许有效地产生甲醇或混合烃作为燃料。f-t方法的缺点在于:1)缺乏产物选择性,导致难以分离期望产物;2)催化剂容易中毒;3)因为需要高温和高压,所以能源成本很高;和4)在具有商业竞争力的成本下可获得的产物的范围很有限。对于发酵法,已显示合成气可在能将其转化为例如乙醇、乙酸和氢气等产物的许多厌氧微生物中用作碳源和能源(参看下文和表1)。合成气的发酵转化的主要好处有:有机体选择性地产生单一产物,对合成气杂质的耐受性较大,操作温度和压力较低,和可能从合成气获得大量产物。发酵法的主要缺点在于,已知能转化合成气的有机体倾向于只产生有限范围的化学物(例如乙醇和乙酸),且不能有效地产生其它化学物;有机体缺乏基因操作的公认工具;且有机体对高浓度的最终产物敏感。本发明涉及产生可有效地从合成气或其它气态碳源产生期望产物(包括化学物和燃料)的微生物。本发明的有机体和方法允许与基于石油的传统产物和直接衍生自葡萄糖、蔗糖或木质纤维素糖的产物相比,显著节省成本地产生化学物和燃料。在一实施方案中,本发明提供一种非天然存在的微生物,其能够利用合成气或其它气态碳源产生期望产物,其中所述母体微生物缺乏利用合成气的天然能力(参看实施例viii)。在所述微生物中,一种或多种蛋白质或酶在微生物中表达,从而赋予利用合成气或其它气态碳源产生期望产物的途径。在其它实施方案中,本发明提供一种经基因修饰的非天然存在的微生物,其例如通过表达一种或多种外源蛋白质或酶,从而使期望产物的产生效率提高,其中所述母体微生物具有利用合成气或其它气态碳源产生期望产物的能力。因此,本发明涉及产生具有能利用合成气的新颖代谢途径的微生物,以及产生利用合成气或其它气态碳源产生期望产物的效率得到提高的微生物。本发明另外提供一种非天然存在的微生物,其表达编码以下的基因:与mtaabc型甲基转移酶系统一起催化wood-ljungdahl途径的羰基分支的酶,和与所述羰基分支有关的蛋白质。所述有机体能将甲醇(一种可来源于合成气的相对廉价的有机原料)和包含co、co2和/或h2的气体转化为乙酰-coa、细胞物质和产物。大肠杆菌是工业工作母体有机体(workhorseorganism),具有无与伦比的一套基因工具。将合成气转化为乙酰-coa(重要代谢物,可由其获得所有细胞物质组分和许多有价值的产物)的能力可被工程改造入外部宿主,例如大肠杆菌,其随后表达编码wood-ljungdahl途径的各种蛋白质的外源基因。所述途径在例如热乙酸穆尔氏菌(moorellathermoacetica)(以前称作热乙酸梭菌(clostridiumthermoaceticum))等产乙酸有机体中高度活跃,热乙酸穆尔氏菌早在1942年被分离出时就作为阐明wood-ljungdahl途径的模型有机体(fontaine等人,jbacteriol.43:701-715(1942))。wood-ljungdahl途径包含两个分支:东部或甲基分支,其允许co2转化为甲基四氢叶酸(me-thf);和西部或羰基分支,其允许甲基四氢叶酸、co和辅酶a转化为乙酰-coa(参见图1和2)。如本文所公开,本发明提供一种非天然存在的微生物,其表达催化wood-ljungdahl途径的两个分支的基因。所述有机体能将包含co、co2和/或h2的气体转化为乙酰-coa、细胞物质和产物。本发明另外提供一种非天然存在的微生物,其表达与mtaabc型甲基转移酶系统一起催化wood-ljungdahl途径的羰基分支的酶的编码基因。所述有机体能将甲醇(一种可来源于合成气的相对廉价的有机原料)和包含co、co2和/或h2的气体转化为乙酰-coa、细胞物质和产物。合成气也称为发生炉煤气,是煤和碳质材料(例如生物质材料,包括农作物和残余物)的主要气化产物。合成气是主要由h2和co组成的混合物,可经由气化任何有机原料,包括(但不限于)煤、煤油、天然气、生物质和有机废物来获得。气化通常在高燃料/氧气比下进行。虽然合成气主要是h2和co,但也可包含少量的co2和其它气体。因此合成气提供一种节省成本的气态碳源,例如co和co2。如本文所公开,例如包含co和/或co2的合成气等气态碳源可被本发明的非天然存在的微生物利用以产生期望产物。虽然碳源在本文中一般例示为合成气,但应了解任何包含co和/或co2的气态碳源都可被本发明的非天然存在的微生物利用。因此,本发明涉及能利用co和/或co2作为碳源的非天然存在的微生物。wood-ljungdahl途径催化co和h2转化为乙酰-coa和其它产物,例如乙酸。能利用co和合成气的有机体一般也具有经由wood-ljungdahl途径所涵盖的相同的一组基础酶和转化作用利用co2和co2/h2混合物的能力。微生物依赖于h2将co2转化为乙酸早在co也可被相同的微生物利用且涉及相同的途径揭示之前已被公认。已显示许多产乙酸菌可在co2存在下生长且产生例如乙酸等化合物,只要存在氢以便供应必需的还原当量即可(参见例如drake,acetogenesis,第3-60页,chapmanandhall,newyork,(1994))。这可由以下等式概括:2co2+4h2+nadp+npi→ch3cooh+2h2o+natp因此,具有wood-ljungdahl途径的非天然存在的微生物也可利用co2与h2的混合物来产生乙酰-coa和其它期望产物。wood-ljungdahl途径在本领域中为人所熟知,且由可分为2个分支的12个反应组成:(1)甲基分支和(2)羰基分支。甲基分支将合成气转化为甲基四氢叶酸(甲基-thf),而羰基分支则将甲基四氢叶酸转化为乙酰-coa。甲基分支中的反应是由以下酶或蛋白质依次催化:铁氧还蛋白氧化还原酶、甲酸脱氢酶、甲酰四氢叶酸合成酶、次甲基四氢叶酸环化脱水酶、亚甲基四氢叶酸脱氢酶和亚甲基四氢叶酸还原酶。羰基分支中的反应是由以下酶或蛋白质依次催化:甲基四氢叶酸:类咕啉蛋白甲基转移酶(例如acse)、类咕啉铁硫蛋白、镍蛋白装配蛋白(例如acsf)、铁氧还蛋白、乙酰-coa合成酶、一氧化碳脱氢酶和镍蛋白装配蛋白(例如cooc)。按照本文提供的关于引入足够数量的编码核酸以便产生乙酰-coa途径方面的教导和指导,所属领域技术人员将了解,也可实施同样的工程设计导入宿主有机体中没有的编码wood-ljungdahl酶或蛋白质的核酸。因此,将一种或多种编码核酸引入到本发明的微生物有机体中,以致经修饰的有机体含有一个分支或完全wood-ljungdahl途径,这会赋予合成气利用能力。因此,本发明的非天然存在的微生物可利用合成气或其它提供co和/或co2的气态碳源来产生期望产物。在co2的情况下,其它来源包括(但不限于)氨气和氢气工厂里作为副产物产生的co2,其中甲烷转化为co2;木材和化石燃料的燃烧;啤酒、威士忌和其它酒精饮料酿造过程中或其它发酵过程中作为糖发酵副产物产生的co2;石灰cao制造中石灰石caco3的热分解;磷酸钠制造中作为副产物产生的co2;和直接来自于天然二氧化碳来源,其中二氧化碳是通过酸化水对石灰石或白云石的作用而产生。当关于本发明的微生物有机体或微生物使用时,如本文所用的术语“非天然存在”欲意谓微生物有机体具有至少一处在天然存在的所提及物种的菌株(包括所提及物种的野生型菌株)中通常未发现的基因变异。基因变异包括例如引入可表达的编码代谢多肽的核酸的修饰、其它核酸添加、核酸缺失和/或微生物遗传物质的其它功能性破坏。所述修饰包括例如所提及物种的异源、同源或异源与同源多肽的编码区和其功能片段。其它修饰包括例如非编码调控区,其中修饰会改变基因或操纵子的表达。示例性代谢多肽包括乙酰-coa生物合成途径内的酶或蛋白质。代谢修饰是指自天然存在的状态发生改变的生化反应。因此,非天然存在的微生物可具有对编码代谢多肽的核酸或其功能片段的基因修饰。本文公开了示例性代谢修饰。当关于微生物有机体或微生物使用时,如本文所用的术语“经分离的”欲意谓有机体基本上不含在自然界中发现所提及的微生物有机体时所伴随的至少一种组分。所述术语包括移除自然环境中所伴随的部分或所有组分的微生物有机体。所述术语还包括移除非天然存在的环境中伴随微生物有机体的部分或所有组分的微生物有机体。因此,分离的微生物有机体是在自然界中发现时或在非天然存在的环境中生长、储存或生存时与其它物质部分或完全分离。经分离的微生物有机体的特定实例包括部分纯的微生物、基本上纯的微生物和在非天然存在的培养基中培养的微生物。如本文所用的术语“微生物性”、“微生物有机体”或“微生物”欲意谓以古菌域、细菌域或真核域内所包括的显微细胞形式存在的任何有机体。因此,所述术语欲涵盖具有显微尺寸的原核或真核细胞或有机体,且包括所有种类的细菌、古细菌和真细菌,以及真核微生物,例如酵母和真菌。所述术语还包括可经培养以用于产生生化物质的任何种类的细胞培养物。如本文所用的术语“coa”或“辅酶a”欲意谓有机辅因子或辅基(酶的非蛋白质部分),其存在为许多酶(脱辅基酶蛋白)形成活性酶系统的活性所必需。辅酶a在某些缩合酶中,在乙酰基或其它酰基转移中,在脂肪酸合成和氧化,在丙酮酸氧化中和在其它乙酰化作用中发挥功能。当关于培养或生长条件使用时,如本文所用的术语“基本上厌氧”欲意谓液体培养基中的含氧量小于溶解氧饱和含量的约10%。所述术语还打算包括维持在小于约1%氧气的气氛下的液体或固体培养基的密封室。如本文所用的“外源”欲意谓所提及的分子或所提及的活性是引入到宿主微生物有机体中。分子可例如通过将编码核酸引入到宿主遗传物质中而引入,例如通过编码核酸整合到宿主染色体中或编码核酸作为非染色体遗传物质(例如质粒)。因此,在关于编码核酸的表达使用时,所述术语是指将编码核酸以可表达形式引入到微生物有机体中。当关于生物合成活性使用时,所述术语是指活性被引入到宿主参考有机体中。来源可为例如同源或异源编码核酸,其在引入到宿主微生物有机体中之后表达所提及的活性。因此,术语“内源”是指所提及的分子或活性是存在于宿主中。类似地,当关于编码核酸的表达使用时,所述术语是指表达微生物有机体内所含的编码核酸。术语“异源”是指分子或活性是来源于除所提及的物种以外的来源,而“同源”是指分子或活性是来源于所述宿主微生物有机体。因此,本发明的编码核酸的外源表达可利用异源编码核酸或同源编码核酸或其两者。本发明的非天然存在的微生物有机体可含有稳定的基因变异,这是指微生物在培养超过5代后仍不会损失所述变异。一般来说,稳定的基因变异包括持续超过10代的修饰,特定来说,稳定的修饰将持续超过约25代,且更特定来说,稳定的基因修饰将持续超过50代,包括无限持续下去。所属领域技术人员将了解,对基因变异(包括本文示例的代谢修饰)的描述是关于合适的宿主有机体(例如大肠杆菌)和其对应的代谢反应,或产生期望遗传物质(例如针对期望代谢途径的基因)的合适来源有机体。然而,鉴于多种有机体的完整基因组测序和基因组学领域中的高度技术水平,所属领域技术人员能够容易地将本文提供的教导和指导应用于基本上所有其它有机体。举例来说,通过并入来自除所提及物种以外的物种的相同或类似的编码核酸,本文示例的大肠杆菌代谢变化可容易地应用于其它物种。所述基因变异一般包括例如种间同源物的基因变异,且特定来说,直系同源物、旁系同源物或非直系同源基因置换。直系同源物是通过垂直家系产生关联且在不同有机体中负责基本上相同或一致的功能的基因。举例来说,小鼠环氧化物水解酶和人类环氧化物水解酶可被视为环氧化物水解的生物功能的直系同源物。例如,当基因共有足量的序列相似性以指示其是同源的,或通过从共同祖先进化而产生关联时,所述基因通过垂直家系产生关联。如果基因具有足量的三维结构相似性但未必具有足量的序列相似性,从而在无法鉴别到一级序列相似性的范围内表明其是进化自共同祖先,那么所述基因也可被视为直系同源物。直系同源的基因可编码序列相似性为氨基酸序列同一性的约25%到100%的蛋白质。如果编码氨基酸相似性小于25%的蛋白质的基因的三维结构也显示相似性,那么其也可被视为是由垂直家系产生的。丝氨酸蛋白酶家族的成员(包括组织纤溶酶原激活物和弹性蛋白酶)被视为是通过垂直家系从共同祖先产生的。直系同源物包括经由例如进化而在结构或总体活性上趋异的基因或其编码的基因产物。举例来说,在一种物种编码展现两种功能的基因产物的情况下,以及在所述功能分离成第二物种中的不同基因的情况下,这三种基因和其对应产物被视为直系同源物。为了产生生物化学产物,所属领域技术人员将了解可对具有欲引入或破坏的代谢活性的直系同源基因进行选择,以便构建非天然存在的微生物。展现可分离活性的直系同源物的一实例是不同活性已在两种或两种以上物种之间或在单一物种内被分离成不同基因产物。一特定实例是弹性蛋白酶蛋白水解和纤溶酶原蛋白水解(两种类型的丝氨酸蛋白酶活性)被分离成作为纤溶酶原激活物和弹性蛋白酶的不同分子。另一实例是支原体5’-3’核酸外切酶和果蝇dna聚合酶iii活性的分离。第一物种的dna聚合物可被视为第二物种的核酸外切酶或聚合酶中一者或两者的直系同源物,且反之亦然。相反,旁系同源物是通过例如复制和随后的进化趋异而产生关联且具有相似或共同、但不完全相同的功能的同源物。旁系同源物可来源于或衍生自例如相同物种或不同物种。举例来说,微粒体环氧化物水解酶(环氧化物水解酶i)和可溶性环氧化物水解酶(环氧化物水解酶ii)可被视为旁系同源物,因为其代表两种共同进化自共同祖先的不同酶,催化不同反应且在相同物种中具有不同功能。旁系同源物是来自相同物种的彼此具有显著序列相似性的蛋白质,表明其是同源的或通过共同进化自共同祖先而产生关联。旁系同源蛋白质家族的分组包括hipa同源物、荧光素酶基因、肽酶等。非直系同源基因置换是来自一个物种的非直系同源基因可取代不同物种中的参考基因功能。取代包括例如能够在起源物种中执行与不同物种中的参考功能相比基本上相同或类似的功能。虽然一般来说,非直系同源基因置换可被鉴别为在结构上与编码参考功能的已知基因相关,但是结构相关性较小但功能类似的基因和其对应的基因产物在本文中使用时仍然处于所述术语的含义内。功能相似性需要例如非直系同源基因产物的活性位点或结合区域与编码设法取代的功能的基因相比具有至少一些结构相似性。因此,非直系同源基因包括例如旁系同源物或无关基因。因此,在鉴别和构建具有乙酰-coa生物合成能力的本发明的非天然存在的微生物有机体的过程中,所属领域技术人员将了解,通过对特定物种应用本文提供的教导和指导,代谢修饰的鉴别可包括直系同源物的鉴别和纳入或失活。只要参考微生物中存在旁系同源物和/或非直系同源基因置换以用于编码催化类似或基本上类似的代谢反应的酶,那么所属领域技术人员也可利用这些进化上相关的基因。直系同源物、旁系同源物和非直系同源基因置换可通过所属领域技术人员熟知的方法来确定。举例来说,检查两种多肽的核酸或氨基酸序列将会揭示所比较序列之间的序列同一性和相似性。基于所述相似性,如果相似性足够高,那么所属领域技术人员可确定蛋白质是通过进化自共同祖先而产生关联。所属领域技术人员熟知的算法(例如align、blast、clustalw等)比较和确定粗略序列相似性或同一性,并且确定序列中可被指派权重或分数的空位的存在或意义。所述算法在本领域中也是已知的,且类似地可用于确定核苷酸序列相似性或同一性。足以确定关联性的相似性的参数是基于用于计算统计相似性的熟知方法,或在随机多肽中发现类似匹配的概率和所确定匹配的意义来计算得出。两种或两种以上序列的计算机比较在必要时也可由所属领域技术人员目测优化。预期相关的基因产物或蛋白质可具有高相似性,例如25%到100%序列同一性。如果扫描足够大小的数据库,那么无关的蛋白质可具有与预期偶然发生的概率基本上相同的同一性(约5%)。5%与24%之间的序列可能代表或可能不代表足以推断所比较序列是相关序列的同源性。可执行鉴于数据集的大小确定所述匹配的意义的其它统计分析,以便确定这些序列的相关性。使用blast算法确定两种或两种以上序列的关联性的示例性参数可例如说明如下。简言之,氨基酸序列比对可使用2.0.8版(1999年1月5日)blastp和以下参数来进行:矩阵:0blosum62;空位开放:11;空位延伸:1;x_扣分:50;期望值:10.0;字长:3;过滤器:开。核酸序列比对可使用2.0.6版(1998年9月16日)blastn和以下参数来进行:匹配:1;错配:-2;空位开放:5;空位延伸:2;x_扣分:50;期望值:10.0;字长:11;过滤器:开。所属领域技术人员知悉,为了增加或降低比较严格度并确定两种或两种以上序列的关联性,可对上述参数作哪些修改。在一实施方案中,本发明提供一种非天然存在的微生物,其包含一种或多种赋予所述微生物将co和/或co2和h2转化为乙酰辅酶a(乙酰-coa)的途径的外源蛋白质,其中在不存在所述一种或多种外源蛋白质的情况下,所述微生物缺乏将co和/或co2和h2转化为乙酰-coa的能力。举例来说,所述一种或多种外源蛋白质或酶可选自钴酰胺类咕啉/铁硫蛋白甲基转移酶、一氧化碳脱氢酶、乙酰-coa合成酶、乙酰-coa合成酶二硫键还原酶和氢化酶(参见图1和实施例vii和viii)。微生物也可表达两种或两种以上、三种或三种以上以及以此类推(包括直到所有)的赋予将co和/或co2和h2转化为乙酰-coa的途径的蛋白质和酶,例如钴酰胺类咕啉/铁硫蛋白甲基转移酶、一氧化碳脱氢酶、乙酰-coa合成酶、乙酰-coa合成酶二硫键还原酶和氢化酶。如本文所公开的本发明的一实施方案涉及产生一种可利用co和/或co2作为碳源以产生期望产物的非天然存在的微生物。举例来说,将wood-ljungdahl途径的羰基和/或甲基分支的蛋白质和酶(图1和2)引入到天然不含wood-ljungdahl酶的微生物中。尤其适用于wood-ljungdahl途径的基因工程的有机体是大肠杆菌,其可用的基因操纵工具和发酵条件已经得到充分表征(参见实施例viii)。在另一实施方案中,本发明提供一种非天然存在的微生物,其包含一种或多种赋予所述微生物将包含co和h2的合成气或其它气态碳源转化为乙酰辅酶a(乙酰-coa)的途径的外源蛋白质,其中所述微生物在不存在所述一种或多种外源蛋白质的情况下,缺乏将co和h2转化为乙酰-coa的能力。所述合成气或其它气体可进一步包含co2。因此,本发明的非天然存在的微生物可包含提高co2、co和/或h2到乙酰-coa的转化效率的途径。此外,本发明提供一种非天然存在的微生物,其包含一种或多种赋予所述微生物将包含co2和h2的气态碳源转化为乙酰-coa的途径的外源蛋白质,其中所述微生物在不存在所述一种或多种外源蛋白质的情况下,缺乏将co2和h2转化为乙酰-coa的能力。气体可进一步包含co。如本文所论述,外源蛋白质可选自钴酰胺类咕啉/铁硫蛋白甲基转移酶、一氧化碳脱氢酶、乙酰-coa合成酶、乙酰-coa合成酶二硫键还原酶和氢化酶。在另一实施方案中,本发明提供一种非天然存在的微生物,其包含一种或多种赋予所述微生物将co和/或co2和h2转化为甲基-四氢叶酸(甲基-thf)的途径的外源蛋白质,其中所述微生物在不存在所述一种或多种外源蛋白质的情况下,缺乏将co和/或co2和h2转化为甲基-四氢叶酸的能力。如本文所公开,所述一种或多种外源蛋白质可选自铁氧还蛋白氧化还原酶、甲酸脱氢酶、甲酰四氢叶酸合成酶、次甲基四氢叶酸环化脱水酶、亚甲基四氢叶酸脱氢酶和亚甲基四氢叶酸还原酶(参见图1和实施例viii)。微生物也可表达两种或两种以上、三种或三种以上以及以此类推(包括直到所有)的赋予将co和/或co2和h2转化为甲基-四氢叶酸的途径的蛋白质和酶,包括至多以下所有酶:铁氧还蛋白氧化还原酶、甲酸脱氢酶、甲酰四氢叶酸合成酶、次甲基四氢叶酸环化脱水酶、亚甲基四氢叶酸脱氢酶和亚甲基四氢叶酸还原酶。本发明另外提供一种非天然存在的微生物,其包含一种或多种赋予所述微生物将包含co和h2的合成气或其它气态碳源转化为甲基-四氢叶酸的途径的外源蛋白质,其中所述微生物在不存在所述一种或多种外源蛋白质的情况下,缺乏将co和h2转化为甲基-四氢叶酸的能力。合成气可进一步包含co2。此外,本发明提供一种非天然存在的微生物,其包含一种或多种赋予所述微生物将包含co2和h2的气态碳源转化为甲基-四氢叶酸的途径的外源蛋白质,其中所述微生物在不存在所述一种或多种外源蛋白质的情况下,缺乏将co2和h2转化为甲基-四氢叶酸的能力。气态碳源可进一步包含co。如上所述,外源蛋白质可选自铁氧还蛋白氧化还原酶、甲酸脱氢酶、甲酰四氢叶酸合成酶、次甲基四氢叶酸环化脱水酶、亚甲基四氢叶酸脱氢酶和亚甲基四氢叶酸还原酶。因此,本发明涉及非天然存在的微生物和利用所述微生物从包含co和/或co2的合成气或其它气体产生期望产物(例如乙酰-coa或甲基-四氢叶酸)的方法,尤其涉及产生能利用包含co和/或co2的合成气或其它气体的微生物,所述微生物先前不能利用包含co和/或co2的合成气或其它气体作为碳源(参见实施例viii)。此外,微生物可经工程改造以便含有wood-ljungdahl途径的甲基和羰基分支(图1、2和6)。此外,也可通过对微生物进行工程改造产生期望产物也能产生其它期望产物,所述工程改造是通过表达能产生期望产物(例如产生作为前体的具有乙酰-coa或甲基-四氢叶酸的产物)的蛋白质或酶来进行(参见图3)。如本文所公开,所述微生物可通过表达赋予期望代谢途径的蛋白质或基因或者通过确定可驱使代谢产生期望产物的缺失来产生。此外,本发明提供一种非天然存在的微生物,其包含基因修饰,所述基因修饰使所述微生物从co和/或co2和h2产生乙酰-coa的效率相对于不存在所述基因修饰的情况下的所述微生物获得提高,其中所述微生物包含将co和/或co2和h2转化为乙酰-coa的途径。在所述微生物中,基因修饰可包括使编码一种或多种外源蛋白质的一种或多种核酸分子得到表达,借此所述一种或多种外源蛋白质的表达会提高从co和/或co2和h2产生乙酰-coa的效率。所述一种或多种外源蛋白质可选自钴酰胺类咕啉/铁硫蛋白甲基转移酶、一氧化碳脱氢酶、乙酰-coa合成酶、乙酰-coa合成酶二硫键还原酶和氢化酶,包括至多所有如本文所公开的这些蛋白质。所述非天然存在的微生物可另外或替代地具有包括一种或多种基因破坏的基因修饰,借此所述一种或多种基因破坏会提高从co和/或co2和h2产生乙酰-coa的效率。此外,本发明提供一种非天然存在的微生物,其包含使得使用本文所公开的方法产生甲基-四氢叶酸或其它期望产物的效率得到提高的基因修饰。因此,本发明另外涉及提高微生物产生期望产物的效率,所述微生物已经具有从包含co和/或co2的合成气或其它气体产生期望产物的能力。本发明还涉及一种非天然存在的微生物,其包含一种或多种赋予所述微生物利用包含co和/或co2的合成气或其它气体作为碳源的能力的蛋白质,其中所述微生物在不存在所述一种或多种赋予利用co和/或co2的能力的蛋白质的情况下缺乏利用碳源的能力。此外,本发明提供一种非天然存在的微生物,其包含一种或多种赋予所述微生物利用一氧化碳和/或二氧化碳作为碳源的能力的蛋白质,其中所述微生物在不存在所述一种或一种蛋白质的情况下缺乏利用碳源的能力。在另一实施方案中,本发明提供一种非天然存在的微生物,其包含一种或多种赋予所述微生物利用co和/或co2以及h2作为碳源的能力的蛋白质,其中所述微生物缺乏在不存在所述一种或一种蛋白质的情况下利用碳源的能力。本发明另外提供一种非天然存在的微生物,其包含一种或多种赋予所述微生物利用co以及h2和co2作为碳源的能力的蛋白质,其中所述微生物在不存在所述一种或一种蛋白质的情况下缺乏利用碳源的能力。所述微生物可用于从碳源产生期望产物,例如甲基-四氢叶酸或乙酰辅酶a(乙酰-coa)或其它期望产物,如本文所公开,包括从乙酰-coa或甲基-四氢叶酸合成而来的产物。所述非天然存在的微生物可表达一种或多种增加产物产量的外源蛋白质,如本文所公开(参见图1和2)。本发明进一步提供一种非天然存在的微生物,其包含一种或多种赋予所述微生物利用合成气或其它气态碳源的能力的外源蛋白质,其中所述微生物在不存在所述一种或多种外源蛋白质的情况下具有利用碳源的能力,借此所述一种或多种外源蛋白质的表达会提高碳源的利用效率。本发明另外提供一种非天然存在的微生物,其包含一种或多种赋予所述微生物利用一氧化碳作为碳源的能力的外源蛋白质,其中所述微生物在不存在所述一种或多种外源蛋白质的情况下具有利用碳源的能力,借此所述一种或多种外源蛋白质的表达会提高碳源的利用效率。在另一实施方案中,本发明提供一种非天然存在的微生物,其包含一种或多种赋予所述微生物利用co和/或co2以及h2作为碳源的能力的外源蛋白质,其中所述微生物在不存在所述一种或多种外源蛋白质的情况下具有利用碳源的能力,借此所述一种或多种外源蛋白质的表达会提高碳源的利用效率。本发明另外提供一种非天然存在的微生物,其包含一种或多种赋予所述微生物利用co以及h2和co2的能力的外源蛋白质,其中所述微生物在不存在所述一种或多种外源蛋白质的情况下具有利用碳源的能力,借此所述一种或多种外源蛋白质的表达会提高碳源的利用效率。所述微生物可用于从碳源产生期望产物,例如乙酰-coa、甲基-四氢叶酸或其它期望产物,如本文所公开。本发明还提供一种非天然存在的微生物有机体,其能够利用甲醇和合成气产生乙酰-coa。因此,微生物有机体能利用甲醇和co、co2和/或h2(例如co2;co2和h2;co;co和h2;co2和co;或co2、co和h2)产生乙酰-coa。因为乙酰-coa在大多数微生物有机体中产生,所以应当理解能产生乙酰-coa的本发明的非天然存在的微生物有机体是经工程改造以便包含期望途径的微生物有机体。此外,微生物有机体经工程改造以便利用甲醇和合成气产生乙酰-coa(参见实施例)。在一实施方案中,本发明提供一种非天然存在的微生物有机体,其具有包含至少一种编码乙酰-coa途径酶或蛋白质的外源核酸的乙酰辅酶a(乙酰-coa)途径,所述外源核酸足量表达以产生乙酰-coa,所述乙酰-coa途径包含甲醇-甲基转移酶和乙酰-coa合成酶/一氧化碳脱氢酶。在所述非天然存在的微生物有机体中,乙酰-coa途径可赋予将co2、co和/或h2、即其组合转化为乙酰-coa的能力。所述乙酰-coa途径的甲醇-甲基转移酶活性可包括例如选自甲醇甲基转移酶、类咕啉蛋白(例如mtac)和甲基四氢叶酸:类咕啉蛋白甲基转移酶(例如mtaa)的酶或蛋白质(参见实施例ii和iii)的酶和蛋白质。所述乙酰-coa途径的乙酰-coa合成酶/一氧化碳脱氢酶活性可包括例如选自甲基四氢叶酸:类咕啉蛋白甲基转移酶(例如acse)、类咕啉铁硫蛋白(例如acsd)、镍蛋白装配蛋白(例如acsf)、铁氧还蛋白、乙酰-coa合成酶、一氧化碳脱氢酶和镍蛋白装配蛋白(例如cooc)的酶或蛋白质(参见实施例ii和iii)。如本文所公开,两种或两种以上、三种或三种以上、四种或四种以上、五种或五种以上、六种或六种以上、七种或七种以上、八种或八种以上、九种或九种以上等的编码乙酰-coa途径的核酸可在本发明的非天然存在的微生物有机体中表达。在一特定实施方案中,非天然存在的微生物有机体可包含十种编码甲醇-甲基转移酶和乙酰-coa合成酶/一氧化碳脱氢酶的外源核酸,所述甲醇-甲基转移酶包括甲醇甲基转移酶、类咕啉蛋白(例如mtac)和甲基四氢叶酸:类咕啉蛋白甲基转移酶(例如mtaa),且所述乙酰-coa合成酶/一氧化碳脱氢酶包括甲基四氢叶酸:类咕啉蛋白甲基转移酶(例如acse)、类咕啉铁硫蛋白(例如acsd)、镍蛋白装配蛋白(例如cooc)、铁氧还蛋白、乙酰-coa合成酶、一氧化碳脱氢酶和镍蛋白装配蛋白(例如acsf)。在另一实施方案中,非天然存在的微生物有机体可进一步包含丙酮酸铁氧还蛋白氧化还原酶。举例来说,丙酮酸铁氧还蛋白氧化还原酶可由外源核酸编码。在另一实施方案中,非天然存在的微生物有机体可进一步包含氢化酶,其可由内源或外源核酸编码,如本文所公开(参见实施例ii和iii)。如本文所公开,非天然存在的微生物有机体可含有例如至少一种作为异源核酸的外源核酸。如本文所进一步公开,非天然存在的微生物有机体可例如在基本上厌氧的培养基中生长。本文对本发明的描述一般是通过代谢反应、反应物或其产物,或具体通过一种或多种核酸或基因描述,所述核酸或基因编码与所提及的代谢反应、反应物或产物相关的酶或催化所提及的代谢反应、反应物或产物的酶,或与所提及的代谢反应、反应物或产物相关的蛋白质。除非本文明确说明,否则所属领域技术人员将了解提及反应时同样表示提及反应的反应物和产物。类似地,除非本文明确说明,否则指代反应物或产物时同样表示提及反应,且提及任何这些代谢组分时同样表示提及一种或多种编码催化所提及的反应、反应物或产物的酶或与所提及的反应、反应物或产物相关的蛋白质的基因。同样,鉴于代谢生物化学、酶学和基因组学是熟知领域,本文提及基因或编码核酸也等同于提及对应的所编码酶和其催化的反应,或反应的相关蛋白质,以及反应的反应物和产物。本发明的非天然存在的微生物有机体可通过引入编码一种或多种乙酰-coa生物合成途径中所涉及的一种或多种酶或蛋白质的可表达核酸来产生。取决于为生物合成所选的宿主微生物有机体,可表达部分或所有的特定乙酰-coa生物合成途径的核酸。举例来说,如果所选宿主缺乏期望生物合成途径的一种或多种酶或蛋白质,那么将用于所缺乏酶或蛋白质的可表达核酸引入到宿主中以供随后的外源表达。或者,如果所选宿主展现一些途径基因的内源表达,但缺乏其它基因,那么需要编码所缺乏酶或蛋白质的核酸以便实现乙酰-coa生物合成。因此,本发明的非天然存在的微生物有机体可通过引入外源酶或蛋白质活性以获得期望生物合成途径来产生,或者期望生物合成途径可通过引入一种或多种外源酶或蛋白质活性来获得,所述一种或多种外源酶或蛋白质活性与一种或多种内源酶或蛋白质一起产生例如乙酰-coa等期望产物。取决于所选宿主微生物有机体的乙酰-coa生物合成途径组分,本发明的非天然存在的微生物有机体将包含至少一种外源表达的编码乙酰-coa途径的核酸,最多为一种或多种乙酰-coa生物合成途径所有的编码核酸。举例来说,乙酰-coa生物合成可在缺乏途径酶或蛋白质的宿主中经由对应编码核酸的外源表达来实现。在缺乏乙酰-coa途径的所有酶或蛋白质的宿主中,可包含所有途径酶或蛋白质的外源表达,但应了解即使宿主含有途径酶或蛋白质中的至少一种,也可表达所有的途径酶或蛋白质。举例来说,可包含用于产生乙酰-coa的所有途径酶或蛋白质的外源表达,例如甲醇-甲基转移酶,其可包括甲醇甲基转移酶、类咕啉蛋白(例如mtac)和甲基四氢叶酸:类咕啉蛋白甲基转移酶(例如mtaa);和乙酰-coa合成酶/一氧化碳脱氢酶,其可包括甲基四氢叶酸:类咕啉蛋白甲基转移酶(例如acse)、类咕啉铁硫蛋白(例如acsd)、镍蛋白装配蛋白(例如acsf)、铁氧还蛋白、乙酰-coa合成酶、一氧化碳脱氢酶和镍蛋白装配蛋白(例如cooc)。在另一实施方案中,在用于从合成气或其它气态碳源产生乙酰-coa的途径中,生物合成途径中的一种或多种蛋白质可选自钴酰胺类咕啉/铁硫蛋白甲基转移酶、一氧化碳脱氢酶、乙酰-coa合成酶、乙酰-coa合成酶二硫键还原酶和氢化酶(参见图2和实施例vii和viii)。在用于产生甲基-四氢叶酸的途径中,生物合成途径中的一种或多种蛋白质可选自铁氧还蛋白氧化还原酶、甲酸脱氢酶、甲酰四氢叶酸合成酶、次甲基四氢叶酸环化脱水酶、亚甲基四氢叶酸脱氢酶和亚甲基四氢叶酸还原酶(参见图1和实施例viii)。此外,编码乙酰-coa和甲基-四氢叶酸的产生所必需的酶的基因可引入到微生物中(参见图3和实施例viii)。美国申请案第11/891,602号(2007年8月10日申请)和wo/2008/115840例如描述用于产生其它期望产物(包括柠檬酸、4-羟基丁酸和1,4-丁二醇)的代谢途径。根据本文所提供的教导和指导,所属领域技术人员将了解以可表达形式引入的编码核酸的数目至少与选定宿主微生物有机体的乙酰-coa途径缺乏的相当。因此,本发明的非天然存在的微生物有机体可具有一种、两种、三种、四种、五种、六种、七种、八种、九种或至多所有的编码组成本文所公开的乙酰-coa生物合成途径的酶或蛋白质的核酸。在一些实施方案中,非天然存在的微生物有机体也可包含其它基因修饰,其促进或优化乙酰-coa生物合成或赋予宿主微生物有机体其它有用的功能。一种所述其它功能可包括例如增加一种或多种乙酰-coa途径前体(例如甲醇)的合成。一般来说,对宿主微生物有机体进行选择,以便其能产生作为天然产生的分子或工程产物的乙酰-coa途径的前体,所述工程产物提供期望前体的从头产生,或导致由宿主微生物有机体天然产生的前体的产生增多。宿主有机体可经工程改造以便增加前体的产量,如本文所公开。此外,已经工程改造以产生期望前体的微生物有机体可用作宿主有机体,且进一步经工程改造以表达乙酰-coa途径的酶或蛋白质。在一些实施方案中,本发明的非天然存在的微生物有机体是从含有合成乙酰-coa的酶促能力的宿主产生。在此特定实施方案中,可以增加乙酰-coa途径产物的合成或积累以便例如驱动乙酰-coa途径反应朝产生乙酰-coa的方向进行。增加的合成或积累可通过例如编码一种或多种上述乙酰-coa途径酶或蛋白质的核酸的过度表达来实现。乙酰-coa途径的一种或多种酶和/或蛋白质的过度表达可例如经由一种或多种内源基因的外源表达或经由一种或多种异源基因的外源表达来进行。因此,天然存在的有机体可容易地变为本发明的非天然存在的微生物有机体,从而例如经由过度表达一种、两种、三种、四种、五种、六种、七种、八种、九种或十种、即至多所有的编码乙酰-coa生物合成途径酶或蛋白质的核酸来产生乙酰-coa。此外,非天然存在的有机体可通过诱发内源基因的突变,从而导致乙酰-coa生物合成途径中的酶活性增加来产生。在尤其有用的实施方案中,利用编码核酸的外源表达。外源表达赋予宿主定制表达和/或调控元件的能力,以及实现由使用者控制的期望表达水平的应用。然而,其它实施方案中也可利用内源表达,例如通过移除负调控效应分子或当连接于可诱导的启动子或其它调控元件时诱导基因的启动子。因此,具有天然存在的可诱导启动子的内源基因可通过提供适当的诱导剂而得到上调,或内源基因的调控区可经工程改造以并入可诱导的调控元件,从而允许在期望时间对内源基因增加的表达进行调控。类似地,可包含可诱导的启动子作为引入非天然存在的微生物有机体中的外源基因的调控元件。应了解,在本发明的方法中,所述一种或多种外源核酸中的任一种皆可引入到微生物有机体中以产生本发明的非天然存在的微生物有机体。可引入核酸以便例如赋予微生物有机体乙酰-coa生物合成途径。或者,可引入编码核酸以便产生中间微生物有机体,其具有催化一些赋予乙酰-coa生物合成能力所必需的反应的生物合成能力。举例来说,具有乙酰-coa生物合成途径的非天然存在的微生物有机体可包含至少两种编码期望酶或蛋白质的外源核酸,所述期望酶或蛋白质为例如甲醇甲基转移酶与类咕啉蛋白的组合、甲醇甲基转移酶与甲基四氢叶酸:类咕啉蛋白甲基转移酶的组合、类咕啉蛋白与类咕啉铁硫蛋白的组合、镍蛋白装配蛋白与铁氧还蛋白的组合等。因此,应了解本发明的非天然存在的微生物有机体可包含生物合成途径的两种或两种以上酶或蛋白质的任何组合。类似地,应了解本发明的非天然存在的微生物有机体可视需要包含生物合成途径的三种或三种以上酶或蛋白质的任何组合,例如甲醇甲基转移酶、类咕啉铁硫蛋白(例如acsd)和乙酰-coa合成酶;类咕啉蛋白(例如mtac)、一氧化碳脱氢酶和镍蛋白装配蛋白(例如cooc或acsf);甲基四氢叶酸:类咕啉蛋白甲基转移酶(例如acse)、铁氧还蛋白和乙酰-coa合成酶等,只要期望生物合成途径的酶和/或蛋白质的组合导致产生对应的期望产物即可。类似地,本发明的非天然存在的微生物有机体可视需要包含如本文所公开的生物合成途径的四种、五种、六种、七种、八种、九种或以上酶或蛋白质的任何组合,只要期望生物合成途径的酶和/或蛋白质的组合导致产生对应的期望产物即可。除了本文所述的乙酰-coa的生物合成外,本发明的非天然存在的微生物有机体和方法也可以彼此的各种组合以及与本领域中熟知的其它微生物有机体和方法的各种组合来利用,以便通过其它途径实现产物的生物合成。举例来说,除了使用产乙酰-coa微生物有机体外,一种产生乙酰-coa的替代方案是添加另一种能将乙酰-coa途径中间物转化为乙酰-coa的微生物有机体。一种所述程序包括例如发酵可产生乙酰-coa途径中间物的微生物有机体。乙酰-coa途径中间物可接着用作底物以供第二微生物有机体将乙酰-coa途径中间物转化为乙酰-coa。乙酰-coa途径中间物可直接添加到第二有机体的另一培养物中,或者可例如通过细胞分离从乙酰-coa途径中间物生产者的原始培养物移除这些微生物有机体,随后可向发酵液中添加第二有机体以便无需中间纯化步骤即可产生最终产物。在其它实施方案中,本发明的非天然存在的微生物有机体和方法可以众多亚途径装配以便实现例如乙酰-coa的生物合成。在这些实施方案中,本发明的期望产物的生物合成途径可分到不同的微生物有机体中,且不同的微生物有机体可共培养以便产生最终产物。在所述生物合成方案中,一种微生物有机体的产物是另一种微生物有机体的底物,直到合成最终产物为止。举例来说,乙酰-coa的生物合成可通过构建含有用于将一种途径中间物转化为另一种途径中间物或产物的生物合成途径的微生物有机体来实现。或者,乙酰-coa也可经由使用两种有机体在同一容器中共培养或共发酵而以生物合成方法从微生物有机体产生,其中第一微生物有机体产生乙酰-coa中间物,而第二微生物有机体将中间物转化为乙酰-coa。根据本文所提供的教导和指导,所属领域技术人员将了解,本发明的非天然存在的微生物有机体和方法,连同其它微生物有机体、具有亚途径的其它非天然存在的微生物有机体的共同培养物、和本领域中熟知的用于产生乙酰-coa的其它化学和/或生物化学程序的组合存在众多组合和置换。此外,因为乙酰-coa是其它期望产物的前体,所以本发明的非天然存在的微生物有机体可用作宿主有机体,其根据需要被赋予其它利用乙酰-coa作为前体或中间物的期望途径。乙酰-coa途径酶或蛋白质的编码核酸的来源可包括例如其中经编码基因产物能催化所提及的反应的任何物种。所述物种包括原核和真核有机体,其包括(但不限于)细菌(包括古细菌和真细菌)和真核生物(包括酵母、植物、昆虫、动物和哺乳动物,包括人类)。所述来源的示例性物种包括例如大肠杆菌、巴氏甲烷八叠球菌(methanosarcinabarkeri)、嗜乙酸甲烷八叠球菌(methanosarcinaacetivorans)、热乙酸穆尔氏菌、生氢氧化碳嗜热菌(carboxydothermushydrogenoformans)、深红红螺菌(rhodospirillumrubrum)、伍氏醋酸杆菌(acetobacteriumwoodii)、食甲基丁酸杆菌(butyribacteriummethylotrophicum)、自产乙烷梭菌(clostridiumautoethanogenum)、嗜羧酸梭菌(clostridiumcarboxidivorans)、杨氏梭菌(clostridiumljungdahlii)、粘液真杆菌(eubacteriumlimosum)、普氏产醋杆菌(oxobacterpfennigii)、产生消化链球菌(peptostreptococcusproductus)、沼泽红假单胞菌p4(rhodopseudomonaspalustrisp4)、胶状红长命菌(rubrivivaxgelatinosus)、柠檬酸杆菌y19(citrobacterspy19)、嗜乙酸甲烷八叠球菌c2a、巴氏甲烷八叠球菌、东方脱硫芽孢弯曲菌(desulfosporosinusorientis)、脱硫脱硫弧菌(desulfovibriodesulfuricans)、普通脱硫弧菌(desulfovibriovulgaris)、热自氧穆尔氏菌(moorellathermoautotrophica)、太平洋羧酸双分枝菌(carboxydibrachiumpacificus)、热自氧羧酸胞菌(carboxydocellathermoautotrophica)、thermincolacarboxydiphila、嗜羧酸热石杆菌(thermolithobactercarboxydivorans)、嗜羧酸热弯曲菌(thermosinuscarboxydivorans)、嗜热自养甲烷杆菌(methanothermobacterthermoautotrophicus)、嗜羧酸脱硫肠状菌(desulfotomaculumcarboxydivorans)、库氏脱硫肠状菌(desulfotomaculumkuznetsovii)、致黑脱硫肠状菌(desulfotomaculumnigrificans)、热苯脱硫肠状菌热共养亚种(desulfotomaculumthermobenzoicumsubsp.thermosyntrophicum)、弗氏互营杆菌(syntrophobacterfumaroxidans)、尿酸梭菌(clostridiumacidurici)、非洲脱硫弧菌(desulfovibrioafricanus)等,以及本文公开的或可作为对应基因的来源有机体获得的其它示例性物种。然而,因为现在可从超过550种物种获得完整基因组序列(其中超过一半可从例如ncbi等公开数据库获得),包括395种微生物基因组和多种酵母、真菌、植物和哺乳动物基因组,所以对于相关或远亲物种中的一种或多种基因鉴别编码必需乙酰-coa生物合成活性的基因是常规的且在本领域中为人所熟知,包括例如已知基因的同源物、直系同源物、旁系同源物和非直系同源基因置换,和有机体之间基因变异的互换。因此,本文参考特定有机体(例如大肠杆菌)描述的能实现乙酰-coa的生物合成的代谢变化可容易地应用于其它微生物,同样包括原核和真核有机体。根据本文所提供的教导和指导,所属领域技术人员将知悉在一种有机体中示例的代谢变化可同样地应用于其它有机体。在一些情况下,例如当无关物种中存在替代乙酰-coa生物合成途径时,宿主物种可被赋予乙酰-coa生物合成,例如通过从无关物种外源表达一种或多种旁系同源物,这会催化类似但不相同的代谢反应置换所提及的反应。因为不同有机体的代谢网络之间存在某些差别,所以所属领域技术人员将了解不同有机体之间的实际基因使用可有所不同。然而,根据本文所提供的教导和指导,所属领域技术人员还将了解,本发明的教导和方法可应用于所有的微生物有机体,其中使用本文中示例的用于在合成乙酰-coa的目的物种中构建微生物有机体的代谢变化的同源代谢变化。宿主微生物有机体可选自以下物种且非天然存在的微生物有机体可在以下物种中产生:例如细菌、酵母、真菌或各种适用于发酵过程的其它微生物中的任一种。示例性细菌包括选自以下的物种:大肠杆菌、产酸克雷伯氏菌(klebsiellaoxytoca)、产琥珀酸厌氧螺菌(anaerobiospirillumsucciniciproducens)、产琥珀酸放线杆菌(actinobacillussuccinogenes)、产琥珀酸曼海姆氏菌(mannheimiasucciniciproducens)、菜豆根瘤菌(rhizobiumetli)、枯草杆菌(bacillussubtilis)、谷氨酸棒杆菌(corynebacteriumglutamicum)、(gluconobacteroxydans)、氧化葡萄糖酸杆菌(zymomonasmobilis)、乳酸乳球菌(lactococcuslactis)、植物乳杆菌(lactobacillusplantarum)、天蓝色链霉菌(streptomycescoelicolor)、丙酮丁醇梭菌(clostridiumacetobutylicum)、荧光假单胞菌(pseudomonasfluorescens)和恶臭假单胞菌(pseudomonasputida)。示例性酵母或真菌包括选自以下的物种:酿酒酵母(saccharomycescerevisiae)、粟酒裂殖酵母(schizosaccharomycespombe)、乳酸克鲁维酵母(kluyveromyceslactis)、马克斯克鲁维酵母(kluyveromycesmarxianus)、土曲霉(aspergillusterreus)、黑曲霉(aspergillusniger)和毕赤酵母(pichiapastoris)。大肠杆菌是尤其有用的宿主有机体,因为其是得到充分表征的适用于基因工程的微生物有机体。其它尤其有用的宿主有机体包括酵母,例如酿酒酵母。适合作为宿主有机体的示例性产乙酸菌包括(但不限于)深红红螺菌、热乙酸穆尔氏菌和哈氏脱亚硫酸菌(desulfitobacteriumhafniense)(参见实施例)。用于构建非天然存在的乙酰-coa生产宿主和测试其表达水平的方法可例如通过本领域中熟知的重组和检测方法来执行。例如sambrook等人,molecularcloning:alaboratorymanual,第3版,coldspringharborlaboratory,newyork(2001);和ausubel等人,currentprotocolsinmolecularbiology,johnwileyandsons,baltimore,md(1999)描述所述方法。用于产生乙酰-coa的途径中所涉及的外源核酸序列可使用本领域中熟知的技术稳定地或暂时地引入宿主细胞中,所述技术包括(但不限于)接合、电穿孔、化学转化、转导、转染和超声波转化。对于在大肠杆菌或其它原核细胞中的外源表达,真核核酸的基因或cdna中的一些核酸序列可编码导向信号,例如n端线粒体导向信号或其它导向信号,必要时其可在转化到原核宿主细胞中之前被移除。举例来说,移除线粒体前导序列会导致在大肠杆菌中的表达有所增加(hoffmeister等人,j.biol.chem.280:4329-4338(2005))。对于在酵母或其它真核细胞中的外源表达,基因可在细胞溶质中表达而无需添加前导序列,或可通过添加合适的导向序列(例如适用于宿主细胞的线粒体导向或分泌序列)而导向到线粒体或其它细胞器或经导向用于分泌。因此,应了解为了移除或包含导向序列而对核酸序列所作的适当修饰可并入外源核酸序列中以便赋予所需性质。此外,可使用本领域中熟知的技术对基因进行密码子优化以获得蛋白质的优化表达。可构建一种或多种表达载体以包括如本文示例的一种或多种乙酰-coa生物合成途径编码核酸,所述编码核酸可操作性连接到在宿主有机体中具有功能的控制序列上。适用于本发明的微生物宿主有机体的表达载体包括例如质粒、噬菌体载体、病毒载体、附加体(episome)和人工染色体,其包括可用于稳定整合到宿主染色体中的载体和选择序列或标记。另外,表达载体可包括一种或多种选择标记基因和适当的表达控制序列。也可包括选择标记基因,其例如提供抗生素或毒素抗性、补充营养缺陷或供应培养基中没有的关键营养物。表达控制序列可包括本领域中熟知的组成型和诱导型启动子、转录增强子、转录终止子等。当打算共表达两种或两种以上外源编码核酸时,这两种核酸皆可插入例如单一表达载体中或单独的表达载体中。对于单一载体表达,编码核酸可操作性地连接于一种常用表达控制序列或连接于不同的表达控制序列,例如一种诱导型启动子和一种组成型启动子。代谢或合成途径中所涉及的外源核酸序列的转化可使用本领域中熟知的方法进行证实。所述方法包括例如核酸分析,例如mrna的northern印迹技术或聚合酶链反应(pcr),或基因产物表达的免疫印迹技术,或其它用于测试所引入核酸序列或其对应基因产物的表达的合适分析方法。所属领域技术人员应了解外源核酸是足量表达以产生期望产物,且应进一步了解可使用本领域中熟知且如本文所公开的方法优化表达水平以获得充分表达。本发明另外提供一种通过培养具有乙酰-coa途径的本发明的非天然存在的微生物有机体来产生乙酰-coa的方法。乙酰-coa途径可包含例如至少一种编码乙酰-coa途径酶或蛋白质的外源核酸,其在用于产生乙酰-coa的条件和足够时间下足量表达以产生乙酰-coa,所述乙酰-coa途径包含甲醇-甲基转移酶和乙酰-coa合成酶/一氧化碳脱氢酶。在所述乙酰-coa途径中,甲醇-甲基转移酶可包括选自甲醇甲基转移酶、类咕啉蛋白(例如mtac)和甲基四氢叶酸:类咕啉蛋白甲基转移酶(mtaa)的酶或蛋白质。此外,在所述乙酰-coa途径中,乙酰-coa合成酶/一氧化碳脱氢酶可包括例如选自甲基四氢叶酸:类咕啉蛋白甲基转移酶(例如acse)、类咕啉铁硫蛋白(例如acsd)、镍蛋白装配蛋白(例如acsf)、铁氧还蛋白、乙酰-coa合成酶、一氧化碳脱氢酶和镍蛋白装配蛋白(例如cooc)的酶或蛋白质。非天然存在的微生物有机体可处在基本上厌氧培养基中。在一特定实施方案中,非天然存在的微生物有机体可在co2、co和/或h2、即其组合以及甲醇存在下培养。非天然存在的微生物有机体可进一步包含丙酮酸铁氧还蛋白氧化还原酶,其可由外源核酸表达。非天然存在的微生物有机体还可进一步包含氢化酶,其例如由内源或外源核酸编码。在另一实施方案中,非天然存在的微生物有机体可在存在电子受体(例如硝酸盐)、尤其在基本上厌氧条件下培养(参见实施例iii)。应了解可向微生物培养物中添加适量硝酸盐以实现生物质的期望增加,例如1mm到100mm硝酸盐,或视需要更低或更高浓度,只要添加量为生物质的期望增加提供足量的电子受体即可。所述量视情况包括(但不限于)5mm、10mm、15mm、20mm、25mm、30mm、40mm、50mm以实现生物质的期望增加。可使用熟知方法执行用于测试乙酰-coa产生的合适纯化和/或分析。对于打算测试的每种经工程改造的菌株,可培养合适的复制菌株,例如一式三份培养物。举例来说,可监测经工程改造的生产宿主中的产物和副产物形成。可通过例如hplc(高效液相色谱)、gc-ms(气相色谱-质谱法)和lc-ms(液相色谱-质谱法)或其它合适的分析方法等方法,使用本领域中熟知的常规程序来分析终产物和中间物和其它有机化合物。也可用培养物上清液来测试发酵液中的产物释放情况。副产物和残余葡萄糖可通过hplc,使用例如针对葡萄糖和醇类的折射率检测器和针对有机酸的uv检测器(lin等人,biotechnol.bioeng.90:775-779(2005)),或其它在本领域中熟知的合适分析和检测方法来定量。来自外源dna序列的单独酶或蛋白质活性也可使用本领域中熟知的方法来分析(参见实施例iii)。乙酰-coa或来源于乙酰-coa的产物可使用本领域中熟知的各种方法与培养物中的其它组分分离。来源于乙酰-coa的产物包括(但不限于)乙醇、丁醇、异丁醇、异丙醇、1,4-丁二醇、琥珀酸、富马酸、苹果酸、4-羟基丁酸、3-羟基丙酸、乳酸、甲基丙烯酸、己二酸和丙烯酸。所述分离方法包括例如萃取程序,以及包括连续液液萃取、渗透蒸发、膜过滤、膜分离、反渗透、电渗析、蒸馏、结晶、离心、萃取过滤、离子交换色谱、尺寸排阻色谱、吸附色谱和超滤的方法。所有上述方法皆为本领域中所熟知。可培养本文所述的任何非天然存在的微生物有机体以产生和/或分泌本发明的生物合成产物。举例来说,可培养产乙酰-coa微生物有机体以便以生物合成产生乙酰-coa或来源于乙酰-coa的产物。为了产生乙酰-coa,在具有甲醇和包含co、co2和/或h2的气体以及其它必需营养物作为碳源和能源的培养基中培养重组菌株。非常需要在发酵罐中维持厌氧条件以降低全过程的成本。所述条件可例如通过首先用氮气喷射培养基,然后用隔膜和螺旋盖密封烧瓶来获得。对于在厌氧条件下未观察到生长的菌株,可通过在隔膜上打出用于有限通气的小孔来应用微氧条件。示例性厌氧条件先前已有描述且为本领域中所熟知。例如美国专利申请案第11/891,602号(2007年8月10日申请)和wo/2008/115840描述示例性需氧和厌氧条件。发酵可如本文所公开以分批、补料分批或连续方式进行。必要时,可通过根据需要添加碱(例如naoh或其它碱)或酸使培养基维持在所需ph下而使培养基的ph维持在期望ph,尤其中性ph,例如约7的ph。生长速率可通过使用分光光度计(600nm)测量光学密度来测定,且葡萄糖摄取速率可通过监测碳源随时间的消耗来测定。生长培养基可包含例如任何可向非天然存在的微生物供应碳源的碳水化合物源。所述碳水化合物源包括例如糖,例如葡萄糖、木糖、阿拉伯糖、半乳糖、甘露糖、果糖和淀粉。其它碳水化合物源包括例如再生原料和生物质。可在本发明方法中用作原料的生物质的示例性类型包括纤维素类生物质、半纤维素类生物质和木质素原料或所述原料的部分。所述生物质原料含有例如可用作碳源的碳水化合物基质,例如葡萄糖、木糖、阿拉伯糖、半乳糖、甘露糖、果糖和淀粉。根据本文提供的教导和指导,所属领域技术人员将了解除上文示例者之外的再生原料和生物质也可用于培养本发明的微生物有机体以供产生乙酰-coa。因此,根据本文所提供的教导和指导,所属领域技术人员将了解可产生非天然存在的微生物有机体,其在利用例如碳水化合物、甲醇和包含co、co2和/或h2的气体等碳源生长时,可细胞内表达或分泌经生物合成的本发明化合物。所述化合物包括(但不限于)乙酰-coa和乙酰-coa途径中的任何中间代谢物,以及来源于乙酰-coa的产物,包括乙醇、丁醇、异丁醇、异丙醇、1,4-丁二醇、琥珀酸、富马酸、苹果酸、4-羟基丁酸、3-羟基丙酸、乳酸、甲基丙烯酸、己二酸和丙烯酸。为了实现期望化合物或中间物的生物合成,需要对一种或多种所需酶或蛋白质活性进行工程改造,包括例如并入部分或所有乙酰-coa生物合成途径。因此,本发明提供一种非天然存在的微生物有机体,其在利用碳水化合物或其它碳源生长时产生乙酰-coa,且在利用碳水化合物或其它碳源生长时产生和/或分泌乙酰-coa途径中所示的任何中间代谢物或产生和/或分泌来源于乙酰-coa的产物。本发明的产乙酰-coa微生物有机体可引发从例如5-甲基-四氢叶酸(me-thf)等中间物启动合成。可使用如本文示例的本领域中熟知的方法构建本发明的非天然存在的微生物有机体,以便以足够量外源表达至少一种编码乙酰-coa途径酶或蛋白质的核酸以产生乙酰-coa。应了解本发明的微生物有机体是在足以产生乙酰-coa的条件下培养。根据本文提供的教导和指导,本发明的非天然存在的微生物有机体可实现乙酰-coa的生物合成,从而产生约0.001-200mm或以上的细胞内浓度。乙酰-coa的细胞内浓度一般介于约3-150mm之间,尤其介于约5-125mm之间,且更尤其介于约8-100mm之间,包括约10mm、20mm、50mm、80mm或以上。还可从本发明的非天然存在的微生物有机体获得介于这些示例性范围之间和在这些示例性范围以上的细胞内浓度。在一些实施方案中,培养条件包括厌氧或基本上厌氧的生长或维持条件。示例性厌氧条件先前已有描述且为本领域中所熟知。本文描述了用于发酵过程的示例性厌氧条件,且其也例如描述于美国专利申请案第11/891,602号(2007年8月10日申请)和wo/2008/115840中。这些条件中的任一种以及本领域中熟知的其它厌氧条件皆可用于非天然存在的微生物有机体。在所述厌氧条件下,产乙酰-coa微生物有机体可以5-10mm或以上的细胞内浓度以及本文示例的所有其它浓度合成乙酰-coa。应了解以上描述是指细胞内浓度,且产乙酰-coa微生物有机体可细胞内产生乙酰-coa。此外,可细胞内产生和/或分泌来源于乙酰-coa的产物。所述产物包括(但不限于)乙醇、丁醇、异丁醇、异丙醇、1,4-丁二醇、琥珀酸、富马酸、苹果酸、4-羟基丁酸、3-羟基丙酸、乳酸、甲基丙烯酸、己二酸和丙烯酸。培养条件可包括例如液体培养程序以及发酵和其它大规模培养程序。如本文所述,本发明的生物合成产物的尤其有用的产量可在厌氧或基本上厌氧的培养条件下获得。如本文所述,一种用于实现乙酰-coa的生物合成的示例性生长条件包括厌氧培养或发酵条件。在某些实施方案中,本发明的非天然存在的微生物有机体可在厌氧或基本上厌氧条件下维持、培养或发酵。简言之,厌氧条件是指没有氧的环境。基本上厌氧条件包括在例如培养基中的溶解氧浓度保持在0与10%饱和度之间的条件下培养、分批发酵或连续发酵。基本上厌氧条件还包括在维持于小于1%氧的气氛的密封室内,在液体培养基中或固体琼脂上生长或放置细胞。氧的百分比可通过例如用n2/co2混合物或其它合适的一种或多种非氧气体喷射培养物来维持。本文所述的培养条件可以按比例扩大和连续扩大以供产生乙酰-coa。示例性生长程序包括例如补料分批发酵和分批分离;补料分批发酵和连续分离;或连续发酵和连续分离。所有这些过程皆为本领域中所熟知。发酵程序尤其适用于以生物合成方法产生商业数量的乙酰-coa。通常情况下且如同不连续培养程序中的情况一样,乙酰-coa的连续和/或接近连续产生将包括在充足的营养物和培养基中培养本发明的非天然存在的产乙酰-coa有机体以保持和/或接近保持指数生长期的生长。在所述条件下的连续培养可包括例如1天、2天、3天、4天、5天、6天或7天或以上。此外,连续培养可包括1周、2周、3周、4周或5周或以上和至多数月。或者,本发明的有机体可根据特定应用的需要培养数小时。应了解连续和/或接近连续培养条件还可包括这些示例性时段之间的所有时间间隔。应进一步了解,本发明的微生物有机体的培养时间是足以产生足量产物用于期望目的的时段。发酵程序为本领域中所熟知。简言之,用于以生物合成方法产生乙酰-coa的发酵可例如以下列方式利用:补料分批发酵和分批分离;补料分批发酵和连续分离;或连续发酵和连续分离。分批和连续发酵程序的实例为本领域中所熟知。除了使用本发明的产乙酰-coa微生物有机体连续产生大量乙酰-coa的上述发酵程序外,产乙酰-coa微生物有机体也可例如根据需要同时经历化学合成程序以将产物转化为其它化合物,或产物可自发酵培养物分离,和依次经历化学转化以将产物转化为其它化合物。多年来,已经分离出至少三十种不同的野生型有机体,且其显示可利用合成气或合成气的组分生长,包括能将合成气转化为乙醇的微生物(vega等人,appl.biochem.biotechnol.20/21:781-797(1989))(参见表1)。用于改良型合成气发酵的候选有机体包括产乙酸菌、光能利用菌、硫酸还原菌和产甲烷菌,其可利用co和/或co2/h2作为唯一的碳源和能源(sipma等人,crit.rev.biotechnol.26:41-65.(2006))。嗜温产乙酸菌嗜羧酸梭菌代表最有前景用于合成气生成化学物平台(syngas-to-chemicalsplatform)的有机体中的一种,因为其具有快速倍增时间且已显示可利用合成气生长期间天然产生乙醇和少量的丁醇(henstra等人,curr.opin.biotechnol.18:200-206(2007))。可开发用于这种有机体的基因工具。针对产氢紫色非硫细菌、即深红红螺菌的目标基因缺失或插入的基因工具已经存在,所述细菌是另一种用于开发合成气利用以产生期望产物的优良候选有机体,但其天然从合成气产生氢且因此可根据需要工程改造代谢改变,一些合成气利用型有机体的代谢是已知的。举例来说,例如嗜羧酸梭菌等产乙酸菌可通过利用wood-ljungdahl途径在co或co2存在下生长,甚至可在不存在葡萄糖的情况下生长,只要存在氢以便供应必需的还原当量即可。图3说明wood-ljungdahl途径(也参见图1和2),且所述途径显示产乙酸菌经由产生关键的代谢中间物乙酰-coa而利用co作为唯一碳源和能源的能力。特定来说,co可经氧化以产生还原当量和co2,或可被直接同化成乙酰-coa,其随后转化为生物质或代谢物。重要的是,乙酰-coa是关键的代谢中间物,可用作许多代谢物和其它化学实体的前体。因此,微生物从合成气或其它气态碳源产生乙酰-coa的能力允许对合成气利用型有机体或能利用其它气态碳源的有机体进行工程改造,以便产生作为期望产物的许多化学物和燃料。为了表征合成气或其它气态碳源作为可行的原料经由发酵来商业制造化学物和燃料的应用,进行可行性研究以解决与当前系统有关的关键问题和难题。初步代谢建模工作已经表明合成气转化为化学物可在热力学上非常有利,且特定化学物可作为专有产物制得。这不仅会降低下游加工需求,而且会最大化产物产量。此外,期望产物的产生可与生长关联,因此可根据需要连续进行发酵。因为连续过程是维持在高细胞浓度下且节约分批往返时间,所以其在经济上更为有利。如本文所公开,本发明涉及开发能利用合成气或其它气态碳源的微生物,从而允许以高产率、滴度和生产率将co和/或co2有效地转化为化学产物。一个示例性的适用商业实施方案涉及开发能以≥80%理论最大值的产率、≥50g/l的产物耐受性(producttolerance)、≥50g/l的滴度和至少2g/l/h的生产率产生特定化学物的有机体。虽然这些标准在商业上很有用,但应了解能获得小于任何或所有这些标准的结果的有机体也适用于本发明。举例来说,有机体可以大于或等于75%、70%、65%、60%、55%、50%、45%、40%、35%、30%、25%、20%等中的任一种的产率产生特定化学物,只要所得产率足以满足期望应用即可。类似地,有机体可获得大于或等于45g/l、40g/l、35g/l、30g/l、25g/l、20g/l、15g/l、10g/l等中的任一种的产物耐受性,只要所得产率足以满足期望应用即可。此外,有机体可获得大于或等于200g/l、190g/l、180g/l、170g/l、160g/l、150g/l、140g/l、130g/l、120g/l、110g/l、100g/l、90g/l、80g/l、70g/l、60g/l、50g/l、45g/l、40g/l、35g/l、30g/l、25g/l、20g/l、15g/l、10g/l等中的任一种的滴度,只要所得产率足以满足期望应用即可。此外,有机体可获得1.5g/l/h、1g/l/h、0.5g/l/h等中的至少任一种的生产率,只要所得产率足以满足期望应用即可。如本文所公开,对丁醇作为合成气利用产物的假设分析表明,能有效利用便宜且容易获得的合成气作为原料,且可得到可能比当前石油化学方法节省≥50%成本的方法,特别是在合成气作为原料的低成本方面。除了低成本外,合成气还是一种丰富且适应性强的基质,可从煤和许多类型的生物质产生,所述生物质包括能源作物,例如柳枝稷,以及废物,例如废木材、农业废物、乳业废物和市政固体废物。因此,产生能利用合成气或其它气态碳源产生期望产物的有机体的能力允许从几乎任何生物质源产生期望产物。这种特征避免了针对用于生物燃料或化学物生产的每种类型的生物质特别开发不同方法的需求。对于合成气产生中的废物的利用也可用于降低环境污染并缓解生物废物的严重处理问题。此外,合成气作为原料不会引起在例如基于玉米产生乙醇的情况下存在的进料与燃料的争议。鉴于可用于产生合成气的基质的范围很广,预期这种原料的供应和成本结构在很多年内都会保持相对稳定。最后,合成气广泛用于加热和供能,且因此可用作生物质能的来源,其可补充或消除生产上对基于石油的能量的需求,从而提供额外的成本节约。虽然在本文的各个实施方案中示例丁醇作为期望产物,但应了解可产生任何能由本发明的微生物产生的产物并利用其产生期望产物。期望产物一般包括(但不限于)可用于化学合成或可用作燃料的烃类。示例性期望产物包括(但不限于)甲醇、乙醇、丁醇、乙酸、丁酸、乳酸、琥珀酸、4-羟基丁酸、1,4-丁二醇等。在其它方面,本发明提供一种非天然存在的微生物有机体,其具有可包含至少一种编码4-羟基丁酸途径酶的外源核酸的4-羟基丁酸途径,所述外源核酸足量表达以产生4-羟基丁酸。4-羟基丁酸途径酶可包括乙酰乙酰-coa硫解酶、3-羟基丁酰-coa脱氢酶、巴豆酸酶、巴豆酰-coa水合酶、4-羟基丁酰-coa转移酶、磷酸转-4-羟基丁酰酶和4-羟基丁酸激酶。在其它方面,本发明提供一种非天然存在的微生物有机体,其具有可包含至少一种编码1,4-丁二醇途径酶的外源核酸的1,4-丁二醇途径,所述外源核酸足量表达以产生1,4-丁二醇。1,4-丁二醇途径酶可包括乙酰乙酰-coa硫解酶、3-羟基丁酰-coa脱氢酶、巴豆酸酶、巴豆酰-coa水合酶、4-羟基丁酰-coa还原酶(醇形成型)、4-羟基丁酰-coa还原酶(醛形成型)和1,4-丁二醇脱氢酶。所述有机体还可包含具有至少一种编码乙酰-coa途径酶的外源核酸的乙酰-coa途径,所述外源核酸足量表达以产生乙酰-coa。乙酰-coa途径酶可包括类咕啉蛋白、甲基四氢叶酸:类咕啉蛋白甲基转移酶、类咕啉铁硫蛋白、镍蛋白装配蛋白、铁氧还蛋白、乙酰-coa合成酶、一氧化碳脱氢酶、丙酮酸铁氧还蛋白氧化还原酶和氢化酶。在其它方面,本发明提供一种非天然存在的微生物有机体,其具有可包含至少一种编码1,4-丁二醇途径酶的外源核酸的1,4-丁二醇途径,所述外源核酸足量表达以产生1,4-丁二醇。1,4-丁二醇途径酶可包括乙酰乙酰-coa硫解酶、3-羟基丁酰-coa脱氢酶、巴豆酸酶、巴豆酰-coa水合酶、4-羟基丁酰-coa还原酶(醇形成型)、4-羟基丁酰-coa还原酶(醛形成型)和1,4-丁二醇脱氢酶。所述有机体还可包含具有至少一种编码乙酰-coa途径酶的外源核酸的乙酰-coa途径,所述外源核酸足量表达以产生乙酰-coa。乙酰-coa途径酶可包括乙酰-coa合成酶、甲酸脱氢酶、甲酰四氢叶酸合成酶、次甲基四氢叶酸环化水解酶、亚甲基四氢叶酸脱氢酶和亚甲基四氢叶酸还原酶。在其它方面,本发明提供一种产生4-羟基丁酸的方法,其可包含培养具有4-羟基丁酸途径的非天然存在的微生物有机体。所述途径可包含至少一种编码4-羟基丁酸途径酶的外源核酸,所述外源核酸在用于产生4-羟基丁酸的条件和足够时间下足量表达以产生4-羟基丁酸。4-羟基丁酸途径酶可包括乙酰乙酰-coa硫解酶、3-羟基丁酰-coa脱氢酶、巴豆酸酶、巴豆酰-coa水合酶、4-羟基丁酰-coa转移酶、磷酸转-4-羟基丁酰酶和4-羟基丁酸激酶。在其它方面,本发明提供一种产生1,4-丁二醇的方法,其可包含培养具有1,4-丁二醇途径的非天然存在的微生物有机体。所述途径可包含至少一种编码1,4-丁二醇途径酶的外源核酸,所述外源核酸在用于产生1,4-丁二醇的条件和足够时间下足量表达以产生1,4-丁二醇。1,4-丁二醇途径可包含乙酰乙酰-coa硫解酶、3-羟基丁酰-coa脱氢酶、巴豆酸酶、巴豆酰-coa水合酶、4-羟基丁酰-coa还原酶(醇形成型)、4-羟基丁酰-coa还原酶(醛形成型)和1,4-丁二醇脱氢酶。所述有机体还可包含具有至少一种编码乙酰-coa途径酶的外源核酸的乙酰-coa途径,所述外源核酸足量表达以产生乙酰-coa。乙酰-coa途径酶可包括类咕啉蛋白、甲基四氢叶酸:类咕啉蛋白甲基转移酶、类咕啉铁硫蛋白、镍蛋白装配蛋白、铁氧还蛋白、乙酰-coa合成酶、一氧化碳脱氢酶、丙酮酸铁氧还蛋白氧化还原酶和氢化酶。最后,在一些方面,本发明提供一种产生1,4-丁二醇的方法,其可包含培养具有1,4-丁二醇途径的非天然存在的微生物有机体。所述途径可包含至少一种编码1,4-丁二醇途径酶的外源核酸,所述外源核酸在用于产生1,4-丁二醇的条件和足够时间下足量表达以产生1,4-丁二醇。1,4-丁二醇途径可包含乙酰乙酰-coa硫解酶、3-羟基丁酰-coa脱氢酶、巴豆酸酶、巴豆酰-coa水合酶、4-羟基丁酰-coa还原酶(醇形成型)、4-羟基丁酰-coa还原酶(醛形成型)和1,4-丁二醇脱氢酶。所述有机体还可包含具有至少一种编码乙酰-coa途径酶的外源核酸的乙酰-coa途径,所述外源核酸足量表达以产生乙酰-coa。乙酰-coa途径酶可包括乙酰-coa合成酶、甲酸脱氢酶、甲酰四氢叶酸合成酶、次甲基四氢叶酸环化水解酶、亚甲基四氢叶酸脱氢酶和亚甲基四氢叶酸还原酶。在其它实施方案中,本发明的有机体具有功能性甲基转移酶系统、合成乙酰-coa的能力和从乙酰-coa合成4-hb的能力,如图11所描绘。本文所述的其它有机体具有功能性甲基转移酶系统、合成乙酰-coa的能力和从乙酰-coa合成bdo的能力,如图12所描绘。本发明还提供一种非天然存在的微生物有机体,其具有可包含至少一种编码4-羟基丁酸途径酶的外源核酸的4-羟基丁酸途径,所述外源核酸足量表达以产生4-羟基丁酸。4-羟基丁酸途径酶可包括乙酰乙酰-coa硫解酶、3-羟基丁酰-coa脱氢酶、巴豆酸酶、巴豆酰-coa水合酶、4-羟基丁酰-coa转移酶、磷酸转-4-羟基丁酰酶和4-羟基丁酸激酶。所述有机体还可包含至少一种例如以下的酶或多肽:类咕啉蛋白、甲基四氢叶酸:类咕啉蛋白甲基转移酶、类咕啉铁硫蛋白、镍蛋白装配蛋白、铁氧还蛋白、乙酰-coa合成酶、一氧化碳脱氢酶、丙酮酸铁氧还蛋白氧化还原酶和氢化酶。在一些实施方案中,具有4-羟基丁酸途径的有机体可包含甲醇甲基转移酶。所述有机体利用例如以下的原料:1)甲醇和co,2)甲醇、co2和h2,3)甲醇、co、co2和h2,4)甲醇和包含co和h2的合成气,和5)甲醇和包含co、co2和h2的合成气。其它具有4-羟基丁酸途径的有机体可具有甲酸脱氢酶、甲酰四氢叶酸合成酶、次甲基四氢叶酸环化水解酶、亚甲基四氢叶酸脱氢酶和亚甲基四氢叶酸还原酶。所述有机体利用例如以下的原料:1)co,2)co2和h2,3)co和co2,4)包含co和h2的合成气,和5)包含co、co2和h2的合成气。本发明还提供一种非天然存在的微生物有机体,其具有可包含至少一种编码1,4-丁二醇途径酶的外源核酸的1,4-丁二醇途径,所述外源核酸足量表达以产生1,4-丁二醇。1,4-丁二醇途径酶包括例如乙酰乙酰-coa硫解酶、3-羟基丁酰-coa脱氢酶、巴豆酸酶、巴豆酰-coa水合酶、4-羟基丁酰-coa还原酶(醇形成型)、4-羟基丁酰-coa还原酶(醛形成型)和1,4-丁二醇脱氢酶。所述有机体还可包含至少一种例如以下的酶或多肽:类咕啉蛋白、甲基四氢叶酸:类咕啉蛋白甲基转移酶、类咕啉铁硫蛋白、镍蛋白装配蛋白、铁氧还蛋白、乙酰-coa合成酶、一氧化碳脱氢酶、丙酮酸铁氧还蛋白氧化还原酶和氢化酶。在一些实施方案中,具有1,4-丁二醇途径的有机体可包含甲醇甲基转移酶。所述有机体利用例如以下的原料:1)甲醇和co,2)甲醇、co2和h2,3)甲醇、co、co2和h2,4)甲醇和包含co和h2的合成气,和5)甲醇和包含co、co2和h2的合成气。在其它实施方案中,具有1,4-丁二醇途径的有机体可包含甲酸脱氢酶、甲酰四氢叶酸合成酶、次甲基四氢叶酸环化水解酶、亚甲基四氢叶酸脱氢酶和亚甲基四氢叶酸还原酶。所述有机体利用选自由诸如以下组成的组的原料:1)co,2)co2和h2,3)co和co2,4)包含co和h2的合成气,和5)包含co、co2和h2的合成气。本发明的示例性微生物有机体可含有如图13所描绘的途径。所述有机体可含有wood-ljungdahl途径的功能性甲基分支、合成乙酰-coa的能力和从乙酰-coa合成4-羟基丁酸的能力。本发明的另一示例性微生物有机体可含有如图14所描绘的途径。所述有机体可含有wood-ljungdahl途径的功能性甲基分支、合成乙酰-coa的能力和从乙酰-coa合成1,4-丁二醇的能力。为了产生更好的生产者,可利用代谢建模来优化生长条件。也可用建模来设计基因剔除,其另外优化途径的利用(参见例如美国专利公开案us2002/0012939、us2003/0224363、us2004/0029149、us2004/0072723、us2003/0059792、us2002/0168654和us2004/0009466,和美国专利第7,127,379号)。建模分析允许可靠地预测使代谢朝着更有效产生乙酰-coa或来源于乙酰-coa的产物的方向移动对细胞生长的影响。一种鉴别和设计有利于期望产物的生物合成的代谢改变的计算方法是optknock计算框架(burgard等人,biotechnol.bioeng.84:647-657(2003))。optknock是一种代谢建模和模拟程序,其暗示可形成过量产生目标产物的遗传稳定的微生物的基因缺失策略。特定来说,所述框架检查微生物的完整代谢和/或生物化学网络,以便暗示促使期望生物化学产物变成细胞生长的专性副产物的基因操作。通过用具有战略意义的基因缺失或其它功能基因破坏使生物化学生产与细胞生长偶联,在生物反应器中历经长时间后施加于经工程改造的菌株的生长选择压力可导致性能提高,因为生长与生物化学生产被强制偶联。最后,当构建基因缺失时,经设计的菌株还原成其野生型状态的可能性可以忽略,因为optknock所选择的基因会从基因组完全移除。因此,所述计算方法可用于鉴别可实现期望产物的生物合成的替代途径,或与非天然存在的微生物有机体结合使用以便进一步优化期望产物的生物合成。简言之,optknock是本文中用于指代建模细胞代谢的计算方法和系统的术语。optknock程序涉及将特定约束纳入通量平衡分析(fba)模型中的模型和方法的框架。这些约束包括例如定性动态信息、定性调控信息和/或dna微阵列实验数据。optknock还例如通过缩窄经由通量平衡模型产生的通量边界,随后探测在基因添加或缺失存在下代谢网络的性能极限来计算各种代谢问题的解决方案。optknock计算框架允许构建能够有效地询问代谢网络的性能极限的模型公式,并提供对所得混合整数线性规划问题求解的方法。本文中称为optknock的代谢建模和模拟方法是描述于例如2002年1月10日申请的美国公开案2002/0168654、2002年1月10日申请的国际专利第pct/us02/00660号和2007年8月10日申请的美国专利申请案第11/891,602号,以及wo/2008/115840中。另一种鉴别和设计有利于产物的生物合成产生的代谢变化的计算方法是被称作的代谢建模和模拟系统。这种计算方法和系统是描述于例如2002年6月14日申请的美国公开案2003/0233218和2003年6月13日申请的国际专利申请案第pct/us03/18838号中。是一种计算系统,可用于产生硅中(insilico)网络模型并模拟质量、能量或电荷通过生物系统的化学反应的通量,以便界定含有化学反应在系统中任何和所有可能的功能性的解空间,从而确定生物系统的允许活性的范围。这种方法被称作基于约束的建模,因为解空间是由例如所包括反应的已知化学计量以及反应热力学和与通过反应的最大通量能力约束等约束界定。可询问这些约束所界定的空间以确定生物系统或其生物化学组分的表型能力和行为。这些计算方法与生物现实一致,因为生物系统适用性强且可以许多不同方式获得相同结果。经由进化机制设计生物系统,所述进化机制已经受所有活系统必须面对的基本约束限制。因此,基于约束的建模策略涵盖这些一般现实。此外,经由缩窄约束而对网络模型连续施加进一步约束的能力导致解空间的尺寸变小,从而提高生理性能或表型的预测精确性。根据本文所提供的教导和指导,所属领域技术人员将能够应用代谢建模和模拟的各种计算框架,以便设计和实施期望化合物在宿主微生物有机体中的生物合成。所述代谢建模和模拟方法包括例如上文以和optknock示例的计算系统。为了说明本发明,本文关于建模和模拟的optknock计算框架描述了一些方法。所属领域技术人员将知悉如何使用optknock对本领域中熟知的任何其它代谢建模和模拟计算框架和方法应用代谢变化的鉴别、设计和实施。上文所述的方法将提供一组用于破坏的代谢反应。所述组内每个反应的消除或代谢修饰可导致期望产物在有机体的生长期中作为专性产物产生。因为这些反应是已知的,所以二层optknock问题的解决方案也将提供催化这一组反应内每个反应的一种或多种酶的相关编码基因。对于一组反应和其参与每个反应的酶的对应编码基因的鉴别一般是自动化方法,这可经由将所述反应与在酶和编码基因之间具有关系的反应数据库相关联来实现。一旦得到鉴别,就通过至少一种编码这一组反应内每个代谢反应的基因的功能破坏在目标细胞或有机体中实施打算破坏以产生期望产物的这一组反应。一种尤其有用的实现反应组的功能破坏的方法是缺失每种编码基因。然而,在一些情况下,通过其它基因畸变破坏反应可能是有利的,包括例如突变、调控区(例如启动子或调控因子的顺式结合位点)缺失或在许多位置中的任一个位置截断编码序列。举例来说,当希望快速评定产物偶联时,或当遗传逆转不太可能发生时,产生少于基因集合的总体缺失的缺失的这些畸变可能是有利的。为了针对上述二层optknock问题确定其它生产解决方案,从而产生用于破坏的其它各组反应或可实现生物合成(包括期望产物的生长偶联型生物合成)的代谢修饰,可实施被称作整数分割的优化方法。所述方法是通过对上文示例的optknock问题迭代求解来进行,其中在每次迭代时纳入被称作整数分割的另一种约束。整数分割约束有效地防止求解过程选择在任何先前迭代中鉴别的完全相同的一组反应,所述迭代强制产物生物合成与生长偶联。举例来说,如果先前鉴别的生长偶联型代谢修饰规定反应1、2和3用于破坏,那么以下约束防止在随后求解中同时考虑相同的反应。整数分割方法在本领域中是熟知的且可描述于例如burgard等人,biotechnol.prog.17:791-797(2001)。和本文关于与代谢建模和模拟的optknock计算框架组合使用而描述的所有方法一样,减少迭代计算分析中的冗余度的整数分割方法也可与本领域中熟知的其它计算框架(包括例如)一起应用。本文中示例的方法允许构建以生物合成方式产生期望产物的细胞和有机体,包括强制目标生物化学产物的产生与经工程改造以具有所鉴别基因变异的细胞或有机体的生长偶联。因此,本文所述的计算方法允许鉴别和实施通过选自optknock或的硅中方法鉴别的代谢修饰。这组代谢修饰可包括例如一种或多种生物合成途径酶的添加和/或一种或多种代谢反应的功能破坏,包括例如通过基因缺失来破坏。如上文所讨论,optknock方法的开发是基于突变型微生物网络当经历长期生长选择时可朝向其以计算机预测的最大生长表型进化这一前提。换句话说,所述方法调节有机体在选择性压力下自我优化的能力。optknock框架允许对基于网络化学计量迫使生物化学生产与细胞生长偶联的基因缺失组合进行穷举。对于最佳基因/反应剔除的鉴别需要对二层优化问题求解,所述问题选择活性反应组,使得所得网络的最佳生长答案过量产生目的生物化学物(burgard等人,biotechnol.bioeng.84:647-657(2003))。大肠杆菌代谢的硅中化学计量模型可用于鉴别先前示例的代谢途径的必需基因,且描述于例如美国专利公开案us2002/0012939、us2003/0224363、us2004/0029149、us2004/0072723、us2003/0059792、us2002/0168654和us2004/0009466,以及美国专利第7,127,379号中。如本文所公开,optknock数学框架可用于定位导致期望产物的生长偶联型生产的基因缺失。此外,二层optknock问题的解决方案仅提供一组缺失。为了列举所有有意义的解决方案、即导致生长偶联型生产形成的所有剔除集合,可实施被称作整数分割的优化技术。这要求对optknock问题迭代求解,其中在每次迭代时纳入被称作整数分割的另一种约束,如上文所讨论。应了解不会对本发明的各种实施方案的活性造成实质影响的修饰也可涵盖在本文提供的本发明的定义中。因此,以下实施例打算说明但不限制本发明。实施例实施例i用于合成气发酵的有机体和途径本实施例描述能利用合成气的有机体和示例性途径。多年来,已经分离出至少三十种不同的有机体,且其显示可利用合成气或合成气的组分(例如co、co2和h2)生长(henstra等人,curr.opin.biotechnol.18:200-206(2007);sipma等人,crit.rev.biotechnol.26:41-65(2006))。表1提供所述有机体的实例以及其许多性质,例如最佳生长温度、最佳生长ph、倍增时间、产物概况和生理群。表1:co利用物种的实例和其生理特征。从henstra等人,curr.opin.biotechnol.18:200-206(2007);sipma等人,crit.rev.biotechnol.26:41-65(2006))改编。被考虑利用合成气的一种有机体类型是嗜热产乙酸菌,因为其能耐受高达72℃的温度,这会减少污染问题并降低与经由蒸馏分离例如丁醇等产物相关的加热成本。然而,尚未证实嗜热细菌可从合成气产生醇,其主要产物为氢气、乙酸和/或h2s。产乙酸嗜热细菌的倍增时间也比嗜温产乙酸菌要长。因此,最初的研究是集中于用嗜温产乙酸菌产生例如丁醇等期望产物,因为这些有机体具有最快的倍增时间且已经显示可从合成气产生醇类。最初的表征是对杨氏梭菌和嗜羧酸梭菌进行。在所有的合成气利用型有机体中,杨氏梭菌具有关于其代谢能力和最佳发酵条件的丰富知识体系。嗜羧酸梭菌已显示利用合成气生长期间可天然产生少量的丁醇(henstra等人,curr.opin.biotechnol.18:200-206(2007))。一些示例性合成气利用型有机体的代谢途径是已知的。图1和2显示两种利用合成气的示例性途径。例如杨氏梭菌和嗜羧酸梭菌等产乙酸菌可利用从己糖到一氧化碳的范围内的多种碳源生长。例如葡萄糖等己糖首先经由embden-meyerhof-parnas(emp)糖酵解代谢为丙酮酸,其接着经由丙酮酸:铁氧还蛋白氧化还原酶转化为乙酰-coa。乙酰-coa可用于组建生物质前体或可转化为乙酸,其经由乙酸激酶和磷酸转乙酰酶产生能量。葡萄糖至乙酸、能量和还原当量的总体转化是:c6h12o6+4adp+4pi→2ch3cooh+2co2+4atp+8[h]产乙酸菌甚至从葡萄糖中提取更多的能量供应到乙酸转化,同时也通过进一步经由wood-ljungdahl途径将co2转化为乙酸来维持氧化还原平衡。2co2+8[h]+nadp+npi→ch3cooh+natp以上等式中的系数n表示这种转化是产生能量的过程,因为许多产乙酸菌可在co2存在下经由wood-ljungdahl途径生长,甚至在没有葡萄糖的情况下也可生长,只要存在氢以便供应必需的还原当量即可。2co2+4h2+nadp+npi→ch3cooh+2h2o+natp图3所说明的wood-ljungdahl途径与na+或h+离子梯度的产生偶联,所述离子梯度可分别经由na+或h+依赖性atp合成酶产生atp(muller,appl.environ.microbiol.69:6345-6353(2003))。基于这些已知的转化,产乙酸菌也可具有利用co作为唯一碳源和能源的能力。特定来说,co可经氧化以产生还原当量和co2,或可被直接同化成乙酰-coa,其随后转化为生物质或乙酸。4co+2h2o→ch3cooh+2co2然而,当存在足够的氢以满足还原当量的需求时,甚至可获得更高的乙酸产率。2co+2h2→ch3cooh根据图3,经由乙酰-coa产生乙酸时会产生一个atp分子,而从乙酰-coa产生乙醇时则不会产生atp分子且需要两个还原当量。因此不预期从合成气产生乙醇会在无乙酸产生的情况下产生足够用于细胞生长的能量。然而,在某些条件下,杨氏梭菌主要从合成气产生乙醇(klasson等人,fuel72:1673-1678(1993)),表明以下途径的一些组合实际上不产生足以支持细胞生长的能量。2co2+6h2→ch3ch2oh+3h2o6co+3h2o→ch3ch2oh+4co22co+4h2→ch3ch2oh+h2o例如深红红螺菌等产氢细菌也可从co和水转化为氢气的过程产生能量(参见图3)(sipma等人,crit.rev.biotechnol.26:41-65(2006))。关键机制是能量转换氢化酶(ech)和co脱氢酶的协同作用。co脱氢酶从co供应电子,其随后通过ech将质子还原为h2,ech的活性与产生能量的质子转移偶联。最终结果是经由水煤气变换反应产生能量。合成气发酵的产物概况是通过选择有机体和实验条件来确定。举例来说,杨氏梭菌产生乙醇与乙酸的混合物(klasson等人,fuel72:1673-1678(1993);gaddy和clausen,美国专利第5,173,429号),而嗜羧酸梭菌产生乙醇、乙酸、丁醇和丁酸的混合物(liou等人,int.j.syst.evol.microbiol.55(pt5):2085-2091(2005))。已经在杨氏梭菌中报导了分别高达26.8g/l和12.4g/l的乙酸和生物质浓度以及低于1g/l的乙醇浓度(gaddy,美国专利第5,807,722、6,136,5776,340,581号)。然而,通过在梭菌中相对于酸产生而增加溶剂形成的传统方法,例如限制营养物、改变培养基、降低ph、添加还原剂等,所述产物反应可朝向增加乙醇形成的方向移动。已经描述了产物曲线对许多条件的敏感性,例如泛酸钙限制、钴限制、h2供应过多、co供应过度、乙酸调节等(gaddy等人,美国专利第7,285,402号)。在针对乙醇产生优化的条件下,在无细胞再循环的情况下,在杨氏梭菌中展示了分别为33.0g/l、4.0g/l和2.7g/l的乙醇、乙酸和细胞浓度。最大乙醇生产率在21g/l/天(无细胞再循环)到39g/l/天(存在细胞再循环)的范围内。也可测定合成气发酵对抑制剂的敏感性。为了产生特定产物而对嗜羧酸梭菌的发酵条件(liou等人,int.j.syst.evol.microbiol.55(pt5):2085-2091(2005))所作的优化工作报导较少。然而,许多最新研究已经集中于用合成气抑制剂来抑制嗜羧酸梭菌生长。特定来说,生物质所产生的发生炉气体中存在的抑制剂终止嗜羧酸梭菌生长和h2利用,但在引入仅由co、co2、n2和h2组成的“洁净”瓶装气体时,生长可得到恢复。气体通过0.025μm滤器可以使其清洁到足以允许细胞生长的程度,但h2利用仍被阻断(ahmed等人,biomassbioenergy30:665-672(2006))。对滤器的扫描电子显微镜分析表明焦油微粒而非灰分是细胞休眠的可能原因。潜在的焦油物质被鉴别为苯、甲苯、乙苯、对二甲苯、邻二甲苯和萘。在10-15天内用0.2μm滤器处理后,细胞则能够适应所存在的焦油。无论滤器尺寸是多少,h2利用都会中断,表明抑制氢化酶的组分无法被过滤。这种化合物随后被鉴别为一氧化氮。no在≥60ppm的含量下会抑制氢化酶(ahmed和lewis,biotechnol.bioeng.97:1080-1086(2007))。可执行类似研究以确定用于在特定有机体中利用合成气以产生期望产物的适当条件。在一示例性实施方案中,假设退出气化炉的合成气是通过旋风分离器、冷凝塔、洗涤器和0.2μm滤器,类似于先前所述的用于柳枝稷气化的系统(datar等人,biotechnol.bioeng.86:587-594(2004);ahmed等人,biomassbioenergy30:665-672(2006))。如先前所建议,使用与吹空气气化相反的吹氧气化,使得可获得低于40ppm的no含量(ahmed和lewis,biotechnol.bioeng.97:1080-1086(2007))。此外,对杨氏梭菌的研究揭示了低于2.7%的h2s含量没有抑制性(klasson等人,fuel72:1673-1678(1993)),甚至当细胞预先未经适应处理时也是如此,且预期含量低于从生物质乃至煤气化获得的合成气中的含量。此外,可经由进化或适应来产生对焦油微粒的耐受性(ahmed等人,biomassbioenergy30:665-67.(2006))。实施例ii设计和建模用于利用合成气的微生物菌株本实施例描述用于从合成气产生期望产物的示例性微生物菌株的设计。最初的研究是利用杨氏梭菌、嗜羧酸梭菌和深红红螺菌的基因组层面模型来设计能利用合成气作为碳源的微生物菌株。使用代谢模型和模拟算法开发利用合成气的菌株。利用期望微生物的基因组序列以及密切相关物种的序列来构建目标有机体的基因组层面的代谢模型。为了推动这种方法,genomatica已经开发出了一种综合方法,以便基于与现有的人工创建的高质量代谢模型的详尽序列对比,自动创建代谢网络的初稿。接下来,人工核查自动产生的基因-蛋白质-反应(gpr)指派(参见图2),且在genomatica的专利模型构建和模拟平台simphenytm内分类详细记录以确保这些记录尽可能的透明。为了产生作为示例性产物的丁醇,在不能天然产生丁醇的那些有机体(例如杨氏梭菌和深红红螺菌)中表达丁醇途径中的酶。使用基于约束的建模方法询问代谢模型(schilling等人,biotechnol.prog.15:288-295(1999);edwards等人,environ.microbiol.4:133-40(2002);varmaandpalsson,biotechnol.12:994-998(1994);patil等人,curr.opin.biotechnol.15:64-69(2004))。简言之,基于连续施加管理性物理化学约束,例如化学计量、热力学、容量和调节约束,基于约束的方法缩窄有机体可显示的可能表型的范围,而不是试图精确计算和预测有机体的表型(price等人,trendsbiotechnol.21:162-169(2003);price等人,nat.rev.microbiol.2:886-897(2004))。因此,代之以计算精确表型“答案”,即有机体在指定基因和环境条件下如何表现,所述方法可确定有机体可运作的表型答案的可行集合。一般来说,基因组层面的基于约束的模型已经显示可用于预测若干种生理特性(例如生长和副产物分泌模式)(edwards和palsson,proc.natl.acad.sci.usa97:5528-5533(2000);varma等人,appl.environ.microbiol.59:2465-2473(1993);varma和palsson,applenvironmicrobiol,60:3724-3731(1994);edwards等人,nat.biotechnol.19:125-130(2001)),确定底物利用的范围(edwards和palsson,上文,2000),确定用于生长的基本培养基(schilling等人,jbacteriol.184:4582-4593(2002)),预测适应进化的结果(ibarra等人,nature420:186-189(2002)),计算理论产物产率(varma等人,biotechnol.bioengineer.42:59-73(1993)),预测基因剔除表型(edwards和palsson,bmcbioinformatics1:1(2000);segre等人,proc.natl.acad.sci.usa99:15112-15117(2002);shlomi等人,proc.natl.acad.sci.usa102:7695-7700(2005))和比较不同有机体的代谢能力(forster等人,genomeres.13:244-253(2003))。基于这些预测能力,所述模型可用于表征工业微生物在实验室和生产规模的发酵条件下的代谢表现。基于约束的方法在其通常用于定位旨在改进菌株性能的成功基因操作的这一点上已经很成熟(bro等人,metab.eng.8:102-111(2006);alper等人,nat.biotechnol.23:612-616(2005);alper等人,metab.eng.7:155-164(2005);fong等人,biotechnol.bioeng.91:643-648(2005);park等人,proc.natl.acad.sci.usa104:7797-7802(2007))。继续监测特征以便实施条件的进一步优化。可通过确定基因剔除以增强期望产物的产生,包括期望产物(例如丁醇)的生长偶联型生产,对有机体进行额外优化(参见实施例v)。杨氏梭菌目前可将co、co2和h2的混合物转化为乙酸和乙醇,而嗜羧酸梭菌则产生乙酸、乙醇、丁酸和丁醇的混合物。深红红螺菌不会天然产生醇类,但已显示可积累高含量的聚-β-羟基链烷酸(pha)。建模分析允许预测使生物催化剂有机体的代谢朝向更有效产生期望产物(例如丁醇)的方向移动对细胞生长的影响。建模也指向旨在驱动通过期望产生途径(例如丁醇产生)的代谢通量的代谢操作。一种建模方法是二层优化方法optknock(burgard等人,biotechnol.bioengineer.84:647-657(2003)),其用于选择共同导致期望产物(例如丁醇)的生长偶联型生产的基因剔除。由于网络化学计量,迫使用基因剔除策略设计的菌株产生高含量的期望产物(例如丁醇)以供有效生长,因为所有其它的生长选择都被移除了。所述菌株是自身优化型且稳定的。因此,即使在面对高生长选择压力的情况下,所述菌株典型地仍然维持或改良生产水平,使得其适合于分批或连续生物工艺以及进化工程。设计若干种候选菌株且对产生条件进行优化。与使用原始过程参数的对照发酵一起,一式三份测试发酵条件。使用来自测试发酵的数据,可执行模拟以评定与预测结果相比,由过程变化所致的代谢变化。如果生产率显著达不到预期值,那么使用这种新知识执行进一步模拟以供设计过程的二次迭代,以便优化菌株。实施例iii开发用于目标有机体的基因工具本实施例描述用于目标有机体的基因操作和工程的工具的开发。在用于利用合成气的候选菌株中开发基因系统。具体地说,开发用于杨氏梭菌和嗜羧酸梭菌的基因系统。也测试深红红螺菌中的基因转化。测试抗生素抗性以确定用于筛选期望基因元件的潜在标记。举例来说,许多梭菌对红霉素和氯霉素敏感。使用熟知方法开发dna转移方法,所述熟知方法包括(但不限于)电穿孔、接合或超声波转化。对革兰氏阳性菌的若干种表达载体、尤其是丙酮丁醇梭菌中所用的载体执行其它测试,以便测定其在杨氏梭菌和/或嗜羧酸梭菌中表达期望基因元件的有效性。可通过用天然杨氏梭菌或嗜羧酸梭菌启动子替换载体启动子来开发其它载体。此外,测试用于基因操作的若干种自杀质粒,包括丙酮丁醇梭菌和解纤维梭菌(c.cellulolyticum)的自杀质粒。也测试针对其它梭菌开发的反义rna抑制的基因剔除技术。可获得用于嗜温物种解纤维梭菌(clostridiumcellulolyticum)和丙酮丁醇梭菌的转化、表达和反义rna抑制工具。解纤维梭菌是纤维素降解的模型系统(desvaux,femsmicrobiolrev.741-764(2005)),而丙酮丁醇梭菌产生例如丁醇等溶剂的能力已得到充分表征(durre,biotechnol.j.2:1525-1534(2007))。值得注意的是,两种物种都能产生乙醇和氢气作为最终产物。因此,从这两种菌株获得的知识对于其它产乙醇和/或氢气的梭菌物种具有指导意义。已经开始解纤维梭菌中的定点诱变研究,且其可类似地用于其它候选有机体。这些研究的结果允许所产生的突变体的表型表征以及杨氏梭菌和/或嗜羧酸梭菌的基因工程。根据需要进行其它优化,以用不同的方法、质粒和条件开发基因系统从而获得最佳结果(lynd等人,microbiol.mol.biol.rev.66:506-577(2002))。更详细地说,表征杨氏梭菌和/或嗜羧酸梭菌的抗生素抗性能力。基因系统开发中的重要步骤是确定目标菌株的天然抗生素抗性特征。红霉素和氯霉素是两种抗生素,具有已显示在丙酮丁醇梭菌和解纤维梭菌的质粒上发挥功能的抗性标记(kashket和cao,appl.environ.microbiol.59:4198-4202(1993);green和bennett,biotechnol.bioeng.58:215-221(1998))。然而,其通常不可用于常见自杀质粒,所述自杀质粒通常含有氨苄西林、庆大霉素、利福平、卡那霉素和四环素的抗生素标记。为了确定抗生素敏感性,使杨氏梭菌和嗜羧酸梭菌在厌氧培养室内在确定成分培养基中生长(ahmed和lewis,biotechnol.bioeng.97:1080-1086(2007);younesi等人,bioresour.technol.6月18日,2007)。以1μg/ml到500μg/ml的梯度浓度添加上文所述的常规抗生素。使用例如typefp-1100-cbioscreenc机器(thermolabsystems;walthamma)等仪器控制生长温度在37℃且以不同间隔自动测量细胞生长的光学密度。所有的生理研究是重复进行,例如一式三份,以便可计算平均值和标准偏差。此生长数据表明杨氏梭菌和嗜羧酸梭菌对所测试的抗生素具有敏感性。抑制菌株生长的抗生素用于进一步研究中。更详细地说,开发dna转移方法和基因表达系统以提供用于基因工程的简单且有效的dna传递方法。用于细菌dna转移的方法包括接合、电穿孔、化学转化、转导和超声波转化。其中,电穿孔和接合先前已在若干梭菌物种中得到证实(jennert等人,microbiol.146:3071-3080(2000);tardif等人,j.ind.microbiol.biotechnol.27:271-274(2001);tyurin等人,j.appl.microbiol.88:220-227(2000);tyurin等人,appl.environ.microbiol.70:883-890(2004))。超声波转化是一种便利且有效的方法,其对革兰氏阴性菌提供高转化效率(>106cfu/μgdna)(song等人,nucl.acidsres.35:e129(2007))且同样可在革兰氏阳性菌中测试。测试电穿孔、超声波转化和接合对杨氏梭菌和嗜羧酸梭菌的转化效率。测试来自革兰氏阳性菌的具有不同复制子的各种质粒(例如pip404、pamβ1和pim13)。根据需要,基于抗生素抗性测试,使用亚克隆以合适的抗生素抗性基因盒置换现有质粒的抗生素抗性基因盒。使用标准分子亚克隆技术(包括限制性酶切、t4连接酶连接和大肠杆菌转化)对质粒进行工程改造(sambrook等人,molecularcloning:alaboratorymanualcoldspringharborlaboratorypress(1989))。根据许多其它梭菌物种的需要,这些质粒在dna传递前经甲基化以防止其被宿主细菌降解。对于电穿孔和接合,首先测试解纤维梭菌和丙酮丁醇梭菌的现有实验方案。变动例如电穿孔设置、回收时间和电穿孔缓冲液中的ca2+和mg2+浓度等参数以便优化转化效率。对于超声波转化,在先前所述(song等人,上文,2007))的低频超声波(例如40khz)和长回收时间条件下进行实验。一旦对某些质粒确立了有效的dna转移方案,就可对质粒进行工程改造以并入天然杨氏梭菌或嗜羧酸梭菌启动子,随后并入多克隆位点,从而产生表达载体。预期丙酮丁醇梭菌的现有表达载体,例如psos95和pimp1,很可能也在杨氏梭菌或嗜羧酸梭菌中工作而不需要改变启动子,因此这些质粒可用于初期测试。为了开发基因破坏方法,根据自杀质粒作为杨氏梭菌和/或嗜羧酸梭菌的自杀质粒的适用性,筛检出若干种自杀质粒,例如pknock、pds3.0、pspuc和pbluescriptskii。如上文所讨论,使用现有的抗生素抗性基因盒,或用合适的抗生素抗性基因盒将其替换。将选定靶基因的dna片段亚克隆到适当的自杀质粒中。被选定用作初始靶标的基因是编码负责乙醇生产的醇脱氢酶的基因。之所以选择这些基因是因为其导致形成副产物,很可能被鉴别为产丁醇菌株的破坏靶标,且提供通过分析发酵液中的乙醇进行筛选的简单筛检法。因为嗜羧酸梭菌中的醇脱氢酶具有宽广的底物特异性,所以如果这些酶的缺失除了降低乙醇产量外还会降低丁醇产量,那么可与其它丁醇途径基因一起克隆促进丁醇形成超过乙醇形成的醇脱氢酶(例如丙酮丁醇梭菌的adhe2)(atsumi等人,metab.eng.sep14,2007)以构建丁醇途径。工程改造的自杀质粒经甲基化且转移到杨氏梭菌和嗜羧酸梭菌中。在含有适当抗生素的固体培养基上筛选克隆。使用经破坏基因组区域的pcr扩增和随后测序、southern印迹技术和生理学研究来校验基因组中被靶向基因的正确破坏。表达系统也可用作基因破坏的替代方案以表达靶基因的反义rna,其将抑制但不会完全终止靶基因的基因表达。因此,反义rna系统充当期望基因的基因剔除的便利方法。实施例iv深红红螺菌的遗传评定本实施例描述针对深红红螺菌开发基因工具,深红红螺菌是利用合成气的有机体。深红红螺菌是一种革兰氏阴性的紫色非硫细菌,其在厌氧条件下氧化co(kerby等人,j.bacteriol.177:2241-2244(1995);kerby等人,j.bacteriol.174:5284-5294(1992))。深红红螺菌具有ni-fe-sco脱氢酶(codh),其催化co的氧化,这与氢气形成相偶联(ensign和ludden,j.biol.chem.1991.266:18395-18403(1991))。鉴于其co氧化能力和固定co2的能力,深红红螺菌能在黑暗中利用合成气有效地生长(do等人,biotechnol.bioeng.97:279-286(2007))。此外,已显示在利用合成气生长的过程中,至多34%的总细胞碳以聚-β-羟基链烷酸(pha)的形式被储存起来,所述pha主要由β-羟基丁酸(phb)组成。深红红螺菌能有效地引导细胞碳形成还原4碳化合物,这使其成为用于工程改造期望产物(例如1-丁醇)产生的有吸引力的平台。此外,已确立了用于深红红螺菌的基因系统,且可使用包括宽宿主范围rk2衍生物的多种克隆载体(saegesser等人,femsmicrobiol.lett.95:7-12(1992))。利用深红红螺菌的另一个有吸引力的方面在于,导致phb和1-丁醇合成的途径有很大一部分的重叠(图5)。因为已经针对phb作为生物降解塑料的用途对phb合成进行了研究,所以可获得关于phb途径调控和过度表达的大量信息(anderson和dawes,microbiol.rev.54:450-472(1990))。与创建如上文所讨论操作梭菌菌株所必需的基因工具平行,开发由丙酮丁醇梭菌的形成1-丁醇合成途径的若干种基因组成的合成操纵子。因为深红红螺菌已被测序并具有易操作的基因系统(saegesser等人,femsmicrobiol.lett.95:7-12(1992)),所以预期可在选定基因座中进行目标缺失。可使用允许产生无标记缺失的宽宿主范围的位点特异性基因切除系统(hoang等人,gene212:77-86(1998))。因此,有可能在单一菌株中产生多重基因敲除而无需依赖于多重抗生素筛选。这种方法可通过缺失phb合成酶基因(其是phb合成的最终步骤)进行测试(hustede等人,femsmicrobiol.lett.72:285-290(1992))。之所以选择phb合成酶基因是因为phb合成很可能会与所提到的丁醇途径竞争4碳前体和还原当量(图5)。扭脱甲基杆菌(methylobacteriumextorquens)是一种已知可积累30重量%以上的phb的革兰氏阴性菌,已报导其中phb合成酶基因的成功缺失并不会对生长产生有害影响(korotkova和lidstrom,j.bacteriol.183:1038-1046(2001))。实施例v工程改造微生物以从合成气产生丁醇本实施例描述工程改造微生物以从合成气产生丁醇。在最初研究中,使用梭菌菌株、尤其嗜羧酸梭菌针对丁醇的产生和耐受性来工程设计合成气的利用。嗜羧酸梭菌已显示可从合成气产生丁醇(liou等人,int.j.syst.evol.microbiol.55(pt5):2085-2091(2005))。对嗜羧酸梭菌进行工程改造以提高合成气利用效率,提高从合成气产生作为示例性期望产物的丁醇的效率,并且提高产物耐受性从而可获得较高产率的期望产物。初步代谢网络分析已经揭示了来源于木质纤维素的合成气转化为丁醇的理论转化率有利地与糖发酵法相当。合成气到丁醇:12co+5h2o→8atp+8co2+1c4h10o4co+8h2→4atp+3h2o+1c4h10o4co2+12h2→2atp+7h2o+1c4h10o糖到丁醇:1c6h12o6→2atp+2co2+1h2o+c4h10o1.2c5h10o5→1.7atp+2co2+1h2o+c4h10o鉴于生物质气化可最佳提供1:1的co/h2比,因此产生1摩尔丁醇将需要12摩尔co+h2。重要的是,合成气通过发酵转化为丁醇是产能过程,因此支持高产物产率下的细胞生长。此外,初期计算揭示基质成本低于等量糖所需的成本。如上文所讨论,利用模型和基因工具来设计促进丁醇或其它期望产物作为细胞生长的专性产物产生的菌株。换言之,对细胞进行工程改造,使得丁醇成为利用co生长的过程中必需的电子冷阱。构建菌株,其可具有基因剔除与适当酶的过度表达的组合,且可经进化以获得改良的产生和生长条件耐受性。为了构建产生丁醇的梭菌菌株,使用上文所论述的基因组分析来鉴别实现和/或改进杨氏梭菌和嗜羧酸梭菌中的丁醇产生所必需的生物途径。可通过增加合成气利用途径和/或丁醇产生途径蛋白质和酶的表达来获得丁醇产生的额外改进。为了表达被靶向生物途径中的一种或多种基因,使用如上文所述开发的基因表达载体。如果存在一种以上基因,那么将基因通过pcr扩增且克隆到表达载体中作为合成操纵子。所得表达质粒转移到杨氏梭菌和嗜羧酸梭菌中。使用northern印迹技术和/或实时pcr或其它合适技术检查转录水平下的基因表达。为了改进丁醇产生,很可能使杨氏梭菌和嗜羧酸梭菌的一种或多种内源基因失活,从而使氧化还原电位朝向丁醇产生的方向前进。为此,被靶向基因的内部dna片段将通过pcr扩增且克隆到自杀质粒中。然后将质粒转移到杨氏梭菌和嗜羧酸梭菌中,从而导致单一交换组合对靶基因造成破坏。通过对从经破坏基因组位点扩增的pcr产物进行测序和/或southern印迹技术,或使用其它合适的分析技术来证实正确的破坏。如果存在一种以上被靶向基因,那么对自杀质粒进行工程改造以改变抗生素标记,使得可在单一菌株中产生多重基因剔除。预期至多3到6个基因缺失可能有利于优化丁醇产生。为了针对丁醇产生对深红红螺菌进行基因工程,开发由若干种形成丙酮丁醇梭菌中的丁醇合成途径的基因组成的合成操纵子。允许大肠杆菌中产生丁醇的类似方法最近已有报导,证实了革兰氏阴性有机体中所述途径的异源表达的可能性(atsumi等人,metab.eng.9月14日,2007)。深红红螺菌的丁醇产生中的必需基因可在宽宿主范围的表达载体上表达。表达可使用例如tac启动子等诱导型启动子来控制。使用融合pcr技术构建合成型4基因操纵子,且其包括负责巴豆酸酶、丁酰辅酶a脱氢酶、电子传递黄素蛋白和醛/醇脱氢酶活性的基因。已使用融合/装配pcr技术构建用于异源宿主中的表达的合成操纵子(craney等人,nucl.acidsres.35:e46(2007);hill等人,mol.gen.genet.226:41-48(1991))。将丁醇操纵子转化到野生型和phb合成缺陷型深红红螺菌菌株中,且如下所述进行测试。也有可能必须靶向一种以上基因以便基于建模研究进行移除。这些缺失可使用如上所述的无标记方法来实现。当构建中间菌株时,对其进行生理学测试以评估朝向丁醇产生方向的进展,以及维持稳定生长和降低的副产物形成的能力。最初在1ml微型反应器(例如microreactortechnologies,inc.;mountainview,ca)中对生长和丁醇产生执行初始筛检。可控制例如24孔板等配制的ph、温度和气体组成。作为下一步骤,在温度和气体组成受控的培养箱中剧烈振荡血清瓶。这允许对气体顶部空间以及液相进行取样和分析。可通过气相色谱(gc/ms)或hplc,使用常规程序分析产物,例如丁醇、乙醇和有机酸。如先前所述(najafpour和younesi,enzymemicrob.technol.38:223-228(2006)),使用15%ar作为内标,通过gc联合热导检测器检测来分析顶部空间中的h2、co和co2。在这些实验中,使用h2/co比为1/1的合成气。气体组成的影响在发酵优化期间探查。最初,分析具有一种或多种缺失的菌株以相对于野生型细胞比较生长和发酵概况。多重缺失菌株的生长有可能很差,同时不存在丁醇途径的增强表达。在野生型宿主中测试表达一种或多种丁醇途径基因或通过代谢建模鉴别的其它靶标的菌株,以评定增强通过丁醇途径的通量并初步评定哪些步骤可能作为瓶颈的能力。测试不同的基因顺序和(如果可能的话)交替的启动子和核糖体结合位点以优化合成操纵子构建体。将产生最积极结果的一种或多种构建体转化到含有规定基因缺失的宿主中,并如上所述进行测试。将结果与模型预测比较,以评定哪里可能存在未预见到的限制和代谢瓶颈。在进行基因工程操作后,可利用适应进化优化期望菌株中的生产。基于将丁醇产生与生长偶联的菌株设计,我们应用有助于使细胞的生长速率和/或产率得到改良且导致较高丁醇产率的选择压力。因此执行适应进化以改进生长和生产特征(fong和palsson,nat.genet.36:1056-1058(2004);alper等人,science314:1565-1568(2006))。基于这些结果,可利用随后的多轮建模和基因工程进一步优化生产。可在自动维持细胞处于长时间对数生长阶段的装置中执行进化工程步骤,所述维持是通过在达到稳定期之前于新鲜培养基中连续传代批次培养物来实现。特定来说,当达到某一细胞密度时,将具有对数生长细胞的一部分培养基从一个区域转移到邻近区域,同时添加新鲜培养基进行稀释。通过自动进行光学密度测量和液体处理,可以高速率执行连续转移,因此接近恒化器用于发展细胞适应性的效率(dykhuizen,methodsenzymol.224:613-631(1993))。然而,与恒化器将细胞维持在单一容器中相比,此程序消除了不利地选择适合于壁生长的细胞的可能性(chao和ramsdell,j.gen.microbiol.131:1229-1236(1985);lynch等人,nat.methods4:87-93(2007))。此外,这种方法允许细胞维持在确保梭菌生长所必需的严格厌氧条件的封闭系统中。适应进化可扮演的另一角色是发展更耐受丁醇和杂质(例如nox和焦油)的菌株。杨氏梭菌和嗜羧酸梭菌的丁醇耐受含量已被公开,且这是在用于确定耐受含量的野生型细胞中测量的。已经报导野生型丙酮丁醇梭菌具有约180mm(1.2%w/v)的耐受量(tomas等人,appl.environ.microbiol.69:4951-4965(2003)),且其已被工程改造以实现高达2.1%的耐受含量(ezeji等人,chem.rec.4:305-314(2004))。目前有两种方法主要用于改进梭菌的丁醇耐受能力。一种方法涉及经由脂质含量的合理基因修饰,或通过例如连续富集(soucaille等人,curr.microbiol.14:295-299(1987))或随机诱变(jain等人,美国专利第5,192,6731993号)等进化方法改变膜的脂质组成和流动性。然而,耐受量是多种因素的复变函数且难以仅仅通过定向修饰获得。此外,已有报导细胞会在高丁醇浓度下溶解(vanderwesthuizen等人,appl.environ.microbiol.44:1277-1281(1982))。因此,菌株的优化是基于遗传学、进化和代谢建模的组合。野生型菌株可在连续增加的丁醇浓度存在下适应性地进化,以证实梭菌中的丁醇耐受性可经由这个过程获得提高。一个目标是通过使细胞进化以获得丁醇耐受性(例如高达25g/l的浓度)来优化细胞。可使用类似程序评估菌株对合成气杂质(例如no和焦油中普遍存在的芳香族化合物)的耐受性。用于优化生产和/或杂质耐受性的适应进化可依序或同时进行。这种方法也可与丁醇耐受性和膜流动性的相关基因的定向突变整合到一起,以便优化适合于商业规模生产的耐受含量。图4a和图4b说明示例性合成气制丁醇方法。图4a说明利用合成气产生丁醇的方法的方块流程图。实施例vi开发和优化合成气发酵方法本实施例描述合成气发酵方法的开发和优化。执行使用真正合成气的实验室规模合成气发酵,以显示并优化商业规模生产的目标产率。合成气发酵中重要的过程考虑因素有高生物质浓度和良好的气-液传质(bredwell等人,biotechnol.prog.15:834-844(1999))。co在水中的溶解度稍微小于氧在水中的溶解度。在控制发酵罐中执行连续充气发酵,其中通过质谱测定法和周期液体取样进行恒定废气分析并通过gc和hplc进行分析。液相可以分批模式运行。丁醇和副产物形成是作为时间的函数来测量。虽然最终工业方法很可能具有连续液流,但仍可利用分批操作来研究表征和优化的早期阶段中的生理学。这些系统中的所有管道都是玻璃或金属以便维持厌氧条件。用玻璃料执行气体鼓泡以降低气泡尺寸并改进质量传递。测试在约0.1到1vvm(每分钟的蒸气体积)范围内的各种鼓泡速率。为了获得气体吸收率的精确测量,执行暂时停止气流的周期性挑战,并将气相组成作为时间的函数来监测。也开发专门用于合成气利用的发酵系统。虽然用经工程改造的有机体测试设计,但发酵系统的测试仍可与菌株开发平行进行,其中首先使用野生型有机体。为了实现总体目标生产率,使用细胞滞留或再循环方法。关于连续运行的所述系统的一个常见问题是细胞可能会进化为非生产表型。因为有机体是经设计用于偶联生长来产生期望产物,所以有机体在遗传上是稳定的。一种增加微生物浓度的方法是经由切向流膜(tangentialflowmembrane)从测流再循环细胞。也可使用重复分批培养,如先前关于穆尔氏菌(moorella)的乙酸生产所述(sakais.,y.nakashimada,k.inokuma,m.kita,h.okada,和n.nishio,acetateandethanolproductionfromh2andco2bymoorellasp.usingarepeatedbatchculture.j.biosci.bioeng.99:252-258(2005))。也可使用各种其它方法(bredwell等人,biotechnol.prog.15:834-844(1999);datar等人,biotechnol.bioeng.86:587-594(2004))。可测试其它优化(例如1.5atm的超压)以改进质量传递(najafpour和younesi,enzymemicrob.technol.38:223-228(2006))。一旦使用纯h2/co作为进料获得了令人满意的表现,则产生含有可能存在于商业合成气中的抑制剂的合成气混合物。举例来说,典型杂质概况为4.5%ch4、0.1%c2h2、0.35%c2h6、1.4%c2h4和150ppm一氧化氮(datar等人,biotechnol.bioeng.86:587-594(2004))。由例如苯、甲苯、乙苯、对二甲苯、邻二甲苯和萘等化合物代表的焦油以ppm水平添加以测试对生产的任何影响。举例来说,已经显示40ppm的no对嗜羧酸梭菌具有抑制性(ahmed和lewis,biotechnol.bioeng.97:1080-1086(2007))。培养物在转移到发酵罐之前以摇瓶培养法测试。还测试这些潜在抑制化合物的不同含量以便定量其对细胞生长的影响。所述知识用于制定合成气纯度的各种规格,这将用于规模化研究和生产中。如果发现有任何特定组分难以从用于规模化的合成气中减少或移除,那么可如上所述利用适应进化程序,从而使细胞耐受一种或多种杂质。实施例vii用于产生合成气利用型微生物的最小基因集合本实施例描述如何确定用于产生合成气利用型微生物的最小基因/蛋白质集合,尤其是在无法天然利用合成气产生期望产物的微生物中。一般来说,微生物具有产生在生物合成中(例如在甲硫氨酸生产中)作为常见中间物的四氢叶酸和甲基-四氢叶酸(me-thf)的能力。因此,上文所述且在图1中展示的甲基分支并不是利用合成气的有机体的唯一特征。然而,已经发现me-thf的产生所必需的酶在合成气利用型有机体中的活性远高于其在不利用合成气的有机体中的活性。事实上,来自产乙酸菌的四氢叶酸依赖性酶的活性是来自其它来源(例如大肠杆菌和真核生物)的所述酶的活性的50到100倍(morton等人,geneticsandmolecularbiologyofanaerobicbacteria,m.sebald编,第28章,第389-406页,springer-verlage,newyork,ny(1993))。确定基因/蛋白质集合以供设计可利用合成气的有机体的更适当且唯一的方法是使用所述途径的羰基分支(参见图2)。此分支包含用于以下六种蛋白质的基因:钴酰胺类咕啉/铁硫蛋白甲基转移酶、一氧化碳脱氢酶(codh)、乙酰-coa合成酶(acs)、乙酰-coa合成酶二硫键还原酶和co耐受性氢化酶。因此,这六种基因/蛋白质代表了用于赋予能产生乙酰-coa的合成气利用途径的一种或多种蛋白质的集合。实施例viii用于产生合成气利用型微生物的基因集合本实施例描述用于产生合成气利用型微生物的示例性基因集合。甲酸脱氢酶.甲酸脱氢酶是一种有两个亚单元的含硒代半胱氨酸的蛋白质,其催化热乙酸穆尔氏菌中co2并入甲酸中的过程(andreesen和ljungdahl,j.bacteriol.116:867-873(1973);li等人,j.bacteriol.92:405-412(1966);yamamoto等人,j.biol.chem.258:1826-1832(1983))。基因座moth_2312和moth_2313实际上是负责编码甲酸脱氢酶的α亚单元的一个基因,而β亚单元则由moth_2314编码(pierce等人,environ.microbiol.(2008))。编码容易发生co2还原的甲酸脱氢酶活性的另一组基因是由弗氏互营杆菌中的sfum_2703到sfum_2706编码(debok等人,eur.j.biochem.270:2476-2485(2003);reda等人,proc.natl.acad.sci.us.a.105:10654-10658(2008))。与其热乙酸穆尔氏菌对应物类似,sfum_2705和sfum_2706实际上也是一个基因。被假定执行相同功能的类似基因集合是在生氢氧化碳嗜热菌中由chy_0731、chy_0732和chy_0733编码(wu等人,plosgenet.1:e65(2005))。蛋白genbankid有机体moth_2312yp_431142热乙酸穆尔氏菌moth_2313yp_431143热乙酸穆尔氏菌moth_2314yp_431144热乙酸穆尔氏菌sfum_2703yp_846816.1弗氏互营杆菌sfum_2704yp_846817.1弗氏互营杆菌sfum_2705yp_846818.1弗氏互营杆菌sfum_2706yp_846819.1弗氏互营杆菌chy_0731yp_359585.1生氢氧化碳嗜热菌chy_0732yp_359586.1生氢氧化碳嗜热菌chy_0733yp_359587.1生氢氧化碳嗜热菌甲酰四氢叶酸合成酶.甲酰四氢叶酸合成酶消耗1个atp将甲酸连接到四氢叶酸上。这个反应在热乙酸穆尔氏菌中是由moth_0109的基因产物(lovell等人,arch.microbiol149:280-285(1988);lovell等人,biochemistry29:5687-5694(1990);o'brien等人,experientia.suppl.26:249-262(1976))、在尿酸梭菌中是由fhs的基因产物(whitehead和rabinowitz,j.bacteriol.167:205-209(1986);whitehead和rabinowitz,j.bacteriol.170:3255-3261(1988))且在生氢氧化碳嗜热菌中是由chy_2385的基因产物(wu等人,plosgenet.1:e65(2005))催化。蛋白genbankid有机体moth_0109yp_428991.1热乙酸穆尔氏菌chy_2385yp_361182.1生氢氧化碳嗜热菌fhsp13419.1尿酸梭菌次甲基四氢叶酸环化水解酶和亚甲基四氢叶酸脱氢酶.在热乙酸穆尔氏菌、大肠杆菌和生氢氧化碳嗜热菌中,次甲基四氢叶酸环化水解酶和亚甲基四氢叶酸脱氢酶是由moth_1516、fold和chy_1878的双功能基因产物分别产生(d'ari和rabinowitz,j.biol.chem.266:23953-23958(1991);pierce等人,environ.microbiol(2008);wu等人,plosgenet.1:e65(2005))。蛋白genbankid有机体moth_1516yp_430368.1热乙酸穆尔氏菌foldnp_415062.1大肠杆菌chy_1878yp_360698.1生氢氧化碳嗜热菌亚甲基四氢叶酸还原酶.wood-ljungdahl途径的甲基分支的最后步骤是由亚甲基四氢叶酸还原酶催化。在热乙酸穆尔氏菌中,所述酶对氧敏感且含有铁硫簇(clark和ljungdahl,jbiolchem.259:10845-10849(1984))。所述酶在大肠杆菌中是由metf编码(sheppard等人,j.bacteriol.181:718-725(1999)),且在生氢氧化碳嗜热菌中是由chy_1233编码(wu等人,plosgenet.1:e65(2005))。热乙酸穆尔氏菌基因和其生氢氧化碳嗜热菌对应物位于codh/acs基因簇附近,所述基因簇是由假定氢化酶和杂二硫键还原酶基因分隔。蛋白genbankid有机体metfnp_418376.1大肠杆菌chy_1233yp_360071.1生氢氧化碳嗜热菌乙酰-coa合成酶/一氧化碳脱氢酶(acs/codh)和相关蛋白.acs/codh是wood-ljungdahl途径的羰基分支的中心酶。其催化二氧化碳到一氧化碳的可逆还原,以及从一氧化碳、辅酶a和来自甲基化类咕啉-铁硫蛋白的甲基获得乙酰-coa的合成。类咕啉-铁硫蛋白是由甲基四氢叶酸经由甲基转移酶甲基化。acs/codh在外来宿主中的表达涉及引入以下蛋白质和其对应活性中的多种,即便不是全部的话。甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse)类咕啉铁硫蛋白(acsd)镍蛋白装配蛋白(acsf)铁氧还蛋白(orf7)乙酰-coa合成酶(acsb和acsc)一氧化碳脱氢酶(acsa)镍蛋白装配蛋白(cooc)一氧化碳脱氢酶/乙酰-coa合成酶活性所必需的基因典型地驻留在可作为延伸操纵子的天然基因组的有限区域中(morton等人,j.biol.chem.266:23824-23828(1991);ragsdale,crit.rev.biochem.mol.biol.39:165-195(2004);roberts等人,proc.natl.acad.sci.usa86:32-36(1989))。来自产乙酸菌热乙酸穆尔氏菌的此操纵子中的每种基因已在大肠杆菌中克隆并积极地表达(lu等人,j.biol.chem.268:5605-5614(1993);morton等人,上文,1991;roberts等人,上文,1989)。这些基因的蛋白质序列可由以下genbank登记号标识。产氢细菌生氢氧化碳嗜热菌可通过乙酰-coa合成酶利用一氧化碳作为生长基质(wu等人,plosgenet.1:e65.(2005))。在菌株z-2901中,乙酰-coa合成酶复合物因为移码突变而缺乏一氧化碳脱氢酶(we等人,上文,2005),而在菌株dsm6008中,已经纯化到这种蛋白质的功能性未移码全长形式(svetlitchnyi等人,proc.natl.acad.sci.usa101:446-451(2004))。来自菌株z-2901的生氢氧化碳嗜热菌基因的蛋白质序列可由以下genbank登记号标识。生氢氧化碳嗜热菌dsm6008的序列目前无法从公众可利用的数据库获得,但可容易地确定所述序列可以获得。产甲烷古细菌嗜乙酸甲烷八叠球菌也可利用一氧化氮生长,展现乙酰-coa合成酶/一氧化碳脱氢酶活性,且同时产生乙酸和甲酸(lessner等人,proc.natl.acad.sci.usa103:17921-17926(2006))。这种有机体含有两组编码acs/codh活性的基因(rother和metcalf,proc.natl.acad.sci.usa101:16929-16934(2004))。这两组嗜乙酸甲烷八叠球菌基因的蛋白质序列可由以下genbank登记号标识。acsc、acsd、acsb、acseps和acsa蛋白通常被称作产甲烷菌codh/acs的γ、δ、β、ε和α亚单元。例如热乙酸穆尔氏菌等产乙酸菌或例如生氢氧化碳嗜热菌等产氢细菌中并不存在ε编码基因的同源物。嗜乙酸甲烷八叠球菌中存在两种活性codh/acs操纵子的假设包括:催化性质(即km、vmax、kcat),其促进一氧化碳营养或解乙酸生长;或差异基因调控,其启动各种刺激以诱发codh/acs表达(rother等人,arch.microbiol.188:463-472(2007))。在热乙酸穆尔氏菌和生氢氧化碳嗜热菌中,其它codh编码基因位于acs/codh操纵子外部。这些酶提供从一氧化碳到二氧化碳的转化作用中提取电子或还原当量的能力。还原当量然后传递到受体,例如氧化铁氧还蛋白、nadp+、水或过氧化氢,以分别形成还原铁氧还蛋白、nadph、h2或水。在一些情况下,氢化酶编码基因与codh邻近。在深红红螺菌中,经编码的codh/氢化酶蛋白形成膜结合酶复合物,其被提议作为通过co转化为co2和h2而产生质子梯度形式的能量的位点(fox等人,j.bacteriol.178:6200-6208(1996))。生氢氧化碳嗜热菌的codh-i和其相邻基因已被提议基于其与深红红螺菌codh/氢化酶基因簇的类似性来催化类似的功能作用(wu等人,plosgenet.1:e65(2005))。也已显示生氢氧化碳嗜热菌codh-i在连接于电极时会展现强烈的co氧化和co2还原活性(parkin等人,j.am.chem.soc.129:10328-10329(2007))。对编码生氢氧化碳嗜热菌codh-ii和邻近蛋白coof的基因进行克隆和测序(gonzalez和robb,femsmicrobiol.lett.191:243-247(2000))。所得复合物是膜结合的,但codh-ii的细胞质部分显示可催化nadph的形成,这暗示合成代谢作用(svetlitchnyi等人,j.bacteriol.183:5134-5144(2001))。codh-ii的晶体结构也可获得(dobbek等人,science293:1281-1285(2001))。示例性codh和氢化酶基因的蛋白质序列可由以下genbank登记号标识。乙酰-coa合成酶二硫键还原酶.在热乙酸穆尔氏菌中,一组编码杂二硫键还原酶的基因(moth_1194到moth_1196)直接位于上文所述的acs基因簇的下游。此外,与热乙酸穆尔氏菌一样,生氢氧化碳嗜热菌含有一组直接在acse下游的编码杂二硫键还原酶的基因。氢化酶(hyd).不同于co和甲醇变为乙酰-coa或乙酸的氧化还原中性转化,以最高的可能产率产生还原程度更高的产物(例如乙醇、丁醇、异丁醇、异丙醇、1,4-丁二醇、琥珀酸、富马酸、苹果酸、4-羟基丁酸、3-羟基丙酸、乳酸、甲基丙烯酸、己二酸和丙烯酸)则需要从co和h2提取额外的还原当量(例如参见图7中的乙醇形成)。特定来说,还原当量(例如图6中的2[h])是通过co和水经由实施例ii中所述的一氧化碳脱氢酶转化为co2来获得,或者直接来自利用氢的氢化酶将电子从h2转移到受体(例如铁氧还蛋白、黄素氧还蛋白、fad+、nad+或nadp+)的活性。大肠杆菌和其它肠细菌天然具有编码至多4种氢化酶的多种基因(sawers,antonievanleeuwenhoek66:57-88(1994);sawers等人,j.bacteriol.164:1324-1331(1985);sawers和boxer,eur.j.biochem.156:265-275(1986);sawers等人,j.bacteriol.168:398-404(1986))。鉴于酶活性的多样性,大肠杆菌或另一种宿主有机体有可能提供足够的氢化酶活性以便分裂进入的分子氢并还原对应受体。大肠杆菌的内源氢裂解酶包括氢化酶3、使用铁氧还蛋白作为受体的膜结合酶复合物和也使用铁氧还蛋白受体的氢化酶4。氢化酶3和4是由hyc和hyf基因簇分别编码。大肠杆菌中的氢化酶活性也取决于hyp基因的表达,所述hyp基因对应的蛋白质与氢化酶复合物的装配有关(jacobi等人,arch.microbiol.158:444-451(1992);rangarajan等人,j.bacteriol.190:1447-1458(2008))。如果生产宿主缺乏足够的内源氢化酶活性,那么热乙酸穆尔氏菌氢化酶是合适的候选物。热乙酸穆尔氏菌可以co2作为独有的碳源生长,表明还原当量是从h2提取以允许经由wood-ljungdahl途径的乙酰-coa合成(drake,j.bacteriol.150:702-709(1982);drake和daniel,res.microbiol.155:869-883(2004);kellum和drake,j.bacteriol.160:466-469(1984))(参见图6)。热乙酸穆尔氏菌具有来自大肠杆菌的若干hyp、hyc和hyf基因的同源物。这些基因所编码的这些蛋白质序列可由以下genbank登记号标识。此外,热乙酸穆尔氏菌中存在若干种编码氢化酶和/或杂二硫键还原酶功能的基因簇,且其对应的蛋白质序列也在下文提供。hyp装配蛋白.热乙酸穆尔氏菌中基因与大肠杆菌hyp基因同源的蛋白质.氢化酶3.氢化酶4.热乙酸穆尔氏菌中基因与大肠杆菌hyc和/或hyf基因同源的蛋白质.热乙酸穆尔氏菌中其它的氢化酶编码基因簇.经工程改造而具有这些能力且天然也具有回补能力的宿主有机体(例如大肠杆菌)可能在合适的外部电子受体(例如硝酸盐)存在下,利用合成气所产生的乙酰-coa更有效地生长。这种电子受体是接受来自于经由琥珀酸脱氢酶而形成的还原苯醌的电子所必需的。添加外部电子受体的另一优点在于可从乙酰-coa的呼吸作用产生额外的能量用于细胞生长、维持和产物形成。替代策略涉及将丙酮酸铁氧还蛋白氧化还原酶(pfor)工程改造到菌株中以允许在不存在外部电子受体的情况下合成生物质前体。丙酮酸铁氧还蛋白氧化还原酶(pfor).在不存在外部电子受体的情况下,利用合成气和甲醇的厌氧生长通过允许经由丙酮酸铁氧还蛋白氧化还原酶(pfor)合成丙酮酸而赋予宿主有机体acs/codh活性。来自非洲脱硫弧菌的pfor已在大肠杆菌中克隆并表达,从而产生在氧存在下可稳定数天的活性重组酶(pieulle等人,j.bacteriol.179:5684-5692(1997))。氧稳定性在pfor中相对罕见,认为其是由非洲脱硫弧菌酶的多肽链中的60个残基的延伸引起的。热乙酸穆尔氏菌pfor也已得到充分表征(menon和ragsdale,biochemistry36:8484-8494(1997))且显示在自养生长期间在丙酮酸合成的方向上具有高活性(furdui和ragsdale,j.biol.chem.275:28494-28499(2000))。此外,大肠杆菌具有未被表征的开放阅读框ydbk,其编码与热乙酸穆尔氏菌pfor具有51%同一性的蛋白质。丙酮酸氧化还原酶活性的证据已有描述(blaschkowski等人,eur.j.biochem.123:563-569(1982))。这些示例性pfor酶的蛋白质序列可由以下genbank登记号标识。若干种其它的pfor酶已有描述(ragsdale,chem.rev.103:2333-2346(2003))。本实施例描述用于工程改造有机体以从包含co、co2和h2中的至少一种的气体产生乙酰-coa的示例性基因集合。实施例ix将合成气利用途径工程改造到微生物中本实施例描述工程改造微生物以使其含有合成气利用途径。除了提高具有利用co和/或co2作为碳源的天然能力的微生物(例如梭菌物种)的效率外(实施例ii、iii和v),不具有利用co和/或co2的天然能力的微生物也可被工程改造以表达一种或多种赋予co和/或co2利用途径的蛋白质或酶。一种示例性途径是wood-ljungdahl途径,其允许利用co和/或co2作为碳源,从而允许微生物利用合成气或其它气态碳源(参见实施例i和vii)。在初步研究中,无法天然利用合成气的大肠杆菌被用作目标有机体以便引入co和/或co2利用途径,例如wood-ljungdahl途径。wood-ljungdahl途径涉及对氧敏感的膜结合蛋白质以及在大肠杆菌中天然不存在的特异性辅因子。虽然已经将若干种wood-ljungdahl途径基因克隆到大肠杆菌中,但只有一种酶、即甲基转移酶被发现可以活性形式表达(roberts等人,proc.natl.acad.sci.usa86:32-36(1989))。从热乙酸梭菌纯化出羰基分支(参见图2)途径基因,这揭示了甲基-四氢叶酸到乙酰-coa的活体外转化研究所必需的最小酶集合(roberts等人,j.bacteriol.174:4667-4676(1992))。初步研究是针对将wood-ljungdahl途径、尤其羰基分支(图2)工程改造到大肠杆菌中,并测试生长和从甲基-四氢叶酸和合成气进行的乙酸产生。大肠杆菌提供一种用于开发能利用合成气或其它气态碳源的非天然存在的微生物的良好模型,因为其可进行基因操作且已知能够在厌氧条件下从葡萄糖有效地产生各种产物,例如乙醇、乙酸和琥珀酸。为了产生经工程改造而含有wood-ljungdahl途径的大肠杆菌菌株,使用熟知的分子生物学技术(参见例如sambrook,上文,2001;ausubel上文,1999;roberts等人,上文,1989)在大肠杆菌中表达所述途径的羰基分支所必需的蛋白质和酶的编码核酸(参见图2和实施例vii)。如先前所述,热乙酸梭菌的乙酰-coa合成中的关键蛋白质的编码基因簇已经在大肠杆菌中克隆并表达(roberts等人,上文,1989)。为了确保活性蛋白质的产生,需要特定地改变条件,例如培养基的金属组成。钴酰胺类咕啉/铁硫蛋白甲基转移酶、一氧化碳脱氢酶(codh)、乙酰-coa合成酶(acs)、乙酰-coa合成酶二硫键还原酶和co耐受性氢化酶的编码基因在大肠杆菌中克隆并表达,以便引入wood-ljungdahl途径的羰基分支(关于wood-ljungdahl途径基因,也参见ragsdale,criticalrev.biochem.mol.biol.39:165-195(2004))。因为大肠杆菌不能正常地合成钴胺素或钴胺素样辅因子,而这又是钴酰胺-类咕啉/铁硫蛋白活性所必需的,所以也可引入所述辅因子,或用于合成必需辅因子的蛋白质和酶的编码基因。可向培养基提供钴胺素或钴胺素样辅因子,但成本可能会限制这种方法用于规模化和商业制造。更好的替代方案是在大肠杆菌菌株中克隆和表达必需基因,从而表达钴胺素必需蛋白质。这已通过来自鼠伤寒沙门氏菌(salmonellatyphimurium)的含20个基因的钴胺素操纵子转移到大肠杆菌中并在其中进行功能性表达而得到证实(raux等人,j.bacteriol.178:753-767(1996))。使用用于确定所引入基因的表达的常规分析,例如northern印迹技术、mrna的pcr扩增、免疫印迹技术,或其它用于确认所引入基因的核酸和蛋白质表达的熟知分析,测试wood-ljungdahl途径基因的表达。经表达的酶的酶活性可单独测试,或根据例如乙酰-coa等产物的产量来测试(参见例如roberts等人,上文,1989)。经工程改造的大肠杆菌菌株利用co和/或co2作为碳源以便产生乙酰-coa的能力可使用气相色谱-质谱法(gcms)或液相色谱-质谱法(lcms)直接分析,或经由使用代谢性的放射性或同位素标记(例如放射性co或co2)并分析放射性标记在乙酰-coa产物中的并入情况或同位素标记的co或co2前体的并入情况,以及使用例如质谱法(gcms或lcms)或核磁共振光谱法(nmr)等技术的分析来分析。在存在或不存在h2的情况下,仅使用co和/或co2作为唯一碳源的大肠杆菌的生长是另一种针对全功能途径的有用测试。一旦功能性wood-ljungdahl途径被工程改造到大肠杆菌菌株中,菌株即被优化以便有效利用所述途径。可测试经工程改造的菌株以确定是否任何所引入的基因都以限制速率的水平表达。根据需要,可能限制途径的通量的一种或多种蛋白质或酶的增加表达可用于优化途径的利用以及乙酰-coa的产生。代谢建模可用于优化生长条件(参见实施例ii)。也可用建模来设计基因剔除,其另外优化途径的利用(参见实施例ii、iv和v,以及例如美国专利公开案us2002/0012939、us2003/0224363、us2004/0029149、us2004/0072723、us2003/0059792、us2002/0168654和us2004/0009466,和美国专利第7,127,379号)。建模分析允许预测使代谢朝着更有效产生乙酰-coa或其它期望产物的方向移动对细胞生长的影响。一种建模方法是二层优化方法optknock(burgard等人,biotechnol.bioengineer.84:647-657(2003)),其用于选择共同导致乙酰-coa或其它期望产物的生长偶联型生产的基因剔除,如下文所论述。由于网络化学计量,迫使用基因剔除策略设计的菌株产生高含量的期望产物以供有效生长,因为所有其它的生长选择都被移除了。所述菌株是自身优化型且稳定的。因此,即使在面对高生长选择压力的情况下,所述菌株典型地仍然维持或改良生产水平,使得其适合于分批或连续生物工艺以及进化工程。适应进化可用于进一步优化乙酰-coa的生产(参见实施例v)。因此执行适应进化以改进生长和生产特征(fong和palsson,nat.genet.36:1056-1058(2004);alper等人,science314:1565-1568(2006))。基于这些结果,随后多轮的建模、基因工程和适应进化可用于进一步优化生产和酶对合成气或合成气中杂质的耐受性。一旦经工程改造的微生物菌株被优化以便利用wood-ljungdahl途径,就可使用熟知方法且如例如实施例vi中所述对发酵方法进行优化以增加产率。举例来说,在0.5g/l/h下从合成气产生20g/l乙酸的生产力水平将代表理想的生产范围,可针对所述生产范围进一步优化菌株以有效地利用所述途径以及优化发酵条件,从而实现期望生产水平。虽然通过引入羰基分支以对经工程改造的微生物菌株赋予利用co和/或co2的能力进行例证,但也可使用类似方法向大肠杆菌引入用于产生甲基-四氢叶酸的酶。如上文实施例vii中所述,大肠杆菌具有产生甲基-四氢叶酸的能力,但来自产乙酸菌的thf依赖性酶具有特异性活性(morton等人,上文,1993)。使用上文所述的方法引入wood-ljungdahl途径的羰基分支,同时使用类似技术将甲基分支酶引入到大肠杆菌中。引入编码铁氧还蛋白氧化还原酶、甲酸脱氢酶、甲酰四氢叶酸合成酶、次甲基四氢叶酸环化水解酶、亚甲基四氢叶酸脱氢酶和亚甲基四氢叶酸还原酶中的一种或多种的基因(参见图1)。在这种情况下,引入所述基因是为了增加内源酶活性和/或增加利用co和/或co2产生甲基-四氢叶酸的效率。如上文所述执行途径和发酵条件的优化。此外,wood-ljungdahl途径的羰基和甲基分支皆可引入到同一微生物中。在所述经工程改造的有机体中,从co和/或co2产生甲基-四氢叶酸的产量增加可用于进一步增加经工程改造以便使用wood-ljungdahl途径的羰基分支利用co和/或co2的有机体中的乙酰-coa产生(参见图3和6)。乙酰-coa可用作其它期望产物的前体。一旦产生了产乙酰-coa微生物,则可向微生物中引入其它基因以利用乙酰-coa作为前体,从作为碳源的co和/或co2产生其它期望产物。举例来说,可引入用于产生丁醇的酶(参见图3和实施例v)。用于从乙酰-coa开始的丁醇途径的代表性基因有:乙酰-coa酰基转移酶atob;乙酰-coa硫解酶thl;3-羟基丁酰-coa脱氢酶hbd;巴豆酸酶crt;丁酰辅酶a脱氢酶bcd;电子传递黄素蛋白etf;醛/醇脱氢酶adhe2(参见atsumi等人,metabolicengineering,9月14日,2007)。美国申请案第11/891,602号(2007年8月10日申请)和wo/2008/115840例如描述用于产生其它期望产物(包括柠檬酸、4-羟基丁酸和1,4-丁二醇)的代谢途径,且可类似地引入用于所述途径的酶,例如琥珀酰辅酶a连接酶、琥珀酰辅酶a:辅酶a转移酶、琥珀酸半醛脱氢酶、4-羟基丁酸脱氢酶、谷氨酸:琥珀酸半醛转氨酶、4-羟基丁酰-coa转移酶、辅酶a依赖性醛脱氢酶、醇脱氢酶等。乙酰-coa直接进入所有细胞的tca循环,且琥珀酸是tca循环的中间物。因此,赋予能利用从co和/或co2产生的乙酰-coa的途径的其它酶可如上所述经工程改造和优化,以从经工程改造的微生物产生期望产物。实施例x用于从合成气和甲醇产生乙酰-coa的途径本实施例描述利用合成气和甲醇产生乙酰-coa的示例性途径。能够从合成气和甲醇产生乙酰-coa的有机体具有两种关键能力,其描绘于图7中。一种能力是功能性甲基转移酶系统,其允许从甲醇和thf产生5-甲基-四氢叶酸(me-thf)。另一种能力是组合co、辅酶a和me-thf的甲基以形成乙酰-coa的能力。有机体能够‘固定’来自外源co和/或co2和甲醇的碳,以合成乙酰-coa、细胞物质和产物。与利用完全wood-ljungdahl途径相比,用于从甲醇和合成气形成乙酰-coa的这种途径在能量方面具有优势。举例来说,合成气直接转化为乙酸是能量中性过程(参见图6)。特定来说,在通过甲酰基-thf合成酶形成甲酰基-thf的过程中消耗1个atp分子,而在经由乙酸激酶产生乙酸的过程中则产生1个atp分子。卷入甲醇的这种新策略通过确保从甲醇而不是co2获得甲基分支产物甲基-thf上的甲基来避免了atp消耗需求。这因此确保了乙酸形成具有正atp产出,从而帮助支持细胞生长和维持。经工程改造而具有这些能力且天然也具有回补能力的宿主有机体(例如大肠杆菌)可在合适的外部电子受体(例如硝酸盐)存在下,利用甲醇和合成气所产生的乙酰-coa生长。这种电子受体是接受来自于经由琥珀酸脱氢酶而形成的还原苯醌的电子。添加外部电子受体的另一优点在于可从乙酰-coa的呼吸作用产生额外的能量用于细胞生长、维持和产物形成。替代策略涉及将丙酮酸铁氧还蛋白氧化还原酶(pfor)工程改造到菌株中以允许在不存在外部电子受体的情况下合成生物质前体。经工程改造的有机体的另一特征是能够从分子氢提取还原当量。这允许高产率的还原产物,例如乙醇、丁醇、异丁醇、异丙醇、1,4-丁二醇、琥珀酸、富马酸、苹果酸、4-羟基丁酸、3-羟基丙酸、乳酸、甲基丙烯酸、己二酸和丙烯酸。有机体可从以下来源产生乙酰-coa、细胞物质和目标化学物:1)甲醇和co,2)甲醇、co2和h2,3)甲醇、co、co2和h2,4)甲醇和包含co和h2的合成气,和5)甲醇和包含co、co2和h2的合成气。成功地将这种途径工程改造到有机体中会涉及鉴别适当的酶集合,将其对应基因克隆到生产宿主中,优化这些基因的稳定性和表达,优化发酵条件,和分析发酵后的产物形成(参见实施例ii-iv)。下文描述催化合成气和甲醇转化为乙酰-coa所必需的途径的每一步骤的多种酶。为了工程改造生产宿主以利用合成气和甲醇,在微生物中表达一种或多种编码必需酶的外源dna序列。本实施例描述从合成气和甲醇产生乙酰-coa的示例性途径。实施例xi用于产生利用甲醇和合成气的微生物的基因集合本实施例描述用于产生利用甲醇和合成气的微生物的示例性基因集合。甲醇-甲基转移酶(mtr).经修饰的wood-ljungdahl途径在外来宿主中的表达(参见图7)需要一组甲基转移酶以便利用由甲醇提供的碳和氢以及由co和/或co2提供的碳。3种甲基转移酶蛋白质(表示为mtaa、mtab和mtac)的复合物发挥期望的甲醇甲基转移酶活性(naidu和ragsdale,j.bacteriol.183:3276-3281(2001);ragsdale,crit.rev.biochem.mol.biol.39:165-195(2004);sauer等人,eur.j.biochem.243:670-677(1997);tallant和krzycki,j.bacteriol.178:1295-1301(1996);tallant和krzycki,j.bacteriol.179:6902-6911(1997);tallant等人,j.biol.chem.276:4485-4493(2001))。甲醇甲基转移酶(mtab)和类咕啉蛋白(mtac).mtab是一种锌蛋白,催化甲基从甲醇转移到mtac、即类咕啉蛋白上。可在产甲烷古细菌,例如巴氏甲烷八叠球菌(maeder等人,j.bacteriol.188:7922-7931(2006))和嗜乙酸甲烷八叠球菌(galagan等人,genomeres.12:532-542(2002)),以及产乙酸菌热乙酸穆尔氏菌(das等人,proteins67:167-176(2007))中发现编码mtab和mtac的示例性基因。一般来说,mtab和mtac在染色体上彼此相邻,因为其活性紧密地相互依赖。巴氏甲烷八叠球菌、嗜乙酸甲烷八叠球菌和热乙酸穆尔氏菌(m.thermoaceticum)中的各种mtab和mtac编码基因的蛋白质序列可由以下genbank登记号标识。将来自巴氏甲烷八叠球菌的mtab1和mtac1基因yp_304299和yp_304298克隆到大肠杆菌并测序(sauer等人,eur.j.biochem.243:670-677(1997))。也可获得这种甲醇-钴胺素甲基转移酶复合物的晶体结构(hagemeier等人,proc.natl.acad.sci.usa103:18917-18922(2006))。巴氏甲烷八叠球菌中的mtab基因yp_307082和yp_304612是通过与yp_304299的序列同源性鉴别。一般来说,同源性搜索是鉴别甲醇甲基转移酶的有效方法,因为mtab编码基因与作用于替代底物(例如三甲胺、二甲胺、单甲胺或二甲硫醚)的甲基转移酶显示很小的相似性或不显示相似性。mtac基因yp_307081和yp_304611是基于其与mtab基因的邻近性以及其与yp_304298的同源性来鉴别。来自嗜乙酸甲烷八叠球菌的三组mtab和mtac基因已在遗传学、生理学和生物化学上得到表征(pritchett和metcalf,mol.microbiol.56:1183-1194(2005))。缺乏这三组基因中的两组的突变菌株能利用甲醇生长,而缺乏所有三组mtab和mtac基因的菌株则无法利用甲醇生长。这暗示每一组基因都在甲醇利用方面起作用。热乙酸穆尔氏菌mtab基因是基于其与产甲烷菌mtab基因的同源性以及其与甲醇引起的类咕啉蛋白mtac的相邻染色体邻近性来鉴别,mtac已被结晶(zhou等人,actacrystallogr.sect.fstruct.biol.cryst.commun.61:537-540(2005))且通过northern杂交和western印迹技术进一步表征(das等人,proteins67:167-176(2007))。甲基四氢叶酸:类咕啉蛋白甲基转移酶(mtaa).mtaa是一种锌蛋白,催化甲基在产甲烷菌中从mtac转移到辅酶m上或在产乙酸菌中从mtac转移到四氢叶酸上。mtaa还可利用甲基钴胺素作为甲基供体。可在产甲烷古细菌,例如巴氏甲烷八叠球菌(maeder等人,j.bacteriol.188:7922-7931(2006))和嗜乙酸甲烷八叠球菌(galagan等人,genomeres.12:532-542(2002)),以及产乙酸菌热乙酸穆尔氏菌(das等人,proteins67:167-176(2007))中发现编码mtaa的示例性基因。一般来说,催化甲基从ch3-mtac转移的mtaa蛋白难以在生物信息学上鉴别,因为其与其它类咕啉蛋白甲基转移酶具有相似性且在染色体上与mtab和mtac基因相邻定向。然而,许多mtaa编码基因已经得到表征。巴氏甲烷八叠球菌和嗜乙酸甲烷八叠球菌中的这些基因的蛋白质序列可由以下genbank登记号标识。克隆来自巴氏甲烷八叠球菌的mtaa基因yp_304602,对其测序并在大肠杆菌中功能性地过度表达(harms和thauer,eur.j.biochem.235:653-659(1996))。在嗜乙酸甲烷八叠球菌中,mtaa1是利用甲醇生长所必需的,而mtaa2则是不必要的,即便在mtaa2突变株中从甲醇产生甲烷被削弱了(bose等人,j.bacteriol.190:4017-4026(2008))。同样需要注意的是,在巴氏甲烷八叠球菌和嗜乙酸甲烷八叠球菌中还有多种尚未表征的其它mtaa同源物,但其也会催化类咕啉蛋白甲基转移酶活性。热乙酸穆尔氏菌中的假定mtaa编码基因是通过其与已表征的产甲烷菌mtaa基因的序列相似性来鉴别。特定来说,三种热乙酸穆尔氏菌基因与来自巴氏甲烷八叠球菌的yp_304602显示高度同源性(>30%序列同一性)。不同于天然催化甲基从ch3-mtac转移到辅酶m的产甲烷菌mtaa蛋白,鉴于四氢叶酸和辅酶m在产甲烷菌和产乙酸菌中的类似角色,热乙酸穆尔氏菌mtaa很可能将甲基转移到四氢叶酸。来自热乙酸穆尔氏菌的假定mtaa编码基因的蛋白质序列可由以下genbank登记号标识。乙酰-coa合成酶/一氧化碳脱氢酶(acs/codh).acs/codh是wood-ljungdahl途径的羰基分支的中心酶。其催化二氧化碳到一氧化碳的可逆还原,以及从一氧化碳、辅酶a和来自甲基化类咕啉铁硫蛋白的甲基获得乙酰-coa的合成。类咕啉-铁硫蛋白是由甲基四氢叶酸经由甲基转移酶甲基化。acs/codh在外来宿主中的表达涉及引入以下蛋白质和其对应活性中的多种,即便不是全部的话。甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse)类咕啉铁硫蛋白(acsd)镍蛋白装配蛋白(acsf)铁氧还蛋白(orf7)乙酰-coa合成酶(acsb和acsc)一氧化碳脱氢酶(acsa)镍蛋白装配蛋白(cooc)一氧化碳脱氢酶/乙酰-coa合成酶活性所必需的基因典型地驻留在可作为延伸操纵子的天然基因组的有限区域中(morton等人,j.biol.chem.266:23824-23828(1991);ragsdale,crit.rev.biochem.mol.biol.39:165-195(2004);roberts等人,proc.natl.acad.sci.usa86:32-36(1989))。来自产乙酸菌热乙酸穆尔氏菌的此操纵子中的每种基因已在大肠杆菌中克隆并积极地表达(lu等人,j.biol.chem.268:5605-5614(1993);morton等人,上文,1991;roberts等人,上文,(1989))。这些基因的蛋白质序列可由以下genbank登记号标识。产氢细菌生氢氧化碳嗜热菌可通过乙酰-coa合成酶利用一氧化碳作为生长基质(wu等人,plosgenet.1:e65.(2005))。在菌株z-2901中,乙酰-coa合成酶复合物因为移码突变而缺乏一氧化碳脱氢酶(we等人,上文,2005),而在菌株dsm6008中,已经纯化到这种蛋白质的功能性未移码全长形式(svetlitchnyi等人,proc.natl.acad.sci.usa101:446-451(2004))。来自菌株z-2901的生氢氧化碳嗜热菌基因的蛋白质序列可由以下genbank登记号标识。生氢氧化碳嗜热菌dsm6008的序列目前无法从公众可利用的数据库获得,但可容易地确定所述序列可以获得。产甲烷古细菌嗜乙酸甲烷八叠球菌也可利用一氧化氮生长,展现乙酰-coa合成酶/一氧化碳脱氢酶活性,且同时产生乙酸和甲酸(lessner等人,proc.natl.acad.sci.usa103:17921-17926(2006))。这种有机体含有两组编码acs/codh活性的基因(rother和metcalf,proc.natl.acad.sci.usa101:16929-16934(2004))。这两组嗜乙酸甲烷八叠球菌基因的蛋白质序列可由以下genbank登记号标识。acsc、acsd、acsb、acseps和acsa蛋白通常被称作产甲烷菌codh/acs的γ、δ、β、ε和α亚单元。例如热乙酸穆尔氏菌等产乙酸菌或例如生氢氧化碳嗜热菌等产氢细菌中并不存在ε编码基因的同源物。嗜乙酸甲烷八叠球菌中存在两种活性codh/acs操纵子的假设包括:催化性质(即km、vmax、kcat),其促进一氧化碳营养或解乙酸生长;或差异基因调控,其启动各种刺激以诱发codh/acs表达(rother等人,arch.microbiol.188:463-472(2007))。在热乙酸穆尔氏菌和生氢氧化碳嗜热菌中,其它codh编码基因位于acs/codh操纵子外部。这些酶提供从一氧化碳到二氧化碳的转化作用中提取电子(或还原当量)的方式。还原当量然后传递到受体,例如氧化铁氧还蛋白、nadp+、水或过氧化氢,以分别形成还原铁氧还蛋白、nadph、h2或水。在一些情况下,氢化酶编码基因与codh邻近。在深红红螺菌中,经编码的codh/氢化酶蛋白形成膜结合酶复合物,其被提议作为通过co转化为co2和h2而产生质子梯度形式的能量的位点(fox等人,j.bacteriol.178:6200-6208(1996))。生氢氧化碳嗜热菌的codh-i和其相邻基因已被提议基于其与深红红螺菌codh/氢化酶基因簇的类似性来催化类似的功能角色(wu等人,plosgenet.1:e65(2005))。也已显示生氢氧化碳嗜热菌codh-i在连接于电极时会展现强烈的co氧化和co2还原活性(parkin等人,j.am.chem.soc.129:10328-10329(2007))。对编码生氢氧化碳嗜热菌codh-ii和邻近蛋白coof的基因进行克隆和测序(gonzalez和robb,femsmicrobiol.lett.191:243-247(2000))。所得复合物是膜结合的,但codh-ii的细胞质部分显示可催化nadph的形成,这暗示合成代谢作用(svetlitchnyi等人,j.bacteriol.183:5134-5144(2001))。codh-ii的晶体结构也可获得(dobbek等人,science293:1281-1285(2001))。示例性codh和氢化酶基因的蛋白质序列可由以下genbank登记号标识。丙酮酸铁氧还蛋白氧化还原酶(pfor).在不存在外部电子受体的情况下,利用合成气和甲醇的厌氧生长通过允许经由丙酮酸铁氧还蛋白氧化还原酶(pfor)合成丙酮酸而赋予宿主有机体acs/codh活性。来自非洲脱硫弧菌的pfor已在大肠杆菌中克隆并表达,从而产生在氧存在下可稳定数天的活性重组酶(pieulle等人,j.bacteriol.179:5684-5692(1997))。氧稳定性在pfor中相对罕见,认为其是由非洲脱硫弧菌酶的多肽链中的60个残基的延伸引起的。热乙酸穆尔氏菌pfor也已得到充分表征(menon和ragsdale,biochemistry36:8484-8494(1997))且显示在自养生长期间在丙酮酸合成的方向上具有高活性(furdui和ragsdale,j.biol.chem.275:28494-28499(2000))。此外,大肠杆菌具有未被表征的开放阅读框ydbk,其编码与热乙酸穆尔氏菌pfor具有51%同一性的蛋白质。丙酮酸氧化还原酶活性的证据已有描述(blaschkowski等人,eur.j.biochem.123:563-569(1982))。这些示例性pfor酶的蛋白质序列可由以下genbank登记号标识。若干种其它的pfor酶已有描述(ragsdale,chem.rev.103:2333-2346(2003))。氢化酶(hyd).不同于co和甲醇到乙酰-coa或乙酸的氧化还原中性转化,以最高的可能产率产生还原程度更高的产物(例如乙醇、丁醇、异丁醇、异丙醇、1,4-丁二醇、丁二酸、富马酸、苹果酸、4-羟基丁酸、3-羟基丙酸、乳酸、甲基丙烯酸、己二酸和丙烯酸)则需要从co和h2提取额外的还原当量(例如参见图7中的乙醇形成)。特定来说,还原当量(例如图6中的2[h])是通过co和水经由实施例ii中所述的一氧化碳脱氢酶转化为co2来获得,或者直接来自利用氢的氢化酶将电子从h2转移到受体(例如铁氧还蛋白、黄素氧还蛋白、fad+、nad+或nadp+)的活性。大肠杆菌和其它肠细菌天然具有编码至多4种氢化酶的多种基因(sawers,antonievanleeuwenhoek66:57-88(1994);sawers等人,j.bacteriol.164:1324-1331(1985);sawers和boxer,eur.j.biochem.156:265-275(1986);sawers等人,j.bacteriol.168:398-404(1986))。鉴于酶活性的多样性,大肠杆菌或另一种宿主有机体有可能提供足够的氢化酶活性以便分裂进入的分子氢并还原对应受体。大肠杆菌的内源氢裂解酶包括氢化酶3、使用铁氧还蛋白作为受体的膜结合酶复合物和也使用铁氧还蛋白受体的氢化酶4。氢化酶3和4是由hyc和hyf基因簇分别编码。大肠杆菌中的氢化酶活性也取决于hyp基因的表达,所述hyp基因对应的蛋白质与氢化酶复合物的装配有关(jacobi等人,arch.microbiol.158:444-451(1992);rangarajan等人,j.bacteriol.190:1447-1458(2008))。如果生产宿主缺乏足够的内源氢化酶活性,那么热乙酸穆尔氏菌氢化酶是合适的候选物。热乙酸穆尔氏菌可以co2作为独有的碳源生长,表明还原当量是从h2提取以允许经由wood-ljungdahl途径的乙酰-coa合成(drake,j.bacteriol.150:702-709(1982);drake和daniel,res.microbiol.155:869-883(2004);kellum和drake,j.bacteriol.160:466-469(1984))(参见图6)。热乙酸穆尔氏菌具有来自大肠杆菌的若干hyp、hyc和hyf基因的同源物。这些基因所编码的这些蛋白质序列可由以下genbank登记号标识。此外,热乙酸穆尔氏菌中存在若干种编码氢化酶和/或杂二硫键还原酶功能的基因簇,且其对应的蛋白质序列也在下文提供。hyp装配蛋白.热乙酸穆尔氏菌中基因与大肠杆菌hyp基因同源的蛋白质.氢化酶3.氢化酶4.热乙酸穆尔氏菌中基因与大肠杆菌hyc和/或hyf基因同源的蛋白质.热乙酸穆尔氏菌中其它的氢化酶编码基因簇.本实施例描述用于工程改造有机体以从合成气和甲醇产生乙酰-coa的示例性基因集合。实施例xii用于工程改造有机体以从合成气和甲醇产生乙酰-coa的基因和所编码酶的克隆、表达和活性分析本实施例描述提供可利用合成气和甲醇的有机体的酶的编码基因的克隆和表达。甲醇-甲基转移酶(mtr).在大肠杆菌中克隆并表达用于从甲醇产生me-thf的至少最小基因集合,例如mtaa、mtab和mtac。经由校对pcr(proof-readingpcr)克隆这些基因,并将其连接到一起以供在阻抑型pa1-laco1启动子的控制下,在高拷贝数的载体(例如pze22-s)中表达(lutz和bujard,nucleicacidsres.25:1203-1210(1997))。将辅酶b12添加到生长培养基中,因为这些甲基转移酶活性需要钴胺素作为辅因子。通过pcr和/或限制性酶图谱验证克隆的基因以证实3-基因集合的构建和其被插入表达载体中。对假定克隆进行dna测序以证实每种基因的预期序列。一旦得到确认,就通过添加最终浓度介于0.05mm与1mm之间的异丙基β-d-1-硫代半乳糖吡喃糖苷(iptg)而在大肠杆菌k-12(mg1655)细胞中表达最终构建体。使用全细胞提取物的sds-page来监测经克隆的基因的表达。为了确定mtaabc蛋白的表达是否赋予大肠杆菌将甲基从甲醇转移到四氢叶酸(thf)的能力,向重组菌株馈送不同浓度的甲醇,且与甲基-thf合成一起监测甲醇吸收。如针对热乙酸穆尔氏菌中作为甲基源的香草酸(naiduandragsdale,j.bacteriol.183:3276-3281(2001))或巴氏甲烷八叠球菌甲醇甲基转移酶(sauer等人,eur.j.biochem.243:670-677(1997);tallant和krzycki.j.bacteriol.178:1295-1301(1996);tallant和krzycki.j.bacteriol.179:6902-6911(1997);tallant等人,j.biol.chem.276:4485-4493(2001))所述,在厌氧条件下分析甲基转移酶系统的活性。对于阳性对照,平行培养大肠杆菌细胞,并监测内源甲基转移酶活性。证实了活性取决于所添加的外源辅酶b12,这确认了甲醇:类咕啉甲基转移酶活性在大肠杆菌中的表达。乙酰-coa合成酶/一氧化碳脱氢酶(acs/codh).使用标准pcr方法,将编码热乙酸穆尔氏菌、生氢氧化碳嗜热菌和嗜乙酸甲烷八叠球菌的acs/codh活性所必需的基因的完全操纵子装配到低或中等拷贝数的载体中,例如pza33-s(基于p15a)或pzs13-s(基于psc101)。如针对甲基转移酶所描述,确认经克隆的基因的结构和序列。经由对在具有必需金属(ni、zn、fe)和辅酶b12的严格厌氧条件下生长的全细胞溶解物进行蛋白质凝胶电泳来监测表达。必要时,通过鉴别任何明显的终止子并将其移除,并引入从已知在大肠杆菌中有效的位点中选择的一致性核糖体结合位点,借此对基因簇进行修饰以供大肠杆菌表达(barrick等人,nucleicacidsres.22:1287-1295(1994);ringquist等人,mol.microbiol.6:1219-1229(1992))。然而,每种基因簇是以与其天然结构和表达平行的方式克隆和表达。这有助于确保大部分彼此相互作用的各种基因产物之间的期望化学计量。一旦在厌氧条件下获得了令人满意的codh/acs基因簇表达,则分析表达这些基因的细胞将co和/或co2固定到细胞碳中的能力。初始条件利用以外源葡萄糖作为碳源和能源,经由底物水平的磷酸化或以硝酸盐作为电子受体的厌氧呼吸,严格厌氧生长的细胞。此外,将外源提供的ch3-thf添加到培养基中。分析组合的mtr和acs/codh途径的活性.如实施例ii中所述将acs/codh基因克隆,同样如实施例ii中所述在也表达甲醇-甲基转移酶系统的细胞中表达。这是通过将表达acs/codh的相容质粒引入到mtr表达细胞中来实现。为了获得附加的长期稳定性,acs/codh和mtr基因也可整合到染色体中。在获得能够利用甲醇产生me-thf并表达活性codh/acs基因的大肠杆菌菌株之后,分析其利用甲醇和合成气以便并入到细胞物质和乙酸中的能力。初始条件是利用在严格厌氧条件下生长的细胞,其以外源提供的葡萄糖作为碳源和能源。或者,或除葡萄糖以外,硝酸盐可添加到发酵液中以用作电子受体和生长引发剂。已经证实大肠杆菌在硝酸盐存在下可利用脂肪酸进行厌氧生长,所述脂肪酸最终代谢为乙酰-coa(campbell等人,mol.microbiol.47:793-805(2003))。可通过在例如硝酸盐等电子受体存在下培养微生物有机体来利用类似条件。也可提供氧,只要其细胞内含量被维持在经工程改造的酶的任何限制阈值以下即可。与甲醇一起使用具有适合于这些实验的组成的“合成气”。向细胞提供13c标记的甲醇或13c标记的co,并使用分析质谱法测量经标记的碳在乙酸和细胞物质(例如蛋白氨基酸)中的并入量。丙酮酸铁氧还蛋白氧化还原酶.克隆来自热乙酸穆尔氏菌、非洲脱硫弧菌和大肠杆菌的丙酮酸铁氧还蛋白氧化还原酶基因,并在展现mtr和acs/codh活性的菌株中表达。条件、启动子等在上文已有描述。鉴于pfor基因的大尺寸和对应酶的氧敏感性,使用低拷贝或单拷贝质粒载体或单拷贝染色体整合法进行测试。应用活性分析(如furdui和ragsdale,j.biol.chem.275:28494-28499(2000)中所述)来证实活性。此外,证实了菌株在不存在外部电子受体的情况下可利用气态碳源和甲醇生长,这提供了活体内pfor活性的另一证据。氢化酶.通过在存在和不存在氢的情况下如上所述培养细胞来测试宿主有机体利用氢的内源氢化酶活性。如果在发酵期间观察到形成更多的还原产物(例如相比乙酸,乙醇增多),那么这表明内源氢化酶的活性足够高。在这种情况下,没有异源氢化酶被克隆和表达。如果天然酶不具有足够活性或减少必需的受体,那么克隆编码个别氢化酶复合物的基因并在展现mtr、acs/codh和pfor活性的菌株中表达。条件、启动子等在上文已有描述。本实施例描述赋予合成气和甲醇利用途径的基因的克隆和表达,以及对适当活性的分析。实施例xiii开发和优化从经工程改造以利用合成气和甲醇的有机体产生乙酰-coa的发酵方法本实施例描述用于合成气和甲醇利用型有机体的发酵条件的开发和优化。合成气发酵中重要的过程考虑因素有高生物质浓度和良好的气-液传质(bredwell等人,biotechnol.prog.15:834-844(1999))。co在水中的溶解度稍微小于氧在水中的溶解度。在控制发酵罐中执行连续充气发酵,其中通过质谱测定法和周期液体取样进行恒定废气分析并通过gc和hplc进行分析。液相可以分批模式运行。例如醇、有机酸和残余葡萄糖以及残余甲醇等发酵产物是通过hplc(shimadzu,columbiamd)定量,其中例如使用hplc柱的系列(例如hpx-87系列)(biorad,herculesca),对于葡萄糖和醇使用折射率检测器,且对于有机酸使用uv检测器。通过使用分光光度计(600nm)测量光学密度来确定生长速率。这些系统中的所有管道都是玻璃或金属以便维持厌氧条件。用玻璃料执行气体鼓泡以降低气泡尺寸并改进质量传递。测试在约0.1到1vvm(每分钟的蒸气体积)范围内的各种鼓泡速率。为了获得气体吸收率的精确测量,执行暂时停止气流的周期性挑战,并将气相组成作为时间的函数来监测。为了实现总体目标生产率,使用细胞滞留或再循环方法。一种增加微生物浓度的方法是经由切向流膜(tangentialflowmembrane)从测流再循环细胞。也可使用重复分批培养,如先前针对穆尔氏菌的乙酸生产所述(sakai等人,j.biosci.bioeng.99:252-258(2005))。也可使用各种其它方法(bredwell等人,biotechnol.prog.15:834-844(1999);datar等人,biotechnol.bioeng.86:587-594(2004))。可测试其它优化(例如1.5atm的超压)以改进质量传递(najafpour和younesi,enzymeandmicrobialtechnology38:223-228(2006))。一旦使用纯h2/co作为进料获得了令人满意的表现,则产生含有可能存在于商业合成气中的抑制剂的合成气混合物。举例来说,典型杂质概况为4.5%ch4、0.1%c2h2、0.35%c2h6、1.4%c2h4和150ppm一氧化氮(datar等人,biotechnol.bioeng.86:587-594(2004))。由例如苯、甲苯、乙苯、对二甲苯、邻二甲苯和萘等化合物代表的焦油以ppm水平添加以测试对生产的任何影响。举例来说,已经显示40ppm的no对嗜羧酸梭菌具有抑制性(ahmed和lewis,biotechnol.bioeng.97:1080-1086(2007))。培养物在转移到发酵罐之前以摇瓶培养法测试。还测试这些潜在抑制化合物的不同含量以便定量其对细胞生长的影响。所述知识用于开发合成气纯度的规格,其用于按比例增大的研究和生产中。如果发现有任何特定组分难以从用于规模化的合成气中减少或移除,那么可利用适应进化程序使细胞耐受一种或多种杂质。本实施例描述用于合成气和甲醇利用型有机体的发酵条件的开发和优化。实施例xiv用于处理co和厌氧培养物的方法本实施例描述用于处理co和厌氧培养物的方法。处理少量co以用于分析和小规模培养.co是一种无嗅、无色且无味的有毒气体。因此,需要对利用co的培养和分析作特别处理。若干种分析(包括co氧化、乙酰-coa合成、使用肌红蛋白的co浓度和小批次培养物中的co耐受/利用)要求co气体的数量很小,从而可在通风柜中分配和处理。生物化学分析要求先用co饱和极小量(<2ml)的生物化学分析培养基或缓冲液,然后进行所述分析。所有的co处理步骤都是在通风柜中执行,其中调节门设定在适当高度且排风机开启;co是从压缩气体钢瓶和连接于希莱克管线的调节器分配得到。调节器确保等浓度的co被分配到若干个可能的试管或小瓶中的每一个中。希莱克管线被设置为在输入侧具有氧洗涤器,且在另一侧具有油压释放鼓泡器和排气口。或者也可使用冷阱。分析试管是无氧的,但含有co。因此,分析试管用橡胶塞完全密封,且试剂的添加或移除是使用气密性进样针头和注射器进行。其次,在密封塞好的血清瓶中,使小规模(约50ml)培养物在饱和co下生长。和生物化学分析一样,使用希莱克管线配置,在通风柜中平衡co饱和的微生物培养物。生物化学分析和微生物培养都是在便携式密封容器中以小体积进行,这有助于通风柜外部的安全处理。压缩co储罐与通风柜紧邻。典型地使用希莱克管线将co分配到试管,其各自通风。用19或20号一次性注射器针头刺穿试管上的橡胶塞并通过所述针头通风。油鼓泡器与co储罐和氧洗涤器一起使用。分光光度计的玻璃或石英管在顶部具有圆孔,其中安装有kontes止动套筒sz7774250-0007。co检测器单元紧邻通风柜安置。供给到大规模培养的较大量co的处理.对发酵培养物供给co或co和h2的混合物,以模拟合成气或在发酵生产中作为原料的合成气。因此,1升到几升范围内的细胞数量可包括添加co气体以增加co在培养基中的溶解浓度。在这些情况下,将向培养基中添加相当大数量的连续给予的co气体。在不同点收集培养物或移出样品。或者,可用作为发酵罐一部分的整合式连续流离心机收集细胞。发酵过程一般在厌氧条件下进行。在一些情况下,为了确保足够的氧饱和度以便提供呼吸环境,将氧气或空气泵入发酵罐中是不经济的。此外,厌氧发酵期间产生的还原力很可能是产物形成而不是呼吸所必需的。此外,被认为用于多种途径的许多酶具有不同程度的氧敏感性。例如热乙酸穆尔氏菌等经典产乙酸菌是专性嫌气微生物,且wood-ljungdahl途径中的酶非常容易由分子氧引起不可逆的失活。虽然存在耐氧产乙酸菌,但wood-ljungdahl途径中的全部酶很可能在氧存在下都具有问题,因为大多数是铁氧还蛋白的关键组分、即金属酶,且调控可使代谢从wood-ljungdahl途径偏离,从而最大化能量获得。同时,培养物中的细胞充当氧清除剂,其缓和在大规模细胞生长的存在下对极端措施的需求。厌氧培养室和条件.示例性厌氧培养室可从市面购得(参见例如vacuumatmospherescompany,hawthorneca;mbraun,newburyportma)。示例性条件包括1ppm或以下的o2浓度和1atm纯n2。在一个实施例中,可使用3个氧洗涤器/催化剂再生器,且培养室可包含1个o2电极(例如teledyne;cityofindustryca)。在打开内部室门之前,几乎所有的物品和试剂都在培养室的气闸中循环4次。体积大于5ml的试剂在引入培养室之前经纯n2鼓泡。手套每年更换约2次,且催化剂容器在培养室对氧含量改变所作出的反应日益缓慢时被定期再生。培养室的压力通过由螺线管启动的单向阀控制。这种特征非常便利,因为其允许将培养室压力设定在高于环境的水平,以便能经由放气阀转移非常小的试管。厌氧培养室可实现始终很低且为对氧气高度敏感的厌氧条件所必需的o2水平。然而,细胞的生长和处理通常不需要所述预防措施。在一替代性厌氧培养室配置中,铂或钯可用作催化剂,其需要混合物中存在一些氢气。代之以使用电磁阀,压力释放可由鼓泡器控制。代之以使用基于仪器的o2监测,可使用测试条(teststrip)。为了改良厌氧条件,可在我们的系统里进行一些相对简单的改变;其中一些已经在进行中。厌氧微生物学.如上文对于co处理所述,处理小规模培养物。特定来说,用厚橡胶塞装备血清或培养基瓶,并使用铝制封皮密封瓶子。以传统方式制备例如极品肉汤(terrificbroth)等培养基,并将其分配到适当大小的血清瓶中。用氮气充填瓶子,维持约30分钟的中等起泡。这将从培养基中移除大部分的氧气,且在此步骤之后,每个瓶子都用橡胶塞(例如bellco20mm隔膜塞;bellco,vineland,nj)盖好并用封皮密封(bellco20mm)。然后使用缓慢(液体)排气循环用高压锅蒸煮培养基瓶。在蒸煮期间至少时不时地可用针头戳穿塞子以提供排气;所述针头需要在瓶子从高压锅移除之后立即移除。经由注射器和针头向无菌培养基中添加其余的培养基组分,例如缓冲液或抗生素。在添加还原剂之前,用氮气(或co,这取决于用途)将瓶子平衡30-60分钟。可添加例如100x150mm硫化钠、200mm盐酸半胱氨酸等还原剂。这可通过以下步骤完成:将硫化钠称重到干燥烧杯中并将半胱氨酸称重到血清瓶中,将两者放到厌氧培养室中,在无氧水中溶解硫化钠,然后将其添加到血清瓶的半胱氨酸中。血清瓶应立即塞好,因为硫化钠溶解会在接触半胱氨酸之后产生硫化氢气体。当注射入培养物时,使用针头过滤器来灭菌溶液。其它组分可经由注射器针头添加,例如b12(10μm氰钴胺素)、氯化镍(nicl2,20μm最终浓度,在培养室中在无氧水中从40mm储备液制备,并通过高压锅蒸煮或通过在注射入培养物之后使用针头过滤器灭菌)和硫酸亚铁铵(最终浓度必需为100μm,在培养室中在无氧水中作为100-1000x储备溶液制备,并通过高压锅蒸煮或通过在注射入培养物之后使用针头过滤器灭菌)。为了促进在厌氧条件下更快地生长,用50ml厌氧生长的预培养物接种1l瓶子。通过添加最终浓度为0.2mm的异丙基β-d-1-硫代半乳糖吡喃糖苷(iptg)来在载体中诱导pa1-laco1启动子,且所述过程进行约3小时。在鼓泡的同时使用连续气体添加,大规模培养物可在较大瓶子中生长。具有金属鼓泡器的橡胶塞在培养基添加后放置于瓶子中,并在装配瓶子的剩余部分之前用氮气鼓泡30分钟或以上。将每个瓶子装配到一起,使得无菌过滤器可对鼓入的气体灭菌,且瓶子上的软管可用小c型夹钳压缩。用磁力搅拌棒搅拌培养基和细胞。一旦添加完所有的培养基组分和细胞,则可将瓶子在恒温箱中在室内空气中,同时向瓶子连续鼓泡氮气的情况下培养。本实施例描述co和厌氧培养物的处理。实施例xvco氧化(codh)分析本实施例描述用于测量co氧化(co脱氢酶;codh)的分析方法。将热乙酸穆尔氏菌的7基因codh/acs操纵子克隆到大肠杆菌表达载体中。克隆完整的约10kbpdna片段,此区域中的一些基因可能从其自身的内源启动子表达且所有基因都含有内源核糖体结合位点。热乙酸穆尔氏菌是革兰氏阳性菌,且预期核糖体结合位点元件可在大肠杆菌中良好工作。使用定量测量codh活性的分析,对这些克隆的co氧化进行分析。热乙酸穆尔氏菌基因产物的抗血清用于western印迹技术以估算比活度。所述活性将在下文更详细地描述,其被估算为热乙酸穆尔氏菌比活度的约1/50。因为热乙酸穆尔氏菌酶具有约55℃的最佳温度,所以这可能会限制重组大肠杆菌细胞的codh活性。因此,嗜温codh/acs途径可能是有利的,例如嗜温且不具有表观完整的codh/acs操纵子和wood-ljungdahl途径的穆尔氏菌的近亲物种、即哈氏脱亚硫酸菌。作为潜在宿主有机体的产乙酸菌包括(但不限于)深红红螺菌、热乙酸穆尔氏菌和哈氏脱亚硫酸菌。co氧化在codh/acs分析中是最灵敏的也是最可靠的。基于大肠杆菌的合成气利用系统最终可能需要像梭菌(即穆尔氏菌)系统一样厌氧,特别是对于最大活性来说。对codh的改进是可能的,但最终会受co气体的水溶性限制。起初将每种基因单独地克隆到表达载体中。产生用于每个复合物中多个亚单元的组合表达单元。测定大肠杆菌中蛋白质水平下的表达。获得组合的热乙酸穆尔氏菌codh/acs操纵子和单独表达克隆。co氧化分析.所述分析是一种用于wood-ljungdahl途径内的酶活性的更简单、可靠且更通用的分析法,并且用于测试codh(seravalli等人,biochemistry43:3944-3955(2004))。热乙酸穆尔氏菌codh比活度的典型活性在55℃下是500u或在25℃下是约60u。所述分析利用在co存在下甲基紫精的还原作用。这是在578nm下在塞紧的无氧玻璃试管中进行测量。更详细地说,用橡胶塞塞紧的玻璃试管是在用去离子水洗涤试管4次并用丙酮洗涤试管1次之后制备。将少量的真空润滑脂涂抹在橡胶垫圈的顶部。试管用co充气,并用22号针头和排气针头干燥10分钟。使用22号针头添加体积0.98ml的反应缓冲液(50mmhepes,ph8.5;2mm二硫苏糖醇(dtt)),其中排气针头开启并存在100%co。甲基紫精(ch3紫精)储备液为1m水溶液。每个分析使用20微升,最终浓度为20mm。当添加甲基紫精时,使用18号针头(部分)作为夹套,以利于使用hamilton注射器抽出ch3紫精。抽出4-5个试样并丢弃,以对注射器进行洗涤和气体平衡。在制备ch3紫精储备液时添加少量的连二亚硫酸钠(0.1m储备液)以稍微还原ch3紫精。温度在被加热的olis分光光度计(bogartga)中平衡到55℃。空白反应(ch3紫精+缓冲液)首先进行以测量ch3紫精还原作用的基准速率。acs90和acs91(分别具有和不具有第一个cooc的热乙酸穆尔氏菌的codh-acs操纵子)的粗制大肠杆菌细胞提取物。每次添加10微升提取物,混合并分析。被还原的ch3紫精变成紫色。分析结果展示于表x中。表2.粗制提取物的co氧化活性.mta98/mta99是表达来自热乙酸穆尔氏菌的甲醇甲基转移酶基因的大肠杆菌mg1655菌株,且因此是含有热乙酸穆尔氏菌codh操纵子的acs90acs91大肠杆菌菌株的阴性对照。如果约1%的细胞蛋白是codh,那么这些数字将是纯热乙酸穆尔氏菌codh的500u/mg活性的大约1/100。基于western印迹技术的实际估算值是0.5%的细胞蛋白,因此活性是热乙酸穆尔氏菌codh的约1/50。然而,在阴性对照中的活性非常小的情况下,所述实验并未明确证实重组大肠杆菌中的co氧化活性。在阴性对照中观察到的少量co氧化(ch3紫精还原)表明大肠杆菌可能具有还原ch3紫精的有限能力。为了估算codh和mtr蛋白的最终浓度,对用于co氧化、acs、甲基转移酶和类咕啉fe-s分析中的相同细胞提取物相继执行sds-page和western印迹分析。所用抗血清是纯化的热乙酸穆尔氏菌codh-acs和mtr蛋白的多克隆,并使用碱性磷酸酶连接的山羊抗兔二抗显现出来。执行western印迹分析且结果展示于图9中。通过与对照泳道对比,估算acs90和acs91中的codh量为50ng。经由western印迹分析确认了包含2个codh亚单元的codh-acs操纵子基因的表达和甲基转移酶。因此,重组大肠杆菌细胞表达7基因操纵子的多个组分。此外,甲基转移酶和类咕啉铁硫蛋白在相同的大肠杆菌细胞中皆具有活性。这些蛋白质是克隆到相同细胞中的相同操纵子的部分。使用热乙酸穆尔氏菌细胞的提取物,对阳性对照重复co氧化分析。虽然大肠杆菌acs90和acs91中的codh活性可以测量到,但其只有热乙酸穆尔氏菌对照的约1/130-1/150。分析结果展示于图10中。简言之,培养细胞(具有codh/acs操纵子的热乙酸穆尔氏菌或大肠杆菌;acs90或acs91或空白载体pza33s)且如上文所述制备提取物。如上所述在55℃在提取物制备当天的各个时间点执行分析。历经120秒的时间,在578nm下跟踪甲基紫精的还原。这些结果描述co氧化(codh)分析和结果。重组大肠杆菌细胞表达co氧化活性,其是通过甲基紫精还原分析来测量。实施例xvi乙酰-coa合成酶(acs)活性分析(co交换分析)本实施例描述acs分析方法。所述分析测量乙酰-coa的羰基与co的acs催化型交换(raybuck等人,biochemistry27:7698-7702(1988))。将acs(以纯化的酶或细胞提取物的部分的形式)与羰基碳经14c标记的乙酰-coa在co气氛下培养。在活性acs存在下,反应的液相中的放射性按指数规律降低,直到达到由经14c标记的乙酰-coa的含量与经14c标记的co的含量之间的平衡所决定的最小值为止。通过这种方法来分析其它分析中所用的表达acs90和acs91的大肠杆菌mg1655的相同细胞提取物,以及对照提取物。更详细地说,在小分析瓶中于标准大气压下,制得0.2mm乙酰-coa、0.1mm甲基紫精和2mm柠檬酸钛(iii)于0.3mmes缓冲液(ph6.0)中的溶液。添加完所有组分后的总反应体积为500μl。小瓶用橡胶塞(bellco)和铝制钳口封皮(bellco)密封,以创建气密性反应气氛。每个小瓶用100%co充填数分钟,时间应足够长以便完全交换小瓶的气氛,并放入厌氧培养室中。分析瓶放置于55℃砂浴中,并在所述温度下使其达到平衡。制备具有40μl的1mhcl的总计10个闪烁瓶以用于每个分析瓶。使用气密性hamilton注射器向分析瓶中添加acs,并培养约2-3分钟以使反应达到平衡。使用气密性hamilton注射器添加1μl(0.36纳摩尔)14c-乙酰-coa以开始分析(时间=0min)。时间点从开始分析时取起。用气密性hamilton注射器从分析瓶中移出样品(40μl)。每个样品都添加到所制备的闪烁瓶中的40μlhcl中以中止反应。因为acs酶将14c标记从乙酰-coa转移到co上,所以同位素浓度按对数规律降低。因此,在早期时间点对分析频繁地取样。记录下每个样品的精确时间点。反应的精确步调取决于acs酶,但一些样品一般是立即获取且初始历经10-15分钟取样。继续获取样品达1-2小时。在一特定示例性分析中,使用4种分析条件:空白(无acs)、12μl经纯化的表达热乙酸穆尔氏菌acs的大肠杆菌菌株、4μl经纯化的大肠杆菌acs和3.7μl热乙酸穆尔氏菌codh/acs。在另一特定示例性分析中,使用4种分析条件:108μgcodh/acs、1mgmta99细胞提取物、1mgacs90细胞提取物和1mgacs91细胞提取物。酶作为100μl溶液(50mmkpi,0.1mnacl,ph7.6)添加。可用于大多数codh-acs活性的更灵敏的分析是下文所述的合成分析。本实施例描述用于测量acs活性的分析条件。实施例xvii乙酰-coa合成和甲基转移酶分析本实施例描述乙酰-coa合成和甲基转移酶分析。合成分析.所述分析是使用codh/acs、甲基转移酶(metr)和类咕啉fe-s蛋白从甲基-四氢叶酸、co和辅酶a合成乙酰-coa的活体外反应(raybuck等人,biochemistry27:7698-7702(1988))。通过添加或省略所涉及的每种酶,所述分析可用于多种实验中,包括测试一种或多种纯酶或细胞提取物的活性,和在各种条件下或用限制量的底物或酶测定反应动力学。各个时间点获取的反应样品用从乙酰-coa终产物释放乙酸的1mhcl中止反应。在用dowex柱纯化之后,可通过色谱法、质谱法或通过测量放射性来分析乙酸。确切方法将由反应中所用的特异性底物来决定。利用14c标记的甲基-thf,并测量所分离的乙酸样品的放射性。主要目的是测试cfesp亚单元。所述分析还包含+/-纯化的甲基转移酶。分析以下6种不同条件:(1)纯化的codh/acs、metr和cfesp,作为阳性对照;(2)纯化的codh/acs与acs90细胞提取物;(3)纯化的codh/acs与acs91细胞提取物;(4)纯化的codh/acs、metr与acs90细胞提取物;(5)纯化的codh/acs、metr与acs91细胞提取物;(6)纯化的codh/acs、metr与尽可能多的acs91细胞提取物(排除mes缓冲液)。反应是在厌氧培养室中于充满co的分析瓶中装配。总反应体积小于小瓶体积,因此试剂可在用co填充小瓶之前或之后添加,只要使用气密性hamilton注射器并维持试剂无氧即可。反应(总计约60μl)是由细胞提取物(除了分析1)、辅酶a、柠檬酸钛(iii)、mes(除了分析6)、纯化的codh/acs、14c-甲基-四氢叶酸、甲基-紫精和铁氧还蛋白组成。此外,将纯化的metr添加到分析1和4-6中,并将纯化的cfesp添加到分析1中。反应在厌氧培养室中在55℃的砂浴中进行。最后添加的试剂是14c-甲基-四氢叶酸,其启动反应(t=0s)。立即获取初始样品,随后在30分钟、1小时和2小时时获取样品。这些时间点并不精确,因为6种条件是同时运行(因为这个实验主要是定性实验)。将15μl样品添加到闪烁瓶中的15μl1mhcl中。对于最后一个样品,如果反应中留下的量小于15μl,那么用15μlhcl冲洗分析瓶以获取反应的剩余部分。10μl体积的细胞提取物用于分析2-5,且26.4μl细胞提取物用于分析6。打算用于分析中的纯酶的典型量如下:codh/acs=ˉ0.2纳摩尔;metr=0.2纳摩尔;cfesp=0.05纳摩尔。所用的典型分析浓度如下:codh/acs=1μm;me-cfesp=0.4μm;metr=1μm;铁氧还蛋白=3μm;coa=0.26mm;14c-甲基-thf=0.4mm;甲基紫精=0.1mm;和柠檬酸钛(iii)=3mm。在对反应混合物计数之后,确定了acs90提取物中的类咕啉fe-s蛋白具有活性,总活性接近阳性对照的约1/5且显著高于阴性对照(无提取物)。也可使用非放射性合成分析。任选的非放射性分析条件如下:分析条件1:100mmmes,ph6.0;1mmcoa;1mmme-thf;0.33mm柠檬酸钛(iii),体积为950μl,+50μl提取物;在co气氛(对照为ar)下在55℃培养。这些反应将在黑暗中进行,因为类咕啉甲基载体对光敏感。分析条件2:100mmmes,ph6.0;1mmcoa;1mmme-thf;1mm甲基紫精;体积为950μl,+50μl提取物;在co气氛下,在55℃,在黑暗中培养。用10μl的10%甲酸中止反应,其中在1hr、3hr和6.5hr时获取样品并储存在-20℃下。分析条件3:100mmtris,ph7.6;5mmcoa;7.5mmme-thf;1mm甲基紫精;体积为90μl,+10μl提取物;在co或ar下,在55℃在黑暗中培养1hr,用10μl10%甲酸中止反应,并储存在-20℃下。在lu等人(j.biol.chem.265:3124-3133.(1990))中,发现合成反应的最佳ph介于7.2-7.5之间。lu等人还发现高于10mm的辅酶a浓度具有抑制性。lu等人描述了使用碘代甲烷代替me-thf作为甲基供体,并使用了5-7.5mm浓度。lu等人还确定了dtt或其它还原剂不是必要的,但他们使用了铁氧还蛋白作为电子载体。甲基紫精在上述反应中被替代。此外,maynard等人(j.biol.inorg.chem.9:316-322(2004))确定了电子载体不是严格意义上必需的,但如果缺乏电子载体则会导致合成的延时。在使用电子载体时,maynard等人使用1mm甲基紫精作为电子载体。甲基转移酶分析.催化ch3从甲基-四氢叶酸转移到acs复合物而作为乙酰-coa合成的一部分的必需甲基转移酶活性是在codh-acs操纵子内编码。这是甲基和羰基途径结合到一起的步骤。在热乙酸穆尔氏菌的操纵子内,mtr编码基因是moth_1197且跟在主要codh和acs亚单元后面。因此,mtr活性将构成更邻近基因可被表达的间接证据。通过光谱法分析mtr活性。特定来说,含有co(iii)的甲基化cfesp在约450nm下具有小吸收峰,而含有co(i)的未甲基化cfesp在约390nm下具有大峰。这种光谱的形成是因为钴和铁-硫簇发色团。此外,cfesp可自发地氧化为co(ii),其在约470nm下产生宽吸收峰(seravalli等人,biochemistry38:5728-5735(1999))。使用大肠杆菌细胞提取物、从热乙酸穆尔氏菌纯化的cfesp和甲基-四氢叶酸测试重组甲基转移酶。类咕啉蛋白的甲基化是根据以下现象观测到:390nm下吸收的减少,450nm下吸收的同时增加,以及470nm下不存在主峰。同时也在开发使用13c-甲醇的非放射性分析。这应当转移到四氢叶酸上且产生分子质量+1的mthf。或者,认为甲基转移酶也通过将甲醇的甲基转移到高半胱氨酸以形成甲硫氨酸来工作。所述分析对其同样适用,因为甲硫氨酸+1质量比mthf+1或其它的一些可能性更容易进行检测。除了使用13c以外,也可使用氘作为示踪剂,这两者都可用质谱法测量。这些示踪剂也可用于活体内标记研究中。还可使用其它分析方法确定各种中间物或产物,包括例如电子顺磁共振(epr)、穆斯堡尔光谱法(mossbauerspectroscopy)、电子-核双共振(endor)、红外、磁圆二色性(mcd)、结晶学、x射线吸收,以及动力学方法,包括停流和快速反应epr(stoppedflowandfreeze-quenchepr)。图8说明甲醇甲基转移酶如何装配到codh/acs(‘合成气’)途径中。基本上,甲醇的甲基经由钴胺素依赖性过程转移到四氢叶酸,然后转移到codh/acs的类咕啉-fes蛋白(也是一种钴胺素蛋白),其接着对acs反应供应甲基,从而合成乙酸。甲醇甲基转移酶复合物是由三种基因产物组成;其中的两种是mtab和mtac(moth_1209和moth_1208),彼此相邻且容易克隆。第三种基因产物mtaa可由三种不同的基因(moth_2100、moth_2102和moth_2346)编码,且所有三种基因是否都是必需的或这三种基因的子集是否可发挥作用尚不明了。大肠杆菌中的所有克隆都是使用lutz-bujard载体进行(lutz和bujard,nucleicacidsres.25:1203-1210(1997))。以下分析可用于确定编码甲醇甲基转移酶基因产物的mtab的活性。甲醇甲基转移酶的阳性对照可用香草酸o-去甲基作用来执行。甲醇甲基转移酶反应.先前已描述了示例性甲醇甲基转移反应(sauer和thauer,eur.j.biochem.249:280-285(1997);naidu和ragsdale,j.bacteriol.183:3276-3281(2001))。反应条件如下:50mmmops/koh,ph7.0;10mmmgcl2;4mm柠檬酸钛(iii);0.2%十二烷基麦芽糖苷(替换sds,参见sauer和thauer,eur.j.biochem.253:698-705(1998));25μm羟基钴胺素;1%meoh或1mm香草酸(取决于甲基转移酶形式)。通过37℃或55℃下在黑暗中的光谱仪读数来测量这些反应。所述分析测试mtab或mtvb分别将甲基从甲醇或香草酸转移到钴胺素的能力。实施例xviii大肠杆菌co耐受实验和co浓度分析(肌红蛋白分析)本实施例描述大肠杆菌对于高浓度co的耐受性。为了测试大肠杆菌是否可在饱和量的co存在下厌氧生长,培养是如上文关于厌氧微生物学所述,以小体积在具有50ml极品肉汤培养基(加上还原溶液、nicl2、fe(ii)nh4so4、氰基钴胺素、iptg和氯霉素)的120ml血清瓶中进行。这些瓶子的一半用氮气平衡30分钟,另一半则用co气体平衡30分钟。使用空白载体(pza33)作为对照,并用n2和co测试含有pza33空白载体以及acs90和acs91的培养物。接种所有培养物并在37℃于振荡(250rpm)下培养36小时。在36小时结束时,检查烧瓶,发现总共有大量的生长。观察到的生长在过夜后整体会发生较长延迟。鉴于所有培养物似乎在co存在下都良好生长,因此确认了最终co浓度。这是通过分析肌红蛋白在暴露于co后的光谱移位来进行的。经连二亚硫酸钠还原的肌红蛋白在435nm下具有吸收峰;这个峰在使用co的情况下则移动到423nm。因为波长很低并且需要记录从300nm向上的全波谱,所以必须使用石英管。针对标准曲线测量co浓度,且其取决于在20℃和1atm下的最大水溶性=970微摩尔浓度的co的亨利定律(henry’slaw)常数。为了测试肌红蛋白的co浓度,将试管用水洗涤10次,用丙酮洗涤1次,然后与codh分析一样用塞子塞紧。向试管中吹入n2,持续约10分钟。用hamilton注射器向空白(未经co平衡)中添加体积1ml的厌氧缓冲液(hepes,ph8.0,2mmdtt)。添加体积10微升的肌红蛋白(约1mm,可变化,只不过需要相当大的量)和1微升连二亚硫酸盐(20mm储备液)。co标准曲线是使用以1微升的增量添加的co饱和缓冲液获得。记录每个增量的峰高和峰位移。测试的培养物是pza33/co、acs90/co和acs91/co。这些培养物各自是以1微升的增量添加到同一试管中。在实验中途设置第二试管并加以使用。结果展示于表3中。表3.一氧化碳浓度,36小时.表3所示的结果表明,无论菌株是否在co存在下培养,培养物都可生长。这些结果表明大肠杆菌可耐受厌氧条件下对co的暴露,并且表达codh-acs操纵子的大肠杆菌细胞可代谢部分co。这些结果证实大肠杆菌细胞无论是否表达codh/acs,都能在饱和量的co存在下生长。此外,这些细胞与用氮气替换co的对照组生长的一样好。这个实验证实了大肠杆菌实验室菌株对在标准大气压下执行的合成气计划中可实现的水平的co不敏感。此外,初步实验表明表达codh/acs的重组大肠杆菌细胞实际上消耗一些co,很可能是通过氧化为二氧化碳。实施例ixx用于产生4-羟基丁酸和1,4-丁二醇的示例性途径本实施例描述用于从乙酰-coa产生4-羟基丁酸和1,4-丁二醇的示例性途径。如本文所公开,组合(1)用于将合成气连同和不连同甲醇转化为乙酰-coa的途径与(2)用于将乙酰-coa转化为4-羟基丁酸或1,4-丁二醇的途径。因此,本发明提供生产有机体和转化途径,其与经工程改造以从碳水化合物原料产生4-羟基丁酸或1,4-丁二醇的有机体相比具有固有的产率优势。举例来说,使用本文所述的从乙酰-coa开始进行的代谢途径,从葡萄糖产生4-羟基丁酸和1,4-丁二醇的最大理论产率是每摩尔葡萄糖得到1摩尔产物。特定来说,经由糖酵解每摩尔葡萄糖可产生2摩尔乙酰-coa,且每摩尔4-羟基丁酸或1,4-丁二醇需要2摩尔乙酰-coa。通过以下化学计量等式描述净转化:4-羟基丁酸:c6h12o6+1.5o2→c4h8o3+2co2+2h2o1,4-丁二醇:c6h12o6→c4h10o2+ch2o2+co2另一方面,葡萄糖气化为其更简单的组分co和h2,随后使用本文所述的途径转化为4-羟基丁酸和1,4-丁二醇,这会产生以下最大理论产率:4-羟基丁酸:6co+6h2→1.333c4h8o3+0.667co2+0.667h2o1,4-丁二醇:6co+6h2→1.091c4h10o2+1.636co2+0.545h2o应注意葡萄糖的气化最多可提供6摩尔co和6摩尔h2。从合成气产生4-羟基丁酸和1,4-丁二醇的最大理论产率可通过如下文所述添加甲醇而得到进一步提高。4-羟基丁酸:ch4o+6co+6h2→1.667c4h8o3+0.333co2+1.333h2o1,4-丁二醇:ch4o+6co+6h2→1.364c4h10o2+1.545co2+1.182h2o4-羟基丁酸:2ch4o+6co+6h2→2c4h8o3+2h2o1,4-丁二醇:2ch4o+6co+6h2→1.636c4h10o2+1.455co2+1.818h2o因此,本文所述的有机体和转化途径显然可提供将碳水化合物转化为4-羟基丁酸或1,4-丁二醇的有效方法。乙酰乙酰-coa硫解酶将2分子的乙酰-coa转化为1分子的乙酰乙酰-coa和1分子的辅酶a。示例性乙酰乙酰-coa硫解酶包括以下基因的基因产物:来自大肠杆菌的atob(martin等人,nat.biotechnol21:796-802(2003))、来自丙酮丁醇梭菌的thla和thlb(hanai等人,applenvironmicrobiol73:7814-7818(2007);winzer等人,j.mol.microbiolbiotechnol2:531-541(2000))和来自酿酒酵母的erg10(hiser等人,j.biol.chem.269:31383-31389(1994))。蛋白genbankid有机体atobnp_416728大肠杆菌thlanp_349476.1丙酮丁醇梭菌thlbnp_149242.1丙酮丁醇梭菌erg10np_015297酿酒酵母将乙酰乙酰-coa转化为3-羟基丁酰-coa的示例性3-羟基酰基脱氢酶包括来自丙酮丁醇梭菌的hbd(boynton等人,journalofbacteriology178:3015-3024(1996))、来自拜氏梭菌(c.beijerinckii)的hbd(colby和chen等人,applenviron.microbiol58:3297-3302(1992))和来自勤奋金属球菌(metallosphaerasedula)的许多类似酶(berg等人,2007science318:1782-1786(2007))。蛋白genbankid有机体hbdnp_349314.1丙酮丁醇梭菌hbdaam14586.1拜氏梭菌msed_1423yp_001191505勤奋金属球菌msed_0399yp_001190500勤奋金属球菌msed_0389yp_001190490勤奋金属球菌msed_1993yp_001192057勤奋金属球菌来自丙酮丁醇梭菌的crt的基因产物催化3-羟基丁酰-coa脱水生成巴豆酰-coa(atsumi等人,metabeng(2007);boynton等人,journalofbacteriology178:3015-3024(1996))。此外,烯脂酰辅酶a水合酶是可逆的酶且因此是催化3-羟基丁酰-coa脱水生成巴豆酰-coa的合适候选物。恶臭假单胞菌的烯脂酰辅酶a水合酶phaa和phab被认为在苯基乙酸分解代谢期间对双键执行羟基化作用(olivera等人,procnatacadsciu.s.a.95:6419-6424(1998))。荧光假单胞菌的paaa和paab催化类似的转化(olivera等人,procnatacadsciu.s.a.95:6419-6424(1998))。最后,许多大肠杆菌基因已经显示可展现烯脂酰辅酶a水合酶功能性,包括maoc、paaf和paag(ismail等人,europeanjournalofbiochemistry270:3047-3054(2003);park和lee,jbacteriol.185:5391-5397(2003);park和lee,applbiochem.biotechnol113-116:335-346(2004);park和yup,biotechnolbioeng86:681-686(2004))。蛋白genbankid有机体crtnp_349318.1丙酮丁醇梭菌paaanp_745427.1恶臭假单胞菌paabnp_745426.1恶臭假单胞菌phaaabf82233.1荧光假单胞菌phababf82234.1荧光假单胞菌maocnp_415905.1大肠杆菌paafnp_415911.1大肠杆菌paagnp_415912.1大肠杆菌已经在许多物种中鉴别出了活体内天然催化逆反应(即4-羟基丁酰-coa脱水生成巴豆酰-coa)的若干种酶。所述转化用于氨基丁酸梭菌(clostridiumaminobutyricum)的4-氨基丁酸发酵(scherf和buckel,eur.jbiochem.215:421-429(1993))和克氏梭菌(clostridiumkluyveri)的琥珀酸-乙醇发酵(scherf等人,arch.microbiol161:239-245(1994))。所述转化也是例如勤奋金属球菌等古细菌中的一个步骤,作为3-羟基丙酸/4-羟基丁酸自养二氧化碳同化途径的一部分(berg等人,science318:1782-1786(2007))。此途径利用巴豆酰-coa的水合以形成4-羟基丁酰-coa。4-羟基丁酰-coa脱水酶的可逆性已有详细记录(friedrich等人,angew.chem.int.ed.engl.47:3254-3257(2008);muh等人,eur.j.biochem.248:380-384(1997);muh等人,biochemistry35:11710-11718(1996)),且平衡常数已被报导为约4,位于巴豆酰-coa一侧(scherf和buckel,eur.jbiochem.215:421-429(1993))。这表明下游4-羟基丁酰-coa脱氢酶保持4-羟基丁酰-coa浓度很低,以致不能在巴豆酰-coa处产生热力学瓶颈。蛋白genbankid有机体abfdcab60035氨基丁酸梭菌abfdyp_001396399克氏梭菌msed_1321yp_001191403勤奋金属球菌msed_1220yp_001191305勤奋金属球菌4-羟基丁酰-coa转移酶将辅酶a部分从4-羟基丁酰辅酶转移到乙酸,于是形成4-羟基丁酸和乙酰-coa。一种示例性4-羟基丁酰-coa转移酶是由克氏梭菌的cat2基因编码(seedorf等人,proc.natl.acad.sci.us.a.105:2128-2133(2008);sohling和gottschalk,jbacteriol.178:871-880(1996))。也显示牙龈卟啉菌(porphyromonasgingivalis)的abft-2基因当作为产生4-羟基丁酸和1,4-丁二醇的途径的一部分实施时可展现4-羟基丁酰-coa转移酶活性(burk等人,wo/2008/115840(2008))。可通过序列同源性推断由牙龈卟啉菌的abft-1编码的另一种候选酶。另一种4-羟基丁酰-coa转移酶是由氨基丁酸梭菌的abft的基因产物编码(gerhardt等人,arch.microbiol174:189-199(2000))。蛋白genbankid有机体cat2yp_001396397克氏梭菌abft-2np_906037牙龈卟啉菌abft-1np_904965.1牙龈卟啉菌abftcab60036氨基丁酸梭菌示例性磷酸转移性酰基转移酶包括由pta编码的磷酸转乙酰酶和由ptb编码的磷酸转丁酰酶。来自大肠杆菌的pta基因编码可将乙酰-coa转化为乙酰磷酸且反之亦然的酶(suzuki,t.1969biochim.biophys.acta191:559-569(1969))。所述酶也可利用丙酰辅酶a代替乙酰-coa,从而在过程中形成丙酸(hesslinger等人,mol.microbiol27:477-492(1998))。类似地,来自丙酮丁醇梭菌的ptb基因编码可将丁酰辅酶a转化为丁酰磷酸的酶(huang等人,j.mol.microbiolbiotechnol2:33-38(2000);walter等人,gene134:107-111(1993))。这种酶显示在作为产生1,4-丁二醇的途径的一部分实施时可对4-羟基丁酰-coa具有活性(wo/2008/115840(2008))。其它ptb基因可在产丁酸菌l2-50(ljungdahl和andreesen,methodsenzymol.53:360-372(1978))和解磷细菌(bacillusmegaterium)(vazquez等人,curr.microbiol42:345-349(2001))中发现。蛋白genbankid有机体ptanp_416800.1大肠杆菌ptbnp_349676丙酮丁醇梭菌ptbaar19757.1产丁酸菌l2-50ptbcac07932.1解磷细菌示例性激酶包括大肠杆菌乙酸激酶,由acka编码(skarstedt和silverstein,j.biol.chem.251:6775-6783(1976));丙酮丁醇梭菌丁酸激酶,由buk1和buk2编码(huang等人,2000j.mol.microbiolbiotechnol2:33-38(2000);walter等人,gene134:107-111(1993));和大肠杆菌γ-谷氨酸激酶,由prob编码(smith等人,j.bacteriol.157:545-551(1984))。这些酶分别磷酸化乙酸、丁酸和谷氨酸。大肠杆菌的acka基因产物也磷酸化丙酸(hesslinger等人,mol.microbiol27:477-492(1998))。burk等人,wo/2008/115840(2008)显示丙酮丁醇梭菌的buk1基因产物当作为产生1,4-丁二醇的途径的一部分实施时对4-羟基丁酰-coa具有活性。蛋白genbankid有机体ackanp_416799.1大肠杆菌buk1np_349675丙酮丁醇梭菌buk2q97ii1丙酮丁醇梭菌probnp_414777.1大肠杆菌醇形成型4-羟基丁酰-coa还原酶催化从4-羟基丁酰-coa形成1,4-丁二醇所必需的2个还原步骤。将酰基辅酶a转化为醇的示例性2步氧化还原酶包括那些将例如乙酰-coa等底物转化为乙醇(例如大肠杆菌的adhe)(kessler等人,febs.lett.281:59-63(1991))和将丁酰辅酶a转化为丁醇(例如丙酮丁醇梭菌的adhe2)(fontaine等人,j.bacteriol.184:821-830(2002))的氧化还原酶。参考文献burk等人,wo/2008/115840(2008)具体地显示了丙酮丁醇梭菌的adhe2酶可用于从4-羟基丁酰-coa产生bdo。除了将乙酰-coa还原为乙醇外,肠膜明串珠菌(leuconostocmesenteroides)的adhe所编码的酶已显示可将支链化合物异丁醛氧化为异丁酰辅酶a(kazahaya等人,j.gen.appl.microbiol.18:43-55(1972);koo等人,biotechnollett.27:505-510(2005))。另一种示例性酶可将丙二酰辅酶a转化为3-hp。具有此活性的nadph依赖性酶已在橙色绿屈挠菌(chloroflexusaurantiacus)中得到表征,其中所述酶参与3-羟基丙酸循环(hugler等人,j.bacteriol.184:2404-2410(2000);strauss和fuchs,eur.j.biochem.215:633-643(1993))。所述酶的质量为300kda,其具有高度的底物特异性且与其它已知的氧化还原酶显示很小的序列相似性(hugler等人,j.bacteriol.184:2404-2410(2002))。没有显示其它有机体中的酶可催化所述特异性反应;然而,存在生物信息学证据证明其它有机体可能具有类似的途径(klatt等人,environ.microbiol.9:2067-2078(2007))。可通过序列相似性推断包括卡氏玫瑰弯菌(roseiflexuscastenholzii)、赤细菌属(erythrobacter)nap1和海洋γ变形杆菌(marinegammaproteobacterium)htcc2080的其它有机体中的候选酶。蛋白genbankid有机体mcraas20429.1橙色绿屈挠菌rcas_2929yp_001433009.1卡氏玫瑰弯菌nap1_02720zp_01039179.1赤细菌属nap1mgp2080_00535zp_01626393.1海洋γ变形杆菌htcc2080从4-羟基丁酰-coa产生bdo的替代途径涉及首先将所述化合物还原为4-羟基丁醛。若干种酰基辅酶a脱氢酶能够将酰基辅酶a还原为其对应的醛。编码所述酶的示例性基因包括:醋酸钙不动杆菌(acinetobactercalcoaceticus)acr1,其编码脂肪酰辅酶a还原酶(reiser和somerville,journalofbacteriology179:2969-2975(1997));不动杆菌属(acinetobactersp.)m-1脂肪酰辅酶a还原酶(ishige等人,appl.environ.microbiol.68:1192-1195(2002));和克氏梭菌sucd基因,其编码辅酶a-和nadp-依赖性琥珀酸半醛脱氢酶(sohling和gottschalk,jbacteriol.178:871-880(1996))。牙龈卟啉菌的sucd是另一种琥珀酸半醛脱氢酶(takahashi等人,j.bacteriol.182:4704-4710(2000))。参考文献burk等人,wo/2008/115840(2008)具体地显示了这些琥珀酸半醛脱氢酶可作为产生1,4-丁二醇的途径的一部分而将4-羟基丁酰-coa转化为4-羟基丁醛。假单胞菌属中由bphg编码的使乙醛脱氢酶酰化的酶是另一种有用的酶,因为其已被证实可氧化乙醛、丙醛、丁醛、异丁醛和甲醛并使其酰化(powlowski等人,jbacteriol.175:377-385(1993))。将酰基辅酶a转化为其对应醛的另一种类型的酶是丙二酰辅酶a还原酶,其将丙二酰辅酶a转化为丙二酸半醛。丙二酰辅酶a还原酶是嗜热嗜酸古菌中经由3-羟基丙酸循环的自养碳固定中的关键酶(berg等人,science318:1782-1786(2007);thauer,r.k.science318:1732-1733(2007))。所述酶利用nadph作为辅因子且已在金属球菌和硫化叶菌(sulfolobusspp)中得到表征(alber等人,j.bacteriol.188:8551-8559(2006);hugler等人,j.bacteriol.184:2404-2410(2002))。所述酶在勤奋金属球菌中是由msed_0709编码(alber等人,j.bacteriol.188:8551-8559(2006);berg等人,science318:1782-1786(2007))。将来自托氏硫化叶菌(sulfolobustokodaii)的编码丙二酰辅酶a还原酶的基因在大肠杆菌中克隆并异源表达(alber等人,j.bacteriol.188:8551-8559(2006))。虽然这些酶的醛脱氢酶功能类似于来自橙色绿屈挠菌的双功能脱氢酶,但是其序列相似性却很小。这两种丙二酰辅酶a还原酶候选物与天门冬氨酸半醛脱氢酶具有高度的序列相似性,天门冬氨酸半醛脱氢酶是一种催化天冬氨酰-4-磷酸还原且同时脱磷酸成天门冬氨酸半醛的酶。可在包括硫磺矿硫化叶菌(sulfolobussolfataricus)和嗜酸热硫化叶菌(sulfolobusacidocaldarius)的其它有机体中通过与蛋白质的序列同源性来发现其它候选基因。蛋白genbankid有机体msed_0709yp_001190808.1勤奋金属球菌mcrnp_378167.1托氏硫化叶菌asd-2np_343563.1硫磺矿硫化叶菌saci_2370yp_256941.1嗜酸热硫化叶菌展现1,4-丁二醇脱氢酶活性的酶能够从4-羟基丁醛形成1,4-丁二醇。催化醛转化为醇的酶(即醇脱氢酶,或等同地称作醛还原酶)的示例性编码基因包括:编码c2-c14的中链醇脱氢酶的alra(tani等人,appl.environ.microbiol.66:5231-5235(2000));来自酿酒酵母的adh2(atsumi等人,nature451:86-89(2008));来自大肠杆菌的yqhd,其偏好长于c(3)的分子(sulzenbacher等人,journalofmolecularbiology342:489-502(2004));和来自丙酮丁醇梭菌的bdhi和bdhii,其将丁醛转化为丁醇(walter等人,journalofbacteriology174:7149-7158(1992))。蛋白genbankid有机体alrabab12273.1不动杆菌菌株m-1adh2np_014032.1酿酒酵母yqhdnp_417484.1大肠杆菌bdhinp_349892.1丙酮丁醇梭菌bdhiinp_349891.1丙酮丁醇梭菌展现4-羟基丁酸脱氢酶活性的酶(ec1.1.1.61)也属于此范畴。所述酶已在真氧产碱杆菌(ralstoniaeutropha)(bravo等人,j.forensicsci.49:379-387(2004))、克氏梭菌(wolff和kenealy,proteinexpr.purif.6:206-212(1995))和拟南芥(arabidopsisthaliana)(breitkreuz等人,j.biol.chem.278:41552-41556(2003))中得到表征。蛋白genbankid有机体4hbdyp_726053.1真氧产碱杆菌h164hbdl21902.1克氏梭菌dsm5554hbdq94b07拟南芥如先前所述,在表达质粒上克隆4-羟基丁酸合成所必需的非天然基因。宿主菌株也表达甲醇甲基转移酶活性、codh/acs活性和可能的pfor和氢化酶活性。此处,将这些(codh/acs等)基因整合到基因组中,并从可组成性使用或与诱导子(即pa1-laco1可在含laci的细胞中诱导,或者在其它方面是组成性的)一起使用的启动子开始表达。一旦4-羟基丁酸的表达和产率得到优化,即可通过在中性位点整合单拷贝的这些基因来进一步修饰基础菌株。鉴于基因的数量相对有限(最少5种且最多6种),可构建编码所需基因的人工操纵子。使用整合质粒引入所述操纵子,并将其与例如杆菌sacb基因所允许的反选择方法偶联(link等人,jbacteriol.179:6228-6237(1997))。如此可在大肠杆菌染色体的任何位置产生无标记且无痕的插入。优化涉及改变基因次序以及核糖体结合位点和启动子。如先前所述,在表达质粒上克隆1,4-丁二醇合成所必需的非天然基因。宿主菌株也表达甲醇甲基转移酶活性、codh/acs活性和可能的pfor和氢化酶活性。此处,将这些(codh/acs等)基因整合到基因组中,并从可组成性使用或与诱导子(即pa1-laco1可在含laci的细胞中诱导,或者在其它方面是组成性的)一起使用的启动子开始表达。一旦1,4-丁二醇的表达和产率得到优化,即可通过在中性位点整合单拷贝的这些基因来进一步修饰基础菌株。鉴于基因的数量相对有限(最少5种且最多6种),可构建编码所需基因的人工操纵子。使用整合质粒引入所述操纵子,并将其与例如杆菌sacb基因所允许的反选择方法偶联(link等人,jbacteriol.179:6228-6237(1997))。如此可在大肠杆菌染色体的任何位置产生无标记且无痕的插入。优化涉及改变基因次序以及核糖体结合位点和启动子。本申请案通篇引用了各种公开案。这些公开案的公开内容是以引用的方式全部并入到本申请案中,以便更充分地描述本发明所属领域的发展水平。虽然已经参考上文提供的实施例描述了本发明,但是应了解在不脱离本发明精神的情况下可进行各种修改。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1