一种重组mGM-CSF与GnRH融合蛋白的基因工程菌的构建的制作方法
在基因工程领域,本发明公开了一种新型蛋白重组工程菌及其构建方法,以及该融合蛋白的纯化。
背景技术:
基因工程是生物工程的一个重要分支,它和细胞工程、酶工程、蛋白质工程和微生物工程共同组成了生物工程。所谓基因工程(geneticengineering)是在分子水平上对基因进行操作的复杂技术。是将外源基因通过体外重组后导入受体细胞内,使这个基因能在受体细胞内复制、转录、翻译表达的操作。它是用人为的方法将所需要的某一供体生物的遗传物质——dna大分子提取出来,在离体条件下用适当的工具酶进行切割后,把它与作为载体的dna分子连接起来,然后与载体一起导入某一更易生长、繁殖的受体细胞中,以让外源物质在其中“安家落户”,进行正常的复制和表达,从而获得新物种的一种崭新技术。它克服了远缘杂交的不亲和障碍。
基因工程疫苗是使用dna重组生物技术,把天然的或人工合成的遗传物质定向插入细菌、酵母菌或哺乳动物细胞中,使之充分表达,经纯化后而制得的疫苗。应用基因工程技术能制出不含感染性物质的亚单位疫苗、稳定的减毒疫苗及能预防多种疾病的多价疫苗。如把编码乙型肝炎表面抗原的基因插入酵母菌基因组,制成dna重组乙型肝炎疫苗;把乙肝表面抗原、流感病毒血凝素、单纯疱疹病毒基因插入牛痘苗基因组中制成的多价疫苗等。
质粒具有稳定可靠和操作简便的优点。如果要克隆较小的dna片段(<10kb)且结构简单,质粒要比其它任何载体都要好。重组质粒是指在基因工程的领域,将目的基因和载体结合成一个具有自我复制能力的dna分子,继而转化或转染入宿主菌株或细胞,筛选出含目的基因的重组子。
肿瘤疫苗是近年研究的热点之一,其原理是通过激活患者自身免疫系统,利用肿瘤细胞或肿瘤抗原物质诱导机体的特异性细胞免疫和体液免疫反应,增强机体的抗癌能力,阻止肿瘤的生长、扩散和复发,以达到清除或控制肿瘤的目的。
根据肿瘤疫苗的具体用途,可分为两种:一种是预防性疫苗,如用与某些特殊肿瘤发生有关的基因制备疫苗,接种于具有遗传易感性的健康人群,进而可以控制肿瘤的发生。另一种是治疗性疫苗,它以肿瘤相关抗原为基础,主要用于化疗后的辅助治疗。
促性腺激素释放激素(gonadotropin-releasinghormone,gnrh)又称为黄体释放激素(1uteinizinghormone-releasinghormone,lhrh),序列为cooh-焦谷-组-色-丝-络-甘-亮-精-脯-甘-nh2(pyro-glu-his-trp-ser-tyr-glyleu-arg-pro-gly-nh2),它是神经、免疫、内分泌三大调节系统相互联系的重要信号分子。1971年,shally和guillenmin从猪的下丘脑首先分离纯化出促性腺激素释放激素并由此获得诺贝尔奖。它由下丘脑特定神经元细胞合成,并以脉冲方式通过垂体门脉循环分泌到垂体前叶,与垂体细胞膜上高亲和力的gnrh受体(gnrhr)特异地结合,引发fsh和lh的合成与释放,从而促进性腺中类固醇激素的合成。通过诱导高滴度的抗gnrh-i抗体来中和机体内的gnrh-i,可抑制其与垂体上i型gnrhr的结合,导致lh和fsh等促性腺激素释放水平明显下降,下调类固醇类激素的合成,降低对肿瘤细胞生长的供应,对激素依赖性肿瘤有良好的治疗效果。同时gnrh可下调肿瘤细胞诱导的血管再生作用以及调控或作用于生长因子,如在前列腺癌细胞中gnrh-a具有抗egf/tgfa系统作用,降低细胞分裂;可能涉及细胞凋亡的诱发或者抑制细胞内诸如p13/pkb等信号通道。因此gnrh及其受体是肿瘤治疗的理想靶点。
gnrh-i是一种小分子半抗原,免疫原性很弱,单独将其作为疫苗很难引起免疫应答,因此本实验室利用辅助t表位来提高gnrh-i的免疫原性。研究表明,麻疹病毒融合蛋白序列中的288-302氨基酸片段是一个典型的t表位(seikgvivrlegvak,下文均简称mvp),可用于人用疫苗而且不会产生明显的针对该t表位的抗体。有研究表明,含有多拷贝线性连接的自身肽序列蛋白的免疫原性可以得到极大的提高,因而,本实验室将编码三段首尾相连的gnrh-i的核苷酸片段克隆入高效表达载体。还有研究表明,半抗原的二聚体能产生很强的免疫原性。人igg1铰链区(hingeregion)寡肽片段226-232/226’-232’(cppcpap/cppcpap)是天然免疫蛋白的枢轴。在天然蛋白中,这个富含脯氨酸的刚性双链环状结构会自发折叠成一个双聚脯氨酸-iiα螺旋,人工合成的铰链区多肽225-232/225’-232’的空间构型与天然蛋白中铰链片段的构型完全一致,进一步研究还发现在igg1铰链区的一端或两端连上非igg1的多肽序列时,仍能形成双聚脯氨酸-iiα螺旋。因此,我们在编码gnrh-i重复序列和mvp的核苷酸序列之间引入该寡肽片段的相应核苷酸序列,希望gnrh-i能藉此形成二聚体,增强免疫原性。
就像大多数多肽疫苗一样,gnrh的重组多肽需要加入佐剂,才能激发机体产生足够强的免疫应答。本实验将与dnak多肽结合结构域有着高度亲和力的多肽片段nrllltg融合在先前所构建的gnrh-i多肽疫苗融合蛋白的c-端。
鼠源粒细胞巨噬细胞集落刺激因子(mousegranulocyte-macrophagecolonystimulatingfactor,mgm-csf)属于造血因子家族,与人源gm-csf有56%的同源性。抗原提呈是机体产生免疫应答的第一步,树突状细胞(dendriticcell,dc)是体内专职的、作用最强大的抗原提呈细胞(antigen-presentingcells,apcs),而gm-csf是对树突细胞调节作用最强的细胞因子,它不仅可以诱导dc细胞的成熟、分化,而且在免疫治疗过程中可增强主要和次要的抗体反应,以促进dc等apc的分化、成熟和活化以及上调cd86的表达,进而增强中性粒细胞、单核巨噬细胞、嗜酸性粒细胞对肿瘤细胞的吞噬作用和adcc(抗体依赖细胞介导的细胞毒性作用)效应等活性,促进th、tc、nk在肿瘤部位浸润,抑制肿瘤细胞的生长。gm-csf强烈激活特异免疫反应这一突出作用可用于肿瘤治疗。大量的动物实验和临床研究证实粒细胞巨噬细胞集落刺激因子可在肿瘤主动免疫治疗作为佐剂使用,同时具有安全、无毒、不良反应小等优点。
由于单独用mgm-csf或gnrh免疫原性相对较低,且从多个位点共同作用于肿瘤已经成为趋势。本发明将mgm-csf基因同gnrh基因连接起来,组建pet28a-mgm-csf-gnrh3-hinge-mvp-nrllltg重组质粒,诱导表达融合蛋白,将其作为疫苗刺激机体产生主动免疫,打破免疫耐受,产生针对mgm-csf和gnrh特异性肽段的抗体,从而抑制肿瘤的生长。
技术实现要素:
本发明公开一种表达重组mgm-csf和gnrh融合蛋白的基因工程菌。
本发明的一个目的是提供该重组菌的制备方法,方法简便,易于操作。
本发明的另一个目的是公开该重组蛋白的纯化方法。
在本发明的第一个方面,该大肠杆菌菌株命名为escherichiacolibl21/pet28a-mggn:pet28a-mgm-csf-gnrh3-hinge-mvp-nrllltg,菌株已提交中国典型培养物保藏中心,保藏地址:中国、武汉、武汉大学。保藏日期:2017年1月10日,保藏编号为cctccno:m2017022,分类命名为escherichiacolibl21/pet28a-mggn:pet28a-mgm-csf-gnrh3-hinge-mvp-nrllltg,其细胞中含有重组质粒pet28a-mgm-csf-gnrh3-hinge-mvp-nrllltg,质粒中含有seqidno.1所示的mgm-csf-gnrh3-hinge-mvp-nrllltg基因序列。
在本发明的第二个方面,提供了该重组质粒的制备方法,其技术路线详述如下:
1.重组质粒pet28a-mgm-csf-gnrh3-hinge-mvp-nrllltg及相应基因工程菌的构建
根据本实验室已有的关于重组质粒pet-28a-vegf-m2-gnrh3-hinge-mvp-nrllltg和pet-28a-mgm-csf-x10-βhcgctp37的序列信息,利用引物设计软件primer5和oligo7来设计引物p1、p2。上游引物p1中引入ncoi,下游引物p2中引入bamhi酶切位点以及dptggs连接肽序列。采用pcr技术从pet-28a-mgm-csf-x10-βhcgctp37质粒中克隆得到基因mgm-csf。通过酶切、酶连反应和转化技术将pcr的产物mgm-csf插入pet-28a质粒载体的相应酶切位点中,得到重组转化子pet28a-mgm-csf-gnrh3-hinge-mvp-nrllltg,将重组质粒转化大肠杆菌e.colibl21获得需要的重组基因的工程菌。
2.融合蛋白的诱导表达
将重组工程菌进行活化,接种至含硫酸卡那霉素的lb培养基中震荡培养过夜,按1:100转接于新鲜lb培养液中,37℃培养至od600值为0.5-0.8时,加入乳糖(终浓度5mm)进行诱导表达,6h后离心收取菌体沉淀,进行15%sds-page分析,观察目的蛋白条带位置和表达量。
3.融合蛋白的分离纯化
收集菌体,每克湿菌体加入10ml菌体裂解缓冲液溶解,菌体超声裂解,离心收集沉淀。将沉淀用含2m尿素的包涵体洗涤液进行洗涤后溶于含6m盐酸胍的包涵体裂解液中,离心取上清,将上清采用分步稀释法按照盐酸胍浓度梯度4m、2m、1.5m、1m进行缓慢稀释复性,离心弃沉淀,上清液过阴离子交换柱deae-cellulose做进一步纯化,用浓度梯度为0-1mnacl层析缓冲液梯度洗脱,收集洗脱峰,检测合并目的蛋白峰组分,蒸馏水充分透析后冻干保存。
附图说明
图1重组质粒构建原理示意图。
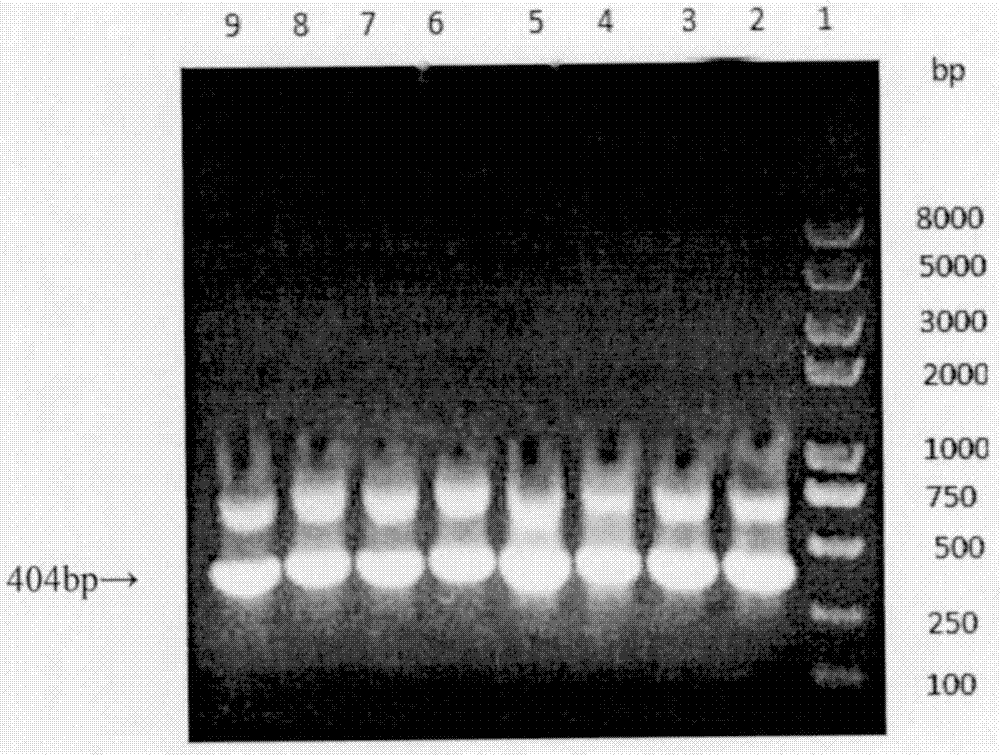
图20.8%琼脂糖凝胶电泳中mgm-csf基因pcr扩增产物电泳图。
lane1:dnamarker;lane2-9:退火温度分别为57℃,58℃,59℃,60℃,61℃,62℃,63℃,64℃时对应的mgm-csfpcr产物
图30.8%琼脂糖凝胶电泳检测mgm-csf-gnrh3-hinge-mvp-nrllltg目的基因的结果图。
lane1:dnamarker;lane2-7:来自于不同菌落的重组质粒pet28a-mgm-csf-gnrh3-hinge-mvppcr产物
图40.8%琼脂糖凝胶电泳重组质粒限制性内切酶验证图。
lane1:dnamarker;lane2:ncoi、hindiii双酶切pet-28a-mgm-csf-gnrh3-hinge-mvp重组质粒;lane3:ncoi单酶切pet-28a-mgm-csf-gnrh3-hinge-mvp重组质粒
图5重组质粒pet28a-mgm-csf-gnrh3-hinge-mvp-nrllltg的基因正向测序图。
图615%sds-page电泳检测重组菌经乳糖诱导表达融合蛋白的诱导曲线图。
lane1:proteinmarker;lane2:重组菌诱导前的全菌蛋白;lane3~10:重组菌诱导时间分别为1h、2h、3h、4h、5h、6h、7h、8h后的全菌蛋白
图715%sds-page菌体裂解物分析图。
lane1:proteinmarker;lane2:诱导前菌体总蛋白;lane3:乳糖诱导6h后菌体总蛋白;lane4:重组菌超声破碎后的上清液;lane5:重组菌超声破碎后的沉淀
图815%sds-page电泳检测尿素洗涤浓度筛选图。
lane1:proteinmarkerlane3,5,7,9:经尿素浓度分别为0.5m,1m,1.5m,2m洗涤液洗涤后的沉淀;lane2,4,6,8:经尿素浓度分别为0.5m,1m,1.5m,2m洗涤液洗涤后的上清
图915%sds-page分析mgm-csf/gnrh融合蛋白冻干纯化结果图。
lane1:proteinmarker;lane2:纯化后的mgm-csf/gnrh融合蛋白
具体实施方式
材料
(1)菌株
载体pet-28a-mgm-csf-x10-βhcgctp37,escherichiacolibl21,菌株pet-28a-vegf-m2-gnrh3-hinge-mvp-nrllltg均为本实验室保存。
(2)工具酶和试剂
分子克隆工具酶为fermentas公司产品;质粒抽提试剂盒为上海捷瑞生物科技有限公司;产物纯化试剂盒以及pcr胶回收试剂盒为上海生工生物科技有限公司的产品。
(3)培养基
lb培养基,配方见参考文献sambrookj,fristshef,maniatist.molecularcloning;alaboratorymanual2nded.ny:coldspringharborlaboratorypress,1989。
本说明书所提及的方法中质粒提取、pcr反应、内切酶酶切、pcr产物的回收、连接酶连接和转化大肠杆菌,这些都是基因工程研究领域的常规操作方法,具体参见sambrookj,fristshef,maniatist.molecularcloning;alaboratorymanual2nded.ny:coldspringharborlaboratorypress,1989,pp.16-340。
实施例1pet28a-mgm-csf-gnrh3-hinge-mvp-nrllltg基因的克隆
根据本实验室已构建的关于pet-28a-mgm-csf-x10-βhcgctp37的序列信息,利用引物设计软件primer、oligo分别设计两对引物p1、p2:
p1:5’-catgccatggcacccacccgct-3’
p2:5′-cgggatccgagccaccagtcgg-3′
上游引物p1中引入酶切位点ncoi,下游p2中引入酶切位点bamhi以及柔性肽dptggs。用质粒提取试剂盒提取质粒pet-28a-mgm-csf-x10-βhcgctp37和质粒pet-28a-vegf-m2-gnrh3-hinge-mvp-nrllltg。利用引物p1、p2克隆mgm-csf基因,pcr反应体系见表1,反应参数见表2。
表1mgm-csfpcr反应体系
表2mgm-csfpcr反应参数
0.8%琼脂糖凝胶电泳鉴定pcr产物(参见说明书附图2),条带位置与预期的404bp一致。
通过切胶回收获得目的片段mgm-csf,将目的片段和pet-28a-vegf-m2-gnrh3-hinge-mvp-nrllltg载体质粒分别经ncoi、bamhi双酶切,双酶切反应体系见表3、表4。
表3mgm-csf基因双酶切反应体系
表4pet-28a-vegf-m2-gnrh3-hinge-mvp-nrllltg双酶切反应体系
酶切产物通过pcr产物纯化试剂盒纯化,琼脂糖凝胶电泳分别回收目的基因片段与载体基因片段后用e.colidna连接酶4℃连接,用冷cacl2法制备大肠杆菌bl21的感受态细胞,将酶连产物转化感受态细胞后涂布到含硫酸卡那霉素的lb固体培养基上,37℃过夜培养后挑取单菌落,将单菌落接种至lb液体培养基中,培养过夜,提取质粒,分别通过菌落pcr、单酶切和双酶切等方法初筛阳性克隆,并送至生工测序公司进行测序,测序结果经软件比对后完全正确。(参见说明书附图3,图4,图5)
实施例2mgm-csf-gnrh3-hinge-mvp-nrllltg基因在大肠杆菌中的表达及培养
重组菌以1%接种量在液体lb培养基试管中37℃振荡培养过夜,再以1%的接种量转接摇瓶大批培养,培养4h后加入终浓度为5mm乳糖诱导表达,诱导6h后收集菌体,留样进行sds-page分析。融合蛋白在诱导后6h达到稳定的最大表达量,通过bandscan软件分析融合蛋白的表达量可达菌体总蛋白量的44.6%。(参见说明书附图6)
实施例3融合蛋白的初步分离纯化
挑选高表达量菌株,接种于lb培养基中,37℃过夜培养;过夜培养液转接入lb培养基,37℃扩大培养,选取最优发酵条件获得发酵菌体。5000r/min离心15min,上清及沉淀均留样。将沉淀用配制好的菌体裂解液(10ml/g菌体)溶解,超声裂解菌体。12000r/min离心20min,收集上清及沉淀均留样标记。sds-page电泳结果显示目的蛋白主要存在于菌体沉淀中,故可判断融合蛋白为包涵体表达。(参见说明书附图7)
实施例4包涵体纯化
取4管10ml裂解后的菌体,4℃、12000r/min离心15min。各管沉淀分别重悬于10ml0.5m、1m、1.5m、2m尿素(含20mmtris-hcl,0.5mmedta,ph8.0)中。4℃磁力搅拌1h后,12000r/min离心10min,上清和沉淀分别取样,15%sds-page电泳分析上清和沉淀中杂蛋白和目的蛋白的含量。每g包涵体湿重加入10ml洗涤液,rt,磁力搅拌1h使沉淀重新悬浮均匀。12000r/min离心15min,弃上清,保留沉淀。用双蒸水洗涤,离心取沉淀4℃备用。包涵体沉淀1g加入20ml包涵体裂解缓冲液,4℃磁力搅拌过夜,使沉淀重悬浮于盐酸胍溶液中。12000r/min离心15min,收集上清。(参见说明书附图8)
实施例5包涵体的复性
将上步收集的上清采用分步稀释法按照盐酸胍浓度梯度4m、2m、1.5m、1m进行缓慢稀释复性,复性液中加入氧化型谷胱甘肽和还原型谷胱甘肽至终浓度分别为0.1mmol/l和1mmol/l及5%甘油,4℃快速搅拌,利用恒流泵控制流速以1ml/min将复性液滴加进蛋白变性液中,每稀释降低一个浓度梯度需静置或缓慢搅拌6-12小时使蛋白充分复性,离心取上清,获得复性后的目的蛋白。
实施例6deae-52阴离子交换层析
本实验采用的deae52是弱酸型阴离子交换剂,将deae-52用naoh、hcl和naoh分别处理后用蒸馏水将其洗至中性,再将deae-52装入层析柱中,层析柱上端进液口连接恒流泵,下出口连接核酸蛋白检测仪,利用离子交换缓冲液(ph8.0,20mmtris·hcl)进行层析柱的平衡,平衡完毕后以1ml/min的速度进行蛋白溶液的上样操作,上样后重复平衡操作,收集穿透峰,再用nacl(0-1m)进行梯度洗脱,收集洗脱峰留样,进行sds-page电泳分析。
实施例6脱盐冻干
收集蛋白纯度较高的洗脱液,装入截留量为8000-14000da的透析袋中4℃对蒸馏水透析过夜,将透析后的洗脱液在冻干机中冻干,刮取蛋白干粉冷冻保存并进行sds-page电泳分析。(参见说明书附图9)
除上述事实外,本发明还可以有其他实施方式,凡采用等同替换或等效变换性的技术方案,均落于本发明要求的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!