一种融合蛋白表达纯化方法与流程
本发明涉及融合蛋白表达纯化方法技术领域,具体为一种融合蛋白表达纯化方法。
背景技术:
在生命科学研究和生物制品的生产过程中,利用表达载体制备重组蛋白时最重要的技术之一,获得大量有活性的重组蛋白是进行生物制品研究和生产的必要条件。构建有效的表达载体是表达目的基因的基本要求,同时也是影响基因表达水平及蛋白活性的重要因素。一般来说,非融合型表达载体虽然能较好的保持外源蛋白的一级结构,但其表达量较低、外源蛋白分离纯化困难,回收率低,分离纯化工艺复杂,工业上大规模生产的成本较高。
技术实现要素:
本发明的目的在于提供一种融合蛋白表达纯化方法,具有表达量高、外源蛋白分离纯化简单、回收率高、分离纯化工艺简便和成本低的优点,以解决上述背景技术中提出的问题。
为实现上述目的,本发明提供如下技术方案:一种融合蛋白表达纯化方法,包括以下实验用品:1ul重组的pET32a质粒、BL21(DE3)菌株、100ug/ml氨苄青霉素、0.5mM的IPTG、PBS缓冲液、220rpm、2M尿素、50mMTris、300mMNaCl、1mMDTT、溶菌酶、0.2%TritonX-100、5mL NI-NTA、EK酶、镍琼脂糖亲和层析和SK3071 非干扰型蛋白浓度测定试剂盒。
一种融合蛋白表达纯化方法,包括以下实验过程:
S1:融合蛋白的原核表达;
S2:融合蛋白的纯化;
S3:分析纯化后融合蛋白,通过SDS-PAGE电泳和灰度分析,检测分析纯化后融合蛋白的纯度,用SK3071 非干扰型蛋白浓度测定试剂盒测定蛋白浓度。
优选的,所述S1包含以下步骤:
S1-1:转化,取1ul重组的pET32a质粒转化BL21(DE3)菌株,42℃热击90s,冰上静置2min后涂平板(100ug/ml氨苄青霉素),37℃培养过夜;
S1-2:选择诱导条件;
S1-3:大量诱导,将培养的菌液按1:100比例接种于4L 的LB液体培养基中,添加100ug/ml氨苄青霉素,37℃,220rpm培养,当OD值达到0.6左右时,添加终浓度为0.5mM的IPTG,20℃,220rpm,诱导过夜,离心收集细胞菌体。
优选的,所述S2包含以下步骤:
S2-1:超声破碎菌体;
S2-2:镍琼脂糖亲和层析。
优选的,所述S3包含以下步骤:
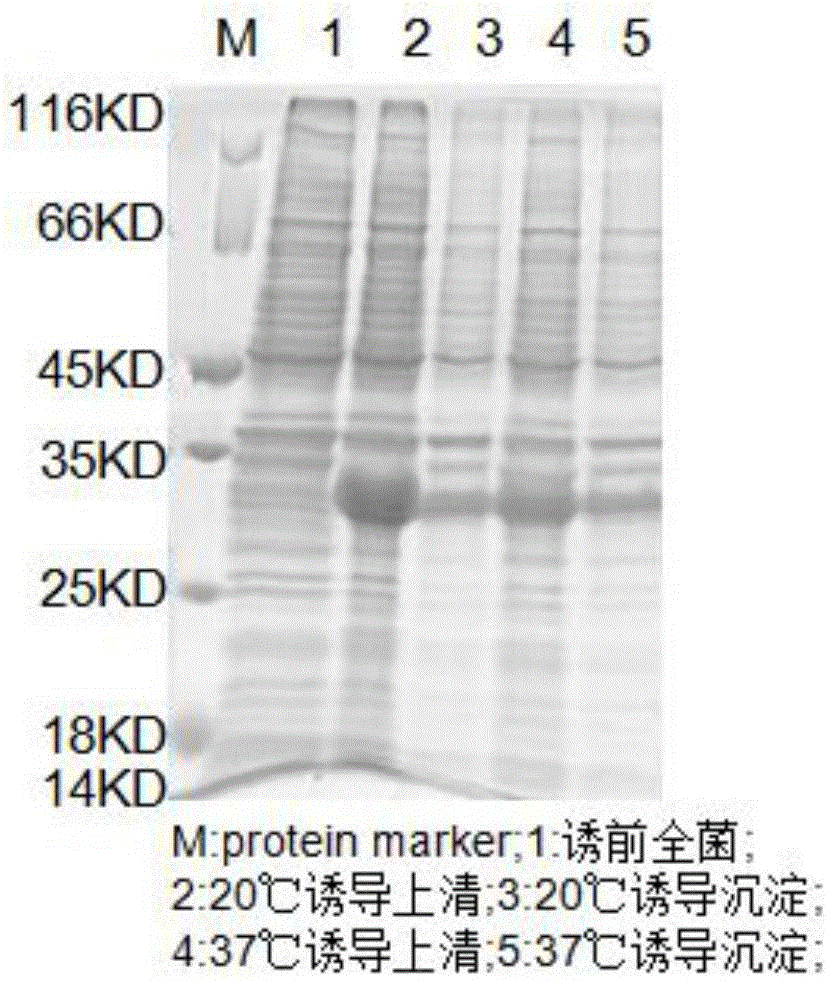
S3-1:融合蛋白的表达及定位,通过S1和S2步骤小试样品进行SDS-PAGE分析;
S3-2:融合蛋白的纯化,SerD融合蛋白镍琼脂糖亲和层析纯化后,SDS-PAGE分析;
S3-3:融合蛋白Western-Blot分析,SerD纯化的融合蛋白经过Western-Blot分析;
S3-4:SerD融合蛋白EK酶切镍琼脂糖亲和层析SDS-PAGE分析,SerD融合蛋白EK酶切后镍琼脂糖亲和层析纯化SDS-PAGE分析;
S3-5:蛋白浓度测定,用SK3071 非干扰型蛋白浓度测定试剂盒测定蛋白浓度:0.8mg/ml,BSA浓度为2mg/ml,测定的蛋白体积为20ul。
优选的,所述S1-2还包括以下步骤:
S1-2-1:挑取表达菌株BL21(DE3)的单菌落于试管中(4mL LB培养基加100ug/ml氨苄青霉素)37℃,220rpm过夜培养;
S1-2-2:将培养的菌液按1:100比例分别接种于4mL的LB培养基中,添加100ug/ml氨苄青霉素,37℃,220rpm培养;
S1-2-3:当OD值达到0.6左右时,添加终浓度为0.5mM的IPTG,分别20℃,220rpm,诱导16h和37℃,220rpm诱导4h,未加IPTG 诱导剂的作为阴性对照;
S1-2-4:收集菌体并用PBS缓冲液悬浮;
S1-2-5:SDS-PAGE电泳检测,选择最佳的蛋白表达诱导条件。
优选的,所述S2-1还包括以下步骤:
S2-1-1:将收集的细菌菌体用破碎Buffer(2M尿素,50mMTris,300mMNaCl,1mMDTT,溶菌酶,0.2%TritonX-100,pH=8.0)溶解,冰浴中超声破碎菌体,功率400W,20min(超声3S,暂停5S为一个循环);
S2-1-1:超声完毕,12000rpm,4℃,离心20min,上清做下一步纯化。
优选的,所述S2-2还包括以下步骤:
S2-2-1:取5mL NI-NTA,用10倍柱床体积的Binding buffer清洗平衡柱子,流速5mL/min。将样品和平衡好的柱料4℃孵育1h;
S2-2-2:样品上柱,流速为2mL/min,收集穿透液;
S2-2-3:10倍柱床体积的结合缓冲液清洗柱子,流速10mL/min;
S2-2-4:洗杂,流速5ml/min,收集洗脱液;
S2-2-5:洗脱,流速2ml/min,收集洗脱液。
与现有技术相比,本发明的有益效果是:本融合蛋白表达纯化方法,采用SDS-PAGE检测,将(500mM咪唑)含目标蛋白洗脱液透析到1M尿素,50mMTris,300mMNaCl,pH8.0缓冲液中,4℃透析过夜,将透析过夜的样品加入EK酶(EK酶的量是1:1000(EK酶量:蛋白量)),4℃酶切过夜,酶切后的蛋白过镍琼脂糖亲和层析,去除标签和EK酶,通过SDS-PAGE电泳和灰度分析,检测分析纯化后融合蛋白的纯度,用SK3071 非干扰型蛋白浓度测定试剂盒测定蛋白浓度,使其相比较非融合型表达载体具有表达量高、外源蛋白分离纯化简单、回收率高、分离纯化工艺简便和成本低的优点。
附图说明
图1为本发明的小试样品进行SDS-PAGE分析结果图;
图2为本发明的SerD融合蛋白镍琼脂糖亲和层析纯化后,SDS-PAGE分析结果图;
图3为本发明的SerD纯化的融合蛋白经过Western-Blot分析结果图;
图4为本发明的SerD融合蛋白EK酶切后镍琼脂糖亲和层析纯化SDS-PAGE分析结果图;
图5为本发明的蛋白浓度测定结果图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行亲楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
本发明提供一种技术方案:一种融合蛋白表达纯化方法,包括以下实验用品:1ul重组的pET32a质粒、BL21(DE3)菌株、100ug/ml氨苄青霉素、0.5mM的IPTG、PBS缓冲液、220rpm、2M尿素、50mMTris、300mMNaCl、1mMDTT、溶菌酶、0.2%TritonX-100、5mL NI-NTA、EK酶、镍琼脂糖亲和层析和SK3071 非干扰型蛋白浓度测定试剂盒。
一种融合蛋白表达纯化方法,包括以下实验过程:
S1:融合蛋白的原核表达,转化,取1ul重组的pET32a质粒转化BL21(DE3)菌株,42℃热击90s,冰上静置2min后涂平板(100ug/ml氨苄青霉素),37℃培养过夜;选择诱导条件,挑取表达菌株BL21(DE3)的单菌落于试管中(4mL LB培养基加100ug/ml氨苄青霉素)37℃,220rpm过夜培养;将培养的菌液按1:100比例分别接种于4mL的LB培养基中,添加100ug/ml氨苄青霉素,37℃,220rpm培养:当OD值达到0.6左右时,添加终浓度为0.5mM的IPTG,分别20℃,220rpm,诱导16h和37℃,220rpm诱导4h,未加IPTG诱导剂的作为阴性对照:收集菌体并用PBS缓冲液悬浮;SDS-PAGE电泳检测,选择最佳的蛋白表达诱导条件;大量诱导,将培养的菌液按1:100比例接种于4L 的LB液体培养基中,添加100ug/ml氨苄青霉素,37℃,220rpm培养,当OD值达到0.6左右时,添加终浓度为0.5mM的IPTG,20℃,220rpm,诱导过夜,离心收集细胞菌体;
S2:融合蛋白的纯化,超声破碎菌体,将收集的细菌菌体用破碎Buffer(2M尿素,50mMTris,300mMNaCl,1mMDTT,溶菌酶,0.2%TritonX-100,pH=8.0)溶解,冰浴中超声破碎菌体,功率400W,20min(超声3S,暂停5S为一个循环);超声完毕,12000rpm,4℃,离心20min,上清做下一步纯化;镍琼脂糖亲和层析,取5mL NI-NTA,用10倍柱床体积的结合缓冲液清洗平衡柱子,流速5mL/min。将样品和平衡好的柱料4℃孵育1h;样品上柱,流速为2mL/min,收集穿透液;10倍柱床体积的结合缓冲液清洗柱子,流速10mL/min;洗杂(2M尿素,50mMTris,300mMNaCl,10/50mM咪唑,pH=8.0),流速5ml/min,收集洗脱液;洗脱(2M尿素,50mMTris,300mMNaCl,500mM咪唑,pH=8.0),流速2ml/min,收集洗脱液;
S3:分析纯化后融合蛋白,通过SDS-PAGE电泳和灰度分析,检测分析纯化后融合蛋白的纯度,用SK3071 非干扰型蛋白浓度测定试剂盒测定蛋白浓度,融合蛋白的表达及定位,通过S1和S2步骤小试样品进行SDS-PAGE分析,结果如图一;融合蛋白的纯化,SerD融合蛋白镍琼脂糖亲和层析纯化后,SDS-PAGE分析,结果如图二;融合蛋白Western-Blot分析,SerD纯化的融合蛋白经过Western-Blot分析,结果如图三;SerD融合蛋白EK酶切镍琼脂糖亲和层析SDS-PAGE分析,SerD融合蛋白EK酶切后镍琼脂糖亲和层析纯化SDS-PAGE分析,结果如图四;蛋白浓度测定,用SK3071 非干扰型蛋白浓度测定试剂盒测定蛋白浓度:0.8mg/ml,BSA浓度为2mg/ml,测定的蛋白体积为20ul,测定结果如图五。
综上所述:本发明使用了一种融合蛋白表达纯化的方法,采用SDS-PAGE检测,将(500mM咪唑)含目标蛋白洗脱液透析到1M尿素,50mMTris,300mMNaCl,pH8.0缓冲液中,4℃透析过夜,将透析过夜的样品加入EK酶(EK酶的量是1:1000(EK酶量:蛋白量)),4℃酶切过夜,酶切后的蛋白过镍琼脂糖亲和层析,去除标签和EK酶,通过SDS-PAGE电泳和灰度分析,检测分析纯化后融合蛋白的纯度,用SK3071 非干扰型蛋白浓度测定试剂盒测定蛋白浓度,使其相比较非融合型表达载体具有表达量高、外源蛋白分离纯化简单、回收率高、分离纯化工艺简便和成本低的优点。
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!