生物反应器中重组vonWillebrand因子的改进生产的制作方法
本申请要求于2014年6月13日递交的欧洲专利申请号EP14172338.7的优先权,其全部内容通过引用并入本文。
序列表
本申请与电子形式的序列表一起递交。序列表的全部内容通过引用并入本文。
发明领域
本发明涉及通过在发酵期间分离不同种类的vWF多聚体来在生物反应器中改进von Willebrand因子(vWF)的重组生产的方法。
背景
生物技术有望生产低成本的生物制药产品,包括重组蛋白。许多治疗性蛋白质诸如凝血因子具有治疗潜力,如果它们可以以保留其生物活性的方式重组产生,并产生足够的产量以商业上可行。例如,重组产生的凝血因子诸如von Willebrand因子(vWF)具有广泛治疗各种出血性疾病的潜力。然而,部分地由于天然存在的生物分子的固有复杂性以及与其在基因工程化细胞中的重组蛋白质对应物的合成相关的限制的多样性,这种潜力未得到充分满足。因此,本领域强烈需要改进生产重组的、高生物活性的治疗性蛋白质诸如vWF的方法。
重组治疗性蛋白质通常在真核细胞中表达,所述真核细胞在不同大小的生物反应器中培养。操作这样的生物反应器的几种模式在本领域中是已知的,如补料分批方法和灌注方法。在这样的发酵方法中,期望维持高细胞活力和细胞密度,以便获得便于后续纯化的浓缩形式的所需重组蛋白。
WO 2008/006494公开了一种灌注方法,其中通过将培养基组分供给到在生物反应器里的细胞培养物中,实现将所需治疗性蛋白质在细胞培养上清液中累积达到高浓度,并且包含细胞、治疗性蛋白质和细胞培养基的细胞培养物在分离系统上循环,其中分离系统将治疗性蛋白质与分子量低于治疗性蛋白质的物质(如代谢物)分离。在WO 2008/006494中待与目标治疗性蛋白质分离的物质的截留分子量(MWCO)为5,000Da至500,000Da,优选至多100,000Da。
EP2171034公开了在连续发酵方法中生产生物聚合物的方法,其中使用杂质过滤器,其允许从生物反应器中将分子量低于目标生物聚合物的分子量的杂质从目标生物聚合物去除。该专利还公开了连续发酵方法,其中将装备有杂质过滤器的过滤器单元的组合与装备有产品过滤器的过滤器单元组合,它们将使目标生物聚合物通过以收获目标生物多肽。描述了孔径高达80,000Da的杂质过滤器,其中优选范围为2,000Da至15,000Da。作为目标生物聚合物,仅描述了具有给定分子量的多肽。所公开的最大目标生物聚合物是具有分子量约280,000Da的因子VIII。
附图简述
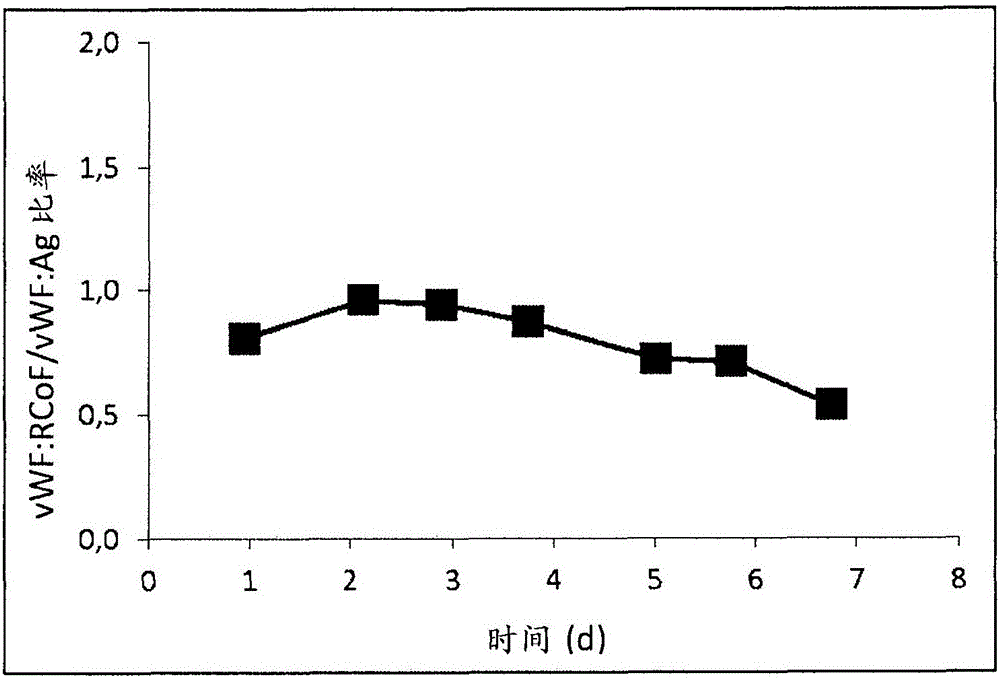
图1显示在分批方法过程中生物反应器里vWF利托菌素辅因子活性与vWF抗原的比率(vWF:RCoF/vWF:Ag)。
图2显示在实施例2的方法过程中渗余物(生物反应器)中和渗透物中vWF利托菌素辅因子活性与vWF抗原的比率(vWF:RCoF/vWF:Ag)。
图3显示实施例2中第4天在渗余物(生物反应器)中HMW vWF的积累和在渗透物中HMW vWF的耗尽。条带1-5、6-10和≥11的相对于标准人血浆的累积像素强度如实施例2所述测定。
图4显示实施例3的方法过程中在渗余物(生物反应器)中和在渗透物中vWF利托菌素辅因子活性对vWF抗原的比率(vWF:RCoF/vWF:Ag)。
图5显示实施例3中第9天在渗余物中(生物反应器)中HMW vWF的累积和在渗透物中HMW vWF的耗尽。条带1-5、6-10和≥11的相对于标准人血浆的累积像素强度如实施例2所述测定。
图6显示实施例4的假设方法设置的示意图。
图7显示实施例5的假设方法设置的示意图。
图8显示在实施例6的第7天在渗余物(生物反应器)中HMW vWF的积累和在渗透物中HMW vWF的耗尽。条带1-5、6-10和≥11的相对于标准人血浆的累积像素强度如实施例2所述测定。
图9显示如实施例2中所述的在实施例6的方法过程中在渗余物(生物反应器)和在渗透物中vWF利托菌素辅因子活性与vWF抗原的比率(vWF:RCoF/vWF:Ag)。
发明概述
本发明涉及令人惊讶的发现:分离系统可以在发酵方法过程中用于生物反应器中以将某些多聚体形式的vWF与其它多聚体形式的vWF分离。具有不同分子量的此类不同多聚体形式的vWF确实具有不同的性质和/或不同的生物活性。在生产的上游发酵步骤步骤中已经发生的此种分离大大降低了下游加工中所需的纯化努力。
因此,本发明的实施方案包括用于产生重组von Willebrand因子(vWF)的方法。
本发明的一个实施方案是通过在生物反应器中在细胞培养基中培养宿主细胞来制备重组von Willebrand因子(vWF)的方法,其中宿主细胞产生分泌到细胞培养基中的重组vWF,并且其中在细胞培养基中的vWF包含不同大小的vWF多聚体,
其中将至少一种细胞培养基组分进料至所述细胞培养基中,并且其中将包含细胞、重组vWF和细胞培养基的细胞培养物泵送通过分离系统,并且其中所述分离系统将所述vWF多聚体分离成至少:
渗透物级分,与分离前的细胞培养上清液中的vWF多聚体相比,所述渗透物级分富含vWF的低分子量(LMW)多聚体而vWF的高分子量(HMW)多聚体减少,和
渗余物级分,与分离前的细胞培养上清液中的vWF多聚体相比,所述渗余物级分的vWF的低分子量(LMW)多聚体减少而富含vWF的高分子量(HMW)多聚体。
在本发明的一个实施方案中,vWF的两个级分确实具有不同的生物活性。
在本发明的另一个实施方案中,意欲进一步纯化的重组vWF的所需级分是渗透物。
在另一个实施方案中,渗透物中的重组VWF富含低分子量(LMW)vWF多聚体,而高分子量(HMW)vWF多聚体减少,其中LMW vWF多聚体对应于条带1至5,而HMW vWF多聚体对应于条带11和更高,所述条带是根据Ott等人的密度计vWF分析(Am J Clin Pathol 2010;133:322-330)。
在本发明的另一个实施方案中,渗透物中的LMW vWF多聚体的比率等于或低于0.9,或换句话说,在渗余物中vWF多聚体条带1至5的“相对于标准人血浆的累积像素强度”除以在渗透物中vWF多聚体条带1至5的“相对于标准人血浆的累积像素强度”的比率低于0.9,其中vWF多聚体条带1至5的“相对于标准人血浆的累积像素强度”是指当根据Ott等人(Am J Clin Pathol 2010;133:322-330)在密度计vWF分析中确定的条带1至5的量除以根据Ott等人(Am J Clin Pathol 2010;133:322-330)的密度计vWF分析中所确定的标准人血浆的条带1至5的量时所获得的数值。优选使用标准人血浆(SHP)(Siemens,标准人血浆,ORKL17)。
在本发明的另一个实施方案中,意欲被进一步纯化的重组vWF的所需级分是渗余物。
在本发明的另一个实施方案中,渗余物中的HMW vWF多聚体的比率等于或大于1.1,或换句话说,在渗余物中vWF多聚体条带11和更高的“相对于标准人血浆累积像素强度”除以渗透物中的vWF多聚体条带11和更高的“相对于标准人血浆的累积像素强度”的比率等于或大于1.1,其中vWF多聚体条带11和更高的“相对于标准人血浆的累积像素强度”是指当根据Ott等人(Am J Clin Pathol 2010;133:322-330)在密度计vWF分析中确定的条带11和更高的量除以根据Ott等人(Am J Clin Pathol 2010;133:322-330)的密度计vWF分析中所确定的标准人血浆的条带11和更高的量时所获得的数值。优选使用标准人血浆(SHP)(Siemens,标准人血浆,ORKL17)。
在某些实施方案中,分离系统的截留分子量大小为约0.05μm至1μm。
在本发明的其它实施方案中,分离系统的截留分子量大小为约550,000至1,000,000Da。
在本发明的另一个实施方案中,分离系统的截留分子量大小为约750,000Da。
在本发明的另一个实施方案中,发生第二次分离,其中在任何上述方法中获得的渗余物进行第二次分离,其中超大vWF多聚体在所述渗余物中富集,提供第二渗透物,所述第二渗透物中总vWF多聚体量中超大vWF多聚体的比例与在所述第二次分离之前所述渗余物中总vWF多聚体量中超大vWF多聚体的比例相比降低。
在一个实施方案中,第二次分离与第一次分离平行进行,而在另一个实施方案中,第二次分离在第一次分离之后进行。
发明详述
定义
除非另有定义,否则本文使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常理解的相同的含义。但是描述了与优选的方法和材料相似或等同的任何方法和材料。为了本发明的目的,以下术语定义如下。
冠词“a”和“an”在本文中用于指该冠词的一个或多于一个(即至少一个)语法对象。作为示例,“一个元件”是指一个元件或多于一个元件。
“约”是指对于参考的数量、水平、值、数字、频率、百分数、尺寸、大小、量、重量、长度或本文所述的其它单位变化多达30%、25%、20%、15%、10%、9%、8%、7%、6%、5%、4%、3%、2%或1%的数量、水平、值、数量、频率、百分数、尺寸、大小、量、重量或长度。
在本发明整个说明书中,除非上下文另有要求,否则词语“包括(comprise、comprises和comprsing)”将被理解为暗示包括所述步骤或元件或者步骤或元件的组,但不排除任何其它步骤或元件或者步骤或元件的组。
“由...组成”表示包括并且限于短语“由...组成”之后的任何内容。因此,短语“由...组成”表示所列元素是必需的或强制性的,并且不可以存在其它元素。“基本上由...组成”意指包括在短语之后列出的任何元件,并且限于不干扰或有助于本公开中针对所列元件指定的活动或动作的其他元件。因此,短语“基本上由...组成”表示所列元素是必需的或强制性的,但是其它元素是任选的,并且可以存在或不存在,这取决于它们是否实质影响所列元件的活性或作用。
“生物活性”是指vWF的可测量的功能,该功能在vWF施用于人时也在体内发挥。如本文所用,术语“功能(function和functional等)”是指vWF的生物学、酶学或治疗功能。vWF的生物活性可以例如由本领域技术人员使用测定利托菌素辅因子活性(vWF:RCoF)的方法(Federici AB等人2004.Haematologica 89:77-85),vWF与血小板糖蛋白复合物Ib-V-IX的GP Ib的结合(Sucker等人2006.Clin Appl Thromb Hemost.12:305-310),胶原结合测定(Kallas&Talpsep.2001.Analals of Hematology 80:466-471)或FVIII结合测定来测定。FVIII结合可以例如通过Biacore分析来测定。
“生物反应器”是指提供和支持用于细胞培养的生物活性环境的任何生产或工程化的装置或系统,其允许细胞生长并产生目标产物。生物反应器一般测量并调节生成这种生物活性环境所需的物理和化学参数。生物反应器可以以不同的模式操作,如分批、补料分批或连续。以连续模式操作的生物反应器另外装备有培养基入口和用于将上清液与细胞分离的装置。通常生物反应器是圆柱形或立方体,大小范围从毫升到立方米,并且通常由不锈钢或塑料制成。
术语“宿主细胞”包括可以是或已经是引入的重组载体、分离的多核苷酸或多肽的受体的个体细胞或细胞培养物。宿主细胞包括单个宿主细胞的后代,并且由于天然、偶然或故意的突变和/或改变,后代可能不必与原始亲本细胞完全相同(在形态学或在总DNA互补中)。宿主细胞包括在体内或体外用重组载体或多核苷酸转染或感染的细胞。包含重组载体的宿主细胞是重组宿主细胞。具体宿主细胞在下面定义。
根据本发明的“分离系统”是指可以用于在发酵方法过程中将宿主细胞保持在生物反应器内的装置,其中借助于分离系统将至少部分细胞培养物上清液与宿主细胞分离,所述分离系统包含具有一定的截留分子量的过滤器。高于一定的分子量的宿主细胞和vWF多聚体被具有一定的截留分子量的所述过滤器保留。小分子、营养物和代谢物以及低于一定的截留分子量的vWF多聚体可以通过具有一定的截留分子量的所述过滤器。可以使用多个细胞保持装置实现培养容器内的细胞保留。不同的分离原理可用于该方法。这些方法可以基于重力沉降、声学沉降、离心沉降或过滤。以下设备组均可用于该方法:内部或外部过滤器如内部或外部旋转过滤器(例如来自Sartorius的Spinfilter P)、外部错流过滤器、外部或内部中空纤维筒式过滤器(例如来自Refine的交变切向流(ATF))。具有一定的截留分子量(MWCO)的过滤器的孔径优选在0.05μm和1.0μm之间。MWCO优选等于或大于500,000Da,或等于或大于550,000Da,或等于或大于600,000Da,或等于或大于650,000Da,或等于或大于700,000Da,或大约750,000Da,或等于或小于1,000,000Da,或等于或小于950,000Da,或等于或小于900,000Da,或等于或小于850,000Da,或等于或小于800,000Da。应当理解,上述较低截留分子量值可以与上述较高截留分子量值组合,以限定具有一定的截留分子量的优选部分的范围,例如在等于或大于500,000Da至1,000,000Da之间或在550,000Da至1,000,000Da之间的范围等等。
已经通过分离装置的细胞培养物的部分称为“渗透物(permeate)”,而由分离装置保留的细胞培养物的部分称为“渗余物(retentate)”。
在分离系统中使用的500,000的MWCO是指小于500,000Da的蛋白质通过分离系统并富集于渗透物中,而大于500,000Da的蛋白质被过滤器保留并因此富集于渗余物中。
该分离系统可用于富集确实具有不同生物活性的具有不同分子大小的vWF多聚体的某些级分。
“实质上(substantially)”或“基本上(essentially)”是指几乎完全或完全是某一给定量,例如,95%、96%、97%、98%、99%或更大。
本文所用的术语“von Willebrand因子”或“vWF”是指具有野生型vWF的生物学活性或vWF的至少部分生物学活性的任何多肽。编码野生型vWF的基因被转录成9kb的mRNA,其被翻译成具有估计分子量为310,000Da的2813个氨基酸的前多肽原。前多肽原由2813个氨基酸组成,并含有22个氨基酸的信号肽、741个氨基酸的多肽原和成熟亚单位。从N末端切割741个氨基酸的多肽原得到由2050个氨基酸组成的成熟vWF。野生型前原vWF的cDNA序列显示在SEQ ID NO:1中。野生型前原vWF的氨基酸序列显示在SEQ ID NO:2中。除非另有说明,分子本文使用的术语“vWF”是指vWF的成熟形式。
野生型vWF的多肽原包含以下列顺序排列的多个结构域:
D1-D2-D'-D3-A1-A2-A3-D4-B1-B2-B3-C1-C2-CK
D1和D2结构域代表肽原,其被切割以产生成熟vWF。羧基末端90个残基包含与蛋白质的“胱氨酸结”超家族同源的“CK”结构域。这些家族成员具有通过二硫键二聚化的倾向。
优选地,野生型vWF包含如SEQ ID NO:2所示的野生型vWF的氨基酸序列。还包括vWF的添加、插入、N末端、C末端或内部缺失,只要保留vWF的至少部分生物学活性即可。野生型vWF的生物活性可以由本领域技术人员使用以下方法来测定:针对利托菌素辅因子活性的方法(Federici AB等人2004.Haematologica 89:77-85)、vWF与血小板糖蛋白复合物Ib-V-IX的GP Ibα的结合(Sucker等人2006.Clin Appl Thromb Hemost.12:305-310)、胶原蛋白结合测定法(Kallas&Talpsep.2001.Anals of Hematology 80:466-471)或FVIII结合测定法。
某些实施方案可以包括如例如WO 2010/048275中所述的重组生产野生型的vWF或其变体,例如,其中已经引入一个或多个氨基酸缺失、添加和/或取代以增加或降低所述蛋白质的至少一种生物活性。
因此,某些实施方案可以使用这些vWF相关序列中的任何一个或多个,包括其组合及其变体。还包括来自其它生物体(诸如本文所述和本领域已知的其它哺乳动物)的vWF相关序列。
在某些实施方案中,术语“vWF”包括vWF的“融合蛋白”,优选vWF蛋白和“异源”融合伴侣的“融合蛋白”。还包括融合蛋白或修饰的蛋白,其包含vWF蛋白的至少一个最小片段或部分和异源融合伴侣或异源序列。
如本文所用,“融合蛋白”包括与另一种(例如,不同的)vWF蛋白(例如以产生多个片段)、vWF蛋白或两者连接的vWF蛋白或其片段。“非vWF蛋白”是指具有对应于不同于vWF蛋白的蛋白质的氨基酸序列的“异源多肽”,并且所述蛋白质可以衍生自相同或不同的生物体。融合蛋白的vWF蛋白可以对应于生物活性vWF蛋白氨基酸序列的全部或一部分。在某些实施方案中,vWF融合蛋白包括vWF蛋白的至少一个(或两个、三个等)生物活性部分。
更一般地,可以利用与异源序列(诸如白蛋白或免疫球蛋白或衍生自无抗原结合结构域的免疫球蛋白的片段(如Fc片段))的融合来去除不想要的特征或改善vWF的所需的特征(例如,药代动力学性质)。例如,与异源序列的融合可以增加化学稳定性,降低免疫原性,改善体内靶向,和/或增加vWF蛋白的循环半率期。
本文所用的“白蛋白”包括白蛋白蛋白质家族的多肽,诸如人血清白蛋白和牛血清白蛋白,包括其变体和衍生物,诸如基因工程化或化学修饰的白蛋白变体和白蛋白片段。融合蛋白的白蛋白部分可以衍生自任何脊椎动物,特别是任何哺乳动物,例如人、牛、羊或猪。非哺乳动物白蛋白包括但不限于鸡和鲑鱼。白蛋白连接的多肽的白蛋白部分可来自与融合蛋白的vWF蛋白部分不同的动物。
包括在本文使用的术语“白蛋白”内的白蛋白蛋白质家族包括进化上相关的血清转运蛋白,例如白蛋白、甲胎蛋白(AFP;Beattie&Dugaiczyk,Gene.20:415-422,1982)、afamin(AFM;Lichenstein等人,J.Biol.Chem.269:18149-18154,1994)和维生素D结合蛋白(DBP;Cooke&David,J.Clin.Invest.76:2420-2424,1985)。甲胎蛋白已被要求保护以增强附接的治疗性多肽的半率期(参见WO 2005/024044)。它们的基因代表多基因簇,其具有映射到人、小鼠和大鼠中相同染色体区域的结构和功能相似性。因此,本发明的一些实施方案可以使用如本文定义的此类白蛋白家族成员或其片段和变体作为融合蛋白的一部分。本发明的治疗性融合蛋白的白蛋白家族成员还可以包括AFP、AFM和DBP的天然存在的多态性变体。
VWF蛋白或其片段或变体可以与人血清白蛋白多肽或其片段或变体融合(参见例如WO 2009/156137)。人血清白蛋白(HSA或HA)是成熟形式具有585个氨基酸的蛋白质,并且负责血清显著比例的渗透压,并且还用作内源和外源配体的载体。在其它益处中,与HSA或其片段或变体的融合可以增加本文所述的vWF蛋白的保存期限、血清半率期和/或治疗活性。
优选地,融合蛋白包含作为C末端部分的白蛋白,以及作为N末端部分的vWF蛋白。在其他实施方案中,融合蛋白具有与白蛋白的N末端和C末端两者融合的vWF蛋白。
肽接头序列可用于将融合蛋白的组分分隔开。例如,肽接头可以通过这样的距离将组分分隔开,所述距离足以确保每个多肽折叠成其二级和三级结构。可以使用本文描述的和本领域公知的标准技术将此类肽接头序列并入融合蛋白中。合适的肽接头序列可以基于以下因素进行选择:(1)它们采取柔性延伸构象的能力;(2)它们不能采用可与第一和第二多肽上的功能表位相互作用的二级结构的能力;和(3)缺少可能与多肽功能表位反应的疏水性或带电荷残基。可有效地用作接头的氨基酸序列包括在Maratea等人,Gene 40:39-46,1985;Murphy等人,Natl.Acad.Sci.USA 83:8258-8262,1986;美国专利号4,935,233和美国专利号4,751,180。
一个或多个非肽或肽接头是任选的。例如,在第一和第二多肽具有可用于将功能结构域分隔开并防止空间干扰的非必需的N末端和/或C末端氨基酸区域的情况下,在融合蛋白中可能不需要接头序列。
如本文所述,本发明的某些实施方案还考虑使用经修饰的vWF蛋白,包括改进蛋白所需特征的修饰。vWF蛋白的修饰包括在一个或多个组成氨基酸处的化学和/或酶衍生化,包括侧链修饰、主链修饰以及N末端修饰和C末端修饰,包括乙酰化、羟化、甲基化、酰胺化和碳水化合物或脂质部分、辅因子的附接等等。示例性修饰还包括vWF蛋白的PEG化(参见,例如,Veronese和Harris,Advanced Drug Delivery Reviews 54:453-456,2002,通过引用并入本文)。与生物学上可接受的聚合物化学缀合的VWF变体描述于例如WO 2006/071801中。
本发明也可以与vWF蛋白的“变体”一起使用。术语蛋白质“变体”包括与SEQ ID NO:2的差别在于至少一个氨基酸残基的添加、缺失和/或取代并且通常保留参考蛋白质的一种或多种活性的蛋白质。鉴定适合取代的氨基酸并设计相对于参考序列具有基本上未改变、改善或降低的活性的变体在本领域技术人员的技能范围内。
如本文所述和本领域已知的,蛋白质变体可以通过一个或多个取代区别于参考序列,所述取代可以是保守的或非保守的。在某些实施方案中,蛋白质变体包含保守取代,并且在这方面,本领域熟知的是,一些氨基酸可以改变为具有广泛相似性质的其他氨基酸而不改变蛋白质活性的性质。
如本文所用的术语“序列同一性”或例如包含“50%相同的序列”是指序列基于逐个核苷酸或逐个氨基酸在比较窗口上相同的程度。因此,可以通过在比较窗口上比较两个最佳对齐的序列计算“序列同一性的百分比”,确定相同核酸碱基(例如A、T、C、G、I)或相同氨基酸残基(例如Ala、Pro、Ser、Thr、Gly、Val、Leu、Ile、Phe、Tyr、Trp、Lys、Arg、His、Asp、Glu、Asn、Gln、Cys和Met)在两个序列中都存在的位置的数目以得到匹配位置的数目,将匹配位置的数目除以比较窗口中的位置的总数(即窗口大小),并将结果乘以100以得到序列同一性的百分比。
用于描述两个或更多个多肽之间的序列关系的术语包括“参考序列”、“比较窗口”、“序列同一性”、“序列同一性百分比”和“实质同一性”。“参考序列”是至少长12个但通常15至18个以及常常至少25个单体单位,包括核苷酸和氨基酸残基。因为两个多肽可以各自包含(1)两个多肽之间相似的序列(即仅完整多肽序列的一部分),和(2)两个多肽之间不同的序列,两个(或更多)多肽之间的序列比较通常通过在“比较窗口”上比较两个多肽的序列进行,以鉴定和比较序列相似性的局部区域。“比较窗口”是指至少6个连续位置,通常约50至约100个,更通常约100至约150个概念区段,其中在两个序列被优化对齐后将序列与在相同数目的连续位置的参考序列进行比较。针对两个序列的优化比对,与参考序列(其不包含添加或缺失)相比,比较窗口可以包含为约20%或更少的添加或缺失(即缺口)。可以通过计算机化实施的算法(Wisconsin Genetics Software Package Release 7.0,Genetics Computer Group,575Science Drive Madison,WI,USA中的GAP、BESTFIT、FASTA和TFASTA)或通过检查和通过所选择的各种方法中的任一种产生的最佳比对(即,导致在比较窗口上的最高百分比同源性)进行用于对齐比较窗口的序列的优化对齐。
如上所述,与参考残基相比,生物活性变体蛋白质可以在沿其序列的不同位置含有保守氨基酸取代。“保守氨基酸取代”包括其中氨基酸残基被具有相似侧链的氨基酸残基替换的氨基酸取代。具有相似侧链的氨基酸残基家族在本领域中已经定义,其通常可以亚分类如下:
酸性的:由于在生理pH下失去H离子,残基具有负电荷,并且残基被水溶液吸引,使得当肽在生理pH的水性介质中时,残基寻找包含其的肽的构象中的表面位置。具有酸性侧链的氨基酸包括谷氨酸和天冬氨酸。
碱性的:由于在生理pH或其一个或两个pH单位内与H离子缔合,残基具有正电荷(例如,组氨酸),并且残基被水溶液吸引,使得当肽在生理pH的水性介质中时,残基寻找包含其的肽的构象中的表面位置。具有碱性侧链的氨基酸包括精氨酸、赖氨酸和组氨酸。
带电荷的:残基在生理pH下带电荷,因此包括具有酸性或碱性侧链的氨基酸(即谷氨酸、天冬氨酸、精氨酸、赖氨酸和组氨酸)。
疏水的:残基在生理pH下不带电荷,并且残基被水溶液排斥,使得当肽在水性介质中时,残基寻找包含其的肽的构象中的内部位置。具有疏水侧链的氨基酸包括酪氨酸、缬氨酸、异亮氨酸、亮氨酸、甲硫氨酸、苯丙氨酸和色氨酸。
中性/极性:残基在生理pH下不带电荷,但是残基不被水溶液充分排斥,使得当肽在水性介质中时,残基将寻找包含其的肽的构象中的内部位置。具有中性/极性侧链的氨基酸包括天冬酰胺,谷氨酰胺,半胱氨酸,组氨酸,丝氨酸和苏氨酸。
该描述还将某些氨基酸表征为“小的”,因为它们的侧链不足够大(即使缺少极性基团)以赋予疏水性。除了脯氨酸,“小的”氨基酸是当侧链上至少一个极性基团存在时具有4个或更少的碳的氨基酸,而当不存在极性基团时具有3个或更少的碳的氨基酸。具有小的侧链的氨基酸包括甘氨酸、丝氨酸、丙氨酸和苏氨酸。基因编码的二级氨基酸脯氨酸是一种特殊情况,因为其对肽链的二级构象具有已知的作用。脯氨酸的结构不同于所有其它天然存在的氨基酸,其侧链与α-氨基的氮以及α-碳键合。出于本发明的目的,脯氨酸被分类为“小的”氨基酸。
分类为极性或非极性所需的吸引或排斥程度是任意的,因此本发明特别考虑的氨基酸已被分类为一种或另一种。大多数未特别命名的氨基酸可以基于已知的行为进行分类。
氨基酸残基可以进一步亚类分类为环状的或非环状的,以及芳族的或非芳族的、就残基的侧链取代基自我解释分类,以及分类为小的或大的。如果残基含有总共四个或更少的碳原子(包括羧基碳),则认为残基是小的,条件是存在额外的极性取代基;如果不存在额外的极性取代基则含有三个或更少。小的残基当然总是非芳族的。取决于它们的结构特性,氨基酸残基可以分为两类或更多类。对于天然存在的蛋白质氨基酸,根据该方案的亚分类示于下表1中。
表1:氨基酸亚分类
保守氨基酸取代还包括基于侧链的分组。例如,具有脂肪族侧链的一组氨基酸是甘氨酸、丙氨酸、缬氨酸、亮氨酸和异亮氨酸;具有脂肪族-羟基侧链的一组氨基酸是丝氨酸和苏氨酸;具有含酰胺侧链的一组氨基酸是天冬酰胺和谷氨酰胺;具有芳香族侧链的一组氨基酸是苯丙氨酸、酪氨酸和色氨酸;具有碱性侧链的一组氨基酸是赖氨酸、精氨酸和组氨酸;具有含硫侧链的一组氨基酸是半胱氨酸和甲硫氨酸。例如,合理地预期用异亮氨酸或缬氨酸替换亮氨酸,用谷氨酸替换天冬氨酸,用丝氨酸替换苏氨酸,或用结构相关的氨基酸替换氨基酸的类似替换将不会对所得变体多肽的性质具有主要的影响。如本文所述,氨基酸变化是否得到生物活性蛋白质可以容易地通过测定其生色和/或凝血活性来测定。
术语“低分子量vWF多聚体”或“LMW vWF多聚体”或“LMW vWF”被同义地使用,并且意味着在根据Ott等人(Am J Clin Pathol 2010;133:322-330)的密度计vWF分析中对应于条带1至5。
术语“高分子量vWF多聚体”或“HMW vWF多聚体”或“HMW vWF”被同义地使用,并且意味着在根据Ott等人(Am J Clin Pathol 2010;133:322-330)的密度计vWF分析中对应于条带11或更高,其中“更高”是指条带11和所有更大的vWF多聚体。
“超大分子量vWF多聚体”或“ULMW vWF多聚体”被同义地使用,并且意味着在根据Ott等人(Am J Clin Pathol 2010;133:322-330)的密度计vWF分析中对应于条带20和更高,其中“更高”是指条带20和所有更大的vWF多聚体。
术语“HMW多聚体比率”是指渗余物中vWF多聚体条带11和更高的“相对于标准人血浆的累积像素强度”除以渗透物中vWF多聚体条带11和更高的“相对于标准人血浆的累积像素强度”的比率。
术语vWF多聚体带11和更高的“相对于标准人血浆的累积像素强度”是指当根据Ott等人(Am J Clin Pathol 2010;133:322-330)的密度计vWF分析中测定的条带11和更高的量除以根据Ott等人(Am J Clin Pathol 2010;133:322-330)的密度计vWF分析中测定的标准人血浆的条带11和更高的量时获得的数值。优选使用标准人血浆(SHP)(Siemens,标准人血浆,ORKL17)。
术语“LMW多聚体比率”是指渗余物中vWF多聚体条带1至5的“相对于标准人血浆的累积像素强度”除以渗透物中vWF多聚体条带1至5的“相对于标准人血浆的累积像素强度”的比率。
术语vWF多聚体条带1至5的“相对于标准人血浆的累积像素强度”是指当根据Ott等人(Am J Clin Pathol 2010;133:322-330)的密度计vWF分析中测定的条带1至5的量除以根据Ott等人(Am J Clin Pathol 2010;133:322-330)的密度计vWF分析中测定的标准人血浆的条带1至5的量时获得的数值。优选使用标准人血浆(SHP)(Siemens,标准人血浆,ORKL17)。
渗透物中LMW vWF多聚体比率在分离前的细胞培养基的LMW vWF多聚体比率“之下”通常是“统计学上显著”降低的比率,并且可以包括在分离前细胞培养基的LMW vWF多聚体比率之下减少了1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9、3.0、3.2、3.4、3.6、3.8、4.0、4.2、4.3、4.4、4.6、4.8、5、6、7、8、9、10或更多倍(包括所有整数和小数点以及介于其间的范围以及大于1,例如5.5、5.6、5.7、5.8等)。
渗透物中HMW vWF多聚体比率在分离前的细胞培养基的HMW vWF多聚体比率“之上”通常是“统计学上显著”增加的比率,并且可以包括在分离前细胞培养基的HMW vWF多聚体比率之上增加了1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9、3.0、3.2、3.4、3.6、3.8、4.0、4.2、4.3、4.4、4.6、4.8、5、6、7、8、9、10或更多倍(包括所有整数和小数点以及介于其间的范围以及大于1,例如5.5、5.6、5.7、5.8等)。
本发明的蛋白质的表达和纯化
本发明的实施方案包括用于表达、收集和任选纯化本文所述的vWF级分的方法和相关组合物。
例如,某些实施方案包括用于产生vWF或其变体的方法,包括在细胞培养基中培养细胞,任选哺乳动物细胞,其中所述细胞包含至少一个导入的编码vWF的多核苷酸,其中所述多核苷酸可操作地连接到至少一种调节元件并表达蛋白质;和从细胞或细胞培养基收集蛋白质。
重组vWF或其变体可以使用标准操作方案方便地制备。作为一个一般实例,可以通过包括一个或多个下列步骤的程序制备重组vWF:(a)制备包含编码蛋白质并且可操作地连接至少一种调节元件的多核苷酸序列的构建体;(b)将所述构建体引入宿主细胞;(c)培养宿主细胞以表达多肽,和(d)从宿主细胞收集或分离多肽。
为了表达vWF,可以将编码多肽的核苷酸序列或功能等同物插入合适的表达载体,即含有用于插入编码序列的转录和翻译的必需元件的载体。本领域技术人员公知的方法可用于构建含有编码vWF和合适的转录和翻译控制元件的序列的表达载体。这些方法包括体外重组DNA技术、合成技术和体内遗传重组,并且是本领域已知的。
存在于表达载体中的“调节元件”或“调节序列”包括载体的那些非翻译区,例如增强子、启动子、5'和3'非翻译区、核糖体结合位点、RNA剪接位点(如果存在含有内含子的基因组DNA)、聚腺苷酸化位点、转录终止序列,其与宿主细胞蛋白质相互作用以进行转录和翻译。此类元件的强度和特异性可以不同。
根据所使用的载体系统和宿主,可以使用任何数量的合适的转录和翻译元件,包括组成型和诱导型启动子。例如,在哺乳动物细胞系统中,来自哺乳动物基因或来自哺乳动物病毒的启动子通常是优选的。
也可以使用特异性起始信号来实现编码目标多肽的序列的更有效的翻译。这样的信号包括ATG起始密码子和相邻序列。
在将编码vWF、其起始密码子和上游序列的序列插入到合适的表达载体中的情况下,可能不需要额外的转录或翻译控制信号。然而,在仅插入编码序列或其一部分的情况下,应提供包括ATG起始密码子的外源翻译控制信号。此外,起始密码子应当在正确的阅读框中以确保整个插入物的翻译。外源翻译元件和起始密码子可以是多种来源的,天然的和合成的。表达的效率可以通过包含适合于所使用的特定细胞系统的增强子来增强,诸如在文献中所描述的那些。
在哺乳动物宿主细胞中,通常可获得许多基于病毒的表达系统。例如,在使用腺病毒作为表达载体的情况下,编码目标多肽的序列可以连接到由晚期启动子和三联前导序列组成的腺病毒转录/翻译复合物中。插入病毒基因组的非必需E1或E3区域可用于获得能在感染的宿主细胞中表达多肽的活病毒。此外,转录增强子(诸如劳氏肉瘤病毒(RSV)增强子或CMV启动子/增强子)可用于增加哺乳动物宿主细胞中的表达。
合适的宿主细胞是高等真核细胞,诸如哺乳动物细胞。有用的哺乳动物宿主细胞系的实例包括由SV40转化的猴肾CV1系(COS-7,ATCC CRL 1651);人胚肾细胞系(例如,HEK293细胞,亚克隆用于在悬浮培养中生长的293细胞;幼仓鼠肾细胞(BHK,ATCC CCL 10));小鼠sertoli细胞;猴肾细胞(CV1,ATCC CCL 70);非洲绿猴肾细胞(VERO细胞,VERO-76,ATCC CRL-1587);COS细胞,人宫颈癌细胞(Hela细胞,ATCC CCL 2);犬肾细胞(MDCK,ATCC CCL 34);大鼠肝细胞(BRL 3A,ATCC CRL 1442);人肺细胞(W138,ATCC CCL 75);人肝细胞(HepG2,HB8065);小鼠乳腺肿瘤细胞(MMT 060562,ATCC CCL51);TR1细胞;MRC 5细胞;FS4细胞和人肝癌细胞系(Hep G2)。其它有用的哺乳动物宿主细胞系包括中国仓鼠卵巢细胞(CHO细胞,包括DHFR-CHO细胞)和骨髓瘤细胞系如NSO和Sp2/0。
其它合适的细胞系包括但不限于大鼠Hep I(大鼠肝癌;ATCC CRL 1600),大鼠Hep II(大鼠肝癌;ATCC CRL 1548),TCMK(ATCC CCL 139),人肺(ATCC HB 8065),NCTC 1469(ATCC CCL 9.1);DUKX细胞(CHO细胞系)和DG44(CHO细胞系)。也有用的是3T3细胞、Namalwa细胞、骨髓瘤和骨髓瘤与其他细胞的融合物。
某些优选的哺乳动物细胞表达系统包括基于CHO和HEK293细胞的表达系统。CHO细胞的具体实例包括CHO-K1和CHO-S细胞。还包括可在无血清培养基上生长的宿主细胞,诸如某些HEK293细胞和CHO细胞。
在一些实施方案中,宿主细胞能够在悬浮培养中生长。如本文所用,悬浮-感受态细胞是可以在悬浮液中生长而不产生大的、坚固的聚集体的细胞,即单分散或以松散聚集体生长的细胞,每聚集体仅有少量细胞。悬浮-感受态细胞包括但不限于在悬浮液中生长而没有适应化或操作的细胞(例如,造血细胞、淋巴样细胞)和已通过从依赖贴壁细胞至悬浮生长的逐渐适应而变成悬浮感受态的细胞(例如上皮细胞、成纤维细胞)。
在一些实施方案中,宿主细胞可以包括相对于它们源自的细胞类型突变或重组细胞,包括表达定性或定量不同蛋白质谱的细胞,其催化蛋白质的翻译后修饰(例如糖基化酶诸如糖基转移酶和/或糖苷酶,加工酶诸如肽原,包括促进功能性vWF形成的酶)。
作为一个实例,宿主细胞包含编码至少一种“加工因子”蛋白的引入的多核苷酸,其中所述多核苷酸可操作地连接至至少一种调节元件并表达加工因子蛋白。术语“加工因子”包括促进功能性蛋白质形成的任何蛋白质、肽、非肽辅因子、底物或核酸。加工因子的实例包括但不限于成对碱性氨基酸转化酶(PACE)、维生素K依赖性环氧化物还原酶(VKOR)、维生素K依赖性γ-谷氨酰基羧化酶(VKGC)或其组合。具体的实施方案利用针对PACE、VKOR和/或VKGC的人序列。
最初从人肝细胞系分离的PACE是枯草杆菌蛋白酶样内肽酶,即对蛋白质的碱性残基(例如,-Lys-Arg-,-Arg-Arg-或-Lys-Lys-)处的切割具有特异性的肽原切割酶。PACE和需要加工以产生成熟蛋白的蛋白质原的共表达导致成熟蛋白的高水平表达。
对于vWF的长期、高产量生产,通常优选稳定表达。例如,稳定表达vWF的细胞系可以使用可以在相同或单独的载体上含有病毒复制起点和/或内源表达元件和选择性标记基因的表达载体进行转化。在引入载体后,可以使细胞在非选择性培养基中生长约1-2天,然后将它们转换到选择性培养基。选择性标记的目的是赋予对选择的抗性,并且它的存在允许成功表达引入的序列的细胞的生长和回收。
可以使用适合于细胞类型的组织培养技术使稳定转化的细胞的抗性克隆增殖。任何数目的选择性标记或系统可用于回收或鉴定转化或转导的细胞系,无论是瞬时的还是稳定的。这些包括但不限于分别可用于tk-或aprt-细胞中的单纯疱疹病毒胸苷激酶和腺嘌呤磷酸核糖基转移酶基因。此外,抗代谢物、抗生素或除草剂抗性可用作选择的基础;例如,二氢叶酸还原酶(DHFR)赋予对氨甲蝶呤的抗性;npt赋予对氨基糖苷类、新霉素和G-418的抗性;als或pat分别赋予对氯磺隆和膦丝菌素乙酰转移酶的抗性。已经描述了另外的可选择基因,例如,trpB,其允许细胞利用吲哚代替色氨酸,或hisD,其允许细胞利用组氨醇代替组氨酸。
用编码vWF的多核苷酸序列转化的宿主细胞可在适合于从细胞培养物表达和回收vWF的条件下培养。可以使用任何化学成分确定的细胞培养基。具体实例包括无血清培养基、无蛋白质培养基、化学成分确定的培养基和缺乏动物来源组分的培养基。
示例性细胞培养基包括但不限于基础培养基Eagle(BME);CMRL-1066培养基;Dulbecco’s改良的Eagle培养基(DMEM);格拉斯哥最低必需培养基,GMEM;H-Y培养基(Hybri-);培养基199;最低必需培养基Eagle(EMEM);NCTC培养基;Swim’s S-77培养基;和Williams培养基E.Click’s培养基;MCDB培养基131和Iscove’s改良的Dulbecco’s培养基(IMDM)。还包括DMEM/Ham's营养混合物F-12(50:50),其经常用作用于开发专有和特殊培养基以培养用于生物制造的CHO细胞的基础培养基,以及为CHO细胞开发的MCDB培养基302。
在具体实施方案中,所述培养基是补充有一种或多种以下成分的基于无血清DMEM/HAM’s F12的制剂:(a)谷氨酰胺;例如,最终浓度约0.9g/l,(b)硫酸铁x7H2O,例如在约0.0006g/l,(c)腐胺,x 2HCl,例如在约0.0036g/l,(d)维生素K1,例如在约0.0025g/l,(e)Synperonic;例如,在最终浓度约1g/l,(f)酚红,例如在约0.008g/l,(g)乙醇胺,例如在约0.00153g/l,和/或(h)碳酸氢钠,例如在约2g/l。
在具体实施方案中,细胞培养基是CD-CHO培养基或CD-CHO AGTTM培养基或CD OptiCHOTM AGTTM培养基,其是可商购的或Pro-CHOTM或Power-CHOTM培养基CH-CHO、CD-CHO AGTTM和CD OptiCHOTM AGTTM培养基可以用作化学成分确定的培养基、无蛋白质培养基和/或无血清培养基,并且如果需要可以补充L-谷氨酰胺。无需钙补充的1X CD-CHO AGTTM培养基的Ca2+水平可以为约0.25-0.35mM的范围(通过原子吸收光谱法测定)。
如上所述,某些实施方案利用无血清细胞培养基。一个实例包括确定的无血清培养基,其能够生长宽范围的悬浮液和单层细胞,并且其包括由胎球蛋白、转铁蛋白、磷脂酰胆碱(例如1-油酰基-2-棕榈酰基-磷脂酰胆碱)、亚油酸和胆固醇组成的血清替代物。另一个实例包括含有固醇(例如胆固醇)的细胞培养基,其通过表面活性剂而不是血清产物或磷脂胶束稳定,并任选含有可溶性羧酸作为脂肪酸前体以满足脂质需求,和/或能够促进细胞的醇。
某些实施方案采用缺乏“动物来源的”组分的细胞培养基。如本文所用,“动物来源的”组分可以包括在完整动物中产生的任何组分(例如,从血清中分离和纯化的蛋白质)或通过使用在完整动物中产生的组分产生的组分(例如,通过使用从动物分离和纯化以水解植物来源材料的酶)。相反,具有动物蛋白质序列(即该蛋白质具有动物中基因组来源)、但是是在细胞培养物中体外产生(例如在重组酵母或细菌细胞中或在重组的或非重组的哺乳动物细胞系中)、在缺少在完整动物中产生和从其分离和纯化的组分的培养基中产生的蛋白质,不是“动物来源的”组分。例如,具有动物蛋白质序列(即具有动物中基因组来源)但在缺乏动物来源组分的培养基中在重组细胞中产生的蛋白质不是“动物来源的”组分。因此,缺乏动物来源的组分的细胞培养基是可含有重组产生的动物蛋白的细胞培养基;但是这样的培养基不含例如动物血清或蛋白质或从动物血清纯化的其它产物。这样的培养基可以例如含有一种或多种源自植物的组分。
可使用在本发明的条件下支持细胞生长和维持的任何细胞培养基。通常,培养基含有水、重量摩尔渗透压浓度调节剂、缓冲液、能量源、氨基酸、无机或重组铁源、一种或多种合成或重组生长因子、维生素和辅因子。缺少动物来源的组分和/或蛋白质的培养基可从商业供应商获得,诸如,例如,SAFC、或
例如,某些实施方案采用悬浮细胞培养技术。悬浮细胞培养技术的实例包括灌注方法、分批方法(例如,简单分批方法、补料分批方法)和取出-填充(draw-fill)方法。
在悬浮细胞灌注方法中,通常将细胞接种到含有细胞培养基的种子培养容器中,所述细胞培养基优选缺乏动物来源的组分,并且增殖直到细胞达到最小密度。
随后,将增殖的种子培养物转移到大规模培养容器中,其同样包含优选缺乏动物来源的组分的培养基。细胞增殖直到达到至少预定的细胞密度。在该阶段中,细胞在悬浮液中生长以允许培养容器内的细胞数目增加到预定或临界值。
可以通过用新鲜培养基连续灌注培养容器来进行培养基交换,同时重组细胞保留在培养容器中。灌注培养基的量可以取决于细胞密度,并且通常为每天(24小时)罐容量的约10-300%,优选约10%至95%,25%至80%。
在生长期,培养物增殖直到细胞达到一定密度。达到这种密度,培养物进入生产阶段。
当细胞密度达到适于开始生产阶段的值时,罐中的罐培养基的约60-95%每24小时更换,优选约80%。在生产阶段中也优选使用80%的培养基交换。也可以在这一点改变设定点,并设定为适合于生产各自蛋白质的值。培养基灌注优选连续进行。培养基的流速可以以每个限定的时间段的培养基的罐体积百分比表示。
培养基灌注可以是每10-48小时约10-200%罐体积;优选地,培养基灌注为每10-48小时约90%,更优选地,培养基灌注为每24小时约80%罐体积。
可以使用许多细胞保留装置实现培养容器内的细胞保留。不同的分离原理可用于该方法。该方法可以基于重力沉降、声学沉降、离心沉降或过滤。以下成套设备可以全部用于该方法:内部或外部过滤器例如内部或外部旋转过滤器(例如来自Sartorius的Spinfilter P),外部错流过滤器、外部或内部中空纤维筒式过滤器(例如来自Refine的交变切向流(ATF))。
VWF多聚体可以从简单的二聚体变化到由超过16个共价连接的vWF单体组成的多聚体。不同的蛋白质形式确实具有不同的生物活性。例如,vWF的低分子量多聚体确实具有较低的利托菌素辅因子活性(vWF:RCoF),而vWF的高分子量形式确实具有较高的vWF:RCoF活性。vWF制剂的高vWF:RCoF活性与初始止血的高活性相关,因为具有高vWF:RCoF的vWF制剂更有效地促进血小板的凝集和血小板对损伤暴露的胶原蛋白的系链束缚。人血浆中vWF:RCoF与抗原含量(vWF:Ag)的比率定义为1.0。
因此,期望制备具有以下vWF:RCoF与vWF:Ag比率的药物vWF制剂:至少0.5、或至少0.55、或至少0.6、或至少0.65、或至少0.7、或至少0.75、或至少0.8、或至少0.85、或至少0.9、或至少0.95或至少1.0。
在某些治疗情况下,还优选制备vWF制剂,其确实具有比人血浆中存在的vWF:RCoF/vWF:Ag比率更高的升高的vWF:RCoF/vWF:Ag比率,例如至少1.05、或至少1.1、或至少1.15、或至少1.2或至少1.25、或至少1.3、或至少1.35、或至少1.40、或至少1.45或至少1.50、或至少1.55或至少1.60、或至少1.65或至少1.70或至少1.75、或至少1.80、或至少1.85或至少1.90或至少1.95或至少2.0。
为了制备具有升高的vWF:RCoF/vWF:Ag比率的药物vWF制剂,通常需要设计增加vWF的较高分子量多聚体的量的下游纯化程序。这通常是麻烦的,并且可能导致vWF产物的产率降低,因为每个下游纯化步骤通常与一些产物损失相关。
本发明的发明人现已惊奇地发现,在细胞培养过程中在制备的上游阶段已经可以通过使用分离装置来实现vWF的更高分子量多聚体的富集,所述分离装置在生物反应器(渗余物)保留vWF的所需高分子量多聚体形式而较不期望的较低分子量形式的vWF通过分离装置(渗透物)。然而,由于较低分子量形式的vWF仍然能够结合和稳定因子VIII,渗透物中的级分也可以是用于某些特定用途的产物,例如用于稳定因子VIII。在后一种情况下,vWF多聚体的低分子量级分可以是所需的vWF形式。
收获富含HMW vWF多聚体的级分可以在i)在发酵方法结束时或ii)伴随地通过使用另外的分离装置进行。在情况ii)中的该另外的分离装置可以是将细胞与渗余物分开的任何分离装置,其不进一步将LMW vWF多聚体与HMW vWF多聚体分开。作为在情况ii)中的这种发酵方法的结果,获得富含HMW vWF多聚体的vWF制剂,并且与在情况i)中的发酵方法相比,在生物反应器中的停留时间减少。缩短停留时间通常有利于使降解事件最小化。
然而,如果vWF:RCoF/vWF:Ag的比率高于2.0,当将这样的制剂给予患者时,血栓栓塞并发症的风险增加,因为这种超大分子量多聚体vWF可导致血小板在非生理情况下凝集。
如果这种超大分子量多聚体存在于细胞培养基中,应用截留分子量(MWCO)为10,000,000Da的分离装置可能是有益的,其在生物反应器(渗余物)中保留超大多聚体vWF,而所需的高分子量形式的vWF被分离进入滤液。
本发明人还发现了用于通过在生物反应器中在细胞培养基中培养宿主细胞来制备重组von Willebrand因子(vWF)的方法,其中宿主细胞产生分泌到细胞培养基中的重组vWF,并且其中在细胞培养基中的vWF包含不同大小的vWF多聚体,其中将至少一种细胞培养基组分进料至细胞培养基中,并且其中将包含细胞、重组vWF和细胞培养基的细胞培养物泵送通过分离系统,并且其中所述分离系统将vWF多聚体分离成至少:
渗透物级分,与分离前的细胞培养上清液中的vWF多聚体相比,所述渗透物级分富含vWF的低分子量(LMW)多聚体而vWF的高分子量(HMW)多聚体减少,和
渗余物级分,与分离前的细胞培养上清液中的vWF多聚体相比,所述渗余物级分的vWF的低分子量(LMW)多聚体减少而富含vWF的高分子量(HMW)多聚体。
HMW vWF多聚体比率优选等于或大于1.1、或大于1.2、或大于1.25、或大于1.30、或大于1.35、或大于1.40或大于1.45或大于1.50或大于1.60、或大于1.70、或大于1.80、或大于1.90。
在优选的实施方案中,本发明还包括生物反应器,其包含在渗余物中的包含vWF多聚体的细胞培养基和在渗透物中包含vWF多聚体的细胞培养基,其中HMW vWF多聚体比率等于或大于1.1、或大于1.2、或大于1.25、或大于1.30、或大于1.35、或大于1.40或大于1.45或大于1.50或大于1.60、或大于1.70、或大于1.80、或大于1.90。
LMW vWF多聚体比率优选等于或小于0.90、或小于0.85、或小于0.80、或小于0.75、或小于0.70或小于0.65或小于0.60、或小于0.55、或小于0.50。
本发明的优选实施方案还包括生物反应器,其包含含有vWF多聚体的细胞培养基和在渗透物中的包含vWF多聚体的细胞培养基,其中LMW vWF多聚体比率小于0.90、或小于0.85、或小于0.80、或小于0.75、或小于0.70或小于0.65或小于0.60、或小于0.55、或小于0.50。
通过选择分离装置的MWCO,本发明使本领域技术人员能够选择vWF产物的分子大小,然后根据本领域公知的技术将其随后纯化。
在发酵阶段,即在上游加工过程中,不同分子量的vWF多聚体的此类分离极大地促进了在随后的发酵后或下游纯化中的分离,因为vWF多聚体的所需级分已经富含所需的vWF多聚体。因此,在下游加工中需要潜在的更少的纯化步骤,导致更快的加工时间和更高的产率。本发明通常还导致所得vWF制品的更高纯度,因为纯化的一部分已经在生物反应器中开始,随后下游加工从已经富集了所需分子量级分的vWF开始。
某些实施方案可包括监测和控制某些参数诸如pH、溶解氧张力(DOT)和温度的培养方法。作为一个实例,可以通过调节顶空气体和/或喷雾器中的CO2浓度,以及当需要时向培养基中加入碱来控制pH。因此,某些实施方案包括在细胞培养基中大规模生产重组多肽,其中监测培养物中溶解的CO2的浓度,并且使用通过培养基的恒定或间歇性空气喷射来维持CO2的某些浓度范围。在一些方面,溶解的CO2的浓度的预定范围为约80-200mmHg,优选约100-180mmHg,例如约140mmHg。在大多数情况下,相对于监测的培养基中溶解的CO2的浓度来控制空气的喷射速率。例如,空气的喷射速率可以在每升培养液约0.000-0.100L/min,优选约每升培养液约0.005-0.020L/min的范围内,特别是当监测的溶解CO2的浓度为等于(预定)设定点浓度。在一些情况下,当监测的溶解CO2的浓度等于设定点浓度-5mmHg时,空气的喷射速率在每升培养液0.000-0.005的范围内,诸如约0.0L/min;当监测的溶解CO2的浓度等于设定点浓度+5mmHg时,在每升培养液0.010-0.100L/min的范围内(参见美国申请号2006/0216790)。这样的方法可以用于在细胞培养基中维持期望的pH,例如,其中添加到培养基中的任何固体或液体物质不产生高于约7.5的局部pH值。
溶解氧张力可以例如通过用空气或纯氧或其混合物喷射来维持。温度控制介质通常是水或其他液体,根据需要加热或冷却。在某些方面,水可以通过围绕容器的夹套或通过浸没在培养物中的管线圈。
由重组细胞产生的vWF可以根据本领域已知的各种技术进行纯化和表征。用于进行蛋白质纯化和分析蛋白质纯度的示例性系统包括快速蛋白质液相色谱(FPLC)(例如,和Bio-Rad FPLC系统)、疏水相互作用色谱和高压液相色谱(HPLC)。用于纯化的示例性化学物质包括离子交换层析(例如Q、S)、尺寸排阻色谱、盐梯度、亲和纯化(例如Ni、Co、FLAG、麦芽糖、谷胱甘肽、蛋白A/G)、凝胶过滤、反相、陶瓷离子交换层析和疏水相互作用柱(HIC),以及本领域已知的其他内容。还包括分析方法诸如SDS-PAGE(例如考马斯、银染)、制备性等电聚焦(IEF)、免疫印迹、Bradford、差示溶解度(例如硫酸铵沉淀)和ELISA,其可用于生产或纯化方法的任意步骤过程中,通常用于测量蛋白质组合物的纯度。
在某些方面,重组vWF可以进行多个色谱纯化步骤,包括亲和色谱、离子交换色谱、疏水相互作用色谱、染料色谱、羟基磷灰石色谱、尺寸排阻色谱和优选免疫亲和色谱的任何组合,主要用于浓缩所需蛋白质并且去除在制造、储存和/或使用过程中可能导致重组蛋白的断裂、活化和/或降解的物质。优选通过纯化除去的此类物质的示例性实例包括其它蛋白质污染物,诸如修饰酶如PACE/弗林蛋白酶、VKOR和VKGC;蛋白质,诸如宿主细胞蛋白质,其在重组蛋白质生产过程中从生产细胞释放到组织培养基中;非蛋白质污染物,诸如脂质;和蛋白质和非蛋白质污染物的混合物,诸如脂蛋白。vWF蛋白的纯化方法是本领域已知的(参见例如WO 2011/022657)。
为了使病毒污染的理论风险最小化,可以在允许有效灭活或消除病毒的方法中包括额外的步骤。此类步骤包括例如在液体或固体状态下的热处理、用溶剂和/或洗涤剂处理、在可见光或UV光谱中的辐射、γ-辐射和纳米过滤。
药物组合物
本发明的实施方案包括蛋白质并优选vWF蛋白质,其根据本文提供的方法产生,并且配制于药学上可接受或生理学上可接受的溶液中用于施用于细胞或动物,单独或与一种或多种更多其他治疗方案组合。还将理解的是,如果需要,本发明的组合物同样可以与其它试剂组合施用,诸如例如其它蛋白质或多肽或各种药学活性剂。对于也可以包括在组合物中的其它组分实际上没有限制,条件是这些另外的试剂不会不利地影响期望待实现的调节或其他效果。
在本发明的药物组合物中,药学上可接受的赋形剂和载体溶液的制剂是本领域技术人员所公知的,如开发合适的给药和治疗方案以将本文所述的特定组合物用于各种治疗方案包括例如口服、肠胃外、静脉内、鼻内、皮下和肌肉内施用和配制。
在某些应用中,本发明的药物或治疗组合物不刺激免疫反应。在一些方面,包含蛋白质的药物组合物可以配制成稳定的液体形式。在其它方面,药物组合物可以配制成冻干形式;蛋白质可以通过本领域已知的各种方法冻干。冻干制剂通常通过加入一种或多种药学上可接受的稀释剂诸如注射用无菌水或无菌生理盐水溶液在使用前重构。
在某些实施方案中,蛋白质具有对于特定施用模式(诸如静脉内施用)所需的溶解度。所需的溶解度的实例包括至少约1mg/ml、至少约10mg/ml、,至少约25mg/ml和至少约50mg/ml。
在某些情况下,需要肠胃外、皮下、静脉内、肌内、动脉内、鞘内、实质内(intraparenchymally)、脑室内(intraventricularly)、尿道内、胸骨内、颅内、滑膜内或甚至腹膜内递送本文公开的药物组合物。用于胃肠外施用的合适的装置包括针(包括微针)注射器、无针注射器和输注技术。
对于在水溶液中的肠胃外给药,例如,如果需要,应该适当地缓冲溶液,并且首先用足够的盐水或葡萄糖使液体稀释剂等渗。这些特定的水溶液特别适用于静脉内、肌内、皮下和腹膜内施用。
无菌注射溶液可以通过将所需量的活性化合物掺入合适的溶剂中,根据需要与上述各种其它成分混合,然后过滤灭菌来制备。通常,通过将各种灭菌的活性成分掺入无菌载剂中制备分散体,所述无菌载剂含有基本分散介质和来自上面列举的那些的所需其它成分。在用于制备无菌注射溶液的无菌粉末的情况下,优选的制备方法是真空干燥和冷冻干燥技术,其从其先前无菌过滤的溶液得到活性成分的粉末加上任何额外的所需成分。
本文公开的组合物可以配制成中性或盐形式。药学上可接受的盐包括酸加成盐(与蛋白质的游离氨基形成),并且其是与无机酸(诸如例如盐酸或磷酸)或有机酸(诸如乙酸、草酸、酒石酸、扁桃酸等)形成的。与游离羧基形成的盐也可以衍生自无机碱(诸如例如氢氧化钠、氢氧化钾、氢氧化铵、氢氧化钙或氢氧化铁),以及有机碱(诸如异丙胺、三甲胺、组氨酸、普鲁卡因等)。在配制时,将以与剂量制剂相容的方式和以治疗有效的量施用溶液。制剂容易以各种剂型施用,例如注射溶液、药物释放胶囊等。
如本文所用,“载体”包括任何和所有溶剂、分散介质、载剂、包衣、稀释剂、抗细菌剂和抗真菌剂、等渗和吸收延迟剂、缓冲剂、载体溶液、悬浮液、胶体等。此类介质和试剂用于药物活性物质的用途是本领域公知的。除非在任何常规介质或试剂与活性成分不相容的情况下,否则考虑其在治疗组合物中的用途。补充的活性成分也可以掺入组合物中。
短语“药学上可接受的”是指当施用于人时不产生过敏或类似的不良反应的分子实体和组合物。含有蛋白质作为活性成分的水性组合物的制备在本领域是众所周知的。
通常,将这样的组合物制备为可注射的,作为液体溶液或悬浮液;也可以制备适于在注射前溶解或悬浮在液体中的固体形式。制剂也可以乳化。
药物组合物可以配制成立即和/或持续释放。持续释放组合物包括延迟的、修饰的、脉冲的、受控的、靶向的和程序性的释放。
配制方法是本领域公知的。本文提供的重组蛋白可相应地施用于任何治疗有效的给药方案。可以选择剂量和频率以产生有效量的蛋白质并使有害作用最小化。有效量将取决各种因素,包括施用途径、所治疗的受试者的类型和所考虑的受试者的身体特征(诸如体重、饮食)、同时给药和医学领域将认可的其他因素。
vWF的制剂已经描述于例如WO 2010/048275中。
在本说明书中引用的所有出版物、专利申请和授权专利通过引用并入,如同每个单独的出版物、专利申请或授权专利被具体地和单独地指示通过引用并入。
尽管为了清楚理解的目的通过说明和实施例相当详细地描述了前述发明,但是根据本发明的教导,本领域普通技术人员将容易明白,某些改变和修改可以在不脱离所附权利要求书的精神或范围的情况下。提供以下实施例仅作为说明而不是限制。本领域技术人员将容易地认识到可以改变或修改以得到基本相似的结果的各种非关键参数。
实施例
使用Sartorius Biostat B-DCU Controller进行所有发酵以将pH控制在7.0,DO在30%空气饱和,温度和150rpm的搅拌器速度。该方法在具有5L工作体积的Sartorius B容器中进行。在反应器接种后,在37℃下进行生长期,然后在33℃下进行生产期。所有方法都用相同的表达在其C末端与人野生型全长白蛋白融合的野生型全长vWF的CHO细胞系进行。如WO 2009/156137中所述获得细胞系。
实施例1(分批方法,比较例)
以4.4×105个细胞/mL的细胞密度开始用CSL-DBM-PFCDM-培养基(SAFC)运行的分批方法。7天后,达到6.9×106个细胞/mL的细胞密度。每天对生物反应器进行取样,并测定样品的vWF活性(vWF:RCoF)和抗原(vWF:Ag)。从这些测量计算vWF:RCoF/vWF:Ag的比率。图1显示在约第2天达到峰值水平后该比值略有降低。
实施例2(本发明的方法)
截留模块,ATF 4(Refine Technology)以3L/min的排气流速和3L/min的压力流速操作。使用获自GE Healthcare Life Sciences的以ATF流动模式操作的750kDa截留分子量(MWCO)中空纤维膜来富集生物反应器中的高分子量(HMW)vWF,并降低生物反应器中的低分子量(LMW)vWF。在生长期期间使用基于CD CHO(Gibco)的培养基并且其也作为进料培养基。以5×105个细胞/mL开始培养。在4天的生长期(数据未显示)后,以每天罐容积的约100%的渗透物收获率开始ATF。此时,生物反应器中的细胞密度为3.8×106个细胞/mL。当细胞密度达到7×106个细胞/mL时,将温度从37℃变为用于生产期的33℃。
每天对生物反应器和渗透物进行取样,并测定vWF利托菌素辅因子活性(vWF:RCoF)和vWF抗原(vWF:Ag)。从这些测量计算vWF:RCoF/vWF:Ag的比率。显示由于去除了LMW vWF,渗余物(生物反应器)中vWF:RCoF/vWF:Ag的比率正在升高,而由于去除了HMW vWF,渗透物中vWF:RCoF/vWF:Ag的比率正在降低(图2)。
在第4天进行了根据Ott等人(Am J Clin Pathol 2010;133:322-330)的vWF多聚体分析(多聚体电泳),以显示在渗余物(生物反应器)中高分子量vWF的富集以及在渗透物中分离和去除低分子量vWF。除了渗余物和渗透物的样品的多聚体分析之外,根据Ott等人(Am J Clin Pathol 2010;133:322-330)进行了标准人血浆(SHP)(Siemens,标准人血浆,ORKL17)样品的多聚体分析,并且在每个单独的印迹中用作参考。然后通过将各个样本中的带段1-5、6-10和≥11的像素强度分别除以标准人血浆中相应带段的平均像素强度来计算“相对于标准人血浆的累积像素强度”,其中两个单独的累积像素强度根据Ott等人(Am J Clin Pathol 2010;133:322-330)进行测定(表2,图3)。
表2(vWF多聚体分析):
实施例3(本发明的方法)
截留模块,ATF 4(Refine Technology)以3L/min的排气流速和3L/min的压力流速操作。使用获自GE Healthcare Life Sciences的以ATF流动模式操作的750kDa截留分子量(MWCO)中空纤维膜来富集生物反应器中的HMW vWF并降低生物反应器中的LMW vFW。基于PowerCHO-3的细胞培养基(Lonza)用于整个过程。以4×105个细胞/mL开始培养。在3天的生长期(数据未显示)后,以每天罐容积的约100%的渗透物收获率开始ATF。此时,生物反应器中的细胞密度为1.4×106个细胞/mL。当细胞密度达到1.7×106个细胞/mL时,将温度从37℃变为用于生产期的33℃。
每天对生物反应器和渗透物进行取样,如实施例1所述测定活性(vWF:RCoF)和抗原(vWF:Ag)。从这些测量计算vWF:RCoF/vWF:Ag的比率。显示由于去除了LMW vWF,渗余物(生物反应器)中vWF:RCoF/vWF:Ag的比率正在升高,而由于去除了HMW vWF,渗透物中的比率vWF:RCoF/vWF:Ag正在降低(图4)。
在该过程结束时,进行多聚体电泳以显示高分子量vWF在生物反应器中的积累和低分子量vWF与渗透物的分离/去除。如上计算相对于标准人血浆的累积像素强度。
在第9天进行了根据Ott等人(Am J Clin Pathol 2010;133:322-330)的vWF多聚体分析(多聚体电泳),以显示在渗余物(生物反应器)中高分子量vWF的富集以及在渗透物中分离和去除低分子量vWF。除了渗余物和渗透物的样品的多聚体分析之外,根据Ott等人(Am J Clin Pathol 2010;133:322-330)进行标准人血浆(SHP)(Siemens,标准人血浆,ORKL17)样品的多聚体分析,并且在每个单独的印迹中用作参考。然后如实施例2中所述计算“相对于标准人血浆的累积像素强度”(表3,图5)。
表3(vWF多聚体分析):
实施例4
本发明的另一方面是一种方法,其中使用另外的分离装置从生物反应器中直接收获如在实施例2和3中的任一个中获得的渗余物。在这种情况下,分离装置可以是将细胞与渗余物分离的任何分离装置,其不进一步将LMW vWF多聚体与HMW vWF多聚体分离。生物反应器条件和培养基如前述实施例中所述。
作为此类发酵方法的结果,获得富含HMW vWF多聚体的vWF制剂,并且减少了在生物反应器中的停留时间。此外,这种方法不受加工时间的限制,因为不发生vWF多聚体的积累。
实施例5
本发明的另一方面是一种方法,其中如在实施例2和3中的任一个中获得的渗余物然后另外进行第二次分离,其中超大vWF多聚体(ULMW vWF多聚体)在渗余物中富集,提供第二渗透物,所述第二渗透物中总vWF多聚体量中超大vWF多聚体的比例与在所述第二次分离之前所述渗余物中总vWF多聚体量中超大vWF多聚体的比例相比降低。生物反应器条件和培养基如前述实施例中所述。第二ATF系统连接到生物反应器(图6),其装配有MWCO约为10,000,000Da或0.1μm的中空纤维膜。通过以20-200%的罐体积的流量收获第二分离系统的渗透物,除去ULMW vWF多聚体。
作为此类发酵的结果,包括第一次分离,导致vWF的HMW多聚体的富集,第二次分离,导致HMW多聚体从ULMW vWF多聚体中耗尽,在第二次分离的渗透物中产生VWF制剂,其耗尽了LMW vWF多聚体和ULMW vWF多聚体二者,然后在初级止血中均具有高活性,但是避免了由于ULMW vWF多聚体的存在而可能的不利影响。
两次分离可以平行或顺序进行。
实施例6(本发明的方法)
使用Sartorius Biostat B-DCU Controller进行发酵以将pH控制在7.0,DO在30%空气饱和,温度和150rpm的搅拌器速度。该方法在具有5L工作体积的Sartorius B容器中进行。
在反应器接种后,在37℃进行生长期,随后在33.5℃下进行生产期。该方法用表达野生型全长vWF(NCBI序列NP_000543)的CHO细胞系进行。如WO 2009/156137中所述获得细胞系。
截留模块,ATF 4(Refine Technology)以3L/min的排气流速和3L/min的压力流速操作。使用获自GE Healthcare Life Sciences的以ATF流动模式操作的750kDa截留分子量(MWCO)中空纤维膜来富集生物反应器中的高分子量(HMW)vWF,并降低生物反应器中的低分子量(LMW)vWF。
在生长期期间使用基于CD CHO(Gibco)的培养基并且其也作为进料培养基。以7.6×105个细胞/mL开始培养。
在1天的生长期(数据未显示)后,以每天罐体积的约100%的渗透物收获率开始ATF。此外,将温度从37℃变为用于整个生产期的33.5℃。此时,生物反应器中的细胞密度为10.9×105个细胞/mL。在第7天,细胞密度达到70.0×105个细胞/mL。
每天对生物反应器和渗透物进行取样,并测定vWF利托菌素辅因子活性(vWF:RCoF)和vWF抗原(vWF:Ag)。从这些测量计算vWF:RCoF/vWF:Ag的比率。显示由于去除了LMW vWF,渗余物(生物反应器)中vWF:RCoF/vWF:Ag的比率正在升高,而由于去除了HMW vWF,渗透物中vWF:RCoF/vWF:Ag的比率正在降低(图9)。
在第7天进行了根据Ott等人(Am J Clin Pathol 2010;133:322-330)的vWF多聚体分析(多聚体电泳),以显示在渗余物(生物反应器)中高分子量vWF的富集以及在渗透物中分离和去除低分子量vWF。除了渗余物和渗透物的样品的多聚体分析之外,根据Ott等人(Am J Clin Pathol 2010;133:322-330)进行标准人血浆(SHP)(Siemens,标准人血浆,ORKL17)样品的多聚体分析,并且在每个单独的印迹中用作参考。然后通过将各个样本中的带段1-5、6-10和≥11的像素强度分别除以标准人血浆中相应带段的平均像素强度来计算“相对于标准人血浆的累积像素强度”,其中两个单独的累积像素强度根据Ott等人(Am J Clin Pathol 2010;133:322-330)进行测定(表4,图8)。
表4(vWF多聚体分析):
序列表
<110> CSL Ltd.
<120> 生物反应器中重组von Willebrand因子的改进生产
<130> 2014_P002_A227
<150> EP 14172338.7
<151> 2014-06-13
<160> 3
<170> PatentIn version 3.5
<210> 1
<211> 8442
<212> DNA
<213> 智人
<220>
<221> CDS
<222> (1)..(8442)
<400> 1
atg att cct gcc aga ttt gcc ggg gtg ctg ctt gct ctg gcc ctc att 48
Met Ile Pro Ala Arg Phe Ala Gly Val Leu Leu Ala Leu Ala Leu Ile
1 5 10 15
ttg cca ggg acc ctt tgt gca gaa gga act cgc ggc agg tca tcc acg 96
Leu Pro Gly Thr Leu Cys Ala Glu Gly Thr Arg Gly Arg Ser Ser Thr
20 25 30
gcc cga tgc agc ctt ttc gga agt gac ttc gtc aac acc ttt gat ggg 144
Ala Arg Cys Ser Leu Phe Gly Ser Asp Phe Val Asn Thr Phe Asp Gly
35 40 45
agc atg tac agc ttt gcg gga tac tgc agt tac ctc ctg gca ggg ggc 192
Ser Met Tyr Ser Phe Ala Gly Tyr Cys Ser Tyr Leu Leu Ala Gly Gly
50 55 60
tgc cag aaa cgc tcc ttc tcg att att ggg gac ttc cag aat ggc aag 240
Cys Gln Lys Arg Ser Phe Ser Ile Ile Gly Asp Phe Gln Asn Gly Lys
65 70 75 80
aga gtg agc ctc tcc gtg tat ctt ggg gaa ttt ttt gac atc cat ttg 288
Arg Val Ser Leu Ser Val Tyr Leu Gly Glu Phe Phe Asp Ile His Leu
85 90 95
ttt gtc aat ggt acc gtg aca cag ggg gac caa aga gtc tcc atg ccc 336
Phe Val Asn Gly Thr Val Thr Gln Gly Asp Gln Arg Val Ser Met Pro
100 105 110
tat gcc tcc aaa ggg ctg tat cta gaa act gag gct ggg tac tac aag 384
Tyr Ala Ser Lys Gly Leu Tyr Leu Glu Thr Glu Ala Gly Tyr Tyr Lys
115 120 125
ctg tcc ggt gag gcc tat ggc ttt gtg gcc agg atc gat ggc agc ggc 432
Leu Ser Gly Glu Ala Tyr Gly Phe Val Ala Arg Ile Asp Gly Ser Gly
130 135 140
aac ttt caa gtc ctg ctg tca gac aga tac ttc aac aag acc tgc ggg 480
Asn Phe Gln Val Leu Leu Ser Asp Arg Tyr Phe Asn Lys Thr Cys Gly
145 150 155 160
ctg tgt ggc aac ttt aac atc ttt gct gaa gat gac ttt atg acc caa 528
Leu Cys Gly Asn Phe Asn Ile Phe Ala Glu Asp Asp Phe Met Thr Gln
165 170 175
gaa ggg acc ttg acc tcg gac cct tat gac ttt gcc aac tca tgg gct 576
Glu Gly Thr Leu Thr Ser Asp Pro Tyr Asp Phe Ala Asn Ser Trp Ala
180 185 190
ctg agc agt gga gaa cag tgg tgt gaa cgg gca tct cct ccc agc agc 624
Leu Ser Ser Gly Glu Gln Trp Cys Glu Arg Ala Ser Pro Pro Ser Ser
195 200 205
tca tgc aac atc tcc tct ggg gaa atg cag aag ggc ctg tgg gag cag 672
Ser Cys Asn Ile Ser Ser Gly Glu Met Gln Lys Gly Leu Trp Glu Gln
210 215 220
tgc cag ctt ctg aag agc acc tcg gtg ttt gcc cgc tgc cac cct ctg 720
Cys Gln Leu Leu Lys Ser Thr Ser Val Phe Ala Arg Cys His Pro Leu
225 230 235 240
gtg gac ccc gag cct ttt gtg gcc ctg tgt gag aag act ttg tgt gag 768
Val Asp Pro Glu Pro Phe Val Ala Leu Cys Glu Lys Thr Leu Cys Glu
245 250 255
tgt gct ggg ggg ctg gag tgc gcc tgc cct gcc ctc ctg gag tac gcc 816
Cys Ala Gly Gly Leu Glu Cys Ala Cys Pro Ala Leu Leu Glu Tyr Ala
260 265 270
cgg acc tgt gcc cag gag gga atg gtg ctg tac ggc tgg acc gac cac 864
Arg Thr Cys Ala Gln Glu Gly Met Val Leu Tyr Gly Trp Thr Asp His
275 280 285
agc gcg tgc agc cca gtg tgc cct gct ggt atg gag tat agg cag tgt 912
Ser Ala Cys Ser Pro Val Cys Pro Ala Gly Met Glu Tyr Arg Gln Cys
290 295 300
gtg tcc cct tgc gcc agg acc tgc cag agc ctg cac atc aat gaa atg 960
Val Ser Pro Cys Ala Arg Thr Cys Gln Ser Leu His Ile Asn Glu Met
305 310 315 320
tgt cag gag cga tgc gtg gat ggc tgc agc tgc cct gag gga cag ctc 1008
Cys Gln Glu Arg Cys Val Asp Gly Cys Ser Cys Pro Glu Gly Gln Leu
325 330 335
ctg gat gaa ggc ctc tgc gtg gag agc acc gag tgt ccc tgc gtg cat 1056
Leu Asp Glu Gly Leu Cys Val Glu Ser Thr Glu Cys Pro Cys Val His
340 345 350
tcc gga aag cgc tac cct ccc ggc acc tcc ctc tct cga gac tgc aac 1104
Ser Gly Lys Arg Tyr Pro Pro Gly Thr Ser Leu Ser Arg Asp Cys Asn
355 360 365
acc tgc att tgc cga aac agc cag tgg atc tgc agc aat gaa gaa tgt 1152
Thr Cys Ile Cys Arg Asn Ser Gln Trp Ile Cys Ser Asn Glu Glu Cys
370 375 380
cca ggg gag tgc ctt gtc aca ggt caa tca cac ttc aag agc ttt gac 1200
Pro Gly Glu Cys Leu Val Thr Gly Gln Ser His Phe Lys Ser Phe Asp
385 390 395 400
aac aga tac ttc acc ttc agt ggg atc tgc cag tac ctg ctg gcc cgg 1248
Asn Arg Tyr Phe Thr Phe Ser Gly Ile Cys Gln Tyr Leu Leu Ala Arg
405 410 415
gat tgc cag gac cac tcc ttc tcc att gtc att gag act gtc cag tgt 1296
Asp Cys Gln Asp His Ser Phe Ser Ile Val Ile Glu Thr Val Gln Cys
420 425 430
gct gat gac cgc gac gct gtg tgc acc cgc tcc gtc acc gtc cgg ctg 1344
Ala Asp Asp Arg Asp Ala Val Cys Thr Arg Ser Val Thr Val Arg Leu
435 440 445
cct ggc ctg cac aac agc ctt gtg aaa ctg aag cat ggg gca gga gtt 1392
Pro Gly Leu His Asn Ser Leu Val Lys Leu Lys His Gly Ala Gly Val
450 455 460
gcc atg gat ggc cag gac gtc cag ctc ccc ctc ctg aaa ggt gac ctc 1440
Ala Met Asp Gly Gln Asp Val Gln Leu Pro Leu Leu Lys Gly Asp Leu
465 470 475 480
cgc atc cag cat aca gtg acg gcc tcc gtg cgc ctc agc tac ggg gag 1488
Arg Ile Gln His Thr Val Thr Ala Ser Val Arg Leu Ser Tyr Gly Glu
485 490 495
gac ctg cag atg gac tgg gat ggc cgc ggg agg ctg ctg gtg aag ctg 1536
Asp Leu Gln Met Asp Trp Asp Gly Arg Gly Arg Leu Leu Val Lys Leu
500 505 510
tcc ccc gtc tat gcc ggg aag acc tgc ggc ctg tgt ggg aat tac aat 1584
Ser Pro Val Tyr Ala Gly Lys Thr Cys Gly Leu Cys Gly Asn Tyr Asn
515 520 525
ggc aac cag ggc gac gac ttc ctt acc ccc tct ggg ctg gcg gag ccc 1632
Gly Asn Gln Gly Asp Asp Phe Leu Thr Pro Ser Gly Leu Ala Glu Pro
530 535 540
cgg gtg gag gac ttc ggg aac gcc tgg aag ctg cac ggg gac tgc cag 1680
Arg Val Glu Asp Phe Gly Asn Ala Trp Lys Leu His Gly Asp Cys Gln
545 550 555 560
gac ctg cag aag cag cac agc gat ccc tgc gcc ctc aac ccg cgc atg 1728
Asp Leu Gln Lys Gln His Ser Asp Pro Cys Ala Leu Asn Pro Arg Met
565 570 575
acc agg ttc tcc gag gag gcg tgc gcg gtc ctg acg tcc ccc aca ttc 1776
Thr Arg Phe Ser Glu Glu Ala Cys Ala Val Leu Thr Ser Pro Thr Phe
580 585 590
gag gcc tgc cat cgt gcc gtc agc ccg ctg ccc tac ctg cgg aac tgc 1824
Glu Ala Cys His Arg Ala Val Ser Pro Leu Pro Tyr Leu Arg Asn Cys
595 600 605
cgc tac gac gtg tgc tcc tgc tcg gac ggc cgc gag tgc ctg tgc ggc 1872
Arg Tyr Asp Val Cys Ser Cys Ser Asp Gly Arg Glu Cys Leu Cys Gly
610 615 620
gcc ctg gcc agc tat gcc gcg gcc tgc gcg ggg aga ggc gtg cgc gtc 1920
Ala Leu Ala Ser Tyr Ala Ala Ala Cys Ala Gly Arg Gly Val Arg Val
625 630 635 640
gcg tgg cgc gag cca ggc cgc tgt gag ctg aac tgc ccg aaa ggc cag 1968
Ala Trp Arg Glu Pro Gly Arg Cys Glu Leu Asn Cys Pro Lys Gly Gln
645 650 655
gtg tac ctg cag tgc ggg acc ccc tgc aac ctg acc tgc cgc tct ctc 2016
Val Tyr Leu Gln Cys Gly Thr Pro Cys Asn Leu Thr Cys Arg Ser Leu
660 665 670
tct tac ccg gat gag gaa tgc aat gag gcc tgc ctg gag ggc tgc ttc 2064
Ser Tyr Pro Asp Glu Glu Cys Asn Glu Ala Cys Leu Glu Gly Cys Phe
675 680 685
tgc ccc cca ggg ctc tac atg gat gag agg ggg gac tgc gtg ccc aag 2112
Cys Pro Pro Gly Leu Tyr Met Asp Glu Arg Gly Asp Cys Val Pro Lys
690 695 700
gcc cag tgc ccc tgt tac tat gac ggt gag atc ttc cag cca gaa gac 2160
Ala Gln Cys Pro Cys Tyr Tyr Asp Gly Glu Ile Phe Gln Pro Glu Asp
705 710 715 720
atc ttc tca gac cat cac acc atg tgc tac tgt gag gat ggc ttc atg 2208
Ile Phe Ser Asp His His Thr Met Cys Tyr Cys Glu Asp Gly Phe Met
725 730 735
cac tgt acc atg agt gga gtc ccc gga agc ttg ctg cct gac gct gtc 2256
His Cys Thr Met Ser Gly Val Pro Gly Ser Leu Leu Pro Asp Ala Val
740 745 750
ctc agc agt ccc ctg tct cat cgc agc aaa agg agc cta tcc tgt cgg 2304
Leu Ser Ser Pro Leu Ser His Arg Ser Lys Arg Ser Leu Ser Cys Arg
755 760 765
ccc ccc atg gtc aag ctg gtg tgt ccc gct gac aac ctg cgg gct gaa 2352
Pro Pro Met Val Lys Leu Val Cys Pro Ala Asp Asn Leu Arg Ala Glu
770 775 780
ggg ctc gag tgt acc aaa acg tgc cag aac tat gac ctg gag tgc atg 2400
Gly Leu Glu Cys Thr Lys Thr Cys Gln Asn Tyr Asp Leu Glu Cys Met
785 790 795 800
agc atg ggc tgt gtc tct ggc tgc ctc tgc ccc ccg ggc atg gtc cgg 2448
Ser Met Gly Cys Val Ser Gly Cys Leu Cys Pro Pro Gly Met Val Arg
805 810 815
cat gag aac aga tgt gtg gcc ctg gaa agg tgt ccc tgc ttc cat cag 2496
His Glu Asn Arg Cys Val Ala Leu Glu Arg Cys Pro Cys Phe His Gln
820 825 830
ggc aag gag tat gcc cct gga gaa aca gtg aag att ggc tgc aac act 2544
Gly Lys Glu Tyr Ala Pro Gly Glu Thr Val Lys Ile Gly Cys Asn Thr
835 840 845
tgt gtc tgt cgg gac cgg aag tgg aac tgc aca gac cat gtg tgt gat 2592
Cys Val Cys Arg Asp Arg Lys Trp Asn Cys Thr Asp His Val Cys Asp
850 855 860
gcc acg tgc tcc acg atc ggc atg gcc cac tac ctc acc ttc gac ggg 2640
Ala Thr Cys Ser Thr Ile Gly Met Ala His Tyr Leu Thr Phe Asp Gly
865 870 875 880
ctc aaa tac ctg ttc ccc ggg gag tgc cag tac gtt ctg gtg cag gat 2688
Leu Lys Tyr Leu Phe Pro Gly Glu Cys Gln Tyr Val Leu Val Gln Asp
885 890 895
tac tgc ggc agt aac cct ggg acc ttt cgg atc cta gtg ggg aat aag 2736
Tyr Cys Gly Ser Asn Pro Gly Thr Phe Arg Ile Leu Val Gly Asn Lys
900 905 910
gga tgc agc cac ccc tca gtg aaa tgc aag aaa cgg gtc acc atc ctg 2784
Gly Cys Ser His Pro Ser Val Lys Cys Lys Lys Arg Val Thr Ile Leu
915 920 925
gtg gag gga gga gag att gag ctg ttt gac ggg gag gtg aat gtg aag 2832
Val Glu Gly Gly Glu Ile Glu Leu Phe Asp Gly Glu Val Asn Val Lys
930 935 940
agg ccc atg aag gat gag act cac ttt gag gtg gtg gag tct ggc cgg 2880
Arg Pro Met Lys Asp Glu Thr His Phe Glu Val Val Glu Ser Gly Arg
945 950 955 960
tac atc att ctg ctg ctg ggc aaa gcc ctc tcc gtg gtc tgg gac cgc 2928
Tyr Ile Ile Leu Leu Leu Gly Lys Ala Leu Ser Val Val Trp Asp Arg
965 970 975
cac ctg agc atc tcc gtg gtc ctg aag cag aca tac cag gag aaa gtg 2976
His Leu Ser Ile Ser Val Val Leu Lys Gln Thr Tyr Gln Glu Lys Val
980 985 990
tgt ggc ctg tgt ggg aat ttt gat ggc atc cag aac aat gac ctc acc 3024
Cys Gly Leu Cys Gly Asn Phe Asp Gly Ile Gln Asn Asn Asp Leu Thr
995 1000 1005
agc agc aac ctc caa gtg gag gaa gac cct gtg gac ttt ggg aac 3069
Ser Ser Asn Leu Gln Val Glu Glu Asp Pro Val Asp Phe Gly Asn
1010 1015 1020
tcc tgg aaa gtg agc tcg cag tgt gct gac acc aga aaa gtg cct 3114
Ser Trp Lys Val Ser Ser Gln Cys Ala Asp Thr Arg Lys Val Pro
1025 1030 1035
ctg gac tca tcc cct gcc acc tgc cat aac aac atc atg aag cag 3159
Leu Asp Ser Ser Pro Ala Thr Cys His Asn Asn Ile Met Lys Gln
1040 1045 1050
acg atg gtg gat tcc tcc tgt aga atc ctt acc agt gac gtc ttc 3204
Thr Met Val Asp Ser Ser Cys Arg Ile Leu Thr Ser Asp Val Phe
1055 1060 1065
cag gac tgc aac aag ctg gtg gac ccc gag cca tat ctg gat gtc 3249
Gln Asp Cys Asn Lys Leu Val Asp Pro Glu Pro Tyr Leu Asp Val
1070 1075 1080
tgc att tac gac acc tgc tcc tgt gag tcc att ggg gac tgc gcc 3294
Cys Ile Tyr Asp Thr Cys Ser Cys Glu Ser Ile Gly Asp Cys Ala
1085 1090 1095
tgc ttc tgc gac acc att gct gcc tat gcc cac gtg tgt gcc cag 3339
Cys Phe Cys Asp Thr Ile Ala Ala Tyr Ala His Val Cys Ala Gln
1100 1105 1110
cat ggc aag gtg gtg acc tgg agg acg gcc aca ttg tgc ccc cag 3384
His Gly Lys Val Val Thr Trp Arg Thr Ala Thr Leu Cys Pro Gln
1115 1120 1125
agc tgc gag gag agg aat ctc cgg gag aac ggg tat gag tgt gag 3429
Ser Cys Glu Glu Arg Asn Leu Arg Glu Asn Gly Tyr Glu Cys Glu
1130 1135 1140
tgg cgc tat aac agc tgt gca cct gcc tgt caa gtc acg tgt cag 3474
Trp Arg Tyr Asn Ser Cys Ala Pro Ala Cys Gln Val Thr Cys Gln
1145 1150 1155
cac cct gag cca ctg gcc tgc cct gtg cag tgt gtg gag ggc tgc 3519
His Pro Glu Pro Leu Ala Cys Pro Val Gln Cys Val Glu Gly Cys
1160 1165 1170
cat gcc cac tgc cct cca ggg aaa atc ctg gat gag ctt ttg cag 3564
His Ala His Cys Pro Pro Gly Lys Ile Leu Asp Glu Leu Leu Gln
1175 1180 1185
acc tgc gtt gac cct gaa gac tgt cca gtg tgt gag gtg gct ggc 3609
Thr Cys Val Asp Pro Glu Asp Cys Pro Val Cys Glu Val Ala Gly
1190 1195 1200
cgg cgt ttt gcc tca gga aag aaa gtc acc ttg aat ccc agt gac 3654
Arg Arg Phe Ala Ser Gly Lys Lys Val Thr Leu Asn Pro Ser Asp
1205 1210 1215
cct gag cac tgc cag att tgc cac tgt gat gtt gtc aac ctc acc 3699
Pro Glu His Cys Gln Ile Cys His Cys Asp Val Val Asn Leu Thr
1220 1225 1230
tgt gaa gcc tgc cag gag ccg gga ggc ctg gtg gtg cct ccc aca 3744
Cys Glu Ala Cys Gln Glu Pro Gly Gly Leu Val Val Pro Pro Thr
1235 1240 1245
gat gcc ccg gtg agc ccc acc act ctg tat gtg gag gac atc tcg 3789
Asp Ala Pro Val Ser Pro Thr Thr Leu Tyr Val Glu Asp Ile Ser
1250 1255 1260
gaa ccg ccg ttg cac gat ttc tac tgc agc agg cta ctg gac ctg 3834
Glu Pro Pro Leu His Asp Phe Tyr Cys Ser Arg Leu Leu Asp Leu
1265 1270 1275
gtc ttc ctg ctg gat ggc tcc tcc agg ctg tcc gag gct gag ttt 3879
Val Phe Leu Leu Asp Gly Ser Ser Arg Leu Ser Glu Ala Glu Phe
1280 1285 1290
gaa gtg ctg aag gcc ttt gtg gtg gac atg atg gag cgg ctg cgc 3924
Glu Val Leu Lys Ala Phe Val Val Asp Met Met Glu Arg Leu Arg
1295 1300 1305
atc tcc cag aag tgg gtc cgc gtg gcc gtg gtg gag tac cac gac 3969
Ile Ser Gln Lys Trp Val Arg Val Ala Val Val Glu Tyr His Asp
1310 1315 1320
ggc tcc cac gcc tac atc ggg ctc aag gac cgg aag cga ccg tca 4014
Gly Ser His Ala Tyr Ile Gly Leu Lys Asp Arg Lys Arg Pro Ser
1325 1330 1335
gag ctg cgg cgc att gcc agc cag gtg aag tat gcg ggc agc cag 4059
Glu Leu Arg Arg Ile Ala Ser Gln Val Lys Tyr Ala Gly Ser Gln
1340 1345 1350
gtg gcc tcc acc agc gag gtc ttg aaa tac aca ctg ttc caa atc 4104
Val Ala Ser Thr Ser Glu Val Leu Lys Tyr Thr Leu Phe Gln Ile
1355 1360 1365
ttc agc aag atc gac cgc cct gaa gcc tcc cgc atc gcc ctg ctc 4149
Phe Ser Lys Ile Asp Arg Pro Glu Ala Ser Arg Ile Ala Leu Leu
1370 1375 1380
ctg atg gcc agc cag gag ccc caa cgg atg tcc cgg aac ttt gtc 4194
Leu Met Ala Ser Gln Glu Pro Gln Arg Met Ser Arg Asn Phe Val
1385 1390 1395
cgc tac gtc cag ggc ctg aag aag aag aag gtc att gtg atc ccg 4239
Arg Tyr Val Gln Gly Leu Lys Lys Lys Lys Val Ile Val Ile Pro
1400 1405 1410
gtg ggc att ggg ccc cat gcc aac ctc aag cag atc cgc ctc atc 4284
Val Gly Ile Gly Pro His Ala Asn Leu Lys Gln Ile Arg Leu Ile
1415 1420 1425
gag aag cag gcc cct gag aac aag gcc ttc gtg ctg agc agt gtg 4329
Glu Lys Gln Ala Pro Glu Asn Lys Ala Phe Val Leu Ser Ser Val
1430 1435 1440
gat gag ctg gag cag caa agg gac gag atc gtt agc tac ctc tgt 4374
Asp Glu Leu Glu Gln Gln Arg Asp Glu Ile Val Ser Tyr Leu Cys
1445 1450 1455
gac ctt gcc cct gaa gcc cct cct cct act ctg ccc ccc cac atg 4419
Asp Leu Ala Pro Glu Ala Pro Pro Pro Thr Leu Pro Pro His Met
1460 1465 1470
gca caa gtc act gtg ggc ccg ggg ctc ttg ggg gtt tcg acc ctg 4464
Ala Gln Val Thr Val Gly Pro Gly Leu Leu Gly Val Ser Thr Leu
1475 1480 1485
ggg ccc aag agg aac tcc atg gtt ctg gat gtg gcg ttc gtc ctg 4509
Gly Pro Lys Arg Asn Ser Met Val Leu Asp Val Ala Phe Val Leu
1490 1495 1500
gaa gga tcg gac aaa att ggt gaa gcc gac ttc aac agg agc aag 4554
Glu Gly Ser Asp Lys Ile Gly Glu Ala Asp Phe Asn Arg Ser Lys
1505 1510 1515
gag ttc atg gag gag gtg att cag cgg atg gat gtg ggc cag gac 4599
Glu Phe Met Glu Glu Val Ile Gln Arg Met Asp Val Gly Gln Asp
1520 1525 1530
agc atc cac gtc acg gtg ctg cag tac tcc tac atg gtg acc gtg 4644
Ser Ile His Val Thr Val Leu Gln Tyr Ser Tyr Met Val Thr Val
1535 1540 1545
gag tac ccc ttc agc gag gca cag tcc aaa ggg gac atc ctg cag 4689
Glu Tyr Pro Phe Ser Glu Ala Gln Ser Lys Gly Asp Ile Leu Gln
1550 1555 1560
cgg gtg cga gag atc cgc tac cag ggc ggc aac agg acc aac act 4734
Arg Val Arg Glu Ile Arg Tyr Gln Gly Gly Asn Arg Thr Asn Thr
1565 1570 1575
ggg ctg gcc ctg cgg tac ctc tct gac cac agc ttc ttg gtc agc 4779
Gly Leu Ala Leu Arg Tyr Leu Ser Asp His Ser Phe Leu Val Ser
1580 1585 1590
cag ggt gac cgg gag cag gcg ccc aac ctg gtc tac atg gtc acc 4824
Gln Gly Asp Arg Glu Gln Ala Pro Asn Leu Val Tyr Met Val Thr
1595 1600 1605
gga aat cct gcc tct gat gag atc aag agg ctg cct gga gac atc 4869
Gly Asn Pro Ala Ser Asp Glu Ile Lys Arg Leu Pro Gly Asp Ile
1610 1615 1620
cag gtg gtg ccc att gga gtg ggc cct aat gcc aac gtg cag gag 4914
Gln Val Val Pro Ile Gly Val Gly Pro Asn Ala Asn Val Gln Glu
1625 1630 1635
ctg gag agg att ggc tgg ccc aat gcc cct atc ctc atc cag gac 4959
Leu Glu Arg Ile Gly Trp Pro Asn Ala Pro Ile Leu Ile Gln Asp
1640 1645 1650
ttt gag acg ctc ccc cga gag gct cct gac ctg gtg ctg cag agg 5004
Phe Glu Thr Leu Pro Arg Glu Ala Pro Asp Leu Val Leu Gln Arg
1655 1660 1665
tgc tgc tcc gga gag ggg ctg cag atc ccc acc ctc tcc cct gca 5049
Cys Cys Ser Gly Glu Gly Leu Gln Ile Pro Thr Leu Ser Pro Ala
1670 1675 1680
cct gac tgc agc cag ccc ctg gac gtg atc ctt ctc ctg gat ggc 5094
Pro Asp Cys Ser Gln Pro Leu Asp Val Ile Leu Leu Leu Asp Gly
1685 1690 1695
tcc tcc agt ttc cca gct tct tat ttt gat gaa atg aag agt ttc 5139
Ser Ser Ser Phe Pro Ala Ser Tyr Phe Asp Glu Met Lys Ser Phe
1700 1705 1710
gcc aag gct ttc att tca aaa gcc aat ata ggg cct cgt ctc act 5184
Ala Lys Ala Phe Ile Ser Lys Ala Asn Ile Gly Pro Arg Leu Thr
1715 1720 1725
cag gtg tca gtg ctg cag tat gga agc atc acc acc att gac gtg 5229
Gln Val Ser Val Leu Gln Tyr Gly Ser Ile Thr Thr Ile Asp Val
1730 1735 1740
cca tgg aac gtg gtc ccg gag aaa gcc cat ttg ctg agc ctt gtg 5274
Pro Trp Asn Val Val Pro Glu Lys Ala His Leu Leu Ser Leu Val
1745 1750 1755
gac gtc atg cag cgg gag gga ggc ccc agc caa atc ggg gat gcc 5319
Asp Val Met Gln Arg Glu Gly Gly Pro Ser Gln Ile Gly Asp Ala
1760 1765 1770
ttg ggc ttt gct gtg cga tac ttg act tca gaa atg cat ggg gcg 5364
Leu Gly Phe Ala Val Arg Tyr Leu Thr Ser Glu Met His Gly Ala
1775 1780 1785
cgc ccg gga gcc tca aag gcg gtg gtc atc ctg gtc acg gac gtc 5409
Arg Pro Gly Ala Ser Lys Ala Val Val Ile Leu Val Thr Asp Val
1790 1795 1800
tct gtg gat tca gtg gat gca gca gct gat gcc gcc agg tcc aac 5454
Ser Val Asp Ser Val Asp Ala Ala Ala Asp Ala Ala Arg Ser Asn
1805 1810 1815
aga gtg aca gtg ttc cct att gga att gga gat cgc tac gat gca 5499
Arg Val Thr Val Phe Pro Ile Gly Ile Gly Asp Arg Tyr Asp Ala
1820 1825 1830
gcc cag cta cgg atc ttg gca ggc cca gca ggc gac tcc aac gtg 5544
Ala Gln Leu Arg Ile Leu Ala Gly Pro Ala Gly Asp Ser Asn Val
1835 1840 1845
gtg aag ctc cag cga atc gaa gac ctc cct acc atg gtc acc ttg 5589
Val Lys Leu Gln Arg Ile Glu Asp Leu Pro Thr Met Val Thr Leu
1850 1855 1860
ggc aat tcc ttc ctc cac aaa ctg tgc tct gga ttt gtt agg att 5634
Gly Asn Ser Phe Leu His Lys Leu Cys Ser Gly Phe Val Arg Ile
1865 1870 1875
tgc atg gat gag gat ggg aat gag aag agg ccc ggg gac gtc tgg 5679
Cys Met Asp Glu Asp Gly Asn Glu Lys Arg Pro Gly Asp Val Trp
1880 1885 1890
acc ttg cca gac cag tgc cac acc gtg act tgc cag cca gat ggc 5724
Thr Leu Pro Asp Gln Cys His Thr Val Thr Cys Gln Pro Asp Gly
1895 1900 1905
cag acc ttg ctg aag agt cat cgg gtc aac tgt gac cgg ggg ctg 5769
Gln Thr Leu Leu Lys Ser His Arg Val Asn Cys Asp Arg Gly Leu
1910 1915 1920
agg cct tcg tgc cct aac agc cag tcc cct gtt aaa gtg gaa gag 5814
Arg Pro Ser Cys Pro Asn Ser Gln Ser Pro Val Lys Val Glu Glu
1925 1930 1935
acc tgt ggc tgc cgc tgg acc tgc ccc tgc gtg tgc aca ggc agc 5859
Thr Cys Gly Cys Arg Trp Thr Cys Pro Cys Val Cys Thr Gly Ser
1940 1945 1950
tcc act cgg cac atc gtg acc ttt gat ggg cag aat ttc aag ctg 5904
Ser Thr Arg His Ile Val Thr Phe Asp Gly Gln Asn Phe Lys Leu
1955 1960 1965
act ggc agc tgt tct tat gtc cta ttt caa aac aag gag cag gac 5949
Thr Gly Ser Cys Ser Tyr Val Leu Phe Gln Asn Lys Glu Gln Asp
1970 1975 1980
ctg gag gtg att ctc cat aat ggt gcc tgc agc cct gga gca agg 5994
Leu Glu Val Ile Leu His Asn Gly Ala Cys Ser Pro Gly Ala Arg
1985 1990 1995
cag ggc tgc atg aaa tcc atc gag gtg aag cac agt gcc ctc tcc 6039
Gln Gly Cys Met Lys Ser Ile Glu Val Lys His Ser Ala Leu Ser
2000 2005 2010
gtc gag ctg cac agt gac atg gag gtg acg gtg aat ggg aga ctg 6084
Val Glu Leu His Ser Asp Met Glu Val Thr Val Asn Gly Arg Leu
2015 2020 2025
gtc tct gtt cct tac gtg ggt ggg aac atg gaa gtc aac gtt tat 6129
Val Ser Val Pro Tyr Val Gly Gly Asn Met Glu Val Asn Val Tyr
2030 2035 2040
ggt gcc atc atg cat gag gtc aga ttc aat cac ctt ggt cac atc 6174
Gly Ala Ile Met His Glu Val Arg Phe Asn His Leu Gly His Ile
2045 2050 2055
ttc aca ttc act cca caa aac aat gag ttc caa ctg cag ctc agc 6219
Phe Thr Phe Thr Pro Gln Asn Asn Glu Phe Gln Leu Gln Leu Ser
2060 2065 2070
ccc aag act ttt gct tca aag acg tat ggt ctg tgt ggg atc tgt 6264
Pro Lys Thr Phe Ala Ser Lys Thr Tyr Gly Leu Cys Gly Ile Cys
2075 2080 2085
gat gag aac gga gcc aat gac ttc atg ctg agg gat ggc aca gtc 6309
Asp Glu Asn Gly Ala Asn Asp Phe Met Leu Arg Asp Gly Thr Val
2090 2095 2100
acc aca gac tgg aaa aca ctt gtt cag gaa tgg act gtg cag cgg 6354
Thr Thr Asp Trp Lys Thr Leu Val Gln Glu Trp Thr Val Gln Arg
2105 2110 2115
cca ggg cag acg tgc cag ccc atc ctg gag gag cag tgt ctt gtc 6399
Pro Gly Gln Thr Cys Gln Pro Ile Leu Glu Glu Gln Cys Leu Val
2120 2125 2130
ccc gac agc tcc cac tgc cag gtc ctc ctc tta cca ctg ttt gct 6444
Pro Asp Ser Ser His Cys Gln Val Leu Leu Leu Pro Leu Phe Ala
2135 2140 2145
gaa tgc cac aag gtc ctg gct cca gcc aca ttc tat gcc atc tgc 6489
Glu Cys His Lys Val Leu Ala Pro Ala Thr Phe Tyr Ala Ile Cys
2150 2155 2160
cag cag gac agt tgc cac cag gag caa gtg tgt gag gtg atc gcc 6534
Gln Gln Asp Ser Cys His Gln Glu Gln Val Cys Glu Val Ile Ala
2165 2170 2175
tct tat gcc cac ctc tgt cgg acc aac ggg gtc tgc gtt gac tgg 6579
Ser Tyr Ala His Leu Cys Arg Thr Asn Gly Val Cys Val Asp Trp
2180 2185 2190
agg aca cct gat ttc tgt gct atg tca tgc cca cca tct ctg gtt 6624
Arg Thr Pro Asp Phe Cys Ala Met Ser Cys Pro Pro Ser Leu Val
2195 2200 2205
tat aac cac tgt gag cat ggc tgt ccc cgg cac tgt gat ggc aac 6669
Tyr Asn His Cys Glu His Gly Cys Pro Arg His Cys Asp Gly Asn
2210 2215 2220
gtg agc tcc tgt ggg gac cat ccc tcc gaa ggc tgt ttc tgc cct 6714
Val Ser Ser Cys Gly Asp His Pro Ser Glu Gly Cys Phe Cys Pro
2225 2230 2235
cca gat aaa gtc atg ttg gaa ggc agc tgt gtc cct gaa gag gcc 6759
Pro Asp Lys Val Met Leu Glu Gly Ser Cys Val Pro Glu Glu Ala
2240 2245 2250
tgc act cag tgc att ggt gag gat gga gtc cag cac cag ttc ctg 6804
Cys Thr Gln Cys Ile Gly Glu Asp Gly Val Gln His Gln Phe Leu
2255 2260 2265
gaa gcc tgg gtc ccg gac cac cag ccc tgt cag atc tgc aca tgc 6849
Glu Ala Trp Val Pro Asp His Gln Pro Cys Gln Ile Cys Thr Cys
2270 2275 2280
ctc agc ggg cgg aag gtc aac tgc aca acg cag ccc tgc ccc acg 6894
Leu Ser Gly Arg Lys Val Asn Cys Thr Thr Gln Pro Cys Pro Thr
2285 2290 2295
gcc aaa gct ccc acg tgt ggc ctg tgt gaa gta gcc cgc ctc cgc 6939
Ala Lys Ala Pro Thr Cys Gly Leu Cys Glu Val Ala Arg Leu Arg
2300 2305 2310
cag aat gca gac cag tgc tgc ccc gag tat gag tgt gtg tgt gac 6984
Gln Asn Ala Asp Gln Cys Cys Pro Glu Tyr Glu Cys Val Cys Asp
2315 2320 2325
cca gtg agc tgt gac ctg ccc cca gtg cct cac tgt gaa cgt ggc 7029
Pro Val Ser Cys Asp Leu Pro Pro Val Pro His Cys Glu Arg Gly
2330 2335 2340
ctc cag ccc aca ctg acc aac cct ggc gag tgc aga ccc aac ttc 7074
Leu Gln Pro Thr Leu Thr Asn Pro Gly Glu Cys Arg Pro Asn Phe
2345 2350 2355
acc tgc gcc tgc agg aag gag gag tgc aaa aga gtg tcc cca ccc 7119
Thr Cys Ala Cys Arg Lys Glu Glu Cys Lys Arg Val Ser Pro Pro
2360 2365 2370
tcc tgc ccc ccg cac cgt ttg ccc acc ctt cgg aag acc cag tgc 7164
Ser Cys Pro Pro His Arg Leu Pro Thr Leu Arg Lys Thr Gln Cys
2375 2380 2385
tgt gat gag tat gag tgt gcc tgc aac tgt gtc aac tcc aca gtg 7209
Cys Asp Glu Tyr Glu Cys Ala Cys Asn Cys Val Asn Ser Thr Val
2390 2395 2400
agc tgt ccc ctt ggg tac ttg gcc tca acc gcc acc aat gac tgt 7254
Ser Cys Pro Leu Gly Tyr Leu Ala Ser Thr Ala Thr Asn Asp Cys
2405 2410 2415
ggc tgt acc aca acc acc tgc ctt ccc gac aag gtg tgt gtc cac 7299
Gly Cys Thr Thr Thr Thr Cys Leu Pro Asp Lys Val Cys Val His
2420 2425 2430
cga agc acc atc tac cct gtg ggc cag ttc tgg gag gag ggc tgc 7344
Arg Ser Thr Ile Tyr Pro Val Gly Gln Phe Trp Glu Glu Gly Cys
2435 2440 2445
gat gtg tgc acc tgc acc gac atg gag gat gcc gtg atg ggc ctc 7389
Asp Val Cys Thr Cys Thr Asp Met Glu Asp Ala Val Met Gly Leu
2450 2455 246
cgc gtg gcc cag tgc tcc cag aag ccc tgt gag gac agc tgt cgg 7434
Arg Val Ala Gln Cys Ser Gln Lys Pro Cys Glu Asp Ser Cys Arg
2465 2470 2475
tcg ggc ttc act tac gtt ctg cat gaa ggc gag tgc tgt gga agg 7479
Ser Gly Phe Thr Tyr Val Leu His Glu Gly Glu Cys Cys Gly Arg
2480 2485 2490
tgc ctg cca tct gcc tgt gag gtg gtg act ggc tca ccg cgg ggg 7524
Cys Leu Pro Ser Ala Cys Glu Val Val Thr Gly Ser Pro Arg Gly
2495 2500 2505
gac tcc cag tct tcc tgg aag agt gtc ggc tcc cag tgg gcc tcc 7569
Asp Ser Gln Ser Ser Trp Lys Ser Val Gly Ser Gln Trp Ala Ser
2510 2515 2520
ccg gag aac ccc tgc ctc atc aat gag tgt gtc cga gtg aag gag 7614
Pro Glu Asn Pro Cys Leu Ile Asn Glu Cys Val Arg Val Lys Glu
2525 2530 2535
gag gtc ttt ata caa caa agg aac gtc tcc tgc ccc cag ctg gag 7659
Glu Val Phe Ile Gln Gln Arg Asn Val Ser Cys Pro Gln Leu Glu
2540 2545 2550
gtc cct gtc tgc ccc tcg ggc ttt cag ctg agc tgt aag acc tca 7704
Val Pro Val Cys Pro Ser Gly Phe Gln Leu Ser Cys Lys Thr Ser
2555 2560 2565
gcg tgc tgc cca agc tgt cgc tgt gag cgc atg gag gcc tgc atg 7749
Ala Cys Cys Pro Ser Cys Arg Cys Glu Arg Met Glu Ala Cys Met
2570 2575 2580
ctc aat ggc act gtc att ggg ccc ggg aag act gtg atg atc gat 7794
Leu Asn Gly Thr Val Ile Gly Pro Gly Lys Thr Val Met Ile Asp
2585 2590 2595
gtg tgc acg acc tgc cgc tgc atg gtg cag gtg ggg gtc atc tct 7839
Val Cys Thr Thr Cys Arg Cys Met Val Gln Val Gly Val Ile Ser
2600 2605 2610
gga ttc aag ctg gag tgc agg aag acc acc tgc aac ccc tgc ccc 7884
Gly Phe Lys Leu Glu Cys Arg Lys Thr Thr Cys Asn Pro Cys Pro
2615 2620 2625
ctg ggt tac aag gaa gaa aat aac aca ggt gaa tgt tgt ggg aga 7929
Leu Gly Tyr Lys Glu Glu Asn Asn Thr Gly Glu Cys Cys Gly Arg
2630 2635 2640
tgt ttg cct acg gct tgc acc att cag cta aga gga gga cag atc 7974
Cys Leu Pro Thr Ala Cys Thr Ile Gln Leu Arg Gly Gly Gln Ile
2645 2650 2655
atg aca ctg aag cgt gat gag acg ctc cag gat ggc tgt gat act 8019
Met Thr Leu Lys Arg Asp Glu Thr Leu Gln Asp Gly Cys Asp Thr
2660 2665 2670
cac ttc tgc aag gtc aat gag aga gga gag tac ttc tgg gag aag 8064
His Phe Cys Lys Val Asn Glu Arg Gly Glu Tyr Phe Trp Glu Lys
2675 2680 2685
agg gtc aca ggc tgc cca ccc ttt gat gaa cac aag tgt ctg gct 8109
Arg Val Thr Gly Cys Pro Pro Phe Asp Glu His Lys Cys Leu Ala
2690 2695 2700
gag gga ggt aaa att atg aaa att cca ggc acc tgc tgt gac aca 8154
Glu Gly Gly Lys Ile Met Lys Ile Pro Gly Thr Cys Cys Asp Thr
2705 2710 2715
tgt gag gag cct gag tgc aac gac atc act gcc agg ctg cag tat 8199
Cys Glu Glu Pro Glu Cys Asn Asp Ile Thr Ala Arg Leu Gln Tyr
2720 2725 2730
gtc aag gtg gga agc tgt aag tct gaa gta gag gtg gat atc cac 8244
Val Lys Val Gly Ser Cys Lys Ser Glu Val Glu Val Asp Ile His
2735 2740 2745
tac tgc cag ggc aaa tgt gcc agc aaa gcc atg tac tcc att gac 8289
Tyr Cys Gln Gly Lys Cys Ala Ser Lys Ala Met Tyr Ser Ile Asp
2750 2755 2760
atc aac gat gtg cag gac cag tgc tcc tgc tgc tct ccg aca cgg 8334
Ile Asn Asp Val Gln Asp Gln Cys Ser Cys Cys Ser Pro Thr Arg
2765 2770 2775
acg gag ccc atg cag gtg gcc ctg cac tgc acc aat ggc tct gtt 8379
Thr Glu Pro Met Gln Val Ala Leu His Cys Thr Asn Gly Ser Val
2780 2785 2790
gtg tac cat gag gtt ctc aat gcc atg gag tgc aaa tgc tcc ccc 8424
Val Tyr His Glu Val Leu Asn Ala Met Glu Cys Lys Cys Ser Pro
2795 2800 2805
agg aag tgc agc aag tga 8442
Arg Lys Cys Ser Lys
2810
<210> 2
<211> 2813
<212> PRT
<213> 智人
<400> 2
Met Ile Pro Ala Arg Phe Ala Gly Val Leu Leu Ala Leu Ala Leu Ile
1 5 10 15
Leu Pro Gly Thr Leu Cys Ala Glu Gly Thr Arg Gly Arg Ser Ser Thr
20 25 30
Ala Arg Cys Ser Leu Phe Gly Ser Asp Phe Val Asn Thr Phe Asp Gly
35 40 45
Ser Met Tyr Ser Phe Ala Gly Tyr Cys Ser Tyr Leu Leu Ala Gly Gly
50 55 60
Cys Gln Lys Arg Ser Phe Ser Ile Ile Gly Asp Phe Gln Asn Gly Lys
65 70 75 80
Arg Val Ser Leu Ser Val Tyr Leu Gly Glu Phe Phe Asp Ile His Leu
85 90 95
Phe Val Asn Gly Thr Val Thr Gln Gly Asp Gln Arg Val Ser Met Pro
100 105 110
Tyr Ala Ser Lys Gly Leu Tyr Leu Glu Thr Glu Ala Gly Tyr Tyr Lys
115 120 125
Leu Ser Gly Glu Ala Tyr Gly Phe Val Ala Arg Ile Asp Gly Ser Gly
130 135 140
Asn Phe Gln Val Leu Leu Ser Asp Arg Tyr Phe Asn Lys Thr Cys Gly
145 150 155 160
Leu Cys Gly Asn Phe Asn Ile Phe Ala Glu Asp Asp Phe Met Thr Gln
165 170 175
Glu Gly Thr Leu Thr Ser Asp Pro Tyr Asp Phe Ala Asn Ser Trp Ala
180 185 190
Leu Ser Ser Gly Glu Gln Trp Cys Glu Arg Ala Ser Pro Pro Ser Ser
195 200 205
Ser Cys Asn Ile Ser Ser Gly Glu Met Gln Lys Gly Leu Trp Glu Gln
210 215 220
Cys Gln Leu Leu Lys Ser Thr Ser Val Phe Ala Arg Cys His Pro Leu
225 230 235 240
Val Asp Pro Glu Pro Phe Val Ala Leu Cys Glu Lys Thr Leu Cys Glu
245 250 255
Cys Ala Gly Gly Leu Glu Cys Ala Cys Pro Ala Leu Leu Glu Tyr Ala
260 265 270
Arg Thr Cys Ala Gln Glu Gly Met Val Leu Tyr Gly Trp Thr Asp His
275 280 285
Ser Ala Cys Ser Pro Val Cys Pro Ala Gly Met Glu Tyr Arg Gln Cys
290 295 300
Val Ser Pro Cys Ala Arg Thr Cys Gln Ser Leu His Ile Asn Glu Met
305 310 315 320
Cys Gln Glu Arg Cys Val Asp Gly Cys Ser Cys Pro Glu Gly Gln Leu
325 330 335
Leu Asp Glu Gly Leu Cys Val Glu Ser Thr Glu Cys Pro Cys Val His
340 345 350
Ser Gly Lys Arg Tyr Pro Pro Gly Thr Ser Leu Ser Arg Asp Cys Asn
355 360 365
Thr Cys Ile Cys Arg Asn Ser Gln Trp Ile Cys Ser Asn Glu Glu Cys
370 375 380
Pro Gly Glu Cys Leu Val Thr Gly Gln Ser His Phe Lys Ser Phe Asp
385 390 395 400
Asn Arg Tyr Phe Thr Phe Ser Gly Ile Cys Gln Tyr Leu Leu Ala Arg
405 410 415
Asp Cys Gln Asp His Ser Phe Ser Ile Val Ile Glu Thr Val Gln Cys
420 425 430
Ala Asp Asp Arg Asp Ala Val Cys Thr Arg Ser Val Thr Val Arg Leu
435 440 445
Pro Gly Leu His Asn Ser Leu Val Lys Leu Lys His Gly Ala Gly Val
450 455 460
Ala Met Asp Gly Gln Asp Val Gln Leu Pro Leu Leu Lys Gly Asp Leu
465 470 475 480
Arg Ile Gln His Thr Val Thr Ala Ser Val Arg Leu Ser Tyr Gly Glu
485 490 495
Asp Leu Gln Met Asp Trp Asp Gly Arg Gly Arg Leu Leu Val Lys Leu
500 505 510
Ser Pro Val Tyr Ala Gly Lys Thr Cys Gly Leu Cys Gly Asn Tyr Asn
515 520 525
Gly Asn Gln Gly Asp Asp Phe Leu Thr Pro Ser Gly Leu Ala Glu Pro
530 535 540
Arg Val Glu Asp Phe Gly Asn Ala Trp Lys Leu His Gly Asp Cys Gln
545 550 555 560
Asp Leu Gln Lys Gln His Ser Asp Pro Cys Ala Leu Asn Pro Arg Met
565 570 575
Thr Arg Phe Ser Glu Glu Ala Cys Ala Val Leu Thr Ser Pro Thr Phe
580 585 590
Glu Ala Cys His Arg Ala Val Ser Pro Leu Pro Tyr Leu Arg Asn Cys
595 600 605
Arg Tyr Asp Val Cys Ser Cys Ser Asp Gly Arg Glu Cys Leu Cys Gly
610 615 620
Ala Leu Ala Ser Tyr Ala Ala Ala Cys Ala Gly Arg Gly Val Arg Val
625 630 635 640
Ala Trp Arg Glu Pro Gly Arg Cys Glu Leu Asn Cys Pro Lys Gly Gln
645 650 655
Val Tyr Leu Gln Cys Gly Thr Pro Cys Asn Leu Thr Cys Arg Ser Leu
660 665 670
Ser Tyr Pro Asp Glu Glu Cys Asn Glu Ala Cys Leu Glu Gly Cys Phe
675 680 685
Cys Pro Pro Gly Leu Tyr Met Asp Glu Arg Gly Asp Cys Val Pro Lys
690 695 700
Ala Gln Cys Pro Cys Tyr Tyr Asp Gly Glu Ile Phe Gln Pro Glu Asp
705 710 715 720
Ile Phe Ser Asp His His Thr Met Cys Tyr Cys Glu Asp Gly Phe Met
725 730 735
His Cys Thr Met Ser Gly Val Pro Gly Ser Leu Leu Pro Asp Ala Val
740 745 750
Leu Ser Ser Pro Leu Ser His Arg Ser Lys Arg Ser Leu Ser Cys Arg
755 760 765
Pro Pro Met Val Lys Leu Val Cys Pro Ala Asp Asn Leu Arg Ala Glu
770 775 780
Gly Leu Glu Cys Thr Lys Thr Cys Gln Asn Tyr Asp Leu Glu Cys Met
785 790 795 800
Ser Met Gly Cys Val Ser Gly Cys Leu Cys Pro Pro Gly Met Val Arg
805 810 815
His Glu Asn Arg Cys Val Ala Leu Glu Arg Cys Pro Cys Phe His Gln
820 825 830
Gly Lys Glu Tyr Ala Pro Gly Glu Thr Val Lys Ile Gly Cys Asn Thr
835 840 845
Cys Val Cys Arg Asp Arg Lys Trp Asn Cys Thr Asp His Val Cys Asp
850 855 860
Ala Thr Cys Ser Thr Ile Gly Met Ala His Tyr Leu Thr Phe Asp Gly
865 870 875 880
Leu Lys Tyr Leu Phe Pro Gly Glu Cys Gln Tyr Val Leu Val Gln Asp
885 890 895
Tyr Cys Gly Ser Asn Pro Gly Thr Phe Arg Ile Leu Val Gly Asn Lys
900 905 910
Gly Cys Ser His Pro Ser Val Lys Cys Lys Lys Arg Val Thr Ile Leu
915 920 925
Val Glu Gly Gly Glu Ile Glu Leu Phe Asp Gly Glu Val Asn Val Lys
930 935 940
Arg Pro Met Lys Asp Glu Thr His Phe Glu Val Val Glu Ser Gly Arg
945 950 955 960
Tyr Ile Ile Leu Leu Leu Gly Lys Ala Leu Ser Val Val Trp Asp Arg
965 970 975
His Leu Ser Ile Ser Val Val Leu Lys Gln Thr Tyr Gln Glu Lys Val
980 985 990
Cys Gly Leu Cys Gly Asn Phe Asp Gly Ile Gln Asn Asn Asp Leu Thr
995 1000 1005
Ser Ser Asn Leu Gln Val Glu Glu Asp Pro Val Asp Phe Gly Asn
1010 1015 1020
Ser Trp Lys Val Ser Ser Gln Cys Ala Asp Thr Arg Lys Val Pro
1025 1030 1035
Leu Asp Ser Ser Pro Ala Thr Cys His Asn Asn Ile Met Lys Gln
1040 1045 1050
Thr Met Val Asp Ser Ser Cys Arg Ile Leu Thr Ser Asp Val Phe
1055 1060 1065
Gln Asp Cys Asn Lys Leu Val Asp Pro Glu Pro Tyr Leu Asp Val
1070 1075 1080
Cys Ile Tyr Asp Thr Cys Ser Cys Glu Ser Ile Gly Asp Cys Ala
1085 1090 1095
Cys Phe Cys Asp Thr Ile Ala Ala Tyr Ala His Val Cys Ala Gln
1100 1105 1110
His Gly Lys Val Val Thr Trp Arg Thr Ala Thr Leu Cys Pro Gln
1115 1120 1125
Ser Cys Glu Glu Arg Asn Leu Arg Glu Asn Gly Tyr Glu Cys Glu
1130 1135 1140
Trp Arg Tyr Asn Ser Cys Ala Pro Ala Cys Gln Val Thr Cys Gln
1145 1150 1155
His Pro Glu Pro Leu Ala Cys Pro Val Gln Cys Val Glu Gly Cys
1160 1165 1170
His Ala His Cys Pro Pro Gly Lys Ile Leu Asp Glu Leu Leu Gln
1175 1180 1185
Thr Cys Val Asp Pro Glu Asp Cys Pro Val Cys Glu Val Ala Gly
1190 1195 1200
Arg Arg Phe Ala Ser Gly Lys Lys Val Thr Leu Asn Pro Ser Asp
1205 1210 1215
Pro Glu His Cys Gln Ile Cys His Cys Asp Val Val Asn Leu Thr
1220 1225 1230
Cys Glu Ala Cys Gln Glu Pro Gly Gly Leu Val Val Pro Pro Thr
1235 1240 1245
Asp Ala Pro Val Ser Pro Thr Thr Leu Tyr Val Glu Asp Ile Ser
1250 1255 1260
Glu Pro Pro Leu His Asp Phe Tyr Cys Ser Arg Leu Leu Asp Leu
1265 1270 1275
Val Phe Leu Leu Asp Gly Ser Ser Arg Leu Ser Glu Ala Glu Phe
1280 1285 1290
Glu Val Leu Lys Ala Phe Val Val Asp Met Met Glu Arg Leu Arg
1295 1300 1305
Ile Ser Gln Lys Trp Val Arg Val Ala Val Val Glu Tyr His Asp
1310 1315 1320
Gly Ser His Ala Tyr Ile Gly Leu Lys Asp Arg Lys Arg Pro Ser
1325 1330 1335
Glu Leu Arg Arg Ile Ala Ser Gln Val Lys Tyr Ala Gly Ser Gln
1340 1345 1350
Val Ala Ser Thr Ser Glu Val Leu Lys Tyr Thr Leu Phe Gln Ile
1355 1360 1365
Phe Ser Lys Ile Asp Arg Pro Glu Ala Ser Arg Ile Ala Leu Leu
1370 1375 1380
Leu Met Ala Ser Gln Glu Pro Gln Arg Met Ser Arg Asn Phe Val
1385 1390 1395
Arg Tyr Val Gln Gly Leu Lys Lys Lys Lys Val Ile Val Ile Pro
1400 1405 1410
Val Gly Ile Gly Pro His Ala Asn Leu Lys Gln Ile Arg Leu Ile
1415 1420 1425
Glu Lys Gln Ala Pro Glu Asn Lys Ala Phe Val Leu Ser Ser Val
1430 1435 1440
Asp Glu Leu Glu Gln Gln Arg Asp Glu Ile Val Ser Tyr Leu Cys
1445 1450 1455
Asp Leu Ala Pro Glu Ala Pro Pro Pro Thr Leu Pro Pro His Met
1460 1465 1470
Ala Gln Val Thr Val Gly Pro Gly Leu Leu Gly Val Ser Thr Leu
1475 1480 1485
Gly Pro Lys Arg Asn Ser Met Val Leu Asp Val Ala Phe Val Leu
1490 1495 1500
Glu Gly Ser Asp Lys Ile Gly Glu Ala Asp Phe Asn Arg Ser Lys
1505 1510 1515
Glu Phe Met Glu Glu Val Ile Gln Arg Met Asp Val Gly Gln Asp
1520 1525 1530
Ser Ile His Val Thr Val Leu Gln Tyr Ser Tyr Met Val Thr Val
1535 1540 1545
Glu Tyr Pro Phe Ser Glu Ala Gln Ser Lys Gly Asp Ile Leu Gln
1550 1555 1560
Arg Val Arg Glu Ile Arg Tyr Gln Gly Gly Asn Arg Thr Asn Thr
1565 1570 1575
Gly Leu Ala Leu Arg Tyr Leu Ser Asp His Ser Phe Leu Val Ser
1580 1585 1590
Gln Gly Asp Arg Glu Gln Ala Pro Asn Leu Val Tyr Met Val Thr
1595 1600 1605
Gly Asn Pro Ala Ser Asp Glu Ile Lys Arg Leu Pro Gly Asp Ile
1610 1615 1620
Gln Val Val Pro Ile Gly Val Gly Pro Asn Ala Asn Val Gln Glu
1625 1630 1635
Leu Glu Arg Ile Gly Trp Pro Asn Ala Pro Ile Leu Ile Gln Asp
1640 1645 1650
Phe Glu Thr Leu Pro Arg Glu Ala Pro Asp Leu Val Leu Gln Arg
1655 1660 1665
Cys Cys Ser Gly Glu Gly Leu Gln Ile Pro Thr Leu Ser Pro Ala
1670 1675 1680
Pro Asp Cys Ser Gln Pro Leu Asp Val Ile Leu Leu Leu Asp Gly
1685 1690 1695
Ser Ser Ser Phe Pro Ala Ser Tyr Phe Asp Glu Met Lys Ser Phe
1700 1705 1710
Ala Lys Ala Phe Ile Ser Lys Ala Asn Ile Gly Pro Arg Leu Thr
1715 1720 1725
Gln Val Ser Val Leu Gln Tyr Gly Ser Ile Thr Thr Ile Asp Val
1730 1735 1740
Pro Trp Asn Val Val Pro Glu Lys Ala His Leu Leu Ser Leu Val
1745 1750 1755
Asp Val Met Gln Arg Glu Gly Gly Pro Ser Gln Ile Gly Asp Ala
1760 1765 1770
Leu Gly Phe Ala Val Arg Tyr Leu Thr Ser Glu Met His Gly Ala
1775 1780 1785
Arg Pro Gly Ala Ser Lys Ala Val Val Ile Leu Val Thr Asp Val
1790 1795 1800
Ser Val Asp Ser Val Asp Ala Ala Ala Asp Ala Ala Arg Ser Asn
1805 1810 1815
Arg Val Thr Val Phe Pro Ile Gly Ile Gly Asp Arg Tyr Asp Ala
1820 1825 1830
Ala Gln Leu Arg Ile Leu Ala Gly Pro Ala Gly Asp Ser Asn Val
1835 1840 1845
Val Lys Leu Gln Arg Ile Glu Asp Leu Pro Thr Met Val Thr Leu
1850 1855 1860
Gly Asn Ser Phe Leu His Lys Leu Cys Ser Gly Phe Val Arg Ile
1865 1870 1875
Cys Met Asp Glu Asp Gly Asn Glu Lys Arg Pro Gly Asp Val Trp
1880 1885 1890
Thr Leu Pro Asp Gln Cys His Thr Val Thr Cys Gln Pro Asp Gly
1895 1900 1905
Gln Thr Leu Leu Lys Ser His Arg Val Asn Cys Asp Arg Gly Leu
1910 1915 1920
Arg Pro Ser Cys Pro Asn Ser Gln Ser Pro Val Lys Val Glu Glu
1925 1930 1935
Thr Cys Gly Cys Arg Trp Thr Cys Pro Cys Val Cys Thr Gly Ser
1940 1945 1950
Ser Thr Arg His Ile Val Thr Phe Asp Gly Gln Asn Phe Lys Leu
1955 1960 1965
Thr Gly Ser Cys Ser Tyr Val Leu Phe Gln Asn Lys Glu Gln Asp
1970 1975 1980
Leu Glu Val Ile Leu His Asn Gly Ala Cys Ser Pro Gly Ala Arg
1985 1990 1995
Gln Gly Cys Met Lys Ser Ile Glu Val Lys His Ser Ala Leu Ser
2000 2005 2010
Val Glu Leu His Ser Asp Met Glu Val Thr Val Asn Gly Arg Leu
2015 2020 2025
Val Ser Val Pro Tyr Val Gly Gly Asn Met Glu Val Asn Val Tyr
2030 2035 2040
Gly Ala Ile Met His Glu Val Arg Phe Asn His Leu Gly His Ile
2045 2050 2055
Phe Thr Phe Thr Pro Gln Asn Asn Glu Phe Gln Leu Gln Leu Ser
2060 2065 2070
Pro Lys Thr Phe Ala Ser Lys Thr Tyr Gly Leu Cys Gly Ile Cys
2075 2080 2085
Asp Glu Asn Gly Ala Asn Asp Phe Met Leu Arg Asp Gly Thr Val
2090 2095 2100
Thr Thr Asp Trp Lys Thr Leu Val Gln Glu Trp Thr Val Gln Arg
2105 2110 2115
Pro Gly Gln Thr Cys Gln Pro Ile Leu Glu Glu Gln Cys Leu Val
2120 2125 2130
Pro Asp Ser Ser His Cys Gln Val Leu Leu Leu Pro Leu Phe Ala
2135 2140 2145
Glu Cys His Lys Val Leu Ala Pro Ala Thr Phe Tyr Ala Ile Cys
2150 2155 2160
Gln Gln Asp Ser Cys His Gln Glu Gln Val Cys Glu Val Ile Ala
2165 2170 2175
Ser Tyr Ala His Leu Cys Arg Thr Asn Gly Val Cys Val Asp Trp
2180 2185 2190
Arg Thr Pro Asp Phe Cys Ala Met Ser Cys Pro Pro Ser Leu Val
2195 2200 2205
Tyr Asn His Cys Glu His Gly Cys Pro Arg His Cys Asp Gly Asn
2210 2215 2220
Val Ser Ser Cys Gly Asp His Pro Ser Glu Gly Cys Phe Cys Pro
2225 2230 2235
Pro Asp Lys Val Met Leu Glu Gly Ser Cys Val Pro Glu Glu Ala
2240 2245 2250
Cys Thr Gln Cys Ile Gly Glu Asp Gly Val Gln His Gln Phe Leu
2255 2260 2265
Glu Ala Trp Val Pro Asp His Gln Pro Cys Gln Ile Cys Thr Cys
2270 2275 2280
Leu Ser Gly Arg Lys Val Asn Cys Thr Thr Gln Pro Cys Pro Thr
2285 2290 2295
Ala Lys Ala Pro Thr Cys Gly Leu Cys Glu Val Ala Arg Leu Arg
2300 2305 2310
Gln Asn Ala Asp Gln Cys Cys Pro Glu Tyr Glu Cys Val Cys Asp
2315 2320 2325
Pro Val Ser Cys Asp Leu Pro Pro Val Pro His Cys Glu Arg Gly
2330 2335 2340
Leu Gln Pro Thr Leu Thr Asn Pro Gly Glu Cys Arg Pro Asn Phe
2345 2350 2355
Thr Cys Ala Cys Arg Lys Glu Glu Cys Lys Arg Val Ser Pro Pro
2360 2365 2370
Ser Cys Pro Pro His Arg Leu Pro Thr Leu Arg Lys Thr Gln Cys
2375 2380 2385
Cys Asp Glu Tyr Glu Cys Ala Cys Asn Cys Val Asn Ser Thr Val
2390 2395 2400
Ser Cys Pro Leu Gly Tyr Leu Ala Ser Thr Ala Thr Asn Asp Cys
2405 2410 2415
Gly Cys Thr Thr Thr Thr Cys Leu Pro Asp Lys Val Cys Val His
2420 2425 2430
Arg Ser Thr Ile Tyr Pro Val Gly Gln Phe Trp Glu Glu Gly Cys
2435 2440 2445
Asp Val Cys Thr Cys Thr Asp Met Glu Asp Ala Val Met Gly Leu
2450 2455 2460
Arg Val Ala Gln Cys Ser Gln Lys Pro Cys Glu Asp Ser Cys Arg
2465 2470 2475
Ser Gly Phe Thr Tyr Val Leu His Glu Gly Glu Cys Cys Gly Arg
2480 2485 2490
Cys Leu Pro Ser Ala Cys Glu Val Val Thr Gly Ser Pro Arg Gly
2495 2500 2505
Asp Ser Gln Ser Ser Trp Lys Ser Val Gly Ser Gln Trp Ala Ser
2510 2515 2520
Pro Glu Asn Pro Cys Leu Ile Asn Glu Cys Val Arg Val Lys Glu
2525 2530 2535
Glu Val Phe Ile Gln Gln Arg Asn Val Ser Cys Pro Gln Leu Glu
2540 2545 2550
Val Pro Val Cys Pro Ser Gly Phe Gln Leu Ser Cys Lys Thr Ser
2555 2560 2565
Ala Cys Cys Pro Ser Cys Arg Cys Glu Arg Met Glu Ala Cys Met
2570 2575 2580
Leu Asn Gly Thr Val Ile Gly Pro Gly Lys Thr Val Met Ile Asp
2585 2590 2595
Val Cys Thr Thr Cys Arg Cys Met Val Gln Val Gly Val Ile Ser
2600 2605 2610
Gly Phe Lys Leu Glu Cys Arg Lys Thr Thr Cys Asn Pro Cys Pro
2615 2620 2625
Leu Gly Tyr Lys Glu Glu Asn Asn Thr Gly Glu Cys Cys Gly Arg
2630 2635 2640
Cys Leu Pro Thr Ala Cys Thr Ile Gln Leu Arg Gly Gly Gln Ile
2645 2650 2655
Met Thr Leu Lys Arg Asp Glu Thr Leu Gln Asp Gly Cys Asp Thr
2660 2665 2670
His Phe Cys Lys Val Asn Glu Arg Gly Glu Tyr Phe Trp Glu Lys
2675 2680 2685
Arg Val Thr Gly Cys Pro Pro Phe Asp Glu His Lys Cys Leu Ala
2690 2695 2700
Glu Gly Gly Lys Ile Met Lys Ile Pro Gly Thr Cys Cys Asp Thr
2705 2710 2715
Cys Glu Glu Pro Glu Cys Asn Asp Ile Thr Ala Arg Leu Gln Tyr
2720 2725 2730
Val Lys Val Gly Ser Cys Lys Ser Glu Val Glu Val Asp Ile His
2735 2740 2745
Tyr Cys Gln Gly Lys Cys Ala Ser Lys Ala Met Tyr Ser Ile Asp
2750 2755 2760
Ile Asn Asp Val Gln Asp Gln Cys Ser Cys Cys Ser Pro Thr Arg
2765 2770 2775
Thr Glu Pro Met Gln Val Ala Leu His Cys Thr Asn Gly Ser Val
2780 2785 2790
Val Tyr His Glu Val Leu Asn Ala Met Glu Cys Lys Cys Ser Pro
2795 2800 2805
Arg Lys Cys Ser Lys
2810
<210> 3
<211> 2813
<212> PRT
<213> 智人
<220>
<221> 肽
<222> (1)..(2813)
<400> 3
Met Ile Pro Ala Arg Phe Ala Gly Val Leu Leu Ala Leu Ala Leu Ile
1 5 10 15
Leu Pro Gly Thr Leu Cys Ala Glu Gly Thr Arg Gly Arg Ser Ser Thr
20 25 30
Ala Arg Cys Ser Leu Phe Gly Ser Asp Phe Val Asn Thr Phe Asp Gly
35 40 45
Ser Met Tyr Ser Phe Ala Gly Tyr Cys Ser Tyr Leu Leu Ala Gly Gly
50 55 60
Cys Gln Lys Arg Ser Phe Ser Ile Ile Gly Asp Phe Gln Asn Gly Lys
65 70 75 80
Arg Val Ser Leu Ser Val Tyr Leu Gly Glu Phe Phe Asp Ile His Leu
85 90 95
Phe Val Asn Gly Thr Val Thr Gln Gly Asp Gln Arg Val Ser Met Pro
100 105 110
Tyr Ala Ser Lys Gly Leu Tyr Leu Glu Thr Glu Ala Gly Tyr Tyr Lys
115 120 125
Leu Ser Gly Glu Ala Tyr Gly Phe Val Ala Arg Ile Asp Gly Ser Gly
130 135 140
Asn Phe Gln Val Leu Leu Ser Asp Arg Tyr Phe Asn Lys Thr Cys Gly
145 150 155 160
Leu Cys Gly Asn Phe Asn Ile Phe Ala Glu Asp Asp Phe Met Thr Gln
165 170 175
Glu Gly Thr Leu Thr Ser Asp Pro Tyr Asp Phe Ala Asn Ser Trp Ala
180 185 190
Leu Ser Ser Gly Glu Gln Trp Cys Glu Arg Ala Ser Pro Pro Ser Ser
195 200 205
Ser Cys Asn Ile Ser Ser Gly Glu Met Gln Lys Gly Leu Trp Glu Gln
210 215 220
Cys Gln Leu Leu Lys Ser Thr Ser Val Phe Ala Arg Cys His Pro Leu
225 230 235 240
Val Asp Pro Glu Pro Phe Val Ala Leu Cys Glu Lys Thr Leu Cys Glu
245 250 255
Cys Ala Gly Gly Leu Glu Cys Ala Cys Pro Ala Leu Leu Glu Tyr Ala
260 265 270
Arg Thr Cys Ala Gln Glu Gly Met Val Leu Tyr Gly Trp Thr Asp His
275 280 285
Ser Ala Cys Ser Pro Val Cys Pro Ala Gly Met Glu Tyr Arg Gln Cys
290 295 300
Val Ser Pro Cys Ala Arg Thr Cys Gln Ser Leu His Ile Asn Glu Met
305 310 315 320
Cys Gln Glu Arg Cys Val Asp Gly Cys Ser Cys Pro Glu Gly Gln Leu
325 330 335
Leu Asp Glu Gly Leu Cys Val Glu Ser Thr Glu Cys Pro Cys Val His
340 345 350
Ser Gly Lys Arg Tyr Pro Pro Gly Thr Ser Leu Ser Arg Asp Cys Asn
355 360 365
Thr Cys Ile Cys Arg Asn Ser Gln Trp Ile Cys Ser Asn Glu Glu Cys
370 375 380
Pro Gly Glu Cys Leu Val Thr Gly Gln Ser His Phe Lys Ser Phe Asp
385 390 395 400
Asn Arg Tyr Phe Thr Phe Ser Gly Ile Cys Gln Tyr Leu Leu Ala Arg
405 410 415
Asp Cys Gln Asp His Ser Phe Ser Ile Val Ile Glu Thr Val Gln Cys
420 425 430
Ala Asp Asp Arg Asp Ala Val Cys Thr Arg Ser Val Thr Val Arg Leu
435 440 445
Pro Gly Leu His Asn Ser Leu Val Lys Leu Lys His Gly Ala Gly Val
450 455 460
Ala Met Asp Gly Gln Asp Val Gln Leu Pro Leu Leu Lys Gly Asp Leu
465 470 475 480
Arg Ile Gln His Thr Val Thr Ala Ser Val Arg Leu Ser Tyr Gly Glu
485 490 495
Asp Leu Gln Met Asp Trp Asp Gly Arg Gly Arg Leu Leu Val Lys Leu
500 505 510
Ser Pro Val Tyr Ala Gly Lys Thr Cys Gly Leu Cys Gly Asn Tyr Asn
515 520 525
Gly Asn Gln Gly Asp Asp Phe Leu Thr Pro Ser Gly Leu Ala Glu Pro
530 535 540
Arg Val Glu Asp Phe Gly Asn Ala Trp Lys Leu His Gly Asp Cys Gln
545 550 555 560
Asp Leu Gln Lys Gln His Ser Asp Pro Cys Ala Leu Asn Pro Arg Met
565 570 575
Thr Arg Phe Ser Glu Glu Ala Cys Ala Val Leu Thr Ser Pro Thr Phe
580 585 590
Glu Ala Cys His Arg Ala Val Ser Pro Leu Pro Tyr Leu Arg Asn Cys
595 600 605
Arg Tyr Asp Val Cys Ser Cys Ser Asp Gly Arg Glu Cys Leu Cys Gly
610 615 620
Ala Leu Ala Ser Tyr Ala Ala Ala Cys Ala Gly Arg Gly Val Arg Val
625 630 635 640
Ala Trp Arg Glu Pro Gly Arg Cys Glu Leu Asn Cys Pro Lys Gly Gln
645 650 655
Val Tyr Leu Gln Cys Gly Thr Pro Cys Asn Leu Thr Cys Arg Ser Leu
660 665 670
Ser Tyr Pro Asp Glu Glu Cys Asn Glu Ala Cys Leu Glu Gly Cys Phe
675 680 685
Cys Pro Pro Gly Leu Tyr Met Asp Glu Arg Gly Asp Cys Val Pro Lys
690 695 700
Ala Gln Cys Pro Cys Tyr Tyr Asp Gly Glu Ile Phe Gln Pro Glu Asp
705 710 715 720
Ile Phe Ser Asp His His Thr Met Cys Tyr Cys Glu Asp Gly Phe Met
725 730 735
His Cys Thr Met Ser Gly Val Pro Gly Ser Leu Leu Pro Asp Ala Val
740 745 750
Leu Ser Ser Pro Leu Ser His Arg Ser Lys Arg Ser Leu Ser Cys Arg
755 760 765
Pro Pro Met Val Lys Leu Val Cys Pro Ala Asp Asn Leu Arg Ala Glu
770 775 780
Gly Leu Glu Cys Thr Lys Thr Cys Gln Asn Tyr Asp Leu Glu Cys Met
785 790 795 800
Ser Met Gly Cys Val Ser Gly Cys Leu Cys Pro Pro Gly Met Val Arg
805 810 815
His Glu Asn Arg Cys Val Ala Leu Glu Arg Cys Pro Cys Phe His Gln
820 825 830
Gly Lys Glu Tyr Ala Pro Gly Glu Thr Val Lys Ile Gly Cys Asn Thr
835 840 845
Cys Val Cys Arg Asp Arg Lys Trp Asn Cys Thr Asp His Val Cys Asp
850 855 860
Ala Thr Cys Ser Thr Ile Gly Met Ala His Tyr Leu Thr Phe Asp Gly
865 870 875 880
Leu Lys Tyr Leu Phe Pro Gly Glu Cys Gln Tyr Val Leu Val Gln Asp
885 890 895
Tyr Cys Gly Ser Asn Pro Gly Thr Phe Arg Ile Leu Val Gly Asn Lys
900 905 910
Gly Cys Ser His Pro Ser Val Lys Cys Lys Lys Arg Val Thr Ile Leu
915 920 925
Val Glu Gly Gly Glu Ile Glu Leu Phe Asp Gly Glu Val Asn Val Lys
930 935 940
Arg Pro Met Lys Asp Glu Thr His Phe Glu Val Val Glu Ser Gly Arg
945 950 955 960
Tyr Ile Ile Leu Leu Leu Gly Lys Ala Leu Ser Val Val Trp Asp Arg
965 970 975
His Leu Ser Ile Ser Val Val Leu Lys Gln Thr Tyr Gln Glu Lys Val
980 985 990
Cys Gly Leu Cys Gly Asn Phe Asp Gly Ile Gln Asn Asn Asp Leu Thr
995 1000 1005
Ser Ser Asn Leu Gln Val Glu Glu Asp Pro Val Asp Phe Gly Asn
1010 1015 1020
Ser Trp Lys Val Ser Ser Gln Cys Ala Asp Thr Arg Lys Val Pro
1025 1030 1035
Leu Asp Ser Ser Pro Ala Thr Cys His Asn Asn Ile Met Lys Gln
1040 1045 1050
Thr Met Val Asp Ser Ser Cys Arg Ile Leu Thr Ser Asp Val Phe
1055 1060 1065
Gln Asp Cys Asn Lys Leu Val Asp Pro Glu Pro Tyr Leu Asp Val
1070 1075 1080
Cys Ile Tyr Asp Thr Cys Ser Cys Glu Ser Ile Gly Asp Cys Ala
1085 1090 1095
Cys Phe Cys Asp Thr Ile Ala Ala Tyr Ala His Val Cys Ala Gln
1100 1105 1110
His Gly Lys Val Val Thr Trp Arg Thr Ala Thr Leu Cys Pro Gln
1115 1120 1125
Ser Cys Glu Glu Arg Asn Leu Arg Glu Asn Gly Tyr Glu Cys Glu
1130 1135 1140
Trp Arg Tyr Asn Ser Cys Ala Pro Ala Cys Gln Val Thr Cys Gln
1145 1150 1155
His Pro Glu Pro Leu Ala Cys Pro Val Gln Cys Val Glu Gly Cys
1160 1165 1170
His Ala His Cys Pro Pro Gly Lys Ile Leu Asp Glu Leu Leu Gln
1175 1180 1185
Thr Cys Val Asp Pro Glu Asp Cys Pro Val Cys Glu Val Ala Gly
1190 1195 1200
Arg Arg Phe Ala Ser Gly Lys Lys Val Thr Leu Asn Pro Ser Asp
1205 1210 1215
Pro Glu His Cys Gln Ile Cys His Cys Asp Val Val Asn Leu Thr
1220 1225 1230
Cys Glu Ala Cys Gln Glu Pro Gly Gly Leu Val Val Pro Pro Thr
1235 1240 1245
Asp Ala Pro Val Ser Pro Thr Thr Leu Tyr Val Glu Asp Ile Ser
1250 1255 1260
Glu Pro Pro Leu His Asp Phe Tyr Cys Ser Arg Leu Leu Asp Leu
1265 1270 1275
Val Phe Leu Leu Asp Gly Ser Ser Arg Leu Ser Glu Ala Glu Phe
1280 1285 1290
Glu Val Leu Lys Ala Phe Val Val Asp Met Met Glu Arg Leu Arg
1295 1300 1305
Ile Ser Gln Lys Trp Val Arg Val Ala Val Val Glu Tyr His Asp
1310 1315 1320
Gly Ser His Ala Tyr Ile Gly Leu Lys Asp Arg Lys Arg Pro Ser
1325 1330 1335
Glu Leu Arg Arg Ile Ala Ser Gln Val Lys Tyr Ala Gly Ser Gln
1340 1345 1350
Val Ala Ser Thr Ser Glu Val Leu Lys Tyr Thr Leu Phe Gln Ile
1355 1360 1365
Phe Ser Lys Ile Asp Arg Pro Glu Ala Ser Arg Ile Thr Leu Leu
1370 1375 1380
Leu Met Ala Ser Gln Glu Pro Gln Arg Met Ser Arg Asn Phe Val
1385 1390 1395
Arg Tyr Val Gln Gly Leu Lys Lys Lys Lys Val Ile Val Ile Pro
1400 1405 1410
Val Gly Ile Gly Pro His Ala Asn Leu Lys Gln Ile Arg Leu Ile
1415 1420 1425
Glu Lys Gln Ala Pro Glu Asn Lys Ala Phe Val Leu Ser Ser Val
1430 1435 1440
Asp Glu Leu Glu Gln Gln Arg Asp Glu Ile Val Ser Tyr Leu Cys
1445 1450 1455
Asp Leu Ala Pro Glu Ala Pro Pro Pro Thr Leu Pro Pro Asp Met
1460 1465 1470
Ala Gln Val Thr Val Gly Pro Gly Leu Leu Gly Val Ser Thr Leu
1475 1480 1485
Gly Pro Lys Arg Asn Ser Met Val Leu Asp Val Ala Phe Val Leu
1490 1495 1500
Glu Gly Ser Asp Lys Ile Gly Glu Ala Asp Phe Asn Arg Ser Lys
1505 1510 1515
Glu Phe Met Glu Glu Val Ile Gln Arg Met Asp Val Gly Gln Asp
1520 1525 1530
Ser Ile His Val Thr Val Leu Gln Tyr Ser Tyr Met Val Thr Val
1535 1540 1545
Glu Tyr Pro Phe Ser Glu Ala Gln Ser Lys Gly Asp Ile Leu Gln
1550 1555 1560
Arg Val Arg Glu Ile Arg Tyr Gln Gly Gly Asn Arg Thr Asn Thr
1565 1570 1575
Gly Leu Ala Leu Arg Tyr Leu Ser Asp His Ser Phe Leu Val Ser
1580 1585 1590
Gln Gly Asp Arg Glu Gln Ala Pro Asn Leu Val Tyr Met Val Thr
1595 1600 1605
Gly Asn Pro Ala Ser Asp Glu Ile Lys Arg Leu Pro Gly Asp Ile
1610 1615 1620
Gln Val Val Pro Ile Gly Val Gly Pro Asn Ala Asn Val Gln Glu
1625 1630 1635
Leu Glu Arg Ile Gly Trp Pro Asn Ala Pro Ile Leu Ile Gln Asp
1640 1645 1650
Phe Glu Thr Leu Pro Arg Glu Ala Pro Asp Leu Val Leu Gln Arg
1655 1660 1665
Cys Cys Ser Gly Glu Gly Leu Gln Ile Pro Thr Leu Ser Pro Ala
1670 1675 1680
Pro Asp Cys Ser Gln Pro Leu Asp Val Ile Leu Leu Leu Asp Gly
1685 1690 1695
Ser Ser Ser Phe Pro Ala Ser Tyr Phe Asp Glu Met Lys Ser Phe
1700 1705 1710
Ala Lys Ala Phe Ile Ser Lys Ala Asn Ile Gly Pro Arg Leu Thr
1715 1720 1725
Gln Val Ser Val Leu Gln Tyr Gly Ser Ile Thr Thr Ile Asp Val
1730 1735 1740
Pro Trp Asn Val Val Pro Glu Lys Ala His Leu Leu Ser Leu Val
1745 1750 1755
Asp Val Met Gln Arg Glu Gly Gly Pro Ser Gln Ile Gly Asp Ala
1760 1765 1770
Leu Gly Phe Ala Val Arg Tyr Leu Thr Ser Glu Met His Gly Ala
1775 1780 1785
Arg Pro Gly Ala Ser Lys Ala Val Val Ile Leu Val Thr Asp Val
1790 1795 1800
Ser Val Asp Ser Val Asp Ala Ala Ala Asp Ala Ala Arg Ser Asn
1805 1810 1815
Arg Val Thr Val Phe Pro Ile Gly Ile Gly Asp Arg Tyr Asp Ala
1820 1825 1830
Ala Gln Leu Arg Ile Leu Ala Gly Pro Ala Gly Asp Ser Asn Val
1835 1840 1845
Val Lys Leu Gln Arg Ile Glu Asp Leu Pro Thr Met Val Thr Leu
1850 1855 1860
Gly Asn Ser Phe Leu His Lys Leu Cys Ser Gly Phe Val Arg Ile
1865 1870 1875
Cys Met Asp Glu Asp Gly Asn Glu Lys Arg Pro Gly Asp Val Trp
1880 1885 1890
Thr Leu Pro Asp Gln Cys His Thr Val Thr Cys Gln Pro Asp Gly
1895 1900 1905
Gln Thr Leu Leu Lys Ser His Arg Val Asn Cys Asp Arg Gly Leu
1910 1915 1920
Arg Pro Ser Cys Pro Asn Ser Gln Ser Pro Val Lys Val Glu Glu
1925 1930 1935
Thr Cys Gly Cys Arg Trp Thr Cys Pro Cys Val Cys Thr Gly Ser
1940 1945 1950
Ser Thr Arg His Ile Val Thr Phe Asp Gly Gln Asn Phe Lys Leu
1955 1960 1965
Thr Gly Ser Cys Ser Tyr Val Leu Phe Gln Asn Lys Glu Gln Asp
1970 1975 1980
Leu Glu Val Ile Leu His Asn Gly Ala Cys Ser Pro Gly Ala Arg
1985 1990 1995
Gln Gly Cys Met Lys Ser Ile Glu Val Lys His Ser Ala Leu Ser
2000 2005 2010
Val Glu Leu His Ser Asp Met Glu Val Thr Val Asn Gly Arg Leu
2015 2020 2025
Val Ser Val Pro Tyr Val Gly Gly Asn Met Glu Val Asn Val Tyr
2030 2035 2040
Gly Ala Ile Met His Glu Val Arg Phe Asn His Leu Gly His Ile
2045 2050 2055
Phe Thr Phe Thr Pro Gln Asn Asn Glu Phe Gln Leu Gln Leu Ser
2060 2065 2070
Pro Lys Thr Phe Ala Ser Lys Thr Tyr Gly Leu Cys Gly Ile Cys
2075 2080 2085
Asp Glu Asn Gly Ala Asn Asp Phe Met Leu Arg Asp Gly Thr Val
2090 2095 2100
Thr Thr Asp Trp Lys Thr Leu Val Gln Glu Trp Thr Val Gln Arg
2105 2110 2115
Pro Gly Gln Thr Cys Gln Pro Ile Leu Glu Glu Gln Cys Leu Val
2120 2125 2130
Pro Asp Ser Ser His Cys Gln Val Leu Leu Leu Pro Leu Phe Ala
2135 2140 2145
Glu Cys His Lys Val Leu Ala Pro Ala Thr Phe Tyr Ala Ile Cys
2150 2155 2160
Gln Gln Asp Ser Cys His Gln Glu Gln Val Cys Glu Val Ile Ala
2165 2170 2175
Ser Tyr Ala His Leu Cys Arg Thr Asn Gly Val Cys Val Asp Trp
2180 2185 2190
Arg Thr Pro Asp Phe Cys Ala Met Ser Cys Pro Pro Ser Leu Val
2195 2200 2205
Tyr Asn His Cys Glu His Gly Cys Pro Arg His Cys Asp Gly Asn
2210 2215 2220
Val Ser Ser Cys Gly Asp His Pro Ser Glu Gly Cys Phe Cys Pro
2225 2230 2235
Pro Asp Lys Val Met Leu Glu Gly Ser Cys Val Pro Glu Glu Ala
2240 2245 2250
Cys Thr Gln Cys Ile Gly Glu Asp Gly Val Gln His Gln Phe Leu
2255 2260 2265
Glu Ala Trp Val Pro Asp His Gln Pro Cys Gln Ile Cys Thr Cys
2270 2275 2280
Leu Ser Gly Arg Lys Val Asn Cys Thr Thr Gln Pro Cys Pro Thr
2285 2290 2295
Ala Lys Ala Pro Thr Cys Gly Leu Cys Glu Val Ala Arg Leu Arg
2300 2305 2310
Gln Asn Ala Asp Gln Cys Cys Pro Glu Tyr Glu Cys Val Cys Asp
2315 2320 2325
Pro Val Ser Cys Asp Leu Pro Pro Val Pro His Cys Glu Arg Gly
2330 2335 2340
Leu Gln Pro Thr Leu Thr Asn Pro Gly Glu Cys Arg Pro Asn Phe
2345 2350 2355
Thr Cys Ala Cys Arg Lys Glu Glu Cys Lys Arg Val Ser Pro Pro
2360 2365 2370
Ser Cys Pro Pro His Arg Leu Pro Thr Leu Arg Lys Thr Gln Cys
2375 2380 2385
Cys Asp Glu Tyr Glu Cys Ala Cys Asn Cys Val Asn Ser Thr Val
2390 2395 2400
Ser Cys Pro Leu Gly Tyr Leu Ala Ser Thr Ala Thr Asn Asp Cys
2405 2410 2415
Gly Cys Thr Thr Thr Thr Cys Leu Pro Asp Lys Val Cys Val His
2420 2425 2430
Arg Ser Thr Ile Tyr Pro Val Gly Gln Phe Trp Glu Glu Gly Cys
2435 2440 2445
Asp Val Cys Thr Cys Thr Asp Met Glu Asp Ala Val Met Gly Leu
2450 2455 2460
Arg Val Ala Gln Cys Ser Gln Lys Pro Cys Glu Asp Ser Cys Arg
2465 2470 2475
Ser Gly Phe Thr Tyr Val Leu His Glu Gly Glu Cys Cys Gly Arg
2480 2485 2490
Cys Leu Pro Ser Ala Cys Glu Val Val Thr Gly Ser Pro Arg Gly
2495 2500 2505
Asp Ser Gln Ser Ser Trp Lys Ser Val Gly Ser Gln Trp Ala Ser
2510 2515 2520
Pro Glu Asn Pro Cys Leu Ile Asn Glu Cys Val Arg Val Lys Glu
2525 2530 2535
Glu Val Phe Ile Gln Gln Arg Asn Val Ser Cys Pro Gln Leu Glu
2540 2545 2550
Val Pro Val Cys Pro Ser Gly Phe Gln Leu Ser Cys Lys Thr Ser
2555 2560 2565
Ala Cys Cys Pro Ser Cys Arg Cys Glu Arg Met Glu Ala Cys Met
2570 2575 2580
Leu Asn Gly Thr Val Ile Gly Pro Gly Lys Thr Val Met Ile Asp
2585 2590 2595
Val Cys Thr Thr Cys Arg Cys Met Val Gln Val Gly Val Ile Ser
2600 2605 2610
Gly Phe Lys Leu Glu Cys Arg Lys Thr Thr Cys Asn Pro Cys Pro
2615 2620 2625
Leu Gly Tyr Lys Glu Glu Asn Asn Thr Gly Glu Cys Cys Gly Arg
2630 2635 2640
Cys Leu Pro Thr Ala Cys Thr Ile Gln Leu Arg Gly Gly Gln Ile
2645 2650 2655
Met Thr Leu Lys Arg Asp Glu Thr Leu Gln Asp Gly Cys Asp Thr
2660 2665 2670
His Phe Cys Lys Val Asn Glu Arg Gly Glu Tyr Phe Trp Glu Lys
2675 2680 2685
Arg Val Thr Gly Cys Pro Pro Phe Asp Glu His Lys Cys Leu Ala
2690 2695 2700
Glu Gly Gly Lys Ile Met Lys Ile Pro Gly Thr Cys Cys Asp Thr
2705 2710 2715
Cys Glu Glu Pro Glu Cys Asn Asp Ile Thr Ala Arg Leu Gln Tyr
2720 2725 2730
Val Lys Val Gly Ser Cys Lys Ser Glu Val Glu Val Asp Ile His
2735 2740 2745
Tyr Cys Gln Gly Lys Cys Ala Ser Lys Ala Met Tyr Ser Ile Asp
2750 2755 2760
Ile Asn Asp Val Gln Asp Gln Cys Ser Cys Cys Ser Pro Thr Arg
2765 2770 2775
Thr Glu Pro Met Gln Val Ala Leu His Cys Thr Asn Gly Ser Val
2765 2770 2775
Val Tyr His Glu Val Leu Asn Ala Met Glu Cys Lys Cys Ser Pro
2795 2800 2805
Arg Lys Cys Ser Lys
2810
- 还没有人留言评论。精彩留言会获得点赞!