一种芘基有机半导体激光材料及其制备方法与应用与流程
本发明属于光电材料技术领域,具体涉及一种芘基有机半导体激光材料及其制备方法与应用。
背景技术:
有机半导体材料由于其良好的光学及电学性能、简单的制备过程以及结构和性能的可调制性,在有机发光二极管(oled),有机场效应晶体管(ofet),有机太阳能电池(opv)及有机激光(organiclasers)等领域得到了广泛的应用,已经成为有机光电子学研究的重要内容。近年来,结构紧凑、价格低廉(甚至可以弃置)的有机半导体激光的研究引起人们的浓厚兴趣。与染料激光器相比,有机半导体材料除了具有有机激光染料的优点(高的发光效率,可调光谱范围宽,可视为四能级系统等)外,还具有高的固态发光效率,载流子传输及成膜性好等使其在激光应用方面受到广泛的关注。然而,由于有机激光在电泵浦下高的激光阈值、低的净增益系数和相对较差的电学性能导致电泵浦有机半导体激光一直难以实现,这也成为一直困扰有机半导体激光发展的瓶颈问题。为降低激光阈值,人们通过优化分子结构设计合成出包括小分子材料、聚合物材料及高分子材料等在内的有机半导体材料。其中具有多维空间拓扑结构单分散大分子,不但可以像小分子那样使用常规的硅胶柱层析进行提纯,还具有类似聚合物的良好的成膜性能。此外,由于它们所具有的空间多维结构减弱了分子间的相互作用,使得它们在溶剂中往往具有更好的溶解性形成表面形貌规整、均一的薄膜,同时该类材料还具有各向同性的光电性能。
对于共轭大分子而言,通过改变臂或核以及对分子端基修饰进行优化分子结构,可以有效的实现材料光电性能的优化与提高。其中寡聚芴由于其高的荧光量子效率,好的光谱稳定性以及成膜性被广泛的作为臂结构应用在有机光电器件中。芘具有大的π-共轭大平面结构体系,较好的刚性共面性,玻璃化温度高,热稳定性好,薄膜形态稳定性好,荧光效率高。二苯胺作为强的给电子基团,通过二苯胺端基修饰可以进一步改善分子的电学性能。目前未见任何文献或专利报道二苯胺端基修饰的多臂结构芘基材料在有机半导体激光中的应用。聚合物虽可以较好地获得低阈值有机半导体材料,但其结构具有不确定性,而且分散性差;小分子虽然结构确定也具有良好的分散性,但是其具有差热稳定,高的水氧敏感使得其器件稳定性和重复性不理想。通过设计合成二苯胺端基修饰的以芘为核的四取代蝶形结构材料,既具有小分子结构明确的优点又具有聚合物低阈值、可溶液加工的特性,而且形成二苯胺-芘核的给受体结构,可以有效实现多臂结构材料的电学特性调控,使其在有机半导体激光和有机电致发光领域具有重要的应用价值。
技术实现要素:
技术问题:本发明提供一种芘基有机半导体激光材料及其制备方法与应用,以解决目前光增益介质阈值高、稳定性差、电学性能不好、材料制备复杂的问题,克服有机半导体激光材料在保证光物理性能优异的情况下电学性能有效调控的难题。
技术方案:为实现上述目的,本发明采用的技术方案是:
一种芘基有机半导体激光材料,该材料以芘为核,以二苯胺基团为封端单元,以不同链长芴基为桥连单元,具有如下式i所示的结构通式:
其中,r为c1-c30的直链或支链烷基或烷氧基;n为1-5的自然数;n是氮原子;h是氢原子。
更具体地,所述的r为甲基、乙基、正己基、正辛基或异辛基中的一种。
芘基有机半导体激光材料的制备方法,该材料的合成路线为:
目标化合物pnf制备:在n2保护下,将3,8,14,19四溴芘核(1)、二苯胺端基修饰的芴单硼酸酯(2)、碱性化合物与相转移催化剂置于微波反应器中,抽换n2后,进行避光处理,加入催化剂,进行反应,反应结束柱色谱纯化得目标化合物pnf。
上述的芘基有机半导体激光材料作为发光激光增益介质或发光材料应用于有机半导体激光器件或有机电致发光器件中。
有益效果:本发明的材料制备方法简单,中间体成本低廉,反应过程容易控制,产品易于分离、收率高、纯度高。另外,该类材料在有机半导体激光器件应用中表现出优异的热稳定性能、成膜稳定性、低阈值特性和高发光强度,同时在有机电致发光器件中也展现出超低的启动电压和优异的电致发光性能;在有机半导体激光和有机电致发光方面具有潜在的应用价值。
附图说明
图1为p1f的1hnmr谱图。
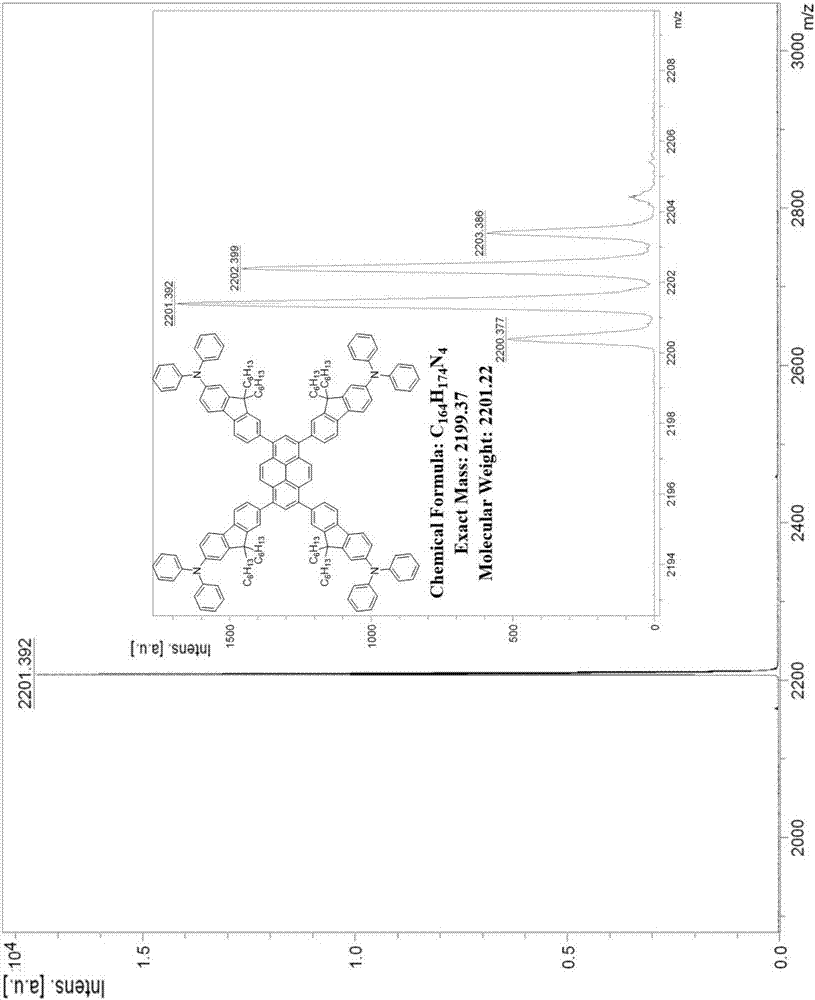
图2为p1f的maldi-tof谱图。
图3为p2f的1hnmr谱图。
图4为p2f的maldi-tof谱图。
图5为p3f的1hnmr谱图。
图6为p3f的maldi-tof谱图。
图7为目标分子p1f、p2f和p3f在溶液和薄膜下的吸收、发射和ase光谱。
图8为目标分子p1f、p2f和p3f在不同电压下发光亮度和电流密度的变化曲线。
图9为目标分子p1f、p2f和p3f在不同退火温度下放大自辐射(ase)阈值的变化曲线。
具体实施方式
本发明的制备方法包括,将二苯胺与2,7-二溴芴化学反应得到单边二苯胺端基修饰芴的单溴取代衍生物,然后进行硼酸酯化反应,最后将其与芘的四溴核通过suzuki偶联反应,制备得到化合物pnf。该类基于二苯胺端基修饰的以芘为核以芴链为臂的四取代蝶形的有机半导体激光材料具有低的阈值,高的光增益系数及高的热稳定性以及优异的电致发光性能。其具有如下的结构通式:
其中,r为c1-c30的直链或支链烷基或烷氧基;n为1-5的自然数;n是氮原子;h是氢原子。
更具体地,所述的r可以是甲基、乙基、正己基、正辛基或异辛基中的一种。
该材料的制备方法包含以下合成路线:
其中,i是在cui催化作用下发生偶联反应;ii是n-buli/异丙醇频哪醇硼酸酯作用下进行酯化反应;iii是在pd(pph3)4催化作用下发生suzuki偶联反应;iv是在pd(dppf)2cl2/联硼酸频那醇酯作用下进行酯化反应;v是在pd(pph3)4催化作用下单体化合物3a,3b和3c分别与单体芘的四溴核进行suzuki偶联反应。
以下通过具体若干具体实例对本发明做进一步说明,但实例不限制本发明的涵盖范围。
实施例1:
反应条件一:在n2保护条件下,将二苯胺(169.1mg,1mmol)、9,9-二己基-2,7-二溴芴(980.2mg,2.0mmol)、叔丁醇钾(179.5mg,1.6mmol),碘化亚铜催化剂(9.5mg,0.05mmol)与相转移催化剂
反应条件二:在n2保护条件下,将二苯胺(169.1mg,1mmol)、9,9-二己基-2,7-二溴芴(1.2g,2.5mmol)、叔丁醇钾(202.1mg,1.8mmol),碘化亚铜催化剂(11.4mg,0.06mmol)与相转移催化剂
反应条件三:在n2保护条件下,将二苯胺(169.1mg,1mmol)、9,9-二己基-2,7-二溴芴(1.5g,3mmol)、叔丁醇钾(202.1mg,1.8mmol),碘化亚铜催化剂(15.2mg,0.08mmol)与相转移催化剂
1hnmr(400mhz,cdcl3,δ):7.52(d,j=8.2hz,1h),7.48–7.38(m,3h),7.27(s,1h),7.24(d,j=7.4hz,3h),7.11(d,j=10.3,4.7hz,5h),7.07–6.99(m,3h),1.94–1.77(m,4h),1.19–1.03(m,12h),0.81(t,j=7.2hz,6h),0.71–0.58(m,4h);13cnmr(100mhz,cdcl3,δ):152.9,151.7,147.9,147.5,140.0,135.1,129.9,129.2,126.0,123.9,123.5,122.6,120.5,120.1,119.1,55.3,31.5,29.5,24.8,23.8,22.6,14.0.maldi-tof-ms(m/z):calcdforc37h42brn,exactmass:579.25;found:580.15(m+).anal.calcdforc37h42brn:c,76.54;h,7.29;n,2.41.found:c,76.24;h,7.59;n,2.18.
实施例2
反应条件一:在n2保护条件下,将反应产物2a(5.8g,10mmol)溶解于80ml已做鼓泡处理干燥的四氢呋喃溶剂中,将反应装置放入-78℃的冰水浴中(丙酮+干冰),抽取7.8ml的n-c4h9li分多次少量加入反应装置;将n-c4h9li全部注入(1.5h)后,加入4.5ml的异丙醇频哪醇硼酸酯;控温0℃条件下,反应12h;反应结束后冷却至室温经萃取和色谱柱纯化得到反应产物3a(2.5g),产率40.1%。
反应条件二:在n2保护条件下,将反应产物2a(8.7g,15mmol)溶解于85ml已做鼓泡处理干燥的四氢呋喃溶剂中,将反应装置放入-78℃的冰水浴中(丙酮+干冰),抽取12ml的n-c4h9li分多次少量加入反应装置;将n-c4h9li全部注入(1.5h)后,加入8ml的异丙醇频哪醇硼酸酯;控温0℃条件下,反应12h;反应结束后冷却至室温经萃取和色谱柱纯化得到反应产物3a(4.8mg),产率50.6%。
反应条件三:在n2保护条件下,将反应产物2a(5.8g,10mmol)溶解于80ml已做鼓泡处理干燥的四氢呋喃溶剂中,将反应装置放入-78℃的冰水浴中(丙酮+干冰),抽取10ml的n-c4h9li分多次少量加入反应装置;将n-c4h9li全部注入(1.5h)后,加入6ml的异丙醇频哪醇硼酸酯;控温0℃条件下,反应12h;反应结束后冷却至室温经萃取和色谱柱纯化得到反应产物3a(2.8mg),产率45.3%。
1hnmr(400mhz,cdcl3,δ):7.78(d,j=8.1hz,1h),7.71(d,j=10.7hz,1h),7.64–7.49(m,2h),7.26(s,1h),7.23(d,j=7.4hz,3h),7.12(d,j=7.6hz,5h),7.02(d,j=7.4hz,3h),1.98–1.77(m,4h),1.39(s,12h),1.06(t,j=18.9hz,12h),0.79(t,j=7.2hz,6h),0.62(d,j=7.3hz,4h);13cnmr(100mhz,cdcl3,δ):152.8,149.2,148.6,147.2,146.3,143.9,136.5,133.5,129.8,128.7,123.8,123.4,122.5,120.8,119.4,118.4,83.7,55.2,40.3,31.3,29.6,24.8,23.7,14.0.maldi-tof-ms(m/z):calcdforc43h54bno2,exactmass:627.42;found:628.35(m+).anal.calcdforc43h54bno2:c,82.28;h,8.67;b,1.72;n,2.23.found:c,82.58;h,9.07;b,2.02;n,2.53.
实施例3
反应条件一:在n2保护条件下,将反应产物3a(0.75g,1.2mmol)、9,9-二己基-2,7-二溴芴(1.2g,2.4mmol),pd(pph3)4(5.8mg,0.005mmol)催化剂溶于40ml的甲苯中,然后加入13ml的k2co3水溶液中,控温100℃反应24h;反应结束后冷却至室温经萃取和色谱柱纯化得到反应产物2b(0.72g),产率65.6%。
反应条件二:在n2保护条件下,将反应产物3a(0.94g,1.5mmol)、9,9-二己基-2,7-二溴芴(1.6g,3.2mmol),pd(pph3)4(11.6mg,0.01mmol)催化剂溶于45ml的甲苯中,然后加入15ml的k2co3水溶液中,控温100℃反应24h;反应结束后冷却至室温经萃取和色谱柱纯化得到反应产物2b(1.05g),产率76.5%。
反应条件三:在n2保护条件下,将反应产物3b(1.5g,1.5mmol)、9,9-二己基-2,7-二溴芴(1.6g,3.2mmol),pd(pph3)4(11.6mg,0.01mmol)催化剂溶于45ml的甲苯中,然后加入15ml的k2co3水溶液中,控温100℃反应24h;反应结束后冷却至室温经萃取和色谱柱纯化得到反应产物2c(1.37g),产率73.5%。
产物2b:1hnmr(400mhz,cdcl3,δ):7.74–7.56(m,8h),7.49(s,2h),7.28(s,2h),7.24(s,2h),7.14(d,j=7.5hz,5h),7.07–6.97(m,3h),1.97(t,j=28.5hz,8h),1.21–1.00(m,24h),0.89(t,j=6.8hz,4h),0.79(d,j=8.7,7.1hz,12h),0.72–0.66(m,4h);13cnmr(100mhz,cdcl3,δ):153.3,152.43,151.5,151.1,148.0,147.2,141.1,140.3,139.9,139.5,139.1,136.0,130.1,129.2,128.8,127.1,126.2,123.7,123.6-123.4,122.5,121.2,120.4,112.0,119.4,55.9,40.5,31.5,29.6,24.1,23.9,14.0.maldi-tof-ms(m/z):calcdforc62h74brn,exactmass:911.50;found:913.12(m+).anal.calcdforc62h74brn:c,81.55;h,8.17;n,1.53.found:c,81.75;h,8.37;n,1.43.
产物2c:1hnmr(400mhz,cdcl3,δ):7.83–7.57(m,14h),7.48(d,j=8.5hz,2h),7.28(s,2h),7.24(s,2h),7.14(d,j=7.6hz,5h),7.03(d,j=14.7,7.6hz,3h),2.14–1.86(m,12h),1.21–1.02(m,36h),0.78(d,j=13.4,6.8hz,30h);13cnmr(100mhz,cdcl3,δ):153.2,152.7,152.2,151.4,151.1,148.3,147.5,141.0,140.0,139.6,139.5,138.8,136.3,129.9,129.1,126.7,123.7,122.4,120.5,120.1,119.4,55.2,40.7,31.4,29.6,24.1,23.3,14.4.maldi-tof-ms(m/z):calcdforc87h106brn,exactmass:1243.75;found:1245.72(m+).anal.calcdforc87h106brn:c,83.88;h,8.58;n,1.12.found:c,83.68;h,8.78;n,1.33.
实施例4
反应条件一:在n2保护条件下,将反应物2b(1.8g,2mmol)与联硼酸频那醇酯(409.5mg,2.4mmol)、pd(dppf2)cl2催化剂(14.2mg,0.02mmol)和koac(588.8mg,6mmol)溶解在60ml无水二氧六环溶剂中,控温110℃条件下,避光反应24h;反应结束经色谱柱纯化得到反应产物3b(1.06g),产率55.4%。
反应条件二:在n2保护条件下,将反应物2b(1.8g,2mmol)与联硼酸频那醇酯(761.8mg,3mmol)、pd(dppf2)cl2催化剂(14.2mg,0.02mmol)和koac(588.8mg,6mmol)溶解在60ml无水二氧六环溶剂中,控温110℃条件下,避光反应24h;反应结束经色谱柱纯化得到反应产物3b(1.18g),产率61.7%。
反应条件三:在n2保护条件下,将反应物2c(1.2g,1mmol)与联硼酸频那醇酯(380.9mg,1.5mmol)、pd(dppf2)cl2催化剂(7.2mg,0.01mmol)和koac(294.4mg,3mmol)溶解在30ml无水二氧六环溶剂中,控温110℃条件下,避光反应24h;反应结束经色谱柱纯化得到反应产物3c(0.78g),产率60.7%。
产物3b:1hnmr(400mhz,cdcl3,δ):7.86–7.57(m,10h),7.29(d,j=6.0hz,4h),7.20–7.11(m,5h),7.05(d,j=14.7,4.7hz,3h),2.10–1.83(m,8h),1.43–1.37(m,12h),1.22–1.02(m,24h),0.85–0.65(m,20h);13cnmr(100mhz,cdcl3,δ):152.4,152.1,151.4,150.2,148.0,147.2,143.8,141.1,140.5,139.7,136.6,133.8,129.0,127.8,126.6,123.7,122.5,121.3,120.4,119.5,119.1,55.2,40.2,31.7,29.6,24.9,23.5,14.1.maldi-tof-ms(m/z):calcdforc68h86bno2,exactmass:959.68;found:960.28(m+).anal.calcdforc68h86bno2:c,85.06;h,9.03;b,1.13;n,1.46.found:c,85.16;h,9.33;b,1.36;n,1.26.
产物3c:1hnmr(400mhz,cdcl3,δ):7.86–7.55(m,16h),7.28(d,j=1.9hz,2h),7.24(s,2h),7.14(d,j=7.5hz,5h),7.06–6.99(m,3h),2.01(t,j=34.3hz,12h),1.39(d,j=6.3hz,12h),1.23–0.96(m,36h),0.88–0.61(m,30h);13cnmr(100mhz,cdcl3,δ):153.2,152.4,152.1,151.4,151.1,148.2,147.5,141.5,140.0,139.6,139.5,138.8,136.0,129.9,129.1,125.6,123.7,122.4,120.4,120.1,119.4,55.2,40.2,31.4,29.6,24.2,23.3,14.4.maldi-tof-ms(m/z):calcdforc93h118bno2,exactmass:1291.93;found:1292.78(m+).anal.calcdforc93h118bno2:c,86.40;h,9.20;b,0.84;n,1.08.found:c,86.26;h,9.15;b,0.89;n,1.13.
实施例5
反应条件一:在n2保护下,将1,3,6,8-四溴芘(50mg,0.097mmol)、3a(363.7mg,0.58mmol)、koh(54mg,0.97mmol)、相转移催化剂四丁基嗅化铵(tbab)(93.8mg,0.29mmol)加入到10ml微波反应管中,抽换n2(2~3次)后,进行避光处理,加入pd(pph3)4催化剂(9.2mg,0.008mmol),然后加入3ml的无水四氢呋喃(thf)在反应管中,采用cem微波反应器,控温150℃反应30min。反应结束经柱色谱纯化得化合物p1f(128.7mg),产率60.3%。
反应条件二:在n2保护下,将1,3,6,8-四溴芘(50mg,0.097mmol)、3b(556.9mg,0.58mmol)、koh(56mg,1mmol)、相转移催化剂tbab(93.8mg,0.29mmol),加入到10ml微波反应管中,抽换n2(2~3次)后,进行避光处理,加入pd(pph3)4催化剂(10mg,0.01mmol),然后加入3.5ml的无水四氢呋喃(thf)在反应管中,采用cem微波反应器,控温150℃反应30min。反应结束经柱色谱纯化得化合物p2f(217.5mg),产率63.5%。
反应条件三:在n2保护下,将1,3,6,8-四溴芘(40mg,0.077mmol)、3c(594.7mg,0.46mmol)、koh(40mg,0.7mmol)、相转移催化剂tbab(74.5mg,0.29mmol)加入到10ml微波反应管中,抽换n2(2~3次)后,进行避光处理,加入pd(pph3)4催化剂(8mg,0.007mmol),然后加入3.5ml的无水四氢呋喃(thf)在反应管中,采用cem微波反应器,控温150℃反应30min。反应结束经柱色谱纯化得化合物p3f(244.4mg),产率65.3%。
产物p1f:1hnmr(400mhz,cdcl3,δ):8.21(s,4h),8.15(s,2h),7.78(d,j=7.7hz,4h),7.65(d,j=7.9,3.6hz,12h),7.27(d,j=8.5hz,10h),7.25(s,6h),7.15(d,j=7.6hz,20h),7.08–6.99(m,12h),2.04–1.82(m,16h),1.11(d,j=17.4,9.9hz,48h),0.88–0.77(m,16h),0.73(t,j=6.9hz,24h);13cnmr(100mhz,cdcl3,δ):152.5,151.0,148.4,147.1,140.1,139.2,137.8,136.6,129.6,129.1,128.3,126.3,125.1,124.4,123.7,122.4,120.4,119.4,118.9,55.2,40.1,31.4,29.6,24.0,22.613.9.maldi-tof-ms(m/z):calcdforc164h174n4,exactmass:2199.37;found:2201.39(m+).anal.calcdforc164h174n4:c,89.49;h,7.97;n,2.55.found:c,89.28;h,7.82;n,2.90.
产物p2f:1hnmr(400mhz,cdcl3,δ):8.27(s,4h),8.22(s,2h),7.92(d,j=8.1hz,4h),7.87(d,j=7.9hz,4h),7.67(d,j=25.2,15.6,6.1hz,32h),7.28(s,10h),7.24(s,6h),7.15(d,j=7.5hz,20h),7.03(d,j=15.3,7.9hz,12h),2.15–1.89(m,32h),1.12(d,j=22.3hz,96h),0.82(d,j=23.1,16.3hz,56h),0.70(t,j=6.4hz,24h);13cnmr(100mhz,cdcl3,δ):152.4,151.8,151.0,148.4,147.1,140.6,139.4,137.8,136.0,129.6,128.7,126.1,125.3,123.7,122.4,121.3,120.4,119.9,119.4,55.1,40.1,31.4,29.8,24.0,22.5,13.9.maldi-tof-ms(m/z):calcdforc264h302n4,exactmass:3528.38;found:3530.66(m+).anal.calcdforc264h302n4:c,89.79;h,8.62;n,1.59.found:c,89.68;h,8.82;n,1.50.
产物p3f:1hnmr(400mhz,cdcl3,δ):8.26(d,j=23.3hz,4h),8.13(s,2h),7.92–7.55(m,64h),7.28(s,10h),7.25(s,6h),7.15(d,j=7.5hz,20h),7.03(d,j=16.1,8.7hz,12h),2.20–1.87(m,48h),1.14(d,j=20.4,3.8hz,144h),0.90–0.64(m,120h);13cnmr(100mhz,cdcl3,δ):152.4,151.9,151.4,148.0,147.1,140.6,140.4,140.1,139.8,136.5,129.5,129.1,128.6,126.1,125.9,125.4,123.8,123.5,122.8,122.4,122.1,121.3,120.4,119.7,119.3,119.0,55.1,40.0,31.5,29.5,23.9,22.5,14.0.maldi-tof-ms(m/z):calcdforc364h430n4,exactmass:4857.38;found:4869.64(m+).anal.calcdforc364h430n4:c,89.93;h,8.92;n,1.15.found:c,89.98;h,8.89;n,1.13.
如图7-9,本发明制备的p1f、p2f和p3f,具有优异的热稳定性能、成膜稳定性、低阈值特性和高发光强度,能够作为发光激光增益介质或发光材料应用于有机半导体激光器件或有机电致发光器件中。在有机电致发光器件中也展现出超低的启动电压和优异的电致发光性能;在有机半导体激光和有机电致发光方面具有潜在的应用价值。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的原理下所做的改进和变换,均应为等效的置换方式,都包含在本发明的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!