一个逆境诱导启动子SlWRKY31P的克隆及应用的制作方法
本发明涉及生物技术和植物基因工程领域,具体为一个逆境诱导启动子slwrky31p的克隆及应用。本发明是一种来源于番茄的高盐、干旱或水杨酸逆境诱导启动子slwrky31p的克隆及应用,该启动子能够驱动目的基因在高盐、干旱或水杨酸逆境条件下在植物中高效表达。
背景技术:
启动子(promoter)是dna链上一段能与rna聚合酶结合并能起始mrna合成的序列,主要由核心启动子区及其上游调控区组成。核心启动子区包含转录起始位点和tata盒结构(rna聚合酶的结合位点处之一,决定转录起始的精确性)。上游调控区包括增强转录效率的caat盒及应答元件,应答元件结合转录因子,调控下游基因表达。
启动子分为组成型启动子(constitutivepromoter)和特异性启动子(specificpromoter)。组成型启动子能在所有细胞、任何时候进行转录;特异性启动子又可分为组织特异性启动子和诱导型启动子。组织特异性启动子可调控基因只在某些特定的部位或器官中表达,常表现出发育调节特性。诱导特异性启动子能够接受逆境条件下的诱导信号,特异启动应答基因表达,在植物体内产生大量的特异蛋白,从而做出调节反应,抵抗外界环境。
植物逆境是指对植物施加有害影响的环境因子,对植物产生重要影响的逆境主要有缺水、低温、盐碱、高温等非生物逆境,以及病原等生物逆境。无论非生物逆境还是生物逆境都会造成各种农作物产量和质量的下降,因此,培育和推广抗逆品种是保证作物稳产高产的有效途径。植物体内多种基因受逆境胁迫诱导,而抗逆基因的表达受启动子所调控。因此,在抗逆基因工程中,选择响应逆境胁迫的诱导型启动子构建植物表达载体,用以驱动胁迫应答基因在植物体内定时、定位、定量表达,是解决植物逆境胁迫问题的一个重要策略,对于研究植物抗逆能力调控具有重要意义。
目前能应用于植物转基因研究的逆境诱导型启动子已有报道,但这些报道的多数启动子都只是受到单一的逆境胁迫诱导,如盐诱导启动子,棉花ghnhx1启动子(杨国栋等,2007)、菊花cddreba启动子(chenetal.,2012);高温诱导启动子,如番茄lemtshsp启动子(liuetal.,2001)和小麦hvhsp17启动子(freemanetal.,2011)等。而对于同时受到多种逆境胁迫诱导的诱导型启动子的克隆和功能研究却鲜有报道。实际上,在植物的整个生长过程中,不仅仅只受到单一的逆境胁迫,而往往会在不同的生长时期受到不同的逆境的胁迫,甚至在同一生长时期会同时受到多种逆境胁迫的影响,因此单一的逆境胁迫诱导型启动子在对提高植物综合抗逆性能(广谱抗性)的应用中就显示出一定的局限性,而多种逆境胁迫诱导型启动子在这方面的应用将更具优势。
为此,本发明人经过长期研究,发现了一个受多种逆境诱导的启动子
slwrky31p,具体为一种来源于番茄的受高盐、干旱或水杨酸逆境诱导的启动子slwrky31p,在植物基因工程改造和植物综合抗逆能力的遗传改良中具有良好的应用前景。
参考文献
1.杨国栋.棉花耐盐基因ghnhx1启动子的克隆及功能分析[d].山东农业大学,2007.
2.cheny,chens,chenf,etal.functionalcharacterizationofachrysanthemumdichrum,stress-relatedpromoter[j].molecularbiotechnology,2012,52(2):161-169.
3.jianl,shonom.molecularcloningthegeneofsmallheatshockproteininthemitochondriaandencoplasmicreticulumoftomato[j].actabotanicasinica,2001,43(2):138-145.
4.freemanj,sparksca,westj,etal.temporalandspatialcontroloftransgeneexpressionusingaheat-induciblepromoterintransgenicwheat.[j].plantbiotechnologyjournal,2011,9(7):788.
技术实现要素:
本发明的发明目的在于:提供一个受多种逆境诱导启动子slwrky31p的克隆及其应用。本发明的slwrky31p对通过启动目的基因在高盐、干旱或水杨酸逆境条件下的高表达,来提高转基因植物对高盐、干旱或病原菌的耐受性和抗性,具有重要意义。
为了实现上述目的,本发明采用如下技术方案:
一种逆境诱导启动子slwrky31p,其核苷酸序列包括如下(a)或(b)或(c)的序列:
(a)具有seqidno:1所示的核苷酸序列;或
(b)与a)限定的核苷酸序列具有75%以上一致性,且具有启动子功能的dna分子;或
(c)在高严谨条件下与(a)或(b)限定的核苷酸序列杂交且具有启动子功能的dna分子。
本发明还公开了一种包含所述dna分子的表达盒。
并公开了一种包含所述表达盒的重组载体;
所述重组载体为双元载体、共合载体,所述重组载体优选
为pbi121sx-slwrky31p。
以及,公开了一种包含所述重组载体的重组微生物,所述重组微生物优选为大肠杆菌或根癌农杆菌eha105。
以及,公开了一种包含所述重组载体的转基因细胞系。
本发明公开了一种引物对,所述引物对用于扩增上述诱导启动子,所述引物对为:
正向引物:5’-actagtctgggatatatgatgcttattag-3’
反向引物:5’-ctcgagtaaaagaaagaagatacaagagtg-3’。
本发明具体公开了一种提取、扩增番茄诱导启动子slwrky31p的pcr方法,包括以下步骤:
1)提取番茄ac+的基因组dna;
2)以番茄ac+的基因组dna为模板,使用引物,利用高保真酶primestarhs,扩增slwrky31p启动子;
其中,扩增总体积50μl,其中正向引物1μl,反向引物1μl,dna模板1μl,primestarhs25μl,ddh2o22μl。扩增程序为:98℃10秒,55℃5秒,72℃5秒,30个循环;
所述引物为:
正向引物:5’-actagtctgggatatatgatgcttattag-3’
反向引物:5’-ctcgagtaaaagaaagaagatacaagagtg-3’。
进一步的,本发明公开了逆境诱导启动子slwrky31p在植物中表达的应用;
优选的,所述逆境诱导启动子slwrky31p在高盐、干旱环境和/或病原菌侵袭条件下诱导启动目的基因在植物中表达的应用;
所述植物为双子叶植物。
所述双子叶植物为番茄、水稻、拟南芥和/或烟草。
为实现上述目的,本发明提供了一个逆境诱导启动子slwrky31p的克隆及其应用,本发明中的启动子,名称为slwrky31p,来源于番茄,是如下a)、b)或c)的dna分子:a)核苷酸序列是seqidno.1的dna分子;b)与a)限定的核苷酸序列具有75%或75%以上一致性,且具有启动子功能的dna分子;c)在高严谨条件下与a)或b)限定的核苷酸序列杂交,且具有启动子功能的dna分子。其中,seqidno.1由1849个核苷酸组成,具体如下:
所述高严谨条件是在2×ssc(柠檬酸钠),0.1%sds(十二烷基硫酸钠)的溶液中,在68℃下杂交并洗膜2次,每次5min;然后用0.5×ssc,0.1%sds的溶液中,在68℃下杂交并洗膜2次,每次15min。
本领域普通技术人员可以很容易地采用已知的方法,例如定向进化和点突变的方法,对本发明的启动子核苷酸序列进行突变。那些经过人工修饰的,具有与本发明分离得到的启动子核苷酸序列75%或者更高同一性的核苷酸,只要保持了表达靶基因的启动子活性,均是衍生于本发明的核苷酸序列并且等同于本发明的序列。这里使用的术语“同一性”指与天然核酸序列的序列相似性。“同一性”包括与本发明的启动子核苷酸序列具有75%或更高,或85%或更高,或90%或更高,或95%或更高同一性的核苷酸序列。同一性可以用肉眼或计算机软件进行评价。使用计算机软件,两个或多个序列之间的同一性可以用百分比(%)表示,其可以用来评价相关序列之间的同一性。
同时,基于本发明的逆境诱导启动子,含有slwrky31p的表达盒、重组载体、重组微生物或转基因细胞系也属于本发明的保护范围。
在所述表达盒中,启动子slwrky31p的下游连接结构基因、或调节基因、或结构基因或调节基因的反义基因、或者能够干扰内源基因表达的小rna的编码dna,用于驱动结构基因、或调节基因、或结构基因或调节基因的反义基因、或者天然小rna或人工合成的小rna的表达。
所述表达盒可由所述启动子slwrky31p、所述启动子slwrky31p启动表达的目的基因以及转录终止序列组成;所述启动子以功能性方式与所述目的基因连接,且所述目的基因与所述转录终止序列连接。在本发明的一个实施例中,目的基因具体为β-葡萄糖苷酶(β-glucuronidase,gus)基因。
所述重组载体可为含有上述表达盒的重组载体,包括但不限于质粒和病毒。所述重组载体也可为重组植物表达载体。所述重组植物表达载体含有上述表达盒并且能够将所述的表达盒转送进入植物宿主细胞、组织或器官及其后代并且能够或者至少方便所述的表达盒整合宿主的基因组中,它包括但不限于双元载体、共合载体。所述宿主细胞、组织或器官及其后代是指所有植物细胞或植物组织或植物器官或由这些细胞、组织或器官通过组织分化或无性胚再生并且发育成熟的整体植株(包括种子)。在本发明的一个实施例中,所述重组载体具体为将pbi121sx(植物表达载体pbi121sx是通过在pbi121载体的hindiii位点后面加入了spei位点,在bamhi位点前面加入了xhoi改造而成)的35s启动子替换为所述启动子得到的重组载体。所述目的基因具体为β-葡萄糖苷酶基因(β-glucuronidase,gus)。
本发明在slwrky31p启动子后连接gus报道基因的转基因实验,验证了slwrky31p启动子受到干旱、高盐和病原菌侵袭模拟条件的诱导,从而启动gus基因的表达。通过测定gus基因的表达产物(β-葡萄糖苷酶)的活性,判断本发明的slwrky31p启动子的确受到干旱、高盐或水盐酸的诱导。
在slwrky31p启动子后连接的目的基因,理论上来讲,可以是任何一个基因,其中包括相关的抗逆基因。slwrky31p启动子受到干旱、高盐或水盐酸的诱导,其后连接的目的基因会受到相应的诱导表达,因为基因的时空表达模式的主要是由启动子决定。
实验中的gus基因是验证本发明slwrky31p启动子功能的一个常用报道基因,在实际应用中slwrky31p启动子后面连接的目的基因可以是任意的一个基因,这里目的基因不唯一,可以任意组合。
所述重组表达载体可以通过使用ti质粒、ri质粒、植物病毒载体、直接dna转化、显微注射、电导、农杆菌介导或基因枪等常规生物学方法转化植物器官或组织或细胞,得到转基因植物细胞或组织或器官及由此分化、再生的完整植株及其无性系或其后代。在本发明的实施例中,具体使用的是农杆菌介导法。
上述slwrky31p在植物中启动目的基因表达的应用,也属于本发明的保护范围。
上述应用中,所述植物为双子叶植物,例如番茄、拟南芥或烟草。
扩增slwrky31p的引物对也属于本发明的保护范围。
申请人对本发明进行了实际验证。实验结果证明,本申请的逆境诱导启动子slwrky31p在200mmnacl处理24小时的环境下启动的目的基因的表达量约为正常生长情况下的2.7倍,slwrky31p在300mm甘露醇(mannitol)处理24小时的环境下启动的目的基因的表达量分别约为正常生长情况下的3.2倍,slwrky31p在1mm水杨酸(salicylicacid,sa)处理24小时的环境下启动的目的基因的表达量分别约为正常生长情况下的2.9倍。实验结果表明,本发明的slwrky31p为高盐、干旱或水杨酸逆境诱导的启动子,具有较好的效果。
综上,本发明的slwrky31p可作为构建植物表达载体的元件,将其连接在目的基因之前,使目的基因的表达受高盐、干旱或水杨酸逆境诱导。因此,本发明的slwrky31p对通过启动目的基因在高盐、干旱或水杨酸逆境条件下的高表达,来提高转基因植物对高盐、干旱或病原菌的耐受性和抗性,具有重要意义。
附图说明
本发明将通过例子并参照附图的方式说明,其中:
图1为slwrky31p启动子的pcr扩增电泳图,其中m为dl2000dnamarker;泳道1为slwrky31p启动子的pcr扩增条带。
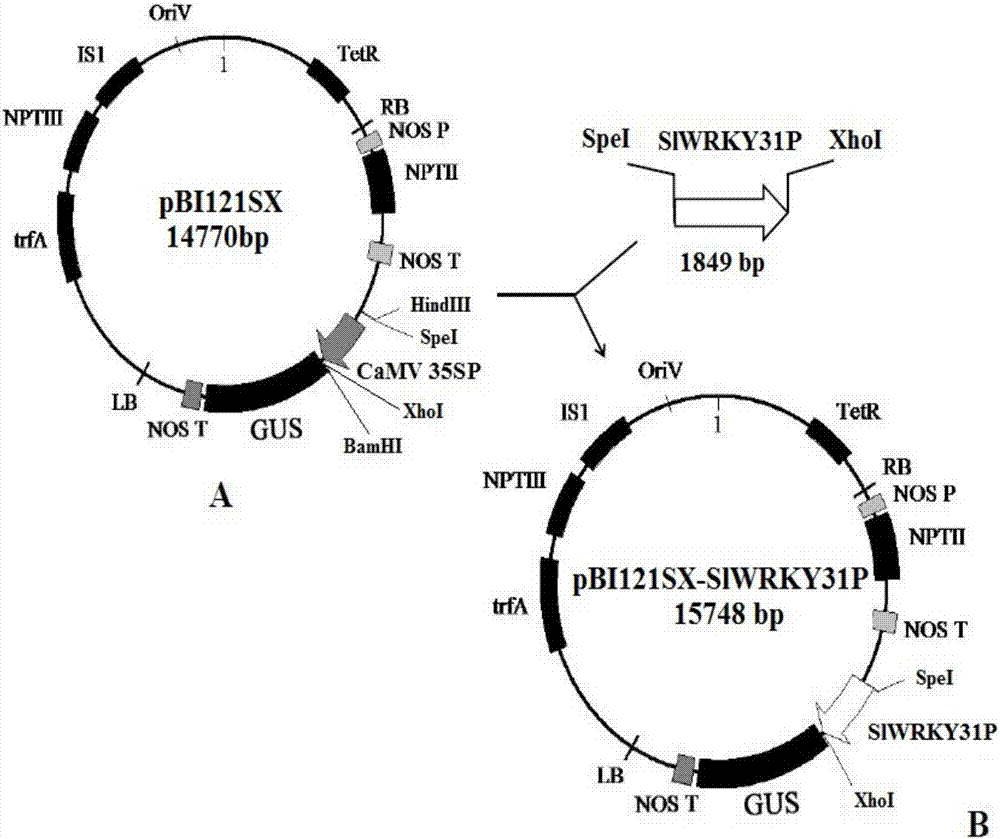
图2为将slwrky31p启动子构建于pbi121sx载体质粒中的示意图,其中图a为pbi121sx示意图,图b为pbi121sx-slwrky31p示意图,其中示出了利用slwrky31p启动子驱动位于其下游的gus基因表达。
图3为对本发明启动子进行酶切验证的结果示意图,其中m为dl15000dnamarker;泳道1为pbi121sx-slwrky31p重组质粒的电泳条带;泳道2为pbi121sx-slwrky31p重组质粒经spei和xhoi双酶切后的电泳条带。
图4为转pbi121sx-slwrky31p的番茄幼苗分别在200mmnacl、300mmmannitol和1mm水杨酸处理24小时环境下幼苗中gus的染色情况。
图5为转pbi121sx-slwrky31p的番茄幼苗分别在200mmnacl、300mmmannitol和1mm水杨酸处理24小时环境下幼苗中gus活性的定量统计分析。
具体实施方式
本说明书中公开的所有特征,或公开的所有方法或过程中的步骤,除了互相排斥的特征和/或步骤以外,均可以以任何方式组合。
本说明书中公开的任一特征,除非特别叙述,均可被其他等效或具有类似目的的替代特征加以替换。即,除非特别叙述,每个特征只是一系列等效或类似特征中的一个例子而已。
以下参照具体的实施例来说明本发明。本领域技术人员能够理解,这些实施例仅用于说明本发现,其不以任何方式限制本发明的范围。
下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1
(一)逆境诱导启动子slwrky31p的克隆
1、植物材料
番茄野生型种子为ac+,由四川大学刘永胜教授实验室惠赠。
2、载体
克隆载体peasy-bluntcloningkit购自北京全式金公司。
3、试剂与药品
高保真酶primestarhs购自takara公司,琼脂糖凝胶回收试剂盒购自omegabio-tek公司。引物由生工生物工程(上海)股份有限公司合成,测序由华大基因科技股份有限公司完成。
缓冲液、试剂、细菌培养基配方参见《分子克隆实验指南》(第三版,作者:著[美]j.莎姆布鲁克、黄培堂译,出版社:科学出版社,isbn:7030103386)。
4、基因克隆
根据sgn(http://solgenomics.wur.nl/)提供的番茄全基因组序列,依据番茄slwrky31基因的上游序列设计扩增引物,正向引物中含有spei识别序列,反向引物中含有xhoi识别序列:
正向:5’-actagtctgggatatatgatgcttattag-3’;
反向:5’-ctcgagtaaaagaaagaagatacaagagtg-3’。
用上述引物以番茄ac+的基因组dna为模板,利用高保真酶primestarhs,扩增slwrky31p启动子。扩增总体积50μl,其中正向引物1μl,反向引物1μl,dna模板1μl,primestarhs25μl,ddh2o22μl。扩增程序为:98℃10秒,55℃5秒,72℃5秒,30个循环。琼脂糖凝胶电泳后胶回收与目的启动子大小相近的片段,连接克隆载体peasy-blunt。将连接产物转化大肠杆菌,37℃恒温培养16-18小时。挑取大肠杆菌单克隆,接种含有氨苄青霉素的lb液体培养基中,置于37℃,150转/每分钟的摇床中扩大培养16-18小时。将扩大培养的大肠杆菌送华大基因科技股份有限公司进行测序分析,测序正确的克隆用以构建表达载体。
5、胶回收
所用bindingbuffer(xp2)、spwbuffer和elutionbuffer全部来自于omegabio-tek公司的琼脂糖凝胶回收试剂盒。
(1)在紫外灯下切下含有目的dna的琼脂糖凝胶,置于1.5ml的离心管中。
(2)在离心管中加入与切下的凝胶块等体积的bindingbuffer(xp2)。混合均匀后于55-60℃中放置约7分钟,期间不断晃动(每2-3分钟一次),直至凝胶块完全融化。
(3)将dna吸附管置于2ml离心管中(试剂盒内提供),将上一步完全融化的凝胶液加入到dna吸附管中,8000-10000×g室温离心1分钟,弃滤液。
(4)将dna吸附管重新置回2ml离心管中,加入300μl的bindingbuffer(xp2),10000×g室温离心1分钟,弃滤液。
(5)将dna吸附管重新置回2ml离心管中,加入700μl的spwbuffer,静置2-3分钟,10000×g室温离心1分钟,弃滤液。
(6)将dna吸附管重新置回2ml离心管中,10000×g室温离心1分钟。
(7)将dna吸附管置于1.5ml离心管中,在吸附管的膜中央加入30-50μl的elutionbuffer,室温静置1分钟。10000×g室温离心1分钟洗脱dna片段。
6、与克隆载体的连接
在200μl离心管中依次加入:胶回收dna片段4μl,peasy-bluntcloningvector1μl,轻轻混合,室温反应10分钟。反应结束后,将离心管置于冰上,用于大肠杆菌转化。
7、大肠杆菌转化
(1)加连接产物于50μltrans1-t1感受态细胞中(peasy-bluntcloning试剂盒提供),轻弹混匀,冰浴20-30分钟。
(2)42℃热激30秒,立即置于冰上2分钟。
(3)加250μl平衡至室温的soc/lb,200转每分钟,37℃孵育1小时。
将菌液于4000转每分钟离心1分钟,弃掉部分上清,保留100-150μl,轻弹悬浮菌体,取全部菌液涂板,37℃培养过夜。
(二)重组表达载体pbi121sx-slwrky31p的构建
1、菌株及载体
大肠杆菌dh5ɑ、根癌农杆菌eha105、表达载体pbi121sx均由西南科技大学生命科学与工程学院生物技术系保存。
2、试剂与药品
限制性内切酶购自thermo公司,taq酶购自tiangen公司,t4dna连接酶购自promega公司,琼脂糖凝胶回收试剂盒及小批量质粒提取试剂盒购自omegabio-tek公司。测序由华大基因科技股份有限公司完成。
缓冲液、试剂、细菌培养基配方、大肠杆菌感受态制备参见《分子克隆实验指南》(第三版,作者:著[美]j.莎姆布鲁克、黄培堂译,出版社:科学出版社,isbn:7030103386)。
3、质粒提取
将测序正确的含有启动子的peasy-blunt-slwrky31p克隆以及pbi121sx大肠杆菌扩大培养,提取质粒。所用溶液i、溶液ii、溶液iii、bufferhb、washbuffer和elutionbuffer全部来自于omegabio-tek公司的小批量质粒提取试剂盒。
(1)在10-20ml试管中,将携带有所需质粒的大肠杆菌接种到5ml含有氨苄青霉素的lb液体培养基,37℃震荡培养12-16小时。
(2)取1.5-5ml菌液室温10000×g离心1分钟。
(3)去上清,加250μl溶液i,涡旋震荡器震荡至菌体完全悬浮。
(4)加入250μl溶液ii,温和颠倒离心管4-6次,获得澄清的裂解液,室温孵育2分钟。
(5)加入350μl溶液iii,温和颠倒数次混合,至出现白色絮状沉淀。
(6)室温13000×g离心10分钟。
(7)小心吸取上清,移至洁净的装配好容积2ml离心管的吸收柱中。室温10000×g离心1分钟。
(8)弃滤液,加500μlbufferhb,10000×g离心1分钟。
(9)弃滤液,用700μlwashbuffer清洗吸收柱,10000×g离心1分钟。
(10)重复第(9)步。
(11)将吸收柱重新置回2ml离心管中,13000×g离心2分钟。
将吸收柱放入干净的1.5ml离心管,在吸附柱的膜中央加30-50μlelutionbuffer,13000×g离心1分钟。
4、slwrky31p片段和pbi12sx载体的酶切和胶回收
对提取的peasy-blunt-slwrky31p和pbi121sx质粒同时用spei和xhoi进行双酶切,反应体系如下表1所示,反应条件为37℃酶切2小时。
将酶切后的产物经琼脂糖凝胶电泳后,分别回收slwrky31p启动子片段和pbi121sx载体片段。
表1反应体系
5、slwrky31p片段和pbi121sx载体的连接
用t4dna连接酶连接slwrky31p启动子片段和pbi12sx载体片段,反应体系为:10×t4ligasebuffer1μl,slwrky31p启动子片段5μl,pbi121sx载体片段3μl,t4ligase1μl。反应条件为:4℃冰箱过夜连接16-18小时。
6、大肠杆菌转化
将连接产物转化大肠杆菌。
(1)从超低温冰箱中取出大肠杆菌感受态细胞,置于冰上解冻。
(2)将连接产物加入到解冻后的感受态细胞中,小心混匀,冰浴30min。
(3)将含有感受态细胞的离心管置于42℃中,热击90秒。
(4)快速将热击后的离心管转移至冰浴中,冷却2-3分钟。
(5)向冷却后的离心管中加入800μl的soc,混匀后置于37℃摇床中120转每分钟振摇培养1小时。
(6)将菌液于4000转每分钟离心1分钟,弃掉部分上清,保留100-150μl,轻弹悬浮菌体,取全部菌液涂板,37℃培养过夜。
(7)挑取大肠杆菌单克隆进行菌落pcr,将阳性克隆接种含有硫酸卡那霉素的lb液体培养基中,置于37℃,150转/每分钟的摇床中扩大培养16-18小时。将扩大培养的大肠杆菌送华大基因科技股份有限公司进行测序分析,测序正确的克隆提取质粒后,用以转化根癌农杆菌eha105。
7、重组表达载体转化根癌农杆菌eha105
(1)从超低温冰箱中取出根癌农杆菌感受态细胞,置于冰上解冻。
(2)将测序正确的重组表达质粒10μl加入到解冻后的感受态细胞中,小心混匀,冰浴30min。
(3)将含有感受态细胞的离心管置于液氮中,速冻1分钟。
(4)快速将速冻后的离心管转移至37℃水浴锅中,放置2-3分钟。
(5)向离心管中加入800μl的soc,混匀后置于28℃摇床中120转每分钟振摇培养4小时。
(6)将菌液于4000转每分钟离心1分钟,弃掉部分上清,保留100-150μl,轻弹悬浮菌体,取全部菌液涂板,28℃培养2天。
(7)挑取农杆菌单克隆进行菌落pcr。
(8)挑取阳性克隆摇菌,并用甘油保存菌液备用。
实施例2利用启动子slwrky31p驱动报告基因在番茄中表达
1、农杆菌介导的番茄遗传转化
将含有pbi121sx-slwrky31p质粒的重组农杆菌转化番茄,具体方法如下。
(1)将番茄种子灭菌后播种于含有1/2ms固体培养基的培养瓶中,暗培养4d左右,露白后转置于光照下,培养条件为:25℃,16小时光照,23℃,8小时黑暗,光照强度为80μmolm-2s-1,并在其第一片真叶长出前取下子叶,置于预培养基上培养2d。
(2)将含有pbi121sx-slwrky31p质粒的重组农杆菌接种于5ml含有50μg/ml利福平和50μg/ml硫酸卡那霉素的lb培养基中,28℃摇床培养12小时,得到5mlpbi121sx-slwrky31p种子液。接种1mlpbi121sx-slwrky31p种子液至50ml含有50μg/ml利福平和50μg/ml硫酸卡那霉素的lb培养基中,28℃摇床培养至od600为0.8左右,得到pbi121sx-slwrky31p培养液。将pbi121sx-slwrky31p培养液于室温4000转每分钟,离心4分钟,弃上清收集菌体,用约10ml诱导培养液重悬菌体,备用。
(3)在灭菌的培养皿中加入40ml的诱导培养液,用移液器吸取800μl重悬菌体加入到含有诱导培养液的培养皿中,混匀。将预培养2天后的番茄子叶浸入诱导培养液和菌体的混合物中10分钟,期间可用无菌镊子尖部对子叶进行垂直打孔。
将子叶捞出置于无菌滤纸上吸干液体,随后将子叶置于共培养基上,于22±1℃、黑暗条件下培养2天后,转移到分化培养基上;然后,置于光照培养箱中,培养条件为:25℃,16小时光照,23℃,8小时黑暗,光照强度为80μmolm-2s-1。每2周更换一次培养基。当愈伤组织长出2.0cm左右的新芽时,切取嫩芽转移至生根培养基上生根,培养约4周后获得完整的硫酸卡那霉素抗性植株。待根系发达后转移至盆中,在温室内24±1℃、16小时光照,8小时黑暗条件下培养至番茄果实成熟,并收获成熟的番茄种子(即t1代转基因种子)。各培养基成分见表2。
表2番茄组织所用培养基
注:6-ba:6-苄氨基嘌呤(6-benzylaminopurine),iaa:吲哚乙酸(indoleaceticacid),kt:激动素(kinetin),2,4-d:2,4-二氯苯氧基乙酸(2,4-dichlorophenoxyaceticacid)。
(5)将t1代转基因番茄种子进行灭菌处理得到无菌t1代番茄种子。将无菌t1代番茄种子播种于含50μg/ml硫酸卡那霉素的1/2ms固体选择培养上,置于光照培养箱中,培养条件为:25℃,16小时光照,23℃,8小时黑暗,光照强度为80μmolm-2s-1。经筛选培养,得到含有硫酸卡那霉素抗性基因的转基因番茄幼苗。将含有硫酸卡那霉素抗性基因的转基因番茄幼苗转移至盆中,在温室内24±1℃、16小时光照,8小时黑暗条件下培养至番茄果实成熟,并收获成熟的番茄种子(即t2代转基因种子)。
2、高盐、干旱和水杨酸诱导slwrky31p
将t2代转基因番茄种子进行灭菌处理,得到无菌t2代番茄种子。将无菌t2代番茄种子播种在含有50μg/ml硫酸卡那霉素的1/2ms固体选择培养。随后,将两周大的无菌转基因番茄幼苗6株置于含有200mmnacl的1/2ms液体培养基中、将两周大的无菌转基因番茄幼苗6株置于含有300mmmannitol(甘露醇)的1/2ms液体培养基中、将两周大的无菌转基因番茄幼苗6株置于含有1mmsa(水杨酸)的1/2ms液体培养基中、将两周大的无菌转基因番茄幼苗6株置于1/2ms液体培养基中,并分别于25℃、16小时光照、23℃、8小时黑暗、平均光照强度为80μmolm-2s-1条件下培养24小时,分别得到200mmnacl处理的番茄幼苗(即盐胁迫24小时的番茄幼苗)、300mmmannitol处理的番茄幼苗(即干旱胁迫24小时番茄幼苗)、1mmsa处理的番茄幼苗(即水杨酸胁迫24小时番茄幼苗,模拟植物病原菌侵染)、和正常培养24小时的番茄幼苗(作为对照),然后将上述所得的材料进行gus组织化学染色。
3、gus组织化学染色
gus能与显色底物x-gluc反应,呈现蓝色,因而可以通过组织化学染色定性的研究gus的表达水平和表达模式。
(1)gus染色底物的配制:50ml0.5m磷酸缓冲液(ph7.0),50μl100mm铁氰化钾k3fe(cn)6(将3.2924g铁氰化钾溶于水,定容至100ml,4℃保存),50μl100mm亚铁氰化钾k4[fe(cn)6]·3h2o(将4.2239g亚铁氰化钾溶于水,定容至100ml,4℃保存),1ml0.5medta,250μl1mg/mlx-gluc(用二甲基甲酰胺溶解,-20℃避光保存)。
(2)染色步骤
染色:将待测样品浸到gus染液中,37℃保温箱中放置24-36小时。
脱色:将染色后的样品经系列浓度乙醇脱色,浓度分别为:50%,75%和90%,至完全脱色后又降低浓度,依次为:90%,70%和50%,最后将样品保存在50%的乙醇溶液中。
(3)观察
用体视镜(leicam205c)分别观察脱色后的正常培养24小时的番茄幼苗、脱色后的200mmnacl处理24小时的番茄幼苗、脱色后300mmmannitol处理24小时的番茄幼苗和脱色后1mmsa处理24小时的番茄幼苗的并拍照,结果见图4。结果显示,正常培养24小时的番茄幼苗经gus染色后,仅在番茄幼苗的根和叶片中的少数的部位呈现出微弱的浅蓝色,而在200mmnacl处理24小时或300mmmannitol处理24小时的的番茄幼苗的根、茎和叶片也都呈现深蓝色,并且在1mmsa处理24小时的番茄幼苗的叶片也都呈现深蓝色。gus染色实验结果表明,相对正常培养的番茄,300mmmannitol或200mmnacl处理的番茄gus表达量在根、茎和叶片中都显著增加,而1mmsa处理番茄gus表达量在叶片中显著增加,在茎和根中也略有增加。
4、gus酶活的测定
按照cote等的方法(cotec,rutledgerg.animprovedmugfluorescentassayforthedeterminationofthegusactivitywithintransgenictissueofwoodyplants.plantcellreport,2003,21(6):619-624)对正常培养24小时的番茄幼苗、200mmnacl处理24小时的番茄幼苗、300mmmannitol处理24小时的番茄幼苗和1mmsa处理24小时的番茄幼苗进行gus活性的荧光定量分析,实验结果如图5所示,实验结果显示:正常培养24小时的番茄的gus活性值为0.96nmol4-mumin-1mg-1蛋白,200mmnacl处理24小时的番茄的gus活性值为2.55nmol4-mumin-1mg-1蛋白,300mmmannitol处理24小时的番茄的gus活性值为3.06nmol4-mumin-1mg-1蛋白,1mmsa处理24小时的番茄的gus活性值为2.73nmol4-mumin-1mg-1蛋白,nacl处理、mannitol处理和sa处理24小时下gus活性分别是正常培养的2.7倍、3.2倍和2.9倍,呈极显著差异。上述结果表明启动子slwrky31p受高盐、干旱和sa的诱导。
在植物的免疫应答中,水杨酸(sa)被认为是一种十分重要的病源信号分子,植物体感染病原菌后体内sa会急剧增加。所以本实施例采用sa处理来模拟病原菌对植物的侵染。
本发明并不局限于前述的具体实施方式。本发明扩展到任何在本说明书中披露的新特征或任何新的组合,以及披露的任一新的方法或过程的步骤或任何新的组合。
序列表
<110>西南科技大学
<120>一个逆境诱导启动子slwrky31p的克隆及其应用
<130>2017
<160>3
<170>patentinversion3.3
<210>1
<211>1849
<212>dna
<213>番茄(solanumlycopersicum)
<400>1
ctgggatatatgatgcttattagagttgcacataatgtgcttcatgtagtgtacttaacc60
tcttaatagagtgcattacatgaagcactattatagtgatacaatccaacttgttctgca120
catactcaattagctctattgtttatctttcgaaaaaaaaacccgatctaaattgatata180
ttgattagatgtgccatttaattaattgagaatacaatatgtgatttctcagataaaatg240
gaagtcaaaaattcttctttggaaatagtttttcttttaacaataataataataataata300
atcaaaagttatccaaatggctcaaaataattacttcaagtaagtaaaagaaattaagat360
tacattattaaacttttcattaattacgtaccatgatatttaatttccagcttctttgat420
ggcatctacaagcttgagttgaaggtggctacgaatacggacgccgaagatggcacagat480
ttcaatgtccgccaggcttcgagcgaaaaatttcacgatccactgagattcagtttttta540
tcattaaaaaataaaaaaaaaacaaaaaagaaagcgaaaacctgctgcattggttaaaca600
cagcggccagtaaactgatcaaatcttttattttggccacaatcatttaaatatataatt660
gctgaaagaagaatatacacctctagaaagaaactttttcctgttccaatcgttatccat720
tttaagtgtataaacaattaaatgaataaaataacgggaaatatccattagagagcatga780
catttgttatttgtccaataaaatttgatgtgcttgcttctttgacttgtatacatttag840
cttaaattgactttatacttaaacaaatgaatttctctttaattaataatcagagtaacg900
taatcctaaaattctagtatattaatcataaaacatataataaaaacacattgtaaaata960
gcacttgcaacatatctcgactatctagactgatatcgataatatattctgagaaacttc1020
ttttgtgatcatttattacttattaggttaaagataaaaactcctttgttttgatgcaaa1080
tagaataatacacaaccacctttaactctcactaatgagcataaatgattaaaatgttta1140
aaacaaaattgaattgtatcattagaaaattaaaaaaagaaaaaagttaattcatttttt1200
tattgctataaatatttagttttaaatctatccaaacaaggttcgaaaagaatggaaaaa1260
gattagataaaaaggatattgacaattcgcccgataaaagagcctcgtgattgattgatt1320
gttagttaatcaactgatagtggccagtggggtaccaccatcacaacgacagcgacataa1380
cgcgtttggcgtaattgcattacaatagcagcctctcttttcttgtacaatttgtgtaaa1440
tgtatctattatagtcaaagccaccaattttgactcaacacacaaatagtattatttttt1500
agatttcattttccacggtcaaagctattttgaggatcttagaagtttctttaaatatct1560
atagaatagaaaaataaaaaagacaatgagcttggatgacactgttttattttttaatta1620
aaaactttagaatttatatttgacagaaaggaaattttattaaaaatgtcaattatcaaa1680
taaattattaaatttaatcaaattttaatattatcgagtgagaaatgaaaaaaaaaaagc1740
tagtggattgtagaatacgtgttcatttttgtttttaatatcccacccactccaaacgaa1800
aggttatataatcgaattcccattgcactcttgtatcttctttctttta1849
<210>2
<211>29
<212>dna
<213>人工序列
<400>2
actagtctgggatatatgatgcttattag29
<210>3
<211>30
<212>dna
<213>人工序列
<400>3
ctcgagtaaaagaaagaagatacaagagtg30
- 还没有人留言评论。精彩留言会获得点赞!
- 大豆低温诱导型启动子、包含该启动子的重组表达载体及应用的制作方法与工艺
- 受植物激素调控的启动子及其应用的制作方法与工艺
- 一种受盐诱导的特异性诱导型启动子DNA序列及应用的制作方法与工艺
- 受维甲酸调控的具有浓度依赖效应的重组启动子及其使用的制作方法与工艺
- 一种磷酸盐诱导启动子降低黑曲霉β‑葡萄糖苷酶表达酶活的方法与流程
- 一种疫霉诱导性人工合成启动子PMP1及其重组表达载体和应用的制作方法与工艺
- 一种植物盐/干旱诱导型启动子soyEQ及其应用的制作方法与工艺
- 新型的L-苏氨酸-诱导型启动子及其应用的制作方法与工艺
- 一种植物茉莉酸甲酯诱导表达启动子PosMeJ1及其应用的制作方法与工艺
- 一个逆境诱导启动子SlWRKY31P的克隆及应用的制造方法与工艺