一种植物盐/干旱诱导型启动子soyEQ及其应用的制作方法
本发明属于基因工程领域,具体涉及盐/干旱诱导型启动子soyEQ及其应用。
背景技术:
土壤盐渍化以及水资源短缺是目前制约农业生产的全球性问题,全球20%的耕地受到盐害威胁,43%的耕地为干旱、半干旱地区,这两种胁迫是世界范围内造成农作物减产最主要的非生物胁迫。这两种非生物胁迫能引发植物从调节基因表达到生长速率、产量变化等一系列反应。因此,增强和改善植物对盐渍、干旱等非生物胁迫的耐受性、抵抗力一直是农业科研工作者的研究目标和热点。
植物基因工程技术是在分子水平上定向重组遗传物质,为培育植物新品种开辟了崭新的途径。在植物转基因工程研究中,除导入抗逆等相关基因,胁迫诱导型启动子无疑已成为植物抗逆研究中的有利工具。胁迫诱导型启动子在胁迫的条件下有着显著的诱导特性,可在植物特定的生长环境下,诱导特定基因的表达,以保证植物的正常生长,当胁迫解除后,特定基因则停止表达,这样不仅不会造成植物体内资源浪费,又可提高植物在胁迫条件下的抗性。如:拟南芥胁迫诱导型启动子rd29A驱动AtDREB1A/CBF3基因转化到高羊茅中,缺水处理30天后,非转基因植株全部萎蔫,而转基因植株只有少部分萎蔫;苋属植物AmCMO基因上游-410bp启动子片段含有盐胁迫响应序列,300mmol/LNaCl处理24小时后,下游报告基因GUS活性显著提高。
根据诱导条件不同,胁迫诱导型启动子主要分为盐诱导型启动子,干旱诱导型启动子,植物激素诱导型启动子,低温诱导型启动子,高温诱导型启动子等。利用盐诱导型启动子、干旱诱导型启动子驱动抗逆基因表达,可使抗逆转基因植物更好的适应环境,从而解决盐渍、干旱带来的农业问题。因此,获得新的有效的盐诱导型启动子,或干旱诱导型启动子,或兼具盐/干旱诱导型启动子特性的启动子,将广泛应用在植物抗逆育种研究中。
技术实现要素:
本发明提供一种大豆盐/干旱诱导型启动子soyEQ,该诱导型启动子soyEQ包含序列表Seq ID No:1所示的核苷酸序列。
本发明的一种植物盐/干旱诱导型启动子soyEQ,它的核苷酸序列如序列表Seq ID No:1所示。
本发明的一种植物盐/干旱诱导型启动子soyEQ的应用,它用于提高植物的抗逆性。
本发明所述的植物盐/干旱诱导型启动子soyEQ所表达的是既有盐诱导型,又有干旱诱导型的启动子soyEQ。
本发明提供的soyEQ启动子可以在盐、干旱胁迫条件下,启动下游基因在植物中高表达。因此该启动子soyEQ可以用于提高和改善植物在盐胁迫、干旱胁迫下的生长状况及环境适应性,从而有效提高植物的抗逆性。经GUS基因转录水平和GUS蛋白活性分析表明,在盐胁迫和干旱胁迫下,soyEQ启动子诱导活性分别能够达到CaMV35S启动子的2.1倍和3.3倍,说明soyEQ是一种新的高效的盐/干旱诱导型启动子。
附图说明
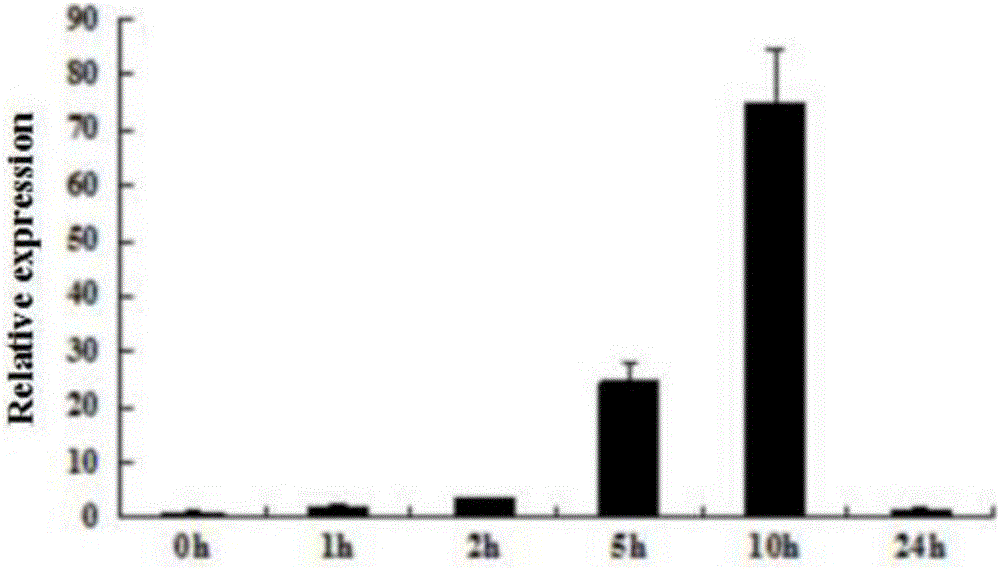
图1为Em基因在盐条件下大豆中的表达量图;
图2为Em基因在干旱条件下大豆中的表达量图;
图3为本发明soyEQ启动子的扩增产物电泳图;其中,M:2000bp DNAmarker;1:PCR产物;
图4为重组质粒pMD18-T-soyEQ的双酶切鉴定电泳图;其中,M:2000bp DNAmarker;1:重组质粒pMD18-T-soyEQ的双酶切结果;
图5为重组质粒pCAM-soyEQ的双酶切鉴定电泳图;其中,M:2000bp DNAmarker;1和2分别为:重组质粒pCAM-soyEQ的双酶切结果;
图6为在盐条件下qRT-PCR检测GUS基因在转pCAM-soyEQ基因烟草中的表达量图;
图7为在干旱条件下qRT-PCR检测GUS基因在转pCAM-soyEQ基因烟草中的表达量图;
图8为在盐胁迫24h下荧光分光光度法测定转pCAM-soyEQ基因烟草中GUS活性图;其中,A为对照(未处理)柱状图,B为在盐胁迫24h下转pCAM-soyEQ基因烟草中GUS活性柱状图;C为在盐胁迫24h下转pCAMBIA1301烟草植株中GUS活性柱状图;D为在盐胁迫24h下野生型烟草中GUS活性柱状图;WT:野生型烟草;CaMV35S:GUS基因由CaMV35S启动子驱动;soyEQ:GUS基因由soyEQ启动子驱动;
图9为在干旱条件10h下荧光分光光度法测定转pCAM-soyEQ基因烟草中GUS活性图;其中,A为对照(未处理)柱状图,B为在干旱条件10h下转pCAM-soyEQ基因烟草中GUS活性柱状图;C为在干旱条件10h下转pCAMBIA1301烟草植株中GUS活性柱状图;D为在干旱条件10h下野生型烟草中GUS活性柱状图;WT:野生型烟草;CaMV35S:GUS基因由CaMV35S启动子驱动;soyEQ:GUS基因由soyEQ启动子驱动;
图10为组织化学染色检测图;其中,A为盐胁迫24h;B为干旱胁迫10h;WT:野生型烟草;CaMV35S:GUS基因由CaMV35S启动子驱动的组织化学染色图片;soyEQ:GUS基因由soyEQ启动子驱动的组织化学染色图片。
具体实施方式
具体实施方式一:本实施方式的一种植物盐/干旱诱导型启动子soyEQ,它的核苷酸序列如序列表Seq ID No:1所示。
具体实施方式二:本实施方式的一种植物盐/干旱诱导型启动子soyEQ的应用,它用于提高植物的抗逆性。
具体实施方式三:本实施方式与具体实施方式二不同的是:该启动子soyEQ用于提高植物的耐盐胁迫性,抗干旱性。其它与具体实施方式二相同。
本发明内容不仅限于上述各实施方式的内容,其中一个或几个具体实施方式的组合同样也可以实现发明的目的。
通过以下实施例验证本发明的有益效果:
1、大豆Em基因在盐/干旱条件下大豆中的表达
1.1 大豆材料处理及RNA提取
大豆品种为吉豆2号,逆境条件下材料处理:将大豆水培幼苗分别置于含有NaCl(200mmol/L)和PEG8000(20%)的Hoaglands营养液中进行盐和干旱胁迫处理。在处理0小时(h)、1h、2h、5h、10h、24h时分别取样,迅速放于液氮中,置-80℃中保存备用。
1.2 qRT-PCR检测Em基因在大豆植株中表达
根据RNA提取试剂盒步骤,提取大豆各种备用材料的总RNA;以总RNA为模板,按照逆转录的步骤分别合成cDNA的第一条链,进行qRT-PCR反应。以大豆持家基因β-tubulin(GMU12286)为内参,内参引物分别为(T1:5’-GGAAGGCTTTCTTGCATTGGTA-3’;T2:5’-AGTGGCATCCTGGTACTGC-3’)。根据NCBI中大豆Em基因的核苷酸序列(AF004805),利用Primer Premier 5.0软件设计检测该基因的引物,上游引物(QF:5’-ATGGCATCTCGTCA AAACAAC-3’)和下游引物(QR:5’-GTCTTCGTTCTGATTCTGGTTCTTG-3’)。利用BIO-RAD CFX96实时定量PCR仪,反应循环参数为:95℃10s,59℃20s,72℃30s。每次取样点设3次技术重复,实验共设3次生物学重复;结果见图1,大豆Em基因在盐胁迫下,随着处理时间的延长,表达量逐渐升高,当处理24h,相对于未处理的对照,表达量约为82.8。结果见图2,在干旱胁迫下,随着处理时间的延长,Em基因表达量逐渐升高,最大值为处理10h,相对于未处理的对照,表达量约为74.5,之后相对表达量下降。说明Em基因在大豆植物中,受盐、干旱诱导,诱导表达上升。
2.大豆盐/干旱诱导型启动子soyEQ的克隆
以大豆叶片为材料,采用CTAB法提取大豆的基因组DNA。根据大豆Em基因的核苷酸序列(AF004805),在大豆基因组序列(http://www.phytozome.net/soybean)中搜索该基因5’端上游序列。以基因组DNA为模板,设计含有PstI酶切位点的上游引物和含有NcoI酶切位点的下游引物,分别为AE(5’-GGGCTGCAGGATTGATGAAGGAGTGAC AGAA-3’)和RE(5’-GGGCCATGGGTTTCTCACACTTGCAAAATTC-3’),扩增大豆Em基因ATG上游序列。PCR反应条件为预变性95℃5min;94℃30s,55℃40s,72℃1min,共30个循环;72℃后延伸7min。PCR扩增获得长度为1997bp的序列,命名为soyEQ(图3为该基因的电泳结果)。将PCR扩增片段连接到pMD18-T克隆载体上,获得重组质粒pMD18-T-soyEQ,双酶切鉴定(电泳结果如图4所示),并进行测序。测序结果如序列Seq ID No:1所示的核苷酸序列,该序列与大豆基因组中相对应序列的同源性为99.25%,说明已获得Em基因上游启动子序列,个别碱基的差异可能与品种间差异有关。
3.soyEQ启动子的序列分析
利用在线启动子分析软件Neural Network Promoter Prediction和softberry网站(http://www.softberry.com)中的TSSP,并结合真核细胞基因启动子的基本特征,推测可能的转录起始位点1902bp处的G。用PLACE(http://www.dna.affrc.go.jp/PLACE/signalscan.html)分析启动子序列中存在的顺式作用元件和转录因子的结合位点,表明该序列中含有多种在其他植物启动子中存在的通用启动子元件TATA盒(1871-1879bp),及多个典型的逆境胁迫相关元件,如:应答逆境胁迫反应及抵抗病原菌侵害的MYB转录因子结合位点元件Myb core(CNGTTR)3个;调控植物防御基因表达的DOF转录因子结合位点元件AAAG有7个;存在于植物防御反应相关启动子中的元件W-box(TTGAC)(WRKY-type转录因子结合位点)4个;响应干旱和低温的元件Evening element(ATATCT)2个;ABA响应元件(ABREs)(PyACGTGG/TC)2个,ABA是一种重要的植物激素,在植物对胁迫耐受性和抗性中发挥重要作用。
4.构建表达载体及转化
用PstI和NcoI双酶切重组质粒pMD18-T-soyEQ,回收克隆片段,与PstI和NcoI双酶切pCAMBIA1301质粒载体得到的大片段进行连接,经转化和酶切验证,构建得到植物表达载体pCAM-soyEQ。将重组质粒pCAM-soyEQ用PstI和NcoI双酶切进行鉴定,获得与预期大小一致的目的片段(图5为该片段的电泳结果),说明soyEQ启动子片段替换了pCAMBIA1301中的组成型启动子CaMV35S,证明该植物表达载体构建正确。通过冻融法,将pCAM-soyEQ和pCAMBIA1301载体质粒转化至农杆菌EHA105中。
5.转基因烟草的筛选及分子鉴定
通过叶盘法,侵染无菌苗烟草叶片,在含有5mg/L潮霉素的MS培养基上进行培养。待生根后转移土壤中继续生长。利用PCR法和RT-PCR法进行检测,获得阳性转烟草植株。用AE和GR(5’-CCCACACTTTGCCGTAATGAG-3’)作为PCR检测转pCAM-soyEQ烟草植株的引物,用GF(5’-AGGACCTAACAGAACTCGCCGTAA-3’)和GR作为PCR检测转pCAMBIA1301烟草植株的引物。ZF(5’-TTCTACACAGCCATCGGTCCA-3’)和ZR(5’-TGAAAAAGCCTGAACTCACCG-3’)作为RT-PCR检测阳性转基因植株引物。继续筛选得到T1代阳性转基因烟草植株。
6.qRT-PCR检测GUS基因在转pCAM-soyEQ基因烟草中表达
在盐、干旱胁迫下,转pCAM-soyEQ烟草植株中GUS基因的转录水平,能够体现soyEQ启动子调控下游基因的转录水平。材料逆境处理、RNA提取、逆转录步骤,与qRT-PCR检测Em基因在大豆植株中表达的步骤相同。进行qRT-PCR反应时,以烟草持家基因a-tubulin为内参,内参引物分别为(PF:5’-ATGAGAGAGTGCATATCGAT-3’;PR:5’-TTCACTGAAG AAGGTGTTGAA-3’)。引物(KF:5’-GATCGCGAAAACTGTGGAAT-3’;KR:5’-TAATGAGTGACCGCATCGAA-3’)作为检测GUS基因的引物。同样利用BIO-RAD CFX96实时定量PCR仪,反应循环参数为:95℃10s,54℃20s,72℃30s。每次取样点设3次技术重复,实验共设3次生物学重复。在阳性转pCAM-soyEQ烟草植株中,盐胁迫和干旱胁迫下,soyEQ驱动GUS基因的表达趋势同Em基因在大豆中盐、干旱胁迫下的表达趋势相似。如图6所示,在盐胁迫下,随着处理时间的延长,表达量逐渐升高,当处理24h,相对于对照(未处理的转基因植株),表达量约为66.4。如图7所示,在干旱胁迫下,随着处理时间的延长,表达量逐渐升高,最大值为处理10h,相对于对照(未处理的转基因植株),表达量约为86.1,之后相对表达量下降。从GUS基因的转录水平,显示出soyEQ启动子受盐、干旱诱导,能够调控下游基因在盐、干旱条件下,表达显著升高。
7.GUS活性分析
根据qRT-PCR检测结果,转pCAM-soyEQ基因的烟草植株,在盐胁迫和干旱胁迫分别是24h和10h时,GUS基因的转录水平最高。继续利用荧光分光光度计进行GUS活性分析,用液氮将样品研磨成粉末,加提取缓冲液(100mL中加入:50mmol/L磷酸钠缓冲液pH=7.050mL,β-巯基乙醇100μL,0.5mmol/L EDTA 2mL,10%SDS 1mL,100μL TritonX 100),12000rpm 4℃离心10分钟,取上清液得到GUS可溶性蛋白粗体液。取出部分加1mmol/L的GUS反应底物4-MUG,37℃保温20分钟,加0.2mmol/L的Na2CO3反应终止液终止反应。可溶性蛋白含量的测定采用Bradford法。以1分钟水解4-MUG生成1nmol/L 4-MU所需酶量为一个酶活力单位,以每毫克蛋白的酶活力表示GUS活性,上述实验重复三次。结果如图8所示,在盐胁迫下24h时,转pCAM-soyEQ基因烟草植株中,soyEQ驱动的GUS活性约为175.1nmol/LMU/mg,是未处理转pCAM-soyEQ基因植株的51.5倍,是转pCAMBIA1301烟草植株(CaMV35S启动子驱动的GUS活性)的2.1倍;如图9所示,在干旱胁迫下10h时,转pCAM-soyEQ基因烟草植株中,soyEQ驱动的GUS活性约为268.6nmol/LMU/mg,是未处理转pCAM-soyEQ基因植株的79倍,是转pCAMBIA1301烟草植株(CaMV35S启动子驱动的GUS活性)的3.3倍。
此外,进行GUS组织化学染色分析,将处理后的烟草叶片放入GUS染色液中(50mmol/L磷酸缓冲液(pH=7.0),0.5mmol/L K3[Fe(CN)6],0.5mmol/L K4[Fe(CN)6],10mmol/L EDTA,0.1%Triton X-100和2mmol/LX-gluc),37℃染色12h,之后材料先后用50%、75%、100%乙醇漂洗,至完全脱色。肉眼下观察,并拍照。如图10所示,在盐胁迫24h和干旱胁迫10h时,野生型烟草叶片均未染色,转CaMV35S启动子的烟草叶片都染成蓝色,说明该载体中的GUS报告基因能够被CaMV35S组成型启动子激活表达。转soyEQ启动子的烟草叶片在盐胁迫24h和干旱胁迫10h时,都染成较转CaMV35S启动子烟草叶片更深的蓝色,尤其在干旱胁迫10h时。
以上GUS基因转录水平和GUS蛋白活性分析结果,说明soyEQ启动子受盐和干旱诱导,且诱导活性分别能够达到CaMV35S启动子的2.1倍和3.3倍,说明soyEQ是一种新的高效的盐/干旱诱导型启动子。
- 还没有人留言评论。精彩留言会获得点赞!
- 大豆低温诱导型启动子、包含该启动子的重组表达载体及应用的制作方法与工艺
- 受植物激素调控的启动子及其应用的制作方法与工艺
- 一种受盐诱导的特异性诱导型启动子DNA序列及应用的制作方法与工艺
- 受维甲酸调控的具有浓度依赖效应的重组启动子及其使用的制作方法与工艺
- 一种磷酸盐诱导启动子降低黑曲霉β‑葡萄糖苷酶表达酶活的方法与流程
- 一种疫霉诱导性人工合成启动子PMP1及其重组表达载体和应用的制作方法与工艺
- 一种植物盐/干旱诱导型启动子soyEQ及其应用的制作方法与工艺
- 新型的L-苏氨酸-诱导型启动子及其应用的制作方法与工艺
- 一种植物茉莉酸甲酯诱导表达启动子PosMeJ1及其应用的制作方法与工艺
- 一个逆境诱导启动子SlWRKY31P的克隆及应用的制造方法与工艺
- 一种基于转录组测序构建的棒状杆菌组成型表达载体启动子的制造方法与工艺
- 一种棒状杆菌组成型表达载体启动子、含有该启动子及gnd基因的表达载体的制造方法与工艺
- 一种棒状杆菌组成型表达载体启动子、含有该启动子及lrp基因的表达载体的制造方法与工艺
- 一株呕吐毒素降解菌及其应用的制造方法与工艺
- 一种具有家蚕血细胞特异性活性的启动子的鉴定方法与流程
- 一种改造的质粒复制子及其应用的制造方法与工艺
- 一种水稻种子特异性启动子Posseed及其应用的制造方法与工艺
- 一种在水稻幼穗特异表达的启动子及其应用的制造方法与工艺
- 一种表达外源基因的启动子及其应用的制造方法与工艺
- 可诱导的CRISPRon或CRISPRi小鼠胚胎干细胞及其应用的制造方法与工艺