一种成人型多囊肾的检测方法与流程
本发明属于遗传病基因检测技术领域,涉及一种成人型多囊肾的检测方法。
背景技术:
多囊肾是一种常见的遗传性肾病,主要表现为双侧肾脏出现多个大小不一的囊肿,囊肿进行性增大占位,挤压正常肾单位,破坏肾脏的结构和功能,最终导致终末期肾病。该病临床常表现为多发性肾脏囊肿、进行性肾功能衰竭、持续性高血压和泌尿系感染等症状,还可合并其他器官囊肿(肝囊肿、胰腺囊、卵巢囊肿等),脑血管畸形,动脉瘤,心脏瓣膜病变,门脉高压等多种并发症。由于目前缺乏有效治疗手段,多数患者发展为终末期肾衰而不得不进行肾脏替代治疗或肾移植手术。
目前现有技术中采用的探针捕获技术或普通长片段扩增,但是都存在假基因的干扰或随机突变等问题,随机突变率高,特异性低,检测结果可靠性低。
专利申请号为cn201610005746.0的发明专利公开了一种通过靶向高通量半导体测序技术检测多囊肾致病基因突变的dna文库及其应用。具体来说,根据6个多囊肾病致病基因,设计引物池,对样本基因组dna进行超多重pcr扩增,扩增产物利用高通量半导体测序技术进行测序,寻找致病突变,明确多囊肾的遗传学病因,为临床诊断提供遗传学和分子生物学的理论依据,为多囊肾患者晚期移植手术供体鉴别提供支持,为多囊肾患者进行选择性优生优育提供基础。该发明涉及6个基因检测区域能够检测常染色体显性多囊肾和常染色体隐性多囊肾,但是并没有提供详细快速的检测方法。
技术实现要素:
为了克服现有技术的不足,本发明提供一种成人型多囊肾的检测方法,采用长片段特异扩增技术,可以避免假基因、复杂模板的干扰,得到特异的目标片段。长片段序列建库在基因组建库的基础上,通过调整试验参数,完成二代测序文库构建,可以一次性完成测序结果,便于流程化检测多囊肾的实现。测序结果分析流程基于snp分析流程,通过参数调整,使之完成适合本检测方法的准确检测,能够快速找出有效突变信息,并对其作出致病性判读,直接给出二代测序检测报告。同时,一代测序可以验证致病突变二代测序检出结果是否正确,从而保证检测结果的可靠性,满足应用与临床检测的各个要求,便于规范化批量样本检测,并给出可靠的检测结果。
本发明提供了如下的技术方案:
一种成人型多囊肾的检测方法,包括以下步骤:
(1).长片段pcr,pcr产物电泳质检;
(2).pcr产物回收、纯化;
(3).构建文库;
(4).rt-pcr定量;
(5).测序;
(6).信息分析。
(7).一代测序验证
(8).检测报告。
优选的是,所述步骤(2)中pcr产物回收、纯化的具体方法为:将pcr产物按1:1混匀,向混合物中加入0.1×积分数的proteinasek,振荡混匀,离心,室温孵育,加入ampurexp磁珠,混匀后离心,孵育后,将离心管置于磁力架上,待溶液澄清,吸弃上清液,加入乙醇,待溶液澄清后,丢弃上清液,重复多次,室温晾干磁珠。加入nf·h2o振荡混匀,室温孵育后,离心,待溶液澄清,吸取上清液,测定浓度后保存备用。
上述任一方案优选的是,所述步骤(3)中构建文库具体包括片段化;富集;长度分选、纯化;电泳质检。
上述任一方案优选的是,所述片段化的具体方法为:取纯化后混合产物解冻,在pcr管中加入各反应组分吹打混匀,进行pcr反应;涡旋振荡混匀ampurexp磁珠并吸取至ep管中,把片段化产物移入离心管中,吹打混匀,室温孵育;将反应管离心后分离磁珠和液体,移除上清液;保持离心管始终处于磁力架中,漂洗磁珠,于室温孵育后移除上清,室温晾干,加入nf·h2o洗脱,吹打混匀,室温孵育,离心后分离磁珠和溶液,待溶液澄清吸取上清至pcr管中。
上述任一方案优选的是,所述长度分选、纯化的具体方法为:振荡混匀ampurexp磁珠并吸取部分至ep管中,然后把起始pcr产物移入离心管中,轻轻吹打充分混匀,室温孵育;将离心管离心后分离磁珠和溶液,转移上清液至干净离心管中,振荡混匀ampurexp磁珠,吸取部分至上清液中,轻轻吹打充分混匀,室温孵育;将离心管离心后分离磁珠和溶液,弃上清;加入乙醇漂洗磁珠,于室温孵育后移除上清;室温晾干,加入nf·h2o洗脱,充分混匀,室温孵育;离心后分离磁珠和溶液,吸澄清溶液至灭菌pcr管中。
上述任一方案优选的是,所述步骤(4)rt-pcr定量包括以下步骤:
(6.1).配置qpcr体系和重复的反应体系,每个样本两次重复;
(6.2).稀释样本文库:取2μl测试样本文库,用无核酶水在低吸附试管内1:1000,分两次稀释,先1:10稀释,再1:100稀释;
(6.3).pcr试剂放置冷冻试剂在冰盒内,充分混匀试剂,离心;
(6.4).每个反应,吸取16μl的混合溶液到每个pcr反应管内;
(6.5).加4μl的稀释标准文库和待测试文库到每个pcr反应管内;
(6.6).加4μl无核酶水到没有模板反应管内作为阴性对照;
(6.7).密封pcr管,简单离心收集样本并减少气泡生成;
(6.8).运行实时定量pcr反应,计算文库的浓度。
上述任一方案优选的是,所述步骤(5)中测序的方法为:对每个定量的文库进行稀释,并将稀释浓度相同的多个文库按照数据量比例混匀;任意二代测序仪按其上机测序要求完成操作,要求双端测序总测序长度>150bp,或单端>200bp,双index测序,数据量为0.5m。
上述任一方案优选的是,所述步骤(6)中信息分析时通过bwa(burrows–wheeleralignment)软件将测得的序列与人类基因组参考序列进行比对,采用gatk(genomeanalysistoolkit)软件识别突变位点,并筛选出高质量结果,然后采用annovar综合注释软件对突变位点的人群频率,保守性和对蛋白结构和功能影响剧烈程度进行评估,进一步提取人群频率低,保守性高,对蛋白结构或功能有剧烈影响的突变,最后结合功能注释结果,频率注释和文献报道,按照acmg突变位点致病性注释标准指南,对位点进行致病性注释,筛选出明确致病或可能致病的突变位点。
上述任一方案优选的是,所述步骤(7)中一代测序进行验证的方法为:对二代测序检出突变点所在的片段进行长片段扩增,针对突变点设计验证引物,扩增完成后,用验证引物对二代测序检测突变点进行一代测序验证。
上述任一方案优选的是,所述步骤(7)中检测报告至少包括:病人基本信息、样本基本信息、二代测序检测结果、一代测序验证结果、疾病描述,突变点致病类型和参考文献。
有益效果
(1).本发明提供一种成人型多囊肾的检测方法,采用长片段特异扩增技术,可以避免假基因、复杂模板的干扰,得到特异的目标片段。相较于现有探针捕获技术,本发明可以排除假基因的干扰;普通长片段扩增由于体系的问题,会引入随机突变,本发明通过体系优化,得到的扩增产物经检测检测出1/10000的随机突变,明显低于优化前;普通长片段扩增会有较多的非特异扩增,本发明体系优化后特异性高,扩增条带单一,本发明的分析方法也确认捕获方案的可靠性,并未出现异于正常范围的突变数,实验及分析方法统一性好,利于数据解读。
(2).本发明建库方案经过优化,可以得到最优的检测方案,文库片段及捕获片段均一性等方面能很好满足测序分析的需要。
(3).本发明的分析方法可以通过设置的阈值排除扩增引入随机突变,提高分析结果准确性;本发明建立了多囊肾检测突变位点判读方法(文献+频率数据库),在其他公用数据库比对后,可用自建数据库进一步比对,给出精确的分析结果,标注各个突变类型。
(4).本发明有现有引物,可以用一代测序快速验证二代测序检出结果的准确性,能满足临检报告的检测周期,快速得到验证数据。
(5).本发明有完整的检测方案,从检测到验证,有完整的操作规范,可以应用于多囊肾的临床检测,各部分质检体系完整,能够把控实验及分析各个环节,保证检测流程的可靠性。
附图说明
图1为本发明成人型多囊肾的检测方法一优选实施例的文库质检结果;
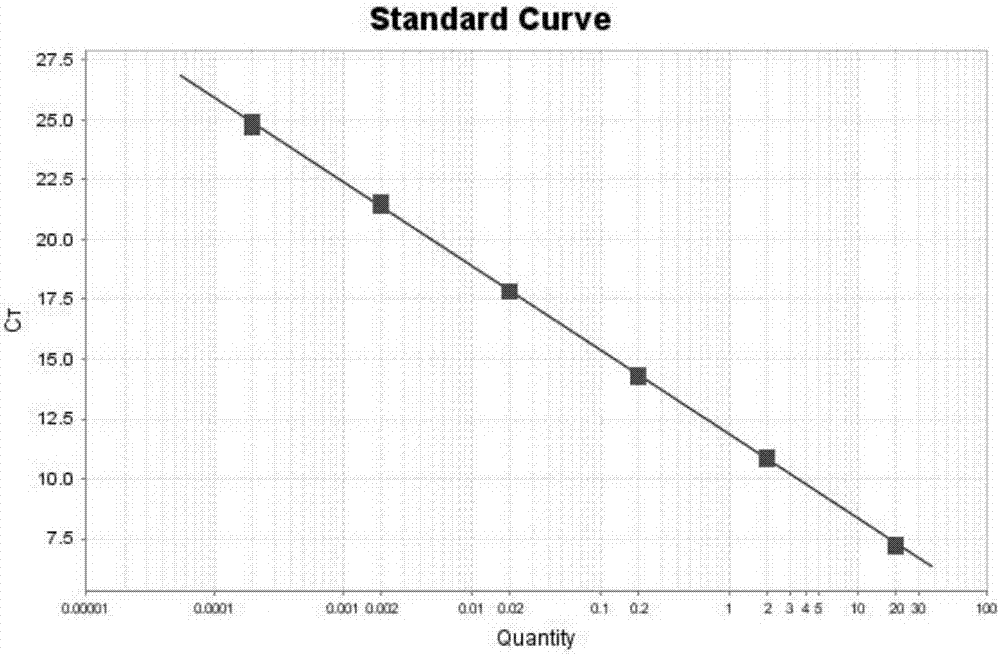
图2为本发明成人型多囊肾的检测方法一优选实施例的标准曲线图;
图3为本发明成人型多囊肾的检测方法一优选实施例的标准文库和多个测试文库的典型定量扩增图谱;注:1.曲线扩增效率在90-110%(e=10-1/a-1;2.曲线相对系数r2>0.99;3.标准品△cq值在3.1-3.6;
图4为本发明成人型多囊肾的检测方法一优选实施例的稀释文库的浓度;
图5为本发明成人型多囊肾的检测方法一优选实施例的flowcell各组份位置图;
图6为本发明成人型多囊肾的检测方法一优选实施例的测序结果在pkd1基因外显子区的覆盖情况;
图7为本发明成人型多囊肾的检测方法一优选实施例的pkd1/pkd2基因靶向捕获二代测序信息分析流程;
图8为本发明成人型多囊肾的检测方法一优选实施例的测序结果峰图;
图9为本发明成人型多囊肾的检测方法一优选实施例的一代测序结果一部分检测报告;
图10为本发明成人型多囊肾的检测方法一优选实施例的一代测序结果另一部分检测报告。
具体实施方式
为了进一步了解本发明的技术特征,下面结合具体实施例对本发明进行详细地阐述。实施例只对本发明具有示例性的作用,而不具有任何限制性的作用,本领域的技术人员在本发明的基础上做出的任何非实质性的修改,都应属于本发明的保护范围。
实施例一
二代测序检测
1.多重pcr
通过多种pcr酶验证,本发明选择保真性、扩增效率、不同长度片段扩增均衡性等表现最好的酶kod-multi&epi。引物来自自主设计及文献参考,具体序列如表1所示。
表1引物信息
1.1反应体系
1.2反应条件:
pkd1
pkd2:
1.3pcr产物电泳质检
2.pcr产物回收
本实验采用ampurexp珠子纯化。
(1).取一1.5ml离心管,将上述7组pcr产物按1:1混匀。即7x10ul,混合后约63ul。
(2).向混合物中加入0.1×体积分数的proteinasek(7ul)。振荡混匀,短暂离心。
(3).室温孵育10min(期间每隔2min振荡混匀一次)。
(4).加入0.6×积分数的ampurexp磁珠(42ul),混匀后短离心,室温静置,孵育5min。
(5).将离心管置于磁力架上。
(6).待溶液澄清,用移液枪小心吸弃上清液(防止吸取到磁珠)。
(7).加入80%乙醇200ul,待溶液澄清后,用移液枪小心吸取丢弃上清液(防止吸取到磁珠)。
(8).重复步骤7一次。
(9).将离心管从磁力架上取下置于离心机中简短离心后放回磁力架。
(10).待溶液澄清,用10ul长枪头吸弃上清液(防止吸取到磁珠)。
(11).室温晾干磁珠。(注意:乙醇残留会抑制后续的酶反应,所以晾干时要确保乙醇挥发干净。但也不要干燥太长时间,以免难以洗脱核酸。)
(12).将离心管从磁力架上取出,加入30ul的nf·h2o振荡混匀,室温孵育5min(期间每隔1min振荡混匀一次)。
(13).将离心管简短离心置于磁力架,待溶液澄清,吸取上清液28ul置于新的1.5ml离心管。
(14).用qubit3.0测定浓度后于-20℃保存或立即进行后续实验
3.建库
3.1片段化
(1).取上述纯化后混合产物50ng备用。
(2).于室温解冻5×ttbl,上下颠倒混匀后备用。
(3).在灭菌pcr管中依次加入各反应组分:
注:尝试了5ul,6ul两个酶用量。
(4).使用移液器轻轻吹打20次充分混匀(重要)
(5).将pcr管置于pcr仪中,设置如下反应程序:
注:尝试了2min,10min两个片段化时间。
(6).涡旋振荡混匀ampurexp磁珠并吸取50ul至1.5mlep管中,然后把片段化产物全部移入离心管中,使用移液器轻轻吹打10次充分混匀,室温孵育5min(期间每隔1min振荡混匀一次)。
(7).将反应管简短离心置于磁力架上分离磁珠和液体,待溶液澄清小心移除上清液。
(8).保持离心管始终处于磁力架中,加入200ul新鲜配置的80%乙醇漂洗磁珠。于室温孵育30sec后小心移除上清。
(9).重复步骤8一次。
(10).保持离心管始终处于磁力架中,开盖室温晾干。
注意:乙醇残留会抑制后续的酶反应,所以晾干时要确保乙醇挥发干净。但也不要干燥太长时间,以免难以洗脱核酸。
(11).将离心管从磁力架中取出,加入26ulnf·h2o洗脱。涡旋振荡或移液器轻轻吹打充分混匀,室温孵育3min(期间每隔1min振荡混匀一次)。
(12).将离心管简短离心置于磁力架中分离磁珠和溶液。待溶液澄清小心吸取24ul上清至灭菌pcr管中。
(13).立即进行步骤32。
3.2富集
将灭菌pcr管置于冰浴中,依次添加各反应组分:
接头n5xx有8种,接头n7xx有12种,共计96种组合,每批上机样本本中不得出现接头组合相同的样本,在样本量少时,选择试剂盒推荐接头组合,避免测序结果区分困难,给信息分析带来问题。
使用移液器轻轻吹打充分混匀,将pcr管置于pcr仪中进行如下反应:
3.3长度分选、纯化
起始pcr产物体积为50ul,不足50ul则用水补足。
(1).涡旋振荡混匀ampurexp磁珠并吸取37.5ul至1.5mlep管中,然后把50ulpcr产物全部移入离心管中,使用移液器轻轻吹打10次充分混匀,室温孵育5min。
(2).将离心管简短离心并置于磁力架中分离磁珠和溶液,待溶液澄清小心转移上清液至干净离心管中。
(3).涡旋振荡混匀ampurexp磁珠,吸取7.5ul至上清液中,使用移液器轻轻吹打10次充分混匀,室温孵育5min。
(4).将离心管简短离心并置于磁力架中分离磁珠和溶液,弃上清。
(5).加入200ul新鲜配置的80%乙醇漂洗磁珠。于室温孵育30sec后小心移除上清。
(6).重复步骤5一次。
(7).室温晾干5min。
注意:乙醇残留会抑制后续的酶反应,所以晾干时要确保乙醇挥发干净。但也不要干燥太长时间,以免难以洗脱核酸。
(8).加入22ulnf·h2o洗脱。涡旋振荡或移液器轻轻吹打充分混匀,室温孵育3min。
(9).简短离心置于磁力架中分离磁珠和溶液。待溶液澄清小心吸取20ul上清至灭菌pcr管中。
3.4电泳质检
对建库结果进行质检,电泳结果如图1所示。
为了保证文库定量的准确性,质控合格的样本,采用qpcr方法定量。可用appliedbiosystems7500或stepone定量pcr仪进行定量。
(1).准备足够量的试剂配置qpcr体系和重复的反应体系。每个样本需要两次重复。每个20μl体系。
(2).稀释样本文库:取2μl测试样本文库,用无核酶水在低吸附试管内1:1000,分两次稀释,先1:10稀释,再1:100稀释。
准备的测试样本文库的稀释浓度建议在梯度稀释的标准文库浓度范围内,反应每个需要2个技术重复.
(3).pcr试剂放置冷冻试剂在冰盒内。轻轻的但充分混匀每一种试剂,然后简单离心将试剂收集在管底部。
按照下表配置混合溶液。
(4).每个反应,吸取16μl的混合溶液到每个pcr反应管内
(5).加4μl的稀释标准文库和待测试文库到每个pcr反应管内。
(6).加4μl无核酶水到没有模板反应管内作为阴性对照。
(7).密封pcr管,简单离心收集样本并减少气泡生成。
(8).运行实时定量pcr反应
*可根据文库长度适当调节时间。
将pcr管放置在定量pcr仪上(注:stepone仪器,八联管放在黑色架子上,96孔板直接放孔上),运行反应并收集定量数据。
(9).定量结果:
标准文库和多个测试文库的典型定量扩增图谱如图3显示结果。典型的标准曲线如图2所示。实时定量pcr仪分析软件可以计算出稀释文库的浓度,如图4所示。
(10).对合格的样本计算样本浓度,公式如下:
样本浓度(nm)=qpcr定量浓度*452/目的片段长度(400bp)
(11).合格样本,将样本编号,样本建库标签,样本浓度录入到上机数据统计表中,供上机测序使用。
(12).浓度过低样本需重新建库(浓度需>0.5nm)。
(13).溶解曲线提示有接头(120bp)存在的文库,需将接头去除干净后重新做质控、定量。
5.测序
任意二代测序仪按其上机测序要求完成操作,依定量结果制作《上机任务单》,提取相应的文库样本并符合样本信息。按任务单要求对对每个定量的文库进行稀释,并将稀释浓度相同的多个文库按照数据量比例混匀;要求双端测序总测序长度>150bp,或单端>200bp,双index测序,数据量为0.5m。
下面以nextseq500测序流程为例描述:
5.1上机前准备
5.1.1准备文库
(1).对每个定量的文库进行稀释,取2μl文库稀释至0.5nm。并将稀释浓度相同的多个文库按照数据量比例混匀。如各文库数据量相同,则将相同浓度的文库等体积混匀即可。
(2).将-20℃保存的nextseqaccessorybox4℃解冻,解冻后将ht1放置冰上或4℃冰箱保存保持预冷状态。
(3).准备新鲜配制的0.2nnaoh
在1.5mlep管中加入以下试剂:
纯水800μl
1nnaoh200μl
振荡混匀,离心
(4).取40μl的0.5nm文库到新的1.5mlep管上与新鲜配制的40μl的0.2nnaoh等体积混合。
(5).涡旋混匀,微离。室温放置5分钟,使文库变成单链
(6).在上面体系中加入200mmtris-hcl,ph7,40μl。涡旋混匀,微离。
(7).在装有变性文库的1.5mlep管中加入880μl的预冷ht1。涡旋混匀,微离。此时终体积为1ml,文库浓度为20pm。
注:在稀释至最终上机浓度前,把20pm的文库放至冰上保存。
(8).将变性文库稀释至最终上机浓度
在ncs1.2软件中,把20pm变性文库稀释到3pm的上机浓度按下面方式混合:
20pm变性文库450μl
预冷的ht12550μl
此时文库终浓度为3pm,终体积为3ml。
(9).颠倒混匀几次,微离,放置冰上。
(10).如要混入1%phix,需将10nmphix按照步骤7、8变性稀释至20pm后,按照下面表格中的比例与样本混匀:
20pm变性phix5μl
3pm变性文库2995μl
(11).变性后的文库上机前可短时间内可4℃保存。
5.1.2试剂准备
(1).将-20℃保存的测序试剂盒reagentcartridge常温水浴解冻,约需要1小时充分解冻,上机前确定时间完全解冻方可上机。
(2).将4℃保存的nextseqflowcell室温静置,此时无需打开锡箔包装袋(上机半小时拿出即可)。
(3).准备新鲜配制的0.03%–0.06%(w/v)naocl,体积为3ml
(4).将完全解冻的reagentcartridge颠倒5次混匀,轻轻扣击桌面以去除管底气泡。
(5).在#28孔中加入3ml稀释好的0.03%–0.06%(w/v)naocl
(6).如做duoindex测序,需在#18孔中加入bp13;如做singleindex测序,则不需要进行这步操作。要明确index测序类型需核对文库制备说明书。
(7).将最终稀释变性好的文库加入样本孔#10。
(8).再次将reagentcartridge轻轻叩击桌面去除管底气泡。
(9).将flowcell从锡箔纸中取出,观察flowcell上表面是否干净。如果有灰尘,用无尘纸擦干净;观察flowcell下表面各组份是否紧扣在平面上,如有翘起,需将其归位,各组份位置如附图5所示:
5.2nextseq上机设置
(1).在ncs界面中选择sequence。flowcell舱门即会打开,系统准备运行设置。
(2).选择数据分析和存储路径。如用basespace进行数据分析,则需在basespace中设置运行参数,此时软件提醒输入basespace账号和密码。注意:这种配置需要高速而稳定的网络。
如不用basespace进行数据分析,需按照下面图示操作选择standaloneinstrument,并将outputfolder设置为服务器上用来存储数据的文件夹。注意:这种配置仅能生成bcl文件,需要进一步在服务器上进行bcltofastq转换。
(3).装入flowcell。确认屏幕上显示flowcellid。
(4).清空废液托盘。用两只手取下废液托盘,清空后重新装入废液托盘。
(5).装入缓冲液盒。确认屏幕上显示缓冲液id。
(6).装入reagentcartridge。选择load,确认屏幕上显示试剂id。
(7).设置运行参数。
在用basespace设置模式下,根据界面显示选择已设置好的运行参数即可。
在standalone模式下,在如下图的界面中输入运行参数。例如pairedend双端150循环测序,双index。
(8).选择start,测序开始运行。
6信息分析
6.1数据量及数据质量
单个样本数据量要求0.5mreads数,q30>80%,唯一比对率98%左右,图测序结果在pkd1基因外显子区的覆盖情况如图6所示。
6.2序列比对,突变识别和突变注释
采用自行组装的数据分析流程,通过bwa(burrows–wheeleralignment)软件将测得的序列与人类基因组参考序列(hg19版本,已屏蔽假基因区域)进行比对,采用gatk(genomeanalysistoolkit)软件识别突变位点,并筛选出高质量结果,然后采用annovar综合注释软件对突变位点的人群频率,保守性和对蛋白结构和功能影响剧烈程度进行评估,进一步提取人群频率低(<0.01),保守性高,对蛋白结构或功能有剧烈影响的突变,最后结合功能注释结果,频率注释和文献报道,按照acmg突变位点致病性注释标准指南,对位点进行致病性注释,筛选出明确致病或可能致病的突变位点,pkd1/pkd2基因靶向捕获二代测序信息分析流程见图7所示。
实施例二
一代测序验证
二代测序分析得到结果后,需对二代测序检出的突变点进行一代测序验证。对二代测序检出突变点所在的片段进行长片段扩增,针对突变点设计验证引物,扩增完成后,用验证引物对二代测序检测突变点进行一代测序验证。
测序结果双向核对一致,且都对该突变点有统一的检出结果(如图8)。一代测序验证后的致病突变位点即可认定为检测结果。
1pcr
二代测序分析得到结果后,需对二代测序检出的突变点进行一代测序验证。对二代测序检出突变点所在的片段进行长片段扩增,反应体系及反应条件与实施例1中的1.长片段pcr相同。针对突变点设计验证引物,扩增完成后,用验证引物对二代测序检测突变点进行一代测序验证。
2pcr产物测序
普通测序仪测序,针对检出突变信息设计双向引物,引物设计视具体突变点而定,用验证引物对二代测序检测突变点进行一代测序验证,测序长度1kb,突变点位于中间位置,保证双向测序时能在稳定区域内检出突变点。
3测序产物分析
查看测序峰图,双向测序结果比对,确认突变信息。结果必须保证测序结果双向核对一致,且都对该突变点有统一的检出结果(如图8)。一代测序验证后的致病突变位点即可认定为检测结果,。
4检测报告
结合样本的临床表现,影像学检测,生化检测结果和基因检测结果,综合判断,按临床要求给出检测报告。
检测结束后出具一份检测报告,包括二代测序检出结果,检出突变的一代测序验证结果,疾病描述,突变点解读,参考文献,其他备注或补充信息,一代测序结果报告如图9和图10所示。
- 还没有人留言评论。精彩留言会获得点赞!