癌症中的T细胞亚群及其特征基因的制作方法
本发明涉及生物
技术领域:
,尤其是总体上涉及细胞或细胞亚群,特别是源自肿瘤组织的t细胞亚群的鉴定、表征以及富集。本发明也涉及分离肿瘤中t细胞亚群的一系列标记、分离方法和所得到的制剂,以及使用分离的t细胞亚群用于药物研究与开发和用于诊断、治疗和其他临床与非临床应用。
背景技术:
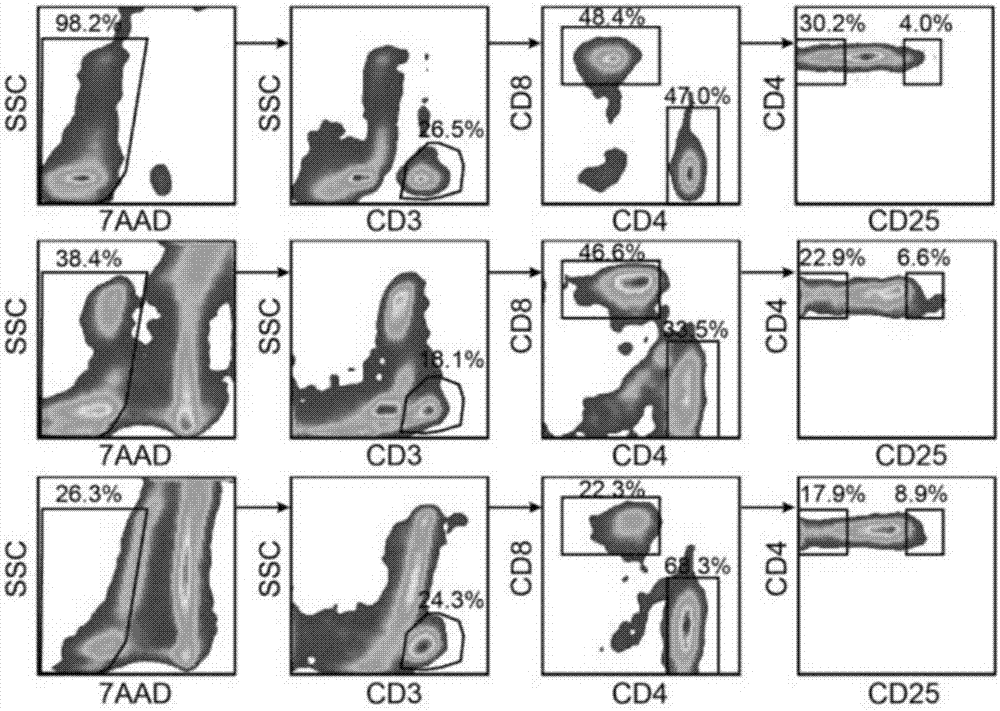
一般认为,t淋巴细胞参与的适应性免疫应答被认为是人体对抗肿瘤细胞主要途径之一。当前免疫治疗已经成为肿瘤临床治疗中不可或缺的环节。免疫治疗的药物和方案涉及到机体免疫系统识别和攻击癌细胞的各个阶段。已有的肿瘤免疫的药物包括以下多个类型:靶向癌细胞的抗体、过继细胞治疗、溶瘤病毒、树突状细胞相关治疗、dna和蛋白水平的肿瘤疫苗、免疫激活细胞因子以及其他免疫调节化合物。这些药物涉及机体免疫系统识别和杀伤肿瘤的各个阶段。其中针对t细胞检验点抑制蛋白的抗体类药物和肿瘤抗原特异性的t细胞过继疗法近年来取得突破,广受瞩目。针对t细胞检验点抑制剂是一种抗体类免疫治疗,通过恢复细胞毒t细胞(cytotoxictlymphocyte,ctl)的活性来监控和杀死肿瘤细胞。肿瘤微环境中的效应t细胞受到抑制而无法杀死肿瘤细胞,这是由于肿瘤中存在多种免疫逃逸机制。人们针对已知的免疫逃逸机制设计出加强或阻碍相关通路的抗体,从而增强免疫系统的作用。例如靶向ctla-4的药物ipilimumab,通过阻断ctla-4来解除调节性t细胞(tregular,treg)对ctl的抑制作用。pd-1是t细胞表面表达的pd-l1/l2的受体,后者在肿瘤细胞表面表达,两者结合后会激活t细胞的凋亡通路。抗体类药物nivolumab通过阻断t细胞表面的pd-1来抑制其与pd-l1/l2的结合,从而抑制t细胞失活或凋亡,使ctl始终具有免疫活性。反过来,靶向pd-l1的mdx-1151也可以有效的提高肺癌、黑色素瘤和肾癌的生存率。但是,与靶向治疗等类似,t细胞检验点抑制剂的靶点仍有进一步拓展的空间;同时,如何寻找到更多的有效应答的患者,也需要从生物学上系统的了解t细胞在癌组织中的反应过程。另一方面,肿瘤的早期诊断、早期治疗和预后的判断,对提高肿瘤的治疗效果、患者的生存率有重要意义。利用分子生物学技术确定可靠的肿瘤标志物,对预测肿瘤临床结局,靶向治疗和评价疗效均有重要意义。目前发现的肿瘤预后标志物主要包括抑癌基因、癌基因、细胞周期调控因子、凋亡调控因子、侵袭和转移相关标志物、端粒酶等。能够用于监测和评估肿瘤免疫状态的分子标志物还很少。理解免疫系统与癌组织的相互作用成为开发和改善免疫疗法的关键,也能对机体的肿瘤免疫状态提供评估和监测的手段。但是浸润到癌组织中t细胞(tumorinfiltratinglymphocyte,til)的类别、分化以及受抑制的途径迄今还没有被完整理解。目前已知til中存在耗竭t细胞、失能的t细胞或老化的t细胞群体。考虑到人体免疫细胞、特别是t细胞类型的复杂性,需要从更高精度认识与肿瘤相关的免疫细胞的分类、分化过程和功能基因,进一步为肿瘤免疫治疗药物开发提供更多潜在的免疫靶点,以及可用于肿瘤预后的分子标志物。近年来,迅速发展的单细胞测序技术为群体细胞以及单细胞的基因表达差异研究提供了有力的支撑。目前已发展出strt-seq(single-celltaggedreversetranscriptionsequencing)、smart-seq和smart-seq2、cell-seq(cellexpressionbylinearamplificationandsequencing)和pma-seq(phi29-mrnaamplificationandsequencing)等单细胞转录组深度测序方法,以及多种与之匹配的生物信息学分析方法。技术实现要素:本发明发明人利用单细胞转录组分析技术,通过分析癌症组织中浸润的t细胞的单细胞基因表达谱,分离和表征了能反映机体肿瘤免疫状态的t细胞亚群,并进一步研究确定了该细胞亚群所表达的新的特征基因,以及这些特征基因与肿瘤预后之间的关系,在此基础上完成了本发明。因此,本发明在广义上是针对可以用来鉴定或表征并且任选地用来分离、划分、分开或富集与肿瘤免疫有关的t细胞亚群的一系列标记、方法、化合物、组合物和制造品。所述的t细胞包括cd8+t细胞和cd4+t细胞,尤其是耗竭性cd8+t细胞和调节性cd4+t细胞。更具体地,本申请的发明人已经发现一系列可以独立或共同地用来精确鉴定、分选、富集和/或表征来自肿瘤的t细胞亚群的标记。使用选择的生物化学技术,通过本发明的标记与肿瘤组织中的t细胞关联,能够富集、分离或纯化出反映肿瘤免疫状态的t细胞亚群。本发明公开的这些标记,能够识别或鉴定来自肿瘤的t细胞亚群,构成这类肿瘤免疫细胞的通用性表征,能用于治疗靶标的阐明和药物化合物的筛选。而且,可以进一步在临床和非临床中使用,用于肿瘤患者的诊断、预后、分类、监测和管理,以及提供相关的试剂盒或其他制造品。本发明的第一方面提供:一种用于诊断或监测的cd8+t细胞的生物标志物组,其包含基因wars和acp5,或者所述基因所表达的蛋白或蛋白片段。优选,所述生物标志物组进一步包含基因havcr2,pdcd1和lag3中至少一种,或者所述至少一种基因所表达的蛋白或蛋白片段。例如,所述生物标志物组包含基因wars、acp5和havcr2,或者所述基因所表达的蛋白或蛋白片段;或者,所述生物标志物组包含基因wars、acp5和pdcd1,或者所述基因所表达的蛋白或蛋白片段;或者,所述生物标志物组包含基因wars、acp5和lag3,或者所述基因所表达的蛋白或蛋白片段;或者,所述生物标志物组包含基因wars、acp5、havcr2和pdcd1,或者所述基因所表达的蛋白或蛋白片段;或者,所述生物标志物组包含基因wars、acp5、havcr2和lag3,或者所述基因所表达的蛋白或蛋白片段;或者,所述生物标志物组包含基因wars、acp5、pdcd1和lag3,或者所述基因所表达的蛋白或蛋白片段;或者,所述生物标志物组包含基因wars、acp5、havcr2、pdcd1和lag3,或者所述基因所表达的蛋白或蛋白片段。最优选,所述生物标志物组包含基因wars、acp5、havcr2、pdcd1和lag3,或者所述基因所表达的蛋白或蛋白片段。所述诊断或监测可以是诊断或监测cd8+t细胞的耗竭状态。所述诊断或监测可以是诊断或监测肿瘤的预后。与患者正常组织或外周血中的cd8+t细胞相比,上述五种基因中的至少一种的表达或表达增加,表示所述cd8+t细胞处于耗竭状态,进一步,预示着患者预后不佳。一种用于诊断或监测的cd4+t细胞的生物标志物组,其包含基因stam和batf,或者所述基因所表达的蛋白或蛋白片段。优选,所述生物标志物组进一步包含基因tnfrsf4和/或基因ctla4,或者所述基因所表达的蛋白或蛋白片段。例如,所述生物标志物组包含基因stam、batf和tnfrsf4,或者所述基因所表达的蛋白或蛋白片段;或者,所述生物标志物组包含基因stam、batf和ctla4,或者所述基因所表达的蛋白或蛋白片段;或者,所述生物标志物组包含基因stam、batf、tnfrsf4和ctla4,或者所述基因所表达的蛋白或蛋白片段。最优选,所述生物标志物组包含基因stam、batf、tnfrsf4和ctla4,或者所述基因所表达的蛋白或蛋白片段。所述诊断或监测可以是诊断或监测cd4+t细胞是否为活性的调节性t细胞。所述诊断或监测可以是诊断或监测肿瘤的预后。与患者正常组织或外周血中的cd4+t细胞相比,所述基因的表达或表达增加,表示所述cd4+t细胞为活性的调节性t细胞,进一步,预示着患者预后不佳。在本发明的一个实施方式中,所述肿瘤包括肝癌,尤其是肝细胞癌。本发明的第二个方面提供:一种用于诊断或监测肿瘤预后的试剂盒,所述试剂盒包含能与cd8+t细胞的基因wars或其表达的蛋白或蛋白片段相结合的结合剂,以及,能与cd8+t细胞的基因acp5或其表达的蛋白或蛋白片段相结合的结合剂。优选,所述试剂盒进一步包含能与cd8+t细胞的基因havcr2或其表达的蛋白或蛋白片段相结合的结合剂,和/或,能与cd8+t细胞的基因pdcd1或其表达的蛋白或蛋白片段相结合的结合剂,和/或,能与cd8+t细胞的基因lag3或其表达的蛋白或蛋白片段相结合的结合剂。最优选,所述试剂盒包含能与cd8+t细胞的基因wars或其表达的蛋白或蛋白片段相结合的结合剂,能与cd8+t细胞的基因acp5或其表达的蛋白或蛋白片段相结合的结合剂,能与cd8+t细胞的基因havcr2或其表达的蛋白或蛋白片段相结合的结合剂,能与cd8+t细胞的基因pdcd1或其表达的蛋白或蛋白片段相结合的结合剂,以及,能与cd8+t细胞的基因lag3或其表达的蛋白或蛋白片段相结合的结合剂。一种用于诊断或监测肿瘤预后的试剂盒,所述试剂盒包含能与cd4+t细胞的基因stam或其表达的蛋白或蛋白片段相结合的结合剂,以及,能与cd4+t细胞的基因batf或其表达的蛋白或蛋白片段相结合的结合剂。优选,所述试剂盒进一步包含能与cd4+t细胞的基因tnfrsf4或其表达的蛋白或蛋白片段相结合的结合剂,和/或,能与cd4+t细胞的基因ctla4或其表达的蛋白或蛋白片段相结合的结合剂。所述的结合剂包括核酸、配体、酶、底物、抗体等。在本发明的一个实施方式中,所述试剂盒包括包含一种或多种所述结合剂的一个容器或多个容器。进一步优选,还包含使用所述试剂盒的指导材料,例如说明书。在本发明的一个优选实施方式中,所述肿瘤包括肝癌,尤其是肝细胞癌。本发明的第三个方面提供:一种抑制剂在制备肿瘤治疗药物中的应用,所述抑制剂抑制目标基因的表达或抑制目标基因表达的蛋白,所述基因选自由以下基因组成的组:wars,acp5,stam和batf。在本发明的一个优选实施方式中,所述肿瘤包括肝癌,尤其是肝细胞癌。由于wars或acp5的表达或者高表达会导致相应的cd8+t细胞处于耗竭状态,stam或batf的表达或高表达会导致cd4+t细胞转化为调节性t细胞,抑制这些基因的表达或者抑制所表达蛋白的活性,将有利于恢复耗竭状态的cd8+t细胞的活性,或抑制cd8+t细胞失活或凋亡,或解除调节性t细胞对细胞毒t细胞的抑制作用,从而实现治疗肿瘤的效果。本发明的第四个方面提供:筛选药物的方法,该方法包括以下步骤:1)将受试化学物质与所述基因或其表达的蛋白混合,或者将受试化学物质与表达所述基因的cd8+t细胞或者cd4+t细胞混合;2)检测所表达蛋白的活性变化、或者受试化学物质是否与所述基因或其表达的蛋白结合、或者所述细胞的活性变化、或者所述细胞的所述基因表达量的变化;所述基因选自由以下基因组成的组:wars,acp5,stam和batf。在本发明的一个优选实施方式中,所述药物用于治疗肿瘤。在本发明的一个实施方式中,所述肿瘤包括肝癌,尤其是肝细胞癌。本发明的第五个方面提供:一种cd8+t细胞亚群,其表达基因wars和acp5。所述cd8+t细胞亚群可进一步表达基因havcr2,pdcd1和lag3中的至少一种。例如,所述cd8+t细胞亚群表达基因wars、acp5和havcr2;或者,所述cd8+t细胞亚群表达基因wars、acp5和pdcd1;或者,所述cd8+t细胞亚群表达基因wars、acp5和lag3;或者,所述cd8+t细胞亚群表达基因wars、acp5、havcr2和pdcd1;或者,所述cd8+t细胞亚群表达基因wars、acp5、havcr2和lag3;或者,所述cd8+t细胞亚群表达基因wars、acp5、pdcd1和lag3;或者,所述cd8+t细胞亚群表达基因wars、acp5、havcr2、pdcd1和lag3。所述cd8+t细胞亚群是耗竭性t细胞。本发明的发明人通过对比研究首次发现,表达基因wars和acp5的cd8+t细胞处于耗竭状态。所述cd8+t细胞亚群在浸润到肿瘤中的t细胞中的占比越大,预示着患者浸润到肿瘤中的t细胞杀伤肿瘤细胞的能力越弱,患者预后越差;所述cd8+t细胞亚群表达wars、acp5、havcr2、pdcd1和lag3五种基因中的基因种类越多,其对患者的肿瘤免疫状态的诊断越准确,对患者预后判断越准确。一种cd4+t细胞亚群,其表达基因stam和batf。所述cd4+t细胞亚群可进一步表达基因tnfrsf4,和/或ctla4。例如,所述cd4+t细胞亚群表达基因stam、batf和tnfrsf4;或者,所述cd4+t细胞亚群表达基因stam、batf和ctla4;或者,所述cd4+t细胞亚群表达基因stam、batf、tnfrsf4和ctla4。所述cd4+t细胞亚群是调节性t细胞。本发明的发明人通过对比研究首次发现,表达基因stam和batf的cd4+t细胞是调节性t细胞,对细胞毒性t细胞产生抑制性调节作用。所述cd4+t细胞亚群在浸润到肿瘤中的t细胞中的占比越大,预示着患者浸润到肿瘤中的t细胞杀伤肿瘤细胞的能力越弱,患者预后越差;所述cd4+t细胞亚群表达stam、batf、tnfrsf4和ctla4四种基因中的基因种类越多,其对患者的肿瘤免疫状态的诊断越准确,对患者预后判断越准确。在本发明的一个优选实施方式中,上述两种t细胞亚群均来自于肿瘤。在本发明的一个具体实施方式中,所述肿瘤为肝癌,特别是肝细胞癌。本发明的第六个方面提供:富集第五方面所述的t细胞亚群的方法。该方法包括以下步骤:使浸润到肿瘤的免疫细胞群与结合剂接触,该结合剂与至少一种上述基因或其表达的蛋白或蛋白片段相结合;并且,分选与所述结合剂结合的免疫细胞,以提供富集的t细胞亚群。所述的结合剂包括核酸、配体、酶、底物、抗体等。作为本发明的一个实施方式,富集一种cd8+t细胞亚群的方法,该方法包括以下步骤:使浸润到肿瘤的免疫细胞群与结合剂接触,该结合剂与目标基因或其表达的蛋白或蛋白片段相结合;并且,分选与所述结合剂结合的免疫细胞,以提供富集的cd8+t细胞亚群。所述目标基因包括wars和acp5。优选,所述目标基因进一步包括havcr2,pdcd1和lag3中的至少一种。作为本发明的另一个实施方式,富集一种cd4+t细胞亚群的方法,该方法包括以下步骤:使浸润到肿瘤的免疫细胞群与结合剂接触,该结合剂与目标基因或其表达的蛋白或蛋白片段相结合;并且,分选与所述结合剂结合的免疫细胞,以提供富集的cd4+t细胞亚群。所述目标基因包括stam和batf。优选,所述目标基因进一步包括tnfrsf4,和/或ctla4。在本发明的优选实施方式中,所述分选步骤包括荧光激活细胞分选、磁辅助细胞分选、底物辅助细胞分选、激光介导切割、荧光测定法、流式细胞术或显微技术。在本发明的一个优选实施方式中,所述肿瘤为肝癌,特别是肝细胞癌。本发明的第七个方面提供:一种诊断或评价的方法,该方法包括以下步骤:1)将从受试者处获得的浸润到肿瘤中的免疫细胞样品分类为cd8+t细胞和cd4+t细胞;和,2)将分出的cd8+t细胞与至少一种结合剂接触,该结合剂与目标基因或其表达的蛋白或蛋白片段相结合,所述目标基因包括wars和acp5;和/或,3)将分出的cd4+t细胞与至少一种结合剂接触,该结合剂与目标基因或其表达的蛋白或蛋白片段相结合,所述目标基因包括stam和batf。所述的结合剂包括核酸、配体、酶、底物、抗体等。优选步骤2)中,所述目标基因进一步包括havcr2,pdcd1和lag3中的至少一种。优选步骤3)中,所述目标基因进一步包括tnfrsf4,和/或ctla4。在本发明的一个优选实施方式中,所述肿瘤为肝癌,特别是肝细胞癌。在本发明的一个实施方式中,该方法在患者接受治疗之前进行。在其他实施例中,该方法可以在受试者接受治疗之后进行,例如化疗后、放疗后、手术治疗后等。在本发明的一个实施方式中,所述方法用于判断受试者的预后情况。本发明的第八个方面提供:一种t细胞的单细胞转录组分析方法,所述方法包括如下步骤:(1)获得单个的t细胞;(2)构建每个t细胞的cdna文库并测序,获得每个细胞每个基因的表达量;(3)依据每个细胞每个基因的表达量,对t细胞进行非监督聚类;(4)分析每一类t细胞的特征表达基因。根据本发明,可采用本领域已知的各种方法获得单个的t细胞,例如对于血液中的单个t细胞,可采用密度梯度离心法;对于组织中的单个t细胞,可采用研磨法。根据本发明,可采用本领域已知的各种单细胞转录组的cdna文库构建方法,构建每个t细胞的cdna文库并测序,获得每个细胞每个基因的表达量,例如:汤富酬2009年创立的方法(tang,f.etal.rna-seqanalysistocapturethetranscriptomelandscapeofasinglecell.nat.protoc.5,516–535(2010))、strt-seq(single-celltaggedreversetranscriptionsequencing)、smart-seq和smart-seq2、cell-seq(cellexpressionbylinearamplificationandsequencing)和pma-seq(phi29-mrnaamplificationandsequencing)等方法。在本发明的一个优选实施方式中,采用smart-seq2构建每个t细胞的cdna文库并测序,获得每个细胞每个基因的表达量。本发明的发明人,对比研究了汤富酬2009年创立的方法和smart-seq2,发现smart-seq2法在保证测序质量的情况下可以检测到更多的基因,包括t淋巴细胞共有的标志物cd3基因;并且smart-seq2法更有利于扩增出完整的cdna,更适用于进行t细胞单细胞转录组扩增。本发明的发明人通过实验研究,进一步改进了smart-seq2中的操作条件,提高了mrna的反转录收率,以及pcr扩增后产物的纯化效率。在本发明的具体实施方式中,采用smart-seq2法反转录时,采用如下的反转录条件,提高了反转录cdna的产率和cdna全长的比例:相比于常用的50℃30分钟的反转录条件,改进后的反转录条件能将cdna产率提高16~23%,cdna全长的平均长度提高20%左右。在本发明的具体实施方式中,采用smart-seq2法对pcr扩增产物纯化时的方法如下,极大的提高了pcr产物的纯度,有利于后续的测序和文库构建质量的提高:用磁珠进行纯化,第一次纯化时,所加入的磁珠体积与pcr扩增产物体积相同,第二次纯化时,所加入的磁珠体积为pcr扩增产物体积的2倍。根据本发明,在进行步骤(3)的分析时,对步骤(2)获得的生物信息数据进行比对和质量控制,去除低质量的部分。根据本发明,对于cdna的测序读段(reads)数据质量控制的方法为:保留符合以下条件的测序读段:①未知碱基占给定读段总序列不超过10%,②phred质量值低于5的碱基不超过50%,③不含有接头序列。根据本发明,对于细胞质量控制的方法为,去除数据量和数据质量低的细胞,保留符合以下条件的细胞:①cd3d的tpm大于3;②当分离cd4+t细胞时,cd4的tpm需要大于3,同时cd8的tpm小于30;③分离cd8+t细胞时,cd8的tpm需要大于3,同时cd4的tpm小于30;④线粒体基因上的读段占所有读段的比例不高于10%。其中,tpm值的定义为:其中cij表示为基因i在细胞j中的读段的数量。根据本发明,对用于分析的单细胞的基因表达量的质量控制方法为:当一个基因在所有细胞中被检测到的读段平均数量大于1才用于后续分析。根据本发明,对所有基因的表达量进行log2转化,并将每个基因在每个患者中表达的log2转化后的平均值设定为0,从而便于比较给定基因在不同患者中的表达差异。根据本发明,在步骤(3)中可采用本领域已知的各种软件,对表达基因进行比对分析,包括但不限于gsnap软件;可采用本领域已知的各种软件,分析各读段在基因上的归属,包括但不限于r语言包“findoverlaps”。根据本发明,步骤(3)的非监督聚类分析利用软件sc3进行。软件sc3的工作原理和步骤如下:筛选方差最大的n个基因进行谱聚类:计算spearman相关系数作为细胞间距离的测度;依据细胞间距离,将细胞变换到d维的特征图空间中;在d维的特征图空间中进行k-means聚类。每取一个d得到一个运行结果,将所有d取值的运行结果平均后得到一致性矩阵。一致性矩阵的元素表示相应行的细胞和相应列的细胞在多少比例的运行结果中聚在一个类里面。再在一致性矩阵上利用层次聚类得到k个类。根据一致性矩阵、silhouette统计量、dunn统计量等方面选择适当的聚类结果。在本发明的具体实施方式中,维度数d的取值从细胞总数的4%到7%。在本发明的具体实施方式中,尝试k从2到6,n为1500,2000和3000,得到不同的sc3运行结果。在本发明的一个优选实施方式中,在得到聚类结果后,可以再对每一类进行相同的聚类分析,以得到更精细的聚类结果。根据本发明,可采用本领域已知的各类用于分析特征表达基因的软件进行步骤(4)的分析。在本发明的一个实施方式中,使用r语言包(aov)识别每一组中的特征表达基因,基因差异表达的认定标准是:1.bh矫正的f检验,p<0.05;2.honest显著性差异检验(任意两组间的差异),p<0.01。在本发明的一个具体实施方式中,为了鉴定cd8+t细胞中的耗竭性t细胞的特征基因,用软件limma进行了耗竭性和非耗竭性t细胞的差异分析。设定标准为表达量绝对值差异大于4倍,bh矫正的p<0.01。在本发明的一个具体实施方式中,为了识别有活性的调节性cd4+t细胞的特征表达基因,使用limma软件进行差异表达分析。设定标准为表达量在活性调节性t细胞和非活性调节性t细胞间,以及调节性t细胞和其他cd4+t细胞间的绝对值差异均需要大于4倍,bh矫正的p<0.01。本发明的有益效果:本发明利用单细胞转录组分析技术,通过分析癌症组织中浸润的t细胞的单细胞基因表达谱,发现了新的能反映机体肿瘤免疫状态的t细胞基因。本发明发现t细胞表达基因wars和acp5,意味着该t细胞处于耗竭状态,基因wars和acp5是本发明首次发现的与t细胞的耗竭状态相关的基因,并且表达wars和acp5基因的cd8+t细胞与肿瘤预后之间存在关联。本发明发现cd4+t细胞表达基因stam和batf,意味着该调节性t细胞转变为在癌组织中有活性的状态,基因stam和batf是本发明首次发现的与调节性t细胞的活性状态相关的基因,并且表达stam和batf的cd4+t细胞与肿瘤预后之间存在关联。在此基础上,cd8+t细胞的wars和acp5基因,cd4+t细胞的stam和batf基因可以成为t细胞的功能分子,抑制所述基因的表达或其表达蛋白的活性,能用于肿瘤的免疫治疗。另外,cd8+t细胞的wars和acp5基因,cd4+t细胞的stam和batf基因,也可以作为肿瘤预后的诊断标志物组。此外,本发明在研究过程中,开发和调试了t细胞的单细胞转录组分析技术,提高了单细胞mrna的反转录收率,提高了分析方法的准确性和有效性。本发明中的术语说明:havcr2,又名tim3,编码蛋白属于免疫球蛋白超家族和tim家族。已知该基因表达于th1细胞上,能够调节巨噬细胞的活性,并且抑制th1细胞介导的自体免疫反应,从而促进免疫耐受。pdcd1,又名pd1,编码蛋白属于免疫球蛋白超家族,是跨膜蛋白。该基因表达于前体b细胞上,并在b细胞分化中发挥作用。在小鼠中该基因的缺失将导致扩张型心肌病和充血性心力衰竭,pdcd1同样在t细胞中发挥抑制自体免疫反应的重要作用。已有针对pdcd1的肿瘤免疫抗体药物。wars,是氨酰基trna合成酶,它的编码蛋白催化trna的氨酰化作用。wars在干扰素介导下表达,负责为trna加上色氨酸残基,是一种进化上非常保守的基因。acp5,该基因编码蛋白为包含金属元素的糖蛋白,负责将磷酸单脂转化为酒精和磷酸盐的催化反应。acp5基因的损伤与spondyloenchondrodysplasia相关的免疫缺陷有关。lag3,编码蛋白属于免疫球蛋白超家族,已知在cd4+t上特异表达,是t细胞的共抑制分子。tnfrsf4,又名ox40,编码蛋白属于肿瘤坏死因子(tnf)受体超家族,是t细胞活化的共刺激分子。可以通过与traf2和traf5活化nf-kappab(一种转录因子)。stam,编码蛋白属于信号转导连接体的分子家族,在细胞间的细胞因子和生长因子的作用中发挥作用,可能在t细胞分化过程发挥作用。batf,属于ap-1家族的转录因子。该基因在t细胞中的表达在t细胞分化中起到重要作用,包括th17和tfh(follicularthelper)细胞。该蛋白的亮氨酸锌指蛋白结构可以帮助jun蛋白的二聚化。ctla4,编码蛋白属于免疫球蛋白超家族,介导抑制t细胞活性的信号分子,编码蛋白包括v区、跨膜区和胞内区。该基因的突变已知与多种疾病相关,包括胰岛素依赖型糖尿病,格式病(gravesdisease),乳糜泻,全身性红斑狼疮,甲状腺相关眼眶病等自身免疫疾病。已有针对ctla4的肿瘤免疫抗体药物。上述基因的基本信息如下(基因名称以hgnc为准,ng、nm和np编号以refseq数据库为准):在本发明中,术语“选择”、“分选”、“划分”或“分离”所选择的细胞、细胞群或细胞亚群可以互换地使用,并且除非上下文另有说明,表示将所选择的细胞或定义的细胞子集从组织样品中移出。术语“富集”可以宽泛地解释为被处理的细胞群,其含有比未处理的、另外的等同的细胞群或样品中更高百分比的所选择的细胞类型。在一些优选的实施例中,富集细胞群是指与起始细胞群相比增加细胞群中的一种细胞类型的大约50%或大于50%的百分比。在其他优选实施例中,本发明的富集细胞群将包括至少50%、60%、70%、80%、85%、90%、95%、98%或99%所选择的细胞类型。就特定细胞群而言,术语“基本上纯的”是指相对于构成总细胞群的细胞,具有至少大约75%、优选至少大约85%、更优选至少大约90%、并且最优选至少大约95%纯度的细胞群。术语“标志物”、“标记”或“细胞标记”含义相同,表示处于化学或生物实体形式的任何性状或特征。标记可以在性质上是形态的、功能的或生物化学的。在优选的实施例中,标记是差异性或优先地由特定细胞类型(例如,耗竭性cd8+t细胞)表达(或不表达),或由细胞在某些条件(例如,在细胞周期的特定时点或在特定细胞外基质)下表达的细胞因子或表面抗原或膜蛋白或胞浆蛋白等。在本发明中更具体地指那些可借助其存在(阳性)或不存在(阴性)来指示细胞或细胞亚群的标记。类似地,在组织、细胞或细胞群的背景下,术语“标记表型”表示可以用来表征、鉴定、定量、分开、分离、纯化或富集特定细胞或细胞群的任何标记或标记组合。在具体的优选实施例中,标记表型是可以通过检测或鉴定细胞表面标记组合的表达来确定细胞表面表型。术语“结合剂”、“结合分子”和“结合实体”是同义的,可以互换使用。在本发明的上下文中,结合剂结合、识别在所述t细胞亚群上的选择标记,与之相互作用、反应或以别的方式发生关联。示例性结合剂可以包括但不限于抗体或其片段、抗原、适配体、核酸(例如dna和rna)、蛋白质(例如受体、酶、酶抑制剂、酶底物、配体)、肽、凝集素、脂肪酸或脂质和多糖。例如,在本发明的一些实施例中,结合剂包括抗体或其片段、核酸(例如dna和rna)。术语“抗体”以最宽泛的意义使用,具体地涵盖合成抗体、单克隆抗体、多克隆抗体、重组抗体、胞内抗体、多特异性抗体、双特异性抗体、单价抗体、多价抗体、人抗体、人源化抗体、嵌合抗体、灵长类化抗体、fab片段、f(ab')片段、单链fvfc(scfvfc)、单链fv(scfv)、抗独特型(抗id)抗体和任何其他免疫活性抗体片段,只要它们展示出所希望的生物活性(即,标记相关或结合)即可。在更广的意义上,本发明的抗体包括免疫球蛋白分子和免疫球蛋白分子(即,含有抗原结合部位的分子)的免疫活性片段,其中这些片段可以或可以不与另一个免疫球蛋白结构域(包括但不限于fc区或其片段)融合。此外,如在此更详细地概述的,术语抗体和多种抗体具体地包括fc变体或其片段,包括全长抗体和包含fc区的变体fc-融合物,其任选地包含至少一个氨基酸残基修饰并且与免疫球蛋白的免疫活性片段融合。分子的“片段”意思是指分子的任何连续多肽或核苷酸子集。例如跨膜蛋白的片段可以包括仅包含胞外结构域或其某个部分的构建体。就本发明而言,标记片段或衍生物可以包括选择标记的任何免疫反应性或免疫活性部分。分子(如标记)的“类似物”意思是指在功能上与整个分子或与其片段相似的分子。如在此使用的,当分子含有通常不是该分子的一部分的另外的化学部分时,将所述分子称为另一种分子的“化学衍生物”。这样的部分可以改善分子的溶解度、吸收、生物半衰期,等等。这些部分可以替代地降低分子的毒性、消除或减弱分子的任何不良副作用,等等。术语“受试者”或“患者”可互换使用,包括但不限于人、非人类动物,例如非人灵长类如黑猩猩和其他猿类和猴种类;农场动物如牛、绵羊、猪、山羊和马;家养受试者如狗和猫;实验室动物,包括啮齿类如小鼠、大鼠和豚鼠,等等。该术语不指示具体的年龄或性别。术语“恶性肿瘤”、“肿瘤”和“癌症”可互换使用,是指以细胞不受控制、过度增生性或异常生长或转移为特征的疾病或失调。术语“诊断剂”是指用于诊断疾病或失调目的的任何分子、化合物、和/或物质。在优选的实施例中,诊断剂应当包含与报告分子结合的结合剂。诊断剂的其他非限制性实例包括抗体、抗体片段、或其他蛋白质,包括与检测试剂结合的那些。术语“检测试剂”或“报告分子”是指通过本领域技术人员可获得的任何方法学可检测的任何分子、化合物、和/或物质,非限制性实例包括染料、荧光标记、气体、金属、或放射性同位素。术语“受试化学物质”是指被测定活性的化学物质,包括但不限于小分子化合物,核酸(dna或rna),蛋白质或多肽(例如配体、抗体、融合蛋白等),多糖等。术语“抑制”是指与没有抑制剂的情况相比,蛋白质或细胞的活性降低。在一些实施方式中,术语“抑制”是指活性降低至少约25%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%、或至少约95%。在其它实施方式中,抑制是指活性降低约25%至约50%、约50%至约75%、或约75%至100%。在一些实施方式中,抑制是指活性降低约95%至100%,例如活性降低95%、96%、97%、98%、99%、或100%。可使用多种本领域技术人员公知的技术来测量这样的降低。术语“表达”和“基因表达”含义相同,是指细胞在生命过程中,把储存在dna顺序中的遗传信息经过转录和翻译,转变成具有生物活性的蛋白质分子。术语“表达增高”和“高表达”含义相同,是指与正常水平相比,基因转录的拷贝数增高,和/或翻译增高。术语“预后”是指预测疾病的可能病程和结局,既包括判断疾病的特定后果(如康复,某种症状、体征和并发症等其它异常的出现或消失及死亡),也包括提供时间线索,如预测某段时间内发生某种结局的可能性。附图说明图1肿瘤组织、正常组织和外周血t细胞的流式细胞分析图。第一行:外周血中t细胞;第二行:正常组织中的t细胞;第三行:肿瘤组织中t细胞。图2-1、图2-2合格的单细胞cdna示例。96个细胞同时使用lifetechreal-timepcr仪7500检测所得的结果图。对象rt-pcr的ct值低于26(图2-1黑框所示);对象溶解曲线的峰值在85℃到90℃之间(图2-2黑框所示)。图3合格的单细胞cdna示例。基于毛细管电泳的fragmentanalysis的检测结果。1700左右的峰是全长转录组的片段大小,1100左右的峰是作为内参的ercc。图4合格的cdna文库示例。基于毛细管电泳的fragmentanalysis检测结果。图5-1、图5-2不同聚类软件的dunn值和silhouette值。其中,图5-1为取不同的k值(聚类的类别数目)时的不同聚类方法的dunn值;图5-2为取不同的k值(聚类的类别数目)时的不同聚类方法的silhouette值。圆圈中的点为最优k值得到的结果。图6cd8+t细胞基因表达的热图。根据基因表达的情况,聚成5类cd8+t细胞亚群。其中cluster4是耗竭性t细胞。图7cd4+t细胞基因表达的热图。根据基因表达的情况,聚成6类cd4+t细胞亚群。其中cluster3是有活性的调节性t细胞。图8-1~图8-9盒形图分别显示acp5,batf,ctla4,havcr2,lag3,pdcd1,stam,tnfrsf4,wars在不同细胞亚群中的表达量。图中每个点是一个细胞,横坐标是聚类得到的9个t细胞亚群的类别,纵坐标是相应基因的表达量tpm(log2转化)。图9调节性cd4+t细胞特征基因的表达与肝癌患者生存的相关性kaplan-meier曲线,所述特征基因为tnfrsf4,stam,batf,ctla4。图10耗竭性cd8+t细胞特征基因的表达与肝癌患者生存的相关性kaplan-meier曲线,所述特征基因为havcr2,pdcd1,wars,acp5,lag3。图11tang2009的方法的扩增偏向统计图。图12smart-seq2的扩增偏向统计图。具体实施方式以下结合实施例对本发明做进一步描述。以下实施例是以肝癌患者为例,开展的t细胞的单细胞转录组信息分析方法的示例说明。需要说明的是,实施例不能作为对本发明保护范围的限制,本领域的技术人员理解,任何在本发明基础上所作的改进和变化都在本发明的保护范围之内。以下实施例所用化学试剂都是常规试剂,均可商购获得。所用分析软件及其来源如下:gsnap(http://research-pub.gene.com/gmap/);统计软件r(https://www.r-project.org/);htseqgenie,deseq2,sc3,monocle,complexheatmap,ggplot2,rtsneandsurvival(https://www.bioconductor.org/)hcc序列数据库:ega(https://www.ebi.ac.uk/ega/home)accessionnumberegas00001002072tcga数据:cbioportal(http://www.cbioportal.org/)和(https://gdc.cancer.gov/)。实施例1t细胞的单细胞转录组数据获取1、临床样本收集从2014年8月到2015年6月,在北京大学人民医院和北京世纪坛医院采集患者的手术组织和外周血,包括癌组织(直径3~5mm)和癌旁正常组织,并采集外周血(3ml)。患者为肝细胞癌,未经受术前辅助放疗或化疗,共5例。本项研究符合赫尔辛基宣言的医学伦理标准,并通过北京大学医学伦理委员会的审核。血样在手术前采集于edta抗凝管中暂时于冰上保存;癌组织和癌旁正常组织样本在手术中采集,其中癌症组织剔除坏死组织;癌旁组织为远离癌组织至少5cm处的正常组织。癌组织和癌旁组织在离体30分钟以内置于冰上和rnalater(qiagen)溶液中,当日内完成单细胞分离操作。2、单细胞悬液制备外周血:采用密度梯度离心法分离外周血单核细胞。具体操作为将3ml全血缓慢加到3ml-1077分离液(sigma,cat.no.1077)上,400g室温离心30分钟,小心吸取白色层单核细胞,用10mlpbs清洗,4℃离心15分钟,重复上述清洗步骤一次。最后将细胞溶解于0.5mlpbs,并加入1%小牛血清(fbs)。癌组织和癌旁正常组织:采用研磨法获得癌组织和癌旁正常组织的单细胞。首先将手术离体的组织剪成1mm3大小的碎块,浸泡于rpmi-1640培养基中,并加入10%小牛血清。使用铜网快速磨碎组织,通过40μm筛除组织碎片,400g离心10分钟收集单细胞悬液。使用红细胞裂解液进一步去除组织中混入的红细胞。同样用10mlpbs清洗两次,最后将细胞溶解于0.5mlpbs,并加入1%小牛血清。3、目的t细胞单细胞分离分离的目的细胞包括细胞毒t细胞(cd3阳性,cd8阳性),辅助性t细胞(cd3阳性,cd4阳性,cd25阴性)和调节性t细胞(cd3阳性,cd4阳性,cd25阳性)。这三种细胞分别用不同抗体进行荧光标记,抗体来自ebioscience公司,每106个细胞使用5μl抗体:兔抗cd3抗体(facs,cat#48-0037-41)兔抗cd4抗体(facs,cat#11-0048-41)小鼠抗cd8抗体(facs,cat#17-0086-41)小鼠抗cd25抗体(facs,cat#12-0259-42)7aad(facs,cat#00-6993-50),7aad用于标记死亡细胞。96孔板的每个孔中预先加入反应溶液:引物序列为:aagcagtggtatcaacgcagagtacttttttttttttttttttttttttttttttvn目的t细胞的分离结果如图1所示。根据细胞表面的分子标记,选择细胞毒t细胞,辅助性t细胞和调节性t细胞,用流式细胞仪分别将单个细胞收集入相应的96孔板的每个孔中。4、mrna反转录和cdna扩增对于分离至96孔板中的单细胞进行反转录获得cdna,操作步骤按照smart-seq2方法(picelli,s.etal.full-lengthrna-seqfromsinglecellsusingsmart-seq2.nat.protoc.9,171–181(2014).),如下:1)单细胞裂解:将上述溶液中的单细胞旋涡震荡至少10秒。在pcr仪上72℃孵育3分钟。2)加入内参rna(erccrnaspike-inmix,invitrogen,cat.no.4456740)。事先需要稀释350倍,加入1μl。内参rna有助于对基因表达量的定量计算。3)反转录:反应体系为:tso引物的序列为:aagcagtggtatcaacgcagagtacatrgrg+g反应条件为:4)pcr扩增:反应体系为:kapahifihotstartreadymix(2x)12.5μlispcr引物(10μm)0.25μl无核酸酶的超纯水2.25μl。ispcr引物序列为:aagcagtggtatcaacgcagagt反应条件为:经扩增后的pcr产物用agencourtampurexp磁珠(beckman)进行纯化,方法如下:(1)在25μl上一步反应溶液中加入25μl磁珠,吹打混匀;(2)室温放置5分钟;(3)把盛有溶液的试管或板子放于磁力架上5分钟;(4)移除液体;(5)用100μl80%的乙醇清洗磁珠,放置30秒后移除,重复此过程一次;(6)从磁力架上拿下,加入20μleb溶液,吹吸混匀;(7)放置2分钟后,置于磁力架上,放置2分钟后,再吸出液体。研究中发现,上述过程中残留在溶液中的引物会降低文库构建的效率,使文库包含非细胞cdna的成分。为此需要再增加一遍纯化操作,除将磁珠用量变成50μl之外,纯化过程与前述一致。进行质量检测,即通过rt-pcr检测t细胞特别表达的基因cd3,判断扩增的有效性。反应体系为:cd3的引物序列为:tcattgccactctgctcc(正向)和gttcacttgttccgagcc(反向)。反应条件为:判断cdna是否可用的标准有两条:一是对象rt-pcr的ct值低于26;二是对象溶解曲线的峰值在85℃到90℃之间。图2-1和图2-2给出了本实施例获得的合格的cdna示例。另一项质量控制手段为fragmentanalysis,基于毛细管电泳检测样本dna的片段大小和浓度。图3给出了本实施例获得的合格的cdna示例。5、测序文库构建cdna文库构建采用truepreptmdnalibraryprepkitv2for试剂盒(vazyme,cat.no.td501/502/503);分别匹配双端index为truepreptmindexkitv2for(vazyme,cat.no.td202)。按照试剂盒说明书操作,用1μgcdna起始建库。用磁珠做片段大小的选择,获得目的片段大小为400bp~600bp的cdna文库,最后经fragmentanalysis进行质量控制,经测定,文库构建合格,相应的分析结果参见图4。采用illuminahiseq4000测序,测序模式为双端150bp,通常一个细胞的数据量需要1百万条读段。实施例2生物信息分析1、数据比对与质量控制对于从测序仪获得的读段(reads),首先去除低质量的部分,保留的标准如下:①未知碱基占给定读段总序列不能超过10%,②质量值低于5的碱基不能超过50%,③不能含有接头序列。使用gsnap软件完成比对。计算基因表达量时,使用的参考基因集合来自ucsc的“knowngene.txt”,使用r语言包“findoverlaps”统计读段在基因上的归属,使用tpm值标定每个基因在每个细胞中的表达量,使用的公式为:其中cij表示为基因i在细胞j中的读段的数量。数据量和数据质量低的t细胞需要被过滤掉。保留符合以下标准的细胞:①cd3d的tpm大于3;②当分离cd4+t细胞时,cd4的tpm需要大于3,同时cd8的tpm小于30;③分离cd8+t细胞时,cd8的tpm需要大于3,同时cd4的tpm小于30;④线粒体基因上的读段占所有读段的比例不高于10%。另外,在文库容量(librarysize)和基因表达数量上也设定了一些参考标准。当一个基因在所有细胞中被检测到的读段平均数量大于1才用于后续分析。对所有基因的表达量进行log2转化,并将每个基因在每个患者中表达的log2转化后平均值设定为0,从而便于比较给定基因在不同患者中的表达差异,具体使用r语言包computesumfactors。一般来讲,每个细胞能检测到的表达基因的数量约为3000个上下。2、单细胞表达谱识别针对上一步获得的每个细胞每个基因表达量的矩阵,进行t细胞类型的判别。首先利用软件sc3进行迭代的非监督聚类(kiselevvy,kirschnerk,schaubmt,andrewst,yiua,chandrat1,natarajankn,reikw,barahonam8,greenar,hembergm.sc3:consensusclusteringofsingle-cellrna-seqdata.natmethods.2017may;14(5):483-486.doi:10.1038/nmeth.4236.epub2017mar27.)。具体来说,筛选方差最大的n个基因进行谱聚类:计算spearman相关系数作为细胞间距离的测度;细胞间的距离可以用图来表示,通过图的拉普拉斯矩阵及其特征向量,可以将细胞变换到d维的特征图空间中;在d维的特征图空间中进行k-means聚类。维度数d的取值从细胞总数的4%到7%,每取一个d得到一个运行结果,将所有d取值的运行结果平均可以得到一个一致性矩阵。一致性矩阵的元素表示相应行的细胞和相应列的细胞在多少比例的运行结果中聚在一个类里面。再在这个一致性矩阵上利用层次聚类得到k个类。k是sc3软件的一个参数。尝试k从2到6,n为1500,2000或3000,从这些不同的sc3运行结果中,根据一致性矩阵、silhouette统计量、dunn统计量等方面选择一个最好的作为聚类结果。得到聚类结果后,再对每一类进行以上过程,以得到更精细的聚类,直到找到有意义的聚类结果。同时,我们对同样的数据采用基于hclust和k-means的聚类方法进行了对比分析,分别包含是否进行主成分分析的前处理。比较的方法为计算dunn和silhouette的数值。dunn的计算公式为即比较同一类中距离最远的点和不同类中距离最近点。而silhouette的计算公式为si=(bi-ai)/max(ai,bi),即比较一组内任意两点的距离和最远的聚类。当这两个值越大时表示细胞类别之间的边界越清晰,同时类别内细胞的紧密程度越高。经过对比,发现不同聚类方法,即:sc3、hclust和k-means,得到的dunn和silhouette值不同,sc3的结果优于hclust和k-means的方法,对比结果参见图5-1和图5-2。当采用sc3分析是时,取k=4时结果相对最优,故用此聚类结果进行后续的特征基因的识别。图6和7分别给出了采用sc3软件对cd8+t细胞和cd4+t细胞进行聚类后的获得各类亚群的矩阵图。使用r语言包(aov)识别每一组中的特征表达基因,通过特征表达基因推断细胞的功能类别,包括细胞毒性t细胞,调节性t细胞等。为了鉴定cd8+t细胞中的耗竭性t细胞的特征基因,我们用软件limma进行了耗竭性和非耗竭性t细胞的差异分析。设定标准为表达量绝对值差异大于4倍,bh矫正的p<0.01。最后在肝癌中获得了102个耗竭性t细胞的特征表达基因(表1,表中e为科学计数法)。表1肝癌组织中浸润的耗竭性t细胞特征表达的基因同样,为了识别有活性的调节性cd4+t细胞的特征表达基因,使用limma软件进行差异表达分析。设定标准为表达量在活性调节性t细胞和非活性调节性t细胞间,以及调节性t细胞和其他cd4+t细胞间的绝对值差异均需要大于4倍,bh矫正的p<0.01。最后在肝癌中获得了94个调节性t细胞的特征表达基因(表2,表中e为科学计数法)。表2肝癌组织中浸润的调节性t细胞特征表达的基因所述特征表达的基因中有已知的免疫治疗靶点基因,例如pdcd1和ctla4,也有以前未知的与细胞状态和功能有关的基因。我们通过研究发现了batf和stam是活性调节性t细胞特征表达的新的基因,wars和acp5是耗竭性t细胞特征表达的新的基因。3、预后判断中的效用对于上述识别的t细胞功能组别的特征基因,分析其在患者疾病预后上的使用价值。使用的数据集合为tcga(thecancergenomeatlas)肝癌(lihc,肝细胞癌)的数据,因为这项研究收集整理了患者的随访信息。患者癌组织基因表达量的数据从ucscxena(http://xena.ucsc.edu/)下载,患者随访(生存)信息从gdcdataportal(https://gdc-portal.nci.nih.gov/)下载。为了排除患者非肿瘤浸润性t细胞的细胞中某个基因表达量对分析的干扰,对于经上述工作识别的耗竭性cd8+t细胞和活性调节性cd4+t细胞的特征基因,将tcga数据库中获得的基因表达信息,通过z-score转换后的基因表达量在每个样本中取平均值,然后除以每个样本cd3的表达值,以反应t细胞在癌组织中的浸润程度。为了最大限度的区分患者的预后情况,对特征基因进行了单独的和随机组合的分析。对于单独的基因,患者将被分为表达量高组和表达量低组,以中位值做分组。对于组合的基因,首先将一组内的基因表达量取平均值,然后再分为表达量高组和表达量低组,以中位值做分组。候选的基因范围是通过前述步骤2的分析获得的耗竭性cd8+t细胞中特异高表达的基因和活性调节性cd4+t细胞中特异高表达的基因。使用kaplan-meier曲线表现患者生存差异(图9和10),使用log-rank检验生存差异是否显著(p<0.01)。表3耗竭性t细胞的特征表达基因在患者生存差异预后上的统计值基因组合p值风险比havcr2_pdcd1_wars_acp5_lag30.00221.7207havcr2_ctla40.00391.6622havcr2_pdcd1_sirpg_wars_acp5_lag30.00701.6092havcr2_pdcd1_wars_acp5_dusp4_layn0.00821.5948sirpg_wars_acp5_lag30.00871.5923pdcd1_wars_acp5_lag30.00931.5858tigit_wars_acp5_lag30.00961.5798由上表可见,cd8+t细胞高表达wars、acp5的肝癌患者生存时间短,在肝癌患者预后诊断中有重要意义,含有wars、acp5的cd8+t细胞表达的基因组合可用于肝癌患者预后的诊断。表4活性调节性t细胞的特征表达基因在患者生存差异预后上的统计值基因组合p值风险比tnfrsf4_ctla4_stam_batf0.00031.9009tnfrsf4_stam_batf0.00041.8816ctla4_stam_batf0.00261.6954stam_batf0.00541.6299由上表可见,活性调节性t细胞高表达stam、batf的肝癌患者生存时间短,在肝癌患者预后诊断中有重要意义,含有stam、batf的活性调节性t细胞表达的基因组合可用于肝癌患者预后的诊断。其中,由上述列表可见:耗竭性cd8+t细胞的以下5个基因的表达与肝癌患者预后的关系最为显著:havcr2,pdcd1,wars,acp5,lag3。活性调节性cd4+t细胞的以下4个基因的表达与肝癌患者预后的关系最为显著:tnfrsf4,stam,batf,ctla4。对比实施例:1、cdna建库方法的对比将smart-seq2方法和汤富酬创建的方法(为方便描述,以下简称为“tang2009”,tang,f.etal.rna-seqanalysistocapturethetranscriptomelandscapeofasinglecell.nat.protoc.5,516–535(2010).)在cdna扩增效率上:在完成cdna扩增后,以无核酸的超纯水为阴性对照,利用rt-pcr来检测管家基因β-actin、gapdh或cd3基因的表达来检验扩增效率。判断基因是否表达的标准有两条:一是细胞样品rt-pcr的ct值明显小于阴性对照;二是细胞样品的溶解曲线峰值在85℃到90℃之间(阴性对照约为78℃)。根据实验的结果,用smart-seq2法扩增后,在绝大部分细胞中均可以检测到β-actin、gapdh和cd3。用tang2009法扩增后可在大部分细胞中检测到β-actin和gapdh的表达,仅能在极少数细胞中检测到cd3。在cdna文库质量上:文库的构建不受扩增方法影响,用tang2009法和smart-seq2法扩增均能提供构建文库所需的cdna量,所建文库的片段大小均符合illumina测序仪要求。但如果对比最终构建所得的cdna文库数和用于建库的起始单细胞数的比值,以三个肝癌患者的样本比较来看,用smart-seq2法扩增t细胞的成功率总体上高于tang2009法,如下表所示。构建cdna文库成功率表患者编号建库方法ptcpthptrttctthttrntcnthntr20141202tang200946%24%26%62%52%78%///20150205smart-seq280%80%67%80%60%67%///20150508smart-seq292%74%92%95%92%88%70%86%/注:“/”表示无该类型样本。ptc为外周血中的细胞毒t细胞,pth为外周血中的辅助性t细胞,ptr为外周血中的调节性t细胞。ttc为癌组织中的细胞毒t细胞,tth为癌组织中的辅助性t细胞,ttr为癌组织中的调节性t细胞。ntc为正常肝脏组织中的细胞毒t细胞,nth为正常肝脏组织中的辅助性t细胞,ntr为正常肝脏组织中的调节性t细胞。以下每个表的简写相同。在测序质量上:以三个肝癌患者的样本为例,具体参数见下表。tang2009法(患者20141202)样本平均测序质量表细胞类型总读段高质量读段率比对率表达基因数ptc136586790.02%95.36%1329pth191226354.62%98.36%1189ptr138027394.55%98.85%2376ttc141841288.63%98.13%1987tth215566793.54%94.95%1274ttr144634393.86%97.52%1698smart-seq2法(患者20150205)样本平均测序质量表细胞类型总读段高质量读段率比对率表达基因数ptc156141997.88%62.47%3042pth161040398.33%79.72%2553ptr148232398.42%60.33%3103ttc144257399.51%51.83%3071tth189006977.07%66.7%2478ttr155868598.49%67.87%3478smart-seq2法(患者20150508)样本平均测序质量表细胞类型总读段比对率高质量读段率表达基因数ntc181983097.10%99.25%2187nth143165693.38%99.44%2267ptc1476204.595.40%99.38%2745pth153059086.35%99.39%2026ptr151319096.09%99.43%2295.5ttc160217595.83%99.38%2823tth1562359.594.52%99.38%2795.5ttr151448696.33%99.43%2907作为单细胞rna-seq的数据,多数细胞的高质量读段率、比对率均较高,说明测序质量好,所得数据适合做表达量和表达序列的分析。从检测到的基因数方面看,smart-seq2法所能检测到的基因数明显高于tang2009法。在扩增偏向上,tang2009法和smart-seq2法扩增cdna时存在不同的倾向性。从测序结果的分析图中不难看出,tang2009法更倾向于扩增出cdna的3’端,这种偏向性不利于整个tcr结构的组装,而smart-seq2法则能更为均一地扩增cdna,有利于组装出tcr的全部序列(图11和图12)。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1