抗癌活性物质放线菌素FGR的分离鉴定方法与流程
本发明涉及微生物
技术领域:
,具体涉及抗癌活性物质放线菌素fgr的分离鉴定方法。
背景技术:
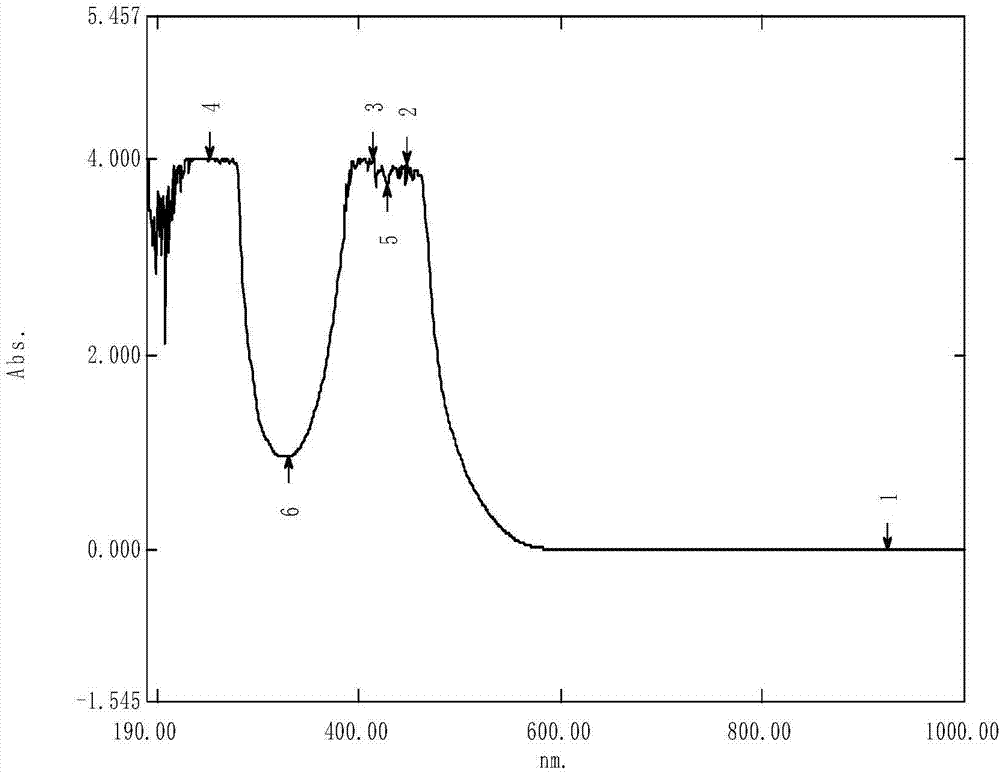
恶性肿瘤是全世界一个主要的致死病种,据世界卫生组织报道,2012年全世界因恶性肿瘤死亡的人次达820万,预计恶性肿瘤病例将持续迅猛增长,将逐年递增至2025年1900万人,2035年达2400万人。肿瘤严重威胁人类生命健康,而现有大多化学药物在治疗疾病的同时,不仅仅杀伤肿瘤细胞,正常细胞也收到严重的伤害,从而使患者产生了严重的不良反应。因此,寻求一类高效、低毒的抗肿瘤药物迫在眉睫,将有助于提高用药安全性和有效性。放线菌是一类次级代谢产物功能丰富的菌属,其次级代谢产物可作为色素、抗生素等,放线菌还是一类具有开发利用潜质的抗癌药物,在生命科学领域、食品行业、饲料添加剂、医学科学及化工工业等行业具有潜在的应用价值。但是产量受发酵、提取等各个不确定因素的制约,而无法大量生产。放线菌次级代谢产物分离纯化过程,通常涉及分离和结构解析两大部分。目前,分离技术应用最为广泛的,主要包括:离子交换色谱法、大孔树脂吸附法、双水相萃取技术、膜分离技术等。硅胶柱层析、凝胶柱层析、高效液相色谱等;而结构解析最典型的莫过于紫外光谱、红外光谱、质谱及核磁共振谱等四大波谱了,可以达到待测物质分子结构水平,从而进行解析及鉴定。技术实现要素:本发明的目的就是针对上述现有技术中的缺陷,提供了抗癌活性物质放线菌素fgr的分离鉴定方法。本发明为了从放线菌次级代谢产物中获得一些新的有活性的成分,以放线菌次级代谢产物抗癌作用为主旨,对发酵粗品设计更深一步的分离和纯化试验,采取有机溶剂萃取法,紫外分光光度计法(uv)及高效液相色谱法(hplc)。选用多种有机溶剂检测放线菌素fgr的溶解性,然后检测ph、温度、光照(可见光和紫外光)、金属离子、防腐剂、氧化剂和还原剂对放线菌素fgr稳定性的影响。为了实现上述目的,本发明提供的技术方案为:抗癌活性物质放线菌素fgr的分离鉴定方法,包括以下步骤:1)将放线菌素fgr经过紫外分光光度计uv进行全波长扫谱检测;2)再用高效液相色谱hplc对放线菌素fgr进行进一步鉴定;3)鉴定后采用高效液相色谱hplc进行分离;进一步的,上述的抗癌活性物质放线菌素fgr的分离鉴定方法,所述放线菌素fgr是公牛链霉菌fgr-015的次级代谢产物,以扩大培养基液体发酵放线菌fgr-015分离纯化所得;所述放线菌为链霉菌,命名为公牛链霉菌(streptomycestauricus)fgr-015,保藏单位为中国微生物菌种保藏管理委员会普通微生物中心(地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,邮编100101),保藏时间为2018年6月14日,保藏编号为cgmccno.15942;所述放线菌素fgr是公牛放线菌fgr-015次级代谢产物,以扩大培养基液体发酵放线菌fgr-015分离纯化所得;所述扩大培养基的组成为:可溶性淀粉20g,kno30.1g,k2hpo40.05g,mgso4·7h2o0.05g,nacl0.05g,feso4·7h2o0.001g,蒸馏水1000ml;ph值调节为7.1;所述扩大发酵方法为:接种量为12.61%,装瓶量为48.65%,摇床转速为150r/min,摇床温度为28℃,发酵时间为7.5d;所述分离纯化方法,包括以下步骤:离心转速为10000r/min,4℃离心20min,弃沉淀物,以乙酸乙酯为萃取剂萃取,30℃水浴超声30min,然后移入梨型分液漏斗中,静置2h;以乙酸乙酯为萃取剂,料液比为1:5,超声温度为44℃,提取时间为16h;用乙酸乙酯萃取3次;分离有机相,直至待测溶液为无色,将有机相保留并经过60℃旋转蒸发、-20℃结冰及-80℃冷冻干燥3d制成放线菌素fgr成品。进一步的,上述的抗癌活性物质放线菌素fgr的分离鉴定方法,所述步骤1)中,放线菌素fgr紫外分光光度计扫谱结果为最大吸收波长210nm。进一步的,上述的抗癌活性物质放线菌素fgr的分离鉴定方法,所述步骤1)中,放线菌素fgr紫外分光光度计扫谱的具体方法为:称取10mg放线菌素fgr用甲醇溶解为10mg/ml的溶液,用甲醇做空白对照,在紫外分光光度计上进行全波长扫谱,即190~1000nm扫谱,检测出放线菌素fgr的最大吸收波长。进一步的,上述的抗癌活性物质放线菌素fgr的分离鉴定方法,所述步骤2)中,放线菌素fgr的高效液相色谱hplc鉴定结果为含有11种以上的物质。进一步的,上述的抗癌活性物质放线菌素fgr的分离鉴定方法,所述步骤2)中,高效液相色谱法的具体操作为:10mg的放线菌素fgr用甲醇溶解为10mg/ml的溶液;色谱纯的流动相甲醇与纯净水分别用真空泵过滤7~10次至完全无杂质,然后超声30min,静置室温备用;hplc检测条件为:流动相为甲醇:水=75:25,流速1ml/min,洗脱1h,进样量为10μl,色谱柱规格为pursuitxrsc18(250mm×10mm),uv检测器检测波长为252nm。本发明涉及筛选得到的放线菌fgr-217在固体高氏1号培养基生长过程中,菌龄逐渐成熟,菌落的外观形态由最初的白色逐渐变为粉红色、红色,最后为紫红色,甚至扩散整个培养基。放线菌素fgr(放线菌fgr-217次级代谢产物的暂时命名)为紫红色颗粒,有一定粘度,因此可确定,放线菌fgr-217代谢过程中产生红色素,天然红色素有着广泛且宝贵的应用价值。此外,经试验验证,该放线菌素fgr不仅对一些如大肠杆菌、绿脓杆菌、金黄色葡萄球菌、肺炎双球菌的致病菌具有一定的抑制效果,还对多种恶性肿瘤也有一定的杀伤力,因此,鉴定放线菌素fgr以及对其理化性质的研究就显得尤为迫切。本发明的有益效果为:本发明公开了一种抗癌活性物质放线菌素fgr的初步分离鉴定的方法及其理化性质探索。首先对该抗癌活性物质放线菌素fgr进行紫外分光光度计扫谱鉴定,结果为最大吸收波长为210nm,而怀疑对象放线菌素d最大吸收波长为252nm和428nm,表明本发明放线菌素fgr与放线菌素d不是同一种物质;然后运用高效液相色谱法进一步对放线菌素fgr进行鉴定,甲酸、dmso和甲醇3种不同溶剂的放线菌素fgr溶液出峰时间均在2.0min,而放线菌素d出峰时间为10.589min,再一次表明放线菌素fgr与放线菌素d不是同一种物质;然后再次运用高效液相色谱法,进行梯度洗脱对放线菌素fgr进行初步分离,可知,此抗癌活性物质至少有11种以上的成分,但在11.801min有个峰,表明放线菌素fgr中含有放线菌素d的同系物,且根据放线菌素d的回归方程y=731.5x-17.709可知,其含量为0.015mg/ml;本发明继续研究了放线菌素fgr的溶解性,以及酸碱(ph)、温度、光照(可见光和紫外光)、金属离子、防腐剂、氧化剂和还原剂稳定性等理化特性。附图说明图1显示为放线菌素d的uv图谱。图2显示为放线菌素fgr的uv图谱。图3显示为放线菌素d标品的高效液相图谱。图4显示为放线菌素fgr的高效液相图谱。图5显示为放线菌素fgr的高效液相分离图谱。图6显示为ph对放线菌素fgr稳定性的影响。图7显示为光照时间对放线菌素fgr稳定性的影响(a:可见光;b:紫外光)。图8显示为不同温度对放线菌素fgr稳定性的影响。图9显示为100℃不同时间对放线菌素fgr稳定性的影响。图10显示为金属离子对放线菌素fgr稳定性的影响。图11显示为氧化剂和还原剂对放线菌素fgr稳定性的影响。图12显示为防腐剂对放线菌素fgr稳定性的影响。具体实施方式一种抗癌活性物质放线菌素fgr的初步分离鉴定的方法及其理化性质探索,首先将该抗癌活性物质放线菌素fgr经过紫外分光光度计(uv)全波长扫谱检测,找到最大吸收波长,与怀疑对象放线菌素d对比,然后运用高效液相色谱(hplc)进一步对放线菌素d和放线菌素fgr进行比较鉴定,接着运用高效液相色谱(hplc)对放线菌素fgr进行初步分离,最后对该抗癌活性物质放线菌素fgr的理化性质进行检测,包括放线菌素fgr的溶解性以及酸碱(ph)、温度、光照(可见光和紫外光)、金属离子、防腐剂、氧化剂和还原剂对其稳定性的影响。实施例1:1放线菌素fgr的提取将放线菌发酵液取出并摇匀,于4000r/min的离心机中4℃离心20min,弃沉淀,用食盐将上清液配制为饱和食盐水溶液,再经过真空泵抽滤(饱和食盐水和真空抽滤过程可减轻发酵液的乳化现象),然后将上清液与4倍体积的乙酸乙酯充分混匀,44℃水浴超声30min,然后移入梨型分液漏斗中,静置16h,用乙酸乙酯萃取,分离有机相,直至待测溶液为无色,将有机相保留并经过60℃减压旋转蒸发、-20℃结冰后-80℃冷冻干燥3d,从而得到粗提物放线菌素fgr,为紫红色小颗粒。2放线菌素fgr的uv检测放线菌素d为紫红色粉末,有一定粘度,具有抑菌抗癌作用,因此怀疑放线菌素fgr为放线菌素d或者其类似物,故准备放线菌素d标品与之来uv扫谱对比。放线菌素d用甲醇溶解为1mg/ml的溶液,称取10mg的放线菌素fgr用甲醇溶解为10mg/ml的溶液,用甲醇做空白对照,在紫外分光光度计上进行全波长(190~1000nm)扫谱,分别检测放线菌素d和放线菌素fgr的最大吸收波长。放线菌素d图谱如图1,放线菌素d最大吸收波长有两个,分别为252nm和428nm。放线菌素fgr图谱如图2,全波长190~1000nm扫谱。该化合物在210nm处有最大吸收波长,a210nm=3.42。由图1和2可知,相同条件出峰时间不一致,可见放线菌素fgr不是放线菌素d。3放线菌素fgr的hplc检测为进一步验证放线菌素fgr与放线菌素d是否为同一物质,故利用以下hplc检测。3.1样品的制备放线菌素fgr用甲醇溶解为10mg/ml的溶液,用0.22μm滤器过滤后备用;放线菌素d用甲醇溶解为1mg/ml的溶液,然后依次倍比稀释为0.5、0.25、0.125、0.0625、0.03125mg/ml浓度的溶液,分别用0.22μm滤器过滤后备用。3.2流动相的准备流动相:甲醇(色谱纯)与新鲜纯净水(娃哈哈)水分别使用对应的有机滤膜和无机滤膜的真空泵过滤7~10次,肉眼无可见杂质为止,然后超声30min消泡,静置至室温备用。3.3hplc色谱检测条件流动相为甲醇:水=75:25,流速1ml/min,进样量为10μl,色谱柱规格为sunfirec18(250mm×10mm),uv检测器检测波长为252nm。放线菌素fgr和放线菌素d分别洗脱1h和30min,检测色谱图,分析放线菌素fgr和放线菌素d的关系。3.3放线菌素fgr的hplc检测结果1mg/ml的放线菌素d溶液色谱图如图3。由图3可知放线菌素d在10.589min出峰。放线菌素fgr分别用甲酸、dmso及甲醇溶解为10mg/ml的溶液,hplc检测,流动相为甲醇:水=75:25,进样量10μl,检测波长252nm。结果见图4。图4中a、b、c分别代表放线菌素fgr的甲酸、dmso及甲醇溶液的hplc检测图:(a)甲酸与放线菌素fgr发生反应,溶解效果最好,无颗粒,溶液均一,但是出峰位置在2.025min,与放线菌素d不一致;(b)dmso溶解效果次之,其最大峰在1.975min处出峰,但在10~11min内有较小的峰出现;(c)甲醇溶解效果较甲酸和dmso次之,两个最大出峰位置为2.577min和3.506min,但是由图可知,至少有5种以上的峰,放线菌素fgr是次级代谢粗品,它至少含有5种以上物质。4放线菌素fgr初步分离使用hplc流动相梯度洗脱法对放线菌素fgr进行初步分离,梯度条件见表1,其他hplc检测条件不变,浓度为10mg/ml的放线菌素fgr甲醇溶液,进样量为10μl,色谱柱规格为sunfirec18(250mm×10mm),uv检测器检测波长为252nm。按照以上色谱条件洗脱30min,检测色谱图。表1为放线菌素fgr梯度洗脱条件。表1放线菌素fgr梯度洗脱条件时间(min)甲醇水流速(ml/min)040601535650.81030700.61530700.6放线菌素fgr进样10μl,经梯度条件后,检测结果如图5,图中共11个峰,表明放线菌素fgr这个粗品中至少有11种以上的物质,可结合质谱、红外光谱等对放线菌素fgr做进一步地分离、纯化以及鉴定。5放线菌素fgr的溶解性分析将10mg的放线菌素fgr分别浸泡于多种10ml有机溶剂甲醇、无水乙醇、正丁醇、异丙醇、乙二醇、乙酸乙酯、二氯甲烷、三氯甲烷乙醚、乙腈、正丙醇、1-辛醇、石油醚、苯、乙酸、甲酸、乙醇中,摇匀,6h后观察溶解情况。观察发现,该在极性不同的有机试剂中的溶解度存在明显的差异,如表2所示。放线菌素fgr在石油醚、乙酸乙酯、三氯甲烷中不溶,因此放线菌素fgr在极性较小的溶剂溶解度小;而在正丁醇、乙醇、甲醇等极性较大的溶剂中溶解效果好,说明放线菌素fgr易溶于极性较大的有机溶剂。表2为放线菌素fgr的溶解情况。表2放线菌素fgr的溶解情况溶剂溶解情况溶剂溶解情况甲醇溶解乙醚微溶无水乙醇易溶乙腈微溶正丁醇溶解正丙醇溶解异丙醇溶解1-辛醇微溶乙二醇溶解石油醚不溶二氯甲烷不溶苯易溶三氯甲烷不溶乙酸微溶甲酸易溶乙酸乙酯不溶6放线菌素fgr稳定性研究研究不同温度、光照、酸碱、氧化剂和还原剂、防腐剂以及不同金属离子对放线菌素fgr稳定性的影响。6.1放线菌素fgr的酸碱稳定性将放线菌素fgr用甲醇配制为0.1mg/ml的溶液,初始ph为7.2,平均分装于13支试管中,用hcl和naoh溶液分别将其ph调节为2、3、4、5、6、7、8、9、10、11、12、13及14,静置3h,观察溶液颜色变化。以原始放线菌素fgr为对照,测量最大吸收波长处的光吸收值。放线菌素fgr原始ph为7.2,结果如图6所示:ph在7.2附近的酸碱环境(5~12),对于稳定性影响都不大;反而是过酸(ph<5)条件下,该物质极不稳定,溶液颜色变浅;过碱(ph>12)时吸光值反而有所增大,若放线菌素fgr单纯作为一种红色素,反而效果要更好些。6.2放线菌素fgr的光稳定性6.2.1可见光对放线菌素fgr稳定性的影响将放线菌素fgr用甲醇配制为0.1mg/ml的溶液,平均分为15份,置于可见光照生长箱中,进行放线菌素fgr的可见光照处理,处理时间分别为0、1、2~15d每个处理设3次重复,至取样时间后,取出放线菌素fgr保存在4℃遮光条件下,待全部取样结束后,以原始放线菌素fgr为对照,测量最大吸收波长处的吸收值。6.2.2紫外光对放线菌素fgr稳定性的影响将放线菌素fgr用甲醇配制为0.1mg/ml的溶液,平均分为5份,放入5个培养皿中,培养皿裸露,紫外灯直照,置于紫外灯下处分别照射3、6、9、12及24h,以原始放线菌素fgr为对照,测量最大吸收波长处的吸收值。结果见图7,可见光对放线菌素fgr基本没影响;图7(b)在紫外照射的0~9h内,对放线菌素fgr稳定性基本没影响,但是>9h后吸收值降低,但影响也不大,约0.03.6.3放线菌素fgr的热稳定性6.3.1不同加热温度相同时间的稳定性试验将放线菌素fgr用甲醇配制为0.1mg/ml的溶液,平均分为11份,运用冰箱、水浴锅、灭菌锅调节4、20、30、40、50、60、70、80、90、100及121℃,各温度处理30min后取出,自然冷却,还原至原始体积,以原始放线菌素fgr为对照,测量最大吸收波长处的光吸收值。结果见图8,温度在70℃以下时,温度对线菌素fgr吸光值影响不显著(p>0.05),当70~120℃,线菌素fgr吸光值随着温度的升高而显著下降(p<0.05),因此,低温对线菌素fgr基本不影响,而高温破坏线菌素fgr的成分。6.3.2100℃条件下不同处理时间的稳定性试验将放线菌素fgr用甲醇配制为0.1mg/ml的溶液,平均分为5份,在100℃水浴,于15、30、60、90及120min后取出,冷却后,加甲醇还原至原始体积,以原始放线菌素fgr为对照,测量最大吸收波长处的吸收值。结果如图9所示,在100℃,放线菌素fgr的吸光值随着温度的升高而逐渐缓慢降低(p>0.05),因此,虽然高温破坏放线菌素fgr的成分,但是持续高温,将影响不显著。6.4金属离子对放线菌素fgr稳定性的影响放线菌素fgr用甲醇配制为0.1mg/ml的溶液,平均分为6份,向其中5份分别加入kcl、mncl2、nacl、nh4cl、fecl3、cucl2、zncl2使得溶液的金属离子浓度为1mol/l,静置12h,以剩下的以一份为对照,测量最大吸收波长处的光吸收值,同时测定放线菌素fgr的抗癌效果。结果见图10,影响放线菌素fgr吸光值减小的金属离子由效果大到小依次为:mn2+>k+>fe3+;促进放线菌素fgr吸光值增加的金属离子由效果大到小依次为:zn2+>cu2+>na+>nh4+.6.5放线菌素fgr的氧化剂和还原剂稳定性将放线菌素fgr用甲醇配制为0.1mg/ml的溶液60ml,移取11份,每份5ml,选取10份分别加入20%的硝酸或浓盐酸溶液1、2、3、4、5ml,11份全部用甲醇补足10ml。静置2h,以不加硝酸或浓盐酸的放线菌素fgr溶液为对照,测量最大吸收波长处的光吸收值。由图11可知,还原剂浓盐酸对放线菌素fgr的稳定性有影响;相反,随着氧化剂(硝酸)的不断增加,放线菌素fgr的吸光值越大,表明放线菌素fgr抗氧化能力较强。6.6防腐剂对放线菌素fgr稳定性的影响将放线菌素fgr用甲醇配制为0.1mg/ml的溶液,平均分为13份,其中12份分别加入1、2、4mg0.5%的食盐、蔗糖、红糖、亚硝酸钠,混合后静置2h,以剩下的一份为对照,测量最大吸收波长处的吸收值。由图12可知,4种防腐剂(添加剂)的添加以及添加的量对放线菌素fgr吸光值都增大,因此,若作为色素来使用,添加这些防腐剂可以增强效果。效果由大到小依次为:红糖>亚硝酸钠>食盐>蔗糖。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1