一种抗肥胖四肽PQTR及其应用的制作方法
本发明属于生物制药领域,具体涉及一种合成多肽即抗肥胖四肽pqtr及其应用。
背景技术
生物活性肽是对机体的功能或状态具有积极作用并最终影响机体健康的特殊蛋白质片段。相较于蛋白质而言,小分子肽片段的优越性主要体现在:更易被人体吸收利用;活性高,在较小浓度下即可发挥其特有的生理作用;分子量小,易于修饰和改造,能够通过人工化学合成等。而相较于单一的氨基酸而言,小分子肽除了具有特殊的生理活性外,在吸收通道和吸收速度上也具有氨基酸无可比拟的优越性。已有研究证实,人体小肠存在专门的低聚肽吸收通道,人体摄入的蛋白质经过多种消化酶的水解,主要以低肽的形式被吸收。许多研究表明,各种来源的生物活性肽具有抗氧化、抗肿瘤、抑菌、降压、降血糖等多种作用,成为生物医药和保健品开发的热点。肥胖增加动脉粥样硬化,冠心病,高血压,糖尿病,痛风,脂肪肝等疾病的发病危险。因此,对具有减肥降脂作用而安全无害的生物活性肽的开发研究,变得尤为重要。目前,具有减肥降脂作用的多肽包括利拉鲁肽,鲈鱼活性肽,蚕蛹肽等。抗肥胖的原理有:抑制胰脂肪酶活性、抑制食欲等。抑制胰脂肪酶作为抗肥胖效果的评价指标之一,被广泛应用于天然产物抗肥胖药物的开发中。
技术实现要素:
本发明选取脂肪酶和小鼠前脂肪细胞3t3-l1为研究对象,使用铜皂法测定合成肽的体外抑制脂肪酶活性和甘油三酯试剂盒检测肽的体外抑制成熟脂肪细胞内的抑制甘油三酯活性。本发明的目的是提供一种具有体外抗肥胖活性的合成多肽,可应用于生物制药领域。
本发明所述的合成多肽抗肥胖四肽缩写为pqtr,分子量500.56,序列为:pro-gln-thr-arg。其中,
pro表示英文名称为proline,中文名称为脯氨酸的氨基酸的相应残基;
gln表示英文名称为glutamicacid,中文名称为谷氨酰胺的氨基酸的相应残基;
thr表示英文名称为threonine,中文名称为苏氨酸的氨基酸的相应残基;
arg表示英文名称为arginine,中文名称为精氨酸的氨基酸的相应残基。
本发明所述的氨基酸序列采用标准fmoc方案,通过树脂的筛选,合理的多肽合成方法。将目标多肽的c-端羧基以共价键形式与一个不溶性的高分子树脂相连,然后以这个氨基酸的氨基作为起点,与另一分子氨基酸的羧基作用形成肽键。不断重复这一过程,即可以得到目标多肽产物。合成反应完成后,去除保护基,将肽链与树脂分离,即得到目标产物。多肽合成是一个重复添加氨基酸的过程,固相合成顺序从c端向n端合成。
本发明将终浓度为20-200μg/ml的合成多肽与橄榄油和胰脂肪酶混合后的吸光度进行分析,其对胰脂肪酶活性抑制率达到32.29%-53.41%;300-900μg/ml的合成多肽与诱导的3t3-l1模型细胞混匀,孵育48h后,经tg试剂盒检测,对脂肪细胞内甘油三酯抑制率达到19.59%-37.84%,能在生物医药中应用。
与现有技术相比,本发明具有如下优点和技术效果:
本发明首次合成了该肽,并且采用铜皂法方法检测了合成多肽的胰脂肪酶活性抑制率,tg试剂盒检测了合成多肽的体外脂肪细胞模型内的甘油三酯量,所述合成多肽具有脂肪细胞抑制能力。
附图说明
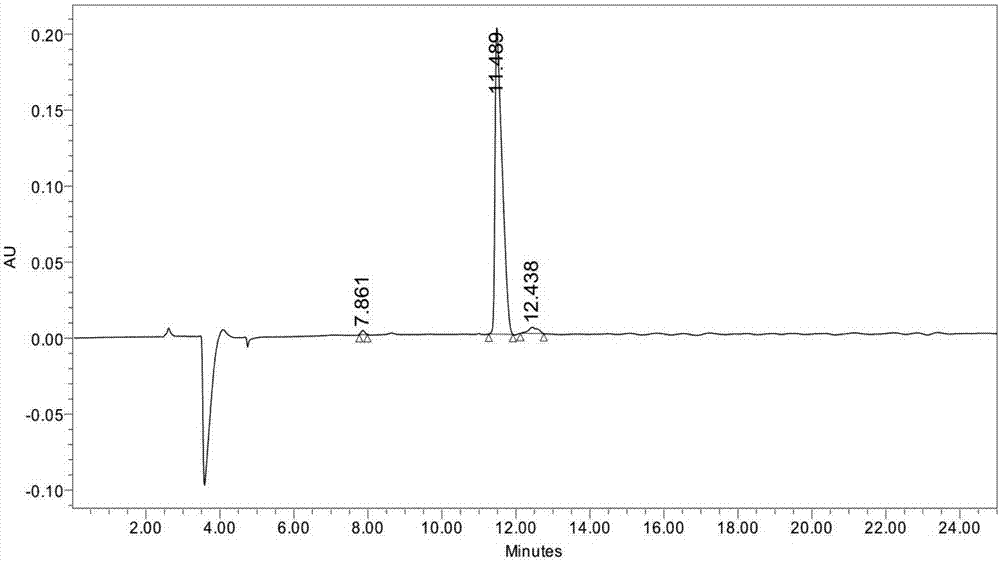
图1a为合成多肽pro-gln-thr-arg的hplc图。
图1b为合成多肽pro-gln-thr-arg的ms图。
图2a为合成多肽pro-gln-thr-arg对脂肪酶的抑制活性。
图2b为合成多肽pro-gln-thr-arg对脂肪细胞3t3-l1甘油三脂的抑制率。
具体实施方式
以下结合具体实例对本发明作进一步说明,但本发明的实施和保护范围不限于此。
多肽固相合成
选用高分子树脂(中肽生化有限公司),按照氨基酸序列pro-gln-thr-arg的特征,先将pro的羧基以共价键的形式与一个树脂相连,然后pro的氨基和gln的羧基缩水反应,处理后,再添加thr,gln的氨基和thr的羧基反应,依次从右到左添加氨基酸,加好最后一个arg氨基酸后,再切除树脂即得到目标多肽。采用高效液相色谱进行纯化,色谱柱型号为phenomenexc18,尺寸4.6*150mm,流动相a:含有0.1%三氟乙酸(tfa)的水;流动相b:含有0.09%tfa的溶液(80%乙腈+20%水);20min内b相由14.0%上升到24.0%,流速1.0ml/min,检测波长220nm。液氮速冻,冷冻干燥,得到最后的产品,要求纯度达到96.72%以上,并经ms鉴定结构(如图1所示)。
合成多肽对胰脂肪酶体外抑制活性
通过铜皂法分析多肽组分对脂肪酶的抑制作用。具体操作步骤如下:
1)首先精确量取5、10、15、20、25、30ul的油酸置于10ml容量瓶中,并用萃取剂溶解,配成一系列浓度。
2)取4ml于烧杯中,加入1ml显色剂,磁力搅拌5min,在2683g,离心10min,取有机相进行全波长扫描,找出最大吸收峰处的波长λ。空白对照组未加油酸,其他操作均相同。以λ处的吸光度值为纵坐标,油酸浓度为横坐标,做出油酸浓度——吸光度值的标准曲线。
3)取橄榄油1ml,3ml0.0667mol/lph=7.38的pbs,在37℃预热5min,加入1ml抑制剂(c=10mg/ml)、0.1ml胰脂肪酶酶(浓度为1mg/ml),磁力搅拌15min,加入8ml环己烷萃取剂,搅拌3min,取有机相4ml,加入1ml用吡啶调节ph为6.1的醋酸铜显色剂,搅拌5min,2683g离心10min后,取有机相,测量在λ波长处的吸光度,空白组不加酶解液,其他操作相同。
胰脂肪酶抑制率的计算公式如下:
胰脂肪酶抑制率(%)=1-
其中,ab是指添加抑制物时的吸光度值;a0是指空白对照组吸光度值
aa是指未添加抑制物时的吸光度值
合成多肽对3t3-l1细胞内甘油三脂的抑制
通过mtt比色法分析肽组分对3t3-l1的生长抑制作用测定多肽的安全剂量,通过甘油三酯试剂盒法分析多肽组分对脂肪细胞抑制甘油三脂的积累。具体操作步骤如下:
1)取对数生长期的细胞,经0.25%(体积)的胰蛋白酶-edta消化液消化后,加入相应的完全培养基终止消化并重悬细胞,血球平板计数后,调整细胞悬液的浓度至5×104个/ml,加至96孔板中,每孔100µl,于37℃恒温co2培养箱中培养;
2)培养24h后细胞贴壁,吸出废旧培养液,加入终体积为200µl的含有不同浓度待测样品的新鲜基础培养基,并以完全培养基为阴性对照,于37℃恒温co2培养箱中培养;
3)48h后吸出药液,用pbs洗板2次,加入5μg/ml的mtt溶液20µl和新鲜完全培养基180µl;于37℃恒温co2培养箱中继续培养;
4)4h后,弃去含有mtt的培养液,加入150µldmso后于微型振荡器上振荡15min,490nm波长处测定光密度值并计算抑制率:
3t3-l1细胞生长抑制率(%)=((对照组od-空白组od)-(给药组od-空白组od))/((对照组od-空白组od))×100
5)取对数生长期的细胞,经0.25%(体积)的胰蛋白酶-edta消化液消化后,加入相应的完全培养基终止消化并重悬细胞,血球平板计数后,调整细胞悬液的浓度至5×104个/ml,加至96孔板中,每孔100µl,于37℃恒温co2培养箱中培养;
6)用10%新生小牛血清dmem低糖培养基培养至细胞完全汇合后,继续培养两天,让细胞产生接触抑制,再加入含有诱导剂的(0.5mmol/libmx,llamol/ldex,10pg/ml胰岛素,10%的fbs)dmem高糖培养基,3天后替换为含10%的fbs和10pg/ml胰岛素的dmem高糖培养基,继续培养3天,换成含10%fbs的dmem高糖培养基培养2天,共8天。在整个诱导分化过程中加入不同浓度的多肽,对照以等体积的dmso代替多肽,dmso浓度不超过0.1%。
7)甘油三酯试剂盒,537nm波长处测定光密度值并计算抑制率:
3t3-l1细胞甘油三脂抑制率(%)=((对照组od-空白组od)-(给药组od-空白组od))/((对照组od-空白组od))×100
应用实施例1
首先精确量取5、10、15、20、25、30ul的油酸置于10ml容量瓶中,并用萃取剂溶解,配成一系列浓度。取4ml于烧杯中,加入1ml显色剂,磁力搅拌5min,在2683g,离心10min,取有机相进行全波长扫描,找出最大吸收峰处的波长λ。空白对照组未加油酸,其他操作均相同。以λ处的吸光度值为纵坐标,油酸浓度为横坐标,做出油酸浓度——吸光度值的标准曲线。取橄榄油1ml,3ml0.0667mol/lph=7.38的pbs,在37℃预热5min,加入1ml多肽抑制剂(c=10mg/ml)、0.1ml胰脂肪酶酶(浓度为1mg/ml),磁力搅拌15min,加入8ml环己烷萃取剂,搅拌3min,取有机相4ml,加入1ml用吡啶调节ph为6.1的醋酸铜显色剂,搅拌5min,2683g离心10min后,取有机相,测量在λ波长处的吸光度测定光密度值并计算抑制率。由图2a可知,50µg/ml的多肽对脂肪酶的抑制率是32.29%。
应用实施例2
首先精确量取5、10、15、20、25、30ul的油酸置于10ml容量瓶中,并用萃取剂溶解,配成一系列浓度。取4ml于烧杯中,加入1ml显色剂,磁力搅拌5min,在2683g,离心10min,取有机相进行全波长扫描,找出最大吸收峰处的波长λ。空白对照组未加油酸,其他操作均相同。以λ处的吸光度值为纵坐标,油酸浓度为横坐标,做出油酸浓度——吸光度值的标准曲线。取橄榄油1ml,3ml0.0667mol/lph=7.38的pbs,在37℃预热5min,加入1ml抑制剂(c=20mg/ml)、0.1ml胰脂肪酶酶(浓度为1mg/ml),磁力搅拌15min,加入8ml环己烷萃取剂,搅拌3min,取有机相4ml,加入1ml用吡啶调节ph为6.1的醋酸铜显色剂,搅拌5min,2683g离心10min后,取有机相,测量在λ波长处的吸光度测定光密度值并计算抑制率。由图2a可知,100µg/ml的多肽对脂肪酶的抑制率是43.62%。
应用实施例3
首先精确量取5、10、15、20、25、30ul的油酸置于10ml容量瓶中,并用萃取剂溶解,配成一系列浓度。取4ml于烧杯中,加入1ml显色剂,磁力搅拌5min,在2683g,离心10min,取有机相进行全波长扫描,找出最大吸收峰处的波长λ。空白对照组未加油酸,其他操作均相同。以λ处的吸光度值为纵坐标,油酸浓度为横坐标,做出油酸浓度——吸光度值的标准曲线。取橄榄油1ml,3ml0.0667mol/lph=7.38的pbs,在37℃预热5min,加入1ml抑制剂(c=20mg/ml)、0.1ml胰脂肪酶酶(浓度为1mg/ml),磁力搅拌15min,加入8ml环己烷萃取剂,搅拌3min,取有机相4ml,加入1ml用吡啶调节ph为6.1的醋酸铜显色剂,搅拌5min,2683g离心10min后,取有机相,测量在λ波长处的吸光度测定光密度值并计算抑制率。由图2可知,125µg/ml的多肽对脂肪酶的抑制率是53.41%。
应用实施例4
取对数生长期的细胞,经0.25%(体积)的胰蛋白酶-edta消化液消化后,加入相应的完全培养基终止消化并重悬细胞,血球平板计数后,调整细胞悬液的浓度至5×104个/ml,加至96孔板中,每孔100µl,于37℃恒温co2培养箱中培养;用10%新生小牛血清dmem低糖培养基培养至细胞完全汇合后,继续培养两天,让细胞产生接触抑制,再加入含有诱导剂的(0.5mmol/libmx,llamol/ldex,10pg/ml胰岛素,10%的fbs)dmem高糖培养基,3天后替换为含10%的fbs和10pg/ml胰岛素的dmem高糖培养基,继续培养3天,换成含10%fbs的dmem高糖培养基培养2天,共8天。在整个诱导分化过程中加入200μg/ml浓度的多肽,对照以等体积的dmso代替多肽,dmso浓度不超过0.1%。甘油三酯试剂盒,537nm波长处测定光密度值并计算抑制率,537nm波长处测定光密度值并计算抑制率。由图2可知,200µg/ml的多肽对前脂肪细胞3t3-l1内甘油三脂抑制率是19.59%。
应用实施例5
取对数生长期的细胞,经0.25%(体积)的胰蛋白酶-edta消化液消化后,加入相应的完全培养基终止消化并重悬细胞,血球平板计数后,调整细胞悬液的浓度至5×104个/ml,加至96孔板中,每孔100µl,于37℃恒温co2培养箱中培养;用10%新生小牛血清dmem低糖培养基培养至细胞完全汇合后,继续培养两天,让细胞产生接触抑制,再加入含有诱导剂的(0.5mmol/libmx,llamol/ldex,10pg/ml胰岛素,10%的fbs)dmem高糖培养基,3天后替换为含10%的fbs和10pg/ml胰岛素的dmem高糖培养基,继续培养3天,换成含10%fbs的dmem高糖培养基培养2天,共8天。在整个诱导分化过程中加入200μg/ml浓度的多肽,对照以等体积的dmso代替多肽,dmso浓度不超过0.1%。甘油三酯试剂盒,537nm波长处测定光密度值并计算抑制率,537nm波长处测定光密度值并计算抑制率。由图2可知,400µg/ml的多肽对前脂肪细胞3t3-l1内甘油三脂抑制率是32.32%。
应用实施例6
取对数生长期的细胞,经0.25%(体积)的胰蛋白酶-edta消化液消化后,加入相应的完全培养基终止消化并重悬细胞,血球平板计数后,调整细胞悬液的浓度至5×104个/ml,加至96孔板中,每孔100µl,于37℃恒温co2培养箱中培养;用10%新生小牛血清dmem低糖培养基培养至细胞完全汇合后,继续培养两天,让细胞产生接触抑制,再加入含有诱导剂的(0.5mmol/libmx,llamol/ldex,10pg/ml胰岛素,10%的fbs)dmem高糖培养基,3天后替换为含10%的fbs和10pg/ml胰岛素的dmem高糖培养基,继续培养3天,换成含10%fbs的dmem高糖培养基培养2天,共8天。在整个诱导分化过程中加入200μg/ml浓度的多肽,对照以等体积的dmso代替多肽,dmso浓度不超过0.1%。甘油三酯试剂盒,537nm波长处测定光密度值并计算抑制率,537nm波长处测定光密度值并计算抑制率。由图2可知,600µg/ml的多肽对前脂肪细胞3t3-l1内甘油三脂抑制率是37.84%。
序列表
<110>华南理工大学
<120>一种抗肥胖四肽pqtr及其应用
<160>1
<170>siposequencelisting1.0
<210>1
<211>4
<212>prt
<213>合成肽(pqtr)
<400>1
proglythrala
1
- 还没有人留言评论。精彩留言会获得点赞!