唐古特虎耳草中黄酮类化合物的定向分离纯化方法与流程
本发明涉及黄酮类化合物的分离纯化技术领域,尤其涉及唐古特虎耳草中黄酮类化合物的定向分离纯化方法。
背景技术
唐古特虎耳草(saxifragatanguticaengl.)为虎耳草科(saxifragaceae)虎耳草属(saxifraga)植物,藏药名:松吉蒂,中药中称之为迭达,主要分布在青海、甘肃、西藏、四川以及不丹与克什米尔地区海拔2900~4900m的针叶林灌丛下。唐古特虎耳草为常用藏药,其味苦性凉,清热,治肝、胆热症和创伤,还可治疗急性中耳炎、风热咳嗽,现代药理学研究表明唐古特虎耳草具有抑菌、抗病毒、抗炎和抗肿瘤的药理作用。
迄今,有关唐古特虎耳草的研报道文献仅有《藏药甘青虎耳草化学成分研究》一文,文中描述了利用传统的柱层析、结晶等分离手段从中分离到四个以槲皮素为母核的黄酮类化合物,其中包括:(i)槲皮素、(ii)槲皮素-3-o-β-d-半乳糖糖苷,(iii)槲皮素-3-o-β-d-葡萄糖苷,(iv)槲皮素-3-o-β-d-半乳糖-7-o-β-d-葡萄糖苷;以谷甾醇为母核的两个甾醇类化合物,包括:β-谷甾醇以及胡萝卜苷;以及两个小极性的脂肪烃类化合物:正二十九烷和正三十一烷。中国专利cn105153250b和cn105085589a报道了唐古特虎耳草中二芳基庚烷类化合物类组分的富集方法以及新结构的抗肿瘤活性的二芳基庚烷类化合物,而从唐古特虎耳草中获取黄酮类化合物的定向分离纯化方法未见文献报道。
技术实现要素:
本发明所要解决的技术问题是提供一种快速、简单的唐古特虎耳草中黄酮类化合物的定向分离纯化方法。
为解决上述问题,本发明所述的唐古特虎耳草中黄酮类化合物的定向分离纯化方法,包括以下步骤:
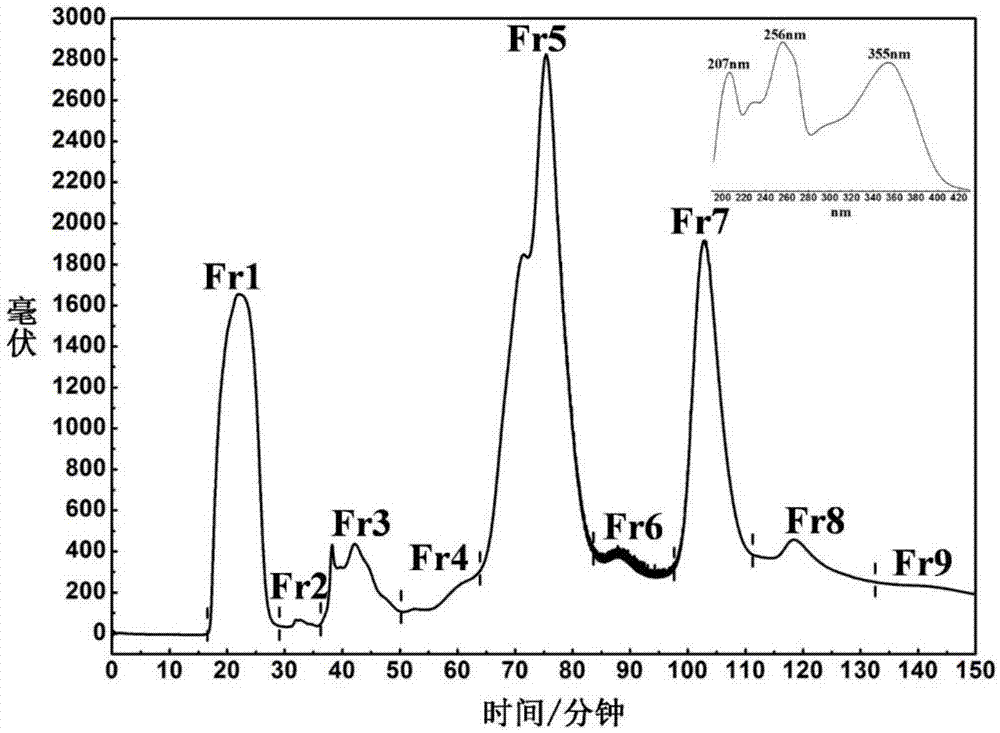
⑴采用中压色谱塔,将唐古特虎耳草95%乙醇提取物进行色谱分离,按下述线性梯度洗脱方式进行洗脱:0~90min,体积浓度0%→100%b;90~120min,体积浓度100%→100%b;收集馏分共计9个组分,利用高效液相色谱结合黄酮类化合物特征紫外吸收光谱进行筛查,确定黄酮类化合物主要分布于馏分7中,将馏分7减压浓缩至恒重;
⑵采用二维制备液相色谱系统,将中压色谱塔分离所得的馏分7经第一维制备型高效液相色谱分离,并按下述线性梯度洗脱方式进行洗脱:0~60min,体积浓度90%→65%b;利用高效液相色谱结合黄酮类化合物特征紫外吸收光谱进行筛查,最终确定收集的馏分共计9个组分,每个组分减压浓缩至恒重;
⑶采用二维制备液相色谱系统,将步骤(2)所得馏分1~9共9个组分经第二维制备型高效液相色谱分离,并按下述线性梯度洗脱方式进行洗脱:0~60min,体积浓度17%→23%b;定向收集母核离子为303,287和317的色谱峰,减压浓缩至恒重,即得黄酮类化合物单体。
所述步骤⑴中中压色谱塔色谱分离的工作参数是指装填mci微孔树脂固定相;中压色谱塔内径为36.0~100.0mm;制备流动相a水,b为甲醇或乙醇;分离过程中采用紫外检测器检测,检测波长为254nm;流速为18~50.0ml/min。
所述步骤⑵中第一维制备型高效液相色谱分离的工作参数是指色谱柱为亲水色谱柱xion或xamide,其内径为20.0~100.0mm;制备流动相a为0.2%甲酸-水,b为乙腈;样品溶液浓度为50.0~200.0mg/ml;进样量为2.0~40.0ml;流速为15~330.0ml/min。
所述步骤⑶中第二维制备型高效液相色谱分离的工作参数是指色谱柱为耐纯水反相色谱柱megressc18;其内径为20~100.0mm;制备流动相a为0.2%甲酸-水,b为乙腈;分离过程中采用紫外检测器检测,检测波长为254nm;流速为15~330.0ml/min。
所述步骤⑴、⑵和⑶中减压浓缩条件是指真空度为0.07~0.09mpa,温度为50~60℃。
本发明与现有技术相比具有以下优点:
1、本发明采用中压色谱塔和二维制备液相色谱从唐古特虎耳草95%乙醇提取物中定向分离纯化黄酮类化合物,其中中压色谱塔采用mci固定相、第一维色谱分离采用亲水色谱柱、第二维色谱分离采用反相色谱柱,三步色谱分离均为可视化操作,不但快速、简单,而且易于规模化扩大。
2、采用本发明方法,可实现黄酮类化合物的目标制备,可获取批量的已知活性黄酮,同时富集分离微量黄酮,从而可以不断丰富黄酮类化合物库,为黄酮类化合物的活性研究和单一成分的新药开发提供物质基础。
附图说明
下面结合附图对本发明的具体实施方式作进一步详细的说明。
图1为本发明的中压色谱塔分离色谱图。
图2为本发明的一维制备馏分收集色谱图。
图3为本发明的一维馏分再分析色谱图。
图4为本发明的二维制备馏分收集色谱图。
具体实施方式
唐古特虎耳草中黄酮类化合物的定向分离纯化方法,包括以下步骤:
⑴采用中压色谱塔,将唐古特虎耳草95%乙醇提取物进行色谱分离,按下述线性梯度洗脱方式进行洗脱:0~90min,体积浓度0%→100%b;90~120min,体积浓度100%→100%b;收集馏分共计9个组分,利用高效液相色谱结合黄酮类化合物特征紫外吸收光谱进行筛查,确定黄酮类化合物主要分布于馏分7中,将馏分7减压浓缩至恒重;
其中:
中压色谱塔色谱分离的工作参数是指装填mci微孔树脂固定相;中压色谱塔内径为36.0~100.0mm;制备流动相a水,b为甲醇或乙醇;分离过程中采用紫外检测器检测,检测波长为254nm;流速为18~50.0ml/min。
减压浓缩条件是指真空度为0.07~0.09mpa,温度为50~60℃。
⑵采用二维制备液相色谱系统,将中压色谱塔分离所得的馏分7经第一维制备型高效液相色谱分离,并按下述线性梯度洗脱方式进行洗脱:0~60min,体积浓度90%→65%b;利用高效液相色谱结合黄酮类化合物特征紫外吸收光谱进行筛查,最终确定收集的馏分共计9个组分,每个组分减压浓缩至恒重;
其中:
第一维制备型高效液相色谱分离的工作参数是指色谱柱为亲水色谱柱xion或xamide,其内径为20.0~100.0mm;制备流动相a为0.2%甲酸-水,b为乙腈;样品溶液浓度为50.0~200.0mg/ml;进样量为2.0~40.0ml;流速为15~330.0ml/min。
减压浓缩条件是指真空度为0.07~0.09mpa,温度为50~60℃。
⑶采用二维制备液相色谱系统,将所述馏分1~9共9个组分经第二维制备型高效液相色谱分离,并按下述线性梯度洗脱方式进行洗脱:0~60min,体积浓度17%→23%b;定向收集母核离子为303,287和317的色谱峰,减压浓缩至恒重,即得黄酮类化合物单体。
其中:
第二维制备型高效液相色谱分离的工作参数是指色谱柱为耐纯水反相色谱柱megressc18;其内径为20~100.0mm;制备流动相a为0.2%甲酸-水,b为乙腈;分离过程中采用紫外检测器检测,检测波长为254nm;流速为15~330.0ml/min。
减压浓缩条件是指真空度为0.07~0.09mpa,温度为50~60℃。
实施例选取唐古特虎耳草95%乙醇提取物第一维制备所得3个有代表性的馏分(fr2,fr3和f8),通过第二维反相色谱制备获得7个黄酮类化合物单体。该化合物的结构信息如表1:
表17个黄酮类化合物单体
具体过程如下:
①选取fraction2采用反相色谱分离模式进行第二维制备型高效液相色谱分离,色谱条件:色谱柱为耐纯水柱(megressc18,250×20mm,i.d.,10μm);0.2%甲酸-水(a)和乙腈(b)流动相体系;0~60min,体积浓度17%→23%b梯度洗脱;流速为15ml/min;检测波长为254nm;收集30~45min内的两个色谱主峰,减压干燥回收溶剂,经1hnmr和13cnmr核磁确定获得fr2-1和fr2-2两个单体化合物。hplc检测纯度均大于98%,经理化测定,数据如下:
fr2-1:黄色粉末,1h-nmr(dmso-d6,600mhz)δ:7.97(2h,d,j=2.0hz,h-2'),7.54(1h,d,j=8.5,2.0hz,h-6'),7.22(2h,d,j=8.5hz,h-5'),6.46(1h,d,j=2.0hz,h-8),6.24(1h,d,j=2.0hz,h-6),5.50(1h,d,j=7.7hz,h-1”),5.38(1h,d,j=7.8hz,h-1”'),3.08~3.81(11h,m,h-2”~h-6”,h-2”'~h-5”'),3.82(3h,s,c-7');13cnmr(151mhz,dmso-d6)δ:177.3(c-4),165.3(c-7),161.2(c-5),156.3(c-2),156.1(c-9),148.7(c-3'),147.7(c-4'),133.4(c-3),121.8(c-6'),121.5(c-1'),116.0(c-5'),115.3(c-2'),103.7(c-10),101.6(c-1”),100.9(c-1”'),98.9(c-6),93.6(c-8),77.6(c-5”),76.5(c-3”),75.9(c-3”'),74.1(c-2”),73.2(c-2”'),69.9(c-4”),69.8(c-4”'),67.9(c-5”'),60.1(c-6”),56.2(c-7')。
fr2-2:黄色粉末,1h-nmr(dmso-d6,600mhz)δ:8.04(2h,d,j=8.5hz,h-2',h-6'),6.88(2h,d,j=8.5hz,h-3',h-5'),6.44(1h,d,j=2.0hz,h-8),6.21(1h,d,j=2.0hz,h-6),5.46(1h,d,j=7.5hz,h-1”),3.07~3.67(6h,m,h-2”~h-6”);13cnmr(151mhz,dmso-d6)δ:177.4(c-4),164.2(c-7),161.2(c-5),160.0(c-4'),156.4(c-2,c-9),133.1(c-3),130.9(c-2',c-6'),120.9(c-1'),115.1(c-3',c-5'),104.0(c-10),100.9(c-1”),98.7(c-6),93.7(c-8),77.5(c-3”),76.4(c-5”),74.2(c-2”),69.9(c-4”),60.8(c-6”)。
②选取fraction3采用反相色谱分离模式进行第二维制备型高效液相色谱分离,色谱条件:色谱柱为耐纯水柱(xaquac18,250×50mm,i.d.,10μm);0.2%甲酸-水(a)和乙腈(b)流动相体系;0~60min,体积浓度17%→23%b梯度洗脱;流速为60ml/min;检测波长为254nm;收集20~50min内的三个色谱主峰,减压干燥回收溶剂,经1hnmr和13cnmr核磁确定获得fr3-1、fr3-2和fr2-2三个单体化合物。hplc检测纯度均大于98%,经理化测定,数据如下:
fr3-1:黄色粉末,1h-nmr(dmso-d6,600mhz)δ:8.01(2h,d,j=8.5hz,h-2',h-6'),6.90(2h,d,j=8.5hz,h-3',h-5'),6.80(1h,d,j=2.0hz,h-8),6.49(1h,d,j=2.0hz,h-6),5.29(1h,d,j=8.5hz,h-1”),4.39(1h,d,j=1.2hz,h-1”'),4.70(1h,d,j=1.2hz,h-1””),3.70~3.20(21h,m,h-2”~h-6”,h-2”'~h-6”',h-2””~h-6””),1.06(3h,d,j=6.5hz,h-6”'),0.96(3h,d,j=6.5hz,h-6””);13cnmr(151mhz,dmso-d6)δ:177.4(c-4),164.9(c-7),169.8(c-5),161.0(c-4'),156.6(c-9),156.5(c-2),133.5(c-3),131.1(c-2',c-6'),121.0(c-1'),115.1(c-3',c-5'),103.8(c-10),102.4(c-1”),102.3(c-1””),100.2(c-1”'),99.1(c-6),94.0(c-8),78.1(c-3”'),73.4(c-3”,c-5”'),72.9(c-5”),72.1(c-2”),71.1(c-4””),70.9(c-4”'),70.5(c-2”'),70.4(c-2””),70.0(c-3””),68.3(c-5””),68.1(c-4”),65.2(c-6”),17.9(c-6”'),17.7(c-6””)。
fr3-2:黄色粉末,1h-nmr(dmso-d6,600mhz)δ:8.04(2h,d,j=8.7hz,h-2',h-6'),6.91(2h,d,j=8.5hz,h-3',h-5'),6.43(1h,d,j=2.0hz,h-8),6.19(1h,d,j=2.0hz,h-6),5.69(1h,d,j=6.9hz,h-1”),4.61(1h,d,j=7.8hz,h-1”'),3.05~3.51(12h,m,h-2”~h-6”,h-2”'~h-6”');13cnmr(151mhz,dmso-d6)δ:177.5(c-4),164.0(c-7),161.3(c-5),160.0(c-9),156.3(c-2),155.6(c-4'),132.9(c-3),131.0(c-2',c-6'),120.9(c-1'),115.3(c-3',c-5'),104.1(c-10),104.0(c-1”),98.7(c-1”'),97.9(c-6),93.6(c-8),82.4(c-3”),77.5(c-5”'),77.0(c-3”'),76.6(c-2”,c-5”),74.4(c-2”'),69.7(c-4”),69.6(c-4”'),60.8(c-6”),60.5(c-6”')。
fr3-3:黄色粉末,1h-nmr(dmso-d6,600mhz)δ:8.02(1h,d,j=2.1hz,h-2'),7.50(1h,d,j=8.4,2.1hz,h-6'),6.90(2h,d,j=2.1hz,h-5'),6.44(1h,d,j=2.0hz,h-8),6.21(1h,d,j=2.0hz,h-6),5.38(1h,d,j=7.7hz,h-1”),3.84(3h,s,h-7'),3.38~3.84(6h,m,h-2”~h-6”);13cnmr(151mhz,dmso-d6)δ:177.4(c-4),164.2(c-7),161.2(c-5),156.4(c-9),156.3(c-2),149.4(c-3'),147.0(c-4'),133.1(c-3),121.9(c-6'),121.1(c-1'),115.2(c-5'),113.5(c-2'),104.0(c-10),101.6(c-1”),98.7(c-6),93.7(c-8),77.5(c-3”),76.4(c-5”),74.2(c-2”),70.0(c-4”),60.(c-6”),56.1(c-7')。
③选取fraction8采用反相色谱分离模式进行第二维制备型高效液相色谱分离,色谱条件:色谱柱为耐纯水柱(xaquac18,250×100mm,i.d.,10μm);0.2%甲酸-水(a)和乙腈(b)流动相体系;0~60min,体积浓度17%→23%b梯度洗脱;流速为330ml/min;检测波长为254nm;收集10~30min内的两个色谱主峰,减压干燥回收溶剂,经1hnmr和13cnmr核磁确定获得fr8-1和fr8-2两个单体化合物。hplc检测纯度均大于98%,经理化测定,数据如下:
fr8-1:黄色粉末,1h-nmr(dmso-d6,600mhz)δ:7.38(2h,m,h-2',h-6'),6.86(1h,d,j=2.2hz,h-5'),6.77(1h,d,j=2.0hz,h-8),6.60(1h,d,j=2.0hz,h-6),5.01(1h,d,j=8.0hz,h-1”),3.30~3.82(6h,m,h-2”~h-6”);13cnmr(151mhz,dmso-d6)δ:176.2(c-4),162.8(c-7),160.3(c-5),148.0(c-2),156.1(c-9),159.4(c-4'),145.6(c-3'),103.2(c-3),129.8(c-6'),121.5(c-1'),129.5(c-2'),115.7(c-5'),105.1(c-10),100.6(c-1”),99.1(c-6),94.6(c-8),77.3(c-5”),76.8(c-3”),78.4(c-2”),70.2(c-4”),61.2(c-6”')。
fr8-2:黄色粉末,1h-nmr(dmso-d6,600mhz)δ:7.93(2h,d,j=2.1hz,h-2'),7.50(1h,d,j=8.4,2.1hz,h-6'),6.91(2h,d,j=2.1hz,h-5'),6.42(1h,d,j=2.0hz,h-8),6.20(1h,d,j=2.0hz,h-6),5.51(1h,d,j=7.4hz,h-1”),4.08(1h,d,j=7.8hz,h-1”'),2.78~3.90(12h,m,h-2”~h-6”,h-2”'~h-6”');13cnmr(151mhz,dmso-d6)δ:177.8(c-4),164.8(c-7),161.6(c-5),156.9(c-9),156.7(c-2),149.9(c-3'),147.4(c-4'),133.5(c-3),122.6(c-6'),121.4(c-1'),115.7(c-5'),113.8(c-2'),104.5(c-10),103.6(c-1”),101.5(c-1”'),99.2(c-6),94.3(c-8),77.2(c-5”'),77.0(c-3”),76.9(c-5”),76.7(c-3”'),74.7(c-2”),73.9(c-2”'),70.2(c-4”),70.1(c-4”'),68.2(c-6”),61.2(c-6”'),56.3(c-7')。
- 还没有人留言评论。精彩留言会获得点赞!