植物双重特性表达启动子及其应用的制作方法
本发明涉及一种从植物中分离的启动子,尤其涉及从水稻中分离的植物双重特性表达启动子,本发明还涉及含有该双重特性表达启动子的重组表达载体以及在改良植物性状、培育植物新品种等方面的应用。
背景技术:
水是植物生命活动的物质基础,参与植物的代谢、物质的吸收、转化和运输等过程。水分维持植物的正常生长发育,它对外界环境的适应起着重要作用。水分不能维持植物正常生命活动时,植物就会表现出减少吸水,关闭气孔,减缓蒸腾,新陈代谢异常等干旱胁迫症状。干旱对植物的影响广泛而深刻,从种子萌发、营养生长、生殖生长到开花结果的各个阶段都受到其影响。另外,光合作用、呼吸作用、水分和营养元素的吸收运转、各种酶的活性和有机物的转化等生理生化代谢过程都受到干旱的影响。植物受到干旱的影响,造成植物细胞缺水,从而产生干旱信号,诱导植物产生抗旱反应。对植物适应干旱胁迫的分子机理的了解有利于开展植物抗旱基因工程,在提高植物抗旱能力和促进农业生产的发展中具有十分重要的意义。目前干旱化趋势已经成为全球关注的焦点之一,也成为困扰我国农业可持续发展的重要因素,因此如何高效利用有限的淡水资源进行大规模的农业生产已经成为国际和国内生物科学技术迫切需要解决的重大课题之一。而培育抗旱作物新品种是解决这一问题的一条经济而有效的途径。
水稻抗旱研究日益受到人们关注,现代基因工程技术为作物的定向改良和品种选育开辟了一条新途径。水稻抗早遗传改良的一个重要策略是将来源于水稻或其它植物(玉米、小麦、黑麦、拟南芥等)抗旱相关基因置于组成性表达或诱导性启动子控制之下直接转化水稻。利用诱导性表达启动子既可以达到在特定时期(如植物受到逆境胁迫时)、特定组织中特异表达抗旱相关基因,又可以避免由于组成性表达所带来可能的不利影响,因此,干旱特异诱导性启动子的分离和鉴定对于抗旱遗传改良显得尤为重要。
而且,研究人员目前所研究的启动子往往仅具备单一表达特异性,从目前文献中所了解到的具有多重表达特异性的启动子寥寥无几。因此,若是能够提供一种具有两重表达特异性的启动子,其将对转基因植物,尤其是转基因水稻的性状改良将具有极其重大的意义。
技术实现要素:
针对上述问题,本发明的目的是提供一种具有双重表达特异性的启动子以及该启动子的应用。本发明从水稻中分离克隆出双重特性表达启动子posdro5,该启动子不仅具有干旱诱导活性,而且该启动子能够驱动目的基因在种子中特异表达。利用该启动子为转基因水稻育种服务,能够保护在干旱条件下的种子发育,同时有利于提高转基因作物的安全性,并为长远的启动子改造和设计储备资源。
具体而言,本发明提供一种植物双重特性表达启动子,其特征在于,所述植物干旱诱导表达启动子分离自水稻植株,所述植物双重特性表达启动子的dna序列包含seqidno:1所示的dna序列,
seqidno:1所示的dna序列为:
accgcaaacatggacggaatagttcatttggatttgtccattcgtggaaactgatttttttttaaaaaaaattaaagctttcagtctttgcaataactaataaaacatgagaaattttataatatttgagatgtaccaaaatctttaatctaaatttttatttatcggaggtaccaaaatttacagtatattttttgtaccgccttaaaaattataaaatcattcgtaatacatactattatgtaaccataattatttttgtcactaagattcaaaccctgacgaatgaagctgtacgtgcccgattccacgccgcatgaatggtgcttcacataaactgataaattcaagttgcgttttgtttgtttccagagaaaagaaataatcaaatgccactgtcagccacgtattgttttgttcttaattagcaaagcgtgtaaaacacatcccccgctaactaaatgccatcgaaatttctgttcatgtgtttgactgccgtatagtccatgagctttaatctagttattcgatttatcagataggcaagtggtttaaaagacatagttattcaatggtgagtcgaccgaaactaaactcgatttatcatgacataatagacacggttgccacttgccacagaaagaataagagcgctgctacacgtacttaaaagtgaaatacttgcaaaatccttacaaacaataatctgaactgtttgatttaactagacgagagttacagaaaatctatatatactcacagtttgataagagtttagtagaaagaatttcatatttatagcctttttccagaagaaatgatcaaatcaagaagtgaaaccggccggagaaagtctacaccggcaggcccggctcatgcagcccacgttaggaagcctggctgcactgggtggcccaacggtggggtgggccacctcgggccagccgcagcagaatgcatgggccggcccataaatgggccactccaaagcagaccggcgctcagaggtccatcctgatgaatgaacattcatgcaggtgaccggcccaaaataattacagaaacccaaaaattacagaaaaactacgggttgttcatgttataccatttcagaacataccatttttttaaagttgataaatatacgtatccattaagttttttactaataaatacgtaagaaatcctgtcaaaacttggcaatattgctaaattgttgccaaaactttataaggtttattttagctacaatctaaacagaccttatgtatttgctaaaaacttaaaaaaaagtgcagaaaattaggaatttgctcaaaaatatggtaacagtttggaccattagataagcttaatgatttattctagcgagagattcttgctggatgtatgcatgtaaatatattgtaattacaccgtaattatgctatagttatatttgaaatatttttatcttaaagaactgatatgttatatagctacttccgaaaactagcacggaaatgcttttttgaaaaaagaaacatatgttctcctttctgtgtgaataaagcacgagcagttccagttgtatatatatgcgtccaaatatactgtcccgtggtttattcatccaaacgacaaatccttttttctaaaaaaaaattccaacgcattactttcttcccttttctctagcgaaaaaaagaaagcaccgaccaaagtggctcaaaaatggacgcgtccaaagatcgcgctgccacatgacaacggacttcgatgaaattatcgtcaatttttatcaaattccgatcaaatcattcctcgtcggcgtccatcccggatactataggtggacaccttcgagtcgcttctctcttctccggcgacactgccactgccacgcgtccctcccttcctccccgcccaacccccacgtgtgcgtccacgtggcacccgcccatctcacctcctcctcctatatcctcctctcctccgccattgccgcacctcatcacctcctcgtcttcttcttccacctcgcaaatccgatcaacacatcagcttgagaaaca。
优选地,所述启动子包含:
(a)在seqidno:1中所示的核苷酸序列中添加一个或多个核苷酸后所获得的核苷酸序列;或者
(b)与seqidno:1中所示的核苷酸序列具有至少90%同源性的核苷酸序列;或者
(c)在seqidno:1中所示的核苷酸序列中取代一个或多个核苷酸后所获得的核苷酸序列;或者
(d)seqidno:1中所示的核苷酸序列缺失一个或多个核苷酸后所获得的核苷酸序列;或者
(e)与带有seqidno:1中所示的核苷酸序列的植物杂交后所获得的相应产物的对应核苷酸序列。
优选地,所述启动子来自日本晴水稻,分离所采用的扩增引物包括第一引物和第二引物。
另一方面,本发明提供一种表达盒,其特征在于,所述表达盒包含所述的植物双重特性表达启动子。
另一方面,本发明提供一种重组表达载体,其特征在于,所述重组表达载体包含所述的干旱诱导型组织特异性表达启动子,在所述重组表达载体中,所述干旱诱导型组织特异性表达启动子连接于载体中待表达的基因序列的上游。
优选地,所述待表达的基因为gus基因,所述重组表达载体为pcambia1381-posdro5,其中pcambia1381为植物双元表达载体。
另一方面,本发明提供一种增强植物种子发育及抗旱能力的方法,其特征在于,所述方法包括:将所述的植物水淹诱导型组织特异性启动子posdro5连接种子发育基因和耐旱基因,构成重组载体,将所述重组载体导入到目标植株中,以促进植物种子发育,并且当所述目标植株遭受干旱环境时,所述水稻干旱诱导型组织特异性启动子posdro5诱导所述耐干旱基因大量表达,以促进植物的抗旱能力。
本发明对获得的转基因水稻进行gus化学染色检测发现,植株根、茎和叶中没有蓝色,而在种子中有明显的蓝色着色。而当植株经过干旱诱导后,根、茎、叶和种子组织上都呈现出明显的着色。特别是,当干旱处理12小时后,启动子驱动的gus基因表达量是未处理的12倍,从而证明该2054bp的序列具有种子特异性,并且具有干旱诱导活性。
技术效果
本发明所克隆的启动子posdro5能够调控基因在水稻种子中特异表达,并且能够促进干旱诱导下在植株中表达。因此,可以将其与所需的靶标基因连接,用于对各种单子叶植物进行外源基因在植株中表达的调节和控制,对农作物或能源植物品种进行基因改造,也可将其用于调控干旱诱导相关基因在植物中的表达,特别是保护干旱条件下的种子萌发,为耐旱植物品种的筛选和安全生产提供参考,对培育耐旱植物品种具有重要的意义。
附图说明
以下,结合附图来详细说明本发明的实施方案,其中:
图1为将posdro5启动子构建于pcambia1381载体质粒中的示意图,其中a为pcambia1381示意图,b为pcambia1381-posdro5示意图,其中示出了利用posdro5启动子驱动位于其下游的gus基因表达;
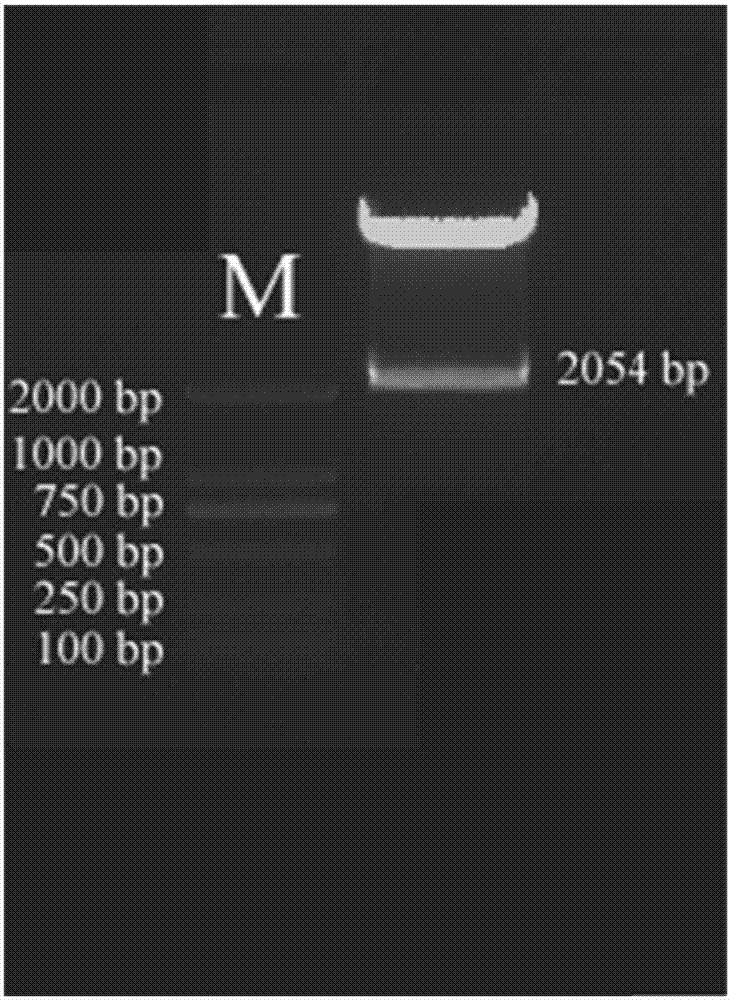
图2为对本发明构建的pcambia1381-posdro5表达载体进行酶切验证的结果示意图。
图3为对获得的posdro5::gus转基因水稻植株,进行干旱处理前后的各部位gus染色结果示意图,图中a、b、c、d表示的是干旱诱导前根茎、叶和种子组织染色结果,下面e、f、g和h表示干旱诱导后各组织染色结果,从左向右分别表示根、茎、叶和种子组织(标尺=0.5cm)。
图4为对获得的posdro5::gus转基因水稻植株,进行干旱处理前后gus基因表达量的qrt-pcr检测结果。图中以干旱处理前转基因植株中的gus基因表达量为1,干旱处理后posdro5启动子驱动的gus基因表达量是处理前的12倍。
具体实施方式
以下参照具体的实施例来说明本发明。本领域技术人员能够理解,这些实施例仅用于说明本发明,其不以任何方式限制本发明的范围。
本发明利用水稻日本晴成熟种子(由安徽省农科院水稻所生技室保存)来来分离启动子片段。
下面对实施例中所用的主要药材原料、试剂材料等进行简单说明,原料、试剂如无特殊说明,均为市售购买产品。
次氯酸钠(naclo,有效氯浓度4%),tween20购自sigma公司。潮霉素b购自roche公司;peasy-tsimple和dnamarker-trans2k购自transgen公司;限制性内切酶购自neb公司;kod高保真聚合酶和定量pcr试剂盒购自大连takara宝生物技术有限公司;t4dna连接酶购自promega公司;dna片段回收试剂盒购自tiangen公司;质粒dna提取采用axygen质粒小提试剂盒。引物合成和测序由北京六合华大基因科技股份有限公司完成。缓冲液、试剂、细菌培养基配方、大肠杆菌感受态制备参见《分子克隆实验指南》(第三版)。
本发明所采用的大肠杆菌菌株为xl-blue;根瘤农杆菌为eha105,安徽省农科院水稻所生物技术室保存;植物表达载体pcambia1381购自澳大利亚cambia公司。
具体实施例1:启动子posdro5的获得
本申请的发明人根据ncbi中提供的水稻品种日本晴(oryzasativalcv.nipponbare)全基因组序列,以loc_os10g36180基因转录起始位点上游2054bp的核苷酸序列作为该基因的启动子,并将其命名为posdro5。依据水稻loc_os10g36180基因的启动子序列设计扩增引物,并根据选用的载体及靶标基因的特点,设计引物的酶切位点,引物由深圳华大基因公司合成。具体设计的引物为:正向引物序列为ctgcagaccgcaaacatggacggaatag(seqidno:2),5’端带psti酶切位点,反向引物为ggatcctgtttctcaagctgatgtgttg(seqidno:3),5’端带bamhi酶切位点。
以常规方法提取水稻品种日本晴dna。以日本晴dna为模板,利用正向引物、反向引物扩增启动子posdro5,按常规pcr体系,采用如下扩增程序:
95℃预变性5min;95℃变性30s,58℃退火30s,72℃延伸2min30s,35个从95℃预变性到72℃延伸的循环;最后72℃延伸10min。回收pcr扩增的目的片段,目的片段长度2054bp,将其连接到pgem-t-easy载体(购自promega公司,按载体说明书中的比例混合)上,按照热激法转化大肠杆菌。感受态细胞激活后,进而将目的片段转入到激活的感受态细胞中,然后,经菌落pcr筛选获得阳性克隆,挑取单克隆摇菌液提质粒,质粒提取方法如下:
用axygen质粒dna小量试剂盒提取相应的质粒,具体操作方法如下:第一次使用时,将试剂盒携带的rnasea全部加入到buffers1中,混匀,4℃贮存。
(1)取约4ml过夜培养的菌液(菌液过浓时体积应减半或更少),12,000×g离心30s,弃尽上清。
(2)加250μlbuffers1悬浮细菌沉淀,悬浮需均匀,不应留有小菌块。
(3)加250μlbuffers2,缓慢地上下翻转4-6次,混合均匀使菌体充分裂解,直至形成透亮的溶液。此步骤不宜超过5min。
(4)加350μlbuffers3,温和并充分地上下翻转混合6-8次,12,000×g离心10min。
(5)吸取步骤4中的上清并转移到吸附柱(置于2ml离心管中),室温静止2min,12,000×g离心1min,弃滤液。
(6)将吸附柱放回离心管,加500μlbufferw1,12,000×g离心30s,弃滤液。
(7)将吸附柱放回离心管,加700μlbufferw2,12,000×g离心30s,弃滤液;以同样的方法再用500μlbufferw2洗涤一次。弃滤液。
(8)将吸附柱置回2ml离心管中,12,000×g离心2min。
(9)将吸附柱移入新的1.5ml离心管(试剂盒内提供)中,在吸附柱膜中央加60μl去离子水(65℃预热),室温静置2min。12,000×g离心1min。将洗脱下来的溶液重新加到吸附膜的中央,复洗一次。
提取质粒后再用psti和bamhi进行双酶切验证。将经过鉴定的阳性克隆送交invitrogen公司测序。验证正确的克隆即为所要获得的启动子posdro5,其核酸序列如seqidno:1所示。
具体实施例2:植物表达载体的构建
从上面“启动子posdro5的获得”过程中获得的阳性克隆中提取质粒,用psti和bamhi双酶切,回收启动子posdro5片段。同时利用psti和bamhi对pcambia1381进行线性化处理、回收pcambia1381,将上述的posdro5片段和pcambia1381片段用t4连接酶(购于takara公司)进行连接,得到启动子posdro5与gus基因融合的植物表达载体pcambia1381-posdro5(图1b),提取质粒后再用psti和bamhi进行双酶切验证,结果如图2所示。利用冻融法将植物表达载体转入根癌农杆菌(agrobacteriumtumefaciens)eha105,挑选出阳性克隆,并用甘油保存在-80℃冰箱中。
具体实施例3:农杆菌介导的水稻遗传转化
(1)愈伤组织诱导消毒后的水稻种子用无菌水在30℃黑暗条件下浸泡过夜,用解剖刀将胚剥下置于诱导培养基上。每皿(规格为100×25mm的一次性塑料培养皿,内含50ml诱导培养基)均匀放置12个胚,在30℃黑暗条件下放置2~3周诱导愈伤组织,至长出淡黄色颗粒状愈伤。
(2)预培养从诱导培养基上挑选颗粒状、不带病斑的愈伤组织置于新的诱导培养基上,于30℃黑暗条件下培养3~5d。
(3)侵染及共培养将预培养的愈伤组织转移至50ml无菌管中,加入“具体实施例2”中获得的包含表达载体的农杆菌菌液浸泡20min,倒出菌液,并用无菌滤纸将残余菌液吸干。后将愈伤均匀撒在共培养培养基上,于23℃黑暗条件下培养2~3d。
(4)恢复将共培养的愈伤转移至恢复培养基上(愈伤之间尽量避免重叠)。23℃黑暗培养3~5d。
(5)筛选从筛选培养基上挑选不带菌斑颜色鲜亮呈淡黄色颗粒状的抗性胚性愈伤组织,每皿30粒接种于筛选培养基,30℃黑暗培养2~3周,至长出新的抗性颗粒状愈伤。
(6)分化每一转化事件(筛选时由一粒愈伤组织繁殖产生的所有愈伤组织)挑选三个独立的胚性愈伤到分化培养基某一区域,30℃光照培养室(16h光照/8h黑暗)条件下培养3~4周,待幼苗长出。
(7)生根每一区域挑选两棵健壮的幼苗移栽至生根培养基,30℃组织培养室光周期(16h光照/8h黑暗)培养三周左右,进行鉴定并移栽至田间。
具体实施例4:gus染色结果鉴定
gus能与显色底物x-gluc反应,显现蓝色,因而可以通过组织化学染色定性的研究gus的表达水平和表达模式。
gus染色所用试剂及流程参照jefferson(jeffersonra等人.gusfusion:β-glucuronidaseasasensitiveandversatilegenefusionmarkerinhigherplant[j].emboj.,1987,6:3901-3907)等提出的方法,具体如下:
①染色:将待测样品浸到gus染液中,37℃保温箱中放置24h-36h。
②脱色:加入100%乙醇浸泡直至完全脱色。可用含有30%甘油和70%乙醇的溶液保存。
③在显微镜下拍照记录。
按上述方法进行gus染色,结果如图3所示,其中图3a、b、c和d表示的是干旱诱导前各组织染色结果。可以看出,在转基因植株中,在根、茎、叶组织中均没有蓝色,而在种子中有明显的蓝色,说明该启动子是一个种子特异性启动子,并且在根、茎、叶组织中的本底活性很低(标尺=0.5cm)。
同时,利用生长10天的幼苗和种子进行干旱诱导后的gus染色。结果如图3e、f、g和h所示,在干旱处理12小时后根、茎、叶和种子中都有明显的着色,说明该启动子是一个干旱诱导启动子(标尺=0.5cm)。
具体实施例5:gus基因表达量鉴定
选取不带病斑、胚发育良好的posdro5::gus转基因水稻种子去颖壳,70%乙醇浸泡并剧烈摇晃1min后,倒掉乙醇,加入50%的次氯酸钠(有效氯4%)和少许几滴tween20浸泡20min(150r/min,30℃)进行表面消毒。种子接种于含有25mg/l潮霉素的1/2ms培养基,于30℃、16h光照/8h黑暗条件下培养7-10天。在胁迫处理时,先清洗根部培养基并用吸水纸吸干水分,将幼苗分别浸泡在含300mm甘露糖的1/2ms溶液中进行模拟干旱处理,于12h取样。未处理的幼苗作为对照。幼苗经液氮速冻后存于-80℃超低温冰箱用于提取rna。
rt-pcr采用天根公司(北京)的superreal荧光定量预混液试剂盒(tiangen,sybrgreen,fp205)。以水稻actin基因作为内参基因对所用rna模板量进行定量。采用2–δδct(δct=ct目标基因-ct内参基因;δδct=δct处理后-δct对照)对获得的信号和数据进行处理。每个基因做3次重复。本实验中用到的基因的定量引物为:
actin-fp5’-cctgacggagcgtggttac-3’;
actin-rp,5’-ccagggcgatgtaggaaagc-3’
用于内参基因actin的扩增;
gus-fp,5’-tacggcaaagtgtgggtcaataatca-3’
gus-rp,5’-caggtgttcggcgtggtgtagag-3’
用于gus基因的扩增。
定量rt-pcr结果如图4所示,以干旱处理前的10天大小的posdro5启动子转基因植株整株中的gus基因表达量为1,当干旱处理12小时后,由posdro5启动子驱动的gus基因表达量是处理前的12倍,这进一步说明,该启动子是一个干旱诱导启动子,它能够在干旱条件下,驱动gus基因的表达。
以上对本发明具体实施方式的描述并不限制本发明,本领域技术人员可以根据本发明作出各种改变或变形,只要不脱离本发明的精神,均应属于本发明所附权利要求的范围。
序列表
<110>安徽省农业科学院水稻研究所
<120>植物双重特性表达启动子及其应用
<130>hci20170108
<160>7
<170>patentinversion3.3
<210>1
<211>2054
<212>dna
<213>双重特性表达启动子
<400>1:
accgcaaacatggacggaatagttcatttggatttgtccattcgtggaaactgatttttt60
tttaaaaaaaattaaagctttcagtctttgcaataactaataaaacatgagaaattttat120
aatatttgagatgtaccaaaatctttaatctaaatttttatttatcggaggtaccaaaat180
ttacagtatattttttgtaccgccttaaaaattataaaatcattcgtaatacatactatt240
atgtaaccataattatttttgtcactaagattcaaaccctgacgaatgaagctgtacgtg300
cccgattccacgccgcatgaatggtgcttcacataaactgataaattcaagttgcgtttt360
gtttgtttccagagaaaagaaataatcaaatgccactgtcagccacgtattgttttgttc420
ttaattagcaaagcgtgtaaaacacatcccccgctaactaaatgccatcgaaatttctgt480
tcatgtgtttgactgccgtatagtccatgagctttaatctagttattcgatttatcagat540
aggcaagtggtttaaaagacatagttattcaatggtgagtcgaccgaaactaaactcgat600
ttatcatgacataatagacacggttgccacttgccacagaaagaataagagcgctgctac660
acgtacttaaaagtgaaatacttgcaaaatccttacaaacaataatctgaactgtttgat720
ttaactagacgagagttacagaaaatctatatatactcacagtttgataagagtttagta780
gaaagaatttcatatttatagcctttttccagaagaaatgatcaaatcaagaagtgaaac840
cggccggagaaagtctacaccggcaggcccggctcatgcagcccacgttaggaagcctgg900
ctgcactgggtggcccaacggtggggtgggccacctcgggccagccgcagcagaatgcat960
gggccggcccataaatgggccactccaaagcagaccggcgctcagaggtccatcctgatg1020
aatgaacattcatgcaggtgaccggcccaaaataattacagaaacccaaaaattacagaa1080
aaactacgggttgttcatgttataccatttcagaacataccatttttttaaagttgataa1140
atatacgtatccattaagttttttactaataaatacgtaagaaatcctgtcaaaacttgg1200
caatattgctaaattgttgccaaaactttataaggtttattttagctacaatctaaacag1260
accttatgtatttgctaaaaacttaaaaaaaagtgcagaaaattaggaatttgctcaaaa1320
atatggtaacagtttggaccattagataagcttaatgatttattctagcgagagattctt1380
gctggatgtatgcatgtaaatatattgtaattacaccgtaattatgctatagttatattt1440
gaaatatttttatcttaaagaactgatatgttatatagctacttccgaaaactagcacgg1500
aaatgcttttttgaaaaaagaaacatatgttctcctttctgtgtgaataaagcacgagca1560
gttccagttgtatatatatgcgtccaaatatactgtcccgtggtttattcatccaaacga1620
caaatccttttttctaaaaaaaaattccaacgcattactttcttcccttttctctagcga1680
aaaaaagaaagcaccgaccaaagtggctcaaaaatggacgcgtccaaagatcgcgctgcc1740
acatgacaacggacttcgatgaaattatcgtcaatttttatcaaattccgatcaaatcat1800
tcctcgtcggcgtccatcccggatactataggtggacaccttcgagtcgcttctctcttc1860
tccggcgacactgccactgccacgcgtccctcccttcctccccgcccaacccccacgtgt1920
gcgtccacgtggcacccgcccatctcacctcctcctcctatatcctcctctcctccgcca1980
ttgccgcacctcatcacctcctcgtcttcttcttccacctcgcaaatccgatcaacacat2040
cagcttgagaaaca2054
<210>2
<211>28
<212>dna
<213>正向引物
<400>2:
ctgcagaccgcaaacatggacggaatag28
<210>3
<211>28
<212>dna
<213>反向引物
<400>3:
ggatcctgtttctcaagctgatgtgttg28
<210>4
<211>19
<212>dna
<213>引物
<400>4:
cctgacggagcgtggttac19
<210>5
<211>20
<212>dna
<213>引物
<400>5:
ccagggcgatgtaggaaagc20
<210>6
<211>26
<212>dna
<213>引物
<400>6:
tacggcaaagtgtgggtcaataatca26
<210>7
<211>23
<212>dna
<213>引物
<400>7:
caggtgttcggcgtggtgtagag23
- 还没有人留言评论。精彩留言会获得点赞!