新生儿软骨发育不全与软骨发育低下检测试剂盒的制作方法
本发明属于生物
技术领域:
,涉及一种用于检测新生儿软骨发育不全(achondroplasia,ach)与软骨发育低下(hypochondroplasia,hch)相关基因突变的检测方法和产品。具体而言是利用整合的多重pcr技术、单碱基延伸技术和质谱技术,来检测孕妇外周血浆游离dna中胎儿fgfr3基因的第1108位碱基g>t、第1138位碱基g>a和g>c以及第1620位碱基c>a,共计4种突变类型的方法及相应的试剂盒。
背景技术:
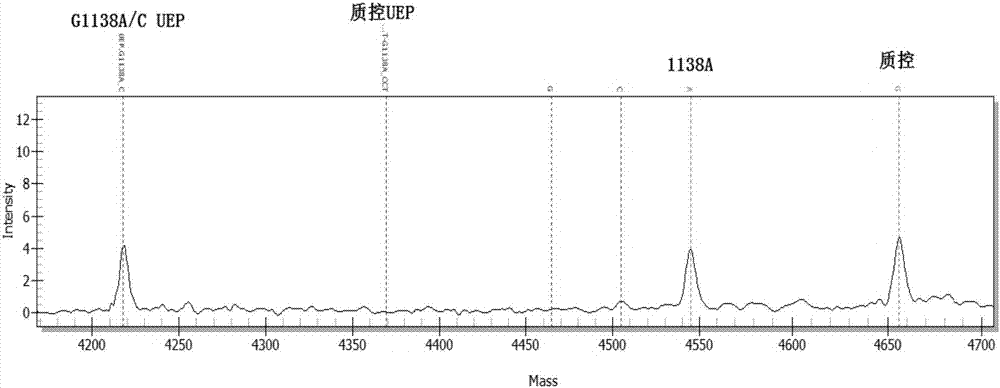
:我国是出生缺陷高发国家,估计目前我国出生缺陷发生率在5.6%左右,每年新增出生缺陷数约90万例,其中单基因遗传病是出生缺陷中最主要的一个类型,根据who统计显示,全球出生人口单基因病累计发病率高达10‰。其中先天性软骨发育不全(achondroplasia,ach)为典型的常染色体显性遗传的单基因遗传病,出生发病率为1/30000,没有种族倾向,其中80%~90%的患者为散发型。它是短肢侏儒中最常见的一种疾病,临床表现为身材矮小,头大,前额圆凸,鼻梁下陷,手指呈现三叉状分离等。早期发现并及时终止妊娠是现在减少该病发生的主要手段。在不断的研究过程中,人们对软骨发育不全(ach)有了逐步深刻的认识。shiang(mutationsinthetransmem‐branedomainoffgfr3causethemostcommongeneticformofdwarfism,achondroplasia.cell,1994,78(2):335‐342)将ach的致病基因定位于4号染色体短臂t末端,不久rousseau等(mutationsinthegeneencodingfibroblastgrowthfactorreceptor‐3inachondro‐plasia.nature,1994,371(6494):252‐254)几乎同时发现成纤维细胞生长因子受体3(fgfr3)跨膜区基因第1138位核苷酸的突变是ach发病的原因。fgfr3有19个外显子和18个内含子,其中第10外显子编码fgfr3跨膜区以dna测序发现,绝大多数的突变是第1138位核苷酸g>a碱基转换,少数为g>c转换,这两种突变都导致了fgfr3跨膜区第380位密码子的错义突变(甘氨酸gly替换为精氨酸arg)(cell,1994,78(2):335‐342;nature,1994,371(6494):252‐254),是骨关节先天畸形中发生基因突变率最高的。1996年dau‐mingniu等研究发现fgfr31138g>a在中国人群中同样也是高频突变,张晔等研究22例ach患者,其中21例存在1138位g>a,fgfr3基因第1138位碱基突变的患者中,95%以上为g>a转换,尚有少数发生g>c的颠换,因此检测该点突变可从分子水平上鉴别ach。尚有学者发现ach患者fgfr3基因第10外显子1180a‐t(p.thr394ser)新的错义突变,也位于fgfr3基因跨膜区(zhub,dongqm,huangxh,etal.mutationanalysisoffibroblastgrowthfactorreceptor3geneinanachondroplasiafamily[j].chinesejournalofmedicalgenetics,2003,20(5):373‐375)。此外,近年另有学者分别在欧洲和日本ach患者中发现了fgfr3基因1123位g‐t颠换,导致375位密码子的突变,即由半胱氨酸代替了甘氨酸,表明ach与其他遗传性疾病一样存在着等位基因的异质性(朱泓,“软骨发育不全的产前诊断研究”,《海南医学》,2010年第21卷第9期)。一种核苷酸的点突变和一种疾病存在如此高的对应率是及其罕见的,这也保证了软骨发育不全基因诊断的准确性。由于在中国人中,fgfr3基因突变的患者中,95%以上为g1138a转换,尚有少数发生g1138c的颠换,基本上包括了中国人的常见fgfr3基因突变频率(超过99%),因此以上3种突变类型成为了诊断软骨发育不全基因的主要方向(朱泓,《海南医学》,2010年第21卷第9期;themolecularandgeneticbasisoffibroblastgrowthfactorreceptor3disorders.endocrrev,2000,21(1)∶23‐39)。目前临床主要的检测方法为超声检查(b超下可见胎儿头大e股骨e胫骨和腓骨均短,三叉形态和“古钟”样胸腔,胎儿腹部膨隆,腹围增大,胎儿四肢短小,长骨短粗且伴有弯曲,骨端膨大,羊水量增多),但是由于发现时间晚(孕晚期,28周后),并不能实现早期发现,从而有效地减少该病的发生。相对于常规的血清学筛查方法而言,往往采取绒毛活检或者羊水穿刺取样,进行胎儿染色体核型分析或基因检测获得确切的结果明确诊断。但侵入性诊断始终存在约0.5%‐1.0%的胎儿丢失率,并且对于产妇和胎儿均造成一定伤害。目前,基因诊断成为检测软骨发育不全基因的主要手段。pcr‐单链构象多态性分析(singlestrandconformationpolymorphism,sscp)ach最常见的1138位g>a突变可被限制性内切酶sfei检测出,抽提软骨发育不全患者的dna,pcr扩增含有fgfr3基因高发突变位点gly380arg区域,将pcr产物直接用限制性内切酶sfei消化,15%page凝胶电泳。电泳检测结果是软骨发育不全患者将出现正常pcr产物条带及其被内切酶消化后的两条带(109bp和55bp两条dna片段),而患者父母及正常人仅出现pcr产物相同大小单条带(l64bp的dna片段)。pcr‐限制性酶切法已成为检测这一已知最常见点突变的有效方法。但是,sscp的检测条件可因dna片段长度及核苷酸组成有较大差别,电泳条件可因突变类型不同而各异,故较难掌握;另外,可因加量不适当导致多态性条带,与正常条带重叠不易判断;另外还可由于变性不彻底而出现双链,特别是异源双链的干扰而影响实验结果的准确性(方福德.现代医学实验技巧全书[m]中国协和医科大学联合出版社,1995)。fgfr3是ach的致病基因,鉴于该疾病的发生99%以上均是由g1138a、g1138c、g1123t所引起的,对于有条件的实验室,可以直接通过对pcr产物的基因测序来检测上述突变,将测序结果和正常基因序列对照,若能发现第1138位核苷酸发生g>a或g>c的碱基转换以及g1123t则可确诊为软骨发育不全,若与正常序列相同则可完全排除。由于基因测序尚不能保证100%的准确性,故应取不同pcr产物从两端分别进行测序才能确诊。基因芯片(genechip,dnachip,dnamicroarray,wuj,smithl,plasstc.chip‐chipcomesofageforgenome‐widefunctionalanalysis.cancerres,2006,66(14):6899.)将大量的核酸分子同时固定在载体上,一次可检测分析大量的dna和rna,解决了传统核酸印迹杂交技术复杂、自动化程度低、检测目标分子数量少、成本高、效率低等的缺点。pinar等(detectionofachondroplasiag380rmutationfrompcrampliconsbyusinginosinemodifiedcarbonelectrodesbasedonelectrochemicaldnachiptechnology.clinicachimicaacta,2003,336(1):57‐64)研制出诊断软骨发育不全的电化学芯片,并成功地用于软骨发育不全的基因诊断。基因芯片诊断不但可以明确有无突变,而且能明确突变类型,高密度芯片诊断能达到与基因测序一样的准确性,并且能够明确患者是杂合子还是纯合子,产业化的芯片相对基因测序也更易于普及。目前,该技术在软骨发育不全的基因诊断领域已显示出重要的理论和应用价值。胚胎植入前诊断植入前遗传学诊断(preimplantationgeneticdiagnosis,pgd)在胚胎植入子宫前进行诊断,经检测胚胎无待测的遗传缺陷时才被植入子宫。rechitsky等(rechitskys,verlinsky,amett,etal.reliabilityofpreimplantationdiagnosisforsinglegenedisorders.molecularandcellularendocrinology,202,183(9):65‐68.)已经成功地开展了软骨发育不全的pgd。但是,因为软骨发育不全80%以上无家族史,仅对患者进行pgd是不安全的,确保无任何遗传病变婴儿的出生,是产前诊断的最终目标。对每例移植胚胎均在植入前进行软骨发育不全的突变筛选才是最安全的。基质辅助激光解析电离飞行时间质谱(maldi‐tof‐ms)是近年来发展起来的一种新型的软电离生物质谱,其原理是用激光照射样品与基质形成的共结晶薄膜,基质从激光中吸收能量传递给生物分子,而电离过程中将质子转移到生物分子或从生物分子得到质子,而使生物分子电离的过程。tof的原理是离子在电场作用下加速飞过飞行管道,根据到达检测器的飞行时间不同而被检测即测定离子的质荷比(m/z)与离子的飞行时间成正比,检测离子。尽管maldi‐tof的准确度高达0.1%~0.01%,远远高于目前常规应用的sds电泳与高效凝胶色谱技术,但该质谱技术主要以针对蛋白或多肽类疾病,目前还没有任何利用该质谱技术用于诊断fgfr3突变位点的报道。因此,目前需要一种更为准确、有效且不伤及母体和胎儿的快速检测方法。技术实现要素:本发明原理之一在于,针对现有已知的检测fgfr3基因的常见突变位点,在保留常见的g1138a、g1138c的待测突变的情况下,放弃g1123t的待测snp,同时补充了与软骨发育不全(achondroplasia,ach)相关小的g1108t和c1620a的待测位点,通过优化筛选之后,首次摸索提供了利用联合多重pcr技术、单碱基延伸技术和质谱检测技术,采用飞行时间质谱法对fgfr3基因上述突变位点进行检测。其中,c1620a位点是软骨发育低下(hypochondroplasia,hch)的突变位点,约有60%的hch患者存在fgfr3基因第13外显子第1620位核苷酸的突变(包括c‐a和c‐g转换),其遗传形式和临床表现与ach类似,仅症状轻微,故临床上常难以分辨。但患者发病年龄较晚,多在学龄期发病,可通过后天锻炼和激素治疗得以缓解。本发明原理之二在于,为了避免对母体和胎儿的检测伤害,本发明仅仅针对孕妇外周血浆游离dna作为检测样本,即可完成对胎儿的fgfr3基因的突变位点的检测,从而为产前基因检测提供准确的诊断结果。此外,发明人设计了通过检测y染色体的性别决定基因(sry,sex‐determiningregionontheychromosome)(theroleofsryinmammaliansexdetermination.lovell‐badger.cibafoundsymp.1992;165:162‐79;discussion179‐82)和常染色体的25个a/g变异的snp(单核苷酸多态性)位点,来证实孕妇外周血浆游离dna中确含有胎儿游离dna。其中sry基因仅存在于男胎的y染色体上,在孕妇外周血浆游离dna中检测到sry基因的片段,即可判定该孕妇血浆中存在男胎儿的游离dna。另外对于25个常染色体上的a/g变异的snp位点,先检测孕妇基因组dna中这25个位点的基因型,确定哪些位点在孕妇基因组中为纯合基因型,再在孕妇外周血浆游离dna中,对这些在孕妇基因组中为纯合基因型的位点进行检测,只要检测到其中含有杂合基因型的位点,即可判定该孕妇血浆中存在胎儿的游离dna。本发明原理之三在于,在检测过程中引入了g1108t‐g1138a_c质控和c1620a质控进行检测。由于本发明所检测的目标突变,位于占孕妇血浆总游离dna约5%‐15%的胎儿游离dna序列中,比例占少数的胎儿游离dna的目标突变质谱峰,相对比例占多数的母体游离dna的野生质谱峰低得多,所以需通过实验方法不显示出fgfr3基因的第1108位、第1138位和第1620位碱基的野生基因型质谱峰;但又需要引入质控把这种人为设计的野生基因型质谱峰不出现和实验失败进行区分。g1108t‐g1138a_c质控和fgfr3基因的第1108位、第1138位碱基所在的目标位点处于同一pcr扩增片段,c1620a质控和fgfr3基因的第1620位碱基所在的目标位点处于同一pcr扩增片段。当fgfr3基因的第1108位、第1138位和第1620位碱基所在的目标位点的pcr反应成功时,g1108t‐g1138a_c质控和c1620a质控也会被成功进行pcr扩增,从而被质谱仪检测。表1:fgfr3基因型检测位点信息突变类型密码子碱基变化氨基酸变化导致疾病种类g1108t370g→tgly→cysachg1138a380g→agly→argachg1138c380g→cgly→argachc1620a540c→aasn→lyshch因此,基于以上发明原理,本发明第一个目的是提供一种用于检测胎儿fgfr3基因的第1108位碱基g>t、第1138位碱基g>a和g>c以及第1620位碱基c>a,共计4种突变类型的引物组合物,其序列如表2所示。其中,所述4种突变类型分别是:fgfr3基因的第1108位碱基g>t、第1138位碱基g>a和g>c以及第1620位碱基c>a,共计4种突变类型。其中,各待检测位点对应的延伸引物及延伸产物分子量如表3所示。表3在一个实施方案中,上述pcr引物序列为核心序列,其在5'端可包括保护碱基序列,优选5‐15个碱基。在一个具体实施方案中,保护碱基序列选自在5'端加入10bp的tag(acgttggatg),保护碱基的序列使得pcr引物(即核心引物)的分子量增大,可以避免反应剩余的pcr引物一并进入质谱检测过程中,以避免干扰检测效果。另外,在一个具体实施方案中,延伸引物的5'端也可以适量增加碱基序列(如上述保护碱基序列)。增加碱基序列的目的是当两个目标检测位点对应的延伸引物及产物的分子量接近时,通过给其中一个延伸引物或两个延伸引物都增加碱基,改变引物及其产物的分子量,与其他延伸引物及产物的分子量之间拉大差距,提高检测效果。而且,增加后的引物及产物分子量,一定不超出检测窗口。例如,pcr引物seqidno:1为5'‐acgttggatgccgccaccaccaggatgaa‐3’。在另一个具体实施方案中,延伸引物的5'端也可以增加作为接头的碱基序列。本发明第二个目的是提供了由上述引物组合物所制备的检测产品。其中,该产品选自检测试剂盒、检测试剂、检测芯片等。在一个实施方案中,该产品为检测试剂盒,包括:(1)用于pcr的反应试剂,包括:特异性pcr引物,耐高温的dna聚合酶,dntps,pcr反应缓冲液;(2)用于pcr产物纯化的试剂;(3)用于单碱基延伸反应的试剂,包括:延伸引物,耐高温的单碱基延伸酶,ddntps,延伸反应缓冲液。在一个具体实施方案中,该试剂盒还可包括:阴性质控品,阳性质控品,纯化用树脂,点样及质谱检测用靶片,外切酶,人基因组dna提取试剂等试剂。在另一个具体实施方案中,用于pcr产物纯化的试剂:碱性磷酸酶,或碱性磷酸酶和外切酶exoi,或电泳凝胶回收试剂,或pcr产物纯化柱。其中当包括碱性磷酸酶和外切酶exoi的纯化试剂时,所使用的pcr引物无需包括保护碱基。本发明第三个目的是使用上述引物组合物、产品或试剂盒来检测新生儿软骨发育不全与软骨发育低下的相关突变位点的方法,包括如下步骤:(1)多重pcr:使用特异性的pcr引物,在一个反应体系中,对fgfr3基因等目标检测dna区域同时进行扩增,得到目标检测dna区域的pcr产物;(2)pcr产物纯化:对步骤(1)得到的pcr产物进行纯化,以减少对后续反应的干扰;(3)单碱基延伸:使用3条特异性的延伸引物,在一个反应体系中,对步骤(2)得到的纯化后pcr产物进行多重单碱基延伸,延伸引物在对应的目标位点处延伸一个核苷酸,该核苷酸与目标位点处的基因型互补配对;(4)延伸产物纯化:对步骤(3)得到的延伸产物进行纯化,以获得高纯的延伸产物,避免盐离子等杂质对后续检测的影响;(5)质谱仪检测:将步骤(4)得到的纯化产物点在含有基质的靶片上,放入质谱仪进行进行检测;其中,所述4个与新生儿软骨发育不全与软骨发育低下相关基因的突变分别是:胎儿fgfr3基因的第1108位碱基g>t、第1138位碱基g>a和g>c以及第1620位碱基c>a这4种突变类型。在一个实施方案中,步骤2的纯化过程可以选自碱性磷酸酶消化、碱性磷酸酶和外切酶exoi消化、切胶纯化、pcr纯化柱过柱等。在一个具体实施方案中,当使用碱性磷酸酶消化、或碱性磷酸酶和外切酶exoi消化进行纯化后,进行高温酶失活处理。本发明第四个目的是提供前述试剂盒来检测孕妇外周血浆游离dna中胎儿fgfr3基因的第1108位碱基g>t、第1138位碱基g>a和g>c以及第1620位碱基c>a,共计4种突变类型。技术效果本发明优点和效果如下:1、敏感:本发明综合了多重pcr、单碱基延伸、质谱检测等技术为一体,既可通过pcr技术放大检测模板,又可通过质谱技术检测微量样本,综合了两种技术的优点,远远优于单独使用pcr检测目标dna区域,因此它的检测灵敏度很高。2、特异:单碱基延伸又称为“微测序”,使用特异性探针对dna分子进行识别,具有测序技术的高准确性,特异性好、假阳性低等特点;特别的,不同于测序技术延伸数百个碱基,该技术仅延伸单个碱基,出错概率更低;3、简便安全:操作简单、安全、自动化程度高、防污染;4.快速:速度快、高通量,可在5‐6小时内完成数百个样本的检测。5、本发明可对多个已知患者进行检测,分别得到具有不同突变位点的检测结果,其中患者可以是单个突变位点发生突变,也可以是多个突变位点发生突变。这表示患者可以携带一个或多个突变突变,从而为选择合适剂量提供参考信息。6、本发明克服了以往技术一次检测突变位点过少的缺陷,成本低廉。7、本发明克服了采取绒毛活检或者羊水穿刺取样的缺陷,采用无创的方式对胎儿进行产前检测,避免对产妇和胎儿造成的伤害。8、本发明针对fgfr3基因单一突变的第1138碱基位点的检测效率,联合了多个其他与软骨发育不全相关度低的突变位点检测,检测结果证明相比于单一突变的质谱检测效率95%,本发明的联合质谱检测,效率为100%,具有更为准确的优势。原理和定义本发明提供了一种联合多重pcr、单碱基延伸和质谱检测等技术,检测与软骨发育相关基因突变位点的检测方案。其原理在于:在多重pcr步骤中,通过设计并使用合适的引物从而能同时扩增多达6个单碱基多态/突变(snv)位点所在dna片段。在单碱基延伸步骤中,对上一步多重pcr的产物依次进行纯化和多重单碱基延伸。其中,延伸引物共6条,分别与6个snv位点对应,并在对应的目标位点处延伸一个核苷酸,该核苷酸与snv位点处的基因型互补配对(如某snv位点处是a基因型,将在对应的延伸引物上延伸t核苷酸)。在单碱基延伸步骤中,采用ddntp代替dntp,因此,在延伸一个碱基后,延伸引物将终止延伸。在质谱检测过程中,单碱基延伸产物在脱盐纯化后,点至含基质的靶片,并在真空环境中被激光激发,通过飞行管至检测器。不同物质通过飞行管的时间与它们的分子量呈负相关,即分子量越大,飞行速度越慢,到达检测器的时间越晚。术语“检测产品”,指用于检测目标位点基因型的任何常规产品,包括:检测试剂、检测芯片、检测载体,以及检测试剂盒等。术语“保护碱基”,指在pcr引物的5'端额外增加的碱基。由于保护碱基的序列使得pcr引物(即核心引物)的分子量增大,可以避免反应剩余的pcr引物进入质谱检测窗口,以避免干扰检测效果。此外,延伸引物的5'端也可以适量增加碱基序列,但其作用并非如同pcr引物的保护碱基,使其超出检测窗口,而是适当调整延伸引物的分子量,使延伸引物及其产物在检测窗口内处于一个合理的位置。例如,当两个基因多态位点对应的延伸引物及产物的分子量接近时,通过给其中一个延伸引物增加碱基,改变引物及其产物的分子量,与其他延伸引物及产物的分子量之间拉大差距,以避免局部区域质谱峰过于集中而产生干扰和分辨不清,从而提高检测效果。因此,增加碱基后的延伸引物及产物的分子量,一定不会超出检测窗口。上述延伸引物的额外碱基可称为引物接头。术语“碱性磷酸酶消化”,其作用是降解pcr反应后体系中残余dntp,其原理是使dntp的5'‐p末端转换成5'‐oh末端,从而失去与引物结合使引物延伸的能力,避免了对下一步单碱基延伸的影响。术语“外切酶exoi消化”,其作用是从单链dna的一端开始按序催化水解组成dna的dntp之间3,5‐磷酸二酯键,使单链dna最终水解为dntp。在本技术方案中用于降解pcr反应后残余的pcr引物。由于外切酶可以将单链的pcr引物切除,并不会在检测窗口中出现,因此使用该外切酶时,所使用的pcr引物无需包括保护碱基。术语“单碱基延伸”,又被称之为微测序(minisequence),指在体系中加入延伸引物和ddntp,ddntp与延伸引物的3'端连接形成延伸产物(即引物延伸了一个碱基),根据碱基互补配对原则,由snv位点处基因型决定具体连接何种ddntp,这个过程类似于pcr过程中dntp根据互补链的碱基组成,逐个添加到pcr引物上。由于“ddntp”与普通dntp不同的是,在脱氧核糖的3'位置缺少一个羟基,不能同后续的ddntp形成磷酸二酯键,因而,延伸引物仅在目标位点处连接一个ddntp,而不能像pcr那样,不断的往下延伸,因此称之为单碱基延伸。单碱基延伸与测序过程非常相似,测序体系中加入的是dntp和ddntp的混合物,测序引物连接dntp后将继续延伸,只有连接ddntp后,方终止延伸,因此测序产生的是长短不一的核苷酸片段的混合物;单碱基延伸体系中加入只有ddntp,延伸引物只能连接一个ddntp,并终止延伸,因此单碱基延伸产生的是延伸引物仅延伸一个碱基的核苷酸片段。术语“ddntp”是一种特殊的核苷酸,本技术方案共采用四种,它们之间存在分子量差异,如ddatp、ddctp、ddgtp、ddttp的分子量分别是271.2da、247.2da、287.2da、327.1da(其中ddttp是修饰后的分子量)。当延伸引物根据目标单碱基突变/多态位点的基因型而延伸不同的核苷酸,将形成分子量差异。通过质谱检测,可分辨出这种差异。例如,某snp位点若是c/t多态,对应的延伸引物长度为17个碱基(分子量5019.3da),当该snp位点处是c基因型,延伸引物将延伸一个g核苷酸并终止延伸,形成18个碱基长、分子量5306.5da的延伸产物,当该目标单碱基突变/多态位点处是t基因型,延伸引物将延伸一个a核苷酸并终止延伸,形成18个碱基长、分子量5290.5da的延伸产物,两种产物之间存在16da的分子量差异。即对该突变/多态位点的该实验方案,c基因型对应5306.5da的质谱峰,t基因型对应5290.5da的质谱峰。在实际检测过程中,使用者可通过软件对5019.3da、5306.5da、5290.5da三处进行观察:若5019.3da处出现质谱峰,则是有部分或全部延伸引物没有与ddntp结合;不论5019.3da处是否出现质谱峰,若5306.5da与5290.5da处出现一处质谱峰,则该突变/多态位点的基因型为纯合型,并与质谱峰的位置对应,如前所述,5306.5da的质谱峰对应c基因型,5290.5da的质谱峰对应t基因型;若5306.5da与5290.5da两处质谱峰均出现,则该突变/多态位点的基因型为杂合型;若5306.5da与5290.5da两处质谱峰均未出现,则实验失败。术语“纯化”,指用于减少待检体系内其他物质对后续反应的影响的处理步骤。本发明的pcr产物纯化有两种方式:一是分离杂质并丢弃,二是使杂质失去活性。其中,切胶纯化、过纯化柱等都是通过电泳、纯化柱等分离杂质,并回收相对较纯的pcr产物,可以认为是第一种纯化方式,该方式一般耗时,操作复杂,特别是样本量大时;碱性磷酸酶的作用是降解(亦称“消化”)dntp,使之不能继续作为dna聚合酶或单碱基延伸酶的底物参与pcr或单碱基延伸反应,从而不干扰后续反应,可以认为是第二种纯化方式。应当指出的是,单独的外切酶exoi不起纯化作用,当它与碱性磷酸酶混合使用时,其作用是预先将单链dna(在反应完成后的pcr产物体系中,主要是剩余的pcr引物)降解成dntp,再由碱性磷酸酶使dntp继续降解。由于pcr引物被降解,不会进入最后的质谱检测步骤,因此,如果计划纯化步骤中增加exoi外切酶处理,那么无需使用具有保护碱基的pcr引物。此外,在单碱基延伸步骤之前,由于外切酶和碱性磷酸酶都通过高温失活,其不会降解在单碱基延伸步骤中加入的单链的延伸引物、ddntp等,因此避免对后续实验产生影响。术语“检测窗口”,指可用于质谱检测核苷酸分子量的范围,通常涉及引物的设计参考范围。其中,在设计延伸引物时,对于不同的snv位点,根据这些位点所在dna区域的序列特点,以及突变/多态位点的基因型,可以设计出分子量不同的延伸引物和延伸产物,避免不同延伸引物及产物之间由于分子量接近而存在干扰,从而可在一个相对宽阔的检测窗口,如4000‐9000da,实现对多个突变/多态位点的检测。术语“snp”基因型,指表示人基因组中单核苷酸多态性的类型。其中,在实际检查中,作为对照的用于检测的基因型既可来自于对照人基因组中,也可来自已克隆入质粒的载体工具,而后者具有可复制和保存便捷、来源稳定而受到实际使用者的欢迎。术语“snv”,指基因人基因组中单核苷酸变异的类型,包括单核苷酸多态性和单核苷酸突变两种。术语“胎儿游离dna”主要指为胎儿提高造血细胞的胎盘滋养层,将部分胎儿dna通过胎盘进入母体,少部分是胎儿造血细胞发生凋亡后进入母体循环,极少部分是胎儿dna穿越胎盘屏障直接计入母体血浆。应当指出的是,鉴于以上核酸质谱的特殊性,例如,其需先通过pcr反应扩增出含snv位点的片段,然后通过延伸引物延伸出突变/多态位点的碱基;各snv的pcr反应、延伸反应间无明显干扰;各snv的延伸引物、产物间分子量要有足够大的差异以便实现区分等,因此,并非所有的已知snv均可以用来进行核酸质谱的检测,也并不是所有针对snv位点设计的引物均可用以进行多重pcr反应和多重单碱基延伸反应。例如,cláudiam.b等人(optimizationofamultiplexminisequencingprotocolforpopulationstudiesandmedicalgenetics,genet.mol.res4(2005)115‐125)指出,在进行多重pcr反应前需首先对单重pcr的反应效果进行验证,如果单重pcr扩增效率低则需要放弃,另外,若pcr产物长度偏长,多重pcr效果会比较差,也需要放弃。nissumm等人(high‐throughputgeneticscreeningusingmatrix‐assistedlaserdesorption/ionizationmassspectrometry,psychiatrgenets12(2002)109‐117)也报道了通过maldi‐tofms高通量检测snp的过程中,发现只能获得90%的准确率,其中在标准实验条件下,竟然有5%的情况不能实施pcr扩增过程,而在单碱基延伸过程中,由于自身引物自身配对、引物二聚体的形成以及扩增产物过低等因素,也导致有5%的情况难以实现单碱基延伸过程,因此必须进一步优化核酸质谱实验条件(如扩增引物、实验参数等),否则将影响maldi‐tofms在核酸质谱检测snv的应用。此外,在核酸质谱检测过程中,多重扩增过程的干扰作用,对于最终获得的延伸产物也存在影响。saschasauer等人(typingofsinglenucleotidepolymorphismsbymaldimassspectrometry:principlesanddiagnosticapplications,clinicachimicaacta363(2006)95–105)和heyiyang等人(multiplexsingle‐nucleotidepolymorphismgenotypingbymatrix‐assistedlaserdesorption/ionizationtime‐of‐flightmassspectrometry,analyticalbiochemistry314(2003)54–62)在利用maldi质谱技术研究核酸质谱检测过程中提出,所设计的多重引物应具有相近的熔解温度(tm值)并彼此间的相互作用力较弱。如果引物之间的相互作用力过于强烈(δg的最小值为‐10kcal/mol),那么必须放弃该理论设计的引物而重新进行设计;当同一反应体系中存在多重反应引物,那么多重扩增的规模主要受限于引物之间的相互作用程度,从而影响核酸质谱检测过程;此外,为了准确区分不同碱基之间的差异,特别是腺嘌呤(a)和胸腺嘧啶(t)(4种碱基中这二者分子量之间差值最小,为9da),要求的寡核苷酸长度一般不超过40个碱基,实际应用中,质谱检测窗口的分子量范围一般为4000~9000da,即要求所涉及的延伸引物和产物的分子量尽量分布在4000~9000范围之内。同时,要避免各延伸引物及其延伸产物之间的叠合。由此可见,并非所有已知的snv均可应用于核酸质谱尤其是多重核酸质谱的检测,其实际效果会受到多种实验因素的影响,因此需要通过实验来验证snv的可行性以及筛选不同引物的组合。附图说明图1为实施例四中,对c1样本fgfr3基因的1108位点的检测结果;图2为实施例四中,对c1样本fgfr3基因的1138位点的检测结果;图3为实施例四中,对c1样本fgfr3基因的1138位点的检测结果;图4为实施例四中,对c1样本fgfr3基因的1620位点的检测结果;图5为实施例四中,对c1样本fgfr3基因的sry的检测结果。图6为实施例四中,对c1样本fgfr3基因的1620位点的测序结果。具体实施方式下面结合具体实施例对本发明作进一步详细说明。实施例一:引物设计及合成。针对fgfr3基因的第1108、1138和1620位碱基上4种突变类型,设计对应特异性pcr引物核心序列(seqidno:1至seqidno:6)和特异性延伸引物核心序列(seqidno:7至seqidno:9)。其中,为了避免pcr引物进入质谱仪检测窗口而干扰检测效果,每条pcr引物的5'端可以在核心序列(seqidno:1至seqidno:6)的基础上增加一定数目的碱基,常见如10bp的tag(acgttggatg),以使pcr引物的分子量增大,从而超出质谱仪检测窗口。相关引物在生工生物工程(上海)有限公司进行合成。以下检测过程参照毅新兴业(北京)科技有限公司的《叶酸遗传代谢基因突变检测试剂盒(飞行时间质谱法)说明书》(以下简称“说明书”)进行操作。实施例二:孕妇外周血浆游离dna提取所用血片是直径2cm的圆形滤纸,取50ul全血,滴在圆形滤纸的正中央,然后晾干备用。血片dna提取具体具体步骤如下:(1)准备剪刀,预先用75%酒精处理。然后将有血斑的圆形纸片剪下,并剪成很小的碎片,放入1.5ml离心管中,加+入20ul蛋白酶k,20uldtt和500ullysisbuffer1,充分混匀(涡旋),于56℃放置2h(期间颠倒混匀3‐4次)。(2)取出离心管,短暂离心,用移液器尽量完全的将上清移到新的1.5ml离心管中,以去除滤纸对下步实验的干扰。(3)于上清中加入850ulbindingbuffer2和150ul磁珠(磁珠使用前要充分悬浮),充分混匀(轻微涡旋),室温放置5min。(4)将离心管置于磁力架上1min,使管内磁珠被吸附,用移液器移走管内液体。(5)在离心管中加入200ulwashbuffer3,颠倒混匀数次(也可轻微涡旋),将磁珠团打散即可,置于磁力架吸附磁珠1min,然后移走管内液体。(6)在离心管中加入200ulwashbuffer4,颠倒混匀数次(也可轻微涡旋),将磁珠团打散即可,置于磁力架吸附磁珠1min,然后移走管内液体。(7)在离心管中加入200ulwashbuffer5,颠倒混匀数次(也可轻微涡旋),将磁珠团打散即可,置于磁力架吸附磁珠1min,然后移走管内液体。(8)在离心管中加入200ulwashbuffer6,颠倒混匀数次(也可轻微涡旋),将磁珠团打散即可,置于磁力架吸附磁珠1min,然后移走管内液体。(9)将留有磁珠的离心管开盖、于56度放置10min,充分干燥。(注:在加入洗脱液之前,磁珠必须充分干燥)(10)加入50ulelutionbuffer7(可根据实验要求决定洗脱体积),使用移液器吹打,使磁珠重新悬浮,室温放置5min。(11)将离心管置于磁力架上1min,使磁珠吸附,将dna转移至新的1.5ml离心管中,‐20℃保存备用。实施例三:生物实验。使用abi9700型pcr仪,按说明书对fgfr3基因的3个目标检测位点进行检验。试剂盒中用于pcr、pcr产物纯化和单碱基延伸的组分如表5:表5按说明书,具体操作方法如下:1.pcr扩增1.1在pcr配液区,按照待检样品数(含阳性质控品、阴性对照、空白对照)准备200ulpcr反应管,并在管上标记样本编号;1.2从试剂盒中取出pcr混合物、pcr酶,使其自然解冻,涡旋振荡使其充分混匀,瞬时离心至管底;1.3根据样本数目,按下表的比例取出pcr引物混合液和pcr反应液,置于一个离心管中混匀,按每pcr反应管加入16ul混合物进行分装。由于分装过程中,移液器吸头残留等因素可能造成不足以分装出所需的份数,建议适当放大混合物的配制体积。例如有10份待测样品时,可按10.5‐11份样品配制混合物。组分名称单反应体积pcr混合物15ulpcr酶1ul合计16ul1.4在pcr扩增区内向每管混合物中加入4ul待测样品,使每份pcr反应体系总体积为20ul。其中,阴性对照为纯化水,空白对照为不加模板。1.5将pcr反应管置于pcr扩增仪中,按下表的程序进行pcr扩增反应。2.sap酶消化pcr后,依次取5ulpcr产物至新管,每管加入sap酶混合物1ul,然后将pcr反应管置于pcr扩增仪中,执行下表程序。温度时间(分)循环数37451851513.延伸3.1在pcr配液区,根据样本数目,按下表的比例取出延伸引物混合液和延伸酶混合物,置于一个离心管中混匀。由于分装过程中,移液器吸头残留等因素可能造成不足以分装出所需的份数,建议适当放大混合物的配制体积。例如有10份酶切产物时,可按10.5‐11份样品配制混合物。组分名称单反应体积延伸引物混合液1ul延伸酶混合物1ul合计2ul3.2在pcr扩增区,按每管酶切产物加入2ul混合物进行分装。3.3将pcr反应管置于pcr扩增仪中,按下表的程序进行延伸反应。4.纯化在pcr扩增区向每管延伸产物中加入16ul纯化水,6mg树脂,颠倒混匀30分钟。5.点样使用微量移液器,吸取1ul纯化产物,点样至靶片。实施例四:上机检测及结果判读。使用北京毅新博创生物科技有限公司生产的clin‐tof型飞行时间质谱仪对点样后的靶片进行检测和结果判断。另外,分别设置以上位点的野生型对照a1‐a4、突变型对照b1‐b4。其中,野生型对照a1‐a4、突变型对照b1‐b4分别来自市售或实验室保藏的人工质粒。本发明中所用的野生型对照质粒a1‐a4和突变型对照质粒b1‐b4,为在商品化质粒pmd18‐tvector(takara公司)的基础上,根据《分子克隆》记载的常规方法,用引物和正常人dna进行pcr后,将pcr产物插入pmd18‐tvector,即构建野生型质粒a1‐a4,再分别定点突变,即构建3个突变型质粒b1‐b4。所述质粒a1‐a4和b1‐b4可长期保存于‐20℃甘油中,用时活化并提取质粒dna。如前述表2所示,6条延伸引物及它们在1个基因上4个突变位点的检测,根据各自基因型产生的延伸产物具有不同的分子量,这些分子量对应各自的质谱峰,若在某分子量处出现质谱峰,则判断为存在与该分子量对应的物质(延伸引物或产物):判断标准:(1)若野生型和突变型对应的质谱峰均未出现,无论延伸引物对应的质谱峰是否存在,均判断为实验失败;(2)若野生型或突变型对应的质谱峰仅出现一个,则判断为所出现质谱峰对应的基因型的纯合型;(3)若野生型或突变型对应的质谱峰均出现,则判断为杂合型。以前述表2所示各位点延伸引物及延伸产物的分子量检查样本c1‐c3的质谱结果(图1‐6),确定各snv位点的基因型,结果如表3所示:c1c2c3g1108tggtgttg1138a/cgggagcc1620acccaaa所有样本的质谱结果如下表4所示:对照实施例一:pcr测序检测一.根据实施例一,另行设计并使用如下引物,对fgfr3基因的1138位点进行扩增和测序:编号引物序列(5’→3’)正向扩增引物caggatgaacaggatgaag反向扩增引物atgtctttgcagccgaggag二.样本来源为使不同实验之间产生的数据具有可比性,测序验证采用与实施例二中用于质谱检测一致的样本,即编号n1至n13的样本。三.测序鉴定1.pcr反应体系为25l,具体配方如下所示:2.反应条件使用abi公司9700pcr热循环仪进行pcr反应。反应程序为:95℃预变性5min,94℃变性30s,60℃退火30s,72℃延伸40s,共35个循环,最后72℃延伸10min,15℃保存。3.pcr产物纯化和测序用试剂盒(omegad2500‐01)回收pcr扩增目的条带,定量后进行测序。测序反应体系为:2μlmix(bigdye3.1、5xsequencingbuffer、h2o),2μl纯化后的pcr产物,1μl引物(5μmol/l);使用abi9700pcr扩增仪进行测序反应。循环条件为:96℃2min→(95℃10s→50℃5s→60℃4min)×30cycles→终止反应。测序反应产物用试剂盒(omega1320‐01)进行纯化,然后上abi3730遗传分析仪进行序列测定。4.结果分析将测序得到的序列,在ncbi上进行blast,确定所扩增序列确实为目的序列后,用teqman进行比对,确定所测样本fgfr3基因的1138位点的基因型,测序峰图见图6(样本n3),结果汇总如表5所示。经过比较,表5与实施例四中的质谱检验结果表4完全一致,说明本发明方法的准确性。对照实施例二:样本盲检根据本发明的方法,依照实施例1‐4中所描述的操作步骤,对7例未知基因型的样本进行盲检。根据实施例四中描述的判定标准对该7例样本进行结果分析,得到表6。由下表6可以看出,本发明所提供的方法可以有效的实现待检样本的软骨发育不全,检出率为100%。样本编号g1138a/c基因型m1(n1)ggm2(n3)gam3(n4)ggm4(n7)ggm5(n9)gam6(n11)ggm7(n13)ggsequencelisting<110>北京毅新博创生物科技有限公司<120>新生儿软骨发育不全与软骨发育低下检测试剂盒<130>2016<160>18<170>patentinversion3.5<210>1<211>29<212>dna<213>人工合成序列<400>1acgttggatgccgccaccaccaggatgaa29<210>2<211>30<212>dna<213>人工合成序列<400>2acgttggatgatgtctttgcagccgaggag30<210>3<211>29<212>dna<213>人工合成序列<400>3acgttggatgccgccaccaccaggatgaa29<210>4<211>30<212>dna<213>人工合成序列<400>4acgttggatgatgtctttgcagccgaggag30<210>5<211>29<212>dna<213>人工合成序列<400>5acgttggatgccgccaccaccaggatgaa29<210>6<211>30<212>dna<213>人工合成序列<400>6acgttggatgatgtctttgcagccgaggag30<210>7<211>30<212>dna<213>人工合成序列<400>7acgttggatgtggtgtctgagatggagatg30<210>8<211>28<212>dna<213>人工合成序列<400>8acgttggatgtaccgcacctaccgccct28<210>9<211>30<212>dna<213>人工合成序列<400>9acgttggatgtggtgtctgagatggagatg30<210>10<211>29<212>dna<213>人工合成序列<400>10acgttggatgtaccgcacctaccgccctg29<210>11<211>30<212>dna<213>人工合成序列<400>11acgttggatggattgtcctaccgctttgtc30<210>12<211>30<212>dna<213>人工合成序列<400>12acgttggatgcacacactcaagaatggagc30<210>13<211>14<212>dna<213>人工合成序列<400>13gatgaagcccaccc14<210>14<211>14<212>dna<213>人工合成序列<400>14tggaggctgacgag14<210>15<211>16<212>dna<213>人工合成序列<400>15cctgcatacacactgc16<210>16<211>18<212>dna<213>人工合成序列<400>16cctgcgtgcaggctccca18<210>17<211>21<212>dna<213>人工合成序列<400>17gaaacacaaaaacatcatcaa21<210>18<211>20<212>dna<213>人工合成序列<400>18agtggctgtagcggtcccg20当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1