染色体G带的制备方法与流程
本发明属于生物技术领域,具体涉及一种染色体g带的制备方法。
背景技术:
采集合适的标本,制备染色体并对染色体染色显带后,进行染色体核型分析,确定染色体数目和结构等有无异常,在医学检验领域是一种血细胞遗传技术;随着分子生物学和细胞遗传学的发展,骨髓染色体核型分析在血液系统疾病的诊断、治疗和预后中发挥着重要的作用。
染色体显带技术可显示染色体细微的结构,有助于识别每一号染色体和诊断异常。主要的显带技术有g带、c带、q带、r带、t带、n带等,g带是目前被广泛应用的一种带型。在制备染色体标本时,针对有核细胞计数少的病人样本,确定接种足够量培养样本,对成功培养有重要的意义。
染色体制片是染色体核型分析的一个重要环节,染色体玻片的质量直接影响后续的分析进程。理想的核型分析中染色体应当分散均匀,无互相交叠,带纹清晰可辨,便于进行核型分析;良好的滴片方法,将能获得良好的制片效果。
但目前的滴片方法、染色体制片技术等难以实现染色体分散均匀,染色体经常会出现互相交叠,并且帯纹不清晰。
因此,建立一种分裂相多,分散较好,带纹清晰等特征的g带制作方法尤为重要。
技术实现要素:
基于此,有必要针对现有技术中染色体分散不均匀、互相交叠、帯纹不清晰等技术问题,提供一种医学检验领域中可用于人淋巴细胞染色体核型分析的染色体g带的制备方法。
本发明的目的是通过以下技术方案实现的:
一种染色体g带的制备方法,包括如下步骤:
细胞培养:将采集到的细胞样本接种到细胞培养基中,培养,得细胞培养物;
终止培养:向所述细胞培养物中加入秋水仙素,培养,得终止细胞培养物;
收获细胞:对所述终止细胞培养物进行离心,收集沉淀部分;向所述沉淀部分中加入低渗溶液进行低渗处理,得低渗细胞悬浮液;向所述低渗细胞悬浮液加入固定液、离心,收集沉淀细胞;向所述沉淀细胞中加入固定液,静置;对所述静置后获得混合物进行离心,收集固定细胞;向所述固定细胞中加入固定液后离心,再向离心沉淀产物中加入固定液,混匀,得滴片悬浮液;
滴片制片:吸取所述滴片悬浮液滴于玻片,然后将载有滴片细胞悬浮液的玻片平置于温度为22-23℃、湿度为45-60%的条件下,待玻片上的滴片细胞悬浮液水分蒸发后,烤片,得染色体标本制片;
染色显带:所述染色体标本制片依次经胰酶消化、姬姆萨染液染色,即可。
在本发明的一些实施例中,所述滴片制片的步骤中,吸取所述滴片细胞悬浮液滴于玻片之前,还需对玻片进入如下预处理:将玻片浸于2-8℃水中,取出所述玻片后将其垂直放置后再倾斜放置。
在本发明的一些实施例中,所述垂直放置包括将从水中取出的玻片垂直放置在吸水纸上2-5s;所述倾斜放置的倾角范围为10-30°。
在本发明的一些实施例中,所述细胞培养的步骤中,所述细胞样本为人外周血。
在本发明的一些实施例中,所述细胞培养的步骤中,所述培养的时间为68-72h。
在本发明的一些实施例中,所述终止培养的步骤中,所述终止培养的步骤中,秋水仙素加入后再终止细胞培养物中的浓度0.3-0.4μg/ml。
在本发明的一些实施例中,所述收获细胞的步骤中,所述再加入固定液进行固定后离心中的固定时长为至少2h。
在本发明的一些实施例中,所述染色显带的步骤中,所述胰酶的浓度为0.02-0.03%,消化的时间为30-40s。
在本发明的一些实施例中,所述染色显带的步骤中,所述染色的时间为1-3min。
在本发明的一些实施例中,所述细胞培养的步骤中,所述培养基为添加有小牛血清、植物血凝素、青霉素、链霉素、碳酸氢钠、hapes缓冲液的rpm11640培养液。
与现有技术相比,本发明的有益效果在于:
本方法基于染色体分散动力学原理,通过将温度限定为22-23℃、湿度限定为45-60%,使两因素协同作用,共同协调载玻片上固定液(甲醇-乙酸)的挥发,带动染色体的分散运动,得到较好的分散效果,从而提升制片质量。
进一步地,本申请还对采用的玻片进行预处理,即通过对玻片先垂直放置、再倾斜放置,并将垂直放置的时间限定为2-5s,倾斜放置的条件限制为10-30°等,使玻片表面形成薄薄一层水膜,该层水膜不仅用以判断玻片是否干净,更重要的是能够提升染色体分散效果。
另外,发明人还通过对培养条件、消化条件、染色条件等的筛选,优化出与人外周血样品种类匹配的染色体g带的制备方法。
附图说明
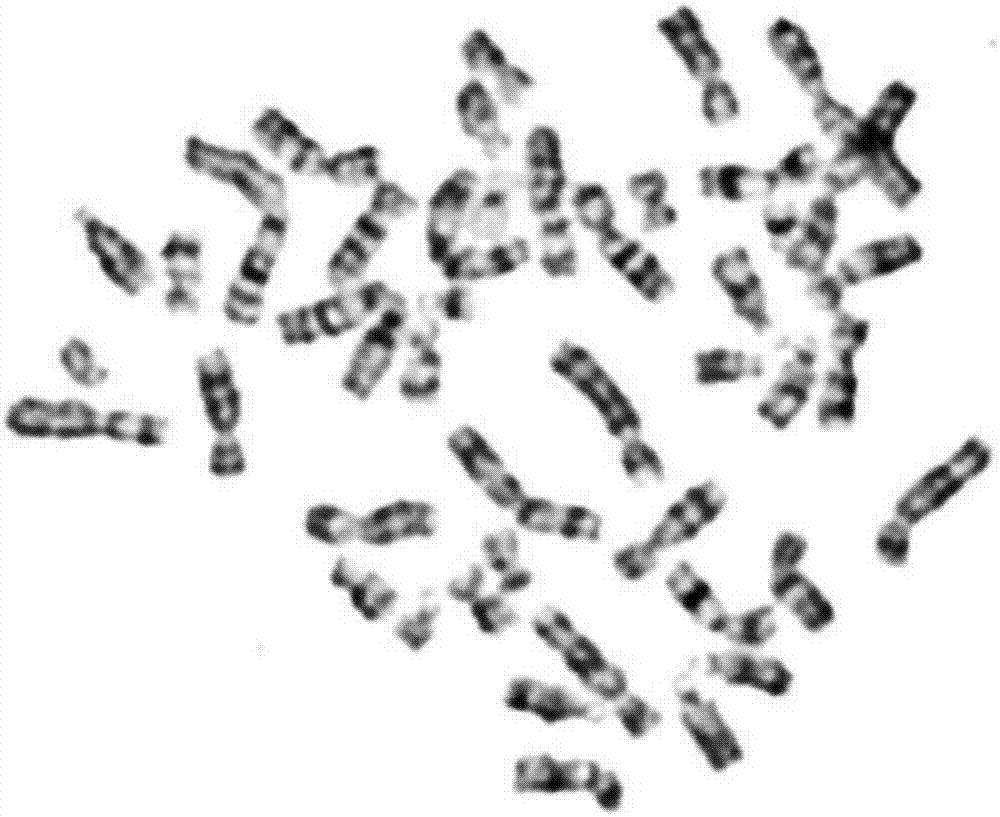
图1为本发明实施例染制备色体g带镜检图;
图2为常规方法所得染色体g带镜检图。
具体实施方式
以下结合具体实施例对本发明的染色体g带的制备方法作进一步详细的说明。
实施例1
本实施例提供一种染色体g带的制备方法,包括如下步骤:
(1)细胞培养:将采集到的细胞样本接种到细胞培养基中,培养,得细胞培养物。
本步骤使用肝素抗凝管采集2ml人外周血样本,并在24小时内进行接种操作;每瓶培养基接种0.45ml人外周血样本,培养基的基规格均以6ml,培养基:添加有小牛血清、植物血凝素、青霉素、链霉素、碳酸氢钠、hapes缓冲液的rpm11640培养液。
本步骤采用的培养的条件为:于培养箱(全封闭式的培养仪)中,培养68-72h,培养温度37℃。
本步骤培养的对象是成熟的淋巴细胞,其本身已经没有分解能力,因培养基中加入了植物血凝素,促使成熟淋巴细胞再进行有丝分裂,而此有丝分裂的高峰为68-72小时,想要得到最多的中期分裂相,必须培养68-72小时。
(2)终止培养:向所述细胞培养物中加入秋水仙素,培养,得终止细胞培养物;具体如下:
本步骤具体为,将0.1ml浓度为20μg/ml的秋水仙素加入培养瓶中,轻轻摇匀后放回培养箱继续培养1小时。
(3)收获细胞:对所述终止细胞培养物进行离心,收集沉淀部分;向所述沉淀部分中加入低渗溶液进行低渗处理,得低渗细胞悬浮液;向所述低渗细胞悬浮液加入固定液、离心,收集沉淀细胞;向所述沉淀细胞中加入固定液进行再次固定,并对所述固定所得产物进行离心,收集沉淀细胞,再加入固定液混匀后离心,向所得离心沉淀中加入固定液,混匀,得滴片悬浮液;具体如下:
将培养瓶中的细胞培养物轻轻摇匀,全部倒入15ml离心管中,离心机2000r/min,离心5min,弃上清液,收集沉淀部分;
向所述沉淀部分中加入37℃预热的0.075mol/l的kcl溶液8ml,充分混匀,在37℃水浴箱中低渗处理25min,得低渗细胞悬浮液;
向低渗细胞悬浮液加入固定液1.5ml混匀,静置5min,后以2000r/min,离心8min,弃上清液,收集沉淀细胞;本发明采用的固定液为甲醇与冰乙酸按3:1体积比混匀所得溶液,现配现用;
向所述沉淀细胞中加入8ml的所述固定液,轻轻混匀,静置2小时;发明人发现静置2小时能够实现更好的固定效果;
用离心机以2000r/min对所述静置后获得的混合物离心8min,弃上清液,收集固定细胞;
向固定细胞中加入8ml固定液,轻轻混匀,2000r/min离心8min,弃上清,得离心沉淀产物,向离心沉淀产物加入适量的固定液轻轻混匀制成滴片悬浮液。
(4)滴片制片:吸取所述滴片悬浮液滴于玻片,然后将载有滴片细胞悬浮液的玻片平置于温度为22-23℃、湿度为45-60%的条件下,待玻片上的滴片细胞悬浮液水分蒸发后,烤片,得染色体标本制片;
本步骤中,使用的玻片是经过清洁的玻片,使用前将玻片置于4℃冰蒸馏水中预冷;将玻片从4℃冰蒸馏水中取出后,还需对玻片进行如下预处理:垂直立于吸水纸上3s,一端抬起20°,斜放于滴片板上,使玻片表面覆有一层薄薄的水膜;
用吸管吸取滴片悬浮液于适当高度处滴片,玻片的头体尾各一滴即可,亦可根据细胞悬液浓度调节滴数;
设置滴片用水浴加热箱为37.5-39.0℃,在滴片用水浴加热箱平铺干净湿润的毛巾,根据当地环境温湿度调节温度及毛巾水分,使加热箱表面环境温度在22-23℃之间,湿度在45-60%之间;
将玻片背面(即不滴滴片悬浮液的一面)水分擦干后放置在平铺的毛巾上;
待玻片表面水分蒸发后,取下玻片编号,后置于75℃的烤箱中烘烤4-5小时。
(5)染色显带:所述染色体标本制片依次经0.025%(g/ml)胰酶消化30-40秒、姬姆萨染液染色1-3min,即可;
0.025%胰酶配制:取0.5%的胰酶一管3.5ml,加入70ml的pbs缓冲液中,充分混匀后,置于水浴箱里待用;
姬姆萨染液配制:取10-15ml姬姆萨母液,加入70ml的pbs缓冲液中,充分混匀后,置于水浴箱里标示染液的染缸中待用;
染色后用自来水冲掉多于染液,待其自然风干或电吹风吹干即可镜检。在显微镜油镜下分别观察染色体显带及染色,是否达到要求,条带水平在320-550之间。根据此预实验的显带及染色时间,对临床标本进行显带、染色。
本步骤中在实施过程采用到染缸,染缸先置于37℃水浴箱中预热20分钟。
同时,本实施例(结果见图1)以常规染色体g带制备方法(结果见图2)为对照。
结果显示,图1所显示的分裂相与图2中分裂相比较,可以明显看出分散情况更好,没有染色体之间交叉重叠的情况,并且条带清晰;这对于后期消化、染色及采图分析都有着积极的作用。
实施例2
本实施例提供一种染色体g带的制备方法,包括如下步骤:
(1)细胞培养:将采集到的细胞样本接种到细胞培养基中,培养,得细胞培养物。
本步骤使用肝素抗凝管采集2ml人外周血样本,并在24小时内进行接种操作;每瓶培养基接种0.4ml人外周血样本,培养基的基规格均以6ml;
本步骤采用的培养的条件为:于培养箱(全封闭式的培养仪)中,培养68h,培养温度37℃。
(2)终止培养:向所述细胞培养物中加入秋水仙素,培养,得终止细胞培养物;具体如下:
本步骤具体为,将20μg/ml的秋水仙素加入培养瓶中,确保培养瓶中的秋水仙素浓度为0.3-0.4μg/ml,轻轻摇匀后放回培养箱继续培养1小时。
(3)收获细胞:对所述终止细胞培养物进行离心,收集沉淀部分;向所述沉淀部分中加入低渗溶液进行低渗处理,得低渗细胞悬浮液;向所述低渗细胞悬浮液加入固定液、离心,收集沉淀细胞;向所述沉淀细胞中加入固定液进行再次固定,并对所述固定所得产物进行离心,收集沉淀细胞,再加入固定液混匀后离心,向所得离心沉淀中加入固定液,混匀,得滴片悬浮液;具体如下:
将培养瓶中的细胞培养物轻轻摇匀,全部倒入15ml离心管中,离心机2000r/min,离心5min,弃上清液,收集沉淀部分;
向所述沉淀部分中加入37℃预热的0.075mol/l的kcl溶液8ml,充分混匀,在37℃水浴箱中低渗处理20分钟,得低渗细胞悬浮液;
向低渗细胞悬浮液加入固定液1ml混匀,静置5min,后以2000r/min,离心8min,弃上清液,收集沉淀细胞;本发明采用的固定液为甲醇与冰乙酸按3:1体积比混匀所得溶液,现配现用;
向所述沉淀细胞中加入8ml的所述固定液,轻轻混匀,静置过夜;发明人发现静置过夜能够实现更好的固定效果;
用离心机以2000r/min对所述静置后获得的混合物离心8min,弃上清液,收集固定细胞;
向固定细胞中加入8ml固定液,轻轻混匀,2000r/min离心8min,弃上清,得离心沉淀产物,向离心沉淀产物加入适量的固定液轻轻混匀制成滴片悬浮液。
(4)滴片制片:吸取所述滴片悬浮液滴于玻片,然后将载有滴片细胞悬浮液的玻片平置于温度为22-23℃、湿度为45-60%的条件下,待玻片上的滴片细胞悬浮液水分蒸发后,烤片,得染色体标本制片;
本步骤中,使用的玻片是经过清洁处理的玻片,使用前将玻片置于4℃冰蒸馏水中预冷;将玻片从4℃冰蒸馏水中取出后,垂直立于吸水纸上2s,一端抬起10°,斜放于滴片板上,使玻片表面覆有一层薄薄的水膜;
用吸管吸取滴片悬浮液于适当高度处滴片,玻片的头体尾各一滴即可,亦可根据细胞悬液浓度调节滴数;
设置滴片用水浴加热箱为37.5-39.0℃,在滴片用水浴加热箱平铺干净湿润的毛巾,根据当地环境温湿度调节温度及毛巾水分,使加热箱表面环境温度在22-23℃之间,湿度在45-60%之间;
将玻片背面(即不滴滴片悬浮液的一面)水分擦干后放置在平铺的毛巾上;
待玻片表面水分蒸发后,取下玻片编号,后置于75℃的烤箱中烘烤5小时。
(5)染色显带:所述染色体标本制片依次经0.02%胰酶消化35秒、姬姆萨染液染色1min,即可;
染色后用自来水冲掉多于染液,待其自然风干或电吹风吹干即可镜检。在显微镜油镜下分别观察染色体显带及染色,是否达到要求,条带水平在320-550之间。
本步骤中在实施过程采用到染缸,染缸先置于37℃水浴箱中预热20分钟。
本实施例的结果同实施例1,可以明显看出分散情况更好,没有染色体之间交叉重叠的情况,并且条带清晰。
实施例3
本实施例提供一种染色体g带的制备方法,包括如下步骤:
(1)细胞培养:将采集到的细胞样本接种到细胞培养基中,培养,得细胞培养物。
本步骤使用肝素抗凝管采集2ml人外周血样本,并在24小时内进行接种操作;每瓶培养基接种0.5ml人外周血样本,培养基的基规格均以6ml;
本步骤采用的培养的条件为:于培养箱(普通水浴锅)中,培养72h,培养温度37℃。
(2)终止培养:向所述细胞培养物中加入秋水仙素,培养,得终止细胞培养物;具体如下:
本步骤具体为,将20μg/ml的秋水仙素加入培养瓶中,确保培养瓶中秋水仙素的浓度为0.3-0.4μg/ml,轻轻摇匀后放回培养箱继续培养1小时。
(3)收获细胞:对所述终止细胞培养物进行离心,收集沉淀部分;向所述沉淀部分中加入低渗溶液进行低渗处理,得低渗细胞悬浮液;向所述低渗细胞悬浮液加入固定液、离心,收集沉淀细胞;向所述沉淀细胞中加入固定液进行再次固定,并对所述固定所得产物进行离心,收集沉淀细胞,再加入固定液混匀后离心,向所得离心沉淀中加入固定液,混匀,得滴片悬浮液;具体如下:
将培养瓶中的细胞培养物轻轻摇匀,全部倒入15ml离心管中,离心机2000r/min,离心5min,弃上清液,收集沉淀部分;
向所述沉淀部分中加入37℃预热的0.075mol/l的kcl溶液8ml,充分混匀,在37℃水浴箱中低渗处理30分钟,得低渗细胞悬浮液;
向低渗细胞悬浮液加入固定液2ml混匀,静置5min,后以2000r/min,离心8min,弃上清液,收集沉淀细胞;本发明采用的固定液为甲醇与冰乙酸按3:1体积比混匀所得溶液,现配现用;
向所述沉淀细胞中加入8ml的所述固定液,轻轻混匀,静置过夜;
用离心机以2000r/min对所述静置后获得的混合物离心8min,弃上清液,收集固定细胞;
向固定细胞中加入8ml固定液,轻轻混匀,2000r/min离心8min,弃上清,得离心沉淀产物,向离心沉淀产物加入适量的固定液轻轻混匀制成滴片悬浮液。
(4)滴片制片:吸取所述滴片悬浮液滴于玻片,然后将载有滴片细胞悬浮液的玻片平置于温度为22-23℃、湿度为45-60%的条件下,待玻片上的滴片细胞悬浮液水分蒸发后,烤片,得染色体标本制片;
本步骤中,使用的玻片是经过清洁处理的玻片,使用前将玻片置于4℃冰蒸馏水中预冷;将玻片从4℃冰蒸馏水中取出后,垂直立于吸水纸上5s,一端抬起30°,斜放于滴片板上,使玻片表面覆有一层薄薄的水膜;
用吸管吸取滴片悬浮液于适当高度处滴片,玻片的头体尾各一滴即可,亦可根据细胞悬液浓度调节滴数;
设置滴片用水浴加热箱为37.5-39.0℃,在滴片用水浴加热箱平铺干净湿润的毛巾,根据当地环境温湿度调节温度及毛巾水分,使加热箱表面环境温度在22-23℃之间,湿度在45-60%之间;
将玻片背面(即不滴滴片悬浮液的一面)水分擦干后放置在平铺的毛巾上;
待玻片表面水分蒸发后,取下玻片编号,后置于75℃的烤箱中烘烤5小时。
(5)染色显带:所述染色体标本制片依次经0.03%胰酶消化40秒、姬姆萨染液染色3min,即可;
染色后用自来水冲掉多于染液,待其自然风干或电吹风吹干即可镜检。在显微镜油镜下分别观察染色体显带及染色,是否达到要求,条带水平在320-550之间。根据此预实验的显带及染色时间,对临床标本进行显带、染色。
本步骤中在实施过程采用到染缸,染缸先置于37℃水浴箱中预热20分钟。
本实施例的结果同实施例1,可以明显看出分散情况更好,没有染色体之间交叉重叠的情况,并且条带清晰。
对比例1
本对比例是实施例1的对比例,对比之处仅在于:(4)滴片制片的步骤中,将载有滴片细胞悬浮液的玻片平置于温度为25℃、湿度为65%的条件下,进行细胞悬浮液水分蒸发。
结果发现,染色会出现过于分散的情况,不易于镜下观察。
对比例2
本对比例是实施例1的对比例,对比之处仅在于:(4)滴片制片的步骤中,无需进行预处理(即垂直放置、倾斜放置),直接从4℃冰蒸馏水中取出后使用。
结果发现,玻片的洁净程度不易判断,并且导致滴片悬浮液不分散。
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!