转化油菜的方法与流程
本发明涉及一种植物转化的方法,特别是涉及一种油菜转化和培育的方法。
背景技术:
油菜是十字花科芸薹属植物,分为白菜型(brassicarapal.)、芥菜型(brassicajunceal.)和甘蓝型(brassicanapul.)3种栽培品种,其中甘蓝型油菜在全球的种植面积最为广泛,芥菜型次之,白菜型最少。目前,油菜作为四大油料作物之一,是全球种植面积第四大的转基因作物,2010年全球转基因油菜的种植面积占全球油菜种植总面积的23%,达到700万hm2,并逐年增加。自1985年ooms等首次利用农杆菌介导法获得转基因油菜以来,油菜转基因研究已在抗病、抗虫、耐受除草剂、雄性不育、蛋白组分改良等多方面取得了突破性进展。
良好的受体系统是油菜遗传转化的一个重要环节,关系到提供适宜转化的受体材料以及转化后的细胞能否再生为正常植株等问题。迄今为止,适合油菜转化的受体材料包括下胚轴、子叶柄、茎段、原生质体、小孢子等。与此同时,油菜的遗传转化方法主要有农杆菌介导法、基因枪轰击法、电击法、peg法和花粉管通道法等,其中农杆菌介导法和基因枪轰击法为目前常用的转基因方法。
最早ooms等(oomsg,etal.theorapplgenet,1985,71:325-329)和fry(fryj,etal.plantcellrep,1987,6:321-325)分别用无菌苗的茎段和花茎建立了根癌农杆菌介导转化体系,但转化效率不高。1989年moloney等首次利用甘蓝型春油菜品种“westar”的子叶柄建立了高效的根癌农杆菌介导转化体系,转化效率达到55%(moloney,etal.1989.plantcellrep.8:238-242),但由其获得的再生植株易为嵌合体,基因型也可能是杂合的。随后各国研究表明“westar”的确易于转化,但moloney等的高效油菜转化体系的重复性低(郭学兰,王汉中。中国油料作物学报,1999,21(3):1-5),目前大部分研究报道的转化效率不超过1%。
下胚轴也是常用的甘蓝型油菜转化受体。radke等的研究发现使用甘蓝型春油菜“westar”的下胚轴作为外植体转化时,其转化效率约为2.5%(radkese,etal.theor.appl.genet.1988,75:685-694.)。目前被广泛使用的下胚轴转化程序主要根据deblock等人(deblockm,etal.plantphysiol,1989,91:694-701)建立的方法。但是这类方法也存在一定的缺陷:下胚轴一般很难从切口处直接再生出不定芽,必须经过愈伤组织阶段的诱导,且生根难、转化效率低;同时冬油菜的遗传转化还存在外植体褐化的问题,严重影响后续的再生和转化。
原生质体的转化是针对单个的植物细胞,而不是多细胞的组织和器官,可以避免产生嵌合体。1994年程振东等利用peg的方法将gus基因导入甘蓝型油菜栽培品种“云北二号“的原生质体中(程振东,卫志明,许智宏。1994.实验生物学报,37(3):341-351)。但是这种转化方法受到诸多因素的影响,如peg的ph值、原生质体的悬浮液组份、外源dna加入的时间、抗生素筛选的时间以及转化品种基因型和原生质体再生能力等。由于转化处理会使原生质体受到伤害,因而大大降低细胞分裂的速度,且实验的重复性较差,转化效率低。
分离的小孢子也可以用来作为外源dna的导入受体(陈军等。激光生物学报1998,7(2):103-107)。实验发现,微束激光穿刺过程中蔗糖浓度降低后影响小孢子的活力,且从微束激光穿刺至进入32℃培养需要超过2小时的时间,对培养造成不利影响。微束激光处理已经分裂的小孢子胚,转化效率也只有1%。这种转化体系不仅要求油菜品种的小孢子有高的胚状体成胚率,即存在严重的基因型依赖,而且还有其它诸多不利因素会导致再生频率及转化效率降低。根癌农杆菌介导的小孢子转化(王新发等。植物学通报,2005,22(3):292-301)无需高精设备,但是农杆菌与小孢子的共培养时间难以控制,小孢子容易发生聚集,不利于成胚,转化效率低。胚诱导的培养和筛选过程中需要使用抗生素,也对小孢子胚的生长不利。况且小孢子培养只有在花期才能进行,周期长,当年无法得到转基因种子。转基因植株小苗的移栽、春化、越夏和结实都需要人工控制温/湿度,消耗大量电力和人力。
综上所述,基于组织培养的甘蓝型油菜遗传转化,主要是以根癌农杆菌作为生物媒介介导外源dna的转化。这类转化方法利用萌发4-12天的子叶柄和下胚轴,或幼嫩组织的原生质体,或游离小孢子,与带有双元载体的根癌农杆菌共培养,然后筛选能够表达报告基因(多为抗生素抗性基因)的再生器官或者胚状体。在共培养后的再生过程中需要不断抑制农杆菌的生长,结果使得再生效率大大下降。另外,外植体的基因型、发育时期、对农杆菌的敏感程度、再生的条件和频率都会影响转化效率。从收集外植体到获得转化植株需要的周期很长,而且要求根癌农杆菌有较高的活力、严格的无菌操作、适合转化和再生的培养基、在培养基中添加抗生素、合适的人工气候室与培养条件,需要不断地更换新鲜的培养基等,实验过程繁琐复杂,对操作人员的熟练程度有很高的要求,周期也非常长。实践中还会遇到组织培养苗难以越夏、需要先满足春化过程才能开花结实等问题。
技术实现要素:
本发明的目的是提供一种转化油菜的方法,有效克服现有技术油菜转化愈伤诱导率低、芽点分化难、转化苗不易生根、移栽与检测成本高等技术缺陷。
为实现上述目的,本发明提供了一种诱导油菜愈伤的方法,包括油菜外植体在含有生长素的愈伤诱导培养基上培养;
优选地,所述生长素为2,4-d;
优选地,所述2,4-d的浓度为0.1-7mg/l;
优选地,所述2,4-d的浓度为5mg/l;
优选地,所述油菜外植体为油菜下胚轴或其切段。
进一步地,所述愈伤诱导培养基中还包含细胞分裂素;
优选地,所述细胞分裂素为6-bap;
优选地,所述6-bap的浓度为0.01-1mg/l;
优选地,所述6-bap的浓度为0.03mg/l。
更进一步地,所述愈伤诱导培养基包括mes、蔗糖、2,4-d、羧苄青霉素、特美汀、硝酸银,6-bap、脯氨酸和天冬氨酸;
优选地,mes的浓度为0.1-5g/l,蔗糖的浓度为5-100g/l,2,4-d的浓度为0.1-7mg/l,羧苄青霉素的浓度为50-300mg/l,特美汀的浓度为20-500mg/l,硝酸银的浓度为1-10mg/l,6-bap的浓度为0.01-1mg/l,脯氨酸的浓度为50-200mg/l,天冬氨酸的浓度为50-200mg/l;
优选地,所述愈伤诱导培养基包括ms盐4.0g/l或n6盐3.95g/l或b5盐3.1g/l、b5维他命、mes1g/l、蔗糖30g/l、2,4-d5mg/l、琼脂8g/l、羧苄青霉素150mg/l、特美汀150mg/l、硝酸银3mg/l,6-bap0.03mg/l、脯氨酸100mg/l和天冬氨酸100mg/l。
为实现上述目的,本发明还提供了一种分化油菜芽的方法,包括油菜抗性愈伤组织在含有zt的分化培养基上培养;
优选地,所述zt的浓度为0.1-5mg/l;
优选地,所述zt的浓度为1mg/l。
进一步地,所述分化培养基包括mes、蔗糖、zt、naa、羧苄青霉素、特美汀、硝酸银、谷氨酸、天冬氨酸和选择剂;
优选地,选择剂为草甘膦;
优选地,mes的浓度为0.1-5g/l,蔗糖的浓度为5-100g/l,zt的浓度为0.1-5mg/l,naa的浓度为0.01-1mg/l,羧苄青霉素的浓度为50-300mg/l,特美汀的浓度为20-500mg/l,硝酸银的浓度为1-10mg/l,谷氨酸的浓度为50-200mg/l,天冬氨酸的浓度为50-200mg/l,草甘膦的浓度为0.1-20mg/l;
优选地,所述分化培养基包括ms盐4.3g/l或n6盐3.95g/l或b5盐3.1g/l、b5维他命、mes1g/l、蔗糖30g/l、zt1mg/l、naa0.5mg/l、琼脂8g/l、羧苄青霉素150mg/l、特美汀150mg/l、硝酸银3mg/l、谷氨酸100mg/l、天冬氨酸100mg/l和草甘膦8.5mg/l。
为实现上述目的,本发明还提供了一种油菜生根的方法,包括油菜小苗依次在含有细胞分裂素和生长素的第一生根培养基和不含任何激素的第二生根培养基上培养;
优选地,所述生长素为iba;
优选地,所述iba的浓度为0.01-1mg/l;
优选地,所述iba的浓度为0.25mg/l;
优选地,所述细胞分裂素为zt;
优选地,所述zt的浓度为0.1-5mg/l;
优选地,所述zt的浓度为1mg/l;
优选地,油菜抗性小苗在含有细胞分裂素和生长素的第一生根培养基上培养5-7天,再在不含任何激素的第二生根培养基上培养生根。
进一步地,所述第一生根培养基包括mes、蔗糖、zt、iba和头孢霉素;
优选地,mes的浓度为0.1-5g/l,蔗糖的浓度为5-100g/l,zt的浓度为0.1-5mg/l,iba的浓度为0.01-1mg/l,头孢霉素的浓度为50-300mg/l;
优选地,所述第一生根培养基包括1/2ms盐2.15g/l或1/2n6盐3.95g/l或1/2b5盐3.1g/l、b5维他命、mes1g/l、蔗糖30g/l、zt1mg/l、iba0.25mg/l、琼脂8g/l和头孢霉素150mg/l。
更进一步地,所述第二生根培养基包括mes、蔗糖和头孢霉素;
优选地,mes的浓度为0.1-5g/l,蔗糖的浓度为5-100g/l,头孢霉素的浓度为50-300mg/l;
优选地,所述第二生根培养基包括1/2ms盐2.15g/l或1/2n6盐3.95g/l或1/2b5盐3.1g/l、b5维他命、mes1g/l、蔗糖30g/l、琼脂8g/l和头孢霉素150mg/l。
为实现上述目的,本发明还提供了一种转化油菜的方法,包括:
油菜种子萌发后获得下胚轴或其切段;
农杆菌菌株侵染所述下胚轴或其切段;
将侵染后的所述下胚轴或其切段进行愈伤诱导培养;
利用选择剂对上述油菜愈伤组织进行筛选培养,将筛选后的油菜抗性愈伤组织在含有zt的分化培养基上进行芽分化培养;
由上述油菜芽生出的油菜小苗依次在含有细胞分裂素和生长素的第一生根培养基和不含任何激素的第二生根培养基上培养。
所述将侵染后的所述下胚轴或其切段进行愈伤诱导培养具体为将侵染后的所述下胚轴或其切段在含有生长素的愈伤诱导培养基上进行愈伤诱导培养;
优选地,所述生长素为2,4-d;
优选地,所述2,4-d的浓度为0.1-7mg/l;
优选地,所述2,4-d的浓度为5mg/l。
进一步地,所述愈伤诱导培养基中还包含细胞分裂素;
优选地,所述细胞分裂素为6-bap;
优选地,所述6-bap的浓度为0.01-1mg/l;
优选地,所述6-bap的浓度为0.03mg/l。
更进一步地,所述愈伤诱导培养基包括mes、蔗糖、2,4-d、羧苄青霉素、特美汀、硝酸银,6-bap、脯氨酸和天冬氨酸;
优选地,mes的浓度为0.1-5g/l,蔗糖的浓度为5-100g/l,2,4-d的浓度为0.1-7mg/l,羧苄青霉素的浓度为50-300mg/l,特美汀的浓度为20-500mg/l,硝酸银的浓度为1-10mg/l,6-bap的浓度为0.01-1mg/l,脯氨酸的浓度为50-200mg/l,天冬氨酸的浓度为50-200mg/l;
优选地,所述愈伤诱导培养基包括ms盐4.0g/l或n6盐3.95g/l或b5盐3.1g/l、b5维他命、mes1g/l、蔗糖30g/l、2,4-d5mg/l、琼脂8g/l、羧苄青霉素150mg/l、特美汀150mg/l、硝酸银3mg/l,6-bap0.03mg/l、脯氨酸100mg/l和天冬氨酸100mg/l。
进一步地,所述zt的浓度为0.1-5mg/l;
优选地,所述zt的浓度为1mg/l。
更进一步地,所述分化培养基包括mes、蔗糖、zt、naa、羧苄青霉素、特美汀、硝酸银、谷氨酸、天冬氨酸和选择剂;
优选地,选择剂为草甘膦;
优选地,mes的浓度为0.1-5g/l,蔗糖的浓度为5-100g/l,zt的浓度为0.1-5mg/l,naa的浓度为0.01-1mg/l,羧苄青霉素的浓度为50-300mg/l,特美汀的浓度为20-500mg/l,硝酸银的浓度为1-10mg/l,谷氨酸的浓度为50-200mg/l,天冬氨酸的浓度为50-200mg/l,草甘膦的浓度为0.1-20mg/l;
优选地,所述分化培养基包括ms盐4.3g/l或n6盐3.95g/l或b5盐3.1g/l、b5维他命、mes1g/l、蔗糖30g/l、zt1mg/l、naa0.5mg/l、琼脂8g/l、羧苄青霉素150mg/l、特美汀150mg/l、硝酸银3mg/l、谷氨酸100mg/l、天冬氨酸100mg/l和草甘膦8.5mg/l。
进一步地,所述生长素为iba;
优选地,所述iba的浓度为0.01-1mg/l;
优选地,所述iba的浓度为0.25mg/l;
优选地,所述细胞分裂素为zt;
优选地,所述zt的浓度为0.1-5mg/l;
优选地,所述zt的浓度为1mg/l;
优选地,油菜小苗在含有细胞分裂素和生长素的第一生根培养基上培养5-7天,再在不含任何激素的第二生根培养基上培养生根。
更进一步地,所述第一生根培养基包括mes、蔗糖、zt、iba和头孢霉素;
优选地,mes的浓度为0.1-5g/l,蔗糖的浓度为5-100g/l,zt的浓度为0.1-5mg/l,iba的浓度为0.01-1mg/l,头孢霉素的浓度为50-300mg/l;
优选地,所述第一生根培养基包括1/2ms盐2.15g/l或1/2n6盐3.95g/l或1/2b5盐3.1g/l、b5维他命、mes1g/l、蔗糖30g/l、zt1mg/l、iba0.25mg/l、琼脂8g/l和头孢霉素150mg/l。
所述第二生根培养基包括mes、蔗糖和头孢霉素;
优选地,mes的浓度为0.1-5g/l,蔗糖的浓度为5-100g/l,头孢霉素的浓度为50-300mg/l;
优选地,所述第二生根培养基包括1/2ms盐2.15g/l或1/2n6盐3.95g/l或1/2b5盐3.1g/l、b5维他命、mes1g/l、蔗糖30g/l、琼脂8g/l和头孢霉素150mg/l。
为实现上述目的,本发明还提供了一种生产转基因油菜植物的方法,包括:
油菜种子萌发后获得下胚轴或其切段;
农杆菌菌株侵染所述下胚轴或其切段;
将侵染后的所述下胚轴或其切段进行愈伤诱导培养;
利用选择剂进行筛选培养并选择转化的油菜抗性愈伤组织;
将所述油菜抗性愈伤组织在含有zt的分化培养基上进行芽分化培养;
由上述油菜芽生出的油菜小苗依次在含有细胞分裂素和生长素的第一生根培养基和不含任何激素的第二生根培养基上培养,以获得转基因油菜植物。
所述将侵染后的所述下胚轴或其切段进行愈伤诱导培养具体为将侵染后的所述下胚轴或其切段在含有生长素的愈伤诱导培养基上进行愈伤诱导培养;
优选地,所述生长素为2,4-d;
优选地,所述2,4-d的浓度为0.1-7mg/l;
优选地,所述2,4-d的浓度为5mg/l。
进一步地,所述愈伤诱导培养基中还包含细胞分裂素;
优选地,所述细胞分裂素为6-bap;
优选地,所述6-bap的浓度为0.01-1mg/l;
优选地,所述6-bap的浓度为0.03mg/l。
更进一步地,所述愈伤诱导培养基包括mes、蔗糖、2,4-d、羧苄青霉素、特美汀、硝酸银,6-bap、脯氨酸和天冬氨酸;
优选地,mes的浓度为0.1-5g/l,蔗糖的浓度为5-100g/l,2,4-d的浓度为0.1-7mg/l,羧苄青霉素的浓度为50-300mg/l,特美汀的浓度为20-500mg/l,硝酸银的浓度为1-10mg/l,6-bap的浓度为0.01-1mg/l,脯氨酸的浓度为50-200mg/l,天冬氨酸的浓度为50-200mg/l;
优选地,所述愈伤诱导培养基包括ms盐4.0g/l或n6盐3.95g/l或b5盐3.1g/l、b5维他命、mes1g/l、蔗糖30g/l、2,4-d5mg/l、琼脂8g/l、羧苄青霉素150mg/l、特美汀150mg/l、硝酸银3mg/l,6-bap0.03mg/l、脯氨酸100mg/l和天冬氨酸100mg/l。
进一步地,所述zt的浓度为0.1-5mg/l;
优选地,所述zt的浓度为1mg/l。
更进一步地,所述分化培养基包括mes、蔗糖、zt、naa、羧苄青霉素、特美汀、硝酸银、谷氨酸、天冬氨酸和选择剂;
优选地,选择剂为草甘膦;
优选地,mes的浓度为0.1-5g/l,蔗糖的浓度为5-100g/l,zt的浓度为0.1-5mg/l,naa的浓度为0.01-1mg/l,羧苄青霉素的浓度为50-300mg/l,特美汀的浓度为20-500mg/l,硝酸银的浓度为1-10mg/l,谷氨酸的浓度为50-200mg/l,天冬氨酸的浓度为50-200mg/l,草甘膦的浓度为0.1-20mg/l;
优选地,所述分化培养基包括ms盐4.3g/l或n6盐3.95g/l或b5盐3.1g/l、b5维他命、mes1g/l、蔗糖30g/l、zt1mg/l、naa0.5mg/l、琼脂8g/l、羧苄青霉素150mg/l、特美汀150mg/l、硝酸银3mg/l、谷氨酸100mg/l、天冬氨酸100mg/l和草甘膦8.5mg/l。
进一步地,所述生长素为iba;
优选地,所述iba的浓度为0.01-1mg/l;
优选地,所述iba的浓度为0.25mg/l;
优选地,所述细胞分裂素为zt;
优选地,所述zt的浓度为0.1-5mg/l;
优选地,所述zt的浓度为1mg/l;
优选地,油菜小苗在含有细胞分裂素和生长素的第一生根培养基上培养5-7天,再在不含任何激素的第二生根培养基上培养生根。
更进一步地,所述第一生根培养基包括mes、蔗糖、zt、iba和头孢霉素;
优选地,mes的浓度为0.1-5g/l,蔗糖的浓度为5-100g/l,zt的浓度为0.1-5mg/l,iba的浓度为0.01-1mg/l,头孢霉素的浓度为50-300mg/l;
优选地,所述第一生根培养基包括1/2ms盐2.15g/l或1/2n6盐3.95g/l或1/2b5盐3.1g/l、b5维他命、mes1g/l、蔗糖30g/l、zt1mg/l、iba0.25mg/l、琼脂8g/l和头孢霉素150mg/l。
所述第二生根培养基包括mes、蔗糖和头孢霉素;
优选地,mes的浓度为0.1-5g/l,蔗糖的浓度为5-100g/l,头孢霉素的浓度为50-300mg/l;
优选地,所述第二生根培养基包括1/2ms盐2.15g/l或1/2n6盐3.95g/l或1/2b5盐3.1g/l、b5维他命、mes1g/l、蔗糖30g/l、琼脂8g/l和头孢霉素150mg/l。
本发明中的克隆基因、表达盒、载体(例如质粒)、蛋白和蛋白片段、以及转化的细胞核植物均可使用标准方法生产。
本发明可用于在油菜植物中表达任何目的基因。目的基因可以是耐除草剂基因、抗病基因或抗虫基因,或者是选择或评价标记,并含有植物可操作的启动子、编码区和终止子区。耐除草剂基因包括对咪唑啉酮或磺酰脲除草剂耐受的ahas基因、对草丁膦除草剂耐受的pat或bar基因、对草甘膦除草剂耐受的epsps基因等。抗病基因包括抗生素合成酶基因,例如硝吡咯菌素合成酶基因,植物来源的抗性基因等。抗虫基因包括苏云金芽孢杆菌杀虫基因。目的基因也可以编码与生物化学途径有关的酶,该酶的表达可改变食物、饲料、营养药和/或药物生产中重要的性状。目的基因可以位于质粒上。适合本发明使用的质粒可以含有一个以上目的基因和/或农杆菌可含有带有不同目的基因的不同质粒。
本发明中所述“油菜”是指brassicanapus,所述方法是以农杆菌介导的目的基因传输到油菜细胞,之后再生为转化的油菜植物为基础的。本发明的方法独立于栽培品种。
本发明中所述“选择标记物”是指这样的基因或多核苷酸,其表达允许鉴别已经用含有所述基因或多核苷酸dna构建体或载体转化的细胞。选择标记物可以提供对毒性化合物的抗性,例如对抗生素、除草剂等。优选地,用5-烯醇丙酮酰莽草酸-3-磷酸合酶(epsps)基因转化,并且转化的基因在草甘膦存在的情况下培养。在含有草甘膦为选择剂的培养基中,epsps基因转化的油菜细胞选择性生长。
本发明中所述“转化”是指将dna引入细胞,从而dna以染色体外元件或染色体整合体形式维持在细胞内。
本发明中,将外源dna导入植物,常规的转化方法包括但不限于,农杆菌介导的转化、微量发射轰击、直接将dna摄入原生质体、电穿孔或晶须硅介导的dna导入。
能使用不同农杆菌菌株,包括但不限于根癌农杆菌和毛根农杆菌。优选使用可转化态菌株,合适根癌农杆菌菌株包括菌株a208、菌株eha101、lba4404。合适毛根农杆菌包括菌株k599。可转化态农杆菌载体的构建为本领域所熟知的。
含有异源核酸(即含有按照本发明的方法转化的细胞或组织)的转基因植物以及通过该转基因植物产生的种子和后代是本发明所涉及的。将转化的细胞培养成有用栽培品种的方法是本领域技术人员公知的。植物组织体外培养技术和整个植株再生技术也是公知的。相应的,所述“种子”包括这些转化植物的种子以及转化植物后代产生的种子。所述“植物”不仅包括转化和再生的植物,还包括通过本发明的方法产生的转化和再生植物的后代。
可以从本发明的方法产生的植物中筛选成功的转化植物。为了开发改良的植物和种子品系,可以持续地筛选和选择本发明再生植物的种子和子代植物以使转基因和整合的核酸序列持续存在。因此,可以将所需要的转基因核酸序列移入(即渐渗或交配)其它的遗传品系如某些原种或商业上有用的品系或品种中。渐渗目的基因进入遗传植物品系的方法可通过本领域公知的多种技术来实现,包括通过传统的育种、原生质体融合、细胞核转移以及染色体转移。育种方法和技术也是本领域公知的。根据本发明获得的转基因植物和自交系可用于生产商业上有价值的杂交植物和农作物。
本发明提供了一种转化油菜的方法,具有以下优点:
1、愈伤诱导率高。本发明在愈伤诱导培养基中添加2,4-d,尤以浓度5mg/l为最佳,明显增强了油菜愈伤的诱导力度,为后续分化和再生阶段奠定了良好的基础。
2、芽分化率高。本发明在分化培养基中选择添加zt,尤以浓度1mg/l为最佳,显著提高了油菜愈伤组织的芽分化率。
3、易于生根、成活率高。本发明在油菜小苗生根并再生成植物步骤中,采用经两种生根培养基处理的生根方式,第一生根培养基中含有诱导生根的激素iba和促进植株生长的激素zt,但培养时间不宜过长;第二生根培养基中不含任何激素,只提供营养物质并起支持作用,由此解决了油菜小苗难以生根或根系发育不良、吸收功能弱、移栽后不易成活等难题,同时缩短了育苗周期(由90天缩短至80天),降低了生产成本,提高了转化植株的成活率。
4、本发明在转化过程中不同阶段使用不同的抗菌素以抑制农杆菌的生长,诱导茎芽分化时用羧苄青霉素,诱导生根时则用头孢霉素,从而解决了头孢霉素对甘蓝型油菜薄层细胞芽分化具有抑制作用的技术困难,为获得转基因植株奠定了良好基础。
5、转化效率高。本发明转化油菜的方法以油菜下胚轴为转化受体,通过添加zt促进芽分化,并采用经两种生根培养基处理的生根方式,使得转化效率高达到8%。
6、本发明使用草甘膦作为选择剂,有效降低了筛选转基因阳性植株的成本;与此同时,转基因油菜可直接用于耐受草甘膦除草剂的油菜产品开发中。
下面通过附图和实施例,对本发明的技术方案做进一步的详细描述。
附图说明
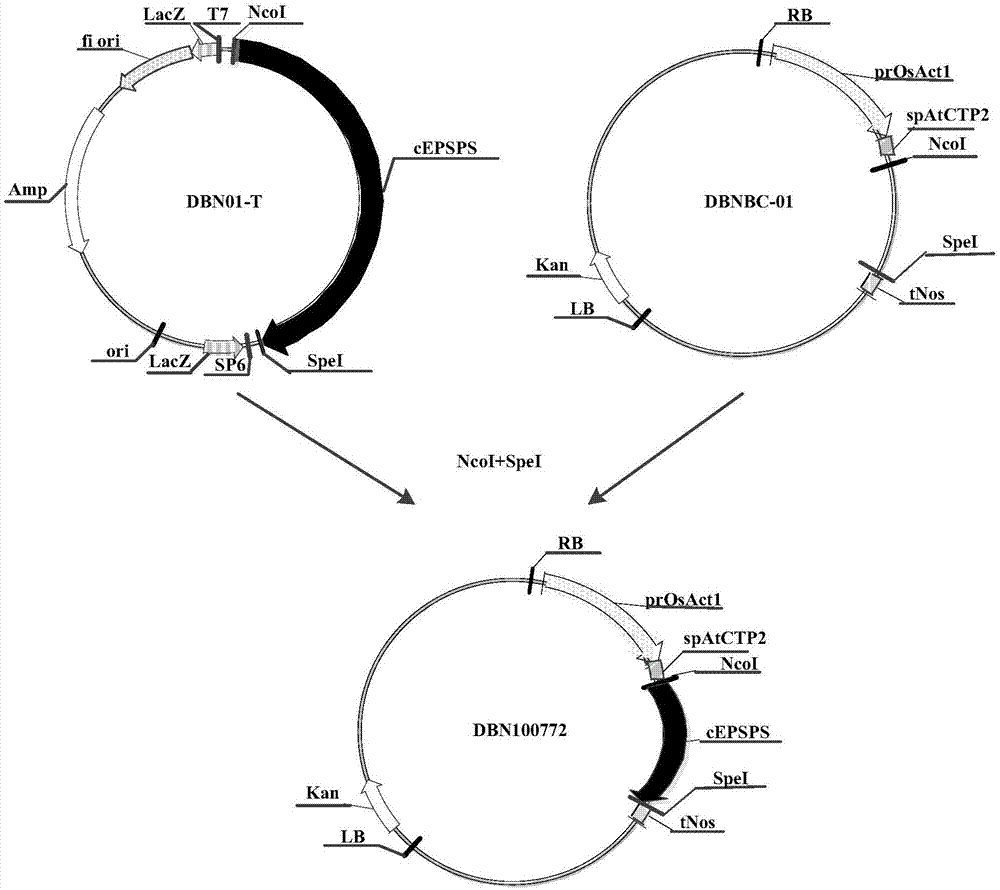
图1为本发明转化油菜的方法的重组克隆载体dbn01-t构建流程图;
图2为本发明转化油菜的方法的重组表达载体dbn100772构建流程图;
图3为本发明转化油菜的方法的转化油菜植株效果图。
具体实施方式
下面通过具体实施例进一步说明本发明转化油菜的方法的技术方案。
第一实施例、重组表达载体的构建及重组表达载体转化农杆菌
1、构建含有目的基因的重组克隆载体
将epsps核苷酸序列连入克隆载体pgem-t(promega,madison,usa,cat:a3600)上,操作步骤按promega公司产品pgem-t载体说明书进行,得到重组克隆载体dbn01-t,其构建流程如图1所示(其中,amp表示氨苄青霉素抗性基因;f1表示噬菌体f1的复制起点;lacz为lacz起始密码子;sp6为sp6rna聚合酶启动子;t7为t7rna聚合酶启动子;cepsps为5-烯醇丙酮酰莽草酸-3-磷酸合酶基因核苷酸序列(seqidno:1);mcs为多克隆位点)。
然后将重组克隆载体dbn01-t用热激方法转化大肠杆菌t1感受态细胞(transgen,beijing,china,cat:cd501),其热激条件为:50μl大肠杆菌t1感受态细胞、10μl质粒dna(重组克隆载体dbn01-t),42℃水浴30s;37℃振荡培养1h(200r/min转速下摇床摇动),在表面涂有iptg(异丙基硫代-β-d-半乳糖苷)和x-gal(5-溴-4-氯-3-吲哚-β-d-半乳糖苷)的氨苄青霉素(100mg/l)的lb固体平板(胰蛋白胨10g/l、酵母提取物5g/l、nacl10g/l、琼脂15g/l,用naoh调ph至7.5)上生长过夜。挑取白色菌落,在lb液体培养基(胰蛋白胨10g/l、酵母提取物5g/l、nacl10g/l、氨苄青霉素100mg/l,用naoh调ph至7.5)中于温度37℃条件下培养过夜。碱法提取其质粒:将菌液在12000r/min转速下离心1min,去上清液,沉淀菌体用100μl冰预冷的溶液i(25mmtris-hcl、10mmedta(乙二胺四乙酸)、50mm葡萄糖,ph8.0)悬浮;加入200μl新配制的溶液ii(0.2mnaoh、1%sds(十二烷基硫酸钠)),将管子颠倒4次,混合,置冰上3-5min;加入150μl冰冷的溶液iii(3m醋酸钾、5m醋酸),立即充分混匀,冰上放置5-10min;于温度4℃、转速12000r/min条件下离心5min,在上清液中加入2倍体积无水乙醇,混匀后室温放置5min;于温度4℃、转速12000r/min条件下离心5min,弃上清液,沉淀用浓度(v/v)为70%的乙醇洗涤后晾干;加入30μl含rnase(20μg/ml)的te(10mmtris-hcl、1mmedta,ph8.0)溶解沉淀;于温度37℃下水浴30min,消化rna;于温度-20℃保存备用。
提取的质粒经ncoi和spei酶切鉴定后,对阳性克隆进行测序验证,结果表明重组克隆载体dbn01-t中插入的epsps基因序列为序列表中seqidno:1所示的核苷酸序列。
2、构建含有目的基因的重组表达载体
用限制性内切酶ncoi和spei分别酶切重组克隆载体dbn01-t和表达载体dbnbc-01(载体骨架:pcambia2301(cambia机构可以提供)),将切下的epsps基因序列插到表达载体dbnbc-01的ncoi和spei位点之间,利用常规的酶切方法构建载体是本领域技术人员所熟知的,构建成重组表达载体dbn100772,其构建流程如图2所示(kan:卡那霉素基因;rb:右边界;prosact1:水稻肌动蛋白1启动子(seqidno:2);spatctp2:拟南芥叶绿体转运肽的编码序列(seqidno:3);cepsps:5-烯醇丙酮酰莽草酸-3-磷酸合酶基因核苷酸序列(seqidno:1);tnos:胭脂碱合成酶基因的终止子(seqidno:4);lb:左边界)。
将重组表达载体dbn100772用热激方法转化大肠杆菌t1感受态细胞,其热激条件为:50μl大肠杆菌t1感受态细胞、10μl质粒dna(重组表达载体dbn100772),42℃水浴30s;37℃振荡培养1h(200r/min转速下摇床摇动);然后在含50mg/l卡那霉素(kanamycin)的lb固体平板(胰蛋白胨10g/l、酵母提取物5g/l、nacl10g/l、琼脂15g/l,用naoh调ph至7.5)上于温度37℃条件下培养12h,挑取白色菌落,在lb液体培养基(胰蛋白胨10g/l、酵母提取物5g/l、nacl10g/l、卡那霉素50mg/l,用naoh调ph至7.5)中于温度37℃条件下培养过夜。碱法提取其质粒。将提取的质粒用限制性内切酶ncoi和spei酶切后鉴定,并将阳性克隆进行测序鉴定,结果表明epsps核苷酸序列正确插入到重组表达载体dbn100772中。
3、重组表达载体转化农杆菌
对己经构建正确的重组表达载体dbn100772用液氮法转化到农杆菌lba4404(invitrgen,chicago,usa,cat:18313-015)中,其转化条件为:100μl农杆菌lba4404、3μl质粒dna(重组表达载体);置于液氮中10min,37℃温水浴10min;将转化后的农杆菌lba4404接种于lb试管中于温度28℃、转速为200r/min条件下培养2h,涂于含50mg/l的利福平(rifampicin)和100mg/l的卡那霉素的lb固体平板上直至长出阳性单克隆,挑取单克隆培养并提取其质粒,用限制性内切酶ncoi和spei酶切后进行酶切验证,结果表明重组表达载体dbn100772结构完全正确。
第二实施例、转基因油菜植株的获得
1、外植体的获得
将甘蓝型油菜品种westar的种子在70%(v/v)的酒精中浸泡1min,接着用30%(v/v)的次氯酸钠溶液灭菌30min,再用无菌水冲洗至少3次;将上述洗净后的种子接种于萌发固体培养基(b5盐3.1g/l、b5维他命、蔗糖20g/l、琼脂8g/l,ph5.6)上,在温度25±2℃、光周期为16/8h的条件下培养成苗。在苗龄为5-7天时,将幼苗的下胚轴切成约1.0cm的切段作为遗传转化受体备用。
在本实施例的所述萌发固体培养基中,b5盐还可以为n6盐(浓度为3.95g/l)或ms盐(浓度为4.3g/l),蔗糖的浓度可以为5-100g/l;上述成分均可以在其浓度范围内进行任意组合,但以所述萌发固体培养基(b5盐3.1g/l、b5维他命、蔗糖20g/l、琼脂8g/l,ph5.6)为优选。
2、农杆菌菌液的制备
将农杆菌菌株从-80℃冰箱中取出,挑取含有dbn100772的农杆菌单菌落,在加有卡那霉素的yp培养板(酵母提取物5g/l、蛋白胨10g/l、nacl5g/l、卡那霉素25mg/l,ph7.0)上活化该菌株(用枪头划线),划好的yp培养板置于28℃恒温培养箱中培养2-3天后,刮取yp培养板上的菌斑重新活化到新的yp培养板上,重新活化的yp培养板在28℃培养箱培养一天后刮取菌落,悬浮于适量的侵染液(即侵染培养基(ms盐2.15g/l、b5维他命、蔗糖20g/l、葡萄糖10g/l、乙酰丁香酮(as)40mg/l、2-吗啉乙磺酸(mes)4g/l、玉米素(zt)2mg/l,ph5.3)的50ml离心管中,不断摇晃以使菌体完全稀释在侵染液中,定容后将其浓度调整为od660=0.2-0.6,待用。
在本实施例的所述侵染培养基中,ms盐还可以为n6盐(浓度为3.95g/l)或b5盐(浓度为3.1g/l),蔗糖的浓度可以为5-100g/l,葡萄糖的浓度可以为5-100g/l,as的浓度可以为10-150mg/l,mes的浓度可以为0.1-5g/l,zt的浓度可以为0.1-5mg/l;上述成分均可以在其浓度范围内进行任意组合,但以所述侵染培养基(ms盐2.15g/l、b5维他命、蔗糖20g/l、葡萄糖10g/l、as40mg/l、mes4g/l、zt2mg/l,ph5.3)为优选。
3、农杆菌侵染油菜下胚轴切段
将本实施例1中切好的下胚轴切段置于50ml离心管中,取本实施2中配制好的农杆菌菌液30ml倒入上述离心管中,所述农杆菌菌液与所述下胚轴切段充分接触,静置或手动轻轻摇晃5-20min,优选为10min,这期间在44℃恒温水浴锅热处理1-5min,优选为1min。将侵染后的下胚轴切段放置于三层滤纸上,吸干下胚轴切段表面的农杆菌菌液。
4、农杆菌与油菜下胚轴切段共培养
将吸干农杆菌菌液的下胚轴切段放置于共培养培养基(ms盐4.3g/l、b5维他命、蔗糖20g/l、葡萄糖10g/l、mes4g/l、zt2mg/l、琼脂8g/l,ph5.6)上培养,培养基中放置一张滤纸,每皿30个下胚轴切段为最佳,在22℃恒温暗培养箱中共培养2-5天,优选为3天。
在本实施例上述共培养培养基中,蔗糖的浓度可以为5-100g/l,葡萄糖的浓度可以为5-100g/l,mes的浓度可以为0.1-5g/l,zt的浓度可以为0.1-5mg/l;上述成分均可以在其浓度范围内进行任意组合,但以所述共培养培养基(ms盐4.3g/l、b5维他命、蔗糖20g/l、葡萄糖10g/l、mes4g/l、zt2mg/l、琼脂8g/l,ph5.6)为优选。
5、诱导培养油菜愈伤
将共培养后的油菜下胚轴切段分别转移到5种2,4-d浓度的愈伤诱导培养基(ms盐4.0g/l、b5维他命、mes1g/l、蔗糖30g/l、琼脂8g/l、羧苄青霉素150mg/l、特美汀150mg/l、硝酸银3mg/l、6-苄基腺嘌呤(6-bap)0.03mg/l、脯氨酸100mg/l、天冬氨酸100mg/l,ph5.6)上,其中2,4-d浓度(mg/l)分别为0、0.1、2、5和7,在温度24±2℃、光周期为16/8h的条件下诱导5-14天,优选为7天,以消除农杆菌并诱导愈伤组织。诱导5-14天后,统计愈伤诱导率(愈伤诱导率=诱导的愈伤数量/侵染下胚轴切段的数量×100%),每一2,4-d浓度设3次重复,取平均值,试验结果如表1所示。
表1、5种2,4-d浓度的愈伤诱导培养基处理后油菜愈伤诱导率的试验结果
表1的试验结果表明:添加2,4-d的愈伤诱导培养基处理后的油菜愈伤诱导率显著高于不添加2,4-d的愈伤诱导培养基(2,4-d浓度为0mg/l),且尤以2,4-d浓度为5mg/l的愈伤诱导培养基为最佳,油菜愈伤诱导率可高达85%左右,因此选择经2,4-d浓度为5mg/l的愈伤诱导培养基处理后的油菜愈伤组织进行下述试验。
在本实施例所述愈伤诱导培养基中,ms盐还可以为n6盐(浓度为3.95g/l)或b5盐(浓度为3.1g/l),mes的浓度可以为0.1-5g/l,蔗糖的浓度可以为5-100g/l,2,4-d的浓度可以为0.1-7mg/l,羧苄青霉素的浓度可以为50-300mg/l,特美汀的浓度可以为20-500mg/l,硝酸银的浓度可以为1-10mg/l,6-bap的浓度可以为0.01-1mg/l,脯氨酸的浓度可以为50-200mg/l,天冬氨酸的浓度可以为50-200mg/l;上述成分均可以在其浓度范围内进行任意组合,但以所述愈伤诱导培养基(ms盐4.0g/l、b5维他命、mes1g/l、蔗糖30g/l、2,4-d5mg/l、琼脂8g/l、羧苄青霉素150mg/l、特美汀150mg/l、硝酸银3mg/l、6-bap0.03mg/l、脯氨酸100mg/l、天冬氨酸100mg/l,ph5.6)为优选。
6、筛选培养油菜愈伤组织
油菜愈伤诱导结束后,将上述经2,4-d浓度为5mg/l的愈伤诱导培养基处理后的油菜愈伤组织转移至含有草甘膦筛选剂的筛选培养基(ms盐4.3g/l、b5维他命、mes1g/l、蔗糖30g/l、zt1mg/l、萘乙酸(naa)0.5mg/l、琼脂8g/l、羧苄青霉素150mg/l、特美汀150mg/l、硝酸银3mg/l、谷氨酸100mg/l、天冬氨酸100mg/l、草甘膦11.8mg/l,ph5.6)上,在温度24±2℃、光周期为16/8h条件下筛选培养10-30天,优选为18天,从而导致转化的细胞选择性生长,获得油菜抗性愈伤组织。
在本实施例所述筛选培养基中,ms盐还可以为n6盐(浓度为3.95g/l)或b5盐(浓度为3.1g/l),mes的浓度可以为0.1-5g/l,蔗糖的浓度可以为5-100g/l,zt的浓度可以为0.1-5mg/l,naa的浓度可以为0.01-1mg/l,羧苄青霉素的浓度可以为50-300mg/l,特美汀的浓度可以为20-500mg/l,硝酸银的浓度可以为1-10mg/l,谷氨酸的浓度可以为50-200mg/l,天冬氨酸的浓度可以为50-200mg/l,草甘膦的浓度可以为0.1-20mg/l;上述成分均可以在其浓度范围内进行任意组合,但以所述筛选培养基(ms盐4.3g/l、b5维他命、mes1g/l、蔗糖30g/l、zt1mg/l、naa0.5mg/l、琼脂8g/l、羧苄青霉素150mg/l、特美汀150mg/l、硝酸银3mg/l、谷氨酸100mg/l、天冬氨酸100mg/l、草甘膦11.8mg/l,ph5.6)为优选。
7、分化培养油菜抗性愈伤组织
从筛选培养基中取出上述油菜抗性愈伤组织,切掉水渍、褐化和无活性的愈伤组织后,将鲜嫩且翠绿的活性愈伤组织分别转移到含3种不同细胞分裂素的分化培养基(ms盐4.3g/l、b5维他命、mes1g/l、蔗糖30g/l、naa0.5mg/l、琼脂8g/l、羧苄青霉素150mg/l、特美汀150mg/l、硝酸银3mg/l、谷氨酸100mg/l、天冬氨酸100mg/l、草甘膦8.5mg/l,ph5.6)上,其中细胞分裂素分别为zt1mg/l、6-bap1mg/l和激动素(kt)1mg/l,在温度24±2℃、光周期为16/8h条件下培养14-30天以分化出芽,优选为21天。分化培养14-30天后,统计分化率(分化率=分化芽数量/侵染下胚轴切段数量×100%),每种细胞分裂素设3次重复,取平均值,试验结果如表2所示。
表2、含3种不同细胞分裂素的分化培养基处理后油菜愈伤分化率的试验结果
表2的试验结果表明:添加zt的分化培养基处理后的油菜愈伤分化率显著高于添加6-bap和kt的分化培养基,油菜愈伤分化率可高达48%,因此选择经含zt的分化培养基处理后的油菜愈伤组织进行分化出芽和下述试验。
在本实施例上述分化培养基中,ms盐还可以为n6盐(浓度为3.95g/l)或b5盐(浓度为3.1g/l),mes的浓度可以为0.1-5g/l,蔗糖的浓度可以为5-100g/l,zt的浓度可以为0.1-5mg/l,naa的浓度可以为0.01-1mg/l,羧苄青霉素的浓度可以为50-300mg/l,特美汀的浓度可以为20-500mg/l,硝酸银的浓度可以为1-10mg/l,谷氨酸的浓度可以为50-200mg/l,天冬氨酸的浓度可以为50-200mg/l,草甘膦的浓度可以为0.1-20mg/l;上述成分均可以在其浓度范围内进行任意组合,但以所述分化培养基(ms盐4.3g/l、b5维他命、mes1g/l、蔗糖30g/l、zt1mg/l、naa0.5mg/l、琼脂8g/l、羧苄青霉素150mg/l、特美汀150mg/l、硝酸银3mg/l、谷氨酸100mg/l、天冬氨酸100mg/l、草甘膦8.5mg/l,ph5.6)为优选。
8、培养分化出的油菜芽生苗
将由上述愈伤组织分化出的、芽点比较饱满的油菜芽转移到不含草甘膦筛选剂的生苗培养基(ms盐4.3g/l、b5维他命、mes1g/l、蔗糖30g/l、zt1mg/l、naa0.5mg/l、琼脂8g/l、羧苄青霉素150mg/l、特美汀150mg/l,ph5.6)上,在温度24±2℃、光周期为16/8h条件下培养至苗高2-3cm。
在本实施例上述生苗培养基中,ms盐还可以为n6盐(浓度为3.95g/l)或b5盐(浓度为3.1g/l),mes的浓度可以为0.1-5g/l,蔗糖的浓度可以为5-100g/l,zt的浓度可以为0.1-5mg/l,naa的浓度可以为0.01-1mg/l,羧苄青霉素的浓度可以为50-300mg/l,特美汀的浓度可以为20-500mg/l;上述成分均可以在其浓度范围内进行任意组合,但以所述生苗培养基(ms盐4.3g/l、b5维他命、mes1g/l、蔗糖30g/l、zt1mg/l、naa0.5mg/l、琼脂8g/l、羧苄青霉素150mg/l、特美汀150mg/l,ph5.6)为优选。
9、油菜小苗生根并再生成植物
将上述培养的油菜小苗转移到第一生根培养基(1/2ms盐2.15g/l、b5维他命、mes1g/l、蔗糖30g/l、zt1mg/l、吲哚丁酸(iba)0.25mg/l、琼脂8g/l、头孢霉素150mg/l,ph5.6)上,在温度24±2℃、光周期为16/8h的条件下培养5-7天,优选为6天。经所述第一生根培养基培养过的小苗分别进行下述2种处理:处理一为继续在所述第一生根培养基上培养,处理二为转移到第二生根培养基(1/2ms盐2.15g/l、b5维他命、mes1g/l、蔗糖30g/l、琼脂8g/l、头孢霉素150mg/l,ph5.6)上培养,在24±2℃、光周期为16/8h的条件下培养生根至株高约5cm,移至温室培养至结实。在温室中,每天于26℃光照条件下培养16小时,再于20℃黑暗条件下培养8小时,可以获得2种生根处理后的转入epsps核苷酸序列的油菜植株。
在本实施例上述第一生根培养基中,ms盐还可以为n6盐(浓度为3.95g/l)或b5盐(浓度为3.1g/l),mes的浓度可以为0.1-5g/l,蔗糖的浓度可以为5-100g/l,zt的浓度可以为0.1-5mg/l,iba的浓度可以为0.01-1mg/l,头孢霉素的浓度可以为50-300mg/l;上述成分均可以在其浓度范围内进行任意组合,但以所述第一生根培养基(1/2ms盐2.15g/l、b5维他命、mes1g/l、蔗糖30g/l、zt1mg/l、iba0.25mg/l、琼脂8g/l、头孢霉素150mg/l,ph5.6)为优选。
在本实施例上述第二生根培养基中,ms盐还可以为n6盐(浓度为3.95g/l)或b5盐(浓度为3.1g/l),mes的浓度可以为0.1-5g/l,蔗糖的浓度可以为5-100g/l,头孢霉素的浓度可以为50-300mg/l;上述成分均可以在其浓度范围内进行任意组合,但以所述第二生根培养基(1/2ms盐2.15g/l、b5维他命、mes1g/l、蔗糖30g/l、琼脂8g/l、头孢霉素150mg/l,ph5.6)为优选。
第三实施例、用taqman验证转入epsps核苷酸序列的油菜植株
分别取上述2种生根处理后的转入epsps核苷酸序列的油菜植株的叶片约100mg作为样品,用qiagen的dneasyplantmaxikit提取其基因组dna,通过taqman探针荧光定量pcr方法检测epsps基因的拷贝数。同时以野生型油菜植株作为对照,按照上述方法进行检测分析。实验设3次重复,取平均值。
检测epsps基因拷贝数的具体方法如下:
步骤11、分别取上述2种生根处理后的转入epsps核苷酸序列的油菜植株和野生型油菜植株的叶片各100mg,分别在研钵中用液氮研成匀浆,每个样品取3个重复;
步骤12、使用qiagen的dneasyplantminikit提取上述样品的基因组dna,具体方法参考其产品说明书;
步骤13、用nanodrop2000(thermoscientific)测定上述样品的基因组dna浓度;
步骤14、调整上述样品的基因组dna浓度至同一浓度值,所述浓度值的范围为80-100ng/μl;
步骤15、采用taqman探针荧光定量pcr方法鉴定样品的拷贝数,以经过鉴定已知拷贝数的样品作为标准品,以野生型油菜植株的样品作为对照,每个样品3个重复,取其平均值;荧光定量pcr引物和探针序列分别是:
以下引物和探针用来检测epsps核苷酸序列:
引物1:ctggaaggcgaggacgtcatcaata如序列表中seqidno:5所示;
引物2:tggcggcattgccgaaatcgag如序列表中seqidno:6所示;
探针1:atgcaggcgatgggcgcccgcatccgta如序列表中seqidno:7所示;
pcr反应体系为:
所述50×引物/探针混合物包含1mm浓度的每种引物各45μl,100μm浓度的探针50μl和1×te缓冲液860μl,并且在温度4℃下,贮藏在琥珀试管中。
pcr反应条件为:
利用sds2.3软件(appliedbiosystems)分析数据。
实验结果表明,epsps核苷酸序列整合到所检测的油菜植株的染色体组中,上述2种生根处理的试验结果如表3和图3所示,阳性植株为8株,转化效率可达8%。
表3、油菜转化效率的试验结果
注:转化效率=阳性植株数/侵染下胚轴切段的数量×100%。
由表3可得,在油菜小苗生根并再生成植物步骤中,经过一种生根培养基培养的小苗,其后代获得的阳性植株率较低,甚至不能获得阳性植株,转化效率在2%以下;经过两种生根培养基培养的小苗,其后代获得的阳性植株率较高,转化效率在8%左右。
综上所述,本发明在愈伤诱导培养基中添加2,4-d,尤以浓度5mg/l为最佳,明显增强了油菜的愈伤诱导率,为后续分化和再生阶段奠定了良好的基础;在分化培养基中选择添加zt,尤以浓度1mg/l为最佳,显著提高了油菜愈伤组织的芽分化率;同时采用经两种生根培养基处理的生根方式,不仅解决了油菜小苗难以生根或根系发育不良、吸收功能弱、移栽后不易成活等难题,而且缩短了育苗周期,降低了生产成本,提高了转化植株的成活率;此外本发明在转化过程中不同阶段使用不同的抗菌素以抑制农杆菌的生长,诱导茎芽分化时用羧苄青霉素,诱导生根时则用头孢霉素,解决了头孢霉素对甘蓝型油菜薄层细胞芽分化具有抑制作用的技术困难;本发明转化油菜的方法转化效率高达到8%,获得的转基因油菜可直接用于耐受草甘膦除草剂的油菜产品开发。
最后所应说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围。
sequencelisting
<110>北京大北农生物技术有限公司
<120>转化油菜的方法
<130>dbnbc123
<160>7
<170>patentinversion3.3
<210>1
<211>1368
<212>dna
<213>artificialsequence
<220>
<223>5-烯醇丙酮酰莽草酸-3-磷酸合酶基因核苷酸序列
<400>1
atgcttcacggtgcaagcagccgtccagcaactgctcgtaagtcctctggtctttctgga60
accgtccgtattccaggtgacaagtctatctcccacaggtccttcatgtttggaggtctc120
gctagcggtgaaactcgtatcaccggtcttttggaaggtgaagatgttatcaacactggt180
aaggctatgcaagctatgggtgccagaatccgtaaggaaggtgatacttggatcattgat240
ggtgttggtaacggtggactccttgctcctgaggctcctctcgatttcggtaacgctgca300
actggttgccgtttgactatgggtcttgttggtgtttacgatttcgatagcactttcatt360
ggtgacgcttctctcactaagcgtccaatgggtcgtgtgttgaacccacttcgcgaaatg420
ggtgtgcaggtgaagtctgaagacggtgatcgtcttccagttaccttgcgtggaccaaag480
actccaacgccaatcacctacagggtacctatggcttccgctcaagtgaagtccgctgtt540
ctgcttgctggtctcaacaccccaggtatcaccactgttatcgagccaatcatgactcgt600
gaccacactgaaaagatgcttcaaggttttggtgctaaccttaccgttgagactgatgct660
gacggtgtgcgtaccatccgtcttgaaggtcgtggtaagctcaccggtcaagtgattgat720
gttccaggtgatccatcctctactgctttcccattggttgctgccttgcttgttccaggt780
tccgacgtcaccatccttaacgttttgatgaacccaacccgtactggtctcatcttgact840
ctgcaggaaatgggtgccgacatcgaagtgatcaacccacgtcttgctggtggagaagac900
gtggctgacttgcgtgttcgttcttctactttgaagggtgttactgttccagaagaccgt960
gctccttctatgatcgacgagtatccaattctcgctgttgcagctgcattcgctgaaggt1020
gctaccgttatgaacggtttggaagaactccgtgttaaggaaagcgaccgtctttctgct1080
gtcgcaaacggtctcaagctcaacggtgttgattgcgatgaaggtgagacttctctcgtc1140
gtgcgtggtcgtcctgacggtaagggtctcggtaacgcttctggagcagctgtcgctacc1200
cacctcgatcaccgtatcgctatgagcttcctcgttatgggtctcgtttctgaaaaccct1260
gttactgttgatgatgctactatgatcgctactagcttcccagagttcatggatttgatg1320
gctggtcttggagctaagatcgaactctccgacactaaggctgcttga1368
<210>2
<211>1534
<212>dna
<213>brassicaoleracea
<400>2
gattatgacattgctcgtggaatgggacagttatggtatttttttgtaataaattgtttc60
cattgtcatgagattttgaggttaatctatgagacattgaatcacttagcattagggatt120
aagtagtcacaaatcgcattcaagaagctgaagaacacgttatggtctaatggttgtgtc180
tctttattagaaaatgttggtcagtagctatatgcactgtttctgtaaaaccatgttggt240
gttgtgtttatttcaagacacatgttgagtccgttgattcagagcttttgtcttcgaaca300
caatctagagagcaaatttgggttcaatttggatatcaatatgggttcgattcagataga360
acaataccctttgatgtcgggtttcgatttggttgagattcatttttatcgggtttggtt420
cgattttcgaattcggtttattcgccccctcatagcatctacattctgcagattaatgta480
caagttatggaaaaaaaaatgtggttttcgaattcggtttagtagctaaacgttgcttgc540
agtgtagttatgggaattatgaaacacgaccgaaggtatcaattagaagaacgggtcaac600
gggtaagtattgagaaattaccggagggtaaaaataaacagtattctttttttttcttaa660
cgaccgaccaaggttaaaaaaagaaaggaggacgagatacaggggcatgactgtaattgt720
acataagatctgatctttaaaccctaggtttccttcgcatcagcaactataaataattct780
gagtgccactcttcttcattcctagatctttcgccttatcgctttagctgaggtaagcct840
ttctatacgcatagacgctctcttttctcttctctcgatcttcgttgaaacggtcctcga900
tacgcataggatcggttagaatcgttaatctatcgtcttagatcttcttgattgttgaat960
tgagcttctaggatgtattgtatcatgtgatggatagttgattggatctctttgagtgaa1020
ctagctagctttcgatgcgtgtgatttcagtataacaggatccgatgaattatagctcgc1080
ttacaattaatctctgcagatttattgtttaatcttggatttgatgctcgttgttgatag1140
aggatcgtttatagaacttattgattctggaattgagcttgtgtgatgtattgtatcatg1200
tgatcgatagctgatggatctatttgagtgaactagcgtacgatcttaagatgagtgtgt1260
attgtgaactgatgattcgagatcagcaaaacaagatctgatgatatcttcgtcttgtat1320
gcatcttgaatttcatgattttttattaattatagctcgcttagctcaaaggatagagca1380
ccacaaaattttattgtggtagaaatcggttcgattccgatagcagcttactgtgatgaa1440
tgattttgagatttggtatttgatatatgtctactgtgttgaatgatcgtttatgcattg1500
tttaatcgctgcagatttgcattgacaagtagcc1534
<210>3
<211>228
<212>dna
<213>arabidopsisthaliana
<400>3
atggcgcaagttagcagaatctgcaatggtgtgcagaacccatctcttatctccaatctc60
tcgaaatccagtcaacgcaaatctcccttatcggtttctctgaagacgcagcagcatcca120
cgagcttatccgatttcgtcgtcgtggggattgaagaagagtgggatgacgttaattggc180
tctgagcttcgtcctcttaaggtcatgtcttctgtttccacggcgtgc228
<210>4
<211>253
<212>dna
<213>agrobacteriumtumefaciens
<400>4
gatcgttcaaacatttggcaataaagtttcttaagattgaatcctgttgccggtcttgcg60
atgattatcatataatttctgttgaattacgttaagcatgtaataattaacatgtaatgc120
atgacgttatttatgagatgggtttttatgattagagtcccgcaattatacatttaatac180
gcgatagaaaacaaaatatagcgcgcaaactaggataaattatcgcgcgcggtgtcatct240
atgttactagatc253
<210>5
<211>22
<212>dna
<213>artificialsequence
<220>
<223>引物1
<400>5
ggtgtgcaggtgaagtctgaag22
<210>6
<211>21
<212>dna
<213>artificialsequence
<220>
<223>引物2
<400>6
ctgtaggtgattggcgttgga21
<210>7
<211>27
<212>dna
<213>artificialsequence
<220>
<223>探针1
<400>7
cggtgatcgtcttccagttaccttgcg27
- 还没有人留言评论。精彩留言会获得点赞!