一种改良酚抽提总RNA的方法与流程
本发明属于基因工程技术领域,具体涉及一种改良酚抽提总rna的方法。
背景技术:
随着分子生物学的不断发展,高质量rna样品是很多实验的关键所在。而一些实验如逆转录pcr(rt-pcr)、基因芯片等,更需要高纯度高质量的rna样品。稳定高效的rna提取方法对于相关实验研究至关重要。
最为经典的抽提rna的方法当属“酚抽提法”,然而,目前学术界对于酚抽提过程中ph值的定义并不明确,甚至有些错误的认识。《分子克隆实验指南》(第三版),j.萨姆布鲁克,d.w.拉塞尔著,科学出版社2002,第1587页提到所谓酚相的ph值,但实际上酚是一种有机溶剂,并非水溶液,所以酚相的ph值是没有意义的。
一种常用于抽提rna的“酸性酚”,是使用固定ph值的酸性缓冲液(醋酸钠或者柠檬酸钠缓冲液)对水饱和酚进行反复的平衡,直至最终平衡之后的水相缓冲液ph值不再变化。这种“酸性酚”制备十分费时费力,而且在实际使用中,这种“酸性酚”对于去除rna样品中基因组dna的残留效果也并不稳定。
如何利用酚抽提方法,在合适的条件下精准地将dna和rna分离,成为了目前亟待解决的问题。
技术实现要素:
基于以上背景,本发明提供了一种改良酚抽提总rna的方法,通过裂解细菌菌体、第一次酚抽提获得总核酸,再使用ph值为3.85±0.10的酸性醋酸钠溶液与总核酸混合,最后通过第二次酚抽提纯化出不含基因组dna的总rna。
本发明采取的技术方案为:
一种改良酚抽提总rna的方法,包括如下步骤:
a)使用重悬液重悬需要提取的生物材料;
b)加入与重悬液体积相同的裂解液,室温裂解3-5分钟,或65℃裂解0.5-1分钟;
c)加入与a)b)两步中溶液总体积相等的酚抽提液1,反复振荡混匀;12000r/min离心10-15分钟;吸取上清液;
d)向c)步骤所得上清液中加入两倍上清液体积的无水乙醇,上下反复颠倒,待充分沉淀;12000r/min离心10分钟;弃上清;
e)向d)步骤所得的沉淀中加入洗涤液,洗涤1~2次,再用超纯水溶解沉淀,所得即为总核酸溶液。
f)取e)步骤中的总核酸溶液,加入与总核酸溶液等体积的酸性醋酸钠溶液,以及等体积的氯化钠溶液;
g)加入同f)步骤中溶液等体积的酚抽提液2,反复混匀之后,12000r/min离心5-10分钟;吸取上清液;
h)向g)步所得的上清液中加入两倍上清液体积的无水乙醇,颠倒混匀,待沉淀完全后,12000r/min离心10分钟;弃上清;
i)加入洗涤液洗涤一次后,加入超纯水溶解沉淀,所得即为rna样品。
步骤a)中,所述重悬液为超纯水;所述生物材料为细菌菌体,菌体与重悬液的质量/体积比为20-50mg/100μl,以避免菌体过多造成纯化困难和菌体过少导致产物得率下降。
步骤b)中,所述裂解液为十二烷基硫酸钠溶液,其重量浓度为2±0.2%。选用十二烷基硫酸钠溶液作为裂解液裂解较为简单,且优于其他一些裂解法,比如异硫氰酸胍+酚作为裂解液的裂解。
步骤c)中,所述酚抽提液1为水饱和酚:氯仿:异戊醇体积比为25:24:1组成的混合液,此种比例是抽提总核酸的最佳比例,可避免在抽提过程中核酸的损失。
步骤e)中,所述洗涤液为75±5%乙醇溶液,选用75±5%乙醇溶液作为洗涤液既能有效洗涤去除盐分等杂质,同时又能避免样品在洗涤的过程中过多损失。
步骤f)中,所述酸性醋酸钠溶液为醋酸钠和醋酸组成的混合溶液,其ph为3.85±0.10;其中,醋酸钠和醋酸的摩尔浓度均为50mmol/l,
步骤f)中,所述氯化钠溶液浓度为150±0.1mol/l,此浓度的氯化钠溶液一方面可以为总核酸溶液提供一定的离子强度,又有利于提高步骤h)中乙醇沉淀rna的效率。
步骤g)中,所述酚抽提液2为水饱和酚:氯仿:异戊醇体积比为125:24:1组成的混合溶液,此种比例最适合提取rna,并能更有效吸附去除基因组dna。
本发明公开的改良酚抽提总rna的方法,采用十二烷基硫酸钠作为裂解试剂裂解生物材料,先利用第一次酚抽提法抽提样品的总核酸,总核酸中包含总rna和基因组dna,并去除生物材料的其他杂质。然后在总核酸中加入酸性醋酸钠溶液,创造酸性的水相环境,使部分核酸可被酚抽提液吸附。酚相所吸附的核酸分子量的大小与水相环境的ph值密切相关。当水相ph值较低时,大量核酸会分配到酚相当中。随着水相ph值的不断提高,分配到水相中的rna不断增多。当水相ph值更高时,基因组dna也会被抽提出来。
利用这一现象,本发明选择了ph值为3.85±0.10的酸性醋酸钠溶液,在第二次酚抽提时将总rna纯化出来,而将基因组dna分配到酚相去除。
与现有技术相比,本发明具有以下优点:
1.总rna的提取过程简单,无需使用dna酶消化去除总核酸中的基因组dna;
2.提取得到的总rna样品的纯度高,样品中残留基因组dna较少;
3.根据本发明公开的方法提取得到的rna的扩增能力较强。
附图说明
图1为实施例1和实施例2中的方法提取得到的rna的电泳结果。m:dnamarkervii;泳道1-10,从左向右分别为所加醋酸钠ph值:3.13、3.51、3.85、4.21、4.56、4.83、5.36、5.73、6.35、7.20;泳道12,抽提rna所用总核酸。
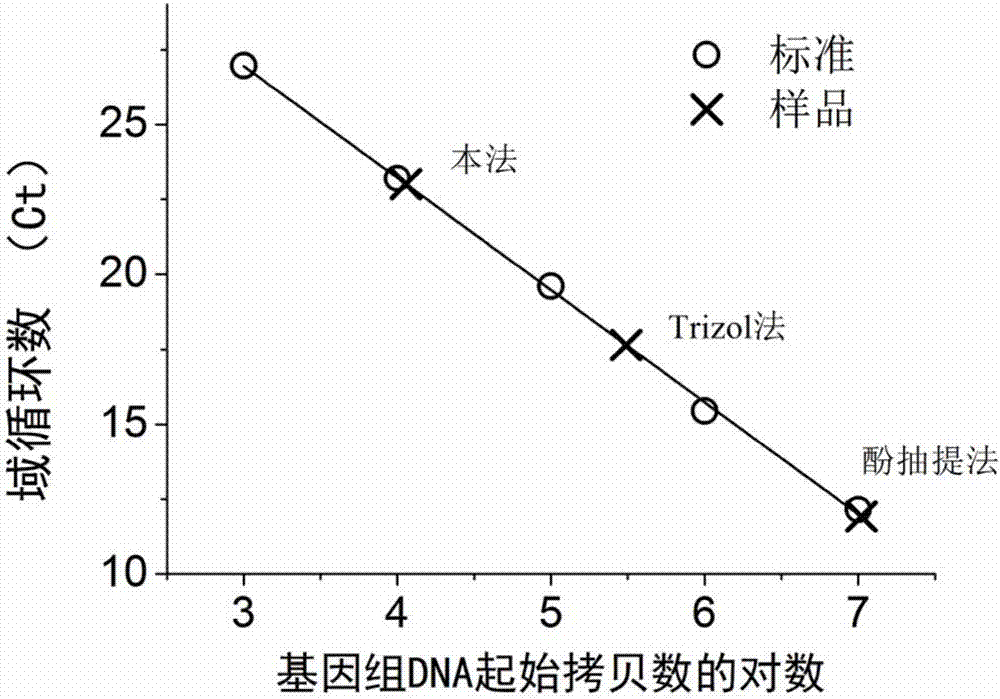
图2为实施例3中实时定量pcr检测本法提取rna样品以及其他方法所得rna样品中残留基因组dna的含量。
图3为实施例4中实时定量pcr检测本法提取rna样品以及其他方法所得rna样品的扩增能力。
具体实施方式
实施例1
a)挑取平板划线培养大肠杆菌菌株dh5α单菌落,至100mllb液体培养基,37度过夜振荡培养。离心收获菌液。1.5ml菌液离心所得菌体用100μl超纯水进行重悬,所述菌体的质量为20-50mg;
b)加入100μl重量浓度为2±0.2%的十二烷基硫酸钠溶液,充分混匀,室温裂解3分钟。
c)加入200μl酚抽提液1,所述酚抽提液1为水饱和酚:氯仿:异戊醇体积比为25:24:1组成的混合液,反复振荡混匀;12000r/min离心10-15分钟;吸取上清液200μl;
d)将c)步骤所得上清液中加入400μl无水乙醇,轻柔地颠倒混匀,待沉淀完全后,12000r/min离心10分钟;弃上清;
e)将d)步骤所得rna沉淀用75±5%乙醇溶液洗涤两次,加入100μl的超纯水溶解。所得即为总核酸溶液;
f)取e)步骤中的总核酸溶液50μl,加入50μl酸性醋酸钠溶液和50μl150±0.1mol/l氯化钠溶液;所述酸性醋酸钠溶液为醋酸钠和醋酸组成的混合溶液,其ph为3.85±0.10;
g)加入150μl酚抽提液2,所述酚抽提液2为水饱和酚:氯仿:异戊醇体积比为125:24:1组成的混合溶液,反复混匀之后,12000r/min离心10分钟;吸取上清液140μl;
h)向g)步所得的上清液中加入280μl无水乙醇,轻柔地颠倒混匀,待沉淀完全后,12000r/min离心10分钟;弃上清;
i)加入75±5%乙醇溶液洗涤一次后,加入50μl超纯水重悬沉淀,所得沉淀即为rna样品。
如图1所示:第3泳道为通过该方法纯化得到的rna,具有3条完整的核糖体rna条带(23s、16s、5s),不含有基因组dna。
实施例2:
本法与使用不同ph醋酸钠溶液酚抽提rna结果的比较:
重复实施例1中a)至e)步骤;分别取e)步骤中的总核酸溶液50μl,相应加入50μlph3.13-7.20的50mmol/l醋酸钠溶液,50μl氯化钠溶液;重复g)至i)步骤,即得到rna样品,其电泳检查结果如图1所示。
从图1中可以看出,当缓冲液ph值小于等于3.51时,纯化出来的样品仅包含部分rna;当缓冲液ph大于等于4.21值时,纯化出核酸样品包含有基因组dna;当缓冲液ph等于3.85时,即实施例1中公开的方法,纯化的样品包含完整的总rna,且不含基因组dna。
实施例3:
基因组dna残留检测:
取实施例1中i)步中所得总rna样品1微克,以及trizol法和酚抽提法所得rna样品,采用rna酶处理后,采用基因组特异性引物扩增。根据与标准样品的域循环数的对比,标准样品为已知拷贝数的大肠杆菌基因组dna,可见本法所得样品残留基因组dna最少,约每微克104拷贝。采用trizol法和酚抽提法所得样品残留基因组dna分别约为每微克105拷贝和107拷贝,如图2所示。
实施例4:
rna扩增能力检测:
取实施例1中i)步中所得总rna样品,以及对相同质量菌体样品采用trizol法和酚抽提法提取的rna样品,分别经dnasei处理后,分别作为模板,使用amv逆转录酶进行逆转录。逆转录所得cdna作为模板进行实时定量pcr反应。所用引物为大肠杆菌pgi基因的特异性引物,其引物序列为pgil:gccgttactctttgtggtc-3;pgir:gcgggttatgggtgatag。根据与标准样品的域循环数的对比,标准样品为已知拷贝数的目的基因cdna片段。可见本法和酚抽提法所提取的rna扩增能力较强,而trizol法所提取的rna扩增能力较弱,说明trizol法不适合提取细菌样品的rna,结果如图3所示。
上述参照实施例对一种改良酚抽提总rna的方法进行的详细描述,是说明性的而不是限定性的,可按照所限定范围列举出若干个实施例,因此在不脱离本发明总体构思下的变化和修改,应属本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!