机械破碎法提取霉菌孢子DNA的方法与流程
本发明涉及一种机械破碎法提取霉菌孢子dna的方法。
背景技术:
虽然关于dna的提取方法诸多,很多方法也已经日趋成熟,但是对于细胞壁成分复杂的真菌,这些常用dna提取方法都有局限性,真菌中富含的多糖、色素、核酸酶等物质使得dna的提取和分离更加困难,特别是像霉菌孢子这类含有较坚硬的孢子壁的dna提取更受限制。
另一方面,由于测序技术的发展,已经改变了我们传统的大样本细胞测序方式,也由对一个细胞群体的分析转变成了对单个细胞的分析,能够给我们提供更多有价值的研究,如在霉菌培养皿的不同位置,可能由于营养物质、霉菌数量等原因的不同,不同位置霉菌的基因组成不尽相同。传统方法要求大量样品才能提取dna,使现存的霉菌孢子dna提取方法不能满足这种测序条件。
技术实现要素:
为解决上述技术问题,本发明提供一种机械破碎法提取霉菌孢子dna的方法。
本发明利用机械法对霉菌孢子壁进行破碎,破碎后再结合柱纯化法进行dna的提取、纯化,而后通过实时荧光定量pcr和凝胶电泳检测提取效果的优劣,并依此建立精准提取霉菌孢子dna的技术体系。
本发明技术方案如下:
一种机械破碎法提取霉菌孢子dna的方法,包括:取霉菌孢子液,加入玻璃珠子(以下简称珠子),进行机械破碎处理,然后进行dna提取。
如无特殊指明,本发明所述机械破碎主要是指研磨处理。
进一步地,所述霉菌孢子液中孢子数量≥1×102个/ml。
更进一步地,所述霉菌孢子液中孢子数量≥5×107个/ml。
进一步地,以1ml霉菌孢子液计,机械破碎处理过程中所用玻璃珠子数量为10-50颗,玻璃珠子大小(指直径,下同)为1-3mm,机械破碎处理(研磨)时间为(1×5)min-(5×5)min。
其中,(1×5)min是指机械破碎(研磨)5min后即拿出放置冰上降温至少30s,共进行该操作1次;(5×5)min是指机械破碎(研磨)5min后即拿出放置冰上降温至少30s,共进行该操作5次。
在本发明的一个实施方案中,以1ml霉菌孢子液计,玻璃珠子数量为40颗,玻璃珠子大小为1-3mm,机械破碎处理(研磨)时间为5min。
在本发明的一个实施方案中,以1ml霉菌孢子液计,玻璃珠子大小为3mm,机械破碎处理(研磨)时间为5min,玻璃珠子数量为10-50颗,优选为30颗。
在本发明的一个实施方案中,以1ml霉菌孢子液计,玻璃珠子数量为30颗,玻璃珠子大小为3mm,机械破碎处理(研磨)时间为(1×5)min-(5×5)min,优选为3×5min。
在本发明的一个较佳实施方案中,以1ml霉菌孢子液计,所述霉菌孢子液中孢子数量≥5×107个/ml,玻璃珠子数量为30颗,玻璃珠子大小为3mm,机械破碎处理(研磨)时间为(2×5)min。
在本发明的另一个较佳实施方案中,以1ml霉菌孢子液计,当所述霉菌孢子液中孢子数量不少于1×102个/ml时,玻璃珠子数量为20颗,玻璃珠子大小为3mm,机械破碎处理(研磨)时间为(2×5)min。
具体的,所述dna提取包括如下步骤:
以1ml经机械破碎处理(研磨)的霉菌孢子液计,
(1)向管中加入20μlproteinasek溶液,混匀;
(2)加入220μl缓冲液gb,振荡15sec,70℃放置10min,溶液应变清亮,简短离心以去除管盖内壁的水珠;
(3)加220μl无水乙醇,充分振荡混匀15sec,此时可能会出现絮状沉淀,简短离心以去除管盖内壁的水珠;
(4)将上一步所得溶液和絮状沉淀都加入一个吸附柱cb3中(吸附柱放入收集管中),12,000rpm离心30sec,倒掉废液,将吸附柱cb3放入收集管中;
(5)向吸附柱cb3中加入500μl缓冲液gd,12,000rpm离心30sec,倒掉废液,将吸附柱cb3放入收集管中;
(6)向吸附柱cb3中加入600μl漂洗液pw,12,000rpm离心30sec,倒掉废液,吸附柱cb3放入收集管中;
(7)重复操作步骤(6);
(8)将吸附柱cb3放回收集管中,12,000rpm离心2min,倒掉废液;将吸附柱cb3置于室温放置数分钟,以彻底晾干吸附材料中残余的漂洗液;
(9)将吸附柱cb3转入一个干净的离心管中,向吸附膜的中间部位悬空滴加50μl洗脱缓冲液te,室温放置5min,12,000rpm离心2min,将溶液收集到离心管中。
荧光定量pcr程序设置为:1.95℃变性5min后;于95℃,30s,60℃,30s;68℃,30s;39个循环后,65℃to95℃,increment0.5℃。pcr反应体系为:水10.75μl,realtimemix11.25μl,引物各0.5μl,dna模板2μl。引物为asp-f(ctgtccgagcgtcattg)和its-r(tcctccgcttattgatat)。
进一步地,所述霉菌孢子为黑曲霉孢子。
本发明所用菌种及试剂均可市售购得。
霉菌孢子机械法提取dna技术实则上是在给霉菌孢子的精准研究提供有力的保障,在精准提取出高质量、高效率的霉菌孢子dna后,就可以研究霉菌孢子个体间的差异。本研究得出的优化后的霉菌孢子dna提取方法,不仅具有高效的提取效率、操作便捷易控、无毒无害等优点,而且最重要的是提取出的dna质量良好,对后续的分子生物学研究提供了可靠的研究基础和有力地保证。
本发明具有以下优点:
1、具有高效的dna提取效率。
2、具有操作便捷易控优点。
3、具有无毒无害优点。
4、首次将霉菌孢子精确到102个孢子进行dna提取。
5、可把霉菌孢子从大量细胞的群体性研究转向对单细胞或少量细胞的精准研究。
6、提取出的dna质量良好,能够满足后续的测序,对后续的分子生物学研究提供了可靠的研究基础和有力地保证。
附图说明
图1为珠子大小单因素试验定量检测结果;
图2为珠子数量单因素试验定量检测结果;
图3为研磨时间单因素试验定量检测结果;
图4为大量孢子dna物理破碎正交试验琼脂糖凝胶电泳图;
图5为大量孢子dna物理正交试验定量检测结果;
图6为少量孢子dna半巢式pcr定量结果;
图7表示少量孢子梯度稀释的线性相关性;
图8为少量孢子dna梯度稀释的琼脂糖凝胶电泳图;
图9为少量孢子dna正交试验半巢式pcr定量结果;
图10为少量孢子dna正交试验的琼脂糖凝胶电泳图。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件,或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可通过正规渠道商购买得到的常规产品。若未特别指明,以下均按照常规实验条件,如sambrook等分子克隆实验手册(sambrookj&russelldw,molecularcloning:alaboratorymanual,2001),或按照制造厂商说明书建议的条件。
实施例
1.实验材料
以下实验所使用的霉菌孢子主要为黑曲霉孢子,黑曲霉菌种购于上海复祥生物公司,保存于含有15%甘油的0.9%无菌氯化钠溶液中,以冷冻干燥菌种为0代,实验中主要为第3、4代。按本领域常规方法培养。
2.以下实验所使用的霉菌孢子机械破碎方法:取霉菌孢子液,加入玻璃珠子(以下简称珠子),进行机械破碎(研磨)处理,然后进行dna提取。
3.以下实验所使用的dna提取方法:
(1)向管中加入20μlproteinasek溶液,混匀;
(2)加入220μl缓冲液gb,振荡15sec,70℃放置10min,溶液应变清亮,简短离心以去除管盖内壁的水珠;
(3)加220μl无水乙醇,充分振荡混匀15sec,此时可能会出现絮状沉淀,简短离心以去除管盖内壁的水珠;
(4)将上一步所得溶液和絮状沉淀都加入一个吸附柱cb3中(吸附柱放入收集管中),12,000rpm离心30sec,倒掉废液,将吸附柱cb3放入收集管中;
(5)向吸附柱cb3中加入500μl缓冲液gd,12,000rpm离心30sec,倒掉废液,将吸附柱cb3放入收集管中;
(6)向吸附柱cb3中加入600μl漂洗液pw,12,000rpm离心30sec,倒掉废液,吸附柱cb3放入收集管中;
(7)重复操作步骤(6);
(8)将吸附柱cb3放回收集管中,12,000rpm离心2min,倒掉废液;将吸附柱cb3置于室温放置数分钟,以彻底晾干吸附材料中残余的漂洗液;
(9)将吸附柱cb3转入一个干净的离心管中,向吸附膜的中间部位悬空滴加50μl洗脱缓冲液te,室温放置5min,12,000rpm离心2min,将溶液收集到离心管中。
荧光定量pcr程序设置为:1.95℃变性5min后;于95℃,30s,60℃,30s;68℃,30s;39个循环后,65℃to95℃,increment0.5℃。pcr反应体系为:水10.75μl,realtimemix11.25μl,引物各0.5μl,dna模板2μl。引物为asp-f(ctgtccgagcgtcattg)和its-r(tcctccgcttattgatat)。
4、具体实验方案
4.1实验材料,同上。
4.2物理法对孢子破壁有效性的研究
在物理法正交试验开始前,首先选取了珠子大小、珠子的数量和珠子研磨时间这三个与破碎效果相关性高的三个因素,研究这三个因素对dna提取的影响及有效性。本节试验中所取菌液浓度均为5×107个/ml,每次取1ml试验,研磨仪操作规格为28frequency/s。
(1)珠子的大小
在珠子大小单因素试验中,分别有1mm、2mm和3mm规格珠子,珠子数量固定为每组40颗,研磨时间固定为5min。6号为不经物理破碎直接做后续试剂盒提取处理的原液对照,具体参数如下表进行单因素试验。
珠子大小的单因素试验
菌液在物理破碎完以后,留一定量的菌液直接用血球计数板进行计数,其他菌液直接进行后续的dna提取,具体操作同上。
(2)珠子的数量
根据(1)的实验结果,确定珠子大小为3mm时破碎效果最佳,所以固定珠子大小为3mm,仍然固定研磨时间为5min研究单因素试验。6号为不经物理破碎直接做后续试剂盒提取处理的原液对照,具体参数如下表进行单因素试验。
珠子数量的单因素试验
菌液在物理破碎完以后,留一定量的菌液直接用血球计数板进行计数,其他菌液直接进行后续的dna提取,同上(1),然后对提取后的dna溶液进行纯度的测量和琼脂糖凝胶电泳验证,再用提取后的dna产物进行rt-pcr反应,反应体系同上(1)。
(3)研磨的时间
根据(2)和(3)的实验结果,固定珠子大小为3mm、珠子数量为30颗,进行研磨时间的单因素试验。考虑到物理法摩擦生热,温度过高可能会影响核酸提取质量和数量,所以本方法中研磨5min后即拿出放置冰上降温30s,其中6号为不经物理破碎直接做后续试剂盒提取处理的原液对照,具体参数参照下表进行单因素试验。
研磨时间的单因素试验
菌液在物理破碎完以后,留一定量的菌液直接用血球计数板进行计数,其他菌液直接进行后续的dna提取,同上(1),然后对提取后的dna溶液进行纯度的测量和琼脂糖凝胶电泳验证,再用提取后的dna产物进行rt-pcr反应,反应体系同上(1)。
4.3正交法研究各因素对物理法大量孢子dna提取的影响
为了得到物理法多因素试验、最优水平组合的高效率试验设计,本研究使用正交试验方法进行试验。基于4.2物理单因素试验结果,设计一个三因素三水平的正交试验进行试验,其中10号为不经物理破碎直接做后续试剂盒提取处理的原液对照,具体参数参照下表进行正交试验。
大量孢子dna提取物理正交试验
菌液在物理破碎完以后,留一定量的菌液直接用血球计数板进行计数,其他菌液直接进行后续的dna提取,同上,然后对提取后的dna溶液进行纯度的测量和琼脂糖凝胶电泳验证,再用提取后的dna产物进行rt-pcr反应,反应体系同上。
4.4少量孢子dna提取阈值试验
在进行少量孢子dna提取前,先进行了阈值试验。引物换成了一对半半巢式引物,第一次半巢式pcr用pfka-qian-f(tcagtgacgtactggttgcc)和pfka-zhong-r(aatgacgaatccacgctggt),第二次半巢式pcr用pfka-qian-f和pfka-qian-r(ccaccagaggtcaagacacc)。
分别设置了1×104个、1×103个、1×102个、1×101个孢子四个梯度。前两组是由高浓度菌液稀释得到,具体做法是对浓度为每毫升5×107个孢子悬浮液进行梯度稀释,浓度分别稀释至2.5×104个/ml、2.5×103个/ml,分别取400μl菌液至离心管即可得到1×104个、1×103个孢子溶液。由于1×102个、1×101个孢子溶液浓度太低,梯度稀释的方法带来的误差太大,所以首次借鉴单细胞挑选的方法。具体做法是把一定浓度的孢子菌液用干净的枪头吸取了滴到灭过菌的载玻片上,把载玻片放置在显微镜下,吸取出一定量的孢子至0.05%(v/v)吐温80和0.9%无菌nacl溶液中,使孢子能更好的溶于溶液中。
在该少量孢子dna提取阈值试验中,预处理过程采用的是大量孢子dna提取正交试验中得到的最优法处理样品,即3mm、30颗、5min×2。
物理破碎后,直接吸取菌液进行第一轮半巢式pcr反应,第一轮半巢式pcr反应完的定量产物作为第二轮半巢式pcr的dna模板。第一次半巢式pcr和第二次半巢式pcr具体体系如下表所示,加完样放入荧光定量pcr中反应。
半巢式pcr体系
因为第一次半巢式pcr片段长度较长,所以延长延伸时间为1min,具体程序设置为:95°变性5min后;于95°,30s,60°,30s;68°,1min;40循环后,65°to95°,increment0.5°。第二次半巢式pcr程序为:95°变性5min后;于95°,30s,60°,30s;68°,30s;40循环后,65°to95°,increment0.5°。第二次半巢式pcr后结合溶解峰和凝胶电泳跑胶大小确认是否为目的基因。
4.5研究物理正交法对少量孢子dna提取的影响
在得到少量孢子dna提取最低阈值后,取最低浓度的菌液作为少量孢子dna提取浓度,吸取400μl菌液于离心管中,以大量孢子dna物理正交试验的三因素三水平的进行试验,试验参数如下表。
少量孢子dna提取物理正交试验
菌液在物理破碎完以后,12,000rpm离心2min,吸取上清液作为第一轮半巢式pcr的dna模板。第一轮反应完后的半巢式pcr定量产物作为第二轮半巢式pcr的dna模板,第二次半巢式pcr后结合溶解峰和凝胶电泳跑胶大小确认是否为目的基因。半巢式pcr反应体系和反应程序同4.4。
5、实验结果
5.1物理法对孢子破壁有效性的研究
(1)珠子大小
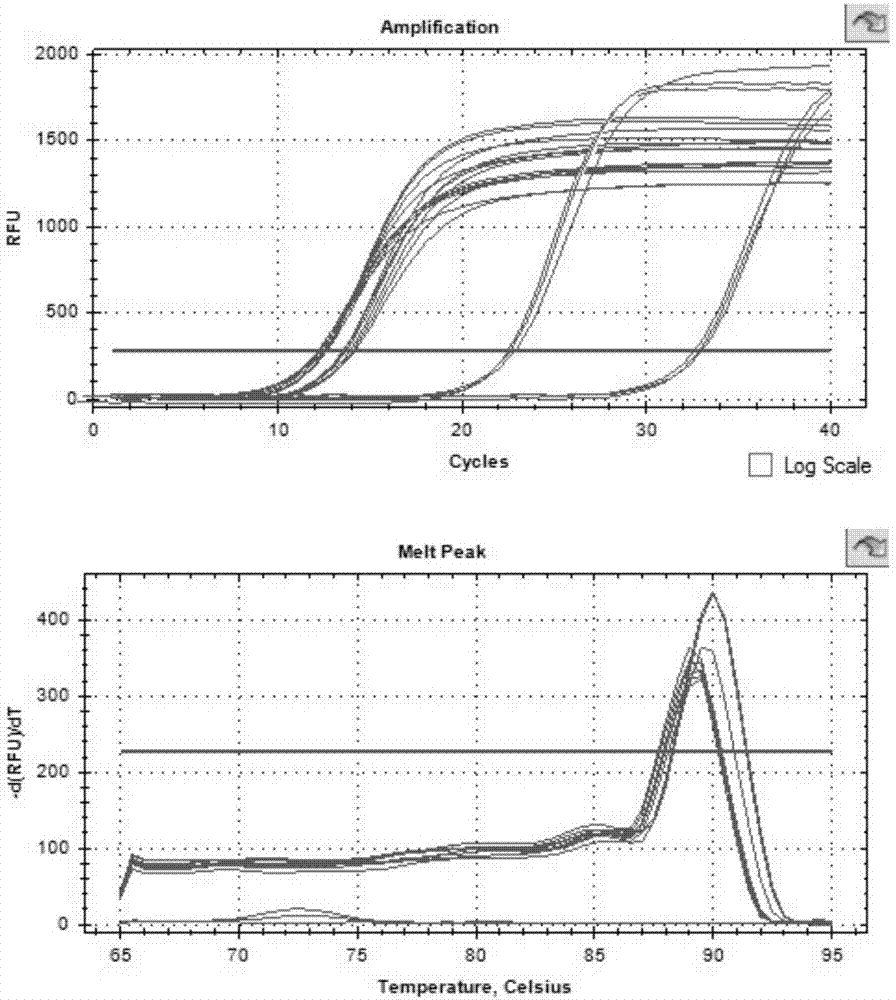
在珠子大小的单因素试验中,通过用血球计数板计数破壁后的溶液得到剩余孢子数和孢子破碎壁如下所示(初始浓度为5×107个/ml),各组珠子对孢子dna提取的定量检测结果如下表及图1所示。图1中,rfu:相对荧光单位;cycle:循环数;temperature:温度;celsius:摄氏度;d(rfu)/dt:求导;meltpeak:溶解峰。
珠子大小单因素试验的破壁率
注:表中上标字母为邓肯氏新复极差测验结果(α=0.05),不同字母代表两组数据之间有显著性差异。
珠子大小单因素试验定量检测结果
注:表中上标字母为邓肯氏新复极差测验结果(α=0.05),不同字母代表两组数据之间有显著性差异。
由以上分析可知,物理破碎的珠子大小因素对提取效率有显著性影响。在珠子数量固定为40颗,研磨时间固定为5min时,第2组即珠子大小为3mm时,破碎效果最佳,破壁率达到64.20%,第6组原液在试剂盒提取中也破碎了一部分,溶解温度都在89.5-90℃。
(2)珠子数量
在珠子数量的单因素试验中,通过用血球计数板计数破壁后的溶液得到剩余孢子数和孢子破碎壁如下所示(初始浓度为5×107个/ml),各组珠子对孢子dna提取的定量检测结果如下表及图2所示。
珠子数量单因素试验的破壁率
注:表中上标字母为邓肯氏新复极差测验结果(α=0.05),不同字母代表两组数据之间有显著性差异。
珠子数量单因素试验定量检测结果
注:表中上标字母为邓肯氏新复极差测验结果(α=0.05),不同字母代表两组数据之间有显著性差异。
由以上分析可知,物理破碎的珠子数量因素对提取效率有显著性影响。在珠子大小固定为3mm,研磨时间固定为5min时,第3组即珠子数量为30颗时,破碎效果最佳,破壁率达到66.87%,第6组原液在试剂盒提取中也破碎了一部分,溶解温度都在89.5-90℃。
(3)研磨时间
在研磨时间的单因素试验中,通过用血球计数板计数破壁后的溶液得到剩余孢子数和孢子破碎壁如下所示(初始浓度为5×107个/ml),各组珠子对孢子dna提取的定量检测结果如下表及图3所示。
研磨时间单因素试验的破壁率
注:表中上标字母为邓肯氏新复极差测验结果(α=0.05),不同字母代表两组数据之间有显著性差异。
研磨时间单因素试验定量检测结果
注:表中上标字母为邓肯氏新复极差测验结果(α=0.05),不同字母代表两组数据之间有显著性差异。
由以上分析可知,物理破碎的研磨时间因素对提取效率有显著性影响。在珠子大小固定为3mm,珠子数量固定为30颗时,第3组即研磨时间为5min×3时,破碎效果最佳,破壁率达到68.42%,第6组原液在试剂盒提取中也破碎了一部分,溶解温度都在89.5-90℃。
5.2正交法研究各因素对物理法大量孢子dna提取的影响
在大量孢子dna提取试验中,从浓度、纯度、和完整性三个方面对正交试验结果进行分析,其中以浓度为主要条件优化指标、纯度和完整性为辅。浓度大小以定量检测结果的cq值反应,纯度通过测量a260/280的值反应,完整性通过琼脂糖凝胶电泳反应。
dna产物琼脂糖凝胶电泳图如图4所示,由图4可知条带清晰、无明显拖尾现象,说明dna完整性较好。
定量检测结果和dna纯度具体数值如下表及图5所示,可见物理破碎法这9组正交试验中,第4组的cq值最低,即dna浓度最高,第10组原液在试剂盒提取中也破碎了一部分,所有纯度都高,样品溶解温度都稳定在89.5-90℃。
大量孢子dna物理破碎正交试验定量检测结果和dna纯度
注:表中上标字母为邓肯氏新复极差测验结果(α=0.05),不同字母代表两组数据之间有显著性差异。
我们定义珠子大小为a因素,珠子数量为b因素,研磨时间为c因素。根据以上结果进行正交分析,得出a因素1水平即珠子1mm时所对应的试验指标之和k(a1)等于38.67,平均值k(a1)等于12.89,;a因素2水平即珠子3mm时所对应的试验指标之和k(a2)等于31.03,平均值k(a2)等于10.35,;a因素3水平即珠子2mm时所对应的试验指标之和k(a3)等于48.53,平均值k(a3)等于16.18,;由于cq值与核酸含量成反比,所以各水平对试验指标的影响大小为:k(a2)>k(a1)>k(a3),即3mm为a因素的最优水平。b因素1水平即珠子数量为20颗时,所对应的试验指标之和k(b1)等于41,平均值k(b1)等于13.67,;b因素2水平即珠子数量为30颗时,所对应的试验指标之和k(b2)等于36.50,平均值k(b2)等于10.35,;b因素3水平即珠子数量为40颗时,所对应的试验指标之和k(b3)等于40.75,平均值k(b3)等于13.58,;各水平对试验指标的影响大小为:k(b2)>k(b3)>k(b1),即珠子数量30颗为b因素的最优水平。c因素1水平即研磨时间为5min×2时,所对应的试验指标之和k(c1)等于36.88,平均值k(c1)等于12.30,;c因素2水平即研磨时间为5min×3时,所对应的试验指标之和k(c2)等于39.23,平均值k(c2)等于13.07,;c因素3水平即研磨时间为5min×4时,所对应的试验指标之和k(c3)等于39.73,平均值k(c3)等于13.24,;各水平对试验指标的影响大小为:k(c1)>k(c2)>k(c3),即5min×2颗为b因素的最优水平。经正交试验分析,可知a2b2c1为本试验的最优水平组合,即大量孢子dna物理破碎正交试验最优结果为:3mm、30颗、5min×2。
在纯度方面,所有样品的纯度都在1.8-1.9之间,纯度相对较高,有利于下游实验的进行。完整性方面,通过琼脂糖凝胶电泳可看出,dna完整性较好,无严重拖尾现象。
5.3少量孢子dna提取阈值试验
少量孢子dna提取阈值试验中,半巢式pcr定量结果如下表及图6所示(前两张图为第一轮半巢式pcr、后两张为第二轮半巢式pcr结果)。
少量孢子dna半巢式pcr定量结果
从第一轮半巢式pcr定量结果的cq值可以看出,随着孢子数的降低,cq值在逐渐增加,即dna浓度随着孢子数的减少而降低。从右边的溶剂峰图可以看出,阳性和试验样品都有两个溶解峰,一个在目标产物的溶解温度(88.5-89.5℃)处,一个是阴性溶解温度(79-79.5℃)。由第二轮半巢式pcr定量结果可看出,dna浓度与cq值呈线性相关,右边的溶解温度中,1、2、3和原液的溶解温度都在87℃,而4号样品的溶解温度为90℃。
由图7可知,第4组数与前3组数据的线性关系不好,前3组数据为数值的标准曲线相关系数r2=0.9998,回归方程为:y=-4.3975x+41.55,线性相关性良好。定量产物的琼脂糖凝胶电泳跑胶验证,结果如图8。
由图8可见,1、2、3号和阳性样品在引物大小为303bp处有明显条带,4号和阴性无条带,结合以上结果,把少量孢子dna提取的浓度定为1×102个孢子。
5.4研究物理正交法对少量孢子dna提取的影响
少量孢子dna提取物理正交试验中,半巢式pcr定量结果如下表及图9所示(前两张图为第一轮半巢式pcr、后两张为第二轮半巢式pcr结果)。
少量孢子dna正交试验半巢式pcr定量结果
从第一轮半巢式pcr定量结果的cq值可以看出,样品间的cq值相差不大。而从右边的溶剂峰图可以看出,阳性和试验样品的溶解峰较有规律,在78.5℃处有一个大溶解峰,在88.5℃左右有一个小峰。从第二轮半巢式pcr定量结果的cq值可以看出,正交试验的9组数据中,第4组的cq值最低,即dna浓度最高,而后依次是6、8、1、2、3、7、5、9,所有样品溶解温度都稳定在86.5-87℃。定量产物的琼脂糖凝胶电泳图如10所示,由跑胶结果可知,1-9号条带大小与目标产物大小一致。
再根据结果进行正交分析,得出a因素1水平即珠子1mm时所对应的试验指标之和k(a1)等于36.08,平均值k(a1)等于12.02,;a因素2水平即珠子3mm时所对应的试验指标之和k(a2)等于31.28,平均值k(a2)等于10.43,;a因素3水平即珠子2mm时所对应的试验指标之和k(a3)等于36.01,平均值k(a3)等于12.00,;由于cq值与核酸含量成反比,所以各水平对试验指标的影响大小为:k(a2)>k(a3)>k(a1),即3mm为a因素的最优水平。b因素1水平即珠子数量为20颗时,所对应的试验指标之和k(b1)等于34.36,平均值k(b1)等于11.45,;b因素2水平即珠子数量为30颗时,所对应的试验指标之和k(b2)等于35.05,平均值k(b2)等于11.68,;b因素3水平即珠子数量为40颗时,所对应的试验指标之和k(b3)等于35.15,平均值k(b3)等于11.72,;各水平对试验指标的影响大小为:k(b1)>k(b2)>k(b3),即珠子数量20颗为b因素的最优水平。c因素1水平即研磨时间为5min×2时,所对应的试验指标之和k(c1)等于30.32,平均值k(c1)等于10.11,;c因素2水平即研磨时间为5min×3时,所对应的试验指标之和k(c2)等于34.89,平均值k(c2)等于11.63,;c因素3水平即研磨时间为5min×4时,所对应的试验指标之和k(c3)等于38.16,平均值k(c3)等于12.72,;各水平对试验指标的影响大小为:k(c1)>k(c2)>k(c3),即5min×2为c因素的最优水平。经正交试验分析,可知a2b1c1为本试验的最优水平组合,即少量孢子dna物理破碎正交试验最优结果为:3mm、20颗、5min×2。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
序列表
<110>中国农业大学
<120>机械破碎法提取霉菌孢子dna的方法
<130>khp171114533.6
<160>5
<170>patentinversion3.3
<210>1
<211>17
<212>dna
<213>人工序列
<400>1
ctgtccgagcgtcattg17
<210>2
<211>18
<212>dna
<213>人工序列
<400>2
tcctccgcttattgatat18
<210>3
<211>20
<212>dna
<213>人工序列
<400>3
tcagtgacgtactggttgcc20
<210>4
<211>20
<212>dna
<213>人工序列
<400>4
aatgacgaatccacgctggt20
<210>5
<211>20
<212>dna
<213>人工序列
<400>5
ccaccagaggtcaagacacc20
- 还没有人留言评论。精彩留言会获得点赞!