成肌细胞分化相关的长非编码RNA及其应用的制作方法
本发明涉及生理和生物医学领域,具体涉及一类具有调节成肌细胞分化功能的长链非编码rna及其应用。
背景技术:
长链非编码rna(lncrna)是一类转录本长度大于200bp,具有相对较长的核苷酸链的非编码rna。lncrna具有类型多、作用模式多和数量多等特点,因此它蕴含的信息十分丰富,其参与表达调控的分子机制也多种多样,主要从表观遗传学、转录水平以及转录后水平三个层面实现对基因表达的调控。lncrna可能主要具有以下几个方面的功能:(1)通过在蛋白编码基因上游启动子区发生转录,干扰下游基因的表达;(2)通过抑制rna聚合酶ii或者介导染色质重构以及组蛋白修饰,影响下游基因表达;(3)通过与蛋白编码基因的转录本形成互补双链,进而干扰mrna的剪切,从而产生不同的剪切形式;(4)通过与蛋白编码基因的转录本形成互补双链,进一步在dicer酶作用下产生内源性的sirna,调控基因的表达水平;(5)通过结合到特定蛋白质上,lncrna转录本能够调节相应蛋白的活性;(6)作为结构组分与蛋白质形成核酸蛋白质复合体;(7)通过结合到特定蛋白上,改变该蛋白的胞质定位;(8)作为小分子rna,如mirna、pirna的前体分子转录。正因为lncrna可以从转录和转录后水平参与蛋白质编码基因的调控,这些基因包括疾病发生相关基因及发育相关基因等,通过参与调控蛋白质编码基因,lncrna既能影响细胞内信号转导途径,也能影响生物体发育过程中的信号转导通路。目前已报道lncrna会对多种疾病的发生和发展产生影响,包括神经系统的疾病,心血管疾病以及多种肿瘤癌症等疾病。
近年来对长非编码rna的研究引起了广泛关注,而与成肌细胞分化相关的lncrna研究尚非常有限。探索新的在成肌分化中扮演重要角色的lncrna,不仅会揭示调控成肌细胞功能的重要机制,还将提供新的检测或治疗靶点,是相关疾病研究中亟待开拓的重要科学问题。
技术实现要素:
本发明涉及以下按顺序编号的段落中定义的主题:
1、一种分离的多聚核酸分子,其特征在于所述核酸分子选自:
1)具有seqidno:01所示核酸序列的多聚核酸分子;
2)具有seqidno:02所示核酸序列的多聚核酸分子;
3)具有seqidno:03所示核酸序列的多聚核酸分子;
4)具有1)、2)或3)所示核酸序列的部分核酸序列的多聚核酸分子;
5)具有与1)、2)、3)或4)所述多聚核酸分子序列90%或以上同源性核酸序列的多聚核酸分子;
6)具有与1)、2)或3)所述多聚核酸分子序列互补核酸序列的多聚核酸分子。
2、段落1所述的多聚核酸分子作为分化标志物的应用。
3、段落1所述的多聚核酸分子作为肌肉组织分化标志物的应用。
4、段落1所述的多聚核酸分子作为肌肉相关疾病标志物的应用。
5、段落1所述的多聚核酸分子作为肌肉相关疾病治疗靶点的应用。
6、一种在离体样本中检测段落1所述多聚核酸分子表达水平的方法,其特征在于所述方法选自杂交法、扩增法或测序法。
7、段落6所述的方法,其特征在于离体样本选自分离的体液、淋巴结样本、或组织样本。
8、段落6所述的方法,其特征在于所述杂交法选自斑点杂交、northern杂交、或基因芯片杂交。
9、段落6所述的方法,其特征在于所述扩增法选自半定量rt‐pcr、实时荧光定量rt‐pcr、taqmanpcr。
10、段落9所述的方法,其特征在于所使用的引物组合选自seqidno:113‐seqidno:118所示的核酸序列。
11、段落6所述的方法,其特征在于所述测序法选自双脱氧终止测序法、或高通量测序。
12、一种检测系统,其特征在于包含段落10所述的引物组合。
13、段落12所述的检测系统,其特征在于该系统还包括逆转录酶及其反应缓冲液、四种脱氧核糖核苷酸底物、dna聚合酶、荧光定量pcr反应缓冲液、人工合成的内参及正常人对照品。
14、段落6‐13任一项所述的方法或系统在分化标志物检测中的应用。
15、段落6‐13任一项所述的方法或系统在肌肉组织分化标志物检测中的应用。
16、段落6‐13任一项所述的方法或系统在肌肉相关疾病标志物检测中的应用。
17、段落14‐16任一项所述的应用,其特征在于包含以下步骤:1)测定段落1所述的多聚核酸分子在离体样本中的水平;2)测定段落1所述的多聚核酸分子在参考样本中的水平;3)比较多聚核酸分子在离体样本和参考样本中的水平。
18、一种能降低段落1所述多聚核酸分子表达水平的抑制剂。
19、段落18所述的抑制剂,其特征在于所述抑制剂为小干扰核酸分子。
20、段落19所述的抑制剂,其特征在于所述小干扰核酸分子序列选自seqidno:201‐seqidno:206所示的核酸序列。
21、段落19‐20任一项所述的抑制剂,其特征在于所述小干扰核酸分子包含如下修饰中的至少一种:1)对核酸序列中连接核苷酸的磷酸二酯键的修饰;2)对核酸序列中核苷酸的核糖的2’‐oh的修饰;3)对核酸序列中核苷酸的碱基的修饰。
22、段落18所述的抑制剂,其特征在于所述抑制剂为shrna表达载体。
23、段落18所述的抑制剂,其特征在于所述抑制剂为反义核酸分子。
24、一种细胞分化抑制剂,其特征在于包含段落18‐23任一项所述的至少一种抑制剂。
25、一种药物组合物,其特征在于包含段落18‐23任一项所述的至少一种抑制剂及药学上可接受的载体。
26、段落18‐25任一项所述的抑制剂在制备疾病治疗药物组合物中的应用。
一方面,本发明提供了一组分离的多聚核酸分子,该多聚核酸分子具有seqidno:01‐seqidno:03所示的全部或部分核酸序列,或与seqidno:01‐seqidno:03所示的全部或部分核酸序列具有90%或以上同源性的核酸序列,或与以上核酸序列互补的核酸序列。
另一方面,本发明提供了上述多聚核酸分子作为分化标志物的应用;优选的,本发明提供了上述多聚核酸分子作为肌肉组织分化标志物的应用;更优选的,本发明提供了上述多聚核酸分子作为肌肉组织相关疾病标志物的应用;更优选的,本发明提供了上述多聚核酸分子作为肌肉组织相关疾病治疗靶点的应用。
另一方面,本发明提供了一种在离体样本中检测上述多聚核酸分子的方法,所述离体样本包括分离的体液、淋巴结样本、或组织样本。
另一方面,本发明提供了一种在离体样本中检测上述多聚核酸分子的方法,所述检测方法包括杂交法、扩增法或测序法。具体地说,扩增法包括半定量rt‐pcr、实时荧光定量rt‐pcr、taqmanpcr;杂交法包括斑点杂交、northern杂交、或基因芯片杂交;测序法包括双脱氧终止测序法、或高通量测序。
优选的,上述pcr检测中所用的检测引物选自seqidno:113‐seqidno:118所示的核酸序列组合。
另一方面,本发明提供了一种在离体样本中检测上述多聚核酸分子的检测系统,该系统包含上述检测引物;在较佳的实施方式中,该系统还包括逆转录酶及其反应缓冲液、四种脱氧核糖核苷酸底物、dna聚合酶、荧光定量pcr反应缓冲液、人工合成的内参及正常人对照品。
另一方面,本发明提供了上述检测方法、检测试剂或检测系统在分化标志物检测中的应用。优选的,本发明提供了上述检测方法、检测试剂或检测系统在肌肉组织分化标志物检测中的应用;更优选的,本发明提供了上述检测方法、检测试剂或检测系统在肌肉组织相关疾病标志物检测中的应用;更优选的,本发明提供了上述检测方法、检测试剂或检测系统在肌肉组织相关疾病治疗中的应用。
另一方面,本发明提供了一种疾病检测及诊断方法,该方法包含以下步骤:1)测定离体样本中上述多聚核酸分子的水平;2)测定参考样本中相应多聚核酸分子的水平;3)比较多聚核酸分子在离体样本和参考样本中的水平。如果与参考样本相比,离体样本中多聚核酸分子的水平有显著改变,表明分化或疾病的存在。
如果与参考样本相比,多聚核酸分子在离体样本中的水平显著升高,表明有分化或疾病发生。“显著升高”在此指的是所述多聚核酸分子的表达水平增加至少5%,包括例如增加至少6%、7%、8%、9%、10%、15%、20%、30%、40%、50%、或更多。
另一方面,本发明提供了一种能够降低所述多聚核酸分子表达水平的抑制剂。优选的,所述抑制剂包括小干扰核酸分子(sirna)、shrna表达载体、或反义核酸分子。这些抑制剂不仅能够降低所述多聚核酸分子的表达水平,也能够改变组织分化或疾病的发生。更优选的,所述小干扰核酸分子选自seqidno:201‐seqidno:206所示的核酸序列、或其化学修饰产物。所述化学修饰为如下修饰中的至少一种:1)对核酸序列中连接核苷酸的磷酸二酯键的修饰;2)对核酸序列中核苷酸的核糖的2’‐oh的修饰;3)对核酸序列中核苷酸的碱基的修饰。
在反义核酸研究中,各种化学修饰方法很多,其中又以硫代和甲氧代修饰的研究最为全面。这两种化学修饰能够有效地抑制核酸酶对反义核酸分子的降解,保持其生物学活性;此外,硫代反义核酸还能显著提高rna酶降解其杂交rna链的活性。应当明确的是,任何能够增加反义核酸分子稳定性和提高其生物利用度的化学修饰方法都可以应用于本发明,如胆固醇修饰、peg修饰等。优选的,本发明中反义核酸分子的化学修饰包括硫代修饰、2’‐甲氧基修饰、胆固醇修饰中的一种或几种。
对于小干扰核酸(sirna)而言,所述化学修饰为本领域技术人员所公知,所述磷酸二酯键的修饰是指对磷酸二酯键中的氧进行修饰,包括硫代磷酸修饰和硼烷化磷酸盐修饰。这两种修饰均能显著提高sirna结构的稳定性,保持碱基配对的高特异性和高亲和力。
所述核糖修饰是指对核苷酸戊糖中2’‐oh的修饰,即在核糖的羟基位置引入某些取代基,例如,2’‐氟代修饰、2’‐氧甲基修饰、2’‐氧亚乙基甲氧基修饰、2,4’‐二硝基苯酚修饰、锁核酸(lna)、2’‐氨基修饰、2’‐脱氧修饰。这些修饰可以提高sirna的生物利用度、与靶序列的亲和性、以及抗核酸酶降解能力。
此外,为了促进抑制剂进入细胞,可以在以上修饰的基础上,在小干扰核酸分子或反义核酸分子中或其末端引入胆固醇、聚乙二醇等亲脂性基团,提高抑制剂的细胞膜穿透能力。
另一方面,本发明还提供了一种药物组合物,该药物组合物含有安全有效量的上述至少一种抑制剂和药学上可接受的载体或赋形剂。优选的,所述抑制剂是小干扰核酸分子或反义核酸分子。本发明提供的药物组合物可用于治疗肌肉组织分化相关的疾病。所述载体或赋形剂包括但不限于:盐水、缓冲液、葡萄糖、水、甘油、乙醇、阳离子脂质体、阳性高分子聚合物及其组合。药物制剂应与给药方式相匹配。本发明的药物组合物可以根据需要被制成多种剂型,如针剂形式,例如用生理盐水或含有葡萄糖和其他辅剂的水溶液通过常规方法进行制备的针剂。所述“有效量”是指可对人和/或动物产生功能或活性且可被人和/或动物所接受的量。所述“药学上可接受的”成分是适用于人和/或动物而无过度不良副反应(如毒性、刺激和变态反应)的成分,即有合理的效益/风险比的物质。
本发明的有益效果
本发明提供了一类与成肌细胞分化相关的长非编码rna。利用基因特异的sirna,可以抑制这类长非编码rna的表达,进而特异性地抑制成肌细胞的分化进程。
附图说明
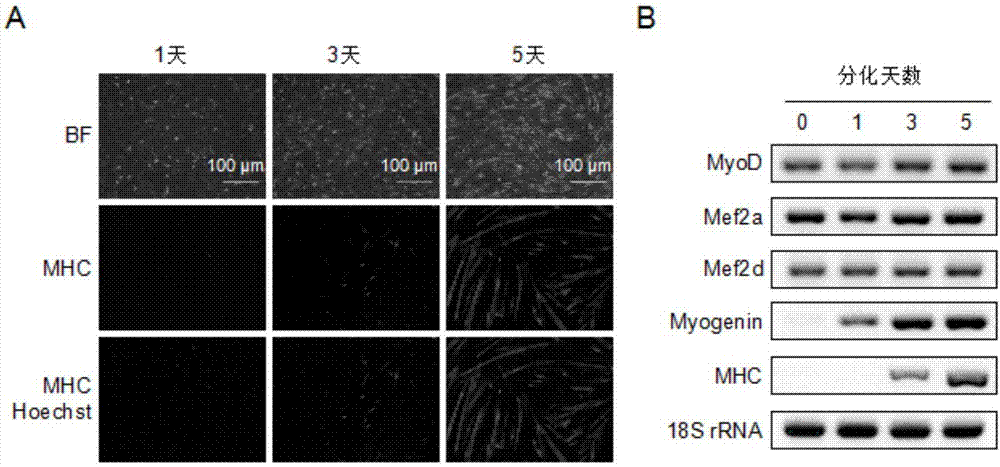
图1、c2c12细胞的成肌细胞体外诱导分化过程。(a)成肌细胞分化过程中的明视场(bf)观察和肌球蛋白重链(mhc)的免疫荧光染色结果。分别在细胞分化的第0天、3天和5天,收获细胞,进行mhc‐fitc染色和hoechst染色,判断成肌细胞的分化情况。(b)细胞分化关键因子的表达情况。利用逆转录聚合酶链式反应(rt‐pcr),检测myod、mef2a、mef2d、myogenin和mhc在细胞分化过程中的表达情况。
图2、敲低长非编码rna对成肌细胞体外诱导分化的影响。在生长培养基中培养细胞,当c2c12细胞生长到50%融合时,进行sirna转染。当细胞继续生长到80%融合时,将生长培养基更换为分化培养基,诱导其往成肌细胞方向分化。在诱导分化的第五天,收获细胞,进行mhc‐fitc染色和hoechst染色,观察细胞肌球蛋白重链(myosinheavychain)的表达和细胞核情况。control:未转染sirna、且未经诱导分化处理的细胞。scrambledsirna:转染一个序列无关的对照sirna、经过诱导分化处理的细胞。sirna18:转染myo18特异性sirna、经过诱导分化处理的细胞。sirna77:转染myo77特异性sirna、经过诱导分化处理的细胞。sirna351:转染myo351特异性sirna、经过诱导分化处理的细胞。
图3、九条长链非编码rna和生肌因子在野生型小鼠中的组织表达谱。利用逆转录聚合酶链式反应(rt‐pcr),检测长非编码rnamyo18‐myo859、以及myod、myogenin和myhc在小鼠主要脏器中的表达水平,以18srrna为内参。
图4、长链非编码rna和生肌因子在野生型小鼠和mdx小鼠骨骼肌中的表达情况。利用逆转录聚合酶链式反应(rt‐pcr),检测长链非编码rnamyo18、myo77和myo351,以及生肌因子myod、myogenin和myhc在小鼠骨骼肌中的表达水平,以18srrna为内参。
图5、长链非编码rna在分化过程的表达谱。在成肌细胞分化过程中,利用qrt‐pcr检测myo18、myo77和myo351表达水平,绘制折线图。以第0天的表达量为对照,对其他数据进行归一化处理。数据的表示方式为平均值±s.e.m.,n=3。
图6、长链非编码rna的亚细胞分布情况。利用核质分离试剂盒,在成肌细胞分化的细胞增殖和分化两个过程中,分别检测myo18、myo77和myo351在细胞核和细胞质的分布情况。
图7、敲低长链非编码rna对生肌因子表达的影响。对敲低长非编码rna表达的c2c12细胞,在诱导分化的第五天,收获细胞,提取总rna。利用qrt‐pcr,检测敲低长链非编码rna对myod、mef2a、myogenin和myhc表达的影响。control:未转染sirna、且未经诱导分化处理的细胞。以scrambledsirna为对照,计算敲低myo18、myo77和myo351对生肌因子表达的影响。数值的表述方式为平均值±标准差。
具体实施方式
下面结合具体实施例及附图,进一步阐述本发明。应当理解,这些实施例仅用于说明本发明而不能用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(newyork:coldspringharborlaboratorypress,1989)中所述的条件,或按照制造厂商所建议的条件。
实施例一:实验动物和材料
试验用小鼠购自于北京维通利华实验动物技术有限公司提供,饲养在北京大学实验动物中心。所有实验方案和操作均得到北京大学实验动物伦理委员会的批准。
dna寡核苷酸购自invitrogen北京公司,rna寡核苷酸购自广州市锐博生物科技有限公司。
实施例二:c2c12成肌细胞体外诱导分化
为了研究c2c12成肌细胞的分化过程,我们首先利用免疫荧光染色,检测了细胞中肌球蛋白重链(mhc)的表达和细胞核数目情况,发现在诱导分化末期(第5天),有较强的mhc荧光信号。此外,我们还利用逆转录聚合酶链式反应(rt‐pcr),检测成肌细胞分化关键因子(myod、mef2a、mef2d、myogenin和myhc)的表达情况。我们发现与文献报道一致,这五个因子在细胞分化过程中均出现典型的表达调控,表明成肌细胞的诱导分化过程是正确的。
研究方案和结果具体如下:
1、c2c12成肌细胞的培养和体外诱导分化:以加入诱导分化培养基,开始诱导分化的当天为第0天,后一天为诱导分化的第1天,并依此类推定义其他诱导分化的时间节点。
在含有10%胎牛血清的dmem液体培养基中,常规培养c2c12细胞,2至3天换液1次。在诱导分化的第0天,当细胞密度达到80%融合时,将常规培养基换成含有2%马血清的dmem液体培养基,进行诱导分化。每天更换新鲜的含有2%马血清的诱导培养基,进行分化培养,直至分化过程结束。
2、mhc免疫荧光和细胞核染色:在诱导分化的前期(第0天)、中期(第3天)和末期(第5天),按照常规方法,用一抗anti‐myosin、二抗antimouseigg‐fitc、以及hoechst33342染料孵育。用高内涵分析仪分析细胞的染色结果(图1a)。
实验步骤:1)在诱导分化的第0天、第3天和第5天,收获培养细胞,用经过冰浴的磷酸缓冲液(pbs)轻缓漂洗1次;2)用4%甲醛固定细胞15分钟;3)与1%聚乙二醇辛基苯基醚(triton)孵育10分钟,pbs轻缓漂洗1次;4)1%牛血清白蛋白(bsa)封闭10分钟,pbs轻缓漂洗1次;5)加入一抗(anti‐myosin,用pbs进行1:500稀释),孵育2小时,pbs轻缓漂洗1次;6)加入二抗(antimouse,用pbs进行1:40稀释),孵育1小时;7)与hoechst33342(用pbs进行1:1000稀释),孵育20分钟,pbs轻缓漂洗1次;8)加入适量pbs以备上机检测;9)利用operetta高内涵分析仪(perkinelmer,美国)进行分析,随机挑选18个视野进行拍照,每个视野检测三个通道,分别为brightfield(50ms),alexa488(200ms),hoechst33342(50ms)10);10)利用columbus图像存储和分析软件(perkinelmer,美国)对细胞融合指数进行定量分析。
3、生肌因子表达的检测:利用rt‐pcr,分析myod、mef2a、mef2d、myogenin和mhc在分化过程中的表达水平,为18s内参基因。检测基因表达的引物序列见表1。实验结果如图1b所示,实验步骤具体如下:
1)总rna提取:分别获得诱导分化第0天,第1天,第3天和第5天的细胞样本,利用trizol试剂,提取细胞总rna,并进行定量。
2)rna逆转录:使用天根生化科技公司的逆转录试剂盒(tianscriptm‐mlv,cat:er104‐03)进行rna样本的逆转录反应,具体按照试剂盒说明书的方法进行,步骤如下:1)取1微克总rna样本,加入2μl(10μm)6碱基随机逆转录引物,加入2μldntp(10mm),混匀后置70℃水浴变性5分钟;2)冰上静置3分钟后,取出,加入4μl5×first‐strandbuffer、0.5μlrnaseinhibitor(40u/μl)和1μlm‐mlv(200u/μl),总体积为20μl;3)混匀后短暂离心,置于eppendorfpcr仪中进行逆转录反应,反应参数为25℃,10分钟;42℃,50分钟;95℃,5分钟;随后置于4℃保存。其中,rnaseinhibitor为promega公司的产品(cat#n211)。
3)逆转录pcr:使用北京全式金生物科技有限公司的2×easytaq@pcrsupermix试剂(cat:as111‐01),检测样本中基因的表达情况,实验步骤具体如下:1)取1μl逆转录产物,加入12.5μl2×easytaq@pcrsupermix,0.5μl(10μm)上游引物,0.5μl(10μm)下游引物,最后加入10.5μl去离子水,反应总体积为25μl。2)混匀后短暂离心,置于technepcr仪中进行pcr扩增反应,反应参数为94℃预变性1分钟,94℃变性30秒,59℃退火30秒,72℃延伸30秒,循环次数为30个循环;72℃,5分钟;随后置于4℃保存。
4)跑胶检测:用2%琼脂糖凝胶检测pcr产物。
表1、rt‐pcr引物对
实施例三:高通量测序鉴定三条成肌细胞分化相关的长非编码rna
polya‐minusrna转录本分离:按照实施例一描述的方案,进行c2c12成肌细胞体外诱导分化。在分化的第0天、第3天和第5天,分别收获处于不同分化阶段的,细胞。利用购自北京博迈德生物生物技术发展公司的离心柱型rnapure试剂盒,提取细胞总rna;然后利用购自北京坚诚达科技有限公司的核糖体rna去除试剂盒去除18s和28s核糖体rna,随后用oligo‐dt杂交分离法去除信使rna,用neb公司的rnasefree的dnasel(cat:m0303s)消化残留的基因组dna,最终获得polya‐minusrna转录本样本。
高通量转录本测序:从分化第0天、第3天和第5天获得的polya‐minusrna样本中,取2ug交由贝瑞和康生物技术公司进行高通量转录本测序。与传统测序技术相比,高通量转录本测序技术的一个重要的技术优势是通过对测序数据的分析,可以精确计算基因转录本的表达丰度。发明人采用最常用的计算方式(rpkm,readsperkilobaseoftranscriptpermillionmappedreads),计算每百万个测序片段中分布在1kb基因组区域内的片段数,用于表示转录本的表达丰度。计算结果表明,与前成肌细胞相比,本发明所述的myo18、myo77、myo351多聚核酸分子的表达丰度在成熟的骨骼肌细胞中分别提高了5倍、12倍和9倍,提示这些转录本的表达与成肌细胞的分化显著相关。
成肌细胞分化相关长非编码rna的序列,具体如下:
myo18(seqidno:01):668bp
ttctcaccacaccctgttgtttatgtactgtttgtggtctttgctgaacctcaagtacaaagtggagttgtctccacagacaacagtgcaagcaaaacttaacagttttttcctatttaacctttaagaatgcatcatgtgatcttttgcccagaaccacagtgtttctgaagtatctggtgatgaaattattctccacataccctctattggtggttttgaacacaagtattagtggtgagctttaagattcagactttagcatttataatttaaaaattaattaatgtttaagtaggcacatgtagctggtggtcatgctaacagacagcacaagacctaaaccttcaaattgttgtaattatctttgcctttccctccctttccttcaatacagatagaacggtatgaacaatgttcttcatccactaagcaaggaaacaaattcaagtagtcttgatttattctgaaagcatagaatttccacttagtttgattagtttacatttgtttttctgacacaaagcaaaaacaaaaccaggccaatataccaatgtttattcaattcgggggcttaaacctgttttcagtattgggtgatggatctcacactccacactctaagtacatttgtctcaccaagagtttttgaattgttcattgtttgaa
myo77(seqidno:02):671bp
gctgagctgctgctactaataataacggtgaagagagtaatggttacacatgttaagaaaacctacacacatcaaagagactagaaacaaaaatggaattcatggtctaggaaaaatgataatgcattctcctattatttttagaaaatgatttgattcagttaaaacaaaaaaccagacattggccctatttttcaagttcttttcctgtctataaagcatggcatgggtctattaatttcctatgtaaaaccagctgaggaatagtctccttctgaaaccctctcctcttatacctcaatactgtgagaatttgcttcaccccccaccaccttgttcctatagcgtatttttagctccttagactctatggcactcagtagcatcagaagacgccaatgaaagggcagttgcagacaagatagcaaagacctcgttgtggtcttaatggctgcagcagggcaggcaagcctggcagagttcctgctgtctccagccagagctgacaactgcccaggagctggacttccttgcagatcagactctaatgtgggatgtgatttcactgagttcaggaggattgggcagagagggcaataaagaaaagacttagcatgatggaatggccttttacacagccctagagagcctggaggaacaccacccattgcc
myo351(seqidno:03):569bp
tctgtttgtgacacctcatcattgctcaaaacactcctctctttggaacagtttggatttctggatcttggattagagatgttcaacctgtaagcatggtggaaagagatcagaaaaccattggtggctcacctcccatgctagggtcctatacgttgactagtaacacctctaatcagcactttgttcgacacaaaggaaggttagctgaagcatgaagttctagctgcatcactgttgtgtaaacacagtgctttgcagtactacacaagcctgtttactccccatctatattggttggtcatttagagatagcccacataaaaagcagccccctgtggcccttctgcacacatctgttgactgtccaaacttggagtctctagaatgcaatggataaaattcccacttctttgtccgcacacagcacacatcggactctgcattacatgcgccctcttgtgaattacactcctatccctaatgtctccttgtttttcatactctcactcaccaacttgagaggtaagagctgatataactaaacagattcaaattgatgggccaaac
实施例四:敲低长非编码rna对成肌细胞诱导分化的抑制作用
为了研究成肌细胞分化相关长非编码rna的表达对细胞分化的影响,我们通过筛选,获得了基因特异的小干扰rna(sirnas),见表2。利用细胞转染试剂lipofectamine2000,我们将这些sirna分别导入培养的c2c12细胞,敲低长非编码rna的表达水平。随后,进行诱导分化。待分化完成后,利用免疫荧光染色,鉴定mhc蛋白的生成、以及细胞融合过程是否受到影响。我们发现与对照细胞相比,用基因特异性的sirna处理细胞,能显著抑制mhc的表达、以及细胞融合过程的发生,实验结果见图2。实验步骤具体如下:
1、c2c12细胞培养:在含有10%胎牛血清的dmem液体培养基中,常规培养c2c12小鼠成肌细胞细胞,2至3天换液1次。
2、sirna转染:利用block‐ittmrnaidesigner(invitrogen)程序,设计基因特异的sirna分子,具体序列如表2所示。
转染前一天,将c2c12细胞接种于6孔培养板中,使细胞贴壁后的融合度达到50%。按照操作手册的要求,使用invitrogen公司的lipofectaminetmrnaimax转染试剂进行细胞转染实验。对于6孔培养板的每个孔,将80pmolsirna在200μldmem细胞培养液中制备rnaimax/sirna混合物,室温静置20分钟后,将rnaimax/sirna混合物加入到6孔板中;转染4个小时后,加入正常细胞培养基进行培养。
继续培养2天后,待细胞长至融合度达到80%,加入含有2%马血清的dmem培养基,开始诱导分化过程。
3、体外诱导分化。
4、免疫荧光染色:在成肌细胞体外诱导分化的第5天,获得细胞样本,进行免疫荧光染色分析。实验步骤具体见实施例二。实验结果见图2。
表2、sirna序列
实施例五:长非编码rna和生肌因子在野生型小鼠不同组织中的表达
为了鉴定长非编码rna、以及成肌细胞分化的关键因子的组织分布情况,我们从野生型balb/c小鼠的心、肝、脾、肺、肾、脑、脂肪组织、骨骼肌中获得rna。利用逆转录pcr,研究上述三条长链非编码rna及生肌因子(myod、myogenin、myhc)的表达情况。
研究结果显示:myo18、myo77和myo351均在骨骼肌组织中高表达。myo351在野生型小鼠心脏和骨骼肌中表达丰度最高,表明其具有肌肉组织特异性。myo77在肺中表达量最高,其次是骨骼肌、心肌和肾。myo18只在骨骼肌中有表达,表明其具有高度的骨骼肌组织特异性,与成肌细胞分化重要的转录因子myod、myogenin及分化因子myhc的表达谱一致。实验的内参基因为18srrna,检测基因表达的引物序列信息见表3。实验结果如图3所示。实验步骤具体如下:
1、总rna提取:分别获得野生型小鼠的心、肝、脾、肺、肾、脑、脂肪组织、骨骼肌组织,利用trizol试剂,提取细胞总rna,并进行定量。
2、rna逆转录:实验步骤具体见实施例二。
3、逆转录pcr:实验步骤具体见实施例二。
4、跑胶检测:用2%琼脂糖凝胶检测pcr产物。
表3、长非编码rna检测引物对
实施例六:长非编码rna和生肌因子在野生型小鼠和mdx小鼠骨骼肌组织中的表达
为了研究长非编码rna与肌肉疾病如杜氏肌营养不良症的关系,我们从野生型小鼠、以及mdx小鼠的骨骼肌组织中获得rna(mdx小鼠是常用的肌肉病动物模型)。利用利用逆转录pcr,研究长非编码rna(myo18、myo77和myo351)和生肌因子(myod、mef2a、myogenin和myhc)的表达情况。
实验结果表明与野生型小鼠相比,mdx小鼠骨骼肌组织中myo77和myo351的表达丰度较低。myo18在野生型小鼠和mdx小鼠中的表达丰度无明显差异。生肌因子如myod、mef2a、myogenin和myhc在mdx小鼠骨骼肌组织中表达量均较低。具体结果如图4所示。实验步骤具体如下:
1、总rna提取:分别获得野生型小鼠和mdx小鼠肌肉组织,利用trizol试剂,提取细胞总rna,并进行定量。
2、rna逆转录:实验步骤具体见实施例二。
3、逆转录pcr:实验步骤具体见实施例二。
4、跑胶检测:用2%琼脂糖凝胶检测pcr产物。
实施例七:长非编码rna在成肌细胞分化中的作用机制研究
为了阐明myo18、myo77和myo351在成肌细胞分化中的作用机制,我们首先研究了这三条长非编码rna在成肌细胞分化过程的表达谱。利用实时荧光定量pcr,我们在分化的第0天、3天和5天,分别检测这三条长非编码rna的表达水平(图5)。发现myo18和myo351的表达水平在分化过程中持续升高,myo77的表达水平先上升后下降,基本维持在较为稳定的水平。
一般而言,在细胞核中分布的长非编码rna,主要在转录水平上发挥功能;而在细胞质中分布的长非编码rna,则主要在基因的转录后修饰或降解中发挥功能。考虑到长非编码rna的作用方式与其亚细胞定位的关系,我们首先获得了处于增殖和分化过程中的成肌细胞;利用paristm(ambion)试剂盒,对细胞核、细胞质中的rna组分进行了分离;随后利用rt‐pcr,检测这三条长非编码rna在细胞核、细胞质rna组分中的含量(图6)。以u6snrna和gapdh作为实验对照。实验步骤具体如下:
1、总rna、细胞核和细胞质rna的提取的提取:严格按照paristm(ambion)试剂盒说明书收集细胞,提取rna。
1)总rna的提取:分别获得增殖过程和分化过程的细胞样本,利用预冷的细胞裂解缓冲液,裂解细胞,获得细胞裂解物,加入2×溶解/结合溶液,离心后加入无水乙醇过滤,先后使用清洗液和洗脱液各两次,提取总rna。
2)细胞质rna的提取:分别获得增殖过程和分化过程的细胞样本,加入预冷的细胞分离缓冲液,冰上孵育5分钟,离心,吸取上清部分,获得细胞质裂解物,按照步骤1的方法,提取细胞质rna。
3)细胞核rna的提取:加入细胞裂解液至细胞核沉淀中,按照步骤1的方法,提取细胞核rna。
2、去除基因组dna(gdna):因为上述过程中得到的总rna、细胞核rna中均会存在基因组dna,对后续的rt‐pcr结果造成影响,所以要先去除gdna,步骤如下:取500纳克rna样本,加入0.5μl(10μm)6碱基随机逆转录引物,2μl4×gdna去除溶液,最后加入去离子水至8μl,混匀后置于42℃水浴2分钟;加入2μl5×hiscript@selectqrtsupermix;混匀后短暂离心,置于eppendorfpcr仪中进行逆转录反应,反应参数为50℃,30分钟;85℃,2分钟;随后置于4℃保存。
3、逆转录pcr:具体步骤见实施例二。
4、跑胶检测:用2%琼脂糖凝胶检测pcr产物。
随后,我们利用实时荧光定量pcr,研究了敲低骨骼肌分化相关长非编码rna对成肌细胞分化关键因子表达的影响。研究结果显示:利用sirna敲低myo18基因的表达,不仅影响了mhc蛋白的生成,还能显著抑制细胞中myod、mef2a、myogenin和myhc基因的表达;利用sirna敲低myo77和myo351基因的表达,能显著抑制细胞中myogenin和myhc基因的表达(图7),这与其对细胞分化的抑制作用是一致的。
实验步骤具体如下:在成肌细胞体外诱导分化的第5天,获得细胞样本,进行实时荧光定量pcr分析,使用promega公司的
sequencelisting
<110>北京大学
<120>成肌细胞分化相关的长非编码rna及其应用
<130>wx2017-by-008
<160>27
<170>patentinversion3.5
<210>1
<211>669
<212>dna
<213>musmusculus
<400>1
ttctcaccacaccctgttgtttatgtactgtttgtggtctttgctgaacctcaagtacaa60
agtggagttgtctccacagacaacagtgcaagcaaaacttaacagttttttcctatttaa120
cctttaagaatgcatcatgtgatcttttgcccagaaccacagtgtttctgaagtatctgg180
tgatgaaattattctccacataccctctattggtggttttgaacacaagtattagtggtg240
agctttaagattcagactttagcatttataatttaaaaattaattaatgtttaagtaggc300
acatgtagctggtggtcatgctaacagacagcacaagacctaaaccttcaaattgttgta360
attatctttgcctttccctccctttccttcaatacagatagaacggtatgaacaatgttc420
ttcatccactaagcaaggaaacaaattcaagtagtcttgatttattctgaaagcatagaa480
tttccacttagtttgattagtttacatttgtttttctgacacaaagcaaaaacaaaacca540
ggccaatataccaatgtttattcaattcgggggcttaaacctgttttcagtattgggtga600
tggatctcacactccacactctaagtacatttgtctcaccaagagtttttgaattgttca660
ttgtttgaa669
<210>2
<211>672
<212>dna
<213>musmusculus
<400>2
gctgagctgctgctactaataataacggtgaagagagtaatggttacacatgttaagaaa60
acctacacacatcaaagagactagaaacaaaaatggaattcatggtctaggaaaaatgat120
aatgcattctcctattatttttagaaaatgatttgattcagttaaaacaaaaaaccagac180
attggccctatttttcaagttcttttcctgtctataaagcatggcatgggtctattaatt240
tcctatgtaaaaccagctgaggaatagtctccttctgaaaccctctcctcttatacctca300
atactgtgagaatttgcttcaccccccaccaccttgttcctatagcgtatttttagctcc360
ttagactctatggcactcagtagcatcagaagacgccaatgaaagggcagttgcagacaa420
gatagcaaagacctcgttgtggtcttaatggctgcagcagggcaggcaagcctggcagag480
ttcctgctgtctccagccagagctgacaactgcccaggagctggacttccttgcagatca540
gactctaatgtgggatgtgatttcactgagttcaggaggattgggcagagagggcaataa600
agaaaagacttagcatgatggaatggccttttacacagccctagagagcctggaggaaca660
ccacccattgcc672
<210>3
<211>570
<212>dna
<213>musmusculus
<400>3
tctgtttgtgacacctcatcattgctcaaaacactcctctctttggaacagtttggattt60
ctggatcttggattagagatgttcaacctgtaagcatggtggaaagagatcagaaaacca120
ttggtggctcacctcccatgctagggtcctatacgttgactagtaacacctctaatcagc180
actttgttcgacacaaaggaaggttagctgaagcatgaagttctagctgcatcactgttg240
tgtaaacacagtgctttgcagtactacacaagcctgtttactccccatctatattggttg300
gtcatttagagatagcccacataaaaagcagccccctgtggcccttctgcacacatctgt360
tgactgtccaaacttggagtctctagaatgcaatggataaaattcccacttctttgtccg420
cacacagcacacatcggactctgcattacatgcgccctcttgtgaattacactcctatcc480
ctaatgtctccttgtttttcatactctcactcaccaacttgagaggtaagagctgatata540
actaaacagattcaaattgatgggccaaac570
<210>4
<211>20
<212>dna
<213>artificialsequence
<220>
<223>artificialsequence
<400>4
cagcatagtggagcgcatct20
<210>5
<211>20
<212>dna
<213>artificialsequence
<220>
<223>artificialsequence
<400>5
gttccctgttctgtgtcgct20
<210>6
<211>20
<212>dna
<213>artificialsequence
<220>
<223>artificialsequence
<400>6
gcagtgcaagtgggatgttg20
<210>7
<211>20
<212>dna
<213>artificialsequence
<220>
<223>artificialsequence
<400>7
cccttgcttgatgggggaat20
<210>8
<211>19
<212>dna
<213>artificialsequence
<220>
<223>artificialsequence
<400>8
cttcgcgtaaccgaggatt19
<210>9
<211>20
<212>dna
<213>artificialsequence
<220>
<223>artificialsequence
<400>9
tgatcaggagcctcacactg20
<210>10
<211>20
<212>dna
<213>artificialsequence
<220>
<223>artificialsequence
<400>10
ctacaggccttgctcagctc20
<210>11
<211>20
<212>dna
<213>artificialsequence
<220>
<223>artificialsequence
<400>11
acgatggacgtaagggagtg20
<210>12
<211>19
<212>dna
<213>artificialsequence
<220>
<223>artificialsequence
<400>12
ccgaaggcggaactactgt19
<210>13
<211>20
<212>dna
<213>artificialsequence
<220>
<223>artificialsequence
<400>13
ggttgacagtgacgcagaac20
<210>14
<211>21
<212>dna
<213>artificialsequence
<220>
<223>artificialsequence
<400>14
cgaacgtctgccctatcaact21
<210>15
<211>28
<212>dna
<213>artificialsequence
<220>
<223>artificialsequence
<400>15
cagacttgccctccaatggatcctcgtt28
<210>16
<211>20
<212>dna
<213>artificialsequence
<220>
<223>artificialsequence
<400>16
ttgcctttccctccctttcc20
<210>17
<211>20
<212>dna
<213>artificialsequence
<220>
<223>artificialsequence
<400>17
aacaggtttaagcccccgaa20
<210>18
<211>20
<212>dna
<213>artificialsequence
<220>
<223>artificialsequence
<400>18
ccccaccaccttgttcctat20
<210>19
<211>20
<212>dna
<213>artificialsequence
<220>
<223>artificialsequence
<400>19
ttattgccctctctgcccaa20
<210>20
<211>21
<212>dna
<213>artificialsequence
<220>
<223>artificialsequence
<400>20
cacaagcctgtttactcccca21
<210>21
<211>20
<212>dna
<213>artificialsequence
<220>
<223>arttificialsequence
<400>21
ttcacaagagggcgcatgta20
<210>22
<211>19
<212>rna
<213>artificialsequence
<220>
<223>artificial
<400>22
ggucuuugcugaaccucaa19
<210>23
<211>19
<212>rna
<213>artificialsequence
<220>
<223>artificial
<400>23
uugagguucagcaaagacc19
<210>24
<211>19
<212>rna
<213>artificialsequence
<220>
<223>artificial
<400>24
gcagccauuaagaccacaa19
<210>25
<211>19
<212>rna
<213>artificialsequence
<220>
<223>artificial
<400>25
uuguggucuuaauggcugc19
<210>26
<211>19
<212>rna
<213>artificialsequence
<220>
<223>artificial
<400>26
gcacuuuguucgacacaaa19
<210>27
<211>19
<212>rna
<213>artificialsequence
<220>
<223>artificial
<400>27
uuugugucgaacaaagugc19
- 还没有人留言评论。精彩留言会获得点赞!