一种乙酰葡萄糖胺印迹材料及其用于乙酰葡萄糖胺及乙酰葡萄糖胺修饰肽段的识别的制作方法
本发明属于高分子材料制备技术及其在生物分子识别中的应用,具体的说是一种新型的乙酰葡萄糖胺印迹材料及其制备和应用。
背景技术:
乙酰葡萄糖胺修饰是一种普遍存在于哺乳动物中的蛋白质翻译后修饰。大量的研究工作已证明乙酰葡萄糖胺修饰在细胞结构、细胞周期、细胞代谢及转录的调控、以及核内物质转运中发挥重要作用。另外,乙酰葡萄糖胺修饰及氧磷酸化修饰可竞争性的发生在同一丝氨酸或苏氨酸位点上,这种相互占用位点的情况可使蛋白质产生不同的活性或稳定性的改变,从而利用这种交互对话的形式实现细胞信号通路及其生物学过程的调控。当前研究已证实乙酰葡萄糖胺修饰的改变与癌症及糖尿病等多种疾病相关。因此,乙酰葡萄糖胺翻译后修饰的研究具有重要意义。
然而乙酰葡萄糖胺修饰蛋白的低丰度、动态修饰性等特征给其研究带来极大的挑战。为克服低丰度的挑战,需在样品预处理阶段对乙酰葡萄糖胺修饰肽段进行富集,目前已报道的方法包括凝集素亲和富集法、抗体富集法、化学标记法、酶催化标记法、硼亲和富集法等。然而上述方法存在亲和力低、特异性不高及易产生假阳性等不足。
分子印迹技术是在模板分子的存在下,通过功能单体与交联剂之间聚合,获得空间结构、尺寸大小及结合位点与模板分子完全匹配的高分子聚合物的制备技术。由于印迹过程中形成的分子印迹位点通常具有与抗原-抗体体系相似的亲和性及选择性,对目标分子具有很高的亲和性及选择性。同时mip具有预定性,针对不同的目标分子,容易根据其结构设计合成出所对应的mip。最后,mip作为高分子聚合物,相对于抗体等生物分子,稳定性更高,可在广泛的化学及物理环境中使用。
然而,作为生物大分子,蛋白质分子量大、体积庞大、其构象对环境变化敏感;同时对于许多有重要生物学意义的蛋白质,很难获得足够量的纯品蛋白作为模板制备其印迹材料。抗原决定基是抗原表面决定其免疫原性的区域,抗体对抗原的捕获就是通过抗体对其抗原决定基的识别进行的。受此启发,研究者以目标蛋白质末端肽段作为抗原决定基,以此抗原决定基作为模板制备印迹材料。这种识别方式类似于抗体通过抗原决定基对抗原进行识别,因此被称为抗原决定基印迹。抗原决定基印迹材料可对具有同种抗原决定基的目标蛋白及肽段进行共同识别的优势,目前已在磷酸化肽段、乙酰化肽段的富集中取得初步应用。
为克服乙酰葡萄糖胺修饰肽段富集亲和力低、特异性不足的问题,我们采用抗原决定基印迹技术,选择乙酰葡萄糖胺修饰肽段的特征性片段乙酰葡萄糖胺作为模板,采用分子印迹的方法,制备乙酰葡萄糖胺印迹材料,并将其用于乙酰葡萄糖胺及乙酰葡萄糖胺修饰肽段的识别中。
技术实现要素:
利用抗原决定基印迹技术,选择乙酰葡萄糖胺作为模板分子,采用本体印迹及皮克林乳液印迹技术制备乙酰葡萄糖胺印迹材料,去除模板后形成乙酰葡萄糖胺印迹材料;并且将该印迹材料用于乙酰葡萄糖胺及乙酰葡萄糖胺修饰肽段的识别中。为实现上述目的,本发明采用的技术方案为:
1.将乙酰葡萄糖胺、功能单体、交联剂、引发剂、溶剂混合后进行聚合,去除模板分子后,得到乙酰葡萄糖胺的本体印迹材料。具体步骤为:
(1)将乙酰葡萄糖溶解后,加入功能单体、交联剂、引发剂,超声或振荡使所有组分溶解并混合均匀,形成预聚合溶液。
(2)在高温(高于50℃)、紫外、或氧化还原条件下引发聚合,促使预聚合溶液发生聚合反应。
(3)利用模板去除溶剂洗脱所得聚合物,去除模板分子后,形成乙酰葡萄糖胺本体印迹材料。
(4)预聚合溶液中不添加乙酰葡萄糖胺,通过上述相同的步骤,制备得到非印迹聚合物。
(5)将该本体印迹聚合物用于乙酰葡萄糖胺及其修饰肽段的识别中。
所述的乙酰葡糖胺溶解溶剂,是指:水、甲醇、乙醇、异丙醇、乙腈、甲苯、丙酮、氯仿、四氢呋喃、二甲基亚砜、二甲基乙酰胺、二甲基甲酰胺等中的一种或两种以上。
所述的本体印迹体系中,乙酰葡萄糖胺在总体系中的质量分数为0.1%-40%;功能单体在总体系中的质量分数为5%-90%;交联剂在总体系中的质量分数为5%-45%;溶剂在总体系中的质量分数为0.01%-10%。
所述的功能单体,是指:能够聚合形成高分子聚合物的单体,包括丙烯酰胺、甲基丙烯酰胺、异丙基丙烯酰胺、羟乙基丙烯酰胺、苯丙烯酰胺、丙烯酸、丙烯酸甲酯、丙烯酸丁酯、甲基丙烯酸、甲基丙烯酸甲酯、甲基丙烯酸乙酯、甲基丙烯酸丁酯、四甲氧基硅烷、氨基三甲氧基硅烷、乙烯基三甲氧基硅烷、丁基三甲氧基硅烷、三甲氧基硅烷苯硼酸、四乙氧基硅烷、氨基三乙氧基硅烷、乙烯基三乙氧基硅烷、丁基三乙氧基硅烷、三乙氧基硅烷苯硼酸、多巴胺、乙烯基吡咯烷酮、乙烯基咪唑、乙烯基环氧乙烷、苯乙烯、乙烯基苯硼酸、乙烯基苯甲酸、甲氧基丙烯及烯丙基甲基醚中的一种或二种以上。
所述的交联剂,是指:亚甲基双丙烯酰胺、二甲基丙烯酸乙二醇酯中的一种或两种以上。
所述的引发剂,是指:过硫酸盐引发剂、偶氮二异丁腈、偶氮二异庚腈、氧化还原引发剂如过硫酸铵/亚硫酸氢钠、过硫酸钾/亚硫酸氢钠等中的一种或两种以上。
所述的模板去除溶剂,是指:醇类溶剂或醇类的乙酸溶液,醇类的乙酸溶液中乙酸的体积浓度为0%-50%;所述的模板去除方法为用模板去除溶剂依次洗脱印迹材料。
2.利用键合有乙酰葡萄糖胺基团的固体颗粒作为稳定剂,加入水相与油相的混合液后使混合液形成稳定的皮克林乳液,引发聚合后去除稳定剂及模板,形成乙酰葡萄糖胺印迹微球。具体步骤为:
(1)利用共价键将乙酰葡萄糖胺键合于硅基质、金属氧化物基质等固体颗粒表面,并以此作为皮克林乳液的稳定剂。
(2)将含有水溶性功能单体及水溶剂的水相、含有油溶性功能单体、交联剂、引发剂及油溶剂的油相,及稳定剂混合后,利用超声或者摇晃的方式制备稳定的皮克林乳液。
(3)利用高温(高于50℃)、紫外、或氧化还原条件下引发聚合,促使皮克林乳液油相发生聚合反应。
(4)利用强酸或强碱溶解稳定剂基质材料,去除稳定剂;随后用模板去除溶剂洗脱材料,去除模板分子形成乙酰葡萄糖胺表面印迹微球。
(5)利用未键合乙酰葡萄糖胺的固体颗粒作为稳定剂,通过上述相同的步骤,制备得到非印迹微球。
(6)将该表面印迹微球用于乙酰葡萄糖胺及其修饰肽段的识别中。
所述的乙酰葡萄糖胺键合,是指:利用乙酰葡萄糖胺上的羟基与基质材料间形成共价键;或在乙酰葡萄糖胺上引入其他可反应基团(包括炔基、叠氮、烯基、巯基、氨基、羧基、环氧基等),从而将乙酰葡萄糖胺键合在基质材料上。所述的固体颗粒是指:在1纳米-1微米间的硅基质或金属氧化物基质的颗粒物。
所述的水相功能单体,是指:丙烯酰胺类及丙烯酸类功能单体,包括丙烯酰胺、甲基丙烯酰胺、异丙基丙烯酰胺、羟乙基丙烯酰胺、苯丙烯酰胺、丙烯酸、丙烯酸甲酯、丙烯酸丁酯、甲基丙烯酸、甲基丙烯酸甲酯、甲基丙烯酸乙酯及甲基丙烯酸丁酯,其质量浓度为1-20%;所述的稳定剂的质量浓度为1-15%。所述的油相,是指:其中油溶性功能单体包括乙烯基吡咯烷酮、乙烯基咪唑、乙烯基环氧乙烷、苯乙烯、乙烯基苯硼酸、乙烯基苯甲酸、甲氧基丙烯及烯丙基甲基醚,交联剂包括亚甲基双丙烯酰胺、二甲基丙烯酸乙二醇酯等,引发剂为偶氮类引发剂,如偶氮二异丁腈、偶氮二异庚腈、偶氮二异丁基脒盐酸盐等,溶剂包括甲苯、氯仿、丙酮、四氢呋喃等。功能单体在总体系中的质量分数为0%-30%;交联剂在总体系中的质量分数为10-99%;引发剂在总体系中的质量分数为0.01-10%;溶剂在总体系中的质量分数为0-50%。
所述的利用强酸或强碱去除稳定剂,是指:利用浓度为500mm-5m的氢氟酸、氢氟化氨、盐酸、硫酸等,或浓度为500mm-5m的氢氧化钠、氢氧化钾、氢氧化钡、氢氧化钙等,溶解基质材料,从而去除稳定剂。
所述的模板去除溶剂,是指:醇类溶剂或醇类的乙酸溶液,醇类的乙酸溶液中乙酸的体积浓度为0%-50%;所述的模板去除方法为用模板去除溶剂依次洗脱印迹材料。
本发明具有如下优点:
(1)本发明利用乙酰葡萄糖胺作为模板分子制备印迹材料,乙酰葡萄糖胺价格低廉、易购买,解决了生物分子印迹中模板难获得的问题。
(2)乙酰葡萄糖胺是所有乙酰葡萄糖胺修饰肽段的共有特征碎片,因此,以乙酰葡萄糖胺作为模板分子制备的印迹材料可实现所有乙酰葡萄糖胺修饰肽段的识别,识别过程具有通用性。
(3)本发明利用键合有乙酰葡萄糖胺基团的固体颗粒作为稳定剂,通过皮克林乳液印迹法制备的分子印迹微球,其印迹位点位于微球表面,具有模板洗脱容易、传质阻力小、目标分子吸附快速的优势。
(4)本发明利用皮克林乳液法制备印迹微球,可通过稳定剂的加入量对微球的大小进行有效调控,从而满足不同应用需求对粒径大小的要求。
(5)本发明可采用多种不同的功能单体进行聚合形成印迹位点。多种功能单体的利用可极大程度的提供多种丰富的相互作用,保证形成的印迹位点对乙酰葡萄糖胺及其修饰肽段的特异性识别。
(6)本发明所述的印迹材料可对乙酰葡萄糖胺及其修饰肽段进行特异性识别,在乙酰葡萄糖胺的分离纯化及乙酰葡萄糖胺修饰肽段的富集鉴定中具有重要的应用价值。
附图说明:
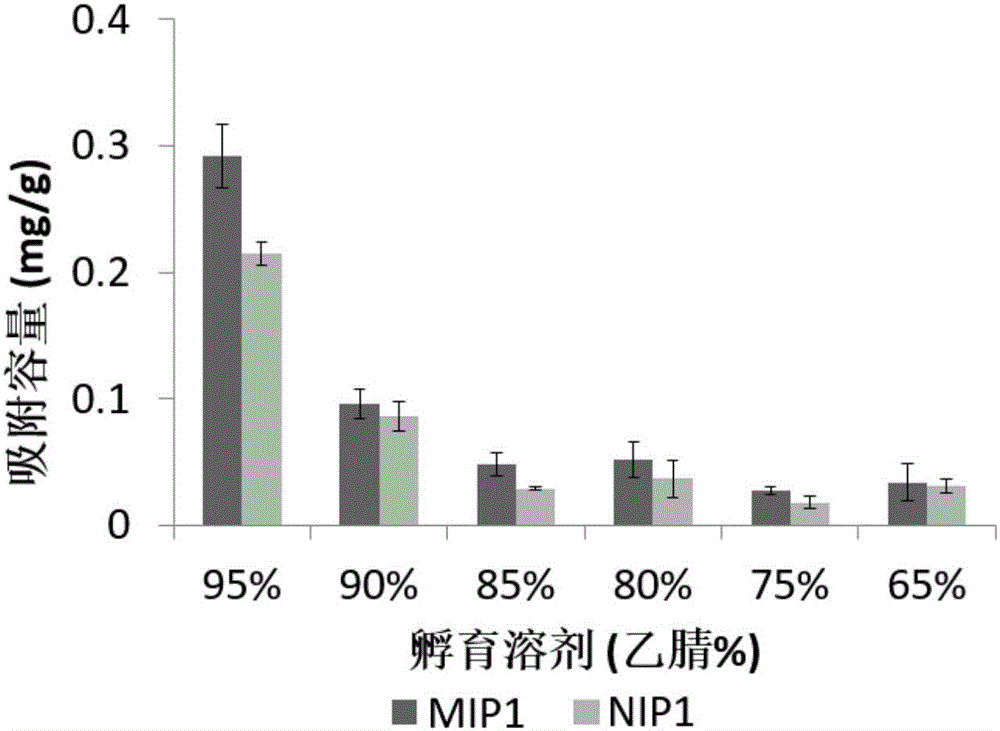
图1为乙酰葡萄糖胺本体印迹材料(mip1)对乙酰葡萄糖胺的吸附容量图。
图2为皮克林乳液印迹法制备所得乙酰葡萄糖胺表面印迹材料(mip2)形貌图。(a)图标尺为10微米,(b)图标尺为1微米。
图3为皮克林乳液印迹法制备所得乙酰葡萄糖胺表面印迹材料(mip2)及非印迹材料(nip2)对乙酰葡萄糖胺的色谱分离图。
图4为mip2对鼠脑组织提取物酶解产物中乙酰葡萄糖胺修饰肽段的富集效果。
图5为硼亲和辅助的乙酰基葡糖胺表面印迹材料(mip3)的形貌表征图。(a)图标尺为10微米,(b)图标尺为1微米。
图6为硼亲和辅助的乙酰基葡糖胺表面印迹材料(mip3)及非印迹材料(nip3)对乙酰葡萄糖胺吸附容量图。
图7为mip3对乙酰葡萄糖胺、甘氨酸(gly)及丝氨酸(ser)的吸附容量图。
图8为mip3对鼠脑组织提取物酶解产物中乙酰葡萄糖胺修饰肽段的富集效果。
具体实施方式
实施例1
乙酰葡萄糖胺本体印迹材料(mip1)的制备
取35mgn-乙酰基-d-葡萄糖胺溶解于0.5ml二甲基亚砜中,随后加入300μl二甲基丙烯酸乙二醇酯、50mg丙烯酰胺胺、3.5mg偶氮二异丁氰,待所有组分完全溶解后,向反应混合液中通氮气10min。4℃静置1h,随后于65℃下反应12h。去除反应所得块状材料,用研钵研磨后,加入4ml模板去除液甲醇:乙酸(9:1)洗脱模板10次,5h/次。最后用300目筛网筛分所得材料,保留小于300目的颗粒,干燥后即的乙酰葡萄糖胺本体印迹材料(mip1)。
该配方中,乙酰葡萄糖胺、功能单体、交联剂、引发剂、溶剂的混合质量比为4:5.6:33.8:0.4:56.2。
用相同的方法,但不加乙酰葡萄糖胺,制备得到非印迹微球(nip)。
分别取20mgmip1或nip1,加入400μl溶解于不同浓度乙腈中的0.1mg/ml乙葡萄糖胺溶液,于25℃下,孵育24h。2500rpm离心5min,去除上清溶液;并用200μl80%乙腈清洗材料2次;最后,用80μl甲醇:乙酸(9:1)洗脱被材料吸附的乙酰葡萄糖胺2次,12h/次;收集洗脱液,并利用高效液相色谱(日立高新chromaster,hilicclickxlon色谱柱4.6×250mm,5μm,
如图1所示,在不同乙腈浓度中,mip1对乙酰葡萄糖胺的吸附容量均高于nip1,说明由于印迹位点的存在,mip1对乙酰葡萄糖胺的亲和力高于nip1。孵育溶剂为85%乙腈时,印迹因子最高,达到1.7,此时mip1对乙酰葡萄糖胺的吸附容量为0.05mg/g。
实施例2
皮克林乳液印迹法制备乙酰葡萄糖胺表面印迹材料(mip2)
以硼酸修饰的硅纳米粒子作为基质材料,粒径30nm。称取100mg乙酰葡萄糖胺溶解于1ml二甲基亚砜中,加入100mg硼酸修饰的硅纳米粒子,超声10min后于60℃振荡反应3h。17000rpm离心20min,收集反应产物,用纯水清洗一次,制备得到键合了乙酰葡萄糖胺的硅纳米粒子,冷冻干燥50min,保存待用,以此作为皮克林乳液的稳定剂。
将50mg键合了乙酰葡萄糖胺的硅纳米粒子超声分散于2.5ml水中,加入68mg功能单体丙烯酰胺,待其完全溶解后于4℃下静置50min,以此作为皮克林乳液的水相。将15mg偶氮二异丁腈加入0.342ml二甲基丙烯酸乙二醇酯中,超声溶解后,将该溶液加入10ml玻璃瓶中;随后将静置后的水相加入玻璃瓶中,用手剧烈摇晃30s;于冰上静置2min后,再剧烈摇晃1min;再次于冰上静置2min后,剧烈摇晃1min;4℃下静置50min后,于70℃反应12h。
将聚合所得材料转移至离心管内,1250rpm离心5min,收集管底材料,用超纯水清洗材料3次,甲醇清洗1次。随后加入3ml甲醇/氢氟酸(v/v,2:1),室温下刻蚀2h,收集材料,再次用3ml刻蚀液刻蚀2h,使硅基质被彻底溶解去除。最后,依次用甲醇-乙酸(9:1,v:v)清洗5次,超纯水清洗2次,甲醇清洗材料2次,真空干燥后,即得乙酰葡萄糖胺表面印迹材料(mip2)。
非印迹材料(nip2)制备过程与mip2相似,但所用稳定剂在模板固定过程中不加乙酰葡萄糖胺。
如图2a所示,乙酰葡萄糖胺表面印迹材料为标准球形颗粒,表面光滑;对其进行局部放大(图2b),可看到mip2表面大量凹陷位点,这是由于表面稳定剂被溶解去除,说明氢氟酸可去除表面稳定剂并形成印迹位点。
实施例3
mip2对乙酰葡萄糖胺及乙酰葡萄糖胺修饰肽段的识别
分别取700mgmip2/nip2加入40ml匀浆液50%乙腈中,超声5min使其形成均一悬浮液。在30mpa压力下装柱,所用柱管尺寸为2.1×150mm。装柱完成后,用50%乙腈在0.1ml/min流速下冲洗柱子2h,随后用0.2ml/min80%乙腈冲洗柱子2h,保存待用。
利用日立高新chromaster色谱系统,以不同比例的乙腈为流动相,流速0.2ml/min,进样5μl0.1mg/ml乙酰葡萄糖胺,检测波长200nm,测定乙酰葡萄糖胺在mip2及nip2柱上的保留时间(tr)。进样5μl20%丙酮,以其出峰时间作为系统死时间(t0)。通过公式k=(tr-t0)/t0计算乙酰葡萄糖胺在mip2及nip2柱上的保留因子k,并以k作为评价指标说明mip2及nip2对乙酰葡萄糖胺作用力的强弱。
图3所示为mip2柱及nip2柱对乙酰葡萄糖胺的色谱分离图。可见,在80%乙腈作为流动相时(图3a),乙酰葡萄糖胺保留很弱,其在mip2柱上的保留略强于nip2柱,这说明mip2对乙酰葡萄糖胺的亲和力强于nip2。将流动相中乙腈浓度升高至95%时,乙酰葡萄糖胺的保留增强,可以看到乙酰葡萄糖胺在mip2柱上的保留明显强于nip2,利用保留因子计算此时if为1.50。
为进一步评价mip2的富集性能,将其用于鼠脑组织酶解产物中乙酰葡萄糖胺修饰肽段的富集。如图4所示,原始鼠脑组织酶解产物中总共鉴定到12个乙酰葡萄糖胺修饰蛋白,对应18条乙酰葡萄糖胺修饰肽段及50张psms。经过mip3富集后,鉴定到的乙酰葡萄糖胺修饰蛋白数提高至20个、乙酰葡萄糖胺修饰肽段提高至50条,对应的psms数升高至222张,说明这mip2对乙酰葡萄糖胺修饰肽段有较好的富集能力。
实施例4
硼亲和辅助的乙酰基葡糖胺表面印迹材料(mip3)的制备
硼亲和辅助的乙酰基葡糖胺表面印迹材料(mip3)及非印迹材料(nip3)的制备方法于实施例2类似,区别在于所用稳定剂不同、采用超声制备皮克林乳液的方式。
稳定剂制备方法如下:以巯基修饰的硅纳米颗粒作为稳定剂的基质材料,粒径300nm。取1g巯基修饰的硅纳米颗粒,及500mg1位烯丙基修饰的乙酰葡萄糖胺,加入50ml甲醇-水(1:1)的溶液中;超声30min后,加入50mg偶氮二异丁基脒盐酸盐,通氮气20min后,于65℃下磁力搅拌反应22h。17000rpm离心10min收集产物,用水和甲醇交替清洗2次,即得键合了乙酰葡萄糖胺的硅纳米颗粒。
取200mg键合了乙酰葡萄糖胺的硅纳米粒子和100mg丙烯酰胺基苯硼酸,加入1.5ml二甲基亚砜中,超声10min使其完全分散,于65℃下振荡反应10h。随后,于20000rpm离心30min,收集离心产物;用1ml甲醇清洗2次后,60℃下真空干燥,即得键合了乙酰葡萄糖胺及乙酰基苯硼酸的硅纳米颗粒,以此作为皮克林乳液的稳定剂,干燥后保存待用。
超声制备皮克林乳液方法如下:将静置后的水相加入玻璃瓶中,用手剧烈摇晃30s;于冰上静置2min后,超声处理1min;再次冰上静置2min后,50%能量下超声处理;置于4℃50min,使模板与egdma通过非共价相互作用进行预组装。
如图5所示,皮克林乳液聚合过程中无破乳现象,制备所得硼亲和辅助的乙酰基葡糖胺表面印迹材料为标准球形,统计其粒径分布,粒径大小为5.6±1.6μm。
实施例5
mip3对乙酰葡萄糖胺及乙酰葡萄糖胺修饰肽段的识别
以80%acn作为孵育溶剂,对mip3及nip3对乙酰葡萄糖胺的吸附性能进行评价,如图6所示。可见mip3对乙酰葡萄糖胺吸附容量高于nip3,说明由于印迹位点的存在,mip3对乙酰葡萄糖胺具有更高的亲和力。
为评价mip3对乙酰葡萄糖胺的选择性,以丝氨酸(ser)和甘氨酸(gly)为参比,分别测定mip3对三种小分子的吸附容量。如图6所示,mip3对乙酰葡萄糖胺的吸附容量最高,达到0.30mg/g;而对ser及gly的吸附容量仅为0.12及0.04mg/g。这说明在简单小分子体系中,mip3对乙酰葡萄糖胺具有较好的选择性。
为进一步评价mip3的富集性能,将其用于鼠脑组织酶解产物中乙酰葡萄糖胺修饰肽段的富集。如图8所示,原始鼠脑组织酶解产物中总共鉴定到12个乙酰葡萄糖胺修饰蛋白,对应18条乙酰葡萄糖胺修饰肽段及50张psms。经过mip3富集后,鉴定到的乙酰葡萄糖胺修饰蛋白数提高至15个、乙酰葡萄糖胺修饰肽段提高至42条,对应的psms数升高至242张,说明这mip3对乙酰葡萄糖胺修饰肽段有较好的富集能力。
实施例6
用甲基丙烯酸作为功能单体,利用亚甲基双丙烯酰胺作为交联剂,以过硫酸铵/亚硫酸氢钠作为氧化还原引发剂,其中乙酰葡萄糖胺、功能单体、交联剂、引发剂、溶剂的混合质量比为30:40:5:5:20,其他同实施例1,可得乙酰葡萄糖胺印本体印迹材料mip4。
实施例7
以10mg键合了乙酰葡萄糖胺的硅纳米粒子作为稳定剂,以乙烯基苯作为功能单体,利用甲苯做油相溶剂,油相中功能单体:交联剂:引发剂:溶剂的质量比为11:72:4.15:12.85,其他同实施例2,可得乙酰葡萄糖胺表面印迹材料mip5。
实施例8
用4m的氢氧化钠水溶液溶解稳定剂的基质材料,具体方法为5ml4m的氢氧化钠水溶液处理聚合产物4次,6h/次。其他同实施例3,可得到乙酰葡萄糖胺表面印迹材料mip6。
- 还没有人留言评论。精彩留言会获得点赞!