人微小miR-106b-5p干扰片段的构建方法及其应用与流程
本发明属于生物技术及基因工程领域,具体涉及一种抑制黑色素瘤细胞增殖的人微小mir-106b-5p(hsa-mir-106b-5p)的干扰片段的构建方法及其应用。
背景技术:
microrna(mirna)是一类长约22个核苷酸的非编码小分子rna,由约70~90个碱基大小的具发夹结构的单链rna前体(pre-mirna)经dicer酶加工后生成。其通过与靶mrna分子3`非编码区域(3’utr)完全或不完全互补配对,降解mrna或抑制其翻译,在个体发育、细胞凋亡、增殖及分化等生命活动中发挥重要作用。mirna可在转录后水平调节多个蛋白表达,单个靶蛋白也可同时接受多个mirnas共同调控,由此形成复杂而精细的调控网络,发挥多种生物学作用。
恶性黑色素瘤死亡率高,放化疗不敏感,晚期患者5年生存率低于5%。我国黑色素瘤发病率及死亡率逐年上升,且发病年龄呈年轻化趋势。尽管分子靶向治疗药物的出现为黑色素瘤临床治疗带来突破性进展,但令人遗憾的是,ctla-4单抗、pd-1单抗、braf抑制剂和mek抑制剂等多种靶向治疗药物均未在国内上市,且价格高昂,耐药率高。因此,寻找黑色素瘤新的治疗靶点尤为重要。
microrna-106b-5p(mir-106b-5p)属于高度保守的mir-106b-25簇,位于染色体7q22,515-bp区域的宿主癌基因微小染色体维持复合组件基因(minichromosomemaintenancecomplexcomponent7,mcm7)内含子13上。研究发现mir-106b-25簇在肿瘤进展中发挥癌基因作用。然而mir-106b-25簇各成员在肿瘤中的作用,至今尚未完全阐明。更重要的是,mir-106b-5p在黑色素瘤恶性进展中的作用尚不明确。
技术实现要素:
本发明的目的是,提出人微小mir-106b-5p(hsa-mir-106b-5p)的干扰片段的构建方法及其在黑色素瘤细胞增殖方面的应用。其中所述的mir-106b-5p全称为:人微小核糖核酸-106b-5`端(hsa-mir-106b-5p)。本发明的目的通过以下技术方案实现:
一、可特异性抑制hsa-mir-106b-5p表达的核苷酸片段的构建方法;
s1,设计与成熟hsa-mir-106b-5p互补的rna单链序列(hsa-mir-106b-5p干扰序列)引物,化学合成该引物。
其中,利用mirbase(http://www.mirbase.org/)数据库,获得成熟hsa-mir-106b-5p的核苷酸序列(hsa-mir-106b-5pmimat0000680)。
s2,设计可特异性干扰hsa-mir-106b-5p的核苷酸序列,并合成其编码基因序列。
s3,用pcr扩增及化学反应的方法,利用“模板序列”合成hsa-mir-106b-5p的干扰序列;
二、采用如上构建方法构建的hsa-mir-106b-5p干扰片段,其特征在于:可与成熟hsa-mir-106b-5p互补配对,形成双链结构,进而抑制hsa-mir-106b-5p的功能。
说明:利用本方法合成的干扰片段,为转录后抑制mirna功能,不能通过pcr扩增的方法检测,其干扰效应及功能需通过以下第三部分方案实现。
三、研究人微小mir-106b-5p的干扰片段在抑制黑色素瘤细胞增殖方面的应用,包括如下步骤。
s4,利用石蜡组织mirna提取试剂盒,分别提取恶性黑色素瘤组织及良性色素痣组织的mirna。分装,-80℃冰箱保存。
s5,mirna反转录为cdna:按下表组份配制rt-pcr反应液(冰上进行),反应条件如下:37℃15min(反转录);85℃5sec(反转录酶的失活反应);4℃保存。
s6,mirnareal-timepcr反应:室温融化2╳mircutemirnapremix。同时,准备好所需正反向引物。将试剂置于冰上,按下表所述配置反应体系,反应条件如下:1╳循环,94℃2min(起始模板变性);35-45╳循环:94℃20sec。
s7,分别合成hsa-mir-106b-5p上下游引物,利用mirnareal-timepcr试剂盒,检测上述恶性黑色素瘤组织及良性色素痣组织中mir-106b-5p的表达情况。(以保守序列u6作为内对照)
mir-106b-5p引物序列:
正向引物:tcgctaaagtgctgacagtgc
反向引物:
gtcgtatccagtgcagggtccgaggtattcgcactggatacgacatctgc
内对照u6引物序列:
正向引物:ctcgcttcggcagcaca
反向引物:aacgcttcacgaatttgcgt
反应体系:
室温融化2╳mircutemirnapremix。同时,准备好所需正反向引物。将试剂置于冰上,配置反应体系:
反应条件如下:1╳循环,94℃2min(起始模板变性);35-45╳循环:94℃20sec(pcr循环中模板变性),60℃34sec(退火延伸);4℃,保存。mirnareal-timepcr结果的计算:
研究采用2-△△ct相对定量法来计算hsa-mir-106b-5p在各黑色素瘤组织细胞及良性色素痣组织细胞中的表达水平,以u6为内源性对照。△ct=各黑色素瘤组织细胞中hsa-mir-106b-5p的ct值—对应样品u6的ct值;△△ct=(各黑色素瘤组织细胞细胞中hsa-mir-106b-5p的ct值-对应样品u6的ct值)—(良性色素痣对照细胞中hsa-mir-106b-5p的ct值-对应样品u6的ct值);而后,以relativeexpression(fold-change)=2-△△ct表示各黑色素瘤组织细胞细胞中hsa-mir-106b-5p表达水平同良性对照组之间的差异。
s8,利用细胞mirna提试剂盒分别提取多株黑色素瘤细胞(a2058、g316、hs852.t、hs895.t)中mirna。
(1)保证细胞生长状态,待细胞融合度约80%-90%时,直接在培养板中加入裂解液充分裂解细胞,提取mirna;
(2)mirna3`末端加poly处理:在冰上预冷的rnasefree的反应管中,加入以下试剂至总体积20ul(最后加入e.colipoly(a)polymerase)。按下表组份配制反应液(冰上进行):
轻轻混匀上述反应液,短暂离心后在37℃反应60min,产物可直接进入下游实验,也可短暂放于-20℃保存,如长期保存则存于-80℃。
(3)poly(a)修饰的mirna逆转录反应:按下表组份配制反应液(冰上进行):
轻轻混匀上述反应液,短暂离心后在37℃反应60min,产物可直接进入下游实荧光定量检测,也可存于-20℃保存。
s8,利用mirnareal-timepcr试剂盒,检测上述恶性黑色素瘤细胞中mir-106b-5p的表达情况(同前述)。
s9、取对数生长的恶性黑色素瘤细胞a2058,加入稀释后的前述人微小核糖核酸-106b-5p干扰片段(hsa-mir-106b-5p-inhibitor),37℃的co2培养箱中培养72h。
s10、细胞增殖试验检测利用mir-106b-5p干扰片段(hsa-mir-106b-5p-inhibitor)抑制mir-106b-5p表达后细胞增殖能力。
本发明的有益效果如下:
1.本发明公开了一种人微小mir-106b-5p(hsa-mir-106b-5p)的干扰片段的构建方法;
2.本发明构建的干扰片段(rna单链)可批量扩增,满足hsa-mir-106b-5p相关的多个分子生物学研究;
3.本发明构建的干扰片段具有抑制人皮肤黑色素瘤细胞增殖的功能。
附图说明
如下具体实施方式将结合上述附图进一步说明本发明。
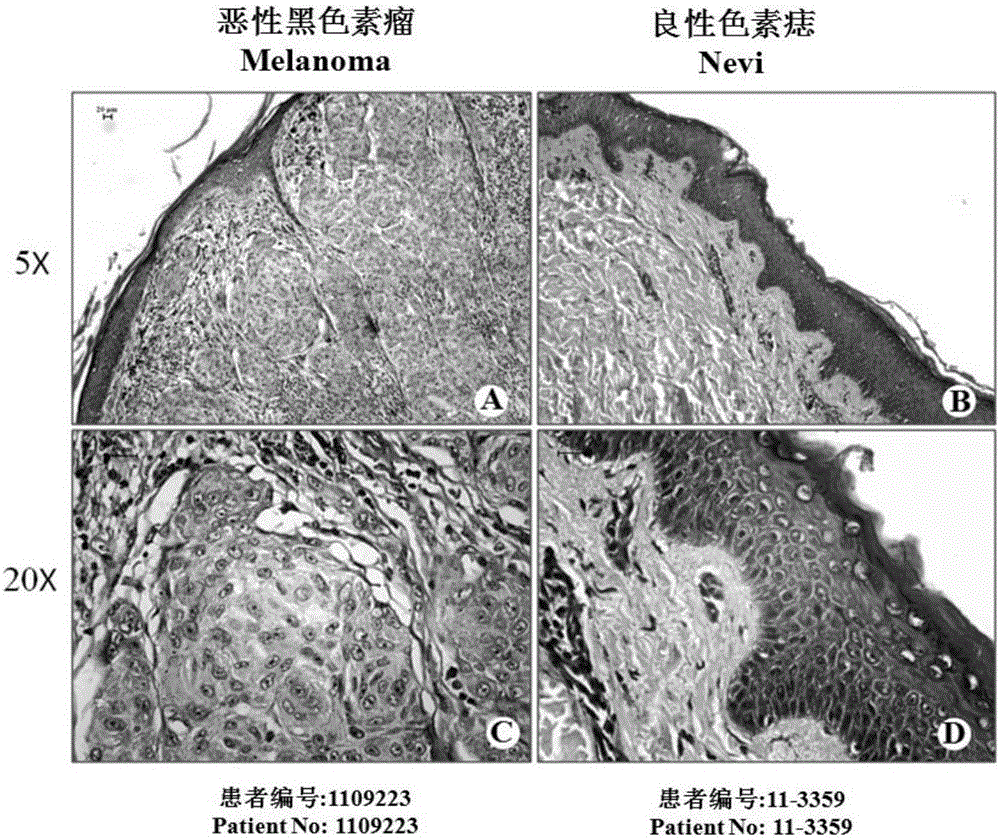
图1表示he染色检测分别检测恶性黑色素瘤组织及良性色素痣组织中肿瘤细胞及痣细胞含量,如图所示:图a、图c恶性黑色素瘤组织;图b、图d良性色素痣组织。
图2表示real-timepcr检测良性色素痣及恶性黑色素瘤组织中mir-106b-5p表达情况,如图所示:a.mir-106b-5p引物融解曲线;b.mir-106b-5p扩增曲线;c.内参u6引物融解曲线;d.内参u6扩展曲线;e.mir-106b-5p在人黑色素瘤组织中表达显著高于良性色素痣(**p<0.01)。
图3表示rt-pcr检测mir-106b-5p在黑色素瘤细胞系a2058、g361、hs852.t、hs895.t中的表达,以u6作为内参;如图所示:mir-106b-5p在四株黑色素瘤细胞系中普遍表达。
图4表示mts检测在a2058细胞中,导入mir-106b-5pinhibitor/nc后,细胞增殖情况;每24h检测实验组及阴性对照组细胞od值,连续检测6天,如图所示:在黑色素瘤细胞中利用mir-106b-5pinhibitor抑制mir-106b-5p后细胞增殖能力明显降低(*p﹤0.05,**p﹤0.01,***p﹤0.001。)
图5表示平板克隆形成试验检测抑制mir-106b-5p黑色素瘤细胞a2058的克隆形成能力;其中,a.未处理组(nt)、无关序列组(nc)及mir-106b-5p抑制组(mir106b-5pkd)中平板克隆形成情况;b.抑制mir-106b-5p后a2058的克隆形成能力与对照组统计情况。如图所示:在黑色素瘤细胞中利用mir-106b-5pinhibitor抑制mir-106b-5p后细胞克隆形成能力明显降低(*p﹤0.05。)
图6表示流式细胞周期术检测抑制mir-106b-5p黑色素瘤细胞a2058的周期阻滞情况;其中,a.未处理组(nt)、无关序列组(nc)及mir-106b-5p抑制组(mir106b-5pkd)中细胞周期分布情况;b.在a2058细胞中抑制mir-106b-5p后各细胞周期检测点细胞数分布情况。如图所示:在黑色素瘤细胞中利用mir-106b-5pinhibitor抑制mir-106b-5p后细胞周期发生g2期阻滞(***p﹤0.001。)
具体实施方式
一种有效抑制黑色素瘤细胞增殖的mir-106b-5p干扰核苷酸序列的构建方法,其包括如下步骤:
(1)利用mirbase(http://www.mirbase.org/)数据库,获得成熟hsa-mir-106b-5p的核苷酸序列(hsa-mir-106b-5pmimat0000680),具体序列如下:
uaaagugcugacagugcagau
(2)利用primerpremier5.0软件设计引物,所设计引物除满足引物设计原则外,其pcr产物应包括全长hsa-mir-106b-5p干扰序列。hsa-mir-106b-5p干扰序列具体序列如下:
cguucauggugucacgc
(3)利用化学合成的方法,合成rna单链。
(4)为了验证hsa-mir-106b-5p干扰片段在皮肤黑色素瘤细胞中的应用,我们检测了hsa-mir-106b-5p在黑色素瘤组织及其良性对照组织(良性色素痣)中的表达情况。为了实现此目的,我们收集了云南省肿瘤医院的黑色素瘤组织及良性色素痣组织各5例,如图1所示,其中恶性黑色素瘤组织中肿瘤细胞含量达到50%~70%。
(5)利用石蜡组织提取rna的方法提取其总rna,并利用real-timepcr技术检测mir-106b-5p的表达情况。如图2所示:引物质量检测提示,mir106b-5p及内参u6在pcr检测组织样本中溶解曲线呈单峰,提示引物特异性较好;扩增曲线重合较好,提示操作具重复性;real-timepcr结果显示:mir-106b-5p在人黑色素瘤组织中表达较良性色素痣显著高表达(图2)
(6)为了进一步验证mir-106b-5p的生物学功能,我们首先关注mir-106b-5p在恶性黑色素瘤细胞系中的表达情况。因此,我们利用rt-pcr初步检测了多株人黑色素瘤细胞系a2058、g361、hs852.t、hs895.t中mir-106b-5p的基础表达量。结果显示:mir-106-5p在黑色素瘤细胞系a2058、g361、hs852.t、hs895.t中普遍表达。
(7)为了研究我们构建的mir-106b-5p干扰片段对黑色素瘤细胞增殖功能的影响,我们在黑色素瘤细胞a2058和g361中,利用mir-106b-5p干扰片段抑制mir-106b-5p表达,利用mts试验检测细胞增殖能力。具体步骤如下:
1.对数生长期的各实验组细胞胰酶消化后,1500rpm离心5min,弃上清;用1ml完全培养基重悬细胞;
2.取20ul混匀的细胞悬液,用200ul台盼蓝稀释,滴在计数板对细胞计数;
3.根据细胞生长快慢决定铺板细胞密度(96孔板,约2000细胞/孔,150ul培养基/孔)
4.将铺板细胞置37℃,5%co2培养箱培养;
5.铺板后第二天观察细胞状态,每天加入30μl/孔mts试剂,置37℃,5%co2培养箱孵育2h;
6.在荧光扫描仪上490nm波长处检测甲臜产物量;
7.根据扫描所得的od值,进行统计绘图,制作细胞增殖曲线;
如图3所示,在黑色素瘤细胞系a2058中,导入mir-106b-5p干扰核苷酸片段后,细胞增殖能力较未处理组(nt)、阴性对照组(nc)及无关序列组增殖能力显著下降。同理,如图4所示在黑色素瘤细胞系a2058中,导入mir-106b-5p干扰片段后,细胞克隆形成能力较未处理组(nt)、阴性对照组(nc)及无关序列组增殖能力显著下降。
(8)在mts和平板克隆形成实验证实mir-106b-5p干扰片段可抑制黑色素瘤细胞a2058增殖功能的情况下,为了进一步探讨mir-106b-5p干扰片段对黑色素瘤细胞周期功能的影响,我们利用流式细胞周期检测导入mir-106b-5p干扰片段后的黑色素瘤细胞a2058细胞周期分布情况。具体操作如下:
1.待各实验组细胞生长至融合率约为80%时,弃细胞培养上清,pbs洗涤细胞一次,胰酶消化细胞,完全培养基终止,收集细胞于15ml离心管中,每组设3个复孔;
2.将15ml离心管1200rpm离心5min,弃去上清;
3.4℃预冷的pbs(ph7.2~7.4)洗涤细胞2次,1500rpm离心5min,弃上清液,收集细胞;
4.4℃预冷的70%乙醇重悬并固定细胞12h;
5.1500rpm离心5min去固定液,pbs洗涤细胞沉淀一次;
6.细胞染色液配制:40×pi母液(2mg/ml):100×rnase母液(10mg/ml):1×pbs=25:10:1000;
7.细胞染色:根据细胞量,加入一定体积的细胞染色液(1~1.5ml)重悬,使上机时细胞通过率为200~350cell/s;
8.300目的筛网过滤于流式上机管中,上机检测;
如图5所示:在黑色素瘤细胞系a2058中,导入mir-106b-5p干扰片段抑制mir-106b-5p后,a2058细胞发生g0/g1期阻滞。
由此可见,人微小mir-106b-5p干扰片段在制备抗黑色素瘤药物方面有着良好的应用前景。
以上所述实施例,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!