一种两离子淀粉基干细胞扩增水凝胶的制备方法及干细胞扩增和收集方法与流程
本发明涉及一种干细胞扩增水凝胶及其制备方法基于两离子淀粉水凝胶的干细胞扩增和收集方法,属于生物医学工程领域。
背景技术:
干细胞是人体及其各种组织细胞的最初来源,具有高度自我更新能力、高度增殖和多向分化潜能、可植入性和重建能力等特征。在细胞治疗和组织工程中具有良好的应用前景,其规模化扩增是其临床应用的前提和基础。在临床治疗及组织工程应用时需求量较大,一般在109-1011之间,传统的二维培养技术由于扩增效率低无法实现干细胞的规模化扩增,近年来,发展的基于微载体的3d培养技术在一定程度上了实现细胞的规模化扩增。但是,也存在一些问题需要解决,例如,在培养过程中容易受到非特异性蛋白的干扰,使细胞在扩增过程中“干性”维持困难,特别是对于一些具有自分化能力的细胞(例如:具有心肌自分化能力的棕色脂肪干细胞),这种现象更为明显。为此,开发一种具有抗蛋白非特异性粘附的干细胞扩增水凝胶具有十分重要的意义。
两性离子聚合物可通过优良的亲水性能,在其表面形成水合层,阻止蛋白的粘附,具有良好的抗蛋白粘附性能。同时具有良好的生物相容性,能够支持多种细胞的增殖,在干细胞扩增中具有潜在的应用前景。为了改善现有细胞扩增用载体的缺点,我们以两性离子淀粉为基材,采用“点击”化学的手段创造性地研制了一种干细胞扩增用水凝胶,两性离子基团的引入可为“干性”维持创造有利的条件。
技术实现要素:
本发明的目的在于克服现有干细胞扩增技术的不足,提供一种生物相容性好、抗蛋白非特异性粘附的两离子淀粉基水凝胶为干细胞扩增载体。
本发明的目的在于克服现有技术的不足,提供一种制备上述两离子淀粉基干细胞扩增水凝胶的制备方法。
本发明的上述目的通过下述技术方案予以实现。
一种两离子淀粉基干细胞扩增水凝胶的制备方法;包括如下步骤:
(1)将淀粉置于去离子水中,形成淀粉悬浮液;将等体积的naoh溶液滴加到淀粉悬浮液中,将混合物升温至30-40℃反应,得到碱化淀粉溶液;
(2)将二甲基(氯丙基)铵丙磺酸盐溶于去离子水中,滴加到步骤(1)的碱化淀粉溶液中,并加热至50-80℃,4-7小时后,冷却至室温,用冰乙酸中和至中性;然后向体系中加入与反应体系等体积的去离子水;并将此溶液滴加到甲醇中进行沉析,而后离心,并用甲醇洗;室温真空干燥后,得到两离子淀粉;
(3)将步骤(2)获得的两离子淀粉溶于二甲基亚砜中,同时将氯化钠加入其中,在130℃下充分溶解,并持续搅拌直至溶液冷却至50℃;在氮气保护下加入4-二甲氨基吡啶,继续搅拌30-60分钟后,加入甲基丙烯酸缩水甘油酯,反应12-36小时;将反应混合液倒入甲醇中析出棕褐色粉末状固体,抽滤,再将粗产物用甲醇洗涤后真空干燥,得到纯净的甲基丙烯酸酯改性的两离子淀粉;
(4)将甲基丙烯酸酯改性两性离子淀粉溶液于磷酸盐缓冲溶液(pbs)中,并在其中加入半胱氨酸-甘氨酸-精氨酸-甘氨酸-天冬氨酸-丝氨酸多肽(cgrgds),反应10-30分钟;
(5)再将双端巯基改性聚乙二醇溶解于pbs中,形成浓度为0.1-40%的溶液;
(6)将等体积的步骤(4)和步骤(5)制备的溶液混合,置于37℃下凝胶化,最终得到两性离子淀粉/聚乙二醇/精氨酸-甘氨酸-天冬氨酸多肽(rgd)两离子淀粉基干细胞扩增水凝胶。
所述步骤(1)中淀粉悬浮液质量浓度为20-60%;naoh溶液浓度为25w/v%。
所述步骤(1)中在30-40℃反应0.5-3h。
所述步骤(2)中淀粉的质量是二甲基(氯丙基)铵丙磺酸盐质量的0.3-30倍。
所述步骤(2)中二甲基(氯丙基)铵丙磺酸盐溶于去离子水溶液质量浓度是1-10%。
所述步骤(2)甲醇体积为去离子水体积的1-5倍。
所述步骤(3)两离子淀粉溶于二甲基亚砜的质量浓度为2-7%;氯化钠的浓度为2-8%;4-二甲氨基吡啶浓度为0.5-3%;甲基丙烯酸缩水甘油酯浓度为1-5%。
所述步骤(4)甲基丙烯酸酯改性两性离子淀粉溶液于pbs中质量浓度1-30%;并在其中加入cgrgds,质量浓度控制0.01-0.1%。
基于本发明制备两离子淀粉基干细胞扩增水凝胶的干细胞扩增和收集方法,其主要包括以下过程:
(1)将干细胞重悬于获得的甲基丙烯酸酯改性两性离子淀粉与cgrgds和双端巯基改性聚乙二醇混合前驱液体中,并加入5-15%的胎牛血清,然后制备水凝胶/干细胞复合体;
(2)将步骤(1)制备的水凝胶/干细胞复合体浸泡于细胞培养液中,37℃和5%co2条件下常规培养,每天换液;
(3)培养7-14天后,采用naoh溶液将培养液ph调控至7.8-8.5,5-30分钟后,水凝胶全部降解后,采用大量的培养液快速稀释,使其ph调整为中性,离心收集扩增的细胞。
与现有技术相比,本发明具有如下有益效果:本发明制备的两离子淀粉基水凝胶通过“点击”化学技术获得,操作简单,同时制备过程中免除了有机溶剂的参与,具有一定的环境友好性,减少了由于合成过程而造成的支架生物相容性降低的缺点。所研制的水凝胶可通过聚合物的含量使其力学强度控制在27.21-69.92kpa.更为重要的是,该水凝胶能够有效降低细胞扩增过程中非特异性蛋白的粘附。在制备过程中引入了细胞特异性粘附多肽cgrgds有效提高了细胞的增殖活性。所研制的水凝胶能够支持多种干细胞的扩增,并在扩增过程中保持干细胞特性,为组织工程和细胞治疗策略提供坚实的技术支持。
附图说明
图1是两离子淀粉基水凝胶的力学强度;所制备两性离子水凝胶的力学强度随着浓度的增加而增加,而rgd的修饰没有改变凝胶的力学强度;
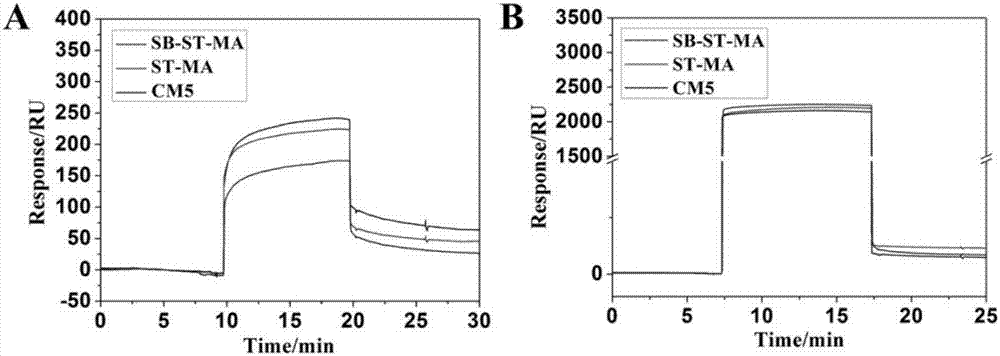
图2是两离子淀粉的抗蛋白粘附行为;(a)白蛋白,(b)纤连蛋白。相比于对照组cm5,两性离淀粉能够有效的阻止白蛋白和纤连蛋白,特别是对于白蛋白,两离子淀粉的抗蛋白能力远高于未经修饰的淀粉;
图3是badscs在水凝胶中的生长形态;两离子淀粉水凝胶具有很好的生物相容性,没有引起细胞毒性,随着时间的延长,水凝胶中细胞的数量明显增加,同时rgd的引入能够提高细胞在水凝胶中的增殖活性;
图4是从水凝胶中收集的badscs在培养板上培养时的ctnt、α-actinin和cx43染色照片。相比于对照组,从两离子淀粉中收集的细胞仍然表现出相似的向心肌细胞分化的行为,表达大量的ctnt和α-actinin心肌特异性蛋白。而在淀粉水凝中的收集的细胞几乎看不到心肌特异性蛋白的表达。
具体实施方式
下面结合具体实施例进一步说明本发明的技术方案。
(1)将淀粉置于去离子水中,形成质量百分比浓度为20-60%的淀粉悬浮液;将等体积的naoh溶液(25w/v%)逐滴滴加到淀粉悬浮液中,将混合物升温至30-40℃,反应0.5-3h;
(2)将二甲基(氯丙基)铵丙磺酸盐(dcaps)溶于去离子水中,形成1-10%的dcaps,并其逐滴滴加到步骤(1)制备的碱化淀粉溶液中,并加热至50-80℃;4-7小时后,冷却至室温,用冰乙酸中和至中性;然后向体系中加入与反应体系等体积的去离子水;并将此溶液逐滴滴加到200-600ml的甲醇中进行沉析,而后离心(5000rpm,5min),并用甲醇洗三次;室温真空干燥24-72h后,得到两离子淀粉(sb-st),备用。
(3)将步骤(2)获得的sb-st溶于dmso中,制备质量浓度为2-7%的sb-st溶液,同时将氯化钠加入其中,使氯化钠的浓度达到2-8%,在130℃下充分溶解,并持续搅拌直至溶液冷却至50℃;在氮气保护下加入4-二甲氨基吡啶(dmap),dmap的浓度控制在0.5-3%,继续搅拌30-60分钟后,加入甲基丙烯酸缩水甘油酯(gma),浓度控制在1-5%,反应12-36小时;将反应混合液倒入大量甲醇中析出棕褐色粉末状固体,抽滤,再将粗产物用甲醇洗涤三次后真空干燥,得到纯净的甲基丙烯酸酯改性的两离子淀粉(sb-st-ma);
(4)将甲基丙烯酸酯改性两性离子淀粉溶液于psb中(质量浓度1-30%),并在其中加入cgrgds,质量浓度控制0.01-0.1%,充分反应10-30分钟;
(5)再将双端改性聚乙二醇溶解于pbs中,形成浓度为0.1-40%的溶液,备用;
(6)将等体积的步骤(4)和步骤(5)制备的溶液混合,置于37℃下凝胶化,最终得到两性离子淀粉/聚乙二醇/rgd水凝胶。
本发明的目的还在于提供一种基于所制备两离子淀粉水凝胶的干细胞扩增和收集技术,其特征主要包括以下过程:
(1)将干细胞(棕色脂肪干细胞、白色脂肪间充质干细胞、骨髓间充质干细胞的扩增等)重悬于获得的甲基丙烯酸酯改性两性离子淀粉与cgrgds和双端巯基改性聚乙二醇混合前驱液体中,并加入5-15%的胎牛血清。然后制备包裹有干细胞的水凝胶。
(2)将步骤(1)制备的水凝胶/干细胞复合体浸泡于细胞培养液中,37℃和5%co2条件下常规培养,每天换液。
(3)培养7-14天后,采用naoh溶液将培养液ph调控至7.8-8.5,5-30分钟后,水凝胶全部降解后,采用大量的培养液快速稀释,使其ph调整为中性,离心收集扩增的细胞。
下面实施例中使用的试剂主要包括以下几种:淀粉(st),两性离子淀粉(sb-st,两性离子修饰度47%),4-二甲氨基吡啶(dmap),甲基丙烯酸缩水甘油酯(gma),聚乙二醇(平均分子量4000),3-巯基丙酸,dl-二流苏糖醇(dtt),对甲苯磺酸(p-tsa),氯化钠,二甲基亚砜(dmso),甲苯,甲醇,丙酮,磷酸盐缓冲液(pbs,0.01m,ph7.4)
实施例1:甲基丙烯酸酯改性两性离子淀粉(sb-st-ma)的制备及表征
例1:将5g淀粉加入20ml水中,逐滴加入浓度为25w/v/%的naoh水溶液20ml,升高温度至40℃,反应3小时。将2.5gdcaps溶于250ml水中,加入上述反应液中,加热到80℃,反应4小时后,冷却至室温,冰乙酸中和至中性。然后加入300ml水,用300ml甲醇沉淀,室温真空干燥后,得到两离子淀粉。
将1.38g两性离子淀粉和4.0g氯化钠在130℃下充分溶解于60mldmso中,并持续搅拌直至溶液冷却至50℃。在氮气保护下加入0.35gdmap继续搅拌30分钟后,加入2.10ggma反应36小时。将反应混合液倒入大量甲醇中析出棕褐色粉末状固体,抽滤,再将粗产物用甲醇洗涤三次后真空干燥,得到纯净的甲基丙烯酸酯改性淀粉,产率90%,甲基丙烯酸酯修饰度30%。采用核磁表征其形成,1hnmr(400mhz,d2o,δ/ppm):6.14,5.72(s,2h;-c=ch2),5.34,3.87,3.76,3.58(s,5h;c-ch-o,c-ch-o,c-ch2-o,c-ch-c),3.42(s,4h;n+-ch2),3.06(s,6h;n+-(ch3)2),2.92(s,2h;ch2-so3-),2.04(s,4h;c-ch2-c),1.90(s,3h;-c(ch3)-c=c).
例2:将5g淀粉加入5ml水中,逐滴加入浓度为25w/v/%的naoh水溶液5ml,升高温度至30℃,反应0.5小时。将150gdcaps溶于1500ml水中,加入上述反应液中,加热到50℃,反应4小时后,冷却至室温,冰乙酸中和至中性。然后加入1500ml水,用7.5l甲醇沉淀,室温真空干燥后,得到两离子淀粉。
将3g两性离子淀粉和1.38g氯化钠在130℃下充分溶解于60mldmso中,并持续搅拌直至溶液冷却至50℃。在氮气保护下加入2.07gdmap继续搅拌60分钟后,加入0.69ggma反应12小时。将反应混合液倒入大量甲醇中析出棕褐色粉末状固体,抽滤,再将粗产物用甲醇洗涤三次后真空干燥,得到纯净的甲基丙烯酸酯改性淀粉,产率85%,甲基丙烯酸酯修饰度25%。采用核磁表征其形成,1hnmr(400mhz,d2o,δ/ppm):6.14,5.72(s,2h;-c=ch2),5.34,3.87,3.76,3.58(s,5h;c-ch-o,c-ch-o,c-ch2-o,c-ch-c),3.42(s,4h;n+-ch2),3.06(s,6h;n+-(ch3)2),2.92(s,2h;ch2-so3-),2.04(s,4h;c-ch2-c),1.90(s,3h;-c(ch3)-c=c).
例3:将5g淀粉加入10ml水中,逐滴加入浓度为25w/v/%的naoh水溶液10ml,升高温度至36℃,反应2小时。将100gdcaps溶于1500ml水中,加入上述反应液中,加热到70℃,反应5小时后,冷却至室温,冰乙酸中和至中性。然后加入1500ml水,用3000ml甲醇沉淀,室温真空干燥后,得到两离子淀粉。
将4.55g两性离子淀粉和5.52g氯化钠在130℃下充分溶解于60mldmso中,并持续搅拌直至溶液冷却至50℃。在氮气保护下加入1.05gdmap继续搅拌50分钟后,加入3.45ggma反应24小时。将反应混合液倒入大量甲醇中析出棕褐色粉末状固体,抽滤,再将粗产物用甲醇洗涤三次后真空干燥,得到纯净的甲基丙烯酸酯改性淀粉,产率88%,甲基丙烯酸酯修饰度30%。采用核磁表征其形成,1hnmr(400mhz,d2o,δ/ppm):6.14,5.72(s,2h;-c=ch2),5.34,3.87,3.76,3.58(s,5h;c-ch-o,c-ch-o,c-ch2-o,c-ch-c),3.42(s,4h;n+-ch2),3.06(s,6h;n+-(ch3)2),2.92(s,2h;ch2-so3-),2.04(s,4h;c-ch2-c),1.90(s,3h;-c(ch3)-c=c).
实施例2:甲基丙烯酸酯改性淀粉(st-ma)的制备及表征
例1:将4.05g淀粉于90℃下完全溶解于50mldmso中,并持续搅拌直至溶液冷却至50℃。在氮气保护下加入1.53gdmap继续搅拌30分钟后,加入1.78ggma反应24小时。将反应混合液倒入大量甲醇中析出棕褐色粉末状固体,抽滤,再将粗产物用甲醇洗涤三次后真空干燥,得到纯净的甲基丙烯酸酯改性淀粉,产率95%,甲基丙烯酸酯修饰度30%。1hnmr(400mhz,d2o,δ/ppm):6.14,5.72(s,2h;-c=ch2),5.32,3.88,3.75,3.57(s,5h;c-ch-o,c-ch-o,c-ch2-o,c-ch-c),1.88(s,3h;-c(ch3)-c=c).
例2:将8.1g淀粉于90℃下完全溶解于50mldmso中,并持续搅拌直至溶液冷却至50℃。在氮气保护下加入3.06gdmap继续搅拌30分钟后,加入3.56ggma反应24小时。将反应混合液倒入大量甲醇中析出棕褐色粉末状固体,抽滤,再将粗产物用甲醇洗涤三次后真空干燥,得到纯净的甲基丙烯酸酯改性淀粉。1hnmr(400mhz,d2o,δ/ppm):6.14,5.72(s,2h;-c=ch2),5.32,3.88,3.75,3.57(s,5h;c-ch-o,c-ch-o,c-ch2-o,c-ch-c),1.88(s,3h;-c(ch3)-c=c).
实施例3:“点击”的两离子淀粉基水凝胶研制及性能评价
例1:将200mg、300mg、400mg的甲基丙烯酸酯改性两性离子淀粉分别溶于1ml的pbs中,在其中加入10mg的cgrgds,cgrgds的终浓度为0.1-2mm,并充分反应30分钟,再将224mg双端巯基改性聚乙二醇溶解于1ml的pbs溶液中并与上述溶液充分混合后置于37℃下凝胶化,最终得到不同st-sb-ma浓度的两性离子淀粉/聚乙二醇/rgd水凝胶。同时制备基于st-ma的水凝胶作为对照。采用万能力学仪测定所研制水凝胶的压缩强度,其压缩强度与聚合物浓度有关,压缩强度可控制在27.21-69.92kpa(图1);spr技术测定两离子淀粉st-sb-ma的抗蛋白粘附性能,与对照st-ma相比具有良好的抵抗白蛋白和纤连蛋白的粘附特性(图2)。
例2:将10mg的甲基丙烯酸酯改性两性离子淀粉分别溶于1ml的pbs中,在其中加入0.3mg的cgrgds,并充分反应15分钟,再将1.0mg双端巯基改性聚乙二醇溶解于1ml的pbs溶液中并与上述溶液充分混合后置于37℃下凝胶化,最终得到不同st-sb-ma浓度的两性离子淀粉/聚乙二醇/rgd水凝胶。
例3:将100mg的甲基丙烯酸酯改性两性离子淀粉分别溶于1ml的pbs中,在其中加入0.1mg的cgrgds,并充分反应10分钟,再将400mg双端巯基改性聚乙二醇溶解于1ml的pbs溶液中并与上述溶液充分混合后置于37℃下凝胶化,最终得到不同st-sb-ma浓度的两性离子淀粉/聚乙二醇/rgd水凝胶。
例4:将300mg的甲基丙烯酸酯改性两性离子淀粉分别溶于1ml的pbs中,在其中加入1mg的cgrgds,并充分反应30分钟,再将150mg双端巯基改性聚乙二醇溶解于1ml的pbs溶液中并与上述溶液充分混合后置于37℃下凝胶化,最终得到不同st-sb-ma浓度的两性离子淀粉/聚乙二醇/rgd水凝胶。
例5:将200mg、300mg、400mg的甲基丙烯酸酯改性两性离子淀粉分别溶于1ml的pbs中,在其中加入100mg的cgrgds,并充分反应20分钟,再将224mg双端巯基改性聚乙二醇溶解于1ml的pbs溶液中并与上述溶液充分混合后置于37℃下凝胶化,最终得到不同st-sb-ma浓度的两性离子淀粉/聚乙二醇/rgd水凝胶。
例6:将800mg的甲基丙烯酸酯改性两性离子淀粉分别溶于1ml的pbs中,在其100mg的cgrgds,并充分反应60分钟,再将448mg双端巯基改性聚乙二醇溶解于1ml的pbs溶液中并与上述溶液充分混合后置于37℃下凝胶化,最终得到不同st-sb-ma浓度的两性离子淀粉/聚乙二醇/rgd水凝胶。
例7:将1mg的甲基丙烯酸酯改性两性离子淀粉分别溶于1ml的pbs中,在其中加入一定量的cgrgds,cgrgds的终浓度为0.1-2mm,并充分反应30分钟,再将224mg双端巯基改性聚乙二醇溶解于1ml的pbs溶液中并与上述溶液充分混合后置于37℃下凝胶化,最终得到不同st-sb-ma浓度的两性离子淀粉/聚乙二醇/rgd水凝胶。
实施例4:棕色脂肪来源干细胞在两离子淀粉基水凝胶中的扩增
例1:(1)棕色脂肪干细胞的分离
将60-80gsd大鼠断颈处死,在75%乙醇浸泡消毒后转移到超净工作台中,用无菌剪刀和弯镊剪开大鼠的背部皮肤,轻轻剪取背部和肩胛骨周围的棕色脂肪组织,注意尽量不要剪到肌肉层,然后将取出的组织在培养皿中用预冷的pbs缓冲液冲洗三遍。弯剪剪碎,每克棕色脂肪组织中加入10ml预热的混合消化酶,在37℃,5%co2条件下旋转搅拌消化40分钟左右,直到无肉眼可见大块组织,消化结束后,在消化液中加入等体积的含15%胎牛血清的α-mem培养基中止消化过程,充分吹吸混匀后,依次用100目和200目筛网过滤消化液,弃去上层残余组织块,收集消化液,600g离心8分钟,用无血清的α-mem培养基洗涤沉淀1次,
(2)badscs在水凝胶中的扩增与收集
将分离的棕色脂肪干细胞重悬于获得的甲基丙烯酸酯改性两性离子淀粉与cgrgds和双端巯基改性聚乙二醇混合前驱液体中,并加入5-15%的胎牛血清。然后制备包裹有干细胞的水凝胶。浸泡于2ml细胞培养液中,37℃和5%条件下常规培养,每天换液。结果显示所研制的水凝胶具有良好的生物相容性,能够支持badscs的生长(图3)。培养10天后,采用naoh溶液将培养液ph调控至7.8,10分钟后,水凝胶全部降解后,采用大量的培养液快速稀释,使其ph调整为中性,离心收集扩增的细胞。收集后的细胞仍然保持badscs向心肌细胞分化的特点(图4)
例2:将分离的棕色脂肪干细胞重悬于获得的甲基丙烯酸酯改性两性离子淀粉与cgrgds和双端巯基改性聚乙二醇混合前驱液体中,并加入5-15%的胎牛血清。然后制备包裹有干细胞的水凝胶。浸泡于2ml细胞培养液中,37℃和5%条件下常规培养,每天换液。结果显示所研制的水凝胶具有良好的生物相容性,能够支持badscs的生长(图3)。培养7天后,采用naoh溶液将培养液ph调控至8.2,30分钟后,水凝胶全部降解后,采用大量的培养液快速稀释,使其ph调整为中性,离心收集扩增的细胞。
例3:将分离的棕色脂肪干细胞重悬于获得的甲基丙烯酸酯改性两性离子淀粉与cgrgds和双端巯基改性聚乙二醇混合前驱液体中,并加入5-15%的胎牛血清。然后制备包裹有干细胞的水凝胶。浸泡于2ml细胞培养液中,37℃和5%条件下常规培养,每天换液。结果显示所研制的水凝胶具有良好的生物相容性,能够支持badscs的生长(图3)。培养14天后,采用naoh溶液将培养液ph调控至8.5,5分钟后,水凝胶全部降解后,采用大量的培养液快速稀释,使其ph调整为中性,离心收集扩增的细胞。
本发明的水凝胶由甲基丙烯酸酯改性两离子淀粉和双端巯基改性聚乙二醇通过巯基-烯点击手段形成,并在制备过程中引入cgrgds多肽,提高水凝胶对细胞的亲和能力。该水凝胶可通过聚合物的含量使其力学强度控制在27.21-69.92kpa.更为重要的是,其能够有效降低细胞扩增过程中非特异性蛋白的粘附。具有良好的生物相容性,能够支持棕色脂肪干细胞的增殖,并在增殖过程中保持其干细胞特性。可为组织工程和细胞治疗策略提供坚实的技术支持。
- 还没有人留言评论。精彩留言会获得点赞!