NGN2介导成年鼠嗅鞘细胞直接重编程为神经元的方法及其应用与流程
本发明涉及细胞重编程技术领域,具体地说,是利用成年小鼠的成体嗅鞘细胞直接重编程为功能性神经元的方法。
背景技术:
细胞移植已经成为治疗脊髓损伤的一个重要手段。嗅鞘细胞(Olfactory ensheathing cells,OECs)移植技术经过多轮临床研究被证实是在是足够安全、可行的,它能够通过改善脊髓损伤局部微环境来发挥神经保护功能,进而有利于神经功能恢复,但效果还不够理想。脊髓损伤引起的主要病理变化是不可逆性局部神经元变性坏死和神经环路破坏,如何补充替代脊髓损伤局部变性丢失的神经元并重建局部神经环路是脊髓损伤治疗的关键。近年来,细胞重编程技术(Reprogramming technique)的出现给整个生命科学和再生医学带来了革命性的变化。通过细胞重编程,我们可以在体外将体细胞直接转分化为特定细胞类型。例如,成纤维细胞、星形胶质细胞或血管周细胞在体外通过直接重编程都可以不经历干细胞或前体细胞的状态而改变细胞的谱系,定向转分化成神经元。OECs是嗅觉系统内一类特殊的胶质细胞,同时存在于中枢(嗅球)和外周(鼻粘膜)神经系统,兼具星形胶质细胞和雪旺细胞的一些生物学特征。相对于成纤维细胞,OECs的细胞谱系与神经元比较接近,理论上较容易被重编程为神经元。更重要的是,OECs在临床上可以通过病人的鼻粘膜自身获取并进行体外扩增。另外,成纤维细胞重编程时,为转分化为神经元的细胞移植后不利于神经再生;而OECs重编程是,为被转分化为神经元的OECs移植后也可以发挥促进神经再生修复的作用。因此,OECs应该是一种理想的重编程靶细胞对象。目前,有关嗅鞘细胞重编程为神经元并应用于移植治疗脊髓损伤,尚无文献报道。
技术实现要素:
本发明的目的在于提供在体外建立将成年小鼠OECs重编程为功能性神经元的方法,并将重编程所得神经元用于移植治疗脊髓损伤。
本发明的第一方面,提供NGN2(Neurogenin 2)介导成年鼠嗅鞘细胞直接重编程为功能性神经元的方法,包括以下步骤:
A、成年小鼠OECs原代培养
成年小鼠鼻中隔两侧的粘膜以及鼻甲表面粘膜放入4℃的解剖液中,在显微镜下剥离粘膜外边的薄膜,剪碎,或取成年小鼠嗅球的嗅神经层和嗅小球层部分剪碎;剪碎后,用0.25%的胰酶在37℃细胞培养箱中消化15min,加入DF12-15%FBS培养基终止消化,离心机800rpm离心4min后吸去上清,重新加入适量培养液后反复吹打单细胞悬液,然后种到不涂胶的T25培养瓶中;36h后将悬浮的细胞液移到新的不涂胶的T25培养瓶中,再过36h后,将没有贴壁的细胞悬液种在涂有L-型多聚赖氨酸(PLL,0.1mg/ml)的培养板上;随后在嗅鞘细胞的培养液中加入2uM的Forskolin和10ng/ml的bFGF;在细胞培养过程中每隔两天换一次液,一周左右即可传代,传代1~2次后用于细胞诱导;
B、NGN2质粒构建和慢病毒包装
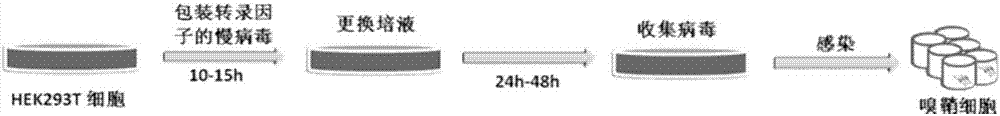
利用PCR仪扩增含有NGN2的目的基因片段,反转录得到cDNA,将携带有人源性NGN2基因的cDNA片段构建到第三代慢病毒载体(pCSC-SP-IRES-GFP)上,获得pCSC-SP-PW-NGN2-IRES-GFP(简称为NGN2)慢病毒质粒;病毒包装时,在DMEM中将NGN2慢病毒质粒与包装质粒(pMDL,VSV-G,和pREV)按照4:1:1:1,通过瞬时转染HEK293T细胞的方法产生出携带有NGN2-GFP基因的复制缺陷型慢病毒,在转染后第10-15h换成培养HEK293T细胞的培液,之后在第24h收集一次病毒上清,在第48h收集第二次病毒上清,将两次收集的病毒液混合离心,经滤器过滤后可直接用于感染OECs;
C、OECs重编程为神经元
将OECs传代后种在铺有PLL及基质胶的细胞培养板上或者细胞玻片上,待细胞完全贴壁后培养2-3天后,将离心纯化后的慢病毒添加聚凝胺(polybrene,6μg/ml)之后加入到培养孔板中感染OECs,10-12h后换成OECs培养液,待细胞感染病毒约48h后换成神经元诱导培养基(neuronal induction medium),在此诱导培养基中含有DMEM/DF12、Neurobasal溶液、0.8%N-2、0.4%B27、Forskolin(2uM)、BMP通路抑制剂Dorsomorphin(1μM)、成纤维细胞生长因子(bFGF,10ng/ml)及1%青链霉素,每隔一天更换一次培养基。
优选的,所述的成年小鼠取自成年(年龄≥8周)C57/BL6J小鼠。
需要说明的是,所述的小鼠嗅球的嗅神经层和嗅小球层的获得方法为:用二氧化碳窒息法将小鼠处死后迅速用75%酒精进行消毒,剪刀断头后,将颅骨剥开,分离出嗅球并置于4℃的解剖液中,显微镜下剥离包裹在嗅球外面的薄膜,获得嗅球的嗅神经层和嗅小球层部分。
需要说明的是,所述的小鼠鼻中隔两侧的粘膜以及鼻甲表面粘膜的获得方法为:用二氧化碳窒息法处死小鼠后快速用75%酒精进行消毒,断头,用剪刀锐性分离外鼻皮肤,将颅骨剪至鼻顶处,再用剪刀在鼻顶部岔开,露出鼻中隔,用弯镊小心将鼻中隔两侧的粘膜以及鼻甲表面粘膜取出。
本发明的第二方面,提供一种采用上述方法从成年小鼠OECs重编程得到的神经元样细胞。
本发明的第三方面,提供一种采用上述方法从成年小鼠OECs重编程得到的神经元样细胞在制备治疗脊髓损伤的药物中的应用。
本发明优点在于:
1、本发明技术方案的关键在于如何通过简单、快速的方法将成年小鼠OECs直接重编程诱导成为神经元,以便在合适的窗口期移植治疗脊髓损伤。本发明首次发现单独应用Neurogenin 2(NGN2)这一个转录因子在两周时间内即可将OECs重编程为神经元。该技术体系的建立,将会对移植自体细胞诱导所得神经元治疗脊髓损伤提供有力技术支持。
2、采用本发明的培养诱导方法培养出的神经元样细胞的分子标识与正常神经元较一致。
3、本发明的神经元诱导重编程方法简便并且不需要特殊的材料及设备,可在实验室中得到广泛的应用。
4、本发明用小鼠作为实验对象,小鼠与人的谱系关系较接近,用其OECs诱导重编程所得神经元,将会对移植自体细胞诱导所得神经元治疗脊髓损伤方面提供有力支持。
附图说明
图1:慢病毒包装和收集用于感染嗅鞘细胞的流程模式图。
图2:慢病毒感染嗅鞘细胞后体外重编程产生神经元的流程模式图。
图3:NGN2诱导嗅鞘细胞重编程为神经元的效率。(A)新生幼鼠的嗅鞘细胞感染病毒后进行诱导培养14天后能得到了Tuj1阳性细胞。(B)成年小鼠的嗅鞘细胞感染病毒后进行诱导培养14天后能得到了Tuj1阳性细胞。(C)实验结果统计后发现成年小鼠的转分化效率(转分化效率=Tuj1+细胞/GFP+细胞)在80%左右。
图4:NGN2诱导嗅鞘细胞转分化得到的神经元能够分化成熟。(A)嗅鞘细胞感染病毒后诱导培养了14天、21天、35天,免疫细胞化学染色的方法显示NGN2诱导的新生神经元能够表达成熟神经元的标记物NeuN,但是对照组并没有相应的表达。比例尺=50um。
图5:NGN2可以诱导嗅粘膜来源的嗅鞘细胞转分化得到神经元。体外诱导14天嗅粘膜中的嗅鞘细胞可转分化得到NeuN阳性的成熟神经元细胞。
图6:嗅鞘细胞重编程为神经元进行体外移植的策略。(A)嗅鞘细胞重编程为神经元进行体外移植移植细胞的制备策略。(B)GFP阳性细胞是移植的诱导细胞,在移植后1周和移植后2周GFP阳性细胞在体内都有存活。通过高倍镜扫图发现大部分GFP阳性细胞能够表达神经元的标记物Tuj1。
具体实施方式
下面结合实施例对本发明提供的具体实施方式作详细说明。
实施例1
本发明提供了一种简单、快速的方法将成年小鼠OECs直接重编程为神经元,如图1和图2所示,具体步骤如下:
1、成年小鼠OECs原代培养
1.1成年小鼠嗅球来源OECs的原代培养方法
成年小鼠OECs取自成年(年龄≥8周)C57/BL6J小鼠的嗅球,主要利用差速贴壁的方法进行细胞纯化。用二氧化碳窒息法将小鼠处死后迅速用75%酒精进行消毒,剪刀断头后,将颅骨剥开,分离出嗅球并置于4℃的解剖液中,显微镜下剥离包裹在嗅球外面的薄膜,取嗅球的嗅神经层和嗅小球层部分剪碎,用0.25v/v%的胰酶在37℃细胞培养箱中消化15min,每隔5min均匀摇动一次,然后加入含有15v/v%胎牛血清的DMEM/F-12(DF12-15%FBS)培养基终止消化,离心机800rpm离心4min后吸去上清,重新加入适量培养液后反复吹打重悬,使其静置5-10min成为单细胞悬液,然后种到不涂胶的T25培养瓶中。36h后将悬浮的细胞液移到另外一个新的不涂胶的T25培养瓶中,再过36h后,将没有贴壁的细胞悬液种在涂有L-型多聚赖氨酸(PLL,0.1mg/ml)的培养板上。细胞贴壁一天,第二天换液时在OECs的培养液中加入毛喉素(Forskolin,2uM)和成纤维细胞生长因子(bFGF,10ng/ml)。在细胞培养过程中,每隔两天换一次培液,一周左右即可传代,传代1~2次后用于细胞诱导实验。有一部分实验的OECs取自转基因GAD-67小鼠,用于验证诱导得到的神经元是GABA神经元,取材方法与上述描述相同。
1.2成年小鼠鼻粘膜嗅鞘细胞的原代培养
成年小鼠鼻粘膜OECs取自成年(年龄≥8周)C57/BL6J小鼠。用二氧化碳窒息法处死小鼠后快速用75%酒精进行消毒,断头,用剪刀锐性分离外鼻皮肤,将颅骨剪至鼻顶处,再用剪刀在鼻顶部岔开,露出鼻中隔,用弯镊小心将鼻中隔两侧的粘膜以及鼻甲表面粘膜取出后放入4℃的解剖液中,在显微镜下剥离粘膜外边的薄膜,剪碎后,用0.25%的胰酶在37℃细胞培养箱中消化15min,加入DF12-15%FBS培养基终止消化,离心机800rpm离心4min后吸去上清,重新加入适量培养液后反复吹打单细胞悬液,然后种到不涂胶的T25培养瓶中。36h后将悬浮的细胞液移到另外一个新的不涂胶的T25培养瓶中,再过36h后,将没有贴壁的细胞悬液种在涂有L-型多聚赖氨酸(PLL,0.1mg/ml)的培养板上。随后在嗅鞘细胞的培养液中加入2uM的Forskolin和10ng/ml的bFGF。在细胞培养过程中每隔两天换一次液,一周左右即可传代。
2、NGN2质粒构建和慢病毒包装
根据文献中关于质粒构建的方法以及慢病毒包装方法加以完善进行NGN2质粒构建和病毒包装(Liu,M.-L.et al.Small molecules enable neurogenin 2to efficiently convert human fibroblasts into cholinergic neurons.Nat.Commun.4:2183doi:10.1038/ncomms3183(2013).)。利用PCR仪扩增含有NGN2的目的基因片段,反转录得到cDNA,将携带有人源性NGN2基因的cDNA片段构建到第三代慢病毒载体(pCSC-SP-IRES-GFP)上,获得pCSC-SP-PW-NGN2-IRES-GFP(简称为NGN2)慢病毒质粒。
NGN2的扩增引物:
Sense:CTAGCTAGCGCCACCATGTTCGTCAAATCCGAGACC(SEQ ID NO.1);
Antisense:CCGCTCGAGCTAGATACAATCCCTGGCTATG(SEQ ID NO.2)。
扩增后的NGN2目的基因片段:Ngn2Gene ID:63973(SEQ ID NO.3)。
病毒包装时,在DMEM中将NGN2慢病毒质粒与包装质粒(pMDL,VSV-G,和pREV)按照4:1:1:1混合,通过瞬时转染HEK293T细胞的方法产生出携带有NGN2-GFP基因的复制缺陷型慢病毒,在转染后第10-15h换成培养HEK293T细胞的培液,之后在第24h收集一次病毒上清,在第48h收集第二次病毒上清,之后将两次收集的病毒液混合离心,经滤器过滤后可直接感染OECs(图1)。
3、OECs重编程为神经元
根据之前关于体细胞向神经元直接重编程的方法(Liu,M.-L.et al.Small molecules enable neurogenin 2to efficiently convert human fibroblasts into cholinergic neurons.Nat.Commun.4:2183doi:10.1038/ncomms3183(2013).),将OECs传代后种在铺有PLL及基质胶的细胞培养板上或者细胞玻片上,待细胞完全贴壁后培养2-3天后,将离心纯化后的慢病毒添加聚凝胺(polybrene,6μg/ml)之后加入到培养孔板中感染OECs,10-12h后换成OECs培养液,待细胞感染病毒约48h后换成神经元诱导培养基(neuronal induction medium),在此诱导培养基中含有200ml DMEM/DF12、50ml Neurobasal溶液、2ml N-2(100X)、1ml B27(50X)、Forskolin(2uM)、BMP通路抑制剂Dorsomorphin(1μM)、成纤维细胞生长因子(bFGF,10ng/ml)及1v/v%青链霉素,每隔一天更换一次培养基。根据该细胞重编程方法先进行筛选,我们发现NGN2可以诱导OECs重编程为神经元,再根据不同的实验设计以及时间节点固定细胞进行免疫荧光染色来验证诱导得到的细胞为神经元(图2)。
我们发现无论是刚出生幼鼠的嗅鞘细胞还是成年小鼠的嗅鞘细胞感染病毒后用相同的方法进行诱导培养14天后都能得到了Tuj1阳性细胞(图3A,图3B),且对实验结果统计后发现成年小鼠的转分化效率(转分化效率=Tuj1+细胞/GFP+细胞)在80%左右(图3C)。
为了证明NGN2诱导嗅鞘细胞转分化得到的神经元能够分化成熟,我们分别对感染病毒后诱导培养了14天、21天、35天的细胞进行固定,通过免疫细胞化学染色的方法用NeuN标记成熟神经元的核蛋白(图4A),结果显示NGN2诱导的新生神经元能够表达成熟神经元的标记物NeuN,但是对照组并没有相应的表达。
实验发现转录因子NGN2同样也可以诱导嗅粘膜的嗅鞘细胞转分化得到神经元,不仅如此,通过诱导嗅粘膜中的嗅鞘细胞转分化也可以得到NeuN阳性的细胞,即诱导得到的神经元可以发育成熟(图5)。
利用携带NGN2的病毒诱导嗅鞘细胞进行转分化,体外诱导培养10-12天,利用微量注射器以及玻璃电极将诱导细胞注射到NOD scid小鼠的脊髓中,注射的细胞量为2μl(5×105cells/2μl)。我们分别在移植后1周和2周对老鼠进行灌注、取材、切片,通过免疫化学染色的方法观察诱导细胞移植到体内的生存状况(图6A)。实验结果显示,GFP阳性细胞是移植的诱导细胞,在移植后1周和移植后2周GFP阳性细胞在体内都有存活(图6B),更值得注意的是,通过高倍镜扫图发现,大部分GFP阳性细胞能够表达神经元的标记物Tuj1
以上已对本发明创造的较佳实施例进行了具体说明,但本发明创造并不限于所述实施例,熟悉本领域的技术人员在不违背本发明创造精神的前提下还可做出种种的等同的变型或替换,这些等同的变型或替换均包含在本申请权利要求所限定的范围内。
序列表
<110> 中国人民解放军第二军医大学
<120> NGN2介导成年鼠嗅鞘细胞直接重编程为神经元的方法及其应用
<130> /
<160> 3
<170> SIPOSequenceListing 1.0
<210> 1
<211> 36
<212> DNA
<213> 人工序列(Artificial)
<400> 1
ctagctagcg ccaccatgtt cgtcaaatcc gagacc 36
<210> 2
<211> 31
<212> DNA
<213> 人工序列(Artificial)
<400> 2
ccgctcgagc tagatacaat ccctggctat g 31
<210> 3
<211> 818
<212> DNA
<213> 人工序列(Artificial)
<400> 3
atgttcgtca aatccgagac cttggagttg aaggaggaag aggacgtgtt agtgctgctc 60
ggatcggcct ccccgccttg gcggccctga ccccgctgtc atccagcgcc gacgaagaag 120
aggaggagga gccgggcgcg tcaggcgggg cgcgtcggca gcgcggggct gaggccgggc 180
agggggcgcg gggcggcgtg gctgcgggtg cggagggctg ccggcccgca cggctgctgg 240
gtctggtaca cgattgcaaa cggcgccctt cccgggcgcg ggccgtctcc cgaggcgcca 300
agacggccga gacggtgcag cgcatcaaga agacccgtag actgaaggcc aacaaccgcg 360
agcgaaaccg catgcacaac ctcaacgcgg cactggacgc gctgcgcgag gtgctcccca 420
cgttccccga ggacgccaag ctcaccaaga tcgagaccct gcgcttcgcc cacaactaca 480
tctgggcact caccgagacc ctgcgcctgg cggatcactg cgggggcggc ggcgggggcc 540
tgccgggggc gctcttctcc gaggcagtgt tgctgagccc gggaggagcc agcgccgccc 600
tgagcagcag cggagacagc ccctcgcccg cctccacgtg gagttgcacc aacagccccg 660
cgccgtcctc ctccgtgtcc tccaattcca cctcccccta cagctgcact ttatcgcccg 720
ccagcccggc cgggtcagac atggactatt ggcagccccc acctcccgac aagcaccgct 780
atgcacctca cctccccata gccagggatt gtatctag 818
- 还没有人留言评论。精彩留言会获得点赞!