一种长链非编码RNA及其应用和生物制品的制作方法
本发明属于基因工程技术领域,具体涉及一种长链非编码RNA及其在诊断和治疗激素抵抗性前列腺癌中的应用。
背景技术:
前列腺癌是一种男性高发恶性肿瘤,其死亡率仅次于肺癌。近年来,随着人们生活方式的改变、人口的老龄化,前列腺癌的发病率呈明显上升趋势,上海市的统计数据显示,前列腺癌的发病率已经从1991年的2.9/10万男性上升至目前的12.6/10万男性,成为严重危害我国男性身体健康的重要疾病之一。
技术实现要素:
在一个方面,本公开的实施例提供了一种长链非编码RNA,具有SEQ ID No.1所示的转录序列或SEQ ID No.1所示的转录序列的同源序列或SEQ ID No.1所示的转录序列的修饰序列。
在本公开的一些实施例中,所述同源序列的同源性不低于90%。
在本公开的一些实施例中,所述修饰序列为经硫代修饰或/和甲氧基修饰。
在另一方面,本公开的实施例提供了上述长链非编码RNA的应用,包括作为分子标志物在诊断或治疗激素抵抗性前列腺癌的生物制品中的应用。
在又一方面,本公开的实施例提供了一种诊断激素抵抗性前列腺癌的生物制品,所述生物制品包括试剂,所述试剂包括用于检测生物样品中长链非编码RNA表达量的试剂,所述长链非编码RNA为上述的长链非编码RNA。
在本公开的一些实施例中,所述生物制品为试剂盒,所述试剂盒包括所述试剂。
在本公开的一些实施例中,所述试剂包含对所述长链非编码RNA具有特异性的标记物。
在本公开的一些实施例中,所述标记物包括所述长链非编码RNA的引物组,或荧光标记的所述长链非编码RNA的引物组,或结合所述长链非编码RNA的化合物。
在本公开的一些实施例中,所述长链非编码RNA的引物组是SEQ ID No.2所示的序列和SEQ ID No.3所示的序列组成的引物对;或SEQ ID No.6所示的序列和SEQ ID No.7所示的序列组成的引物对。
在还一方面,本公开的实施例提供了一种用于治疗激素抵抗性前列腺癌的生物制品,所述生物制品是药物,所述药物包括用于抑制或沉默所述长链非编码RNA表达的成分,所述长链非编码RNA为上述的长链非编码RNA。
本公开的其它方面和技术细节,结合具体实施方式部分的描述将为本领域技术人员所理解。
为便于撰写,在下述中,以LncRNA-LOC100代表上述长链非编码RNA。
附图说明
图1为LncRNA-LOC100沉默后实验例与对照组的前列腺癌DU145细胞的生长图,其中A、B、C依次为对照组、siRNA1、siRNA2中的LncRNA-LOC100的生长情况图,E、F分别为对照组、干扰RNA1、干扰RNA2中的LncRNA-LOC100的细胞存活率、LncRNA-LOC100的表达率示意图。
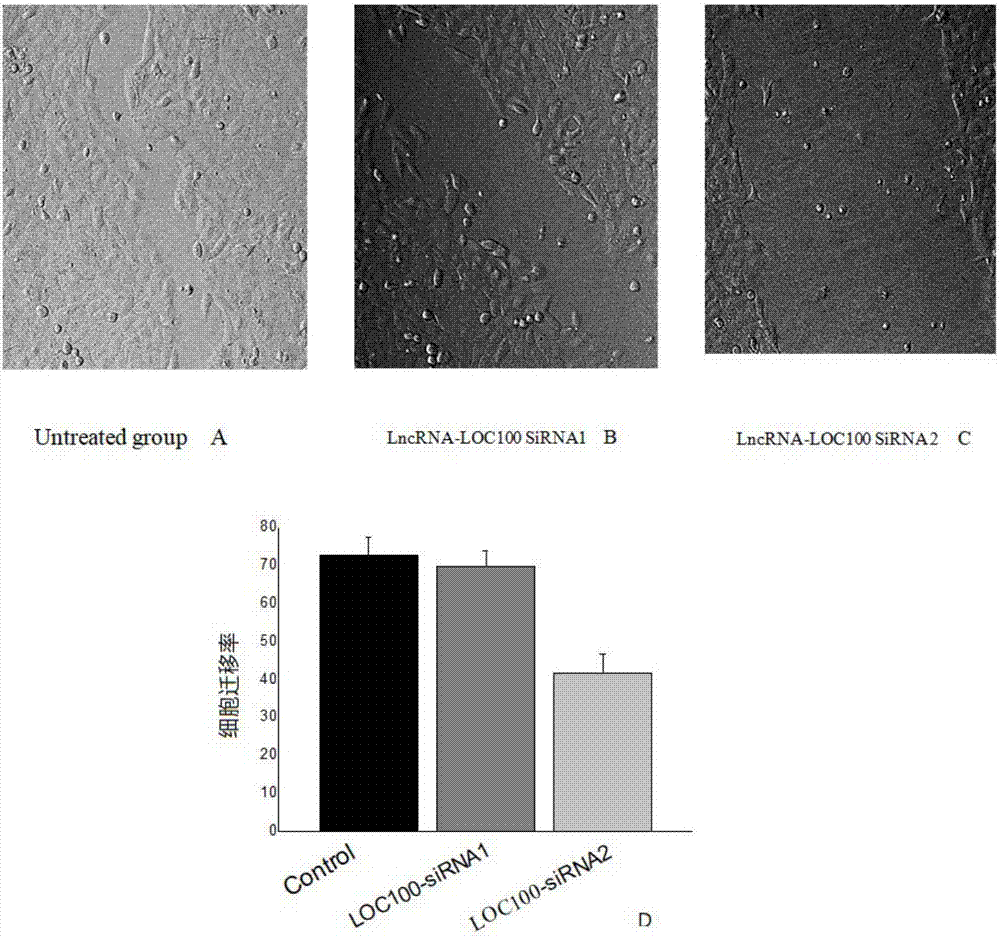
图2为LncRNA-LOC100沉默后实验例与对照组的DU145肿瘤细胞迁移对照图,其中A为对照组没有采取措施,B、C为采用siRNA1、siRNA2沉默LncRNA-LOC100,D显示了细胞迁移率的对比。
图3为LncRNA-LOC100沉默后实验例与对照组的DU145肿瘤细胞凋亡流式细胞检测结果,其中A为对照组没有采取措施,B、C为采用siRNA1、siRNA2沉默LncRNA-LOC100,D显示了凋亡细胞数的对比。
图4为LncRNA-LOC100沉默后实验例与对照组的DU145肿瘤细胞细胞生长速率,其中A、B、C分别为对照组、采用siRNA1、siRNA2沉默LncRNA-LOC100的DU145的细胞体积、细胞体积随周数、DU145中LncRNA-LOC100的变化对照。
图5为LncRNA-LOC100沉默后建立肿瘤模型与对照组的肿瘤模型的DU145肿瘤细胞细胞数量,其中A、B、C、D分别为对照组、采用siRNA1、siRNA2沉默LncRNA-LOC100的DU145细胞的数量变化对照、采用siRNA1沉默LncRNA-LOC100的DU145细胞的数量变化、采用siRNA2沉默LncRNA-LOC100的DU145细胞的数量变化、对照组、采用siRNA1、siRNA2沉默LncRNA-LOC100的DU145细胞的抑制率变化对照。
图6为脾脏组织切片HE染色图。其中,A、B、C依次为对照组、采用siRNA1、siRNA2沉默LncRNA-LOC100后的组。
图7为实时定量PCR检测LncRNA-LOC100在33例前列腺癌病人癌组织和癌旁组织中的表达情况,其中N指癌旁组织,C指前列腺癌组织。
具体实施方式
在发明人所知的技术中,DU145作为一种CRPC癌细胞,是从前列腺癌脑转移肿瘤中分离出来的,分化程度低,为雄激素非依赖的前列腺癌细胞,具有强大的转移潜能,缺乏内源性的雄激素受体的表达。DU145具有显著的间皮细胞特性,是研究上皮细胞间质转化态致肿瘤细胞转移潜能改变的理想的细胞资源。有效地抑制DU145肿瘤细胞的增殖以及转移,可对抑制前列腺癌有明显效果。对DU145肿瘤细胞抑制的有效靶点的研究具有重要意义。
长链非编码RNA(LncRNA)是一种一般不编码蛋白或编码蛋白能力有限的碱基序列,其在表观遗传学、转录调控、转录后调控等多种层面调控基因表达,在多种生物学进程中发挥重要作用,包括人类基因调节、细胞生长分化以及肿瘤疾病的发生、脂肪代谢等。部分研究发现,有些长链非编码RNA与癌症的发生发展存在密切的关系,长链非编码RNA表达水平上的差异或某些癌症类型特异性有关,因此如果能够获得一种与激素抵抗性前列腺癌(CRPC)相关联的LncRNA,将有助于开发新的诊断或治疗CRPC的方法。
在下述实施例中,所涉及的实验操作均可按照《分子克隆实验指南(第三版)》(Molecular Cloning:A Laboratory Manual,3red黄培堂等译,科学出版社.2002.8)中所述条件和方法进行。其它未详细描述的试验方法如无特殊说明,均为本领域的技术人员所熟知的常规方法。下面就各相关试验操作简述如下:
细胞培养
DU145肿瘤细胞购自ATCC公司,细胞培养所用DMEM培养基和胎牛血清及消化细胞所用的胰蛋白酶均为Sigma Aldrich公司产品。DU145细胞DMEM培养基中培养。在DMEM培养基中加入10%FBS,100U/ml青霉素和100mg/ml的链霉素,在37℃含5%CO2的恒温培养箱中培养。每天更换培养基,当细胞密度长满瓶底时进行传代。
总RNA的提取
DU145肿瘤细胞提总RNA,RNA经逆转录成cDNA后,采用PCR进行扩增。将生长状态良好的DU145肿瘤细胞按2×105个细胞/孔接种于6孔板中,将6孔板置于培养箱中,进行培养;将DU145肿瘤细胞从细胞培养箱中取出,吸出培养基,用无菌PBS洗两次,把PBS全部吸出;往细胞培养皿里加入Trizol试剂,用移液器吹打,使细胞全部裂解;把用Trizol试剂裂解的细胞转入无RNA酶的EP管中。用移液器吹打,使细胞全部裂解;把用Trizol试剂裂解的细胞转入无RNA酶的EP管中,氯仿,震荡,静置低温离心;吸取上清转入新的EP管中,异丙醇,冰上静置;离心;弃去上清,得到的沉淀即为RNA,用DEPC酒精洗沉淀;离心;弃去上清,待沉淀自然风干后,加入DEPC水进行溶解;测定提取的总RNA的浓度。
PCR定量分析
采用GeneCopoeia公司的mRNA反转录试剂盒进行总RNA反转录,每25uL体系里加入2ug总RNA;反转录采用的程序为45℃一个小时,85℃,5分钟,4℃保存;把反转录得到的cDNA稀释5倍作为定量PCR的模板;引物稀释为2uM的浓度;采用GeneCopoeia公司mRNA荧光定量PCR试剂盒并根据说明书配制体系和设定程序。具体程序如下:94℃预变性4min;94℃变性30s,64℃退火30s,72℃延伸15s,35个循环;72℃延伸10min。结果分析:分析引物的特异性及扩增效率,根据溶解曲线判断引物的反应特异性。根据扩增曲线得到Ct值,采用相对量法与内参beta-actin进行目的基因相对表达量的分析。计算公式为:2^(-ΔCt),ΔCt+Ct gene-Ct control。
慢病毒的制备
根据Invitrogen Lipofectamine 2000转染试剂使用说明书进行转染操作,具体过程如下:将处于对数生长期的HEK-293T细胞进行胰酶消化,制成细胞悬液;将细胞悬液接种于24孔板中,进行培养;将提取的质粒和Lipofectamine 2000分别溶解于opti-MEM中,混匀,室温静置;将质粒和Lipofectamine 2000混匀,室温静置。把质粒与Lipofectamine 2000的混合液加入HEK-293T细胞中,进行培养;转染72h后收集病毒上清液,离心;过滤分装,得到重组的慢病毒,用于转染DU145肿瘤细胞。
细胞转染
将生长状态良好的DU145肿瘤细胞按2×105个细胞/孔接种于6孔板中,将6孔板置于培养箱中,进行培养;待培养细胞生长至60 80%密度即可开始siRNA的转染;根据Lipofectamine 2000转染试剂说明转染LncRNA-LOC100siRNA(购自Thermo Fisher Scientific生物技术有限公司),转染过程如下:
在无菌EP管中加入的lipofectamine2000于无血清培养基中混匀静置;将慢病毒加入无血清培养基中;然后与上述包含lipofectamine2000的无血清培养基温和混匀,室温静置分钟;用D Hank's液洗涤细胞3次;将上述混合物中加入无血清培养基(无抗生素),温和混匀后加入6孔板中的1个孔;将6孔板置于CO2培养箱中,进行培养,然后弃上清,加入完全培养基继续培养。
MTT法检测LncRNA-LOC100siRNA对肿瘤生长的抑制作用
首先LncRNA-LOC100siRNA转染肿瘤细胞DU145,每孔加培养液至100mL,置于37℃,5%CO2培养箱培养。待DU145细胞密度达到80-90%时准备转染。每孔10ug LncRNA-LOC100siRNA加入200ul培养基中混匀,静置5min(1液),取3-5ul lipo2000加入200ul培养基中,混匀(2液)。把2液和1液混匀后静置25min。细胞用培养基清洗两遍,加入转染混合物。12h后将20ul的MTT液反应液加入每孔,37℃避光孵育4h,弃上清,加入150ul二甲基亚砜(DMSO),490mn波长处测吸光值。
设置空白对照孔、细胞对照孔和加药孔。空白对照孔加培养液、MTT液、二甲基亚砜和siRNA。细胞对照孔和加药孔都要加细胞、培养液、MTT液和二甲基亚砜。
计数法测定肿瘤细胞生长曲线
接种细胞:用胰蛋白酶消化转染72h后各组PC3细胞,用含10%胎牛血清的培养液配成单细胞悬液,接种于6孔板(3.3×105个/孔)中。培养细胞:移入细胞培养箱,37℃、5%CO2及饱和湿度条件下培养。细胞板计数:空白对照组连续检测七天,LncRNA-LOC100siRNA处理组检测三天。每天胰酶消化三个孔细胞计数并记录,绘制细胞生长曲线,实验重复三次。
划痕实验检测各组人前列腺癌PC3细胞的迁移能力
用记号笔在六孔板背后划线,每隔1cm一道线,每孔至少穿过三条线,消化细胞铺板。细胞密度长到80-90%时,用10μl枪头垂直六孔板背后横线划痕。弃旧培养液,PBS洗三遍,加入2%培养液及药物,实验分组同上。倒置显微镜下观察,24h后照相记录结果,实验重复三次。
小鼠DU145移植瘤模型的建立
收集处于对数生长期的DU145细胞,0.25%胰蛋白酶消化后,离心弃上清,用培养液重悬制成2×107个细胞/mL单细胞悬液。选取4~5周龄SCID小鼠35只,标准动物房适应一周后,每只小鼠右下肢根部皮肤备皮,备皮部位皮下接种0.2mL(2.0×107个细胞/mL)Lewis肺癌细胞悬液,每天观察注射部位有无红肿破溃,触摸注射部位,检查有无肿瘤长出。
小鼠体质量及瘤体大小的测定
小鼠荷瘤后,每天触摸小鼠注射部位,直到触摸到米粒大小的肿瘤块,开始用游标卡尺测量肿瘤大小,一周三次。对每一只小鼠标记,进行体质量及肿瘤大小的动态监测。用游标卡尺测量时每次测量同一个位置,量取瘤体的最大长径(A),与长径垂直的最大宽径(B),利用公式:体积(V)=AB2/2来计算瘤体的平均体积,绘制肿瘤生长曲线。抑瘤率的测定
末次给药24h后,称量小鼠体质量,眼球取血后处死小鼠,剥离小鼠肿瘤组织,去除周围组织及血液,Hanks液冲洗干净后滤纸擦干,置电子天平称取瘤体质量,计算抑瘤率:
数据统计
所有数据采用SPSS20.0统计软件进行分析,采用单因素方差分析和t检验进行组间比较,用“均数±标准差”(x±s)来表示,检验水准α=0.05,P<0.05表示差异有统计学意义且为显著性差异,P≥0.05无统计学意义。检验水准α=0.01,P<0.01表示差异有统计学意义且为极显著性差异。
在本公开的至少一个实施例中,提供了一种长链非编码RNA,申请人将其命名为LncRNA-LOC100,具有SEQ ID No.1所示的转录序列或SEQ ID No.1所示的转录序列的同源序列或SEQ ID No.1所示的转录序列的修饰序列。
可选地,所述同源序列的同源性不低于90%,例如同源性不低于95%,例如同源性不低于98%。
可选地,所述修饰序列为经过基团修饰的LncRNA-LOC100,例如硫代修饰,例如甲氧基修饰。
申请人经过实验发现,LncRNA-LOC100在CRPC中的表达明显高于正常前列腺组织细胞和激素非抵抗性前列腺癌细胞,从而可作为预测、诊断CRPC的CRPC进展情况及其作为靶点治疗CRPC。
在本公开的至少一个实施例中,提供了一种诊断激素抵抗性前列腺癌的生物制品,所述生物制品包括试剂,所述试剂包括用于检测生物样品中长链非编码RNA表达量的试剂,所述长链非编码RNA为上述的长链非编码RNA。
可选地,所述生物制品为试剂盒,所述试剂盒包括所述试剂。
可选地,所述试剂包含对所述长链非编码RNA具有特异性的标记物。
可选地,所述标记物包括所述长链非编码RNA的引物组,或荧光标记的所述长链非编码RNA的引物组。
其中,所述试剂可以表现为生物学上任何可接受的产品形式,包括但不限于探针、基因芯片,或PCR引物。
其中,所述生物样品为离体生物样品,包括但不限于来自被检测对象的离体的新鲜组织或细胞、福尔马林固定或石蜡包埋组织或细胞、血液或体液。
其中,所述试剂盒,作为完整商业销售和应用封装的试剂盒,为了提高检测的准确性,便于进行阴性和阳性对照,上述试剂盒中还可含有相关的阳性对照和阴性对照、还可以包含便于快速操作使用的其它辅助试剂,如DNA提取试剂、PCR反应试剂、电泳试剂等,这些成分是PCR扩增检测中常用的,其用量和使用也为本领域技术人员熟练掌握,此处不予赘述。
在本公开的一些实施例中,所述长链非编码RNA的引物组是SEQ ID No.2所示的序列和SEQ ID No.3所示的序列组成的引物对。
在本公开的一些实施例中,所述长链非编码RNA的引物组是SEQ ID No.6所示的序列和SEQ ID No.7所示的序列组成的引物对。
在本公开的至少一个实施例中,提供了一种用于治疗激素抵抗性前列腺癌的生物制品,所述生物制品是药物,所述药物包括用于抑制或沉默所述长链非编码RNA表达的成分,所述长链非编码RNA为上述的长链非编码RNA。例如,所述药物包括LncRNA-LOC100的siRNA。
可选地,所述siRNA可以包括LncRNA-LOC100的反义链,例如SEQ ID No.2所示的序列和SEQ ID No.3所示的序列组成的引物对,例如SEQ ID No.6所示的序列和SEQ ID No.7所示的序列组成的引物对。
实施例1检测LncRNA-LOC100在CRPC肿瘤细胞中的表达情况
为检测LncRNA-LOC100在CRPC肿瘤细胞中的表达情况,首先根据LncRNA-LOC100的基因序列,设计出特异性引物对,F链的核苷酸序列为SEQ ID No:2所对应的序列,R链的核苷酸序列为SEQ ID No:3(对应附图所示的siRNA2实验组);F链的核苷酸序列为SEQ ID No:6所对应的序列,R链的核苷酸序列为SEQ ID No:7(对应附图所示的siRNA1实验组)。
DU145肿瘤细胞购自ATCC公司。细胞培养所用DMEM培养基和胎牛血清及消化细胞所用的胰蛋白酶均为Sigma Aldrich司产品。将生长状态良好的DU145肿瘤细胞按2×105个细胞/孔接种于6孔板中,将6孔板置于37℃,5%CO2培养箱中,进行培养;将DU145肿瘤细胞从细胞培养箱中取出,吸出培养基,用无菌PBS洗两次,把PBS全部吸出;往细胞培养皿里加入Trizol试剂,约每5×106个细胞加入1mL试剂,用移液器吹打几次,使细胞全部裂解;把用Trizol试剂裂解的细胞转入无RNA酶的EP管中,在管壁上作好标记。
实验准备:
1.离心管、枪头等塑料制品用0.1%焦碳酸二乙酯(DEPC)水溶液浸泡12小时以上灭活外源性RNA酶。高压蒸汽灭菌30分钟除去残留的DEPC,以防DEPC通过羧甲基化作用对RNA的嘌呤碱基进行修饰。
2.0.1%DEPC处理水配置:200ml超纯水加入200μlDEPC,磁力搅拌4个小时过夜,高压30分钟以上灭菌并灭活DEPC。
75%酒精用0.1%DEPC处理水配置。
3.玻璃瓶和镊子200℃烘烤3个小时灭活外源性RNA酶。
对提取RNA进行定性(nanodrop)和定量(琼脂糖电泳)
反转录反应
(1)在超净台中,取DEPC处理的20μlPCR管置冰上,依次加入
总RNA 500ng
随即引物(0.5μg/μl) 1μl
无RNA酶水 9ul至总体积12μl
混匀,用微量离心机离心3000转/分30秒。
(2)70℃5分钟变性,取出置冰上冷却。
(3)PCR管置冰上,依次加入
5×RT Buffer 4μl
RNase inhibitor(20U/μl) 1μl
10mM dNTP Mix 2μl
(4)加入M-MuLV逆转录酶(200U/μl)1μl至终体积20μl。
混匀,用微量离心机离心3000转/分30秒。
(5)置水浴锅按以下条件进行
25℃ 10分钟
42℃ 60分钟
70℃ 10分钟
立即冰上冷却,产物cDNA即用于PCR或置-20℃冰箱保存。
PCR反应
(1)取20μIPCR管依次加入
用微量离心机离心3000转/分30秒混匀。
(2)按以下条件进行PCR反应:
实验对照
1.阳性对照:采用已知高表达细胞的总RNA进行逆转录和PCR扩增。
2.阴性对照:用灭菌去离子水代替总RNA的反应体系进行逆转录和PCR扩增。
3.内参照:以引物进行PCR反应的同时,以GAPDH引物进行PCR反应。
实施例2LncRNA-LOC100的沉默对CRPC肿瘤生长的抑制作用
在体外培养DU145细胞。从液氮中取出Lewis细胞冻存管,浸入37℃恒温水浴中,快速震摇1~2min使其尽快融化,解冻后酒精消毒,移至超净工作台中,移液枪快速将细胞移至10mL离心管中,并加入8mL细胞培养液稀释后混匀,离心管封口后置入离心机800r/min,离心4min后取出,弃上清,加入8mL细胞培养液重悬细胞,混匀后将细胞悬液分装至25m2的细胞培养瓶中,标记后放入37℃培养箱中培养,6h后观察细胞贴壁情况。每天观察细胞生长情况,细胞贴壁后,弃上清更换新的培养液以维持细胞正常活性。3天后细胞生长铺满培养瓶的90%,进行细胞的传代。弃去培养瓶中液体,用Hanks液冲洗培养瓶后加入0.2%胰酶,置于37℃培养箱中2~3min进行细胞消化。待细胞消化后将细胞悬液移至10mL离心管中,加入培养液稀释混匀后置于离心机800r/min,离心4min,弃上清,加入细胞培养液稀释,混匀后将细胞悬液分装至75m2的细胞培养瓶中,标记后放入37℃培养箱中培养,及时更换细胞培养液。
细胞培养第3天,细胞生长密度为90%,用胰酶消化,离心后制成细胞悬液,稀释后将细胞悬液配成浓度为1×105个细胞/mL。设置空白对照组、细胞对照组、LncRNA-LOC100处理组共3组,每组设3个复孔。将配好的细胞悬液铺于96孔板中,每孔加入100μL细胞悬液。先将96孔板用细胞培养液湿润后,沿板壁进行加液,加液后上下左右轻轻晃动以使细胞均匀平铺,边缘孔用PBS缓冲液填充,5%CO2,37℃培养箱中培养,至细胞单层铺满孔底。
96孔板培养DU145细胞24h后,弃上清,更换新的培养液。每孔加培养液至100mL,置于37℃,5%CO2培养箱培养。待DU145细胞密度达到80-90%时准备转染。每孔10ug LncRNA-LOC100siRNA质粒加入200ul培养基中混匀,静置5min(1液),取3-5ullipo2000加入200ul培养基中,混匀(2液)。把2液和1液混匀后静置25min。细胞用培养基清洗两遍,加入转染混合物。12h后换成10%培养液。48h后荧光显微镜下观察细胞荧光。
称取MTT粉0.5g,溶于100mL PBS缓冲液中,配成浓度为5mg/mL,即0.5%MTT液。用0.22μm滤膜过滤,除去溶液里的细菌,放4℃避光保存。细胞加药培养24h、48h、72h后,药物处理组分别加入0.5%MTT液20μL,继续培养4h后小心吸去孔内培养液,每孔加入150μL二甲基亚砜,置摇床上低速振荡10min,待结晶物充分溶解后,置酶标仪OD490nm波长处测量各孔的吸光值(OD值),根据公式:抑制率=[1-(实验组OD值-调零孔OD值)/对照组OD值-调零孔OD值)]×100%。
设置空白对照孔、细胞对照孔和加药孔。空白对照孔加培养液、MTT液、二甲基亚砜和siRNA。细胞对照孔和加药孔都要加细胞、培养液、MTT液和二甲基亚砜。
划痕实验检测各CRPC肿瘤细胞的迁移能力。用记号笔在六孔板背后划线,每隔1cm一道线,每孔至少穿过三条线,消化细胞铺板。
细胞密度长到80-90%时,用10μl枪头垂直六孔板背后横线划痕。
弃旧培养液,PBS洗三遍,加入2%培养液及药物,实验分组同上。倒置显微镜下观察,24h后照相记录结果,实验重复三次。
实施例3流式AnnexinV-FITC/PI检测细胞凋亡情况。
采用流式方法检测肿瘤细胞的凋亡情况,检测实验分两组,即对照组和LncRNA-LOC100siRNA处理组。DU145细胞铺六孔板(1×104个/孔),待贴壁后,加不同含量的LncRNA-LOC100siRNA,对照组只加培养液。培养箱中培养细胞24h,消化细胞,PBS洗2次(2000rpm,5mim),置EP管中。
加入Binding Buffer(500μl)重悬细胞。加入5μlAnnexinV-EGFP混匀,再加入5μl Propidium Iodide混匀。
室温避光反应5-15min。
用流式细胞仪定量检测(时间不超过1h),激发波长,发射波长EX 488nm,En530nm,AnnexinV-EGFP的绿色荧光通过FITC通道(FL1)检测,PI红色荧光通过PI通道(FL2)检测。实验重复三次。
实施例4 LncRNA-LOC100的抑制对CRPC在小鼠肿瘤模型中生长和转移的影响。
建立SCID小鼠肿瘤模型(小鼠购自北京维通利华实验动物技术有限公司),在小鼠背部两侧接种肿瘤,接种肿瘤7天后,在注射部位可触及米粒大小肿瘤块。小鼠称重,将经过LncRNA-LOC100沉默的肿瘤细胞接种小鼠,并与对照组即未用LncRNA-LOC100沉默的肿瘤比较,每天观察小鼠注射部位情况,触摸肿瘤块,并测量肿瘤大小。
肿瘤长至1cm大小,将小鼠处死,肉眼观察脾脏变化。处死荷瘤小鼠后,取出脾脏,观察脾包膜的色泽、厚度,有无渗出物、纤维性粘连、凹陷、裂口等,并观察脾边缘是否锐利,有无肿瘤转移灶等。并进一步制备脾脏的组织切片:
(1)取材与固定:取出脾脏,冲洗干净后切成大小为1.5cm×1.5cm×0.3cm的组织块,置于10%福尔马林液中固定24~48h。
(2)脱水透明:由低浓度到高浓度的乙醇作为脱水剂,逐渐脱去组织块中的水份。再将组织块置于既溶于乙醇,又溶于石蜡的透明剂二甲苯中透明,以二甲苯替换出组织块中的乙醇,以便浸蜡包埋。
(3)浸蜡包埋:将透明处理过的组织块置于已溶化的石蜡中,待石蜡完全浸入组织块后进行包埋。先准备好容器,倒入已溶化的石蜡,迅速夹取已浸透石蜡的组织块放入其中,冷却凝固成块即成。
(4)切片与贴片:将包埋好的石蜡块固定于切片机上,切成5~8um厚的薄片。切下的薄片放到加热的水中烫平,贴在载玻片上,放45℃恒温箱中烘干。
(5)脱蜡染色:用二甲苯脱去切片中的石蜡,再经高浓度到低浓度乙醇水化、蒸馏水冲洗,即可进行HE染色,过程如下:
①切片经乙醇水化后放入苏木精水溶液中染色5~20min,自来水冲洗3~5min。
②在酸水及氨水中分色各5~30s,流水冲洗1h后入蒸馏水片刻。
③入70%和90%乙醇中脱水各10min。
④入伊红染色液染色2~3min。
(6)脱水透明:染色后的切片经纯乙醇脱水,再经二甲苯使切片透明。
(7)封固:将已透明的切片滴上树胶,盖上盖玻片封固。
实验结论
如实施例1所描述的,以如下引物对作为LncRNA-LOC100的扩增引物
F:(SEQ ID NO.2):5′-GAGATGACAGAGGCATGCTTTA-3′,
R:(SEQ ID NO.3):5′-CCGAGGAATCACACAGTTCTAC-3′;
F:(SEQ ID NO.6):5′-CCAAGGAAGAAGCAGCTAAGA-3′,
R:(SEQ ID NO.7):5′-AGGATGCCTTTCTCCACATAAG-3′;
以如下作为内对照产物beta-actin的扩增引物
F:(SEQ ID NO.4):5′-GTTGCTGTTTGGTTAGGTATTGG-3′
R:(SEQ ID NO.5):5′-CCACTGAGCTACAAGCTCTTAAT-3′。
如实施例2、3所描述的,参考图1所示,将LncRNA-LOC100沉默后采用MTT方法检测发现前列腺癌DU145细胞的生长受到抑制,与对照组比较差异显著。参考图2所示,细胞迁移实验显示LncRNA-LOC100沉默后与对照比较DU145肿瘤细胞迁移能力明显减弱。参考图3所示,流式细胞检测LncRNA-LOC100沉默后与对照比较DU145肿瘤细胞凋亡细胞数明显增多;参考图4所示,采用细胞计数法检测LncRNA-LOC100沉默后DU145肿瘤细胞细胞生长速率,DU145生长受到明显抑制。
如实施例4所描述的,参考图6所示的脾脏组织切片HE染色图。在图6-A可见,对照组的切片上可见脾实质白髓、红髓结构,脾小体结构不完整,大量肿瘤组织呈散在、簇状、或小团状排列,大小较一致。图6-B将LncRNA-LOC100沉默后可见脾窦扩张,窦内网状细胞增生,可见少量残存淋巴滤泡,其间肿瘤组织明显减少。
除上述之外,申请人还在CRPC患者群体中随机选取了33个患者进行了调查。实验中所用检测LncRNA-LOC100表达的实时定量的引物序列为:LncRNA-LOC100Primer F:(SEQ ID NO.2)和LncRNA-LOC100Primer R:(SEQ ID NO.3)组成的引物对,内对照产物beta-actin的引物核苷酸序列为beta-actin Primer F(SEQ ID NO.4)和beta-actin Primer R(SEQ ID NO.5)。
参考图7所示,在临床的33例样本中,通过实时定量检测发现有20对样本中LncRNA-LOC100的表达明显高于癌旁组织,上调率达到74.3%,统计学分析表明p<0.01,具有显著性。由此可知,本公开实施例提供的LncRNA-LOC100可作为标志物用于诊断用途以预测CRPC进展情况。
由上述可知,可以通过检测LncRNA-LOC100的表达预测CRPC进展情况,可以通过沉默、抑制LncRNA-LOC100的表达从而抑制CRPC肿瘤细胞的增殖、迁移和癌细胞扩散,从而起到治疗CRPC的效果。
序列表
<110> 郑州大学
<120> 一种长链非编码RNA及其应用和生物制品
<130> 2210
<160> 7
<170> SIPOSequenceListing 1.0
<210> 1
<211> 2544
<212> DNA
<213> 人前列腺癌细胞(DU145)
<400> 1
cttaaagggg gcccataaag acgcactgcc aagggctccg tgtgccccgg ggccgcggga 60
atgcggatcg cagccggcag ggaggggccg cggcggagcc ttagacttgg gggagccaag 120
gaggccactc ccaggaggct gcggagcaaa tgactgcctc cccgagcccc tggctgcaaa 180
agcagaggtt gcccgtggct tttgcagctc tggacacgcg ggtgcagccc agggaacgtg 240
gacaagaggt gttgacggac cggaccgtgc atttgagttg gggcatatcg aagtggttta 300
attaaaagcc gcgagtgtgg ccccagatcc tggcgttatc aaagcaaatc aaagcctttc 360
tttccagccg agcgggccct gtggaaatga gatgtacatt tacccttgac gcaccgcaag 420
cctggccgag gctctcaggt taattgatat ttaatggaaa tcatgcccat gaatatagtt 480
tccatcattt cacccttgat agacgtcagc cctgggcgca gggggaggct gaagaatgca 540
ggagggggca ttaggcttgc tgagagagta aatagaagag cggacagaaa cgttctgagg 600
cgggaaaaag ggctcgcgct ggggagggtg acatttcctc gggcaggacg cggctcccgg 660
gtctcagccc cggcgcgcag cgaaccaggg ccggctgcgg ttcccggagg agtgcggagg 720
gcagacgacc gcaagttccc cccaggagcc tcccagccgg cgttcagatc gcgccggttc 780
caggcagctg caggcggccc atcttatgct aacgatccta cttcctccgc caagcctgtg 840
aaattactgc cgagagagcg cgcaggcctc aaagttacga atttttccca aagcagagaa 900
agagaaggct cagcctagtt tgtgagcaga gatgaagaaa agttgcccga gtcatgtggc 960
ccagtcgagt gtgaatcgac aaaatattcc cgattttagc agctctctcc aaagctgtct 1020
ggctttaccc taccaaccgc ctccccacac acttcctttc cctctctgct cccgtttcaa 1080
tgtccaataa atgcaatggt tctctgttgt gtgtgtgtgt tttcccctct cctgctcggc 1140
ctttctcgtg ggctctttgg gtgactgagc cccgtttcct tcgggatagg tacaatgtcg 1200
tgagggcgcc aggcccacag ccttggaaac agacctccaa ggcgcccctg ctcaagctaa 1260
acgcaccacg ccggctttcc acaccaaatg caaatttccg aaaaccccag acggcctcag 1320
agatgctgca ggctggcgag cgatttcagc tacccctagc tccttgtggg ttggcccagc 1380
ctgcgagcgc gatcctgact tgtgtccggg tggactgaaa tatcattttt acaaatggag 1440
aaaatgagat cgagatggac agacatagca aggtgataat gtccgactca attatttcta 1500
ctgggaatga ctgaaaggta aaggaatcgt taatgaatct ggagatgaca gaggcatgct 1560
ttatttaatt tttaaattag taaggagtgc agacttgggg tggtggagag caagggtttt 1620
tttgttgttg ttgctgtttg tttttgtggg gttttttttc tgctggttat tgccaagtat 1680
aatgactttc tttaaatccg aaggcgaacg aattgattct gacaattaag gatttgtcct 1740
tcaatcttgc aaatgcccaa ttaaaagatt attattgtca ataaagcctt ggagctacct 1800
ttgtaattgt gccccttttt ttcagtttgg cctgtgtgtg tgtgtgtgtg tgtgtgtgtg 1860
tgtgtgtttg aaccctggat aaatgagtgg attttggaat ggaatggggg gggggaatga 1920
aagagcctgg atctcaacaa taccaggcat cttgtagaac tgtgtgattc ctcgggggaa 1980
taaaagaaaa atgaacacta gaaaattcat ttatagacat tcaggccaaa tttagaaaac 2040
gttacaacat ttcctcttgg gacaaaacag tttttaacat ttatttaagc attccgttta 2100
taatatgagt agaaaaagag cgcgattaac ttagtaagaa aagatctatg ctttttacag 2160
ctttctgttt tgatataata cattaattta tcatgtttta tagtttcagc tgtgccacag 2220
tccaaagttt ctgaagccat gatcgagcca aaattttatg cccagcaaac acagaaatta 2280
atagtacacc ttgtttattt ttggttaaaa ttatcctaat ttcggattaa aaataagatt 2340
gttaatattt ttaatcaaaa cctttctccg ccgcaattcc agctttacga gatcagaaag 2400
tggagcaaca gcgctctcta gtggccaaat gcgacctcca gtccactgaa tttaattttt 2460
attcatctca aaccaattct aatctcattc ttcaatttgg ggcttggact gctgacacta 2520
ataatgcttc attcctgtga ctgt 2544
<210> 2
<211> 22
<212> DNA
<213> 引物(LncRNA-LOC100 Primer F)
<400> 2
gagatgacag aggcatgctt ta 22
<210> 3
<211> 22
<212> DNA
<213> 引物(LncRNA-LOC100 Primer R)
<400> 3
ccgaggaatc acacagttct ac 22
<210> 4
<211> 23
<212> DNA
<213> 引物(beta-actin Primer F)
<400> 4
gttgctgttt ggttaggtat tgg 23
<210> 5
<211> 23
<212> DNA
<213> 引物(beta-actin Primer R)
<400> 5
ccactgagct acaagctctt aat 23
<210> 6
<211> 21
<212> DNA
<213> 引物(Prime F)
<400> 6
ccaaggaaga agcagctaag a 21
<210> 7
<211> 22
<212> DNA
<213> 引物(Primer R)
<400> 7
aggatgcctt tctccacata ag 22
- 还没有人留言评论。精彩留言会获得点赞!