类肽亲和配体的制作方法
本申请要求于2016年3月9日递交的美国临时申请62/305,831和于2016年3月9日递交的美国临时申请62/305,835的权益和优先权,其公开的内容通过引用整体纳入本文。
本发明公开了类肽和相关化合物,包括类肽亲和配体。还公开了制备类肽亲和配体的方法和使用类肽亲和配体结合、纯化和/或分离免疫球蛋白和相关化合物的方法。
背景技术:
单克隆抗体和fc融合蛋白已经作为一种重要的治疗类型蛋白出现,用于治疗大量的未满足需求的疾病,例如癌症、自身免疫疾病、免疫缺陷、皮肤病和神经障碍。在2011年,这些产品占总体药物市场的40%,市场额为350亿美元。
然而,对于消费者来说,基于抗体的治疗是非常昂贵的。基于抗体的治疗价格高部分地是由于分离和纯化这些生物分子的成本高。纯化的成本主要来自于普遍使用的蛋白a或蛋白g亲和色谱捕获步骤。尽管这些蛋白配体对igg具有高选择性,但是这些蛋白配体的成本高,且化学和生物化学稳定性低。基于蛋白a/g的色谱介质的平均成本为每升树脂约8,000美元至约15,000美元。而且,蛋白配体显示出了对监管指南要求的和通常用于去除污染物常规使用的碱性(0.1-1.0mnaoh)原位清洗和原位消毒的步骤通常耐化学性差。此外,蛋白配体易于被原料流中存在的酶进行蛋白降解。化学剂和酶剂均可以引起配体降解和配体片段从树脂泄露,因此导致色谱柱使用期较短,分别在产品主流中存在潜在毒性和免疫原性的浸出液。
所需要的是物美价廉的和稳健的配体,且对抗体具有高亲和性和选择性。能够有效分离和纯化抗体、fc融合蛋白和相关治疗蛋白的改进的配体能够使得免疫疗法更划算。
技术实现要素:
本发明提供了大体表征为类肽的亲和配体。类肽具有用于亲和纯化应用的理想特征。
首先,在一些实施方式中,在类肽上的官能团的展示(display)类似于肽的展示,暗示类肽可利用与肽配体相当的亲和力水平和选择性水平进行设计和选择。此外,由于所谓的采用了伯胺的“亚单体”合成方案,类肽可探索比蛋白配体和包括天然氨基酸的肽更广的化学多样性。本发明公开了能够微调组合物以实现更高的目标特异性和亲和性的能力的理解。最终,类肽完全耐蛋白质水解,因此对于从包含活性酶的流体中纯化抗体是有利的,包含活性酶的流体如全血浆、其组分或细胞培养物、植物和其它生物体的溶解产物。因此,类肽为蛋白a的经济替代物。除了纯化生物药物外,这些配体还可以在例如诊断和工艺控制中发现进一步的应用。
因此,本发明的第一方面为一种类肽配体,其特异性地结合至抗体,例如igg和/或抗体fc片段和/或fc融合蛋白。在一些实施方式中,这样的类肽配体的长度为3至9个残基或单体。这样的类肽配体为任选的,但是在一些实施方式中,这样的类肽配体优选地结合至固相载体。
因此,本发明提供了类肽亲和配体,其包括类肽化合物,所述类肽化合物由形成类肽骨架的依次连接的类肽残基组成,一个或多个官能团附接到类肽骨架的类肽残基的氮上,其中一个或多个官能团包括以任何顺序但连接至类肽骨架上的依次连接的类肽残基:至少两个芳香族官能团和碱性或酸性官能团,排除条件为类肽亲和配体含有具有下列官能团的三个类肽残基的连续片段:(i)碱性残基,(ii)芳香族残基,和(iii)碱性残基或亲水性残基。
此外,本发明还提供了类肽亲和配体,其包括类肽化合物,所述类肽化合物由形成类肽骨架的依次连接的类肽残基组成,一个或多个官能团附接到类肽骨架的类肽残基的氮上,其中一个或多个官能团包括至少两个芳香族官能团和至少一个碱性或酸性官能团,排除条件为类肽亲和配体从类肽骨架的n端至c端含有具有下列官能团的三个类肽残基的连续片段:(i)碱性残基,(ii)芳香族残基,和(iii)碱性残基或亲水性残基。
本发明公开的这样的类肽化合物还可以是排除条件为,类肽亲和配体从类肽骨架的n端至c端和在n端位置处,含有具有下列官能团的三个类肽残基的连续片段:(i)碱性残基,(ii)芳香族残基,和(iii)碱性残基或亲水性残基。
类肽和亲和配体还特异性地结合免疫球蛋白,其中免疫球蛋白、免疫球蛋白片段或其免疫球蛋白融合蛋白为igg、iga、ige、igd、igm或igy中的一个或多个。
本发明的另一方面为从含有抗体、抗体fc片段或fc融合蛋白的液体组合物中结合抗体、抗体fc片段或fc融合蛋白的方法,其包括如下步骤:(a)提供包括结合有如本文所述的类肽配体的固相载体,(b)使所述组合物接触所述固相载体,从而抗体或fc片段结合至所述化合物;和(c)从所述固相载体分离所述液体组合物,所述抗体或fc片段结合至所述固相载体。这样的方法还包括(d)从化合物/固相载体洗脱或分离结合的抗体和/或免疫球蛋白。
本发明公开的前述和其它目标和方面在下文的说明书中进行详细说明。
本发明公开的主题的实施方式已在上文进行了声明,其通过本发明公开的主题的全部或部分实现,当结合下文所附的实施例描述本发明时,其它实施方式将变得显而易见。
附图说明
可以通过参考下文的图更好地理解本发明公开的主题。附图中的组件不是必须为按比例绘制的,重点是解释本发明公开的主题的原理(通常是示意性的)。在图中,在不同的视图中,相同的附图标记代表相应的部件。可以通过参考解释附图的实施方式来进一步理解本发明公开的主题。尽管所示的实施方式仅是实现本发明公开的主题的示例性系统,但是本发明公开的主题的组织和操作方法总体上与其它的目的和优势一起,可以通过参考附图和下文的说明更容易理解。附图不用于限定本发明公开的主题的范围,本发明公开的主题的范围由所附的权利要求或随后修改的权利要求限定,附图仅用于阐明并示例地描述本发明公开的主题。
参考下列附图来更完整地理解本发明公开的主题,其中:
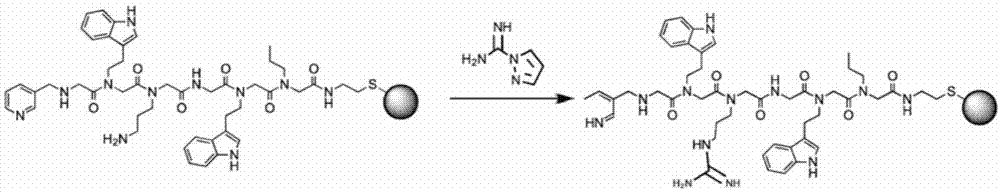
图1为在色谱载体上将类肽伯胺转化为胍基基团的示意图。
图2为多克隆人igg的等温吸附线,多克隆人igg溶解在pbs溶液中,结合至色谱树脂,类肽配体偶联至色谱树脂的表面。
图3为使用类肽亲和树脂从正常兔血清纯化的兔抗体的ph4.0洗脱液的考马斯染色sds-page分析的图像。
图4a和4b示出了本发明公开的类肽对于iga的结合亲和力和产率,图4a为sds-page分析的图像,图4b为纯化的iga的产率的酶联免疫吸附测定结果的柱状图,浅灰色条代表流通(flow-through),黑色条代表洗脱。
图5a和5b示出了本发明公开的类肽对于igm的结合亲和力和产率,图5a为sds-page分析图像,图5b为纯化的igm的产率的酶联免疫吸附测定结果的柱状图,开放条代表流通,封闭条代表洗脱。
图6a和6b示出了本发明公开的类肽对于igy的结合亲和力和产率,图6a为sds-page分析图像,图6b为纯化的igy的产率的酶联免疫吸附测定结果的柱状图,开放条代表流通,封闭条代表洗脱。
发明详述
本发明公开的主题将在下文更完整地描述,其中,描述了本发明公开的主题的部分但不是所有的实施方式。实际上,本发明公开的主题可以许多不同的形式实施,不应被解释为限制为下文所述的实施方式,相反,提供这些实施方式,从而该公开满足适用的法律要求。
本发明使用的术语仅用于描述特定实施方式的目的,并不意在限制本发明公开的主题。
除非在下文另有限定,否则本发明使用的所有技术和科技术语意在具有由本领域技术人员通常理解的相同含义。对本文采用的技术的参考意在指本领域中通常理解的技术,包括对本领域技术人员来说为显而易见的这些技术的变形或等同技术的替代。尽管认为本领域技术人员充分理解下文的术语,但列出下列定义以促进对本发明公开的主题的理解。
在描述本发明公开的主题时,将理解公开了大量的技术和步骤。每个技术和步骤具有单独的益处,并且可以与一个或多个其它公开的技术结合使用,在一些情况下,可以与所有其它公开的技术结合使用。
因此,为了清晰起见,该说明书将避免以不必要的方式重复单个步骤的每个可能的组合。然而,将以理解这样的组合整体在本发明和权利要求的范围内的方式来阅读说明书和权利要求。
根据长期存在的专利法公约,在用在本申请包括权利要求中时,术语“一个(a)”、“一个(an)”、“所述(the)”指“一个或多个”。因此,例如“工具”包括多个这样的工具等。
除非另有说明,否则表示成分、反应条件等的数量的所有数字,在用在说明书和权利要求中时,理解为在所有情况下通过术语“大约”来修饰。因此,除非有相反的说明,否则在说明书和所附的权利要求中所列出的数值参数为近似值,可根据由本发明公开的主题寻求获得的所需特性来变化。
如在本文使用的,术语“大约”,当指组合物、质量、重量、温度、时间、体积、浓度、百分比等的数值或数量时,意味着涵盖变量,在一些实施方式中,变量为特定数量的±20%,在一些实施方式中,变量为特定数量的±10%,在一些实施方式中,变量为特定数量的±5%,在一些实施方式中,变量为特定数量的±1%,在一些实施方式中,变量为特定数量的±0.5%,在一些实施方式中,变量为特定数量的±0.1%,因为这样的变量适于执行所公开的方法或采用所公开的组合物。
术语“包括(comprising)”,其为“包含(including)”“含有(containing)”或“特征在于(characterizedby)”的同义词,为包括性的或开放性结尾的,不排除额外的、未引用的要素或方法步骤。“包括(comprising)”为本领域中在权利要求语言中使用的术语,其意味着所述的要素很重要,但可以添加其它的要素,并还解释为在权利要求的范围内。
如本文所使用的,短语“由……组成(consistingof)”排除了未在权利要求中指出的任何要素、步骤或成分。当短语“由……组成(consistingof)”出现在权利要求的主体的条款中,而不是紧随前序特征时,其将仅限定在条款中列出的要素,其它要素不从权利要求中整体排除。
如本文所使用的,短语“主要由……组成(consistingessentiallyof)”将权利要求的范围限定为具体指定的材料或步骤,加上那些不会实质地影响所要求保护的主题的基本特征和新颖的特征。
关于术语“包括(comprising)”、“由……组成(consistingof)”和“主要由…….组成(consistingessentiallyof)”,当使用这三个术语中的一个时,本发明公开和要求保护的主题包括使用任一其它两个术语。
如本文所使用的,当术语“和/或”用在列出实体时,指实体单独存在或组合地存在。因此,例如,短语“a、b、c和/或d”包括单个的a、b、c和d,还包括a、b、c和d的任意和所有组合和亚组合。
本文使用的“类肽”指多n取代的甘氨酸,具有一个或多个官能团,和/或功能残基。本文公开的类肽和类肽化合物可包括形成类肽骨架的依次连接的类肽残基,一个或多个官能团附接至类肽骨架的类肽残基的氮(n),而不是α碳(c)。如本文所公开的,术语“类肽”、“类肽化合物”和/或“类肽亲和配体”可以互换使用。
如本文使用的“官能团”或“功能残基”可以是任何合适的基团或取代基,包括但不限于h、线性烷基和环烷基、烯基和炔基,可能利用烷氧基、卤基、巯基、叠氮基、氰基、甲酰基、羧基、羟基、硝基、酰基、芳氧基、烷硫基、氨基、烷基氨基、芳基烷基氨基取代和/或功能化,取代的氨基、酰氨基、酰氧基、酯基、硫酯基、羧基硫酯基、醚基、酰胺基、脒基(amidino)、硫酸基(sulfate)、亚砜基(sulfoxyl)、磺酰基、磺酰基、磺酸基、磺酰胺、尿素、烷氧基酰胺基、氨基酰氧基、胍基、醛基、酮基、亚胺、腈基、磷酸盐、硫醇、环氧基、过氧化物、硫氰酸盐、脒基、肟基、腈基、重氮等,这些术语包括下文讨论的这些基团(例如烷基化基团)的组合。
在本文单独使用的或作为另外的基团的一部分使用的“杂环基”指具有至少两个不同元素的原子作为环成员的环化合物。
在本文单独使用的或作为另外的基团的一部分使用的“烷基”指直链的、支链的或环状的、饱和或不饱和的碳氢化合物,其含有1或2至10或20个碳原子,或更多的碳原子。烷基的代表性例子包括但不限于甲基、乙基、正丙基、异丙基、正丁基、仲丁基、异丁基、叔丁基、正戊基、异戊基、新戊基、正己基、3-甲基己基、2,2-二甲基戊基、2,3-二甲基戊基、正庚基、正辛基、正壬基、正癸基等。如本文使用的“低级烷基”为烷基的亚集,在一些优选的实施方式中,指含有1至4个碳原子的直链或支链烃基团。低级烷基的代表性示例包括但不限于甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基等。除非另有说明,术语“烷基”或“低级烷基”意在包括取代的和未取代的烷基或低级烷基,这些基团可用选自以下组中的基团来取代:卤基(例如卤代烷基)、烷基、卤代烷基、烯基、炔基、环烷基、环烷基烷基、芳基、芳基烷基、杂环基、杂环烷基、羟基、烷氧基(从而产生聚烷氧基,例如聚乙二醇)、烯氧基、炔氧基、卤代烷氧基、环烷氧基、环烷基烷氧基、芳氧基、芳基烷基氧基、杂环氧基、杂环烷基氧基、巯基、烷基-s(o)m、卤代烷基-s(o)m、烯基-s(o)m、炔基-s(o)m、环烷基-s(o)m、环烷基烷基-s(o)m、芳基-s(o)m、芳烷基-s(o)m、杂环-s(o)m、杂环烷基-s(o)m、氨基、羧基、烷氨基、烯氨基、炔氨基、卤代烷基氨基、环烷基氨基、环烷基烷基氨基、芳基氨基、芳基烷基氨基、杂环氨基、杂环烷基氨基、二取代的氨基、酰胺基、酰氧基、酯基、酰胺基、磺胺基、尿素、烷氧基酰胺基、氨基酰氧基、硝基或氰基,其中m=0、1、2或3。烷基可以是饱和的或不饱和的,因此当烷基取代基包括一个或多个不饱和键(例如一个或两个双键或三键时),如本文使用的术语“烷基”包括烯基和炔基。烷基基团任选地包括一个或多个杂原子(例如,一个、两个或三个或更多个杂原子独立地选自o、s和nr′,其中r′为任意合适的取代基,例如如上所描述的烷基取代基),以形成如下所具体限定的线性杂烷基或杂环基。
如本文使用的“烯基”指如上所述的烷基基团在其中的两个碳原子之间包括至少一个双键。
如本文使用的“炔基”指如上所述的烷基基团在其中的两个碳原子之间包括至少一个三键。
如本文使用的“烯烃基”指如上所述的烷基基团的一个端基氢被移除,以形成二价取代基。
如本文单独使用或作为另一基团的一部分使用的“芳香族化合物”指含有平面不饱和原子环的基团,该原子环通过形成该环的键的相互作用而稳定。这种化合物在某些情况下可以用苯及其衍生物来表征。芳香族官能团或其它取代基也可以称为芳基。
如本文单独使用或作为另一基团的一部分使用的“杂芳基”是指具有芳香化合物或芳基的特征,同时在环中具有至少一个非碳原子的基团。
如本文单独使用或作为另一基团的一部分使用的“杂环基团”或“杂环基”指脂肪族(例如,完全或部分饱和杂环)或芳香族(例如,杂芳基)单环或双环系统。单环系统以含有1、2、3或4个杂原子的任何5或6元环为例,杂原子独立地选自氧、氮和硫。5元环具有0至2个双键,6元环具有0至3个双键。单环系统的代表性实例包括但不限于氮杂环丁烷、吖庚因(azepine)、氮杂环丙烷、二氮杂卓、1,3-二氧戊环、二氧六环、二噻烷、呋喃、咪唑、咪唑啉、咪唑啉啶、异噻唑、异噻唑啉、异噻唑烷、异恶唑、异噻唑啉、异恶唑烷、吗啉、恶二唑、恶二唑啉、恶唑、恶唑啉、恶唑烷、哌嗪、哌啶、吡喃、吡嗪、吡唑、吡唑啉、吡唑烷、吡啶、嘧啶、哒嗪、吡咯、吡咯啉、吡咯烷、四氢呋喃、四氢噻吩、四嗪、四唑、噻重氮、噻二唑啉、噻二唑啶、噻唑、二氢噻唑、四氢噻唑、噻吩、硫代吗啉、硫代吗啉砜、噻喃、三嗪、三唑、三噻烷等。双环环系统通过与本文中定义的芳基、本文中定义的环烷基或本文中定义的另一单环环系统稠和的上述任何单环环系统来示例。双环系统的典型实例包括但不限于,例如,苯并咪唑、苯并噻唑、苯并噻二唑、苯并噻吩、苯并噻唑、苯并恶唑、苯并呋喃、苯并吡喃、苯并噻喃、苯并二恶英、1,3-苯并二恶唑、噌啉、吲唑、吲哚、吲哚啉、吲哚嗪、萘啶、异苯并呋喃、异苯并噻吩、异吲哚、异吲哚啉、异喹啉、酞嗪、嘌呤、吡喃吡啶、喹啉、喹嗪、喹喔啉、喹唑啉、四氢异喹啉、四氢喹啉、硫代吡喃吡啶等。这些环包括其季铵化衍生物,并且可以任选地用选自以下的基团取代:卤基、烷基、卤代烷基、烯基、炔基、环烷基、环烷基烷基、芳基、芳基烷基、杂环基、杂环烷基、羟基、烷氧基、烯基氧基、炔基氧基、卤代烷氧基、环烷氧基、环烷基烷基氧基、芳氧基、芳基烷基氧基、杂环氧基、杂环烷基氧基、巯基、烷基-s(o)m、卤代烷基-s(o)m、烯基-s(o)m、炔基-s(o)m、环烷基-s(o)m、环烷基烷基-s(o)m、芳基-s(o)m、芳烷基-s(o)m、杂环-s(o)m、杂环烷基-s(o)m、氨基、烷氨基、烯氨基、炔氨基、卤代烷基氨基、环烷基氨基、环烷基烷基氨基、芳基氨基、芳基烷基氨基、杂环氨基、杂环烷基氨基、二取代的氨基、酰胺基、酰氧基、酯基、酰胺基、磺胺基、尿素、烷氧基酰胺基、氨基酰氧基、硝基或氰基,其中m=0、1、2或3。
如在本文中单独使用或作为另一基团的一部分使用的“芳基”指的是具有一个或多个芳香环的单环碳环系统或双环碳环稠合环系统。芳基的代表性实例包括,甘菊基(azulenyl)、二氢茚基、茚基、萘基、苯基、四氢萘基等。除非另有说明,术语“芳基”旨在包括取代的和未取代的芳基,并且这些基团可以用与上述烷基和低级烷基有关的相同基团取代。
如本文中所单独使用的或作为另一基团的一部分使用的“芳烷基”指的是一种芳基,如本文所定义的,通过烷基基团附接在母体分子部分上,如本文所定义。芳烷基的代表性实例包括但不限于苄基、2-苯基乙基、3-苯丙基、2-萘-2-基乙基等。
如本文所使用的“杂芳基”结合上述杂环基进行描述。
如本文单独使用或作为另一基团的一部分使用的“烷氧基”是指烷基或低级烷基,如本文中所定义(因此包括取代形式,如聚烷氧基),通过氧基-o-附接到母分子部分。烷氧基的典型实例包括但不限于甲氧基、乙氧基、丙氧基、2-丙氧基、丁氧基、叔丁氧基、戊氧基、己氧基等。
如本文所使用的“卤基”是指任何合适的卤素,包括-f、c1、-br和-i。
如本文所单独使用或作为另一基团的一部分使用的“酰基”是指-c(o)r自由基,其中r是任何合适的取代基,如芳基、烷基、烯基、炔基、环烷基或本文所述的其他合适的取代基。
如本文单独使用或作为另一基团的一部分使用的“烷硫基”是指如本文定义的烷基,通过如本文定义的硫基部分附接到母分子部分。烷硫基的代表性实例包括但不限于甲基硫基、乙基硫基、叔丁基硫基、己基硫基等。
如本文单独使用或作为另一基团的一部分使用的“烷基氨基”指的是自由基-nhr,其中r是烷基。
如本文单独使用或作为另一基团的一部分所使用的“二取代氨基”是指自由基-nrarb,其中ra和rb独立地选自烷基、卤代烷基、烯基、炔基、环烷基、环烷基烷基、芳基、芳基烷基、杂环基、杂环烷基。
如本文单独使用或作为另一基团的一部分使用的“酰氨基”是指自由基-nrarb,其中ra是本文定义的酰基,rb选自氢、烷基、卤代烷基、烯基、炔基、环烷基、环烷基烷基、芳基、芳基烷基、杂环基、杂环烷基。
如本文单独使用或作为另一基团的一部分所使用的“酰氧基”是指自由基-or,或者r是本文定义的酰基。
如本文单独使用或作为另一基团的一部分使用的“酯基”指c(o)or自由基,其中r是任何合适的取代基,如烷基、环烷基、烯基、炔基或芳基。
如本文单独使用或作为另一基团的一部分使用的“酰胺基”指c(o)nrarb自由基或n(ra)c(o)rb自由基,其中ra和rb是任何合适的取代基,如烷基、环烷基、烯基、炔基或芳基。
如本文使用的“亚砜基”是指式-s(o)r的化合物,其中r是任何合适的取代基,如烷基、环烷基、烯基、炔基或芳基。
如本文使用的“磺酰基”是指式-s(o)(o)r的化合物,其中r是任何合适的取代基,如烷基、环烷基、烯基、炔基或芳基。
如本文使用的“磺酸基”是指式-s(o)(o)or的化合物,其中r是任何合适的取代基,如烷基、环烷基、烯基、炔基或芳基。
如本文所用的“磺酸”是指式s(o)(o)oh的化合物。
如本文单独使用或作为另一基团的一部分使用的“磺酰胺基”指s(o)2nrarb自由基,其中ra和rb是任何合适的取代基,如h、烷基、环烷基、烯基、炔基或芳基。
如本文单独使用或作为另一基团的一部分使用的“尿素”是指-n(rc)c(o)nrarb自由基,其中ra、rb和rc是任何合适的取代基,如h、烷基、环烷基、烯基、炔基或芳基。
如本文单独使用或作为另一基团的一部分使用的“烷氧基酰氨基”是指-n(ra)c(o)orb自由基,其中ra、rb是任何合适的取代基,如h、烷基、环烷基、烯基、炔基或芳基。
如本文单独使用或作为另一基团的一部分使用的“氨基酰氧基”是指-oc(o)nrarb自由基,其中ra和rb是任何合适的取代基,如h、烷基、环烷基、烯基、炔基或芳基。
如本文使用的“固相载体”可以包括任何合适的材料,包括有机材料(例如,有机聚合物)、金属(例如,钛)、无机材料(例如,二氧化硅)及其复合材料。固相载体可以是任何合适的形状或形式,包括膜纤维和膜(例如,再生纤维素)、容器,例如微滴定板孔(例如,基底和/或其壁)颗粒、(例如,由天然或合成聚合物、无机材料形成的树脂或珠子,无机材料如玻璃或二氧化硅、其复合材料等),例如用于色谱柱填料等。
如本文所使用的“连接基团”可以是任何合适的反应基团,例如烯烃、炔烃、醇、巯基(thiol)、氧硒基(selenyl)、膦羧基、羧酸基、甲酰基、卤化物或胺基,直接由母体分子展示或通过中间连接基团(例如,脂肪族、芳香族或混合脂肪族/芳香族基团,如烷基、芳基、芳基烷基或烷基芳基烷基等)展示。
本发明公开了类肽亲和配体,其被配置为特异性结合免疫球蛋白、免疫球蛋白片段和/或其免疫球蛋白融合蛋白。作为示例而非限制性的,在一些实施方式中,本文公开的类蛋白可以用于结合、收集、纯化、在固体表面上固定等,任何类型的抗体或抗体片段(例如,fc片段、fab片段和scfv片段),包括天然和重组(包括嵌合)抗体、工程多体、单域抗体及其组合,例如二价抗体和骆驼科免疫球蛋白,以及单克隆和多克隆抗体,或fc-融合蛋白。抗体可以是任何种类的起源,或者来自任何受试者,包括哺乳动物(兔子、小鼠、大鼠、牛、山羊、绵羊、美洲驼、骆驼、羊驼等)、禽类(例如,鸡、鸭、火鸡等)、软骨鱼(鲨鱼ignar等),包括片段、嵌合体及其组合,如上所述。如本文使用的“受试者”是指任何无脊椎动物或脊椎动物的成员。因此,术语“受试者”旨在包括动物界的任何成员,包括但不限于脊索动物门(例如,硬骨鱼类(硬骨鱼)、两栖类(两栖动物)、爬行纲(爬行动物)、鸟类(鸟)和哺乳类(哺乳动物)的成员),以及其中涵盖的所有目和族。作为示例而非限制性的,这样的受试者可以包括人类和其他灵长类动物,以及那些由于濒临灭绝(如西伯利亚虎)而变得很重要、对人类具有经济重要性(饲养在农场供人类消费的动物)和/或社会重要性(作为宠物或在动物园饲养的动物)的动物,例如,除人类以外的食肉动物(如猫和狗)、猪(猪(pig)、猪(hog)和野猪)、反刍动物(如牛、公牛、绵羊、长颈鹿、鹿、山羊、野牛和骆驼)、啮齿动物(如小鼠、大鼠和兔子)、有袋动物和马。这些受试者还可以包括鸟类,包括那些濒临灭绝的鸟类,动物园饲养的鸟类,以及家禽,尤其是家养的家禽,例如家禽类,如火鸡、鸡、鸭、鹅、珍珠鸡等,因为它们对人类也具有经济重要性。
抗体可以是任何类型的免疫球蛋白,包括但不限于igg、iga、ige、igd、igm、igy(禽)等。抗体可以是任何同种型,例如iga1、iga2、igg1、igg2、igg3、igg4等,或其他亚类,以及任何其他物种,例如大鼠、小鼠、山羊、美洲驼等。
在一些实施方式中,抗体或fc片段(包括其融合蛋白)被携带在诸如血液或血液部分(例如,血清、血浆)、蛋黄和/或白蛋白、组织或细胞生长介质、组织裂解液或匀浆等生物流体中。
所公开的类肽亲和配体或类肽在一些方面可以包括式i至v的化合物:
其中:
r是连接部分(例如,r是-oh、-nh2、-nhr″、-or″、-o-o-r″等,其中r″是烷基等)或-z-r′,其中z是连接基团,r′是固相载体(例如,z是-o-、-nh-、-o-nh-、-o-r″-s-、-nh-r″-s-、-o-nh-r″-s-、-o-r″-s-s-、-nh-r″-s-s-、-o-nh-r″-s-s-;醚(-o-)、硫醚(-s-)、硫酯、氨基甲酸酯、碳酸酯、酰胺、酯、仲胺/叔胺(例如,通过还原胺化偶联反应获得的)、烷基(例如,通过复分解偶联反应获得的)、烯基、磷酸二酯、磷醚基(phosphoether)、肟、亚胺、腙基、缩醛、半缩醛、缩氨基脲、酮、烯酮、缩醛胺、半缩醛胺、烯胺、烯醇、二硫化物、砜、半胱胺、半胱氨酸、赖氨酸、2-叠氮甘氨酸、2-炔基甘氨酸等;
r1’、r2’、r3’、r4’、r5’、r6’和r7’各自独立地不存在或是c1到c4烯烃基基团;
r1、r2、r3、r4、r5、r6和r7各自独立地如本文所述,并且包括一个或多个官能团或功能残基,这些官能团或功能残基按照本文所述的任意顺序定向,使得所得到的类肽对如本文所述的一个或多个免疫球蛋白具有结合亲和力。
在一些实施方式中,这种类肽亲和配体可以包括由形成类肽骨架的依次连接的类肽残基组成的类肽化合物,例如,如式i-v所示,具有附接到类肽骨架的类肽残基的氮的一个或多个官能团,如式i-v所示的r1、r2、r3、r4、r5、r6和r7。在某些方面,肽骨架可以被环化。
官能团或r-基团可以包括本文例示的任何侧链、胺、化学结构等,但不一定限于本文中所公开、讨论或显示的那些实例。作为示例而非限制性的,表1提供了所公开的类肽和类肽亲和配体的示例性r基团或官能团。
在一些实施方式中,一个或多个官能团包括以任何顺序但是偶联到类肽骨架上的依次连接的类肽残基的至少两个芳香族官能团以及碱性或酸性官能团。这种官能团,例如至少两个芳香族官能团和碱性或酸性官能团,可以以任何方式定向或加扰(scramble),只要它们与依次连接的类肽残基偶联并且类肽特异地结合免疫球蛋白、免疫球蛋白片段或其免疫球蛋白融合蛋白,其中免疫球蛋白、免疫球蛋白片段或其免疫球蛋白融合蛋白是igg、iga、ige、igd、igm或igy中的一种或多种。在一些方面,芳香族官能团包括杂芳族官能团。
作为示例而非限制性的,这样的类肽和类肽亲和配体可以包括下面表2中列出和显示的一个或多个序列和结构。
表2
在一些实施方式中,一个或多个官能团包括至少两个芳香族官能团和碱性或酸性官能团,它们以任何顺序定位或附接到类肽骨架的类肽残基的任何氮上。这种官能团,例如至少两个芳香族官能团和碱性或酸性官能团,可以以任何方式定向或扰乱,只要类肽特异性结合免疫球蛋白、免疫球蛋白片段或其免疫球蛋白融合蛋白,其中免疫球蛋白、免疫球蛋白片段或其免疫球蛋白融合蛋白是igg、iga、ige、igd、igm或igy中的一种或多种。在一些方面,芳香族官能团包括杂芳基官能团。
作为示例而非限制性的,这样的类肽和类肽亲和配体可以包括下面表3中列出和显示的序列和结构中的一个或多个。
表3
在一些实施方式中,所公开的类肽和类肽亲和配体,无论是需要特定序列的官能团还是完全随机/分散的,都不包括包含具有三个类肽残基的连续片段的类肽亲和配体,所述类肽残基具有下列官能团:(i)碱性残基,(ii)芳香族残基,和(iii)碱性残基或亲水性残基。在一些方面,从所公开的类肽中排除那些包含从类肽骨架的n端到c端以及在n端位置处的三个类肽残基的连续片段,这些类肽残基具有以下官能团:(i)碱性残基,(ii)芳香族残基,和(iii)碱性残基或亲水性残基。
在一些实施方式中,官能团包括非天然氨基酸官能团,包括d-氨基酸和β-氨基酸。
在一些实施方式中,本发明公开的类肽和类肽亲和配体可以包括形成类肽骨架的依次连接的类肽残基,所述类肽骨架包括3至15个或更多个类肽残基,例如3至10个类肽残基,3至9个类肽残基,3至8个类肽残基,3至7个类肽残基等等。
本发明公开的类肽亲和配体被配置为对免疫球蛋白具有高结合亲和力,因此可以作为有效和高效的纯化配体。作为示例而非限制性的,所公开的类肽亲和配体对免疫球蛋白、免疫球蛋白片段或其免疫球蛋白融合蛋白的平衡解离常数(kd)为大约0.05×10-6摩尔至大约50×10-6摩尔,包括例如大约0.5x10-6摩尔至大约10x10-6摩尔,大约0.5x10-6摩尔至大约5x10-6摩尔,和大约0.5x10-6摩尔至大约1x10-6摩尔。
在一些实施方式中,所公开的类肽亲和配体可以被配置为在比其他亲和配体(例如基于蛋白的亲和配体)可能需要的更高的ph(例如减少酸性)下结合并随后释放结合的免疫球蛋白、免疫球蛋白片段或其免疫球蛋白融合蛋白。例如,结合的免疫球蛋白或其它靶抗原可以在大约3到大约7的ph下释放,包括例如ph大约4到大约6、大约4到大约5、大约3到大约5或大约4到大约7。这些配体允许结合的免疫球蛋白在较高、或较弱酸性和更中性的ph下释放,在某些方面ph可提高配体的稳定性和/或重用性。此外,另一个益处赋予了在这些酸性条件下洗脱的免疫球蛋白。特别地,较温和的ph提高了洗脱的免疫球蛋白的稳定性,特别是增加了对ph敏感的免疫球蛋白的稳定性,并且在一些实施方式中甚至更有利于单克隆抗体,因为它们在理论上是均匀免疫球蛋白的群体。
目前公开的类肽和类肽亲和配体的一个方面是它们不仅能够高亲和力和特异性的结合免疫球蛋白,而且能够在抵抗类肽本身的降解或变性的同时结合免疫球蛋白。因此,在一些实施方式中,公开的类肽和相关亲和配体与结合免疫球蛋白的基于蛋白的配体相比,对蛋白质水解的抵抗强至少50%或更多。在一些实施方式中,与结合免疫球蛋白(例如蛋白a或g)的基于蛋白的配体相比,对蛋白质水解的抵抗强大约10%、20%、30%、40%、50%或更多,以及它们的范围。基于这种稳健特性和对蛋白质水解的抗性,所公开的类肽和类肽亲和配体可以适用于多个纯化周期,即重复使用。因此,本发明公开的配体可以提供优于现有配体的效率和成本效益的优点。
在一些实施方式中,公开的类肽和类肽亲和配体被配置为有效和高效地结合igm,在一些实施方式中,以比现有配体和结合化合物高得多的亲和力结合igm。例如,所公开的类肽亲和配体对igm可以具有大约0.05x10-6到大约50x10-6摩尔的kd,包括例如大约0.5x10-6摩尔到大约10x10-6摩尔,大约0.5x10-6摩尔到大约5x10-6摩尔,以及大约0.5x10-6摩尔到大约1x10-6摩尔。
可以使用所公开的类肽进行结合、分离或以其他方式纯化的免疫球蛋白、免疫球蛋白片段和/或免疫球蛋白融合蛋白可包括来自任何生物体的免疫球蛋白等,包括例如哺乳动物、禽类、软骨鱼类等。
在一些方面,本发明公开的类肽亲和配体可以连接到固相载体,包括例如但不限于颗粒、无机材料和/或有机聚合物材料。在一些实施方式中,这样的固相载体可以包括膜纤维或膜,包括例如再生纤维素。这样的固相载体可用于各种应用,如膜色谱法。
在一些实施方式中,固相载体包括颗粒(例如,珠子,例如多孔聚合物珠子,如色谱树脂珠状物)。在一些实施方式中,固相载体包括无机材料(例如,二氧化硅、二氧化钛、氧化锆等)。在一些实施方式中,固相载体包括有机聚合物材料(例如聚醚砜、pmma等)。
在一些实施方式中,类肽亲和配体可以通过除巯基键以外的键,优选氨基键与固相载体结合。通过提供具有除巯基连接以外的连接的类肽,在一些实施方式中,该类肽可以与免疫球蛋白、免疫球蛋白片段或其免疫球蛋白融合蛋白具有比具有巯基连接的类肽亲和配体至少约10%至约20%更好的结合亲和力。不受任何特定理论或作用机制的约束,这种连接可以允许一个或多个官能团以优化和/或增强与一个或多个免疫球蛋白的结合亲和力的方式定向或定位。
在一些实施方式中,在下面的表4中也提供了如本发明所公开的示例性类肽。这样的类肽包括在类肽状骨架上的3至9个类肽残基,具有相应的官能团或残基,r1至r9如表4所示。官能团r1至r9各自对应于以上表1中的编码或残基id。
表4
本公开的类肽化合物,例如式i-v的化合物和表1-4中的化合物,可根据已知技术制备,包括但不限于在以下文中描述的:n.j.brown,j.johansson和a.e.barron,acc.chem.res.41,1409-1417(2008);n.p.chongsiriwatana,j.a.patch,a.m.czyzewski,m.t.dohm,a.ivankin,d.gidalevitz,r.n.zuckermann和a.e.barron,pnas105,2794-2799(2008);k.e.drexler,peptidescience96,537-544(2011);b.c.gorske,b.l.bastian,g.d.geske和h.e.b1ackwell,j.am.chem.soc.129,8928-8929(2007);t.hara,s.r.durell,m.c.myers和d.h.appella,j.am.chem.soc.128,1995-2004(2006);r.d.haynes,r.j.meagher,j.-i.won,f.m.bogdan和a.e.barron,bioconjugatechem.16,929-938(2005);k.kirshenbaum,a.e.barron,r.a.goldsmith,p.armand,e.k.bradley,k.t.v.truong,k.a.dill,f.e.cohen和r.n.zuckermann,pnas95,4303-4308(1998);y.-u.kwon和t.kodadek,j.am.chem.soc.129,1508-1509(2007);g.maayan,m.d.ward和k.kirshenbaum,pnas106,13679-13684(2009);s.m.miller,r.j.simon,s.ng,r.n.zuckermann,j.m.kerr和w.h.moos,drugdevelopmentresearch35,20-32(1995);p.mora,i.masip,n.cortés,r.marquina,r.merino,j.merino,t.carbonell,i.mingarro,a.messeguer和e.pérez-payá,j.med.chem.48,1265-1268(2005);j.e.murphy,t.uno,j.d.hamer,f.e.cohen,v.dwarki和r.n.zuckermann,pnas95,1517-1522(1998);k.t.nam,s.a.shelby,p.h.choi,a.b.marciel,r.chen,l.tan,t.k.chu,r.a.mesch,b.-c.lee,m.d.connolly,c.kisielowski和r.n.zuckermann,naturematerials9,454-460(2010);j.t.nguyen,m.porter,m.amoui,w.t.miller,r.n.zuckermann,和w.a.lim,chem.biol.7,463-473(2000);p.e.nielsen,ed.,pseudo-peptidesindrugdiscovery,1sted.(wiley-vch,2004);s.h.park和i.szleifer,j.phys.chem.b115,10967-10975(2011);j.a.patch和a.e.barron,j.am.chem.soc.125,12092-12093(2003);i.peretto,r.m.sanchez-martin,x.wang,j.ellard,s.mittoo和m.bradley,chem.commun.2312-2313(n.d.);m.c.pirrung,k.park和l.n.tumey,j.comb.chem.4,329-344(2002);m.m.reddy和t.kodadek,proe.nat.acad.sci.usa102,12672-12677(2005);m.m.reddy,r.wilson,j.wilson,s.connell,a.gocke,l.hynan,d.german和t.kodadek,cell144,132-142(2011);t.j.sanborn,c.w.wu,r.n.zuckermann和a.e.barron,biopolymers63,12-20(2002);t.
本发明的类肽可用于结合、收集、纯化、在固体表面固定等任何类型的抗体或抗体片段(例如,fc片段、fab片段和scfv片段),包括天然和重组(包括嵌合)抗体、工程化多体、单域抗体及其组合,例如二价抗体和骆驼科免疫球蛋白,以及单克隆和多克隆抗体,或fc-融合蛋白。抗体可以是任何种类的起源,包括哺乳动物(兔、小鼠、大鼠、牛、山羊、绵羊、美洲驼、骆驼、羊驼等)、禽类(例如,鸡、火鸡等)、鲨鱼等,包括如上所述的片段、嵌合体及其组合。抗体可以是任何类型的免疫球蛋白,包括但不限于igg、iga、ige、igd、igm、igy(禽类)等。
在一些实施方式中,抗体或fc片段(包括其融合蛋白)被携带在诸如血液或血液部分(例如,血清、血浆)、蛋黄和/或白蛋白、组织或细胞生长培养基、组织裂解液或匀浆等生物流体中。
更具体地,在一些实施方式中提供了结合免疫球蛋白的方法。这样的方法可以允许从含有免疫球蛋白、免疫球蛋白片段或其免疫球蛋白融合蛋白的液体组合物中结合免疫球蛋白、免疫球蛋白片段或免疫球蛋白融合蛋白。这些方法可以包括提供包含本文所公开的类肽亲和配体的固相载体,并使组合物与固相载体接触,使得免疫球蛋白、免疫球蛋白片段或其免疫球蛋白融合蛋白结合至固相载体的类肽亲和配体。然后液体组合物可以与固相载体分离,免疫球蛋白、免疫球蛋白片段或其免疫球蛋白融合蛋白与固相载体的类肽亲和配体结合。此外,免疫球蛋白、免疫球蛋白片段或其免疫球蛋白融合蛋白可从固相载体的类肽亲和配体中分离或洗脱。在某些方面,接触和分离步骤可以连续或分批进行。
在某些方面,从类肽亲和配体分离免疫球蛋白、免疫球蛋白片段或其免疫球蛋白融合蛋白的步骤在ph大约3到大约7,优选ph大约4到大约5下进行。例如,结合的免疫球蛋白或其他靶抗原可以在ph大约3到大约7下释放,包括例如ph大约4到大约6、大约4到大约5、大约3到大约5或大约4到大约7。
能够从其纯化免疫球蛋白或抗体的液体组合物可以包括至少一种蛋白水解酶,在某些方面可以是生物流体。例如,液体组合物、样品或等分试样可以包括血液、血清、血浆、组织或细胞培养基、细胞裂解物、植物提取物或由重组生物体产生和/或分泌的流体。
这些方法可以以与采用蛋白a的方法相同的方式进行,或者通过对于本领域技术人员来说显而易见的变型来执行。例如,接触和分离步骤可以连续进行(例如,通过柱色谱),或者静态(例如,通过分批模式),然后根据已知技术可以进行分离步骤(例如,通过洗脱)。
在一些实施方式中,例如当从其收集抗体或fc片段或fc融合蛋白的液体组合物包含生物流体时,液体组合物进一步包含至少一种蛋白水解酶。如本文所述,类肽结合配体有利地抵抗蛋白水解酶降解。
此外,可以通过用光反应基团(例如二苯甲酮基团)取代类肽的任何侧链残基来进行上述所有目标抗体/免疫球蛋白的光亲和标记。
具体实施方式
包括下面的实施例以进一步说明本发明公开的主题的各种实施方式。然而,根据本公开,本领域普通技术人员应当理解,在所公开的具体实施例中可以做出许多改变,并且仍然在不脱离本发明公开的主题的精神和范围的情况下获得相似或类似的结果。
实施例1
固相合成和纯化用于纯化多克隆抗体或单克隆抗体的类肽配体
类肽配体是在微波辅助下使用biotagealstra自动肽合成器用上述方法生产的(fara等tet.lett.200647,1011-1014;olivos等org.lett.2002,4(23),4057-4059)。在用于固相肽合成(spps)的聚苯乙烯基树脂,包括半胱胺-2-氯三苯甲基树脂上合成类肽。在合成前,树脂在dmf中70℃膨胀20分钟。将作为保护单体、作为n-fmoc-甘氨酸和n-fmoc-n-甲基甘氨酸的残基加入到载体上,用二异丙基碳二酰亚胺(dic)和氧化苦参碱(oxyma)作为偶联剂。每个偶联反应在dmf中在75℃下进行5分钟,然后在室温下用20%哌啶在dmf中进行fmoc-脱保护。类肽残基的其它残基通过常规亚单体方法加入。首先,在40℃下在dmf中将氯乙酸与dic偶联15分钟。然后,通过在dmf中在60℃下反应15分钟的末端氯的亲核置换,加入适当的伯胺。类肽合成中所用的胺和相应的r基团在表1中定义。表2、3和4定义了制备和测试的类肽的结构。
用三氟乙酸、苯酚、水和三异丙基硅烷(92.5/2.5/2.5/2.5)的混合物从合成树脂中分离出类肽。粗类肽经乙醚沉淀后,用低压反相色谱(c18,10%-100%乙腈/水梯度,0.1%乙酸)纯化。将纯化的类肽冻干为干粉末,用lc/ms确认产物的质量。
当需要时,被保护的二胺被用于在合成骨架序列之后允许类肽进一步官能化。选择正交保护基团以度过类肽的合成条件,但在完成完整的肽骨架从合成树脂裂解期间脱保护。然后从树脂中裂解类肽后将这些胺转化。通过用10当量异氰酸钾将类肽以50毫克/毫升溶解在的冰醋酸中,在60℃下孵育2小时,将伯胺转化为脲基基团。在配体与色谱树脂结合后,完成将这些胺转化为胍基基团。通过lc/ms证实脲基基团的加入。
实施例2
类肽亲和配体与色谱载体的结合
通过将类肽与色谱载体结合,制备用于抗体纯化的亲和吸附剂。将类肽与色谱树脂结合,如toyopearl氨基af-650-m、琼脂糖(sepharose)或琼脂糖(agarose),这些树脂用侧基(pendant)环氧、溴乙酰基、三氟代乙烷磺酰(tresyl)或溴醇基活化。在乙醇中以30mg/ml溶解类肽,然后在ph10下,将0.02毫摩尔的类肽配体加入悬浮在当量体积的0.2mk2co3中的1ml活性树脂中。悬浮液在室温下上下颠倒搅拌过夜。然后将树脂过滤并用甲醇、0.1m甘氨酸在ph2.5下洗涤,然后用pbs洗涤。收集的上清液和洗涤部分在280或260nm处进行分光光度分析,以确定相对于溶液中初始量的类肽的结合程度。然后将树脂用0.05%叠氮化钠转移到pbs中作为50v/v%浆料储存。
在类肽与树脂结合之后,对于选择的配体,第三个残基的伯胺被转化成胍基(图1)。将树脂悬浮在ph90.2mk2co3缓冲液中,然后加入10当量的1h-吡唑-1-甲酰胺盐酸盐。将悬浮液在60℃下搅拌3小时,培养后,用pbs依次洗涤树脂,然后以50v/v%的浆料储存在pbsw/0.05%叠氮化钠中。
实施例3
多克隆人igg对类肽亲和树脂的亲和力
通过测定每个树脂对多克隆人igg的吸附等温线来测定类肽-树脂组合的亲和性(pakimna等,jappliedsci.,12(11):1136-1141,2012)。简言之,将0.050ml的50%树脂浆液吸取到96孔滤板(0.45微米,pvdf,harvard仪器)的6个单孔中。采用真空歧管用2x250μlpbs洗涤树脂。将0.25ml的人多克隆igg溶液以不同浓度(10、5、2.5、1.25、0.625和0.3125mg/ml)添加到单个孔中。将树脂/igg悬浮液在摇床上轻轻搅拌30分钟。然后通过真空收集流体,并用0.25毫升pbs洗涤树脂。然后通过bca分析滤液和洗涤液以确定相对于溶液起始浓度的残余igg浓度。
然后使用平衡浓度用以下公式来确定在每个igg浓度下的树脂的容量:
q=体积样品x(初始浓度-平衡浓度)/体积树脂
生成q与平衡浓度的关系图,数据用双曲线拟合,以根据以下公式确定亲和常数(kd)和最大容量(qmax),其中c=抗体在溶液中的平衡浓度:
q=qmaxxc/(kd+c)
典型的吸附等温线如图2所示。制成表的kd和qmax数据见表2。
实施例4
类肽亲和树脂对正常兔血清igg的选择性
在96孔滤板(pvdf,0.45微米过滤器)中,将0.025毫升树脂分配到每个孔中作为pbs中的50%浆料。用0.25毫升pbs、0.25毫升0.1m甘氨酸(ph2.5)洗涤树脂,然后用2×0.25毫升pbs洗涤树脂。然后将未过滤的兔血清(0.2毫升)用0.05毫升50毫克/毫升溶解在pbs中的辛酸钠稀释。然后用0.25毫升稀释血清处理树脂洗涤液。该板用塑料粘合膜密封,涡旋,然后摇晃30分钟。从树脂中过滤出血清洗涤液,然后用溶解在pbs中的3×0.25ml的10mg/ml的辛酸钠溶液洗涤树脂。然后用ph为4的0.25ml的0.1m乙酸钠缓冲液洗脱抗体。然后通过用考马斯颜料染色的还原sds-page凝胶来分析洗脱液纯度(图3)。
实施例5
类肽亲和树脂对iga的选择性
将50毫克的树脂18-63、18-80和pv-19-1a加入离心柱中,用18cv(10mg/ml己二酸/0.8mnaclph5.8)平衡。样品负载为10毫克人iga每毫升树脂,在存在cho条件培养基的情况下负载。用18cv的平衡/洗涤缓冲液从柱中洗涤未结合的蛋白质。通过使用ph4.0的18cv的0.1m乙酸钠进行产品洗脱(洗脱)。
图4a和4b示出了结果。图4a示出了流通和洗脱组分的sds-page(还原条件)。标记:mm-分子量标记;sl-样品负载;ft-流通组分;el洗脱组分。图4b示出了流通和洗脱组分的elisa结果。用人igaelisa定量试剂盒对所收集的组分中的iga的量进行定量。iga的产量计算为iga洗脱与总iga负载的比率。标记:ft-流通组分;el洗脱组分。
实施例6
类肽亲和树脂对igm的选择性
将50毫克的树脂18-63、18-80和pv-19-1a加入离心柱中,用18cv(10mg/ml己二酸/0.8mnaclph5.8)平衡。样品负载为10毫克人igm每毫升树脂,在存在cho细胞条件培养基的情况下负载。用18cv的平衡/洗涤缓冲液从柱中洗涤未结合的蛋白质。通过使用ph4.0的12cv的0.1m乙酸钠进行产品洗脱(洗脱)。
图5a和5b示出了结果。图5a示出了流通和洗脱组分的sds-page(还原条件)。标记:mm-分子量标记;sl-样品负载;ft-流通组分;el洗脱组分。图5b示出了流通和洗脱组分的elisa结果。用人igmelisa定量试剂盒对所收集的组分中的igm的量进行定量。igm的产量计算为igm洗脱与总igm负载的比率。标记:ft-流通组分;el洗脱组分。
实施例7
类肽亲和树脂对igy的选择性
将50毫克的配体树脂18-63、18-80和pv-19-1a加入离心柱中,用18cv(10mg/ml己二酸/0.8mnaclph5.8)平衡。样品负载为20毫克鸡igy,在存在cho无血清培养基的情况下负载。用18cv的平衡/洗涤缓冲液从柱中洗涤未结合的蛋白质。通过使用ph4.0的18cv的0.1m乙酸钠进行产品洗脱(洗脱)。
图6a和6b示出了结果。图6a示出了流通和洗脱组分的sds-page(还原条件)。标记:mm-分子量标记;sl-样品负载;ft-流通组分;el洗脱组分。图6b示出了流通和洗脱组分的elisa结果。用鸡igyelisa定量试剂盒对所收集的组分中的鸡igy的量进行定量。igy的产量计算为igy洗脱与总igy负载的比率。标记:ft-流通组分;el洗脱组分。
本发明列出的所有参考文献,包括但不限于所有专利、专利申请及其出版物、科学期刊文章和数据库条目,只要它们补充、解释、提供背景技术,或教导了本发明采用的方法、技术和/或组合物,均通过引用纳入本文。
应当理解,在不脱离本发明公开的主题的范围的情况下,可以改变本发明公开的主题的各种细节。此外,前面的描述仅是为了说明的目的,而不是为了限制的目的。
- 还没有人留言评论。精彩留言会获得点赞!