miRNA转录组方法和组合物与流程
本申请要求2016年4月27日提交的美国临时申请号62/328,504的权益,该申请通过引用全文纳入本文用于所有目的。
背景技术:
小rna是一类rna分子,其长度通常小于250个核苷酸,并且不编码用于翻译成蛋白质。这些分子通常在细胞内发挥调节作用,与编码rna相互作用以影响它们的翻译。这种小rna的示例类型包括但不限于mirna,snorna和pirna。
mirna是单链非编码rna分子,其含有约22个核苷酸并且在转录后基因表达和基因沉默的调节中起作用。作为该活性的结果,mirna群的分析是研究例如基因调控,疾病发展,分子诊断和药物遗传学的重要工具。
为了通过例如mirna-seq,mirnart-qpcr或mirna微阵列分析mirna分子的转录组群,生物样品中存在的mirna经常必须使用诸如尺寸选择凝胶电泳的技术富集。生产mirna文库的替代方案包括使用mirna特异性扩增反应或杂交探针。用于富集mirna或其他小多核苷酸的这些和其他选择通常是耗时的或难以应用于小样品,例如衍生自单个细胞的那些样品。
技术实现要素:
通常,本文提供用于富集长度在目标范围内的短多核苷酸分子的方法、试剂盒和材料。
提供的一种多核苷酸包含dna序列,包含许多连续的非天然存在的核苷酸的第一衔接子寡核苷酸,和包含iis型或iii型限制酶的识别位点的第二衔接子寡核苷酸。第一和第二衔接子寡核苷酸与dna序列的相对末端连接。如果dna序列具有在目标长度范围内的长度,则连续的非天然存在的核苷酸的数量足以阻断iis型或iii型限制酶的切割。
在一些实施方式中,dna序列具有目标范围内的长度。
在一些实施方式中,dna序列的长度小于目标长度范围的最小值或大于目标长度范围的最大值。
在一些实施方式中,dna序列包含cdna。
在一些实施方式中,dna序列包含通过mirna的逆转录形成的cdna。
在一些实施方式中,dna序列包含通过sirna的逆转录形成的cdna。
在一些实施方式中,识别位点用于iis型限制酶。
在一些实施方式中,识别位点用于iii型限制酶。
在一些实施方式中,iii型限制酶是ecop15i。
在一些实施方式中,第一或第二衔接子寡核苷酸包含至少一个核糖核苷酸。
在一些实施方式中,连续的非天然存在的核苷酸的数量为3至20。
在一些实施方式中,非天然存在的核苷酸包含硫代磷酸化的碱基。
在一些实施方式中,目标长度范围为18至24个碱基对。
在一些实施方式中,第一和第二衔接子寡核苷酸各自还包含引物结合位点。
提供的一种用于富集来自样品的短多核苷酸序列的试剂盒包含iis型或iii型限制酶,和包含多个连续的非天然存在的核苷酸的第一衔接子寡核苷酸。
在一些实施方式中,试剂盒还包含第二衔接子寡核苷酸,其包含iis型或iii型限制酶的识别位点。
在一些实施方式中,试剂盒还包含rna连接酶。
在一些实施方式中,rna连接酶是t4rna连接酶2,缺失突变体。
在一些实施方式中,试剂盒包含iis型限制酶。
在一些实施方式中,试剂盒包含iii型限制酶。
在一些实施方式中,iii型限制酶是ecop15i。
在一些实施方式中,第一或第二衔接子寡核苷酸包含至少一个核糖核苷酸。
在一些实施方式中,连续的非天然存在的核苷酸的数量为1至20。
在一些实施方式中,非天然存在的核苷酸包含硫代磷酸化的碱基。
在一些实施方式中,目标长度范围为18至24个碱基对。
在一些实施方式中,第一和第二衔接子寡核苷酸各自还包含引物结合位点。
提供的一种从多种dna序列的混合物中富集短dna序列的方法,包括:
提供任何前述多核苷酸的群,
在足以形成切割的多核苷酸和完整的多核苷酸的混合物的反应条件下使群与iis型或iii型限制酶接触,和
随后富集完整的多核苷酸。
在一些实施方式中,通过下述步骤形成多核苷酸群:
提供包含具有rna5'末端和rna3'末端的rna分子群的样品;
将包含第一接头寡核苷酸序列和第一接头寡核苷酸3'末端的第一接头寡核苷酸连接至rna分子的rna3'末端,和
将第二接头寡核苷酸连接至rna分子的rna5'末端,从而形成具有如下结构的杂合rna分子:
5’-第二接头寡核苷酸-rna分子-第一接头寡核苷酸-3'。
该方法还包括从杂合rna分子形成包含第一链cdna序列和第一链cdna3'末端的第一链cdna分子,通过使用该杂合rna作为模板以模板依赖性方式延伸第一逆转录引物来实现。第一逆转录引物被配置为在第一接头寡核苷酸3'末端附近退火至第一接头寡核苷酸。该方法还包括通过使用第一链cdna作为模板以模板依赖性方式延伸第二逆转录引物来从该第一链cdna分子形成第二链cdna分子。第二逆转录引物配置成在第一链cdna3'末端附近退火至第一链cdna序列。这形成了包含第一链cdna序列和第二链cdna序列的双链cdna分子;其中
(a)第一接头寡核苷酸包含iis型或iii型限制酶的识别序列,且第二逆转录引物包含多个连续的非天然存在的核苷酸,或
(b)第二接头寡核苷酸包含iis型或iii型限制酶的识别序列,且第一逆转录引物包含多个连续的非天然存在的核苷酸。如果双链cdna分子由长度在目标长度范围内的rna分子形成,则掺入第一或第二逆转录引物中的连续非天然存在的核苷酸的数量足以阻断iii型或iis型限制酶的切割,但如果双链cdna分子由长度小于目标长度范围最小值或大于目标长度范围最大值的rna分子形成,则不阻断iii型或iis型限制酶的切割。
在一些实施方式中,富集包括扩增完整的多核苷酸。
在一些实施方式中,第一和第二衔接子寡核苷酸各自还包含引物结合位点用于扩增。富集还包括通过延伸正向pcr引物和反向pcr引物来扩增完整的多核苷酸。正向和反向pcr引物配置成退火至第一和第二衔接子寡核苷酸的引物结合位点。
提供的一种反应混合物包含任何前述多核苷酸和iis型或iii型限制酶的群。
附图说明
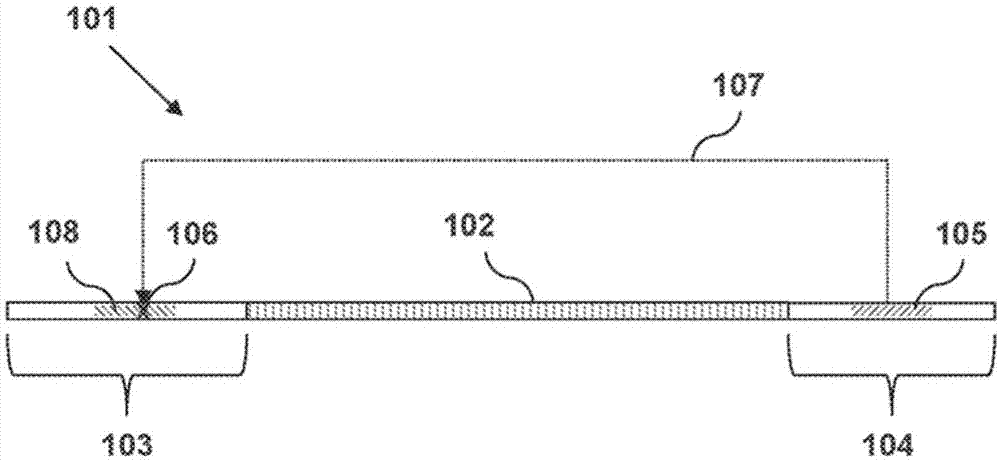
图1说明了根据一个实施方式的多核苷酸。
图2说明了根据一个实施方式的多核苷酸。
图3说明了根据一个实施方式的多核苷酸。
图4说明了根据一个实施方式的多核苷酸。
图5说明了根据一个实施方式的多核苷酸的扩增。
图6说明了对根据一个实施方式的多核苷酸的扩增的阻止。
图7说明了根据一个实施方式的多核苷酸的扩增的形成。
图8说明了根据一个实施方式的多核苷酸的扩增的形成。
图9说明了根据一个实施方式的多核苷酸。
图10是限制酶识别位点数、硫代磷酸化碱基和rna插入物大小对ecop15i多核苷酸消化的影响的图。
定义
除非另有说明,本文所用的以下术语具有它们本来的涵义。
术语“聚合酶”是指进行模板引导的多核苷酸合成的酶。该术语同时包括全长多肽和具有聚合酶活性的结构域。dna聚合酶是本领域技术人员熟知的,包括但不限于从激烈火球菌(pyrococcusfuriosus)、滨海嗜热球菌(thermococcuslitoralis)和海栖热袍菌(thermotogamaritime)分离或衍生的dna聚合酶或其修饰形式。它们包括dna依赖性聚合酶和rna依赖性聚合酶,如逆转录酶。已知至少5个dna-依赖dna聚合酶家族,虽然大多数落入a、b和c家族。各家族之间几乎没有或没有序列相似性。大多数a家族聚合酶是可含有多重酶促功能(包括聚合酶、3'到5'核酸外切酶活性和5'到3'核酸外切酶活性)的单链蛋白质。b家族聚合酶通常有具有聚合酶和3'到5'核酸外切酶活性的单个催化结构域,以及辅助因子。c家族聚合酶通常是具有聚合和3'到5'核酸外切酶活性的多亚基蛋白质。在大肠杆菌中,已经发现了3种类型的dna聚合酶,dna聚合酶i(a家族)、dna聚合酶ii(b家族)和dna聚合酶iii(c家族)。在真核细胞中,核复制中涉及3种不同的b家族聚合酶,dna聚合酶α、δ和ε,并且a家族聚合酶,聚合酶γ用于线粒体dna复制。其它类型的dna聚合酶包括噬菌体聚合酶。相似地,rna聚合酶通常包括真核rna聚合酶i、ii和iii,和细菌rna聚合酶以及噬菌体和病毒聚合酶。rna聚合酶可以是dna依赖性和rna依赖性的。
本文使用的“热稳定聚合酶”指使用dna或rna作为模板通过向核苷酸链中加入核苷酸单元以催化多核苷酸合成的任何酶且该酶在高于45℃的温度下具有最佳活性。
术语“核酸扩增”或“扩增反应”指用于倍增核酸靶序列拷贝的任何体外方法。这种方法包括但不限于聚合酶链反应(pcr),dna连接酶链反应(参见美国专利号4,683,195和4,683,202,《pcr方案:方法和应用指南》(pcrprotocols:aguidetomethodsandapplications)(innis等编,1990)),(lcr),qbetarna复制酶和基于rna转录(如tas和3sr)的扩增反应以及本领域技术人员已知的其它反应。
“扩增”指将溶液置于足以扩增多核苷酸的条件下的步骤。扩增反应的组分包括,例如,引物、多核苷酸模板、聚合酶、核苷酸等。术语扩增一般是指靶核酸的“指数型”增长。然而,本文所用的扩增也可指核酸的选择靶序列数量的线性增长,如由循环测序所得。
“聚合酶链反应”或“pcr”是指靶双链dna的特定区段或子序列得以几何级数式扩增的一种方法。pcr是本领域技术人员所熟知的;参见例如,美国专利号4,683,195和4,683,202;和《pcr方案:方法和应用指南》,innis等编,1990。示例性pcr反应条件一般包括两步或三步循环。两步循环具有变性步骤,之后是杂交/延伸步骤。三步循环包括变性步骤,之后是杂交步骤,之后是独立的延伸步骤。pcr可以终点pcr(即仅在终点处监测)或定量pcr(“实时”监测)的方式进行。
“寡核苷酸引物”或“引物”指退火至靶核酸上的序列并且用作核酸合成的起始点的寡核苷酸序列。引物可以是各种长度并且通常长度小于50个核苷酸,例如长度为12-30个核苷酸。可基于本领域技术人员已知的原理设计用于pcr的引物的长度和序列,参见例如innis等(同上)。
术语“核酸”和“多核苷酸”在本文中可互换使用以表示脱氧核糖核苷酸或核糖核苷酸及其单链或双链形式的聚合物。该术语包括含有已知核苷酸类似物或修饰的主链残基或连接的核酸,其是合成的、天然产生的和非天然产生的,其与参比核酸具有相似结合性质,且以与参比核苷酸相似的方式代谢。这种类似物的示例包括但不限于:硫代磷酸(酯)、氨基磷酸(酯)、甲基膦酸(酯)、手性甲基膦酸(酯)、2-o-甲基核糖核苷酸和肽核酸(pna)。
术语“杂合rna”是指与一个或多个接头或衔接子序列连接(ligate)的rna分子。
术语“接头”和“衔接子”是指与其他dna或rna序列连接(attach)的核苷酸序列。接头或衔接子可以是单链或双链的。接头或衔接子可包含单链和双链区。接头或衔接子可包含rna核苷酸。接头或衔接子可包含dna核苷酸。接头或衔接子可同时包含rna和dna核苷酸。接头或衔接子可包含非天然存在的核苷酸。
当在本文中参考衔接子、接头、识别位点、切割位点、结合位点、引物或其他元件使用时,术语“第一”和“第二”仅是为了更清楚地区分这两个元件而不是为了表示顺序。
本文中使用术语“约”和“近似等于”修饰数值并表示在围绕该值所限定的范围。如果"x"是值,那么"约x"或"近似等于x"通常表示0.90x至1.10x的值。任何提及“约x”至少表示值x、0.90x、0.91x、0.92x、0.93x、0.94x、0.95x、0.96x、0.97x、0.98x、0.99x、1.01x、1.02x、1.03x、1.04x、1.05x、1.06x、1.07x、1.08x、1.09x和1.10x。因此,“约x”也意在公开例如"0.98x"。当将“约”用于数值范围的开始时,其适用于范围的两端。因此,“约6至8.5”等同于“约6至约8.5”。当“约”用于一组值的第一个值时,其用于该集合中的所有值。因此,“约7、9、或11%”等同于“约7%、约9%、或约11%”。
具体实施方式
ii.绪论
发明人已经发现了用于富集具有一定所需大小范围的多核苷酸的方法、材料和试剂盒,通过使用在距识别序列一定距离处切割的限制酶(例如,iis型和iii型限制酶)来实现。例如,发明人已经发现混合物中的dna分子可以各自在一对衔接子寡核苷酸之间连接,其中一个衔接子具有限制酶的识别序列,而另一个衔接子具有不能切割的非天然存在的核苷酸区域。如果在衔接子对之间连接的原始dna分子具有在某个所需范围内的大小,那么限制酶将靶向非天然核苷酸区域内的切割位点。在这种情况下,酶将不能在切割位点切割,并且构建体将保持完整。另一方面,如果原始dna分子长于或短于所需的大小范围,那么限制酶将靶向非天然存在的核苷酸区域之外的切割位点。在这种情况下,酶将能够在切割位点被切割,并且构建体将被消化成两个片段。通过随后从整个构建体群中富集完整构建体的亚群,可以产生富集有具有特定所需大小范围的多核苷酸的混合物。
图1示出了一个实施方式作为描述性示例。显示的是dna构建体多核苷酸101,其包含dna序列102,第一衔接子寡核苷酸103和第二衔接子寡核苷酸104。第二衔接子寡核苷酸104包含用于限制酶的识别位点105,所述限制酶在与识别位点相距距离107的切割位点106处切割dna。切割位点不是由特定的核苷酸序列决定,而是确定为与酶识别序列具有特定距离。第一衔接子寡核苷酸103包含不能被限制酶切割的连续非天然存在的核苷酸区域108。如果多核苷酸101内的dna序列102的长度使得切割位点106在非天然存在的核苷酸的区域108内,则当与限制酶接触时多核苷酸不会被切割。
由于限制酶的切割距离107是通过选择限制酶而确定的固定长度或长度范围,切割位点106相对于阻断区域108的位置将取决于多核苷酸101的几种性质。这些包括区域108内的连续非天然存在的核苷酸的数量,第一衔接子寡核苷酸103内的区域108的位置,第二衔接子寡核苷酸104内的限制酶识别位点105的位置,以及dna序列102的长度。如果第一和第二衔接子寡核苷酸的序列保持恒定并且允许dna序列102变化,那么将是dna序列的长度以及该长度是否在目标长度范围内来决定切割位点106是否位于非天然存在的核苷酸的区域108中。
图2说明了替代性实施方式,其中切割不被阻断,因为dna序列长于目标长度范围。显示的是多核苷酸201,其包含dna序列202,第一衔接子寡核苷酸203和第二衔接子寡核苷酸204。在该示例中,限制酶的切割位点205不在非天然存在的核苷酸的区域206内。结果,当多核苷酸201与限制酶接触时,可发生切割。在图2所示的实施方式中,切割位点205在dna序列202内。如果切割位点205位于阻断区206与第一衔接子寡核苷酸203和dna序列202的接合207之间的位置处的第一衔接子寡核苷酸203内,也会发生切割。
图3说明了替代性实施方式,其中切割不被阻断,因为dna序列短于目标长度范围。显示的是多核苷酸301,其包含dna序列302,第一衔接子寡核苷酸303和第二衔接子寡核苷酸304。在该实施例中,限制酶的切割位点305在第一衔接子寡核苷酸303内,但不在非天然存在的核苷酸的区域306内。如上所述,切割位点如果不是由序列确定,则是与识别序列的距离(核苷酸的数量)的函数。结果,当多核苷酸301与限制酶接触时,可发生切割。
ii.方法
提供了富集包含一定长度的dna序列的多核苷酸的方法。在一些实施方式中,提供了多核苷酸群,其中所述多核苷酸各自包含dna序列,包含多个连续的非天然存在的核苷酸的第一衔接子寡核苷酸,和包含iis型或iii型限制酶的识别位点的第二衔接子寡核苷酸。第一和第二衔接子寡核苷酸可以连接(例如,通过连接或扩增引入)到dna序列的相对末端,如果dna序列的长度在目标长度范围内(不比之长或短),则连续的非天然存在的核苷酸的数量足以阻止iis型或iii型限制酶的切割。在足以形成切割的多核苷酸和完整多核苷酸的混合物的反应条件下,使多核苷酸群与iis型或iii型限制酶接触。例如,如果插入第一和第二衔接子寡核苷酸之间的dna更长或更短(例如,分别如图2和3中所示),则多核苷酸将被切割。如果衔接子寡核苷酸之间的dna序列具有合适的长度,则限制酶将不能切割多核苷酸,因为非天然存在的连续核苷酸将被定位以阻断切割。随后,从混合物中富集完整多核苷酸的亚群。在一些实施方式中,富集包括使用位于多核苷酸末端或附近的引物对扩增混合物中的多核苷酸(例如,设计为适当地与第一和第二衔接子寡核苷酸或其互补物杂交),使得完整的多核苷酸被扩增但被切割的多核苷酸不被扩增。这将导致完整多核苷酸相对切割的多核苷酸的富集。
dna序列可以是dna序列的较大群、混合物或文库中的一个序列。在一些实施方式中,各种dna序列是cdna分子的混合物。在一些实施方式中,dna序列是基因组dna片段的混合物。
在一些实施方式中,第一和第二衔接子寡核苷酸附着于dna序列的相对末端。在一些实施方式中,衔接子通过引物延伸(例如,扩增)而连接。在一些实施方式中,衔接子通过连接反应(ligation)连接。衔接子可含有聚合酶链反应(pgr)引物结合位点,测序引物结合位点,条码序列或可用于扩增、定量或鉴定多核苷酸构建体的其他序列。
第一衔接子寡核苷酸内的连续非天然存在的核苷酸的数量可以是,例如,1至20、1至10、5至14、8至17、11至20、1至7、5至10、8至13、11至16、15至20,或超过20。在一些实施方式中,非天然存在的核苷酸位于第一衔接子寡核苷酸和dna序列的接合处附近。在一些实施方式中,第一衔接子寡核苷酸在接合和连续的非天然存在的寡核苷酸之间含有一个或多个其他核苷酸。
基于它们降低(或阻断)iis型或iii型限制酶的切割效率的能力来选择连续的非天然存在的核苷酸。以这种方式,这些核苷酸类似物保护多核苷酸构建体免于酶促消化。在一些实施方式中,非天然存在的核苷酸包含2’-o-甲基碱基。在一些实施方式中,非天然存在的核苷酸包含2’-氟碱基。在一些实施方式中,非天然存在的核苷酸包含硫代磷酸化的碱基。硫代磷酸化的碱基之间的核苷酸间键的磷原子的手性可以影响非天然存在的核苷酸对多核苷酸的保护程度。该连接的sp立体异构体提供比rp立体异构体显著更多的切割抑制。因为硫代磷酸化的碱基的区域可以包含相同数量的每个连接的手性,所以在阻断区域中存在6个或更多个连续碱基可以提高该区域的整体阻断效率。
可以基于在与限制酶的识别位点分开的切割位点切割多核苷酸的能力来选择iis型或iii型限制酶。限制酶可以切割双链dna以产生钝端,5'突出端或3'突出端。识别位点和切割位点之间的距离可为小于5个碱基对,5至10个碱基对,10至15个碱基对,15至20个碱基对,20至25个碱基对,25至30个碱基对,5至15个碱基对,10至20个碱基对,15至25个碱基对,20至30个碱基对,5至20个碱基对,15至30个碱基对,或超过30个碱基对。在一些实施方式中,限制酶识别位点位于第二衔接子寡核苷酸和dna序列的接合处附近。在一些实施方式中,第二衔接子寡核苷酸在接合和限制酶识别位点之间含有一个或多个其他核苷酸。
在一些实施方式中,限制酶可以是ecop1si。ecop1s1的识别位点在两条互补dna链之一上具有核苷酸序列5'-cagcag。用ecop15i切割通常在5'至3'方向上与识别位点相距25个碱基对,并且在互补dna链上与识别位点相距27个碱基对。用ecop15i切割产生5'-nn突出端。在一些实施方式中,ecop15i在5'至3'方向上以距离识别位点24、25、26、27或28个碱基对的距离切割dna。
在一些实施方式中,第一和第二衔接子序列都包含限制酶识别位点。在一些实施方式中,两个识别位点以头对头方向位于相对的衔接子序列上。在一些实施方式中,识别位点被ecop15i识别。ecop1si的切割效率可以通过存在第二个反向取向的ecop15i识别位点来改善。(参见,例如,
图4示出了实施方式,其中第一和第二衔接子序列都具有头对头构型的ecop15i识别位点。显示的是dna构建体多核苷酸401,其包含dna序列402,第一衔接子寡核苷酸403和第二衔接子寡核苷酸404。第一衔接子寡核苷酸403包含第一ecop15i识别位点405,其对应于第一切割位点406,第一切割位点406是来自第一ecop15i识别位点的24-28个碱基对。在图4所示的实施方式中,第一衔接子寡核苷酸403还包含不能被ecop15i切割的连续非天然存在的核苷酸的区域407。第二衔接子寡核苷酸404包含第二ecop15i识别位点408,其对应于第二切割位点409,第二切割位点409是来自第二ecop15i识别位点的24-28个碱基对。切割位点不是由特定的核苷酸序列决定,而是确定为各自是限制酶识别序列之一的3'方向上的特定距离。
在图4所示的实施方式中,非天然存在的核苷酸的区域407将防止从与第一衔接子序列403上的第一识别位点405结合的第一ecop15i酶起始的切割。第一切割位点406处的这种阻断将独立于连接至第一403和第二404衔接子寡核苷酸的插入dna序列402的长度而发生。第一ecop15i酶仍然可以影响与第二识别位点408结合的第二ecop15i酶的切割效率。如上所述,该第二ecop15i酶切割多核苷酸构建体的能力将部分取决于插入dna序列402的长度。在图4所示的实施方式中,dna序列402具有足够长的长度,使得第二切割位点409不在阻断区域407内,并且可以发生多核苷酸构建体401的切割。
如果插入dna序列在目标长度范围内,可以配置多核苷酸使得切割被阻断,如图1的实例中所示。在这种情况下,切割位点位于连续的非天然存在的核苷酸区域内。目标长度范围可以是,例如,7至22个碱基对,14至29个碱基对,21至36个碱基对,7至17个碱基对,10至20个碱基对,13至23个碱基对,16至26个碱基对,19至29个碱基对,22至32个碱基对,26至36个碱基对,7至12个碱基对,10至15个碱基对,13至18个碱基对,16至21个碱基对,19至24个碱基对,22至27个碱基对,25至30个碱基对,18至33个碱基对,或31至36个碱基对。在一些实施方式中,目标长度范围为19至24个碱基对。
在一个实施方式中,第一衔接子寡核苷酸包含6个连续的硫代磷酸化碱基的区域,其位于第一衔接子寡核苷酸和dna序列的接合的3'处和附近。在该实施方式中,第二衔接子寡核苷酸包含与第二衔接子寡核苷酸和dna序列的接合相邻的ecop15i识别序列。因为ecop15i限制酶通常在距离识别位点3'方向的25个碱基对的距离处切割dna,所以如果插入的dna序列具有在19到24个碱基对的目标范围内的长度,则该多核苷酸构建体被配置为阻断ecop15i的切割。在19个碱基对dna序列的情况下,多核苷酸的阻断区将包含位于距限制酶识别位点(包括ecop15i切割位点)20至25个碱基对的硫代磷酸化碱基。在24个碱基对dna序列的情况下,多核苷酸的阻断区域将包含位于距限制酶识别位点(包括ecop15i切割位点)25至30个碱基对的硫代磷酸化碱基。在dna序列长度小于目标长度范围的19个碱基对最小值的情况下,距离限制酶识别位点最远的阻断区域的末端距离识别位点少于25个碱基对,并且ecop15i切割不会被阻断。在dna序列大于目标最大值的24个碱基对的情况下,最接近限制酶识别位点的阻断区域的末端将距离识别位点大于25个碱基对,并且ecop15i将不被阻断。
如果上述实施例的6个连续的硫代磷酸化碱基的区域位于互补链上,并且该区域是距离接合的2个碱基对,则可以看到类似的结果。这是因为ecop15i限制酶通常在距离互补链上的识别位点3'方向的27个碱基对的距离处切割dna。如果插入的dna序列的长度在19至24个碱基对的目标范围内,则该多核苷酸构建体将被配置为阻断ecop15i的切割。在19碱基对dna序列的情况下,多核苷酸的阻断区域将包含位于距限制酶识别位点(包括ecop15i切割位点)22至27个碱基对的硫代磷酸化碱基。在24个碱基对dna序列的情况下,多核苷酸的阻断区域将包含位于距限制酶识别位点(包括ecop15i切割位点)27至32个碱基对的硫代磷酸化碱基。在dna序列长度小于目标长度范围的19个碱基对最小值的情况下,距离限制酶识别位点最远的阻断区域的末端距离识别位点少于27个碱基对,并且ecop15i切割不会被阻断。在dna序列大于目标最大值的24个碱基对的情况下,最接近限制酶识别位点的阻断区域的末端将距离识别位点大于27个碱基对,并且ecop15i将不被阻断。
在一些实施方式中,多核苷酸构建体包含如上所述的一个限制酶识别位点。在一些实施方式中,多核苷酸构建体可包含两个或更多个限制酶识别位点。多个识别位点可位于第一和第二衔接子寡核苷酸中的一个或两个上。多个识别位点可以具有相同或不同的序列,并且可以由一种或多种iis或iii型限制酶识别。在一些实施方式中,位于第一或第二衔接子寡核苷酸之一上的两个或更多个识别位点可以由iis型或iii型限制酶识别,其可以在位于相对的衔接子寡核苷酸上的两个或更多个切割位点处切割多核苷酸。在一些实施方式中,位于第一衔接子寡核苷酸上的一个或多个识别位点可以被iis型或iii型限制酶识别,所述限制酶可以在位于第二衔接子寡核苷酸上的一个或多个切割位点切割多核苷酸,并且位于第二衔接子寡核苷酸上的一个或多个识别位点可以被iis型或iii型限制酶识别,其可以在位于第一衔接子寡核苷酸上的一个或多个切割位点切割多核苷酸。
在包含两个或更多个限制酶识别位点的一些实施方式中,多核苷酸构建体可以进一步包含两个或更多个连续的非天然存在的核苷酸区域。如果多核苷酸与识别两个或更多个限制酶识别位点的iis型或iii型限制酶接触,则这些阻断区域可以配置成具有足以阻断多核苷酸切割的长度和位置。多核苷酸构建体还可以包含一个或多个连续的非天然存在的核苷酸区域,其被配置为具有足以用于单个阻断区域的长度和位置,以防止与多核苷酸接触的两种或更多种iis或iii型限制酶的切割。
第一和第二衔接子寡核苷酸中的一个或两个可以进一步包含一个或多个引物结合位点。引物结合位点可以位于第一或第二衔接子寡核苷酸之一上,或者它们可以位于第一和第二衔接子寡核苷酸上。在一些情况下,如果引物或引物部分包含一起与引物结合位点序列互补的至少6、8、10、12、14、16或18个连续的寡核苷酸,则引物或其部分可与引物结合位点结合或杂交。连续寡核苷酸还可以包含与一个以上核苷酸伴侣互补的“通用”核苷酸。或者,如果在至少12、14、16或18个连续的互补核苷酸中有不到1或2个互补错配,引物或其部分能杂交至引物结合位点。
在一些情况下,引物结合位点是pcr引物结合位点。在一些实施方式中,第一寡核苷酸衔接子包含正向pcr引物结合位点,第二寡核苷酸衔接子包含反向pcr引物结合位点。在一些实施方式中,第一寡核苷酸衔接子包含反向pcr结合位点,第二寡核苷酸衔接子包含正向pcr引物位点。pcr引物结合位点可以配置成能够在足以进行pcr扩增反应的条件下产生各自包含插入dna序列的dna扩增产物分子,所述pcr扩增反应包括与正向和反向pcr引物结合位点杂交的pcr引物。
图5说明了一个实施方式,其中插入dna序列的长度在目标长度范围内,限制酶切割被阻断,并且可以发生dna序列的扩增。图中显示的是双链多核苷酸501,其包含dna序列502,双链第一衔接子寡核苷酸503和双链第二衔接子寡核苷酸504。第一衔接子寡核苷酸包含连续的非天然存在的核苷酸的区域505和第一pcr引物结合位点506。第二衔接子寡核苷酸504包含iis型或iii型限制酶的识别位点507和第二pcr引物结合位点508。因为dna序列502具有在目标长度范围内的长度,所以识别限制性位点507的限制酶的切割位点509在阻断区域505内。结果,如果在消化步骤510中使多核苷酸501与限制酶接触,则不会发生多核苷酸的消化。随后的变性步骤511可以分离多核苷酸的两条链512和513。在退火步骤514中,第一pcr引物515可以与第一pcr引物结合位点杂交,第二pcr引物516可以与第二pcr引物结合位点杂交。然后可以使用延伸步骤517来产生新的互补dna链518和519。然后这些新的互补dna链518和519可以退火以形成原始dna序列501的新拷贝。鉴于该延伸,发生完整多核苷酸的扩增,导致与混合物中的其他多核苷酸(例如,下文讨论的那些)相比富集该完整多核苷酸,所述其他多核苷酸被切割并因此不被扩增至相同程度。
图6说明了一个实施方式,其中插入dna序列的长度在目标长度范围外,限制酶切割未被阻断,并且无法发生dna序列的扩增。图中显示的是双链多核苷酸601,其包含dna序列602,双链第一衔接子寡核苷酸603和双链第二衔接子寡核苷酸604。第一衔接子寡核苷酸包含连续的非天然存在的核苷酸的区域605和第一pcr引物结合位点606。第二衔接子寡核苷酸604包含iis型或iii型限制酶的识别位点607和第二pcr引物结合位点608。因为dna序列602具有在目标长度范围外的长度,所以识别限制性位点607的限制酶的切割位点609在阻断区域605外。因此,如果在消化步骤610中使多核苷酸601与限制酶接触,则酶将多核苷酸消化成两个双链dna片段611和612。随后的变性步骤613可以将片段611和612中的每一个分成两链,产生四个链614、615、616和617。在退火步骤618中,第一pcr引物619可以与第一pcr引物结合位点杂交,第二pcr引物620可以与第二pcr引物结合位点杂交。然后可以使用延伸步骤621来产生新的dna链622和623。因为这些新dna链622和623彼此不互补,并且两者都不包含与原始dna序列602的整个长度相同的区域,所以它们不能退火形成原始dna序列的新拷贝。因此,不可能成功扩增切割的多核苷酸。虽然图5和6分开描述,但多核苷酸的初始混合物可包括具有所需的和不需要的长度的多核苷酸,产生图5和6中所示多核苷酸的混合物,并如图5所示因扩增而富集多核苷酸。
第一和第二衔接子寡核苷酸中的一个或两个可以进一步包含一个或多个捕获区。捕获区可以是其反向互补序列能够捕获靶多核苷酸或多个目标多核苷酸或与靶多核苷酸或多个目标多核苷酸杂交的任何序列。在一些情况下,反向互补物的捕获区包含一个或多个肌苷、硝基吲哚或其他通用核苷酸。在一些实施方式中,捕获区包含生物素化的核苷酸。
第一和第二衔接子寡核苷酸中的一个或两个可以进一步包含一个或多个条码区,用于鉴定含有一个或多个衔接子的多核苷酸。条码区可各含有至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34或35个条码核苷酸。例如,20个核苷酸的条码区可用于唯一地鉴定420个多核苷酸。在一些情况下,条码区域可各自含有5至25个条码核苷酸,8至20个条码核苷酸,或10至14个条码核苷酸。
除了含有与第一和第二pcr引物结合位点互补的序列外,pcr引物中的一个或两个还可含有一个或多个序列,其起到其他结合位点、捕获区、捕获区或条码区的作用。pcr引物或衔接子寡核苷酸可以进一步含有任何需要的下游应用所需的任何其他序列。这些应用的非限制性实例包括rna测序(rna-seq),实时pcr或定量pcr(qpcr),微阵列或生物标记物检测。
在一些实施方式中,插入dna序列是由rna分子的逆转录产生的cdna。在一些实施方式中,dna是由rna分子的混合物产生的cdna。rna分子的混合物可以是单一类型的rna分子,或两种或多种类型的rna分子。rna分子可以是编码rna或非编码rna。rna分子可以是例如信使rna(mrna),核糖体rna(rrna),信号识别颗粒rna(srprna),转移rna(trna),转移信使rna(tmrna),引导rna(grna),smyrna,小cajal体特异性rna(scarna),核糖核酸酶p(rnasep),核糖核酸酶mrp(rnasemrp),yrna,端粒酶rna组分(terc),剪接前导rna(slrna),反义rna(arna),顺式-天然反义转录物(顺式-nat),crisprrna(crrna)和小干扰rna(sirna)。rna分子可以是任何一种或多种类型的rna的片段。
rna分子可以是小的非编码rna分子,包括但不限于mirna,snrna,snorna,pirna或incrna。微小rna(mirna),一般长度为18或19至25nt,是非蛋白质编码rna,其可抑制靶mrna的翻译(参见,例如,croce和calin,cell122(1):6-7(2005))。其他小rna包括小核质rna(snrna)和小核仁rna(snorna)。这些小rna可在例如,mrna剪接(u1,u2,和u4至u6snrna)、mrna和rrna加工(u7snrna;u3和u8snorna)、和通过2'羟基(盒c/dsnorna)甲基化或通过假尿苷形成(盒h/acasnorna)的rna修饰的位点选择中发挥功能。通过联合哺乳动物中piwi蛋白质来鉴定piwi-相互作用rna(pirna)。pirna的长度范围可以是26-30个核苷酸。也描述了长非编码rna(lncrna)。
还提供了由rna分子混合物的逆转录形成dna序列群的方法。在一些实施方式中,提供了包含rna分子群的样品,其中rna分子具有rna5'末端和rna3'末端。在一些实施方式中,包含第一接头寡核苷酸序列和第一接头寡核苷酸3'末端的第一接头寡核苷酸连接至rna分子的rna3'末端,并且第二接头寡核苷酸连接至rna分子的rna5'末端,从而形成杂合rna分子。随后,通过使用杂合rna作为模板以模板依赖性方式延伸第一逆转录引物,可以从杂合rna分子形成第一链cdna分子。cdna分子包含第一链cdna序列和第一链cdna3'末端,并且第一逆转录引物配置成在第一接头寡核苷酸3'末端附近退火至第一接头寡核苷酸。然后通过使用第一链cdna作为模板以模板依赖性方式延伸第二逆转录引物,从第一链cdna分子形成第二链cdna分子,从而形成包含第一链cdna序列和第二链cdna序列的双链cdna分子。第二逆转录引物可配置成在第一链cdna3'末端附近退火至第一链cdna序列。此外,(a)第一接头寡核苷酸可包含iis型或iii型限制酶的识别序列,并且第二逆转录引物可包含许多连续的非天然存在的核苷酸,或(b)第二接头寡核苷酸可包含iis型或iii型限制酶的识别序列,并且第一逆转录引物可包含许多连续的非天然存在的核苷酸。如果双链cdna分子由长度在目标长度范围内的rna分子形成,则掺入第一或第二逆转录引物中的连续非天然存在的核苷酸的数量可足以阻断iii型或iis型限制酶的切割,但如果双链cdna分子由长度小于目标长度范围最小值或大于目标长度范围最大值的rna分子形成,则不阻断iii型或iis型限制酶的切割。
第一接头或衔接子寡核苷酸与rna分子的连接可以在连接反应中形成。在一些实施方式中,连接反应由rna连接酶2酶的活性催化。rna连接酶2可以是t4rna连接酶2。在需要atp作为辅因子的反应中,t4rna连接酶2在第一接头的5'-磷酸末端和rna分子的3'-羟基末端之间催化形成磷酸二酯键。
在一些实施方式中,第一接头寡核苷酸与dna序列的连接由t4rna连接酶2,缺失突变体催化。该酶也称为t4rna连接酶2,截短的或rnl2(1-249),并含有全长t4rna连接酶2的前249个氨基酸。在这些实施方式中,第一接头的5'末端被预腺苷酸化,并且第一接头的3'末端在连接反应之前被例如-nh3基团封闭。连接反应不需要atp作为辅因子。因为缺失突变体不能使底物的5'末端腺苷酸化,只有那些在其5'末端已被预腺苷酸化的接头可以连接到rna序列的3'-羟基末端。这导致背景连接的减少。t4rna连接酶2,缺失突变体已被用于优化的接头连接,用于克隆mirna用于rna-seq文库构建。
第二接头或衔接子寡核苷酸与rna分子的5'末端的连接可以在连接反应中形成。在一些实施方式中,连接反应由rna连接酶1酶的活性催化。rna连接酶1可以是t4rna连接酶1。在需要atp作为辅因子的反应中,t4rna连接酶1在rna分子的5'-磷酸末端和第二接头的3'-羟基末端之间催化形成磷酸二酯键。
图7说明了实施方式,其中dna序列由rna分子转录的逆转录形成。显示的是具有5'末端702和3'末端703的rna序列701。包含iis型或iii型限制酶的识别序列705的第一接头寡核苷酸704在第一连接步骤706中与rna序列701的3'末端703连接。然后在第二连接步骤708中将第二接头寡核苷酸707连接至rna序列701的5'末端702。或者,第二接头寡核苷酸707可以在第一衔接子寡核苷酸704连接之前连接至rna序列701。在任何一种情况下,结果是形成具有以下结构的杂合rna分子709:
5’-第二接头寡核苷酸-rna分子-第一接头寡核苷酸-3'
然后,通过将第一逆转录引物712在其3'末端附近退火至杂合rna709,然后使用杂合rna分子作为引导物以模板依赖性方式延伸引物,在第一链cdna合成步骤710中形成第一链cdna711。随后,通过将第二逆转录引物715在其3'末端附近退火至与第一链cdna711,然后使用第一链cdna作为引导物以模板依赖性方式延伸引物,在第二链cdna合成步骤714中形成第二链cdna713。第二逆转录引物715可包含连续的非天然存在的核苷酸的区域716。以这种方式,两条cdna链组合形成多核苷酸构建体,其包含(a)从原始rna序列逆转录的dna序列,(b)许多连续的非天然存在的核苷酸,和(c)iis型或iii型限制酶的识别位点。非天然存在的核苷酸区域位于dna序列的相对侧,而不是限制酶识别位点,并且如果原始rna序列的长度在目标长度范围内,则该区域中非天然存在的核苷酸的数量和位置阻断限制酶的切割。
图8说明了替代实施方式,其中dna序列由rna分子转录的逆转录形成。显示的是具有5'末端802和3'末端803的rna序列801。第一接头寡核苷酸804在第一连接步骤706中与rna序列801的3'末端803连接。然后,包含iis型或iii型限制酶的识别序列807的第二接头寡核苷酸806在第二连接步骤808中与rna序列801的5'末端802连接。或者,第二接头寡核苷酸806可以在第一衔接子寡核苷酸804连接之前连接至rna序列801。在任何一种情况下,结果是形成具有以下结构的杂合rna分子809:
5’-第二接头寡核苷酸-rna分子-第一接头寡核苷酸-3'
然后,通过将第一逆转录引物812在其3'末端附近退火至杂合rna809,然后使用杂合rna分子作为引导物以模板依赖性方式延伸引物,在第一链cdna合成步骤810中形成第一链cdna811。第一逆转录引物812可包含连续的非天然存在的核苷酸的区域813。随后,通过将第二逆转录引物816在其3'末端附近退火至与第一链cdna811,然后使用第一链cdna作为引导物以模板依赖性方式延伸引物,在第二链cdna合成步骤815中形成第二链cdna814。以这种方式,两条cdna链组合形成多核苷酸构建体,其包含(a)从原始rna序列逆转录的dna序列,(b)多个连续的非天然存在的核苷酸,和(c)iis型或iii型限制酶的识别位点。非天然存在的核苷酸区域位于dna序列的相对侧,而不是限制酶识别位点,并且如果原始rna序列的长度在目标长度范围内,则该区域中非天然存在的核苷酸的数量和位置阻断限制酶的切割。
可以使用多种逆转录酶中的任何一种将rna分子逆转录成第一链cdna。示例性的逆转录酶包括但不限于鼠白血病病毒(mlv)逆转录酶、禽类成髓细胞血症病毒(amv)逆转录酶、呼吸道合胞病毒(rsv)逆转录酶、犬感染性贫血病毒(eiav)逆转录酶、劳氏-相关病毒-2(rav2)逆转录酶、superscriptii逆转录酶、superscripti逆转录酶、thermoscript逆转录酶和mmlvrna酶h-逆转录酶。在其他实施方式中,可使用具有rna聚合酶功能的dna聚合酶。例如,在锰存在下,dna聚合酶tth和z05可具有逆转录酶的功能。逆转录酶的浓度可变化并且可凭经验并取决于使用的特定逆转录酶确定最优浓度。
在一些实施方式中,第二接头衔接子通过模板转换方法连接。(参见,例如,美国专利号5,962,271)。在该方法中,将第一cdna合成引物在rna分子3'末端附近退火至rna分子。使用rna分子作为模板,以模板依赖性方式延伸第一合成引物。当催化引物延伸的逆转录酶到达rna分子的5'末端时,酶切换模板使得衔接子寡核苷酸用作延伸模板。在一些实施方式中,该衔接子寡核苷酸包含连续的非天然存在的核苷酸区域。在一些实施方式中,衔接子寡核苷酸包含iis型或iii型限制酶的识别序列。
图9说明了用于从混合的rna分子群中富集mirna分子的实施方式。图9中的上部多核苷酸显示了作为5'衔接子和3'衔接子之间的dna插入物的序列来源的mirna分子的实例。图9中的下部多核苷酸显示了作为5'衔接子和3'衔接子之间的dna插入物的序列来源的非mirna分子的实例。3'衔接子含有ecop15i结合位点,3'衔接子含有修饰碱基,该修饰碱基能够阻止由mirna分子构建的克隆通过ecop15i限制酶的作用被切割。在用长度为19-24个核苷酸的mirna构建的上部多核苷酸的情况下,多核苷酸不被切割。然后,可以使用识别5'衔接子的一部分的pcr正向引物和识别3'衔接子的一部分的pcr反向引物,通过pcr扩增该完整多核苷酸。在由长度大于25个核苷酸或小于19个核苷酸的非mirna构建的下部多核苷酸的情况下,多核苷酸可被切割。然后,该经切割的多核苷酸不能通过使用pcr正向和反向引物的pcr进行扩增,因为5'衔接子和3'衔接子将不再是相同分子的一部分。然后切割和扩增的结果将是就衍生自mirna分子的那些成员而富集的多核苷酸群。
在完整多核苷酸已经从完整和切割的多核苷酸的混合物中富集后,富集的群可以用于本领域普通技术人员熟悉的一个或多个下游过程。作为非限制性实例,可以对富集的群进行微阵列杂交,rna-seq或下一代测序,qpcr或实时pcr,文库构建,消减杂交,扩增,或产生测定探针。
多核苷酸可以存在于多个多核苷酸的文库、混合物或群中。在一些实施方式中,所述多核苷酸各自包含已克隆到衔接子中的cdna分子群之一。cdna分子可以从混合的rna群的逆转录产生。在一些实施方式中,rna、cdna或多核苷酸的混合群在群成员之间具有至少10,至少100,至少500,至少1000,至少2000,至少3000,至少4000,至少5000,至少6000,至少7000,至少8000,至少9000,至少10,000,或超过10,000个不同的序列。
rna混合物可以是衍生自一种或多种生物体的样品。样品可以来自单个细胞。样品可以来自两个或更多个细胞。细胞可以是相同或不同的物种。rna样品可以来自细菌来源。rna样品可以来自病毒来源。rna样品可来自哺乳动物来源。
iii.试剂盒
还提供了用于富集来自样品的短多核苷酸序列的试剂盒。试剂盒可含有本文他处所述的任何试剂的组合。在一些实施方式中,试剂盒包含iis型或iii型限制酶和第一衔接子寡核苷酸。第一衔接子寡核苷酸可包含多个连续的非天然存在的核苷酸。第一衔接子寡核苷酸可包含至少一个核糖核苷酸。非天然存在的核苷酸的数量可以是,例如,2至20、2至11、5至14、8至17、11至20、2至7、5至10、8至13、11至16、15至20,或超过20。在一些实施方式中,非天然存在的核苷酸是硫代磷酸化的碱基。在一些实施方式中,iis型或iii型限制酶是ecop15i。
试剂盒可以进一步包含rna连接酶。rna连接酶可以是rna连接酶2。在一些实施方式中,rna连接酶是t4rna连接酶2,缺失突变体或t4rna连接酶2,截短的。该试剂盒可进一步包含rna酶抑制剂。试剂盒可进一步包含连接反应缓冲液。缓冲液可含有一种或多种缓冲组分和盐。在一些实施方式中,缓冲组分是tris-hcl。在一些实施方式中,盐是kcl和mgcl2。
在一些实施方式中,试剂盒包含第二衔接子寡核苷酸。第二衔接子寡核苷酸可包含iis型或iii型限制酶的识别序列。在一些实施方式中,iis型或iii型限制酶是ecop15i。试剂盒可以进一步包含第二rna连接酶。在一些实施方式中,第二rna连接酶是t4rna连接酶1。试剂盒可进一步包含atp。
在一些实施方式中,该试剂盒还包含第一逆转录引物。试剂盒可进一步包含第二逆转录引物。第一或第二逆转录引物之一可以包含非天然存在的核苷酸区域,或者与第一或第二衔接子寡核苷酸上的非天然存在的核苷酸区域互补。试剂盒可进一步包含逆转录酶。试剂盒可进一步包含iis型或iii型限制酶。在一些实施方式中,iis型或iii型限制酶是ecop15i。
在一些实施方式中,试剂盒还包含正向pcr引物和反向pcr引物。正向和反向pcr引物可以配置成选择性地退火至第一和第二衔接子寡核苷酸的pcr引物结合序列或与第一和第二衔接子寡核苷酸互补的pcr引物结合序列,或第一和第二逆转录引物的pcr引物结合序列或与第一和第二逆转录引物互补的pcr引物结合序列。试剂盒可进一步包含热稳定dna聚合酶。在一些实施方式中,dna聚合酶是taqdna聚合酶或iprooddna聚合酶。试剂盒可以进一步包含dntp和pcr反应缓冲液的混合物。
iv.实施例
提供以下实施例是为了更好地使本领域普通技术人员能够制备和使用所公开的组合物和方法,并且不旨在以任何方式限制本发明的范围。
图10显示了用iii型限制酶ecop15i消化不同多核苷酸群的结果。如上所述产生一些群,具有单个ecop15i识别位点。产生一些群,具有两个ecop15i识别位点。从图10中所示的数据可知,当暴露于限制酶时,具有两个ecop15i识别位点的多核苷酸群具有比具有单个识别位点的多核苷酸群大得多的切割百分比。这些结果证明了通过在多核苷酸内包括第二ecop15i识别位点可以实现改善的切割效率。
一些多核苷酸群包括ecop15i切割位点中的非天然存在的硫代磷酸化碱基。一些多核苷酸不包括硫代磷酸化的碱基。从图10中所示的数据可知,在暴露于限制酶时,在切割位点中包含两个ecop15i识别位点和硫代磷酸化碱基的多核苷酸群具有比具有两个ecop15i识别位点且没有硫代磷酸化碱基的多核苷酸群更小的切割百分比。这些结果证明了非天然存在的硫代磷酸化的碱基至少部分阻断限制酶对多核苷酸的消化的能力。
使用长度在所需目标范围内的mirna序列如上所述产生一些多核苷酸群。使用长度大于或小于所需目标范围的序列如上所述产生一些多核苷酸群。从图10中所示的数据可知,对于在切割位点具有两个ecop15i识别位点和硫代磷酸化碱基的多核苷酸群,硫代磷酸化碱基至少部分阻断ecop15i消化的能力在使用mirna序列产生的群中比使用非mirna序列产生的群中更大。这些结果证明了所提供的方法区分序列插入物大小和优先富集具有目标序列长度的群的能力。
应理解,本文所述的实施例和实施方式仅用于说明目的,本领域技术人员应了解据此作出的各种修饰或改变,且它们包括在本申请的主旨和权益以及所附权利要求书的范围内。本文引用的所有出版物、专利、专利申请、网站和数据库通过引用全文纳入本文以用于所有目的。
- 还没有人留言评论。精彩留言会获得点赞!