SLAM多核苷酸和多肽以及其用途的制作方法
本申请要求2016年2月10日提交的美国临时专利申请号62/293,491的权益。美国临时专利申请62/293,491的全部内容以引用的方式整体并入本文。
本公开涉及称为表面脂蛋白组装调节剂多肽或slam多肽的一类多肽,和编码slam多肽的多核苷酸,以及其底物表面脂蛋白(slp)。slam多肽可从革兰氏阴性细菌种获得。slam多肽和多核苷酸可用于预防和治疗由致病性细菌种引起的感染性疾病,所述致病性细菌种包括例如属于奈瑟氏菌属的细菌种。
背景技术:
以下段落旨在向读者介绍随后的更详细描述,而不是限定或限制本公开所要求保护的主题。
致病性细菌种(包括属于奈瑟氏菌属的细菌种)是大规模流行病的致病因子。因此,例如脑膜炎是由脑膜炎奈瑟氏菌引起的并且淋病是由淋病奈瑟氏菌引起的。世界卫生组织(who)在所谓“脑膜炎地带”的撒哈拉以南非洲14个国家报告了2009年超过88,000例疑似脑膜炎病例,其中5,300多例导致死亡(2012年11月的who情况说明书第141号)。散发性脑膜炎的爆发也发生在其他地方,包括北美洲。据估计,全球每年有超过1亿人患淋病,其中仅在美国就报告了820,000例新病例。虽然抗生素诸如氨苄青霉素、四环素和喹诺酮类药物提供治疗奈瑟氏菌感染的选择,但是对这些抗生素的耐药性越来越受到关注。已经开发出对奈瑟氏菌感染提供保护的疫苗,然而还不断存在对额外的疫苗的需要,因为取决于血清群,疫苗的功效各不相同。因此,例如,称为4cmenb的疫苗(针对脑膜炎奈瑟氏菌血清群b的一种四组分疫苗)的功效还有待确认,并且加拿大的儿科使用仅建议用于侵袭性脑膜炎球菌病风险最高的个体(robinsonjl,paediatricchildhealth,201419(2):91-94)。仍然没有可用于淋病奈瑟氏菌的疫苗。
因此,本领域需要开发针对由致病性奈瑟氏菌种和其他致病性细菌种引起的感染的进一步治疗和预防选择。
技术实现要素:
一方面,本公开涉及称为表面脂蛋白组装调节剂(slam)多肽的一类多肽。
另一方面,本公开涉及在宿主细胞,包括致病性或非致病性细菌细胞中产生slam多肽。
另一方面,本公开涉及细胞内某些靶蛋白从细胞的细胞溶质到细胞外表面区域的转运。
因此,一方面,在至少一个实施方案中,本公开提供一种实现靶蛋白从包含靶蛋白的宿主细胞的细胞溶质到细胞外表面的转运的方法,方法包括:
(a)提供嵌合多核苷酸,其包含作为可操作连接的组分:
(i)能够控制在宿主细胞中的表达的多核苷酸;以及
(ii)编码slam多肽的多核苷酸;以及
(b)将嵌合多核苷酸引入宿主细胞并且使宿主细胞生长以产生slam多肽,从而实现靶蛋白从宿主细胞的细胞溶质到细胞外表面的转运。
在一些实施方案中,宿主细胞是革兰氏阴性细菌细胞。
在一些实施方案中,宿主细胞是致病性细菌细胞。
在一些实施方案中,宿主细胞是选自属于以下属的细菌细胞的细胞:奈瑟氏菌属、克雷伯氏菌属、莫拉氏菌属、曼氏杆菌属、放线杆菌属、嗜血杆菌属、巴斯德氏菌属、不动杆菌属、埃希氏菌属或弧菌属。
在一些实施方案中,宿主细胞选自属于以下种的细菌细胞:脑膜炎奈瑟氏菌、淋病奈瑟氏菌、乳糖奈瑟氏菌、灰色奈瑟氏菌、反硝化克雷伯氏菌、卡他莫拉菌、溶血性曼氏杆菌、胸膜肺炎放线杆菌、睡眠嗜组织菌、流感嗜血杆菌、多杀性巴斯德氏菌、鲍氏不动杆菌、大肠杆菌或霍乱弧菌。
在一些实施方案中,slam多肽不天然存在于宿主细胞中。
在一些实施方案中,靶蛋白天然存在于宿主细胞中。
在一些实施方案中,靶蛋白不天然存在于宿主细胞中。
在一些实施方案中,靶蛋白非共价缔合到slam多肽。
在一些实施方案中,靶蛋白共价连接到slam多肽。
在一些实施方案中,靶蛋白是能够在宿主生物体中引发免疫应答的免疫原。
在一些实施方案中,靶蛋白是天然展示在致病性微生物的外表面上的免疫原性多肽或其免疫原性部分。
在一些实施方案中,靶蛋白是表面脂蛋白(slp)。
在一些实施方案中,表面脂蛋白(slp)包含选自以下的序列或由选自以下的序列组成:本文所述的偶数编号的seqidno:seqidno:696至seqidno:1082中的一个;seqidno:1094;seqidno:1100;偶数编号的seqidno:1116至seqidno:1168;以及seqidno;1178。
在一些实施方案中,表面脂蛋白选自转铁蛋白结合蛋白b(tbpb)、血红蛋白-触珠蛋白结合蛋白a(hpua)、因子h结合蛋白(fhbp)和乳铁蛋白结合蛋白(lbpb)。
在一些实施方案中,转铁蛋白结合蛋白b(tbpb)包含选自以下的序列或由选自以下的序列组成:本文所述的seqidno:806、seqidno:828、seqidno:868、seqidno:1094,以及偶数编号的seqidno:seqidno:1148至seqidno:1168中的一个;血红蛋白-触珠蛋白结合蛋白a(hpua)包含选自以下的序列或由选自以下的序列组成:本文所述的seqidno:850、seqidno:924、seqidno:932或seqidno:1110中的一个;因子h结合蛋白(fhbp)包含选自以下的序列或由选自以下的序列组成:本文所述的偶数编号的seqidno:seqidno:1116至seqidno:1136中的一个,并且乳铁蛋白结合蛋白(lbpb)包含选自以下的序列或由选自以下的序列组成:本文所述的seqidno:870或偶数编号的seqidno:seqidno:1138至seqidno:1146中的一个。
在一些实施方案中,编码slam多肽的多核苷酸包含选自以下的序列或由选自以下的序列组成:本文所述的奇数编号的seqidno:seqidno:1至seqidno:693中的一个。
在一些实施方案中,靶蛋白包含选自以下的序列或由选自以下的序列组成:偶数编号的seqidno:seqidno:696至seqidno:1082中的一个,seqidno:1094;seqidno:1100;偶数编号的seqidno:1116至seqidno:1168;以及seqidno;1178。
另一方面,在至少一个实施方案中,本公开提供一种实现靶蛋白从宿主细胞的细胞溶质到细胞外表面的转运的方法,所述方法包括:
(a)选择包含天然存在于细胞中的靶蛋白的宿主细胞;
(b)提供嵌合多核苷酸,其包含作为可操作连接的组分:
(i)能够控制在宿主细胞中的表达的多核苷酸;以及
(ii)编码slam多肽的多核苷酸;以及
(c)将嵌合核酸序列引入宿主细胞并且使宿主细胞生长以产生slam多肽,并且实现靶蛋白从细胞溶质到细胞外表面的转运。
另一方面,在至少一个实施方案中,本公开提供一种实现靶蛋白从宿主细胞的细胞溶质到细胞外表面的转运的方法,所述方法包括:
(a)提供嵌合多核苷酸,其包含作为可操作连接的组分:
(i)能够控制在宿主细胞中的表达的多核苷酸;
(ii)编码slam多肽的多核苷酸;以及
(iii)编码靶蛋白的多核苷酸;以及
(b)将嵌合核酸序列引入宿主细胞并且使宿主细胞生长以产生slam多肽,并且实现靶蛋白从细胞溶质到细胞外表面的转运。
另一方面,本公开提供一种实现靶蛋白从宿主细胞的细胞溶质到细胞外表面的转运的方法,所述方法包括:
(a)提供第一嵌合多核苷酸,其包含作为可操作连接的组分:
(i)能够控制在宿主细胞中的表达的多核苷酸;以及
(ii)编码slam多肽的多核苷酸;以及
(b)提供第二嵌合多核苷酸,其包含作为可操作连接的组分:
(i)能够控制在宿主细胞中的表达的多核苷酸;以及
(ii)编码靶蛋白的多核苷酸;以及
(c)将第一嵌合多核苷酸和第二嵌合多核苷酸引入宿主细胞并且使宿主细胞生长以产生slam多肽和靶蛋白,并且实现靶蛋白从细胞溶质到细胞外表面的转运。
另一方面,本公开涉及编码slam多肽的新型多核苷酸。因此,在至少一个实施方案中,本公开提供一种包含seqidno:1183或由seqidno:1183组成的多核苷酸。
在一些实施方案中,多核苷酸编码slam多肽,其中slam多核苷酸已被修饰以促进slam多肽在宿主细胞中的表达。
在一些实施方案中,编码slam多肽的多核苷酸已经过密码子优化。
在一些实施方案中,经过密码子优化的多核苷酸包含seqidno:1113所示的序列或由seqidno:1113所示的序列组成。
在一些实施方案中,编码slam多肽的多核苷酸额外地包含信号序列。
另一方面,本公开涉及新型多肽。因此,在至少一个实施方案中,本公开提供一种包含seqidno:1184或由seqidno:1184组成的多肽。
另一方面,在至少一个实施方案中,本公开提供一种制备疫苗的方法,所述方法包括:
(a)选择能够产生免疫原的宿主细胞;
(b)提供嵌合多核苷酸,其包含作为可操作连接的组分:
(i)能够控制在宿主细胞中的表达的多核苷酸;以及
(ii)编码slam多肽的多核苷酸;以及
(c)将嵌合核酸序列引入宿主细胞并且使宿主细胞生长以产生slam多肽和免疫原;
(d)使宿主细胞减毒以制备减毒的宿主细胞;以及
(e)使用减毒的宿主细胞制备疫苗制剂。
另一方面,在至少一个实施方案中,本公开提供一种制备疫苗的方法,所述方法包括:
(a)提供第一嵌合多核苷酸,其包含作为可操作连接的组分:
(i)能够控制在宿主细胞中的表达的多核苷酸;
(ii)编码slam多肽的多核苷酸;以及
(b)提供第二嵌合多核苷酸,其包含作为可操作连接的组分:
(i)能够控制在宿主细胞中的表达的多核苷酸;以及
(ii)编码靶蛋白的多核苷酸;以及
(c)将第一嵌合多核苷酸和第二嵌合多核苷酸引入宿主细胞并且使宿主细胞生长以产生slam多肽和靶蛋白;以及
(d)使用(c)的细胞制备疫苗制剂。
另一方面,在至少一个实施方案中,本公开提供一种制备疫苗的方法,所述方法包括:
(a)提供嵌合多核苷酸,其包含作为可操作连接的组分:
(i)能够控制在宿主细胞中的表达的多核苷酸;
(ii)编码slam多肽的多核苷酸;以及
(iii)编码靶蛋白的多核苷酸;以及
(b)将嵌合多核苷酸引入宿主细胞并且使宿主细胞生长以产生slam多肽和靶蛋白;以及
(c)使用(b)的细胞制备疫苗制剂。
另一方面,在至少一个实施方案中,本公开提供一种制备针对致病性细菌感染的疫苗的方法,所述方法包括:
(a)提供包含编码slam多肽的核酸序列的致病性菌株;
(b)减弱致病性菌株中的slam产生以获得slam减弱的致病性菌株;以及
(c)使用slam减弱的致病性菌株来配制疫苗。
另一方面,在至少一个实施方案中,本公开提供一种根据本公开的任何方法制备的疫苗制剂。
另一方面,在至少一个实施方案中,本公开提供一种根据本公开的任何方法制备的疫苗制剂用于使宿主生物体免疫的用途。
在一些实施方案中,疫苗制剂针对由细菌生物体介导的感染性疾病提供保护。
另一方面,在至少一个实施方案中,本公开提供一种用于鉴定在治疗被致病性细菌种感染的患者中使用的候选化合物的筛选方法,方法包括:
(a)提供测试化合物;
(b)在功能测定中,比较测试化合物与对照对致病性细菌种中的slam多肽的功能的影响;以及
(c)鉴定表现出对slam多肽的天然功能有影响的测试化合物。
在一些实施方案中,致病性细菌种属于奈瑟氏菌属。
另一方面,在至少一个实施方案中,本公开提供一种用于鉴定能够通过slam多肽从细胞的细胞溶质转运到细胞外表面的靶蛋白的方法,方法包括:
(a)提供基因组核苷酸序列,其包含
(i)编码slam多肽的第一核苷酸序列;以及
(ii)足够长以编码多肽并且天然连接到第一核苷酸序列的第二核苷酸序列;
(b)评估第二核苷酸序列以鉴定第二核苷酸序列内的多肽编码序列;以及
(c)使用多肽编码序列在包含slam多肽的宿主细胞中表达多肽,以确定蛋白质是否从宿主细胞的细胞溶质转运到细胞外表面,从而鉴定蛋白质是否是靶蛋白。
在一些实施方案中,第一核苷酸序列包含选自本文所述的奇数编号的seqidno:seqidno1至seqidno:695中的任一个的序列。
本公开的其他特征和优点通过以下详细描述将变得明显。然而,应该理解,详细描述(虽然表明本公开的优选实施方案)仅通过说明的方式给出,因为本公开的精神和范围内的各种变化和修改通过详细描述将对于本领域技术人员来说变得明显。
附图说明
本公开在下文中提供了关于其附图描述的段落。本文提供的附图是出于说明目的提供的并且不旨在限制本公开。
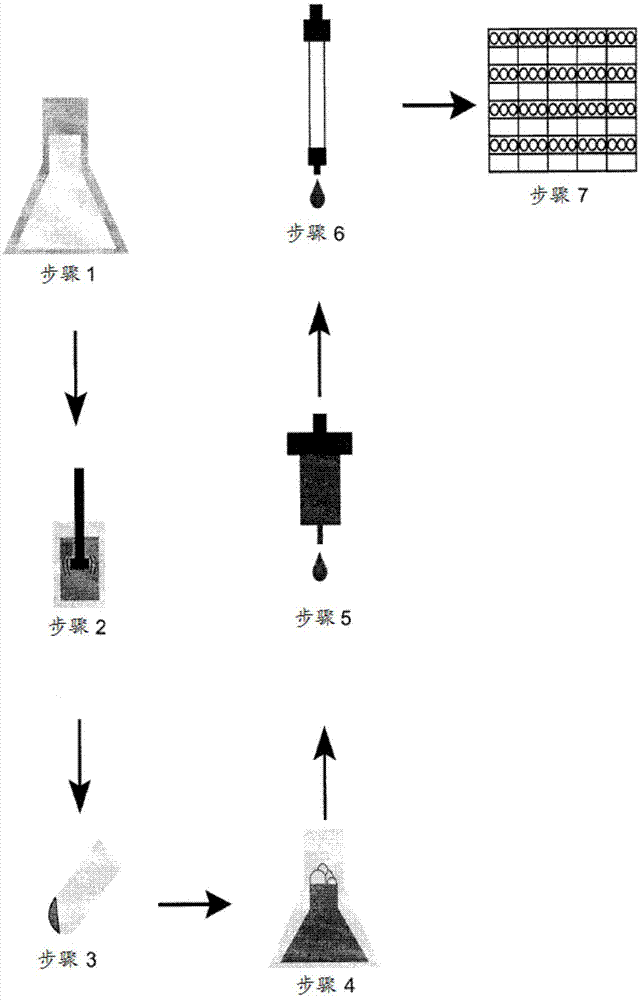
图1示出了概述用于纯化slam的方法的图解。步骤1:用含有5h3的质粒转化的细胞在37℃下生长,直到达到所需的光密度。在此时,通过添加iptg来诱导表达。步骤2:在过夜生长之后,通过离心收获细胞。然后在溶菌酶和dna酶的存在下,通过超声裂解细胞。步骤3:通过超速离心分离裂解物的膜级分。步骤4:将膜沉淀物重新悬浮,并且在50mm磷酸钾(ph7.5,3%elugent和pmsf)中将膜蛋白从膜中萃取过夜。步骤5:将萃取溶液加载到镍-nta柱上。用增加量的咪唑(imiziadole)洗涤柱,然后用含有0.6^c8e4的所有缓冲液从柱上洗脱5h3。步骤6:将含有5h3的浓缩级分加载到凝胶过滤柱上,用于进一步纯化和洗涤剂交换。步骤7:汇集含有5h3的级分并且浓缩,并且将蛋白质用于随后的晶体筛选中。
图2示出了slam1纯化和结晶的各个阶段的概述。图2a:使用s200柱的尺寸排阻色谱(sec)。图2b使用考马斯染色的sds-page分析含有slam1的峰并且进一步浓缩,并且将其用于使用商业上可获得的筛选的结晶试验。图2c示出了slam1的初始晶体命中。
图3示出了系统发育树和各种细菌种中各种slam多肽同源物的系统发育关系。第1组(浅框,顶部)中的slam同源物属于奈瑟氏菌属和卡他莫拉菌,而第2组(中灰色,中部)含有来自γ-变形菌门的巴斯德氏菌科的不同成员。第3组(深绿色,底部)仅含有neisseriashayeganii。
图4示出了slam2纯化和结晶的各个阶段的概述。图4a:用于纯化的构建体含有n-末端pelb序列(用于蛋白质定位)和6xhis标签(用于ninta纯化)。图4b:ninta纯化后收集的不同级分示出了洗脱的级分含有slam2。图4c:级分的蛋白质印迹确认了具有预期摩尔重量的slam2的his标签的存在。测试煮沸和未煮沸的级分。图4d:在ninta纯化后,使用s200柱使用尺寸排阻色谱(sec)进一步纯化样品。所述附图示出了从sec运行中获得的分布图(profile)。将含有slam2的峰进一步浓缩并且用于使用商业上可获得的筛选的结晶试验。图4e:示出了slam2的初始晶体命中。
图5示出了slam1多肽的n-末端部分和c-末端部分(图5a),以及使用经过slam1及其部分转化的脑膜炎奈瑟氏菌敲除菌株和流式细胞术评估表面脂蛋白易位中获得的结果(图5b)以及蛋白酶k消化结果(图5c)
图6示出了在与slp缀合的大肠杆菌中slam1表达后获得的结果。示出的是定量荧光(直方图)和示出易位的蛋白质印迹。示出的是使用tbpb(图6a)、lbpb(图6b)和fhbp(图6c)获得的结果。直方图展示出在用人转铁蛋白或slp特异性抗体孵育,接着用二次荧光分子孵育之后,针对每个样品测量的平均荧光强度。
图7示出了评估slam减弱的奈瑟氏菌菌株中获得的结果。图7a示出了由用多聚甲醛(pfa)固定或用sds裂解、点到硝化纤维素上并且用α-tbpb抗体探测的脑膜炎奈瑟氏菌细胞组成的固相结合测定。δslam/tn5是指通过转座子插入获得的slam缺陷细胞的原始菌株。δslam描述了通过用卡那霉素抗性盒替换slam开放阅读框(orf)获得的脑膜炎奈瑟氏菌中的slam敲除。图7b示出了蛋白酶k消化测定,所述测定示出了当nm细胞是slam缺陷(δslam)时,仅有tbpb、lbpb和fhbp降解。用蛋白酶k孵育表达单独的各个slp和具有slam的slp的脑膜炎奈瑟氏菌细胞,并且使用蛋白质印迹来检测具有和不具有蛋白酶消化的所有三种slp水平的水平(+/-)。流式细胞术用于确认δslam细胞不能在细胞表面上展示tbpb(图7c)或fhbp(图7d)。针对tbpb和fhbp的抗体用于连接表面暴露的slp,然后用连接到藻红蛋白的第二α-兔抗体孵育以提供荧光。使用bdfacscalibur的fl2检测器测量每个样品的平均荧光强度(mfi)。将从野生型细胞获得的信号设定为100%,用于与来自敲除细胞的信号进行比较。误差棒代表来自三次实验的平均值标准误差(sem)。图7e中示出的是用各种菌株进行小鼠感染的结果。通过用1x106cfu的野生型脑膜炎奈瑟氏菌株b16b6、敲除tbpb的b16b6(δtbpb)、或敲除nmb0313的b16b6δslam腹膜内注射来感染小鼠,并且在感染前48小时开始到感染后48小时每12小时监测存活率和疾病症状,并且在感染后3小时额外地监测。通过mantel-cox对数秩测试(graphpadprism5)评价存活率的统计学差异(*p<0.05,n.s.不显著)。
图8示出了包括可以根据本公开使用的示例性微生物的系统发育树。指出的细菌种中的预测slam蛋白数用括号示出。
图9示出了在整个革兰氏阴性细菌种中slam家族蛋白的存在。图9a示出了脑膜炎奈瑟氏菌slam1的结构域结构,其具有两个结构域:含有三角形四肽重复的周质n-末端结构域(ntd)和称为duf560的膜结合14链桶状结构域。图9b示出了变形菌门中的slam蛋白的分布。使用来自55个种的16s-rna序列制成变形菌门的家族树,所述55个种代表了变形菌门内的主要细菌科。将含有至少一种具有slam同源物的种的科通过黑点突出显示。在变形菌门的所有分支中发现了slam同源物。
图10示出了来自大肠杆菌中的卡他莫拉菌和流感嗜血杆菌的slam和tbpb对的易位。图10a示出了卡他莫拉菌和流感嗜血杆菌中的slam和tbpb基因簇。根据进行的生物信息学分析,发现slam与两种人病原体中已知的转铁蛋白结合表面脂蛋白tbpb相邻。图10b示出了用于本研究中的大肠杆菌易位测定的示意性图解。简而言之,在大肠杆菌c43(de3)细胞中表达slam和tbpb基因。用生物素化的人转铁蛋白和连接到r-藻红蛋白(pe)的链霉亲和素标记细胞。使用流式细胞术定量tbpb的表面展示。图10c示出了用slam(用黑色示出)或不用slam(用灰色显示)获得的卡他莫拉菌tbpb(mctbpb)和流感嗜血杆菌tbpb(hitbpb)的流式细胞术分布图。在slam的存在下观察到更高的信号,表明对slam的依赖性用于slp的有效表面表达。图10d示出了使用平均荧光强度的对于来自卡他莫拉菌和流感嗜血杆菌的tbpb同源物的平均荧光印迹。使用单因素anova确定统计学显著性,其中***代表p≤0.001。
图11示出了鉴定多杀性巴斯德氏菌中的slam依赖性表面脂蛋白。图11a示出了多杀性巴斯德氏菌菌株pm70中的slam基因簇。在我们的生物信息学研究中,pm1515(用黑色示出)被鉴定为slam同源物。pm1514(用灰色示出)被注释为假设的蛋白质。pm1514含有信号肽酶ii切割位点,其以推定的脂盒(lipobox)(itac)基序结束。图11b示出了制得用于易位测定以研究pm1514是否是slam依赖性slp的多杀性巴斯德氏菌基因构建体。简而言之,用c-末端flag-标签克隆pm1514(pm1514-flag)、用n-末端his-标签和pelb信号序列克隆pm1515,并且用pm1515和pm1514区克隆pm1515-pm1514-flag。fig.11c示出了多杀性巴斯德氏菌构建体的流式细胞术分布图,其中在图11b中详细说明的所有三种构建体在大肠杆菌c43(de3)细胞中表达,并且用α-flag抗体和连接到r-藻红蛋白(pe)的小鼠第二抗体标记。示出了pm1514-flag(浅灰色)、pm1515和pm1514-flag(黑色)以及pm1515-pm1514-flag(深灰色)的流式细胞术分布图。图11d示出了使用多杀性巴斯德氏菌构建体的平均荧光强度(mfi)定量的平均荧光强度印迹。使用单因素anova确定统计学显著性,其中***指代p≤0.001。
图12示出了鉴定易位基序位于tbpb上的位置。图12a示出了用于本研究中的脑膜炎奈瑟氏菌tbpb和hpua构建体,包括野生型tbpb、野生型hpua、tbpbn端小叶(n-lobe)、tbpbc端小叶(c-lobe)以及融合到hpua的tbpbn端小叶(n小叶_hpua)。图12b示出了通过大肠杆菌c43(de3)细胞的流式细胞术所定量的tbpbn端小叶和c端小叶的易位效率,所述细胞在用α-tbpb和兔fitc抗体标记之后表达全长脑膜炎奈瑟氏菌tbpb和脑膜炎奈瑟氏菌slam1或其各个小叶。图12c、图12d和图12e示出了分别具有α-tbpb、α-hpua和生物素化的人转铁蛋白的n小叶_hpua的易位效率。使用流式细胞术测试slam1和slam2加强n小叶-hpua到大肠杆菌表面的易位的能力。α-tbpb和生物素化的人转铁蛋白用于检测tbpbn端小叶,而使用α-hpua检测hpua。示出了平均荧光强度印迹,并且突出显示将tbpbc端小叶与hpua交换将构建体的特异性从slam1交换到slam2。使用单因素anova确定统计学显著性,其中***指代p≤0.001,****指代p≤0.0001并且n.s.指代不显著。
图13示出了slam依赖性表面脂蛋白的两个c-末端链是保守的并且是表面展示所必需的。图13a示出了在slam依赖性slp上发现的蛋白质结构域的通用结构。该蛋白质家族含有灵活的手柄状结构域和八链桶状结构域。桶状结构域在所有推定的slam依赖性slp中是保守的。图13b示出了来自脑膜炎奈瑟氏菌tbpb的桶状结构域的示意图,其中链根据来自脑膜炎奈瑟氏菌菌株b16b6(pdbid:4qq1)的tbpb结构编号。通过聚丙氨酸突变进行突变的链由b22、b23、b30和b31指代。图13c和图13d示出了大肠杆菌c43(de3)细胞的易位效率,所述细胞表达以下中的一种:单独的tbpb野生型、slam1和tbpb野生型、或在四种不同的β-桶状链中含有聚丙氨酸突变的slam1和tbpb突变体。用α-tbpb和生物素化的人转铁蛋白标记细胞,并且平均荧光强度印迹确定tbpbc端小叶桶状体的最后两条链中的突变阻止tbpb的表面展示。用α-tbpb和α-his进行蛋白质印迹分析以分别确认tbpbc端小叶突变体和slam1的表达。图13e示出了具有用灰色突出显示的保守残基的slam依赖性slp的c-末端β-桶状体的最后两条链的多序列比对。图13f示出了tbpb的c端小叶结构中的最后两条β-桶状链上的保守残基的重叠。两条链彼此面对,其中桶状结构域内部的残基彼此面对,而桶状体外部的残基彼此远离。保守残基在桶状结构域中心处团簇在一起。使用单因素anova确定统计学显著性,其中***指代p≤0.001,****指代p≤0.0001并且n.s.指代不显著。
图14示出了鉴定鲍氏不动杆菌中的slam依赖性表面脂蛋白。图14a示出了鲍氏不动杆菌菌株lac4中的slam基因簇。在生物信息学研究中,abslam(用灰色示出)被鉴定为slam同源物。abslp(用黑色示出)被注释为假设的蛋白质。图14b示出了制得用于易位测定以研究abslp是否是slam依赖性slp的鲍氏不动杆菌基因构建体。简而言之,用c-末端flag标签克隆abslp(abslp-flag),用n-末端his标签和pelb信号序列克隆abslam。图14b(右)示出了鲍氏不动杆菌构建体的流式细胞术分布图,其中详细说明的两种构建体在大肠杆菌c43(de3)细胞中表达,并且用α-flag抗体和连接到r-藻红蛋白(pe)的小鼠第二抗体标记。图14c示出了形成的abslp晶体(左)和abslp的鉴定晶体结构的卡通图。图14d示出了鲍氏不动杆菌中的pk修剃测定。
具体实施方式
下面将描述各种组合物和方法,以提供每个要求保护的主题的实施方案的实例。下面描述的实施方案不限制任何要求保护的主题,并且任何要求保护的主题可以涵盖不同于下面描述的那些的方法、过程、组合物或系统。要求保护的主题不限于具有下面描述的任何一种组合物、方法、系统或过程的所有特征的组合物或方法,或对于下面描述的多种或所有组合物、系统或方法共有的特征。下面描述的组合物、系统、方法或过程可能不是任何要求保护的主题的实施方案。在下面描述的未在本文件中要求保护的组合物、系统、方法或过程中公开的任何主题可以是另一种保护手段的主题,例如,继续专利申请,并且申请人、发明人或所有者并不意图通过其在本文件中的公开而放弃、弃权或献给公众任何此种主题。所有出版物、专利和专利申请以引用的方式整体并入本文,其程度如同每个单独的出版物一样。
术语和定义
除非另外定义,否则本文所使用的所有技术术语和科学术语应该具有与本公开所属领域中的普通技术人员所通常理解的相同的含义。以下术语应该被理解为具有以下含义。
本文可互换使用的术语“表面脂蛋白组装调节剂”、“slam”、“slam蛋白”和“slam多肽”是指任何和所有的slam蛋白,包括偶数编号的seqidno:seqidno:2至seqidno:694和seqidno:1184中的任一个所述的那些,以及包含氨基酸残基的序列的那些,所述氨基酸残基(i)是与构成本文所述的任何slam蛋白的氨基酸序列基本上相同;(ii)由核酸序列编码,所述核酸序列能够在至少中等严格的条件下与编码本文所述的任何slam蛋白的任何核酸序列杂交或能够在至少中等严格的条件下与编码本文所述的任何slam蛋白的任何核酸序列杂交,但使用同义密码子。术语还包括任何slam前体多肽。
术语“表面脂蛋白”是指任何和所有表面脂蛋白,包括本文所述的偶数编号的seqidno:seqidno:696至seqidno:1082中的一个、seqidno:1094、seqidno:1100和偶数编号的seqidno:1116至seqidno:1168和seqidno;1178所述的那些,以及包含氨基酸残基的序列的那些,所述氨基酸残基(i)是与构成本文所述的任何表面脂蛋白的氨基酸序列基本上相同;(ii)由核酸序列编码,所述核酸序列能够在至少中等严格的条件下与编码本文所述的任何表面脂蛋白的任何核酸序列杂交或能够在至少中等严格的条件下与编码本文所述的任何表面脂蛋白的任何核酸序列杂交,但使用同义密码子。术语表面脂蛋白还可以是指包含seqidno:1170和seqidno:1174所述的表面脂蛋白盒序列基序的多肽和包含氨基酸残基的序列的那些,所述氨基酸残基(i)是与构成本文所述的任何表面脂蛋白盒序列基序的氨基酸序列基本上相同;或(ii)由核酸序列编码,所述核酸序列能够在至少中等严格的条件下与编码本文所述的任何表面脂蛋白盒序列基序的任何核酸序列杂交或能够在至少中等严格的条件下与编码本文所述的任何表面脂蛋白盒序列基序的任何核酸序列杂交,但使用同义密码子。
本文可互换使用的术语“转铁蛋白结合蛋白b”、“tbpb蛋白”、“tbpb多肽”和“tbpb”是指任何和所有tbpb蛋白,包括选自本文所述的seqidno:806、seqidno:828、seqidno:868、seqidno:1094和偶数编号的seqidno:seqidno:1148至seqidno:1168中的一个的序列所述的那些,以及包含氨基酸残基的序列的那些,所述氨基酸残基(i)是与构成本文所述的任何tbpb蛋白的氨基酸序列基本上相同;(ii)由核酸序列编码,所述核酸序列能够在至少中等严格的条件下与编码本文所述的任何tbpb蛋白的任何核酸序列杂交或能够在至少中等严格的条件下与编码本文所述的任何tbpb蛋白的任何核酸序列杂交,但使用同义密码子。
本文可互换使用的术语“乳铁蛋白结合蛋白”、“lbpb蛋白”、“lbpb多肽”和“lbpb”是指任何和所有lbpb蛋白,包括选自本文所述的seqidno:870或偶数编号的seqidno:seqidno:1138至seqidno:1146中的一个的序列所述的那些,以及包含氨基酸残基的序列的那些,所述氨基酸残基(i)是与构成本文所述的任何lbpb蛋白的氨基酸序列基本上相同;(ii)由核酸序列编码,所述核酸序列能够在至少中等严格的条件下与编码本文所述的任何lbpb蛋白的任何核酸序列杂交或能够在至少中等严格的条件下与编码本文所述的任何lbpb蛋白的任何核酸序列杂交,但使用同义密码子。
本文可互换使用的术语“因子h结合蛋白”、“fhbp蛋白”、“fhbp多肽”和“fhbp”是指任何和所有fhbp蛋白,包括选自本文所述的偶数编号的seqidno:seqidno:1116至seqidno:1136中的一个的序列的那些,以及包含氨基酸残基的序列的那些,所述氨基酸残基(i)是与构成本文所述的任何fhbp蛋白的氨基酸序列基本上相同;(ii)由核酸序列编码,所述核酸序列能够在至少中等严格的条件下与编码本文所述的任何fhbp蛋白的任何核酸序列杂交或能够在至少中等严格的条件下与编码本文所述的任何fhbp蛋白的任何核酸序列杂交,但使用同义密码子。
本文可互换使用的术语“血红蛋白-触珠蛋白结合蛋白a”、“hpua蛋白”、“hpua多肽”和“hpua”是指任何和所有slam蛋白,包括seqidno:850、seqidno:924、seqidno:932或seqidno:1110所示的那些,以及包含氨基酸残基的序列的那些,所述氨基酸残基(i)是与构成本文所述的任何hpua蛋白的氨基酸序列基本上相同;(ii)由核酸序列编码,所述核酸序列能够在至少中等严格的条件下与编码本文所述的任何hpua蛋白的任何核酸序列杂交或能够在至少中等严格的条件下与编码本文所述的任何hpua蛋白的任何核酸序列杂交,但使用同义密码子。
本文可互换使用的术语“编码表面脂蛋白组装调节剂的多核苷酸”;“编码slam多肽的多核苷酸”;以及编码slam蛋白的多核苷酸是指编码slam多肽的任何和所有多核苷酸,包括任何slam多肽和编码slam前体的任何核酸序列,包括seqidno:1和seqidno:3所示的多核苷酸。如本文所用,“slam前体”是指另外包含n-末端信号序列的slam分子,其促进多肽链跨越大肠杆菌和其他革兰氏阴性细菌种的细胞质膜的输出。编码slam多肽的多核苷酸还包括任何和所有多核苷酸,所述多核苷酸(i)编码与本文所述的slam多肽序列基本上相同的多肽;或(ii)在至少中等严格的杂交条件下与本文所述的任何slam多核苷酸杂交或在至少中等严格的条件下将与其杂交,但是使用同义密码子。
术语“编码表面脂蛋白的多核苷酸”是指编码表面脂蛋白(包括任何表面脂蛋白)的任何和所有多核苷酸,包括本文所述的奇数编号的包括seqidno:695至seqidno:1081和seqidno:1177的seqidno所示的多核苷酸。编码表面脂蛋白的多核苷酸还包括任何和所有多核苷酸,所述多核苷酸(i)编码与本文所述的表面脂蛋白序列基本上相同的蛋白质;或(ii)在至少中等严格的杂交条件下与本文所述的任何表面脂蛋白多核苷酸杂交或在至少中等严格的条件下将与其杂交,但是使用同义密码子。
如本文可以可互换使用的术语“编码tbpb的多核苷酸”、“编码tbpb蛋白的多核苷酸”和“编码tbpb多肽的多核苷酸”是指编码tbpb蛋白(包括任何tbpb蛋白)的任何和所有多核苷酸,包括seqidno:1147所示的多核苷酸。编码表面脂蛋白的多核苷酸还包括任何和所有多核苷酸,所述多核苷酸(i)编码与本文所述的表面脂蛋白序列基本上相同的蛋白质;或(ii)在至少中等严格的杂交条件下与本文所述的任何表面脂蛋白多核苷酸杂交或在至少中等严格的条件下将与其杂交,但是使用同义密码子。
如本文可以可互换使用的术语“编码lbpb的多核苷酸”、“编码lbpb蛋白的多核苷酸”和“编码lbpb多肽的多核苷酸”是指编码lbpb蛋白(包括任何lbpb蛋白)的任何和所有多核苷酸,包括seqidno:869所示的多核苷酸。编码表面脂蛋白的多核苷酸还包括任何和所有多核苷酸,所述多核苷酸(i)编码与本文所述的表面脂蛋白序列基本上相同的蛋白质;或(ii)在至少中等严格的杂交条件下与本文所述的任何表面脂蛋白多核苷酸杂交或在至少中等严格的条件下将与其杂交,但是使用同义密码子。
如本文可以可互换使用的术语“编码fhbp的多核苷酸”、“编码fhbp蛋白的多核苷酸”和“编码fhbp多肽的多核苷酸”是指编码fhbp蛋白(包括任何fhbp蛋白)的任何和所有多核苷酸,包括seqidno:1115所示的多核苷酸。编码表面脂蛋白的多核苷酸还包括任何和所有多核苷酸,所述多核苷酸(i)编码与本文所述的表面脂蛋白序列基本上相同的蛋白质;或(ii)在至少中等严格的杂交条件下与本文所述的任何表面脂蛋白多核苷酸杂交或在至少中等严格的条件下将与其杂交,但是使用同义密码子。
如本文可以可互换使用的术语“编码hpua的多核苷酸”、“编码hpua蛋白的多核苷酸”和“编码hpua多肽的多核苷酸”是指编码hpua蛋白(包括任何hpua蛋白)的任何和所有多核苷酸,包括seqidno:931所示的多核苷酸。编码表面脂蛋白的多核苷酸还包括任何和所有多核苷酸,所述多核苷酸(i)编码与本文所述的表面脂蛋白序列基本上相同的蛋白质;或(ii)在至少中等严格的杂交条件下与本文所述的任何表面脂蛋白多核苷酸杂交或在至少中等严格的条件下将与其杂交,但是使用同义密码子。
术语“基本上相同”意指优选至少50%相同,并且更优选至少85%相同并且最优选至少95%相同,例如96%、97%、98%或99%相同的两个多肽序列。为了确定两个多肽序列之间的同一性的百分比,使用例如needleman和wunsch(needlemansb,wunschcd.1970.ageneralmethodapplicabletothesearchforsimilaritiesintheaminoacidsequenceoftwoproteins.journalofmolecularbiology48:443-453),如由smith和waterman(smithtfamsw.1981.comparisonofbiosequences.advancesinappliedmathematics2:482-489)修订的比对方法,比对此两种序列的氨基酸序列,以使得在两个序列之间获得最高顺序匹配并且确定两个序列之间的相同氨基酸数。一种用于准确比对两个多肽的优选的广泛适用的方法涉及clustalw算法(thompsonjd,higginsdg,gibsontj.1994.clustalw:improvingthesensitivityofprogressivemultiplesequencealignmentthroughsequenceweighting,position-specificgappenaltiesandweightmatrixchoice.nucleicacidsresearch22:4673-4680.),其采用有blosum62评分矩阵(henikoffs,henikoffjg.1992.aminoacidsubstitutionmatricesfromproteinblocks.procnatlacadsciusa89:10915-10919),使用空位开放罚分为10和空位扩展罚分为0.1。这使得能够鉴定两个序列之间的高评分比对,其中两个序列中的一个的总长度的至少50%涉及比对。计算两个比对的氨基酸序列之间的百分比同一性的方法通常是本领域公认的,并且包括例如由carillo和lipton描述的那些(carrilloh和d.lipman.1989.themultiplesequencealignmentprobleminbiology.siamjournalonappliedmathematics48:1073-1082),以及在computationalmolecularbiology,lesk编著oxforduniversitypress,newyork,1988,biocomputing:informaticsandgenomicsprojects中描述的那些。通常,计算机程序将用于此类计算。可用于此方面的计算机程序包括但不限于gcg(devereuxj,haeberlip,smithieso.1984.acomprehensivesetofsequenceanalysisprogramsforthevax.nucleicacidsresearch12:387-395)、blastp、blastn和fasta(altschulsf,gishw,millerw,myersew,lipmandj.1990.basiclocalalignmentsearchtool.journalofmolecularbiology215:403-410)。
“至少中等严格的杂交条件”意指选择促进溶液中的两个互补核酸分子之间的选择性杂交的条件。杂交可对于核酸序列分子的全部或一部分发生。杂交部分的长度通常是至少15个(例如20、25、30、40或50个)核苷酸。本领域技术人员将认识到核酸双链体或杂交体的稳定性由tm确定,其在含钠缓冲液中是钠离子浓度和温度的函数(tm=81.5℃-16.6(log10[na+])+0.41(%(g+c)-600/l)或类似等式)。因此,确定杂交体稳定性的洗涤条件中的参数是钠离子浓度和温度。为了鉴定与已知核酸分子相似但不相同的分子,可以假设1%的错配导致tm降低约1℃,例如,如果寻找具有>95%同一性的核酸分子,最终洗涤温度将降低约5℃。基于这些考虑,本领域技术人员将能够容易地选择合适的杂交条件。在优选的实施方案中,选择严格的杂交条件。举例来说,可以采用以下条件来实现严格杂交:在5×氯化钠/柠檬酸钠(ssc)/5×denhardt溶液/1.0%sds在tm(基于上式)-5℃下的杂交,然后在60℃下洗涤0.2×ssc/0.1%sds。中等严格的杂交条件包括在42℃下在3×ssc中的洗涤步骤。然而,应该理解,使用替代缓冲剂、盐和温度可以实现等效的严格性。关于杂交条件的额外指导可见于:green和sambrook,molecularcloning,alaboratorymanual,coldspringharborlaboratorypress,2012(32)。
如本文在多核苷酸的背景下使用的术语“嵌合”是指非天然连接的至少两个连接的多核苷酸。嵌合核酸多核苷酸包括不同天然来源的连接多核苷酸。例如,构成大肠杆菌细菌启动子的多核苷酸被认为是嵌合的,所述启动子连接到编码奈瑟氏菌属slam多肽的多核苷酸。此外,嵌合多核苷酸可具有相同的天然来源但不是天然连接的。此外,非天然存在的多核苷酸载体是嵌合的。例如,构成从特定细胞类型获得的启动子的多核苷酸可以连接到编码从相同细胞类型获得的多肽的多核苷酸,但通常不连接到构成启动子的多核苷酸。嵌合多核苷酸还包括以下多核苷酸,所述多核苷酸包含连接到任何非天然存在的多核苷酸的任何天然存在的多核苷酸。
如本文所用,术语“细胞溶质”是指细胞(例如细菌细胞)的内部,通常水性部分,并且包括可存在于细胞溶质内的所有细胞组分,但特别地排除细胞的细胞外表面。
如本文所用,术语“细胞外表面”旨在是指将细胞的细胞溶质部分与其外源环境分开的细胞的细胞表面结构。细胞表面结构可包括一个或多个磷脂膜,其中嵌入有蛋白质和/或脂多糖。
如本文所用,术语“宿主生物体”是指人和非人脊椎动物,包括但不限于牛、猪、马、鼠、犬、猫、鱼、绵羊、山羊、猿猴和禽类动物。
本文可互换使用的术语“免疫原”和“免疫原性组合物”以其最广泛的含义使用,是指含有一个或多个表位的分子,所述表位将刺激宿主生物体中的免疫应答以产生细胞免疫原特异性免疫应答或体液抗体应答。免疫原包括蛋白质、多肽、肽和免疫原性蛋白质片段。
如本文可互换使用的术语“疫苗”和“疫苗组合物”是指含有免疫原的任何药物组合物,所述组合物可用于预防或治疗宿主生物体中的疾病或病状。因此,术语涵盖亚单位疫苗,即含有免疫原的疫苗组合物,所述免疫原与免疫原本质上与之相关的整个生物体分开且不连续,并且还包括活疫苗。
应该注意,本文所用的诸如“基本上”、“实质上”、“约”和“近似”的程度术语意指修饰术语的合理偏差量,使得最终结果不会显著改变。这些程度术语应该被解释为包括修饰术语的偏差,如果该偏差不会否定其修饰术语的含义。
如本文所用,措词“和/或”旨在表示包含性的或。也就是说,“x和/或y”旨在意指例如x或y或两者。作为另一实例,“x、y和/或z”旨在意指x或y或z或其任何组合。
如本说明书以及所附权利要求书中所用,除非上下文另外明确规定,否则单数形式的“一个/种”和“所述”包括复数指代物。因此,例如提及“免疫原”包括两种或更多种此类剂的混合物,提及“多肽”包括提及两种或更多种多肽的混合物,提及“细胞”包括两种或更多种此类细胞等。
一般实现方式
如上文所提到,本公开涉及从革兰氏阴性细菌种可获得或获得的多肽和多核苷酸,特别是属于称为表面脂蛋白组装调节剂或slam蛋白的一类蛋白质的多肽。
编码本公开的slam蛋白的多核苷酸可用于宿主细胞中slam蛋白的表达和产生。令人惊讶地是,这种宿主细胞中slam蛋白的表达可以导致另一种蛋白质(在本文中称为靶蛋白,其存在于宿主细胞中)从宿主细胞的细胞质部分到宿主细胞的细胞外表面的易位。
此外,编码slam蛋白的多核苷酸可用于制备可用于预防由致病性细菌种造成的感染的疫苗制剂,所述致病性细菌种例如属于奈瑟氏菌属的细菌种。
此外,编码slam蛋白的多核苷酸和slam蛋白可用于测定中以鉴定可用于治疗由致病性细菌种感染的患者的化合物。
因此,一方面,在至少一个实施方案中,本公开提供一种实现靶蛋白从包含靶蛋白的宿主细胞的细胞溶质到细胞外表面的转运的方法,方法包括:
(a)提供嵌合多核苷酸,其包含作为可操作连接的组分:
(i)能够控制在宿主细胞中的表达的多核苷酸;以及
(ii)编码slam多肽的多核苷酸;以及
(b)将嵌合核酸序列引入宿主细胞并且使宿主细胞生长以产生slam多肽,从而实现靶蛋白从宿主细胞的细胞溶质到细胞外表面的转运。
根据本文编码slam多肽的多核苷酸可从任何细菌种或菌株获得,所述细菌种或菌株包括编码slam蛋白的多核苷酸,特别是包括任何革兰氏阴性细菌种,包括属于变形菌门的任何细菌种,并且还包括属于α-变形菌纲、β-变形菌纲、γ-变形菌纲和δ-变形菌纲的任何细菌种。
在一些实施方案中,编码slam多肽的多核苷酸可以从属于α-变形菌纲内的一个科的细菌种获得,例如鞘脂单胞菌科、根瘤菌科和红杆菌科。这些科中的每一个中的示例性细菌属和种是提供在图8和图9中的所有种。
在一些实施方案中,编码slam多肽的多核苷酸可以从属于β-变形菌纲内的一个科的细菌种获得,例如奈瑟氏菌科、伯克霍尔德菌科(burholderiale)和红环菌科。这些科中的每一个中的示例性细菌属和种是提供在图8和图9中的所有种。
在一些实施方案中,编码slam多肽的多核苷酸可以从属于γ-变形菌纲内的一个科的细菌种获得,例如巴斯德氏菌科、恶臭假单胞菌(pseudomonodale)、肠杆菌科、弧菌科、黄单胞菌科、心杆菌科和噬甲基菌科。这些科中的每一个中的示例性细菌属和种是提供在图8和图9中的所有种。
在一些实施方案中,编码slam多肽的多核苷酸可以从属于δ-变形菌门内的一个科的细菌种获得,例如脱硫弧菌科。该科中的示例性细菌属和种提供在图8和图9中。
在一些实施方案中,编码slam多肽的多核苷酸可以从属于以下种的细菌种获得:脑膜炎奈瑟氏菌、淋病奈瑟氏菌、乳糖奈瑟氏菌、灰色奈瑟氏菌、反硝化克雷伯氏菌、卡他莫拉菌、溶血性曼氏杆菌、胸膜肺炎放线杆菌、睡眠嗜组织菌、流感嗜血杆菌、多杀性巴斯德氏菌、鲍氏不动杆菌或霍乱弧菌。
在一些实施方案中,编码slam多肽的多核苷酸是包含以下或由以下组成的多核苷酸:本文所述的起始于seqidno:1并且在seqidno:693处结束并包括seqidno:693的奇数编号的seqidno中的任一个。
在一些实施方案中,slam多肽是包含以下或由以下组成的多肽:起始于seqidno:2并且在seqidno:694处结束并包括seqidno:694的偶数编号的seqidno中的任一个。
根据本公开的一些方面,编码slam多肽的多核苷酸连接到能够控制宿主细胞中slam多肽的表达的多核苷酸。宿主细胞可以是任何细胞,包括任何真核细胞,包括动物细胞或植物细胞、或微生物细胞,诸如真菌细胞或细菌细胞。
在一些实施方案中,宿主细胞是细菌细胞。
在一些实施方案中,宿主细胞是革兰氏阴性细菌细胞。
在一些实施方案中,宿主细胞是选自属于以下属的细菌细胞的细胞:奈瑟氏菌属、克雷伯氏菌属、莫拉氏菌属、曼氏杆菌属、放线杆菌属、嗜血杆菌属、巴斯德氏菌属、不动杆菌属、埃希氏菌属或弧菌属。
在一些实施方案中,宿主细胞选自属于以下种的细菌细胞:脑膜炎奈瑟氏菌、淋病奈瑟氏菌、乳糖奈瑟氏菌、灰色奈瑟氏菌、反硝化克雷伯氏菌、卡他莫拉菌、溶血性曼氏杆菌、胸膜肺炎放线杆菌、睡眠嗜组织菌、流感嗜血杆菌、多杀性巴斯德氏菌、鲍氏不动杆菌或霍乱弧菌。
在优选的实施方案中,宿主细胞选自属于奈瑟氏菌属的细菌细胞,包括脑膜炎奈瑟氏菌和淋病奈瑟氏菌或大肠杆菌。
根据本公开的一个方面,能够控制在宿主细胞中的表达的多核苷酸连接到编码slam多肽的多核苷酸。因此,一方面,在至少一个实施方案中,本公开还提供一种编码slam多肽的多核苷酸,所述多核苷酸连接到能够控制在宿主细胞中的表达的多核苷酸。
可用于本文的能够控制在宿主细胞中的表达的多核苷酸包括能够控制宿主细胞中多肽表达的任何转录启动子。通常,当根据本文选择微生物宿主时,使用从微生物细胞获得的启动子,而当选择真核宿主时选择真核启动子,依此类推。能够控制在宿主细胞中的表达的其他多核苷酸组分包括转录终止子、增强子等,所有这些都可以包括在本公开的嵌合多核苷酸中。
根据本公开,本公开的嵌合多核苷酸优选包括在表达载体中,所述表达载体确保slam多肽在宿主细胞中的良好表达。因此,在一个实施方案中,本公开包括一种重组表达载体,其包含作为可操作连接的组分:
(i)能够控制在宿主细胞中的表达的多核苷酸;以及
(ii)编码slam多肽的多核苷酸
其中表达载体适用于在宿主细胞中表达。术语“适用于在宿主细胞中表达”意指重组表达载体包含本公开的嵌合核酸序列,所述嵌合核酸序列连接到在宿主细胞中实现表达所需的遗传元件。在这方面可包含在表达载体中的遗传元件包括转录终止区、编码标记基因的一个或多个核酸序列、一个或多个复制起点等。通常如本领域技术人员所知的,通过将例如转录的5'至3'方向的启动子连接到编码序列来可操作连接遗传元件。在优选的实施方案中,表达载体还包含将载体或其部分整合到宿主细胞基因组中所需的遗传元件。根据本公开内容,表达载体可以还含有标记基因。可以根据本公开使用的标记基因包括允许区分转化的细胞与非转化的细胞的所有基因,包括所有可选择和可筛选的标记基因。标记基因可以是抗性基因,诸如针对例如卡那霉素或氨苄青霉素的抗生素抗性标记。可用于通过视觉检查鉴定转化体的可筛选标记包括例如β-半乳糖苷酶、β-葡糖醛酸酶(gus)(美国专利号5,268,463和5,599,670)和绿色荧光蛋白(gfp)(niedzrp,sussmanmr,satterleejs.1995.greenfluorescentprotein-anin-vivoreporterofplantgene-expression.plantcellrep14:403-406)、或其他蛋白质标签,例如多组氨酸标签或flag标签,如图11和图13所示。
根据本公开的一个方面,可以修饰编码slam的天然存在的多核苷酸。因此,可以修饰天然存在的多核苷酸以便增强slam多肽在宿主细胞中的表达,例如通过密码子优化编码slam多肽的多核苷酸序列。因此,本公开还提供一种编码slam多肽的密码子优化的多核苷酸,所述多核苷酸包括seqidno:1113所示的多核苷酸。编码slam的多核苷酸可以进一步修饰以包括促进表达的信号序列。编码信号序列的示例性多核苷酸在seqidno:1179中示出,并且相应的多肽信号序列在seqidno:1180中示出。因此,本公开还包括编码微生物信号序列的嵌合多核苷酸,所述嵌合多核苷酸可操作连接到编码slam多肽的多核苷酸,以及由此类多核苷酸编码的多肽,包括seqidno:1181和seqidno:1182所示的多核苷酸和多肽。
可以特别方便使用的一种宿主细胞是大肠杆菌。可以使用通常已知的技术诸如限制性消化、连接、不依赖于连接的克隆、凝胶电泳、dna测序、聚合酶链式反应(pcr)和其他方法来完成大肠杆菌载体的制备。各种各样的克隆载体可供用于进行制备重组表达载体所需的必要步骤,所述重组表达载体包括本发明人开发的定制载体。具有在大肠杆菌中有功能的复制系统的载体包括诸如puc或pet系列的载体等载体。通常,这些克隆载体含有允许选择转化的细胞的标记。使用例如限制酶和连接酶,可以将多核苷酸引入这些载体,并且通过制备感受态细胞、电穿孔或使用本领域技术人员熟知的其他方法,可以将载体引入大肠杆菌。大肠杆菌可以在合适的培养基诸如luria肉汤培养基中生长并且收获。在收获和裂解细胞后,可以容易地从细胞中回收重组表达载体。此外,关于重组载体的制备和重组生物体的生长的一般指导可以参见例如:sambrook等,molecularcloning,alaboratorymanual,coldspringharborlaboratorypress,2001,第三版。
重组slam多肽的产生可发生在整个菌株的生长中,或可以通过使用例如诱导型启动子,诸如lacz启动子,在生长一段时间以达到显著生物量之后,诱导表达来实现。
根据本文,在一些实施方案中,随后回收slam多肽,分离并且与其他宿主细胞组分分开。因此,在另一个实施方案中,本公开提供一种在宿主细胞中表达slam多肽的方法,所述方法包括:
(a)提供嵌合多核苷酸,其包含作为可操作连接的组分:
(i)能够控制在宿主细胞中的表达的多核苷酸;以及
(ii)编码slam多肽的多核苷酸;以及
(b)将嵌合核酸序列引入宿主细胞并且使宿主细胞生长以产生slam多肽;以及
(c)从宿主细胞中回收slam多肽。
slam蛋白回收可以通过多种不同的蛋白质纯化技术来实现,包括例如金属螯合色谱、离子交换色谱、尺寸排阻色谱、亲和色谱、疏水相互作用色谱、反相色谱、凝胶过滤等。关于蛋白质纯化的另外一般指导例如可见于:proteinpurification:principles,highresolutionmethods,andapplicationsjansonj-c.2013.proteinpurification:principles,highresolutionmethods,andapplication,第54卷.wiley。如本文所用的术语“回收的”意指多肽以大概纯的形式获得。“基本上纯的”意指免疫原性蛋白质与其他宿主细胞组分分开。根据此,免疫原性蛋白质是至少95%纯,并且更优选至少96%、97%、98%或99%纯。
另一方面,本公开涉及新型slam多肽。因此,在至少一个实施方案中,本公开提供一种slam多肽或一种与其基本上相同的多肽,所述slam多肽包含seqidno:1184或由seqidno:1184组成。
另一方面,本公开涉及编码slam多肽的新型多核苷酸。因此,在至少一个实施方案中,本公开提供一种包含seqidno:1183或由seqidno:1183组成的多核苷酸。
关于宿主细胞,slam多肽可以是天然存在于其中的slam多肽,并且因此在一些实施方案中,宿主细胞中slam多肽的产生可以导致调节细胞中slam多肽蛋白浓度,例如细胞中slam多肽的浓度可以由于引入嵌合多肽序列而增加。在其他实施方案中,产生的slam多肽不天然存在于宿主细胞中。
靶蛋白可以是任何蛋白质、多肽或肽,其可需要从宿主细胞的细胞溶质到细胞外表面的转运。如本文所用,术语“细胞外表面”旨在是指将细胞的细胞溶质部分与其外源环境分开的细胞的细胞表面结构。细胞表面结构可包括一个或多个磷脂膜,其中嵌入有蛋白质和/或脂多糖。在革兰氏阴性细菌中,细胞外表面结构包括通过水性周质隔室彼此分开的内部磷脂双层膜和外部磷脂双层膜。在从宿主细胞的细胞溶质到细胞外表面的转运之后,靶蛋白与细胞的细胞外表面结构配位并且相互作用。此种相互作用可导致靶蛋白的至少一部分暴露于细胞的外源环境。
在至少一些实施方案中,靶蛋白是能够在宿主生物体中引发免疫应答的免疫原性蛋白质。
在至少一些实施方案中,靶蛋白是天然展示在致病性微生物的外表面上的免疫原性多肽或其免疫原性部分。
在至少一些实施方案中,免疫原性蛋白质是表面脂蛋白(slp)或其部分。
在至少一些实施方案中,表面脂蛋白(slp)包含选自以下中的一个的多肽序列或其部分或由选自以下中的一个的多肽序列或其部分组成:本文所述的偶数编号的seqidno:seqidno:696至seqidno:1082中的一个、seqidno:1094、seqidno:1100和偶数编号的seqidno:1116至seqidno:1168和seqidno;1178。
在至少一些实施方案中,表面脂蛋白(slp)包含由选自以下的多核苷酸编码的多肽序列或其部分或由选自以下的多核苷酸编码的多肽序列或其部分组成:本文所述的起始于seqidno:695并且在seqidno:1081处结束并包括seqidno:1081的偶数编号的seqidno中的一个。
在至少一些实施方案中,靶蛋白是位于与编码slam多肽的多核苷酸序列相邻的细菌基因组上的表面脂蛋白。
在至少一些实施方案中,免疫原性蛋白质是选自由以下组成的组的表面脂蛋白或其免疫原性部分:转铁蛋白结合蛋白b(tbpb),在一些实施方案中,其包括包含seqidno:1148的tbpb多肽;血红蛋白-触珠蛋白结合蛋白a(hpua),在一些实施方案中,其包括包含seqidno:932的hpua多肽;因子h结合蛋白(fhbp),在一些实施方案中,其包括包含seqidno:1116的fhbp多肽;以及乳铁蛋白结合蛋白(lbpb),在一些实施方案中,其包括包含seqidno:1138的lbpb多肽。
在至少一些实施方案中,转铁蛋白结合蛋白b(tbpb)由包含seqidno:1149或由seqidno:1149组成的多核苷酸序列编码。
在至少一些实施方案中,乳铁蛋白结合蛋白b(lbpb)由包含seqidno:869或由seqidno:869组成的多核苷酸序列编码。
在至少一些实施方案中,因子h结合蛋白(fhbp)由包含seqidno:1115或由seqidno:1115组成的多核苷酸序列编码。
在至少一些实施方案中,血红蛋白-触珠蛋白结合蛋白a(hpua)由包含seqidno:923或由seqidno:923组成的多核苷酸序列编码。
在至少一些实施方案中,靶蛋白是包含两种或更多种表面脂蛋白或其部分的融合蛋白。在一些实施方案中,靶蛋白是包含两种或更多种多肽或其部分的融合蛋白,其从选自本文所述的seqidno:seqidno:696至seqidno:1082和seqidno:1178的脂蛋白中的至少两种获得。在另外的实施方案中,靶蛋白是包含从以下获得的部分的融合蛋白:转铁蛋白结合蛋白(tbpb)、乳铁蛋白结合蛋白(lbpb)、因子h结合蛋白(fhbp)和血红蛋白-触珠蛋白结合蛋白(hpua)中的至少两种。在一些实施方案中,靶蛋白是融合多肽,其包含在n-末端处或在c-末端处融合到第二表面脂蛋白的免疫原性部分的第一表面脂蛋白。在具体实施方案中,靶蛋白是seqidno:1102所示的融合多肽。在实施例9中进一步说明了根据本公开使用融合多肽作为靶蛋白的实现方式。
通常,在其中使用tbpb肽的一部分的实施方案中,此部分包含至少(i)tbpb信号肽脂盒,其包括锚定肽(seqidno:1170),和/或(ii)tbpb多肽的c-末端结构域(seqidno:1098)。
虽然本公开提供了相当数量的靶蛋白,但是在不背离本公开的精神的情况下可以根据本公开发现并且使用新的靶蛋白。因此,关于靶蛋白,本公开并非旨在限制,并且可以使用任何靶蛋白以便进行本公开的新型方法。在一个实施方案中,为了发现新的靶蛋白,可以探测与编码slam多肽的基因组区紧邻的基因组区的编码多肽的多核苷酸序列的存在,并且任何鉴定的多肽可以被评估为靶蛋白。因此,在又一个方面,在至少一个实施方案中,本公开提供一种用于鉴定能够通过slam多肽从细胞的细胞溶质转运到细胞外表面的靶蛋白的方法,方法包括:
(a)提供基因组核苷酸序列,其包含
(i)编码slam多肽的第一核苷酸序列;以及
(ii)足够长以编码多肽并且天然连接到第一核苷酸序列的第二核苷酸序列;
(b)评估第二核苷酸序列以鉴定第二核苷酸序列内的多肽编码序列;以及
(c)使用多肽编码序列在包含slam多肽的宿主细胞中表达多肽,以确定蛋白质是否从宿主细胞的细胞溶质转运到细胞外表面,从而鉴定蛋白质是否是靶蛋白。
根据前述内容,可以提供编码slam多肽的任何基因组核苷酸序列。
在一些实施方案中,提供了来自任何微生物基因组的基因组核苷酸序列,包括例如属于以下属的细菌种的基因组:奈瑟氏菌属、克雷伯氏菌属、莫拉氏菌属、曼氏杆菌属、放线杆菌属、嗜血杆菌属、巴斯德氏菌属、不动杆菌属、埃希氏菌属和弧菌属。基因组核苷酸序列的长度可以变化并且可以代表整个基因组或其部分或片段,然而其条件是第一核苷酸序列和第二核苷酸序列是天然连接的,并且其进一步条件是第二核苷酸序列足够长以包含编码多肽的核苷酸序列。
在一些实施方案中,第一核苷酸序列包含选自奇数编号的seqidno:seqidno1至seqidno:695中的任一个的序列。
通常,可以连接在第一核苷酸序列的任一侧或两侧(即相对于slam编码序列的5’或3’)上的第二核苷酸序列,从第一核苷酸序列延伸至少100个核苷酸。第二核苷酸序列也可以更长,例如,它的长度可以是至少250个核苷酸、至少500个核苷酸、至少1,000个核苷酸、至少2,000个核苷酸或至少5,000个核苷酸。在一些实施方案中,基因组核苷酸序列是呈现在能够在视觉上展示核苷酸序列信息的介质上的核苷酸序列的视觉表示,诸如计算机屏幕、平板电脑或手持设备的屏幕、或在纸上的核苷酸序列印出件。为了获得基因组核苷酸序列,可以在从微生物中分离多核苷酸之后提供多核苷酸,并且可以使用本领域熟知的核苷酸测序技术确定多核苷酸的序列,然后可以视觉表示所获得的核苷酸序列用于评估。可以使用本领域熟知的技术和方法评估核苷酸序列并且分析开放阅读框和编码区多肽编码序列的存在,所述技术和方法包括例如能够核酸序列转译的计算机软件诸如expasy(gasteiger,e.;gattiker,a;hoogland,c;ivanyi,i;appel,rd;bairoch,a(2003)."expasy:theproteomicsserverforin-depthproteinknowledgeandanalysis".nucleicacidsresearch.31(13):3784–8)。在鉴定第二核酸内的多肽编码序列后,可以制备包含多肽编码序列的遗传构建体,并且用于在宿主细胞中表达以确定多肽是否从宿主细胞的细胞溶质转运到细胞外表面。可以通过从其天然来源的微生物中分离多肽编码核苷酸序列,并且将其引入适用于在宿主细胞中表达的表达载体来制备遗传构建体。在一些实施方案中,多肽编码核苷酸序列包含基因组核苷酸序列或由基因组核苷酸序列组成。反过来,表达载体可以被引入宿主细胞中。宿主细胞是包含slam多肽的细胞,在一些实施方案中,slam多肽可以天然存在于其中,或在其他实施方案中,可以在宿主细胞中重组表达。在其中多肽编码核苷酸序列包含基因组序列或由基因组序列组成的实施方案中,可以将多肽编码核苷酸序列和编码slam多肽的核苷酸序列同时引入宿主细胞中。在一些实施方案中,宿主细胞是大肠杆菌细胞。如果在宿主细胞生长并且在宿主细胞中表达靶蛋白后,多肽被转运到宿主细胞的细胞外表面以与细胞外表面缔合,则所述多肽是靶蛋白。本公开的前述实施方案在下面实施例8和实施例10中进一步说明。
在至少一些实施方案中,靶蛋白天然存在于宿主细胞中。因此,本公开还提供一种实现天然存在于宿主细胞中的靶蛋白从宿主细胞的细胞溶质到细胞外表面的转运的方法,所述方法包括:
(a)选择包含天然存在于细胞中的靶蛋白的宿主细胞;
(b)提供嵌合多核苷酸,其包含作为可操作连接的组分:
(i)能够控制在宿主细胞中的表达的多核苷酸;以及
(ii)编码slam多肽的多核苷酸;以及
(c)将嵌合核酸序列引入宿主细胞并且使宿主细胞生长以产生slam多肽,并且实现靶蛋白从细胞溶质到细胞外表面的转运。
在至少一些实施方案中,靶蛋白天然存在于选自由以下组成的细菌的组的致病性细菌种的细胞中:脑膜炎奈瑟氏菌、淋病奈瑟氏菌、乳糖奈瑟氏菌、灰色奈瑟氏菌、反硝化克雷伯氏菌、卡他莫拉菌、溶血性曼氏杆菌、胸膜肺炎放线杆菌、睡眠嗜组织菌、流感嗜血杆菌、多杀性巴斯德氏菌、鲍氏不动杆菌或霍乱弧菌。
在至少一些实施方案中,靶蛋白以非共价方式与slam多肽相互作用并且配位。slam多肽与靶蛋白之间的非共价相互作用可导致包含slam多肽和靶蛋白的异二聚体蛋白质复合物的形成。相互作用可以是临时相互作用,例如持续足够长的时间以允许靶多肽从细胞溶质转运到细胞外表面,或更长时间的相互作用,其中slam多肽与靶蛋白之间的非共价相互作用在靶多肽转运到细胞的细胞外膜后仍保留。
在至少一些实施方案中,靶蛋白不天然存在于宿主细胞中。因此,在至少一个实施方案中,本公开还提供一种实现靶蛋白从宿主细胞的细胞溶质到细胞外表面的转运的方法,所述方法包括:
(a)提供第一嵌合多核苷酸,其包含作为可操作连接的组分:
(i)能够控制在宿主细胞中的表达的多核苷酸;以及
(ii)编码slam多肽的多核苷酸;以及
(b)提供第二嵌合多核苷酸,其包含作为可操作连接的组分:
(i)能够控制在宿主细胞中的表达的多核苷酸;以及
(ii)编码靶蛋白的多核苷酸;以及
(b)将第一嵌合多核苷酸和第二嵌合多核苷酸引入宿主细胞并且使宿主细胞生长以产生slam多肽和靶蛋白。
在至少一些实施方案中,靶蛋白共价连接到slam多肽。因此,在至少一个实施方案中,本公开提供一种实现靶蛋白从宿主细胞的细胞溶质到细胞外表面的转运的方法,所述方法包括:
(a)提供嵌合多核苷酸,其包含作为可操作连接的组分:
(i)能够控制在宿主细胞中的表达的多核苷酸;
(ii)编码slam多肽的多核苷酸;以及
(iii)编码靶蛋白的多核苷酸;以及
(b)将嵌合核酸序列引入宿主细胞并且使宿主细胞生长以产生slam多肽,并且实现靶蛋白从细胞溶质到细胞外表面的转运。
在至少一些实施方案中,嵌合多核苷酸以导致靶蛋白的n-末端到slam多肽的c-末端的共价连接的方式(优选通过肽键)来构建。
在至少一些实施方案中,嵌合多核苷酸以导致slam多肽的n-末端到靶蛋白的c-末端的共价连接的方式(优选通过肽键)来构建。
在至少一些实施方案中,嵌合多核苷酸以导致去除slam多肽的一部分和用靶多肽替换其的方式来构建。在一些实施方案中,嵌合多核苷酸以导致去除slam多肽的n-末端的至少1、2、3、4、5、6、7、8、9或10个氨基酸残基和用靶蛋白替换所述残基的方式来构建。在一些实施方案中,嵌合多核苷酸以导致去除slam多肽的c-末端的至少1、2、3、4、5、6、7、8、9或10个氨基酸残基和用靶蛋白替换所述残基的方式来构建。在一些实施方案中,嵌合多核苷酸以导致在slam多肽的多肽序列内插入靶蛋白的方式来构建。在一些实施方案中,嵌合多核苷酸以导致在slam多肽内插入靶蛋白和由靶蛋白替换slam多肽的至少1、2、3、4、5、6、7、8、9或10个氨基酸残基的方式来构建。
在至少一些实施方案中,编码slam多肽的多核苷酸可以是基本上截短的。值得注意的是,可以去除slam多肽的n-末端部分以获得仅由c-末端结构域β-桶状结构域组成、由12-14条外部跨膜链组成的截短slam多肽。可以根据本文使用以实现靶蛋白转运的截短slam多肽的实例在seqid.no:1111和seqidno:1112中示出。
根据其另一方面,在某些实施方案中,本公开提供制备疫苗的方法。因此,在至少一个实施方案中,本公开还提供一种制备疫苗的方法,所述方法包括:
(a)选择能够产生免疫原的宿主细胞
(b)提供嵌合多核苷酸,其包含作为可操作连接的组分:
(i)能够控制在宿主细胞中的表达的多核苷酸;以及
(ii)编码slam多肽的多核苷酸;以及
(c)将嵌合核酸序列引入宿主细胞并且使宿主细胞生长以产生slam多肽和免疫原;以及
(d)使宿主细胞减毒以制备减毒的宿主细胞;以及
(e)制备包含减毒的宿主细胞的疫苗制剂。
在一些实施方案中,宿主细胞是微生物细胞。
在一些实施方案中,宿主细胞是致病性微生物细胞。
在一些实施方案中,宿主细胞是介导感染性疾病的致病性微生物细胞。
在至少一个实施方案中,宿主细胞是选自由以下组成的细胞的组的细胞:脑膜炎奈瑟氏菌、淋病奈瑟氏菌、乳糖奈瑟氏菌、灰色奈瑟氏菌、反硝化克雷伯氏菌、卡他莫拉菌、溶血性曼氏杆菌、胸膜肺炎放线杆菌、睡眠嗜组织菌、流感嗜血杆菌、多杀性巴斯德氏菌、鲍氏不动杆菌和霍乱弧菌。免疫原可以天然存在于宿主细胞中或它可以在宿主细胞中重组表达。为了实现减毒,在产生slam蛋白和免疫原后,以不再能够感染的方式对细胞进行处理。通常,这通过细菌细胞的热灭活或通过产生外膜囊泡来实现。减毒技术通常将是本领域技术人员已知的并且可以例如参见:vaccinationwithattenuatedneisseriameningitidisstrainsprotectsagainstchallengewithlivemeningococci.liy,sunyh,isonc,levinemm,tangcm.infectimmun.2004年1月;72(1):345-51。liy,zhangq,winterbothamm,mowee,gorringea,tangcm.immunizationwithliveneisserialactamicaprotectsmiceagainstmeningococcalchallengeandcanelicitserumbactericidalantibodies.infectimmun.2006;74(11):6348–55。dalsegr,wedegee,holstj,haugenil,
在至少一些实施方案中,本公开提供一种制备疫苗的方法,所述方法包括:
(a)提供第一嵌合多核苷酸,其包含作为可操作连接的组分:
(i)能够控制在宿主细胞中的表达的多核苷酸;
(ii)编码slam多肽的多核苷酸;以及
(b)提供第二嵌合多核苷酸,其包含作为可操作连接的组分:
(i)能够控制在宿主细胞中的表达的多核苷酸;以及
(ii)编码靶蛋白的多核苷酸;以及
(c)将第一嵌合多核苷酸和第二嵌合多核苷酸引入宿主细胞并且使宿主细胞生长以产生slam多肽和靶蛋白;以及
(d)制备包含(c)的细胞的疫苗制剂。
在至少一些实施方案中,本公开提供一种制备疫苗的方法,所述方法包括:
(a)提供嵌合多核苷酸,其包含作为可操作连接的组分:
(i)能够控制在宿主细胞中的表达的多核苷酸;
(ii)编码slam多肽的多核苷酸;以及
(iii)编码靶蛋白的多核苷酸;以及
(b)将嵌合多核苷酸引入宿主细胞并且使宿主细胞生长以产生slam多肽和靶蛋白;以及
(c)制备包含(b)的细胞的疫苗制剂。
在至少一些实施方案中,本公开还提供一种制备针对致病性细菌感染的疫苗的方法,所述方法包括:
(a)提供包含编码slam多肽的核酸序列的致病性菌株;
(b)减弱致病性菌株中的slam产生以获得slam减弱的致病性菌株;以及
(c)使用slam减弱的致病性菌株来配制疫苗。
在优选的实施方案中,致病性菌株是以下的菌株:脑膜炎奈瑟氏菌、淋病奈瑟氏菌、乳糖奈瑟氏菌、灰色奈瑟氏菌、反硝化克雷伯氏菌、卡他莫拉菌、溶血性曼氏杆菌、胸膜肺炎放线杆菌、睡眠嗜组织菌、流感嗜血杆菌、多杀性巴斯德氏菌、鲍氏不动杆菌或霍乱弧菌。
在至少一些实施方案中,致病性菌株是属于奈瑟氏菌属的菌株。根据前述内容,可以使用任何奈瑟氏菌菌株。为了减弱奈瑟氏菌菌株,可以使用任何方法。优选地,使用导致编码slam多肽的基因组多核苷酸序列的减毒或敲除的方法,例如通过转座子诱变。因此,在优选的实施方案中,slam减弱的奈瑟氏菌菌株是其中编码slam多肽的基因组多核苷酸以不产生大量的slam多肽这样的方式突变的奈瑟氏菌菌株,所述突变可以包括去除编码slam多肽的多核苷酸。
另一方面,在至少一个实施方案中,本公开提供一种包含减弱基因组slam多核苷酸序列的致病性菌株。术语“包含减弱基因组slam多核苷酸序列的菌株”意指菌株不能够产生大量的slam多肽。在一些实施方案中,致病性菌株是奈瑟氏菌菌株。这包括包含其中开放阅读框已被中断的多核苷酸的菌株,并且调节slam蛋白表达的菌株不起作用,并且术语进一步旨在包括已从中去除基因组slam编码多核苷酸序列的菌株。因此,本公开还包括缺乏编码slam多肽的基因组多核苷酸序列的突变致病性菌株。在优选的实施方案中,突变的致病性菌株是奈瑟氏菌菌株。根据前述内容,意图是当与天然菌株相比时,突变菌株缺乏至少一个编码slam多肽的基因组多核苷酸。在优选的实施方案中,突变奈瑟氏菌菌株是脑膜炎奈瑟氏菌菌株或淋病奈瑟氏菌菌株。
根据本公开的某些方面,制备一种疫苗制剂。疫苗可用于施用给宿主生物体,所述宿主生物体包括任何人和非人动物,包括但不限于任何牛、猪、马、鼠、犬、猫、鱼、绵羊、山羊、猿猴和禽类动物。因此,另一方面,在至少一个实施方案中,本公开提供一种根据本公开的任何方法制备的疫苗制剂。
另一方面,在至少一个实施方案中,本公开提供一种根据本公开的任何方法制备的疫苗制剂用于使宿主生物体免疫的用途。
在一些实施方案中,疫苗制剂可以用于使宿主生物体对感染性疾病免疫,所述感染性疾病由属于以下属的细菌生物体介导:奈瑟氏菌属、克雷伯氏菌属、莫拉氏菌属、放线杆菌属、嗜血杆菌属、巴斯德氏菌属、不动杆菌属或霍乱弧菌属。
在一些实施方案中,疫苗制剂可以用于使宿主生物体针对感染性疾病免疫,所述感染性疾病由属于以下种的细菌生物体介导:脑膜炎奈瑟氏菌、淋病奈瑟氏菌、乳糖奈瑟氏菌、灰色奈瑟氏菌、反硝化克雷伯氏菌、卡他莫拉菌、溶血性曼氏杆菌、胸膜肺炎放线杆菌、睡眠嗜组织菌、流感嗜血杆菌、多杀性巴斯德氏菌、鲍氏不动杆菌或霍乱弧菌。
在本公开的至少一些实施方案中,疫苗在施用给人时预防由奈瑟氏菌,尤其脑膜炎奈瑟氏菌和淋病奈瑟氏菌引起的感染。根据此,可以使用细胞来制备疫苗制剂,所述细胞是使用本公开的方法制备的。在一些实施方案中,可以使用减毒细胞来制备疫苗制剂。在其他实施方案中,细胞可以用作来源,可以从其中获得某些级分,例如蛋白质级分或膜,并且用于制备疫苗。本公开的疫苗制剂优选还包含媒介物、赋形剂和辅助物质,诸如润湿剂或乳化剂、ph缓冲物质等。这些媒介物、赋形剂和辅助物质通常是不会在受体受试者中诱导免疫应答并且可以施用而无异常毒性的药剂。药学上可接受的赋形剂包括但不限于液体,诸如水、盐水、聚乙二醇、透明质酸、甘油和乙醇。药学上可接受的盐也可以包括在其中,例如,无机酸盐诸如盐酸盐、磷酸盐、硫酸盐等;和有机酸的盐诸如乙酸盐、丙酸盐、苯甲酸盐等。尽管不是所需的,但还优选制剂将含有药学上可接受的赋形剂,所述赋形剂用作稳定剂,特别是为了稳定本公开的多肽。也用作肽的稳定剂的合适的载体的实例包括但不限于医药级的葡萄糖、蔗糖、乳糖、山梨糖醇、肌醇、葡聚糖等。其他合适的载体包括但不限于淀粉、纤维素、磷酸钠或磷酸钙、柠檬酸、甘氨酸、聚乙二醇(peg)以及其组合。为了增加受试者中的免疫应答,本文提供的组合物还优选包含佐剂,诸如药理学试剂、细胞因子等。合适的佐剂包括增强受试者对本公开的免疫原性多肽的免疫应答的任何物质。佐剂的非限制性实例包括细胞因子,例如il-1、il-2、il-12、il-6,并且还包括无机盐,例如氢氧化铝、磷酸铝和磷酸钙;油乳剂,例如矿物油、mf59、qs-21、montamideisa51和isa-720;免疫刺激复合物免疫刺激复合物(isocom),例如iscomatrix;微生物衍生物,例如mpla、巨噬细胞活化蛋白-2、病毒体、lt/ct、cpg;天然聚合物,例如多糖;以及合成聚合物,例如聚酐和聚酯,如在wilson-welder等(wilson-welderjh,torresmp,kippermj,mallapragadask,wannemuehlermj,narasimhanb.2009.vaccineadjuvants:currentchallengesandfutureapproaches.jpharmsci-us98:1278-1316)中所综述的。佐剂可以在施用减毒细胞的同时、之前或之后,例如作为蛋白质或其他大分子来施用。
本公开仍然还提供一种用于鉴定候选化合物的筛选方法,所述候选化合物用于治疗患有由致病性细菌种引起的感染的患者,方法包括:
(a)提供测试化合物;
(b)在功能测定中,比较测试化合物与对照对致病性细菌种中的slam多肽的天然功能的影响;以及
(c)鉴定表现出对slam多肽的天然功能有影响的测试化合物。
在优选的实施方案中,致病性细菌种属于奈瑟氏菌属。
根据前述内容,可以评估化合物对治疗患有奈瑟氏菌感染的患者的效用。通常,这通过提供人们希望测试的一种或多种的化合物和功能测定的性能来实现。所述测定优选为体外测定,并且可以配置成使得可以同时评估多种化合物。功能测定可以是能够检测对slam多肽的天然功能的影响的任何测定。例如,测定可以涉及在化合物存在下,评估靶蛋白到细胞表面的转运,尤其是比较在阴性对照(例如,良性化合物)或阳性对照(即已知对slam蛋白具有影响的化合物)存在下的转运。因此,例如,可以在选择对slam多肽的天然功能表现出影响的化合物后监测tbpb转运,对所选化合物的进一步评估可包括在体外或体内测试中测试所述化合物,包括向人施用化合物
下文提供了用于进行本公开的方法的具体实施方案以及代表本公开的组合物的实施方案的实施例。实施例仅出于说明的目的提供,并且不旨在以任何方式限制本公开的范围。
实施例
实施例1–编码slam多肽(slam1)的多核苷酸的分离
使用ez::tn<kan2>转座子试剂盒(epicentre)进行脑膜炎奈瑟氏菌-b16b6基因组dna的体外转座。将约400ng的超声处理的dna(1-6kb)与10μl的转座酶在100μl反应中混合,并且在37℃下孵育2小时。添加eztn5-停止液并且在70℃下孵育10分钟。通过乙醇沉淀浓缩后,用t4dna聚合酶和t4连接酶修复dna(v.pelicic,s.morelle,d.lampe,x.nassif,journalofbacteriology,182:5391(2000年10月1日))。
通过斑点转化将转座子引入b16b6(t.h.dillard等surg.obes.rel.dis.9:269(2013年1月1日))。简而言之,将反应混合物点在脑心浸液(bhi)板上,其中使用脑膜炎奈瑟氏菌-b16b6菌落在包括斑点的整个板上划线。在37℃与5%co2下孵育板8小时或直到菌落出现。将斑点上生长的脑膜炎球菌铺板在含有卡那霉素(80μg/ml)的bhi板上并且孵育过夜。将转座子突变体收集到微量滴定板中并且在液体bhi中生长6小时,之后在具有20%甘油的bhi中在-80℃下冷冻。
通过斑点印迹筛选转座子突变体的表面tbpb的存在。将全细胞用pbs中的2%甲醛固定,点在硝化纤维素上,用5%脱脂乳封闭,并且用兔抗tbpb抗体孵育。未显示表面tbpb的突变体通过ratepcr(t.f.ducey,dyerd.,epicentreforum9,(2002))或splinkerettepcr(c.j.potter,l.luo,plosone5,e10168(2010年1月1日))来测序。对于ratepcr,将基因组dna与单引物(inv1或inv2)混合用于三步pcr反应,所述反应由第一轮严格退火温度、第二轮低退火温度和第三轮严格退火温度组成。所得产物用kanf或kanr引物进行测序。对于splinkerettepcr,基因组dna分别被限制酶(bsty1、bglii或hindiii)消化,产生可连接到spinkerette寡核苷酸的粘性端。所得产物用于两个巢式pcr以扩增tn5插入与splinkerette之间的基因组序列。所述产物与另一种巢式引物一起用于测序。使用前述方法,获得seqidno:385所述的编码slam1组的多核苷酸。
对于以下质粒构建体采用无限制克隆(fvandenent,j.lowe,journalofbiochemicalandbiophysicalmethods(2006年1月1日))。简而言之,为了用卡那霉素盒替换nmb0313orf,使用f1(puc19ompu476rf)和r1(puc19-ompurev)将含有nmb0313和nmb0313上游和下游500bp的大约2500bp片段克隆到puc19中。使用引物f2(f-rf-ompudkan)和r2(r-rf-ompudkan)扩增来自ez::tn转座子试剂盒的kan2,并且所得的大引物用于代替二次rf反应中的nmb0313orf。所得质粒用于wtb16b6中的斑点转化。在含有卡那霉素(80μg/ml)的bhi板上选择敲除,并且使用侧接nmb0313的引物通过pcr验证。
使用引物f3(f-rf-pgompu)和r3(r-rf-pgompu),通过将nmb0313基因克隆到pgcc4(i.j.mehr,c.d.long,c.d.serkin,h.s.siefert,genetics,154,523(2000年2月1日))(来自h.siefert的赠与)的paci/fsei位点中构建互补载体pslam。通过用含有his标签的磷酸化的引物f4(f-ompu-hisphos)和r4(r-ompu-hisphos)扩增整个载体并且连接产物,在信号肽后插入his标签。通过红霉素(30μg/ml)板上的斑点转化和选择,敲除和转座子突变体与pslam互补。通过pcr验证nmb0313的插入。通过在1mmiptgbhi板上生长菌落诱导表达,并且通过抗his蛋白质印迹验证。
实施例2–第一slam多肽(slam1)的纯化
如图1所概述,纯化slam多肽。将nmb0313及其同源物克隆到pet26中,并且与n-末端pelb信号肽一起表达,后面是不可切割的7xhis标签。将质粒转化到大肠杆菌bl21-c43细胞中并且在37℃下与50μg/ml卡那霉素在luria肉汤(lb)中生长到od600为0.8,在此时通过添加异丙基β-d-1-硫代半乳糖苷(iptg)到1mm的最终浓度来诱导蛋白质表达。在37℃下使细胞再生长18小时并且通过在4000xg下离心收获。洗涤细胞并且重新悬浮在100ml裂解缓冲液(50mm磷酸钾,ph7.5和0.2mmpmsf)/5g细胞中。通过在冰上超声处理进行细胞裂解,在溶菌酶和dna酶存在下进行四次30秒脉冲。通过在10,000xg下离心20分钟去除未裂解的细胞。然后在95,834xg下离心裂解物1小时以分离膜级分。洗涤沉淀物并且重新悬浮在50ml萃取缓冲液(50mm磷酸钾,ph7.5和3%elugent(millipore))/5g裂解的细胞中。在4℃下进行萃取过夜。在95,834xg下离心40分钟后,将溶解的蛋白质通过0.45μm过滤器,并且加载到用缓冲液a(50mm磷酸钾、0.6%c8e4(affymetrix))平衡的1mlni-nta树脂柱(ge)上。通过将缓冲液a与缓冲液b(50mm磷酸钾、0.6%c8e4、400mm咪唑)混合来制得咪唑梯度。用20mm、60mm和80mm咪唑洗涤柱,并且将所需蛋白质洗脱在260mm咪唑中。通过sds-page验证纯度,并且使用在20mmhepes(ph8)、150mmnacl、0.6%c8e4中平衡的24mlsuperdex-200(ge),通过尺寸排阻色谱法实现进一步纯化。从sephadex-200收集含有5h3nmb0313的单峰,并且使用50kda浓缩器(millipore)以6mg/ml浓缩。结果示于图2中。
实施例3–鉴定编码slam多肽(包括slam2)的其他多核苷酸。
使用slam1蛋白质序列(seqidno:385)作为模板进行a_blastp研究。然后过滤所得物以从相同生物体的多个菌株中去除slam命中,并且保持顶部命中。多重序列比对和系统发育树(邻接)构建使用geneiousr7(biomatters,http://www.geneious.com/)进行。使用内置的引导程序模块对树进行了100次重新采样。在包含slam命中的每个基因组中搜索fhbp、tbpb和lbpb同源物,并将其添加到系统发育树中。系统发育树示于图3中。参考图3,slam同源物(通过细菌基因组的blast搜索鉴定的)聚类成三个组。第1组(浅灰色,顶部)中的slam同系物属于奈瑟氏菌属和卡他莫拉菌,而第2组(中灰色,中部)含有来自γ-变形菌门的巴斯德氏菌科的不同成员。第3组(深灰色,底部)仅含有neisseriashayeganii。为清楚起见,所述树已缩略;不包括来自单一种的多次命中,并且去除步长值(bootstrapvalue)。在其基因组中具有tbpb、lbpb或fhbp同源物的种分别用圆形、正方形和三角形表示。脑膜炎奈瑟氏菌的第二slam多肽slam2的多核苷酸序列在本文示出为seqidno:387。
实施例4–第二slam多肽(slam2)的纯化
使用如在实施例2中所进一步描述的方法,纯化脑膜炎奈瑟氏菌的第二slam多肽(slam2;seqidno:387)。图4示出了所获得的结果。
实施例5–使用完整和截短的slam1多肽的表面脂蛋白易位
使用脑膜炎奈瑟氏菌slam敲除菌株δmnb0313来评估表面脂蛋白(slp)的易位。使用全长slam多肽和slam多肽的n-末端部分和c-末端部分。n-末端部分和c-末端部分示于图5a中。流式细胞术(图5b)和蛋白酶k消化(图5c)实验揭示,在slam敲除菌株中观察到的slp易位缺陷仅可以用c-末端β-桶状结构域(氨基酸204-488)挽救。slam的n-末端结构域(ntd)(氨基酸32-203)不提供任何slp易位活性。针对每个样品测量平均荧光强度,并且将从野生型细胞获得的信号设定为100%以用于与来自敲除和单个结构域互补细胞的信号比较。误差棒代表来自三次实验的平均值标准误差(sem)。a*表示结果在p<0.05下显著不同。
实施例6–大肠杆菌中的slam和表面脂蛋白tbpb、lbpb和fhbp的共表达
从脑膜炎奈瑟氏菌血清型b菌株b16b6的基因组扩增tbpb和nmb0313基因。从脑膜炎奈瑟氏菌血清型b菌株mc58扩增lbpb基因。使用无限制克隆((fvandenent,j.lowe,journalofbiochemicalandbiophysicalmethods(2006年1月1日)).),将全长tbpb插入petduet的多克隆位点2中。将nmb0313插入pet26中,其中天然信号肽被pelb的所述天然信号肽替换。使用定点诱变和无限制克隆分别对这些载体进行突变和截短。将载体对转化到大肠杆菌c43中,并且在补充有卡那霉素(50μg/ml)和氨苄青霉素(100μg/ml)的lb琼脂板中生长过夜。
从卡他莫拉菌菌株o35e和流感嗜血杆菌菌株86-028np的基因组扩增tbpb基因,并且通过如上的无限制克隆将其克隆到pet52b质粒。也使用无限制克隆,将相应的slam(卡他莫拉菌slam1、流感嗜血杆菌slam1)插入pet26b中。将6his标签插入如上的pelb与成熟slam序列之间。将载体转化到如上的大肠杆菌c43中。
通过在4000g下离心收获细胞,并且用1mlpbs洗涤两次以去除任何剩余的生长培养基。然后用0.05-0.1mg/ml生物素化的人转铁蛋白(sigma-aldricht3915-5mg)、α-tbpb(针对卡他莫拉菌和流感嗜血杆菌,来自兔血清的1:200稀释物;针对脑膜炎奈瑟氏菌,来自兔血清的1:10000稀释物)或α-lbpb(来自j.lemieux的赠与获得的兔血清的1:10000稀释物)或a-fhbp(鼠的1:5000稀释物,来自d.granoff的赠与)在4℃下孵育细胞1.5小时,接着用1ml的pbs洗涤两次。然后用r-藻红蛋白缀合的链霉亲和素(0.5mg/mlcedarlane)或r-藻红蛋白缀合的抗兔igg(原种0.5mg/mlrockland)以25ug/ml在4℃下孵育1.5小时。然后用1mlpbs洗涤细胞,并且重新悬浮在200ul固定溶液(pbs+2%甲醛)中,并且放置20分钟。最后,用2x1mlpbs洗涤细胞,并且转移到5ml聚苯乙烯facs管。针对pe荧光,使用bectondickinsonfacscalibur测量每个样品的pe荧光。使用flowjo软件分析结果,并且将其呈现为每个样品的平均荧光强度(mfi)。对于脑膜炎奈瑟氏菌实验,通过将野生型荧光信号归一化到100%来将所有样品与野生型菌株比较。误差棒代表通过三次实验的平均值标准误差(sem)。使用graphpadprism5软件对结果进行统计学分析作图。针对slp,示于图6tbpb(图6a)、lbpb(图6b)和fhbp(图6c)中的结果证明,slam影响在大肠杆菌中的所有三种slp多肽的易位。示于图10中的结果证明,在大肠杆菌中来自卡他莫拉菌(图10c)和流感嗜血杆菌(图10d)的tbpb易位要求所需slam蛋白共表达(slam是奈瑟氏菌属中表面展示脂化毒力因子所需的外膜蛋白。hooday,laicc,judda,buckwaltercm,shinhe,gray-owensd,moraestf.natmicrobiol.2016年2月29日;1:16009)。
实施例7–降低包含减弱slam基因的奈瑟氏菌菌株的毒力
如由gorringea.r.,reddin,k.m.,voetp.和poolmanj.t.(methodsmol.med.66,241(2001年1月1日))和johswich,k.o.等(infect.immun.80,2346(2012年7月1日))所述,进行脓毒症建模。通过用脑膜炎奈瑟氏菌菌株b16b6、b16b6δtbpb或b16b6δnmb0313腹膜内注射来接种6个八周龄c57bl/6小鼠(charlesriverlaboratories)的组(n=2次独立的实验)。为了制备接种物,使用于感染的菌株在gc琼脂上生长过夜,重新悬浮,然后在37℃下伴随振荡在10ml的脑心浸液(bhi)培养基中生长4小时。调节培养物,使得每个最终500μl接种物含有1x106个菌落形成单位和10mg人全铁转铁蛋白。在感染前48小时开始到感染后48小时至少每12小时监测小鼠的体重、临床症状和菌血症的变化。基于以下临床症状的严重性,以0-2的尺度对小鼠进行评分:理毛、姿势、眼鼻外观、呼吸、脱水、腹泻、无端行为以及挑衅行为。将达到终点标准的动物人道地安乐死。根据多伦多大学动物伦理审查委员会(animalethicsreviewcommitteeoftheuniversityoftoronto)进行动物实验。
图7示出了获得的结果。图7a示出了由脑膜炎奈瑟氏菌细胞组成的固相结合测定,所述细胞用多聚甲醛(pfa)固定或用sds裂解并且点到硝化纤维素上并且用α-tbpb抗体探测。δslam/tn5是指通过转座子插入获得的slam缺陷细胞的原始菌株。δslam描述了通过用卡那霉素抗性盒替换slamorf获得的脑膜炎奈瑟氏菌中的slam敲除。图7b示出了蛋白酶k消化测定,所述测定示出了当nm细胞是slam缺陷(δslam)的时,仅有tbpb、lbpb和fhbp降解。用蛋白酶k孵育表达单独的各个slp和具有slam的slp的nm细胞,并且使用蛋白质印迹来检测具有和不具有蛋白酶消化的所有三种slp水平的水平(-/+)。流式细胞术用于确认δslam细胞不能在细胞表面上展示出tbpb(图7c)或fhbp(图7d)。针对tbpb和fhbp的抗体用于结合表面暴露的slp,然后用连接到藻红蛋白的α-兔抗体孵育以提供荧光。使用bdfacscalibur的fl2检测器测量每个样品的平均荧光强度(mfi)。将从野生型细胞获得的信号设定为100%,用于与来自敲除细胞的信号进行比较。误差棒代表来自三次实验的平均值标准误差(sem)。图7e中示出的是用各种菌株进行小鼠感染的结果。通过用1x106cfu的野生型脑膜炎奈瑟氏菌菌株b16b6、敲除tbpb的b16b6(δtbpb)或敲除nmb0313δslam的b16b6腹膜内注射来感染小鼠,并且在感染前48小时开始到感染后48小时每12小时监测存活率和疾病症状,并且在感染后3小时额外地监测。通过mantel-cox对数秩测试(graphpadprism5)评价存活率的统计学差异(*p<0.05,n.s.不显著)。这些结果示出了敲除nmb0313δslam菌株的感染小鼠中感染后死亡率的显著降低。
实施例8:在多杀性巴斯德氏菌中鉴定新型slam依赖性表面脂蛋白
在选择其中鉴定出slam同源物的给定细菌种的基因组时,优选考虑的是含有完整测序基因组的基因组。使用迭代blast搜索将slam同源物鉴定为与奈瑟氏菌密切相关的种到更远亲的种。对于在这些种中鉴定的每种slam同源物,相应的基因组记录(ncbi基因组)用于鉴定上游和下游基因连同其相应功能注释(ncbi蛋白质数据库,ensembl细菌)。在少数情况下,没有预测slam基因上游或下游的基因,因为它们分别太接近于重叠群的起点或终点,因此忽略了这些序列。
分析相邻基因的1)n-末端脂盒基序(使用lipop,signalp预测)和2)tbp样溶质结合蛋白(interpro特征:ipr或ipr011250)或pagp-β桶状物(interpro特征:ipr011250)折叠。如果它们含有这些元件,我们将相邻基因鉴定为潜在的slam依赖性表面脂蛋白。
使用奈瑟氏菌slam作为搜索,在多杀性巴斯德氏菌中鉴定出推定的slam(pm1515,seqidno:1087)。推定的slam(pm1515,seqidno:1087)与新预测的具有未知功能的脂蛋白基因(pm1514,seqidno:1083)相邻(图11a)。推定的slam展示出与脑膜炎奈瑟氏菌slam1的32%同一性,而slp未示出与已知的slam依赖性奈瑟氏菌slp的序列相似性。
如前所述,将推定的slam(pm1515,seqidno:1087)及其相邻的脂蛋白(pm1514,seqidno:1083)分别克隆到pet26b和pet52b中并且转化到大肠杆菌c43,并且在补充有卡那霉素(50ug/ml)和氨苄青霉素(100ug/ml)的lb琼脂上生长过夜。
在37c下使细胞在自动诱导培养基中生长18小时,然后收获,用含有1mmmgcl2的pbs洗涤两次,并且在4c下用α-flag(1:200,sigma)标记1小时。然后用含有1mmmgcl2的pbs洗涤细胞两次,然后在4c下用r-pe缀合的α-小鼠igg(25ug/ml,thermofisherscientific)标记1小时。染色后,用2%甲醛固定细胞20分钟,并且用含有1mmmgcl2的pbs进一步洗涤。bectondickinsonfacscalibur进行流式细胞术,并且使用flowjo软件分析结果。使用至少三次重复计算的平均荧光强度(mfi)用于比较含有或缺乏推定slam(pm1515)的菌株中的脂蛋白的表面暴露,并且示于图11c和图11d中。可以在大肠杆菌的表面上检测到pm1514,从而说明i)slam可以用于鉴定slp并且ii)需要slam来将这些slp易位到细胞的表面–从而鉴定出称为“slam依赖性表面脂蛋白”的一类蛋白质。针对纯化的pmslp(pm1514),抗体上升,并且通过pk修剃测定,示出蛋白质处于多杀性巴斯德氏菌的表面上。
实施例9:鉴定slam依赖性表面脂蛋白的易位基序和在slam特异性中的作用。
所使用的最小结构域和结构域交换构建体是petduethpua(seqidno:1099)、tbpbn端小叶(seqidno:1095)、tbpbc端小叶(seqidno:1097)和tbpbn端小叶-hpua(seqidno:1101)。使用无限制克隆,扩增成熟hpua并且插入在具有tbpb的信号肽的框中,并且同时替换petduettbpb中的tbpb基因的其余部分以产生petduethpua。基于脑膜炎奈瑟氏菌菌株b16b6tbpb结构(pdbid4qq1)剖析锚定肽(氨基酸1-40)、tbpb的n端小叶(氨基酸41-331)和tbpb的c端小叶(氨基酸332-579)。使用petduettbpb作为模板,使用反向克隆以在tbpb的n端小叶与c端小叶之间插入终止密码子来克隆n端小叶构建体。使用无限制克隆以插入并且同时替换petduettbpbn端小叶中的tbpbn端小叶来克隆tbpb的c端小叶。将c端小叶插入在具有锚定肽的框中。通过无限制克隆,通过将hpua(2端氨基酸)插入在具有petduettbpbn端小叶的n端小叶的框中来克隆融合构建体petduettbpbn端小叶-hpua。使用petduettbpb作为模板,使用fastcloning产生poly-ala突变。使用含有slam1或slam2的载体。
将质粒转化到大肠杆菌c43(de3)细胞中并且在37c下在自动诱导培养基中生长18小时。收获细胞,用含有1mmmgcl2的pbs洗涤两次,并且在4c下用α-tbpb抗体(1:200,兔血清)或生物素化的人转铁蛋白(0.05mg/ml,sigma)标记1小时。然后用含有1mmmgcl2的pbs洗涤细胞两次,然后在4c下用r-fitc缀合的α-兔igg(25ug/ml,thermofisherscientific)标记1小时。染色后,用2%甲醛固定细胞20分钟,并且用含有1mmmgcl2的pbs进一步洗涤。用bectondickinsonfacscalibur进行流式细胞术,并且使用flowjo软件分析结果。使用至少三次重复计算平均荧光强度,并且用于比较不同菌株之间给定slp的表面暴露。tbpb的c端小叶似乎是slam1依赖性易位到大肠杆菌的表面(图12b)所需的,而n端小叶似乎并没有发挥重要作用。此外,使用融合到tbpbn端小叶的hpua将slam依赖性从slam1转移到slam2(图12c-e)。
使用上述方法,探测了八条β-桶状链中的四条在表面脂蛋白的表面展示中的重要性。脑膜炎奈瑟氏菌tbpb的两条β-桶状链(链b30(seqidno:1107)和b31(seqidno:1109))的突变示出是tbpb的表面表达所需的(图13c和图13d)。
在来自脑膜炎奈瑟氏菌、淋病奈瑟氏菌、卡他莫拉菌、流感嗜血杆菌和胸膜肺炎放线杆菌的tbpb的c端小叶;来自脑膜炎奈瑟氏菌和乳糖奈瑟氏菌的lbpb的c端小叶;以及来自脑膜炎奈瑟氏菌、淋病奈瑟氏菌和反硝化克雷伯氏菌的hpua的八链桶状结构域的最后两条链上进行多序列比对。如图13e中所示,链b30示出具有保守的[l/m]ggx[f/i/v]序列并且链b31似乎具有保守的φx[a/t/v]fg[a/g]序列。
实施例10:在鲍氏不动杆菌中鉴定新型slam依赖性表面脂蛋白
鲍氏不动杆菌是一种条件性病原体,并且在重症监护患者和免疫功能低下或患有潜在疾病的那些人中引起疾病(camp,c.&tatum,o.l.lab.med.41,649–657(2010))。鲍氏不动杆菌引起各种临床表现,诸如肺炎、脓毒病和尿路感染。它在战区医院获有引起软组织感染的恶名。多重耐药鲍氏不动杆菌对治疗医生提出重大挑战并且对人健康提出威胁,因为鲍氏不动杆菌对临床中使用的许多抗生素具有抗性(camp,c.&tatum,o.l.lab.med.41,649–657(2010))。
使用nmslam作为原始查询序列的迭代blast搜索,在鲍氏不动杆菌中的基因簇中鉴定出slam样蛋白质(abslam)(图14a)(seqidno:1177和1178)。虽然这个基因簇最初由antunes等在寻找涉及铁获取的基因时发现,但是slam基因被错误注释为假设蛋白(antunes,l.c.s.,imperi,f.,towner,k.j.&visca,p.res.microbiol.162,279–284(2011))。与slam基因相邻的是编码未知功能的脂蛋白(abslp)的基因。该预测由蛋白质n-末端处存在的脂盒基序(lvac)支持。
我们已经使用流式细胞术证明可以在大肠杆菌中外源表达abslp,并且仅在与abslam共表达时定位到细胞表面(图14b)。此外,abslp的结构通过x射线晶体学解决(图14c)。abslp包含n-末端β-手柄状物和c-末端8链β-桶状物,所述β-手柄状物由8条反平行β-链组成。结构示出了abslp是与已知slam依赖性slp(tbpb、lbpb、hpua)(图1b-c和图2)的结构具有高度结构相似性的血红素结合蛋白。用其slam表达abslp导致abslp在大肠杆菌中的表面展示(图14b)。针对abslp的抗体上升,并且通过蛋白酶k修剃说明abslp位于鲍氏不动杆菌(lac4)的表面上(图14d)。
通过相邻slam基因的存在发现新型slpabslp说明了slam对鉴定位于slam基因附近的潜在疫苗抗原slp的效用。
虽然已经参考目前被认为是优选的实施例的内容描述了本公开,但是应该理解,本公开不限于所公开的实施例。相反,本公开旨在覆盖包括在所附权利要求的精神和范围内的各种修改和等同布置。
所有出版物、专利以及专利申请以引用的方式整体并入本文,达到如同每个单独的出版物、专利或专利申请被专门地并且单独地指示以引用的方式整体并入的相同程度。
- 还没有人留言评论。精彩留言会获得点赞!