多特异性和多功能分子及其用途的制作方法
背景技术:
披露了包含肿瘤靶向部分和以下中的一种、两种或全部的多特异性分子:免疫细胞衔接子(engager)、细胞因子分子或基质修饰剂,以及使用所述多特异性分子的方法。本文还披露了包含基质修饰部分和肿瘤靶向部分的多功能分子;并且公开了使用所述多功能分子的方法。
技术实现要素:
本披露尤其涉及新颖的多特异性或多功能分子,所述分子包含(i)肿瘤靶向部分;以及以下中的一种、两种或全部:(ii)免疫细胞衔接子(例如,选自nk细胞衔接子、t细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子);(iii)细胞因子分子;和/或(iv)基质修饰部分。在一些实施例中,所述多特异性分子包含(i)基质修饰部分和(ii)与肿瘤抗原或基质抗原结合的肿瘤靶向部分(例如,抗体分子、配体分子、或受体分子)。术语“多特异性”或“多功能”在本文中可互换地使用。
不希望受理论束缚,预期本文披露的多特异性或多功能分子靶向(例如,定位、桥接和/或激活)癌细胞处的免疫细胞(例如,选自nk细胞、t细胞、b细胞、树突细胞或巨噬细胞的免疫效应细胞),和/或改变肿瘤基质(例如,改变癌症位点附近的肿瘤微环境)。预期使用本文描述的多特异性分子增加免疫细胞的接近度和/或活性增强针对癌细胞的免疫应答,从而提供更有效的癌症疗法。不受理论束缚,据信针对癌细胞的靶向的局部的免疫应答降低本文描述的多特异性分子的全身毒性的作用。因此,本文尤其提供了包含前述部分的多特异性分子(例如,多特异性或多功能抗体分子)、编码所述多特异性分子的核酸、产生前述分子的方法、以及使用前述分子靶向癌症的方法。
因此,在一方面,本披露的特征在于多特异性或多特异性分子(例如,多肽或编码所述多肽的核酸),所述特异性或多特异性分子包含:
(i)与癌抗原结合的肿瘤靶向部分,例如第一肿瘤靶向部分;以及
以下中的一种、两种或全部:
(ii)选自nk细胞衔接子、t细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子的免疫细胞衔接子;
(iii)细胞因子分子;和
(iv)基质修饰部分。
在前述分子的一些实施例中:
如果(ii)和(iii)不存在,则存在(i)和(iv),
如果存在一种(i)和一种(ii),则存在(iii)或(iv)或两者,或者
如果存在一种(i)和一种(iii),则存在(ii)或(iv)或两者。
在一些实施例中,所述多特异性或多功能分子包含(i)、(ii)以及(iii)和(iv)中的一种或两种。
在一些实施例中,所述多特异性或多功能分子包含(i)、(iii)以及(ii)和(iv)中的一种或两种。
在一些实施例中,所述多特异性或多功能分子包含(i)、(ii)和(iii)。在其他实施例中,所述多特异性或多功能分子包含(i)、(ii)和(iv)。
在还另一个实施例中,所述多特异性或多功能分子多肽包含(i)、(ii)、(iii)和(iv)。
在另一方面,本文提供了包含以下的多特异性或多功能分子多肽:
(i)与一种或多种癌抗原结合的至少两种肿瘤靶向部分,例如第一和第二肿瘤靶向部分;以及
以下中的一种、两种或全部:
(ii)选自nk细胞衔接子、t细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子的免疫细胞衔接子;
(iii)基质修饰部分;和
(iv)细胞因子分子,例如包含至少两个不连续多肽的细胞因子分子(例如,多链细胞因子)。在一些实施例中,所述细胞因子分子包含两条链,例如α链和β链(例如,il-12)。
在一些实施例中,所述至少两种肿瘤靶向部分(例如,第一和第二肿瘤靶向部分)与相同或不同癌抗原结合。
在一些实施例中,所述多特异性或多功能分子包含如本文描述的一种或两种免疫细胞衔接子。在一个实施例中,所述一种或两种免疫细胞衔接子包括结合至和/或抑制检查点分子的抗体分子,所述检查点分子选自以下中的一种或两种:ctla4、pd1、pd-l1、pd-l2、tim3、lag3、cd160、2b4、cd80、cd86、b7-h3(cd276)、b7-h4(vtcn1)、hvem(tnfrsf14或cd270)、btla、kir、mhci类、mhcii类、gal9、vista、btla、tigit、lair1、或a2ar。在一个实施例中,所述多特异性或多功能分子包含针对一种免疫细胞衔接子(例如,检查点结合剂)的两种肿瘤靶向部分。在一个实施例中,所述多特异性或多功能分子包含针对两种免疫细胞衔接子(例如,两种检查点结合剂(例如,相同或不同的检查点结合剂))的两种肿瘤靶向部分。
在一些实施例中,所述第一肿瘤靶向部分与cd123结合,所述第二肿瘤靶向部分与cd47结合,并且所述t细胞衔接子是或包含cd3激动剂。
在还另一方面,所述多功能(例如,双功能)分子包含基质修饰部分和与肿瘤抗原或基质抗原结合的肿瘤靶向部分(例如,抗体分子、配体分子、或受体分子)。
在任何前述多特异性或多功能分子的实施例中,所述分子可以进一步包含第二肿瘤靶向部分。在实施例中,所述第二肿瘤靶向部分与所述第一肿瘤靶向部分(例如,(i)中的肿瘤靶向部分)和相同或不同的癌抗原结合。所述第二肿瘤靶向部分与所述第一肿瘤靶向部分和相同的癌抗原上的不同表位结合。在其他实施例中,所述第二肿瘤靶向部分与所述第一肿瘤靶向部分和不同的癌抗原结合。所述不同的癌抗原可以存在于相同的细胞或肿瘤组织上,或者可以存在于不同的细胞或肿瘤组织上。
不希望受理论束缚,据信在引起免疫应答之前,通过将免疫治疗剂主要地引导至肿瘤和/或基质可以来管理(例如,减小)免疫治疗剂(如本文描述的多特异性分子)的全身毒性。此作用可以通过平衡所述一种或多种肿瘤靶向部分的亲和力高于所述一种或多种免疫细胞衔接子和/或所述一种或多种细胞因子的亲和力来实现。在一些实施例中,与所述多特异性分子(例如,所述一种或多种免疫细胞衔接子和/或一种或多种细胞因子)对对应的免疫效应细胞的亲和力(例如,组合亲和力)相比,所述一种或多种肿瘤靶向部分对肿瘤和/或基质细胞的亲和力(例如,组合亲和力)高至少10倍。可以使用本领域已知的技术测量组合亲和力。例如,使用基于spr的测定,其能够在单一设置中评估二价双特异性分子的结合活性,例如,如描述在meschendoerfer,w.等人(2017)jpharmbiomedanal.[药学和生物医学分析杂志]5;132:141-147.doi:10.1016/j.jpba.2016.09.028.epub2016年9月26日。
因此,在所述多特异性或多功能分子的一些实施例中,所述第一肿瘤靶向部分和所述第二肿瘤靶向部分对所述癌抗原的亲和力(例如,组合亲和力)等于或大于(ii)、(iii)或(iv)(单独的或作为所述多特异性分子的一部分)对其对应的结合成员的亲和力。例如,所述第一肿瘤靶向部分和所述第二肿瘤靶向部分对所述癌抗原的亲和力(例如,组合亲和力)比(ii)、(iii)或(iv)(单独的或作为所述多特异性分子的一部分)对其对应的结合成员的亲和力大至少2倍、5倍、10倍、20倍、30倍、40倍、50倍、75倍或100倍。
在所述多特异性或多功能分子的还其他实施例中,所述第一肿瘤靶向部分和所述第二肿瘤靶向部分对肿瘤(例如,癌细胞或基质细胞)的亲和力(例如,组合亲和力)等于或大于仅具有所述肿瘤靶向部分或所述第二肿瘤靶向部分之一的相似的多特异性或多功能分子多肽的亲和力。例如,所述第一肿瘤靶向部分和所述第二肿瘤靶向部分对肿瘤(例如,癌细胞或基质细胞)的亲和力(例如,组合亲和力)比仅具有所述肿瘤靶向部分或所述第二肿瘤靶向部分之一的相似的多特异性或多功能分子多肽的亲和力大至少2倍、5倍、10倍、20倍、30倍、40倍、50倍、75倍或100倍。
在另一方面,本文提供了包含以下的多特异性或多功能分子多肽:
a,b-[二聚化模块]-c,-d
其中:
(1)所述二聚化模块包含免疫球蛋白恒定结构域,例如重链恒定结构域(例如,同源二聚体或异源二聚体重链恒定区,例如fc区)、或免疫球蛋白可变区的恒定结构域(例如,fab区);并且
(2)a、b、c、和d独立地不存在;是(i)肿瘤靶向部分,例如第一和/或第二肿瘤靶向部分;(ii)选自nk细胞衔接子、t细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子的免疫细胞衔接子;(iii)细胞因子分子;或(iv)基质修饰部分。
在一些实施例中,所述多特异性或多功能分子多肽包含:
(i)与癌抗原结合的所述肿瘤靶向部分,例如第一肿瘤靶向部分;以及
以下中的一种、两种或全部:
(ii)选自nk细胞衔接子、t细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子的免疫细胞衔接子;
(iii)细胞因子分子;和
(iv)基质修饰部分。在一些实施例中,
如果(ii)和(iii)不存在,则存在(i)和(iv),
如果存在一种(i)和一种(ii),则存在(iii)或(iv)或两者,或者
如果存在一种(i)和一种(iii),则存在(ii)或(iv)或两者。
示例性的多特异性或多功能分子包括以下:
(i)a包含第一肿瘤靶向部分,b包含第二肿瘤靶向部分,c包含第一免疫细胞衔接子,并且d包含第二免疫细胞衔接子(例如,a和b包含相同或不同的靶向部分,并且c和d包含相同或不同的免疫细胞衔接子);
(ii)a包含第一肿瘤靶向部分,b包含第二肿瘤靶向部分,c包含第一细胞因子分子,并且d包含第二细胞因子分子(例如,a和b包含相同或不同的靶向部分,并且c和d包含相同或不同的细胞因子分子);
(iii)a包含第一肿瘤靶向部分,b包含第二肿瘤靶向部分,c包含第一基质修饰部分,并且d包含第二基质修饰部分(例如,a和b包含相同或不同的靶向部分,并且c和d包含相同或不同的基质修饰部分);
(iv)a包含第一肿瘤靶向部分,b包含第二肿瘤靶向部分,c包含免疫细胞衔接子,并且d包含细胞因子分子(例如,a和b包含相同或不同的靶向部分);
(v)a包含第一肿瘤靶向部分,b包含第二肿瘤靶向部分,c包含细胞因子分子,并且d包含免疫细胞衔接子(例如,a和b包含相同或不同的靶向部分);
(vi)a包含第一肿瘤靶向部分,b包含第二肿瘤靶向部分,c包含免疫细胞衔接子,并且d包含基质修饰部分(例如,a和b包含相同或不同的靶向部分);
(vii)a包含第一肿瘤靶向部分,b包含第二肿瘤靶向部分,c包含基质修饰部分,并且d包含免疫细胞衔接子(例如,a和b包含相同或不同的靶向部分);
(viii)a包含第一肿瘤靶向部分,b包含第二肿瘤靶向部分,c包含细胞因子分子,并且d包含基质修饰部分(例如,a和b包含相同或不同的靶向部分);
(ix)a包含第一肿瘤靶向部分,b包含第二肿瘤靶向部分,c包含基质修饰部分,并且d包含细胞因子分子(例如,a和b包含相同或不同的靶向部分);
(x)a包含肿瘤靶向部分,并且b、c、和d中的至少一个、两个、或三个包含第二肿瘤靶向部分、免疫细胞衔接子、细胞因子分子、基质修饰部分,或不存在,条件是如果不存在(ii)和(iii),则存在(i)和(iv);
(xi)b包含肿瘤靶向部分,并且a、c、和d中的至少一个、两个、或三个包含第二肿瘤靶向部分、免疫细胞衔接子、细胞因子分子、基质修饰部分,或不存在,条件是如果不存在(ii)和(iii),则存在(i)和(iv);
(xii)c包含肿瘤靶向部分,并且a、b、和d中的至少一个、两个、或三个包含第二肿瘤靶向部分、免疫细胞衔接子、细胞因子分子、基质修饰部分,或不存在,条件是如果不存在(ii)和(iii),则存在(i)和(iv);
(xiii)d包含肿瘤靶向部分,并且a、b、和c中的至少一个、两个、或三个包含第二肿瘤靶向部分、免疫细胞衔接子、细胞因子分子、基质修饰部分,或不存在,条件是如果不存在(ii)和(iii),则存在(i)和(iv);
(xiv)a包含第一肿瘤靶向部分,b包含第二肿瘤靶向部分,c和d分别是免疫细胞衔接子和不存在;
(xv)a包含第一肿瘤靶向部分,b包含第二肿瘤靶向部分,c和d分别是不存在和免疫细胞衔接子;
(xvi)a包含第一肿瘤靶向部分,b包含第二肿瘤靶向部分,c和d分别是细胞因子分子和不存在;
(xvii)a包含第一肿瘤靶向部分,b包含第二肿瘤靶向部分,c和d分别是不存在和细胞因子分子;
(xviii)a包含第一肿瘤靶向部分,b包含第二肿瘤靶向部分,c和d分别是基质修饰部分和不存在;
(xix)a包含第一肿瘤靶向部分,b包含第二肿瘤靶向部分,c和d分别是不存在和基质修饰部分;
(xx)a包含肿瘤靶向部分,并且b、c或d之一包含基质修饰部分;
(xxi)b包含肿瘤靶向部分,并且a、c或d之一包含基质修饰部分;
(xxii)c包含肿瘤靶向部分,并且a、b或d之一包含基质修饰部分;
(xxiii)d包含肿瘤靶向部分,并且a、b或c之一包含基质修饰部分;
(xiv)a或b包含肿瘤靶向部分,并且c包含免疫细胞衔接子,并且d包含细胞因子分子;
(xv)a或b包含肿瘤靶向部分,并且d包含免疫细胞衔接子,并且c包含细胞因子分子;
(xvi)a和/或b包含一种或两种免疫细胞衔接子,并且d包含肿瘤靶向部分,并且c包含细胞因子分子;
(xvii)a和/或b包含一种或两种免疫细胞衔接子,并且c包含肿瘤靶向部分,并且b包含细胞因子分子;
(xviii)a和/或b包含一种或两种细胞因子,并且d包含肿瘤靶向部分,并且c包含免疫细胞衔接子;或者
(xix)a和/或b包含一种或两种细胞因子,并且c包含肿瘤靶向部分,并且d包含免疫细胞衔接子。
示例性分子的选择包括:
(i)a包含第一肿瘤靶向部分,b包含第二肿瘤靶向部分,c包含免疫细胞衔接子(例如,树突细胞衔接子),并且d包含细胞因子分子(例如,a和b包含相同或不同的靶向部分);
(ii)a包含第一肿瘤靶向部分,b包含第二肿瘤靶向部分,c包含细胞因子分子,并且d包含免疫细胞衔接子(例如,a和b包含相同或不同的靶向部分);
(iii)a包含第一肿瘤靶向部分,b包含第二肿瘤靶向部分,c和d分别是免疫细胞衔接子和不存在;
(iv)a包含第一肿瘤靶向部分,b包含第二肿瘤靶向部分,c和d分别是不存在和免疫细胞衔接子(例如,t细胞衔接子);
(v)a包含第一肿瘤靶向部分,b包含第二肿瘤靶向部分,c和d分别是细胞因子分子和不存在;
(vi)a包含第一肿瘤靶向部分,b包含第二肿瘤靶向部分,c和d分别是不存在和细胞因子分子;
(vii)a包含第一肿瘤靶向部分,b包含第二肿瘤靶向部分,c和d分别是基质修饰部分和不存在;
(viii)a包含第一肿瘤靶向部分,b包含第二肿瘤靶向部分,c和d分别是不存在和基质修饰部分;或者
(ix)a包含肿瘤靶向部分,并且b、c或d之一包含基质修饰部分。
在任何前述分子的一些实施例中,所述第一和第二肿瘤靶向部分与相同癌抗原上的不同表位结合或与不同的癌抗原结合。
在其他实施例中,所述不同的癌抗原存在于相同细胞或肿瘤组织上或存在于不同的细胞或肿瘤组织上。
在任何前述分子的其他实施例中,所述第一和所述第二肿瘤靶向部分对所述癌抗原的亲和力(例如,组合亲和力)等于或大于(ii)、(iii)或(iv)(单独的或作为所述多特异性分子的一部分)对其对应的结合成员的亲和力。例如,所述第一和所述第二肿瘤靶向部分对所述癌抗原的亲和力(例如,组合亲和力)比(ii)、(iii)或(iv)(单独的或作为所述多特异性分子的一部分)对其对应的结合成员的亲和力大至少2倍、5倍、10倍、20倍、30倍、40倍、50倍、75倍或100倍。
在任何前述分子的还其他实施例中,所述第一和所述第二肿瘤靶向部分对肿瘤(例如,癌细胞或基质细胞)的亲和力(例如,组合亲和力)等于或大于仅具有所述肿瘤靶向部分或所述第二肿瘤靶向部分之一的相似的多特异性或多功能分子多肽的亲和力。例如,所述第一和所述第二肿瘤靶向部分对肿瘤(例如,癌细胞或基质细胞)的亲和力(例如,组合亲和力)比仅具有所述肿瘤靶向部分或所述第二肿瘤靶向部分之一的相似的多特异性或多功能分子多肽的亲和力大至少2倍、5倍、10倍、20倍、30倍、40倍、50倍、75倍或100倍。
在一些实施例中,所述肿瘤靶向部分结合至但不激活或调节所述癌抗原。在其他实施例中,所述肿瘤靶向部分结合至并激活或调节所述癌抗原。
在其他实施例中,所述免疫细胞衔接子结合至但不激活免疫细胞,例如效应细胞。在其他实施例中,所述免疫细胞衔接子结合至并激活免疫细胞,例如效应细胞。
在其他实施例中,所述免疫细胞衔接子结合至但不激活免疫细胞,例如效应细胞。在其他实施例中,所述免疫细胞衔接子结合至并激活免疫细胞,例如效应细胞。
在一些实施例中,所述免疫细胞衔接子包括结合至并激活t细胞的t细胞衔接子。在其他实施例中,所述免疫细胞衔接子包括结合并不激活t细胞的t细胞衔接子。
在一些实施例中,所述免疫细胞衔接子包括结合至并激活树突细胞的树突细胞衔接子。在其他实施例中,所述免疫细胞衔接子包括结合并不激活树突细胞的树突细胞衔接子。
在一些实施例中,所述免疫细胞衔接子包括结合至并激活巨噬细胞的巨噬细胞衔接子。在其他实施例中,所述免疫细胞衔接子包括结合并不激活巨噬细胞的巨噬细胞衔接子。
在还其他实施例中,所述免疫细胞衔接子和/或所述肿瘤靶向部分结合至但不抑制检查点抑制剂(例如,表达检查点抑制剂的细胞,例如免疫细胞)。在其他实施例中,所述免疫细胞衔接子和/或所述肿瘤靶向部分结合至并抑制检查点抑制剂(例如,表达检查点抑制剂的细胞,例如免疫细胞)。示例性检查点分子包括但不限于ctla4、pd1、pd-l1、pd-l2、tim3、lag3、cd160、2b4、cd80、cd86、b7-h3(cd276)、b7-h4(vtcn1)、hvem(tnfrsf14或cd270)、btla、kir、mhci类、mhcii类、gal9、vista、btla、tigit、lair1、和a2ar。在一个实施例中,所述免疫细胞衔接子和/或所述肿瘤靶向部分结合至但不抑制pd1-pdl1相互作用。在另一个实施例中,所述免疫细胞衔接子和/或所述肿瘤靶向部分结合至并抑制pd1-pdl1相互作用。
在本文披露的任何实施例中,当单独呈现组分时(例如,在所述多特异性分子的上下文之外(或在具有单独组分(例如,单独免疫细胞衔接子)的多特异性分子的上下文中)),披露的多特异性分子不激活免疫细胞;但当在包含两种或更多种组分(例如,两种或更多种免疫细胞衔接子)的多特异性分子的上下文中呈现时,所述多特异性分子激活免疫细胞。例如,当两种不同的受体被所述多特异性分子的不同的部分结合时或当效应细胞的相同受体上的两种不同的表位被所述多特异性分子结合时(例如激活或抑制免疫细胞上的对应的受体),当结合免疫细胞时所述多特异性分子可以变为激活的。可以通过本文描述的任何测定来评估活性水平,例如通过将例如在所述多特异性分子中单独呈现的组分与在所述多特异性分子中组合呈现的两种或更多种组分进行比较。不希望受理论束缚,据信所述多特异性分子的两种或更多种不同的部分的结合引起物理状态(例如,构象、聚集)的改变,其导致针对癌细胞的免疫应答的调节的靶向的激活;据信这种调节的激活减少本文描述的多特异性分子的全身毒性的作用。
在其他实施例中,所述肿瘤靶向部分包括与所述癌抗原结合的抗体分子、受体分子(例如,受体、受体片段或其功能变体)、或配体分子(例如,配体、配体片段或其功能变体)或其组合。例如,所述肿瘤靶向部分可以与存在于血液癌、实体瘤、转移性癌症、软组织肿瘤、转移病灶、或其组合上的癌抗原结合。在其他实施例中,所述癌抗原是肿瘤抗原或基质抗原、或血液抗原。所述肿瘤抗原或基质抗原可以存在于纤维化的或促结缔织增生的实体瘤上。例如,所述肿瘤抗原或基质抗原存在于肿瘤上,例如由具有以下中的一种或多种代表的一类肿瘤:有限的肿瘤灌注、压缩的血管或纤维化的肿瘤间质。
可以被靶向的示例性癌症包括但不限于肿瘤,例如实体瘤、胰腺癌(例如,胰腺腺癌)、乳腺癌、结肠直肠癌、肺癌(例如,小细胞或非小细胞肺癌)、皮肤癌、卵巢癌、或肝癌。所述癌症还可以是血液癌,包括但不限于b细胞或t细胞恶性肿瘤,例如霍奇金淋巴瘤、非霍奇金淋巴瘤(例如,b细胞淋巴瘤、弥漫性大b细胞淋巴瘤、滤泡性淋巴瘤、慢性淋巴细胞白血病、套细胞淋巴瘤、边缘区b细胞淋巴瘤、伯基特淋巴瘤、淋巴浆细胞性淋巴瘤、毛细胞白血病)、急性髓性白血病(aml)、慢性髓性白血病、骨髓增生异常综合征、多发性骨髓瘤、和急性淋巴细胞白血病。
在一些实施例中,所述癌症(例如,实体瘤)抗原选自:pdl1、cd47、间皮素、神经节苷脂2(gd2)、前列腺干细胞抗原(psca)、前列腺特异性膜抗原(pmsa)、前列腺特异性抗原(psa)、癌胚抗原(cea)、ron激酶、c-met、未成熟层粘连蛋白受体、tag-72、bing-4、钙激活的氯通道2、细胞周期蛋白-b1、9d7、ep-cam、epha3、her2/neu、端粒酶、sap-1、存活素、ny-eso-1/lage-1、prame、ssx-2、melan-a/mart-1、gp100/pmel17、酪氨酸酶、trp-1/-2、mc1r、β-连环蛋白、brca1/2、cdk4、cml66、纤连蛋白、p53、ras、tgf-β受体、afp、eta、mage、muc-1、ca-125、bage、gage、ny-eso-1、β-连环蛋白、cdk4、cdc27、cd47、α辅肌动蛋白-4、trp1/gp75、trp2、gp100、melan-a/mart1、神经节甘脂、wt1、epha3、表皮生长因子受体(egfr)、cd20、mart-2、mart-1、muc1、muc2、mum1、mum2、mum3、na88-1、npm、oa1、ogt、rcc、rui1、rui2、sage、trg、trp1、tsta、叶酸受体α、l1-cam、caix、egfrviii、gpa33、gd3、gm2、vegfr、整合素(整合素αvβ3、整合素α5β1)、碳水化合物(le)、igf1r、epha3、trailr1、trailr2、或rankl。在其他实施例中,所述癌抗原是基质抗原,所述基质抗原可以选自成纤维细胞激活蛋白酶(fap)、tgf-β、透明质酸、胶原(例如,胶原iv)、生腱蛋白c、或生腱蛋白w。在所述癌抗原是血液抗原的实施例中,所述癌抗原可以选自cd19、cd33、cd47、cd123、cd20、cd99、cd30、bcma、cd38、cd22、slamf7、或ny-eso1。
在本文披露的任何多特异性或多功能分子的一些实施例中,所述肿瘤靶向部分选自癌抗原的抗体分子,所述癌抗原选自间皮素、pdl1、her3、igf1r、fap、cd47或cd123。例如,所述肿瘤靶向部分可以包括与间皮素或pdl1结合的抗体分子(例如,fab或scfv)。在一些实施例中,所述肿瘤靶向部分与pdl1结合且抑制pdl1与pd1的相互作用。在其他实施例中,所述肿瘤靶向部分与pdl1结合且不抑制pdl1与pd1的相互作用。
在实施例中,所述多特异性或多功能分子可以包含两种或三种癌抗原的两种或三种抗体分子,所述癌抗原选自间皮素、pdl1、her3、igf1r、fap、cd123或cd47。例如,所述第一和第二肿瘤靶向部分分别是抗间皮素抗体分子和抗pdl1抗体分子;或者所述第二和第一肿瘤靶向部分分别是抗间皮素抗体分子和抗pdl1抗体分子。其他组合包括但不限于,所述第一和第二肿瘤靶向部分分别是抗fap抗体分子和抗pdl1抗体分子;或者所述第二和第一肿瘤靶向部分分别是抗fap抗体分子和抗pdl1抗体分子。在其他实施例中,所述第一和第二肿瘤靶向部分分别是抗her3抗体分子和抗igf1r抗体分子;或者所述第二和第一肿瘤靶向部分分别是抗her3抗体分子和抗igf1r抗体分子。在其他实施例中,所述第一和第二肿瘤靶向部分分别是抗cd123抗体分子和抗cd47抗体分子;或者所述第二和第一肿瘤靶向部分分别是抗cd123抗体分子和抗cd47抗体分子。
在一些实施例中,所述多特异性或多功能分子可以包含免疫细胞衔接子,所述免疫细胞衔接子选自nk细胞衔接子、t细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子、或其组合。在一些实施例中,所述免疫细胞衔接子包括介导与nk细胞的结合和其激活的nk细胞衔接子。在其他实施例中,所述免疫细胞衔接子包括介导与nk细胞的结合而不介导其激活的nk细胞衔接子。示例性nk细胞衔接子可以选自结合至(例如,激活)以下的抗体分子(例如,抗原结合结构域)、或配体:nkp30、nkp40、nkp44、nkp46、nkg2d、dnam1、dap10、cd16(例如,cd16a、cd16b、或两者)、crtam、cd27、psgl1、cd96、cd100(sema4d)、nkp80、cd244(也称为slamf4或2b4)、slamf6、slamf7、kir2ds2、kir2ds4、kir3ds1、kir2ds3、kir2ds5、kir2ds1、cd94、nkg2c、nkg2e、或cd160。在一些实施例中,所述nk细胞衔接子是与nkp30或nkp46结合的抗体分子,例如抗原结合结构域。
在一些实施例中,所述免疫细胞衔接子包括介导与t细胞的结合和其激活的t细胞衔接子。在一些实施例中,所述免疫细胞衔接子包括介导与t细胞的结合而不介导其激活的t细胞衔接子。
在所述多特异性或多功能分子的其他实施例中,所述nk细胞衔接子是配体,任选地,所述配体进一步包含免疫球蛋白恒定区,例如fc区。例如,nkp44或nkp46的配体是病毒ha;dap10的配体是nkg2d的辅助受体;cd16的配体是cd16a/b配体,例如进一步包含抗体fc区的cd16a/b配体。
在其他实施例中,所述免疫细胞衔接子介导与b细胞、t细胞、巨噬细胞、和/或树突细胞中的一种或多种的结合、或其激活、或两者。
在所述多特异性或多功能分子的其他实施例中,所述t细胞衔接子是cd3、tcrα、tcrβ、tcrγ、tcrζ、icos、cd28、cd27、hvem、light、cd40、4-1bb、ox40、dr3、gitr、cd30、tim1、slam、cd2、或cd226的激动剂。在其他实施例中,所述t细胞衔接子结合至但不cd3、tcrα、tcrβ、tcrγ、tcrζ、icos、cd28、cd27、hvem、light、cd40、4-1bb、ox40、dr3、gitr、cd30、tim1、slam、cd2、或cd226。
在一些实施例中,所述免疫细胞衔接子包括选自以下中的一种或多种的b细胞、巨噬细胞、和/或树突细胞衔接子:cd40配体(cd40l)或cd70配体;与cd40或cd70结合的抗体分子;ox40的抗体分子;ox40配体(ox40l);toll样受体的激动剂(例如,tlr4(例如,组成型活性tlr4(catlr4))或tlr9激动剂);41bb;cd2激动剂;cd47;或sting激动剂、或其组合。
在一些实施例中,所述b细胞衔接子是cd40l、ox40l、或cd70配体、或与ox40、cd40或cd70结合的抗体分子。
在其他实施例中,所述巨噬细胞衔接子是cd2激动剂;cd40l;ox40l;与ox40、cd40或cd70结合的抗体分子;toll样受体(tlr)的激动剂(例如,tlr4(例如,组成型活性tlr4(catlr4))或tlr9激动剂);cd47;或sting激动剂。
在还其他实施例中,所述树突细胞衔接子是cd2激动剂、ox40抗体、ox40l、41bb激动剂、toll样受体(例如,tlr4,例如组成型活性tlr4(catlr4))激动剂或其片段、cd47激动剂、或sting激动剂。例如,所述sting激动剂可以包含环状二核苷酸,例如环状二-gmp(cdgmp)、环状二-amp(cdamp)、或其组合,任选地具有2’,5’或3’,5’磷酸酯键。例如通过本领域已知的技术可以将所述sting激动剂所述多特异性或多功能分子与共价偶联。
在其他实施例中,所述多特异性或多功能分子选自白介素-2(il-2)、白介素-7(il-7)、白介素-12(il-12)、白介素-15(il-15)、白介素-18(il-18)、白介素-21(il-21)、或干扰素γ、或其片段或变体、或任何前述细胞因子的组合。所述细胞因子可以是单体或二聚体。例如,所述细胞因子分子可以进一步包含受体二聚化结构域,例如il15rα二聚化结构域。在其他实施例中,所述细胞因子分子(例如,il-15)和所述受体二聚化结构域(例如,il15rα二聚化结构域)不是共价连接的,例如是非共价缔合的。
在其他实施例中,所述多特异性或多功能分子可以包含引起以下中的一种或多种的基质修饰部分:降低基质或细胞外基质(ecm)组分的水平或产生;减少肿瘤纤维化;增加间质肿瘤转运;改善肿瘤灌注;扩大肿瘤微血管;降低肿瘤中的间质液压(ifp);或者减少或增强药剂(例如,癌症治疗剂或细胞疗法)向肿瘤或肿瘤血管的渗透或扩散。例如,降低的基质或ecm组分选自糖胺聚糖或细胞外蛋白、或其组合。所述糖胺聚糖可以选自透明质酸(hyaluronan)(也称为透明质酸(hyaluronicacid)或ha)、硫酸软骨素、软骨素、硫酸皮肤素、硫酸乙酰肝素、肝素、巢蛋白、生腱蛋白、聚集蛋白聚糖或硫酸角蛋白。示例性细胞外蛋白包括但不限于胶原、层粘连蛋白、弹性蛋白、纤维蛋白原、纤连蛋白、或玻连蛋白。
在一些实施例中,所述多特异性或多功能分子包含基质修饰部分,所述基质修饰部分包含降解肿瘤基质或细胞外基质(ecm)的酶分子。所述酶分子可以选自透明质酸酶分子、胶原酶分子、软骨素酶分子、基质金属蛋白酶分子(例如,巨噬细胞金属弹性蛋白酶)、或任何前述的变体(例如,片段)。
在一些实施例中,所述基质修饰部分降低透明质酸的水平或产生。例如,所述基质修饰部分包括透明质酸降解酶、抑制透明质酸合成的试剂、或针对透明质酸的抗体分子。
在还其他实施例中,所述透明质酸降解酶是透明质酸酶分子或其变体(例如,其片段)。所述透明质酸降解酶可以在中性或酸性ph(例如,约4-5的ph)下有活性。在一些实施例中,所述透明质酸酶分子是哺乳动物透明质酸酶分子(例如,重组人透明质酸酶分子)、或其变体(例如,其截短形式)。例如,所述透明质酸酶分子可以选自hyal1、hyal2、或ph-20/spam1、或其变体(例如,其截短形式)。在还其他实施例中,所述截短形式缺乏c-末端糖基磷脂酰肌醇(gpi)附接位点或所述gpi附接位点的一部分。
在还其他实施例中,所述透明质酸酶分子是糖基化的,例如包含至少一个n-连接的聚糖。
在一个实施例中,所述透明质酸酶分子包含seqidno:61的氨基酸序列、或其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:61的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在一些实施例中,所述透明质酸酶分子包含:
(i)seqidno:61的36-464的氨基酸序列;
(ii)ph20的36-481、36-482、或36-483的氨基酸序列,其中ph20具有seqidno:61所示的氨基酸序列;或者
(iii)与seqidno:61所示的氨基酸序列的多肽或截短形式具有至少95%至100%序列同一性的氨基酸序列;或者
(iv)相对于seqidno:61所示的氨基酸序列具有30个、20个、10个、5个或更少氨基酸取代的氨基酸序列。
在一些实施例中,所述透明质酸酶分子包含与seqidno:61的氨基酸序列至少95%(例如,至少95%、96%、97%、98%、99%、100%)相同的氨基酸序列;或者由与seqidno:61的核苷酸序列至少95%(例如,至少96%、97%、98%、99%、100%)相同的核苷酸序列编码。
在其他实施例中,所述透明质酸酶分子是ph20,例如rhuph20。
在一个实施例中,所述透明质酸酶分子是hyal1且包含seqidno:62的氨基酸序列、或其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:62的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在一些实施例中,所述透明质酸降解酶(例如,所述透明质酸酶分子)进一步包含聚合物,例如与聚合物(例如,peg)缀合。例如,所述透明质酸降解酶可以是peg化的ph20酶(pegph20)。
在一些实施例中,所述多特异性或多功能分子多肽(所述透明质酸降解酶,例如所述透明质酸酶分子)进一步包含选自以下的免疫球蛋白链恒定区(例如,fc区):例如,igg1、igg2、igg3、和igg4的重链恒定区,更具体地,人igg1、igg2、igg3、或igg4的重链恒定区。
在一些实施例中,所述免疫球蛋白恒定区(例如,所述fc区)连接(例如,共价连接)至所述透明质酸降解酶(例如,所述透明质酸酶分子)。在一些实施例中,所述免疫球蛋白链恒定区(例如,fc区)被改变(例如,突变)以增加或减少以下中的一种或多种:fc受体结合、抗体糖基化、半胱氨酸残基的数量、效应细胞功能、或补体功能。在一些实施例中,所述透明质酸降解酶(例如,所述透明质酸酶分子)形成二聚体。
在一些实施例中,所述基质修饰部分包括透明质酸合成(例如,ha合酶)的抑制剂。在一些实施例中,所述抑制剂包含针对ha合酶的正义或反义核酸分子或是小分子药物。在一些实施例中,所述抑制剂是4-甲基伞形酮(mu)或其衍生物(例如,6,7-二羟基-4-甲基香豆素或5,7-二羟基-4-甲基香豆素)、或来氟米特或其衍生物。在一些实施例中,所述基质修饰部分包括胶原酶分子(例如,哺乳动物胶原酶分子)、或其变体(例如,片段)。在一些实施例中,所述胶原酶分子是胶原酶分子iv,例如包含seqidno:63的氨基酸序列、或其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:63的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在一些实施例中,所述多特异性或多功能分子多肽包含两种结合特异性或功能,例如,其是双特异性或双功能分子,例如,其包含:i)所述肿瘤靶向部分和所述免疫细胞衔接子,条件是当所述多特异性分子仅包含所述肿瘤靶向部分和所述免疫细胞衔接子时,所述免疫细胞衔接子不是nk细胞抗原的抗体分子;或者ii)所述肿瘤靶向部分和所述基质修饰部分。
在一些实施例中,所述多特异性或多功能分子多肽包含三种或四种特异性或功能,例如是三特异性或四特异性分子。在一些实施例中,所述多特异性或多功能分子多肽包含(i)至少两种肿瘤靶向部分、所述免疫细胞衔接子、和所述细胞因子分子;(ii)所述肿瘤靶向部分、所述免疫细胞衔接子、和所述基质修饰部分;或者(iii)与选自以下的两种癌抗原结合的至少两种肿瘤靶向部分:间皮素、pdl1、her3、成纤维细胞激活蛋白(fap)、或胰岛素生长因子1r(igf1r)、cd47或cd123,条件是所述两种癌抗原不是fap和igf1r;和细胞因子分子。
在一些实施例中,所述多特异性或多功能分子多肽包含:(i)一种肿瘤靶向部分;(ii)两种免疫细胞衔接子(例如,相同或不同的免疫细胞衔接子);以及以下中的一种或两种:(iii)一种细胞因子分子、或(iv)一种基质修饰部分。在一些实施例中,所述多特异性或多功能分子多肽包含(i)两种肿瘤靶向部分(例如,相同或不同的靶向部分);(ii)一种免疫细胞衔接子;以及以下中的一种或两种:(iii)一种细胞因子分子、或(iv)一种基质修饰部分。在一些实施例中,所述多特异性或多功能分子多肽包含(i)一种肿瘤靶向部分;(ii)一种免疫细胞衔接子;以及以下中的一种或两种:(iii)两种细胞因子分子(例如,相同或不同的细胞因子分子)。
在一些实施例中,所述两种肿瘤靶向部分之一结合pdl1;所述两种肿瘤靶向部分之一结合间皮素;所述免疫细胞衔接子结合nkp46或nkp30;并且所述细胞因子分子是il2。
在一些实施例中,所述肿瘤靶向部分或所述免疫细胞衔接子、或两者包含(i)抗体分子,例如至少一个免疫球蛋白结构域;和/或(ii)受体或配体、或其片段。
在一些实施例中,所述肿瘤靶向抗体分子与所述实体瘤抗原和/或所述基质抗原结合,解离常数小于约10nm,并且更典型地10pm–100pm。
在一些实施例中,所述免疫细胞衔接子抗体分子与所述nk细胞抗原、所述b细胞抗原、所述树突细胞抗原、和/或所述巨噬细胞抗原结合,解离常数小于约10nm,并且更典型地10pm–100pm。
在一些实施例中,所述肿瘤靶向抗体分子与所述肿瘤抗原或所述基质抗原上的构象或线性表位结合。
在一些实施例中,所述免疫细胞衔接子抗体分子与所述nk细胞抗原、所述b细胞抗原、所述树突细胞抗原、和/或所述巨噬细胞抗原上的构象或线性表位结合。
在一些实施例中,所述肿瘤靶向抗体分子是单特异性抗体分子、双特异性抗体分子、或三特异性抗体分子。
在一些实施例中,所述肿瘤靶向抗体分子是单价抗体分子、二价抗体分子、或三价抗体分子。
在一些实施例中,所述免疫细胞衔接子抗体分子是单特异性抗体分子、双特异性抗体分子、或三特异性抗体。
在一些实施例中,所述免疫细胞衔接子抗体分子是单价、二价、或三价抗体。
在一些实施例中,所述肿瘤靶向抗体分子和/或免疫细胞衔接子抗体分子是全抗体(例如,包含至少一条、优选两条完整的重链和至少一条、优选两条完整的轻链的抗体)、或抗原结合片段(例如,fab、f(ab')2、fv、单链fv、单结构域抗体、双抗体(dab)、二价抗体、或双特异性抗体或其片段、其单结构域变体、或骆驼科动物抗体)。
在一些实施例中,所述肿瘤靶向抗体分子和免疫细胞衔接子抗体分子独立地是全抗体(例如,包含至少一条、优选两条完整的重链和至少一条、优选两条完整的轻链的抗体)、或抗原结合片段(例如,fab、f(ab')2、fv、单链fv片段、单结构域抗体、双抗体(dab)、二价抗体、或双特异性抗体或其片段、其单结构域变体、或骆驼科动物抗体)。
在一些实施例中,所述肿瘤靶向抗体分子和/或免疫细胞衔接子抗体分子包含选自igg1、igg2、igg3、或igg4的重链恒定区、或其片段。
在一些实施例中,所述肿瘤靶向抗体分子和/或免疫细胞衔接子抗体分子包含选自κ或λ的轻链恒定区的轻链恒定区、或其片段。
在一些实施例中,所述肿瘤靶向部分或所述免疫细胞衔接子、或两者包含与所述肿瘤抗原和/或所述基质抗原、或所述nk细胞抗原、所述b细胞抗原、所述树突细胞抗原、和/或所述巨噬细胞抗原结合的受体或受体片段、或配体或配体片段。
在一些实施例中,所述多特异性或多功能分子多肽进一步包含选自以下的免疫球蛋白恒定区(例如,fc区):igg1、igg2、和igg4的重链恒定区,更具体地,人igg1、igg2或igg4的重链恒定区。在一些实施例中,所述免疫球蛋白恒定区(例如,fc区)连接(例如,共价连接)至所述肿瘤靶向部分、所述免疫细胞衔接子、或所述细胞因子分子中的一种或多种。在一些实施例中,所述免疫球蛋白链恒定区(例如,fc区)被改变(例如,突变)以增加或减少以下中的一种或多种:fc受体结合、抗体糖基化、半胱氨酸残基的数量、效应细胞功能、或补体功能。
在一些实施例中,所述多特异性或多功能多肽包含至少两条不连续多肽链。
在一些实施例中,所述肿瘤靶向部分或免疫细胞衔接子包含选自κ或λ的轻链恒定区的轻链恒定区、或其片段。
在一些实施例中,所述多特异性或多功能多肽包含第一肿瘤靶向部分和第二肿瘤靶向部分,其中所述第一肿瘤靶向部分包含κ轻链恒定区、或其片段,并且所述第二肿瘤靶向部分包含λ轻链恒定区、或其片段。
在一些实施例中,所述多特异性或多功能多肽包含第一肿瘤部分和第二肿瘤靶向部分,其中所述第一肿瘤靶向部分和所述第二肿瘤靶向部分包含共有轻链可变区。
在一些实施例中,所述免疫球蛋白恒定区(例如,所述fc区)连接(例如,共价连接)至肿瘤靶向部分、所述免疫细胞衔接子、所述细胞因子分子、或所述基质修饰部分中的一种或多种。
在一些实施例中,所述多特异性或多功能多肽包含第一和第二免疫球蛋白链恒定区(例如,fc区)的界面,所述界面被改变(例如,突变)以增加或减少二聚化,例如相对于非工程化界面。
在一些实施例中,所述免疫球蛋白链恒定区(例如,fc区)的二聚化通过提供第一和第二fc区的fc界面与以下中的一种或多种来增强:成对空腔-突起(cavity-protuberance)(“杵臼结构(“knob-in-ahole”)”)、静电相互作用、或链交换,使得形成更大比率的异源多聚体:同源多聚体,例如相对于非工程化界面。
在一些实施例中,所述免疫球蛋白链恒定区(例如,fc区)包含在选自例如人igg1的fc区的以下中的一个或多个的位置处的氨基酸取代:347、349、350、351、366、368、370、392、394、395、397、398、399、405、407、或409。
在一些实施例中,所述免疫球蛋白链恒定区(例如,fc区)包含选自以下的氨基酸取代:t366s、l368a、或y407v(例如,对应于空腔或臼(hole))、或t366w(例如,对应于突起或杵(knob))、或其组合。
在一些实施例中,所述多特异性或多功能多肽进一步包含接头,例如在以下中的一种或多种之间的接头:所述靶向部分与所述细胞因子分子或所述基质修饰部分、所述靶向部分与所述免疫细胞衔接子、所述细胞因子分子或所述基质修饰部分与所述免疫细胞衔接子、所述细胞因子分子或所述基质修饰部分与所述免疫球蛋白链恒定区(例如,所述fc区)、所述靶向部分与所述免疫球蛋白链恒定区、或所述免疫细胞衔接子与所述免疫球蛋白链恒定区。
在一些实施例中,所述接头选自:可切割接头、不可切割接头、肽接头、柔性接头、刚性接头、螺旋接头、或非螺旋接头。在一些实施例中,所述接头是肽接头。在一些实施例中,所述肽接头包含gly和ser。
在一些实施例中,所述多特异性或多功能多肽是包含第一和第二不连续多肽的双特异性分子,其中:
(i)所述第一多肽例如在n-至c-方向上包含与例如癌抗原(例如,实体瘤、基质或血液抗原)结合的肿瘤靶向部分,例如抗体分子(例如,第一抗原结构域的第一部分,例如fab分子的第一vh-ch1),所述肿瘤靶向部分任选地经由接头连接至细胞因子分子、基质修饰部分、或免疫细胞衔接子,例如与免疫细胞抗原结合的抗体分子,例如scfv;并且
(ii)所述第二多肽例如在n-至c-方向上包含所述第一抗原结构域的第二部分,例如所述fab的第一vl-cl,所述第二部分与例如癌抗原(例如,实体瘤、基质或血液抗原(例如,由所述第一vh-ch1结合的相同的肿瘤或基质抗原))结合。
在一些实施例中,所述多特异性或多功能多肽是包含第一和第二不连续多肽的双特异性分子,其中:
(i)所述第一多肽例如在n-至c-方向上包含与例如癌抗原(例如,实体瘤、基质或血液抗原)结合的肿瘤靶向部分,例如抗体分子(例如,第一抗原结构域的第一部分,例如fab分子的第一vh-ch1),所述肿瘤靶向部分任选地经由接头连接至第一结构域,所述第一结构域促进所述第一与所述第二多肽之间的关联(例如,第一免疫球蛋白恒定结构域(例如,如本文描述的第一fc分子));
(ii)所述第二多肽例如在n-至c-方向上包含细胞因子分子、基质修饰部分、或免疫细胞衔接子(例如,与免疫细胞抗原结合的抗体分子,例如scfv),所述细胞因子分子、基质修饰部分、或免疫细胞衔接子任选地经由接头连接至第二结构域,所述第二结构域促进所述第一与所述第二多肽之间的关联(例如,第二免疫球蛋白恒定结构域(例如,如本文描述的第二fc分子));并且
(iii)所述第三多肽例如在n-至c-方向上包含与所述癌抗原结合的所述第一抗原结构域的第二部分,例如所述fab的第一vl-cl。
在一些实施例中,所述多特异性或多功能多肽是包含第一、第二和第三不连续多肽的三特异性分子,其中:
(i)所述第一多肽例如在n-至c-方向上包含与例如癌抗原结合的肿瘤靶向部分,例如抗体分子(例如,第一抗原结构域的第一部分,例如fab分子的第一vh-ch1),所述肿瘤靶向部分任选地经由接头连接至第一结构域,所述第一结构域促进所述第一与所述第二多肽之间的关联(例如,第一免疫球蛋白恒定结构域(例如,如本文描述的第一fc分子));
(ii)所述第二多肽例如在n-至c-方向上包含细胞因子分子、基质修饰部分、或免疫细胞衔接子(例如,与免疫细胞抗原结合的抗体分子,例如scfv),所述细胞因子分子、基质修饰部分、或免疫细胞衔接子任选地经由接头连接至第二结构域,所述第二结构域促进所述第一与所述第二多肽之间的关联(例如,第二免疫球蛋白恒定结构域(例如,如本文描述的第二fc分子));并且
(iii)所述第三多肽例如在n-至c-方向上包含与所述癌抗原结合的所述第一抗原结构域的第二部分,例如所述fab的第一vl-cl,
其中所述第一或所述第二多肽进一步包含细胞因子分子或免疫细胞衔接子,所述细胞因子分子或免疫细胞衔接子任选地共价连接至所述第一或第二免疫球蛋白恒定结构域的c-末端。
在一些实施例中,所述多特异性或多功能多肽是包含第一、第二和第三不连续多肽的四特异性分子,其中:
(i)所述第一多肽例如在n-至c-方向上包含与例如癌抗原结合的肿瘤靶向部分,例如抗体分子(例如,第一抗原结构域的第一部分,例如fab分子的第一vh-ch1),所述肿瘤靶向部分任选地经由接头连接至第一结构域,所述第一结构域促进所述第一与所述第二多肽之间的关联(例如,第一免疫球蛋白恒定结构域(例如,如本文描述的第一fc分子));
(ii)所述第二多肽例如在n-至c-方向上包含细胞因子分子、基质修饰部分、或免疫细胞衔接子(例如,与免疫细胞抗原结合的抗体分子,例如scfv),所述细胞因子分子、基质修饰部分、或免疫细胞衔接子任选地经由接头连接至第二结构域,所述第二结构域促进所述第一与所述第二多肽之间的关联(例如,第二免疫球蛋白恒定结构域(例如,如本文描述的第二fc分子));并且
(iii)所述第三多肽例如在n-至c-方向上包含与所述癌抗原结合的所述第一抗原结构域的第二部分,例如所述fab的第一vl-cl,
其中所述第一和所述第二多肽进一步包含细胞因子分子和/或免疫细胞衔接子,所述细胞因子分子和/或免疫细胞衔接子任选地共价连接至所述第一或第二免疫球蛋白恒定结构域的c-末端。
在一些实施例中,所述多特异性或多功能多肽包含a)第一多肽,所述第一多肽包含:促进所述第一和第二多肽的关联的结构域,例如fc分子;以及选自以下的两种多肽:肿瘤靶向部分;免疫细胞衔接子;基质修饰部分、和细胞因子分子,b)第二多肽,所述第二多肽包含:促进所述第一和第二多肽的关联的结构域,例如fc分子;以及选自以下的两种多肽:肿瘤靶向部分;免疫细胞衔接子;和细胞因子分子,其中所述多特异性或多功能分子多肽包含肿瘤靶向部分;免疫细胞衔接子;基质修饰部分;和细胞因子分子。
在一些实施例中,所述多特异性或多功能多肽包含肿瘤靶向部分;免疫细胞衔接子;以及两种细胞因子分子或两种基质修饰部分;
肿瘤靶向部分;两种免疫细胞衔接子;以及细胞因子分子或基质修饰部分;或者
两种肿瘤靶向部分;免疫细胞衔接子;以及细胞因子分子或基质修饰部分。
在一些实施例中,所述多特异性或多功能多肽包含两种肿瘤靶向部分;免疫细胞衔接子;以及细胞因子分子,其中所述两种肿瘤靶向部分之一是结合pdl1的抗体分子;所述两种肿瘤靶向部分之一结合间皮素;所述免疫细胞衔接子结合nkp46或nkp30;并且所述细胞因子是il2。
在一些实施例中,所述多特异性或多功能多肽包含
i)第一多肽,所述第一多肽例如在n-c或c-n方向上包含肿瘤靶向部分;促进所述第一和第二多肽的关联的结构域,例如fc分子;和免疫细胞衔接子;
ii)第一多肽,所述第一多肽例如在n-c或c-n方向上包含肿瘤靶向部分;促进所述第一和第二多肽的关联的结构域,例如fc分子;和细胞因子分子或基质修饰部分;或者
iii)第一多肽,所述第一多肽例如在n-c或c-n方向上包含细胞因子;促进所述第一和第二多肽的关联的结构域,例如fc分子;和免疫细胞衔接子;以及
iv)第二多肽,所述第二多肽例如在n-c或c-n方向上包含肿瘤靶向部分;促进所述第一和第二多肽的关联的结构域,例如fc分子;和免疫细胞衔接子;
ii)第二多肽,所述第二多肽例如在n-c或c-n方向上包含肿瘤靶向部分;促进所述第一和第二多肽的关联的结构域,例如fc分子;和细胞因子分子或基质修饰部分;或者
iii)第二多肽,所述第二多肽例如在n-c或c-n方向上包含细胞因子;促进所述第一和第二多肽的关联的结构域,例如fc分子;和免疫细胞衔接子。
在一些实施例中,(i)所述肿瘤靶向部分包含:
(ia)针对选自以下的实体瘤抗原的抗体分子:pdl1、间皮素、her3、igf-1r、gd2、pmsa、cea、ron激酶、或c-met;和/或
(ib)针对选自以下的基质抗原的抗体分子:fap、透明质酸、胶原iv、生腱蛋白c、或生腱蛋白w;或者
针对所述实体瘤抗原的抗体分子和针对所述基质抗原的抗体分子的组合;以及
(ii)以下中的一种、两种或全部:
(iia)选自以下中的一种、两种、三种、或全部的免疫细胞衔接子:cd40l或cd70配体;与cd40或cd70结合的抗体分子;ox40的抗体分子;ox40l;b7-h6、或sting激动剂、或其组合;
(iib)选自il-2、il-12、il-15、il-18、或il-21、其片段或变体、或任何前述细胞因子分子的组合的细胞因子分子;
(iic)选自透明质酸酶或明胶酶的基质修饰部分。
在一些实施例中,所述多特异性或多功能多肽包含间皮素(例如,人间皮素)的抗体分子;cd40l多肽;和il-15或il-2分子。
在一些实施例中,所述抗体分子包括针对间皮素的具有轻链和重链的fab。
在一些实施例中,针对间皮素的所述fab的重链进一步包含il-15或il-2分子(例如,人il-15分子),任选地,其中所述fab和所述il-15或il-2分子例如经由包含gly和ser的接头连接。
在一些实施例中,所述多特异性或多功能多肽具有以下构型:针对间皮素的所述fab的重链(例如,vh–ch1)至il-15或il-2,从n-至c-末端,任选地包含在所述fab与所述il-15或il-2之间的gly-ser接头。
在一些实施例中,间皮素的所述fab的轻链进一步包含cd40l,任选地,其中所述fab和所述cd40l例如经由包含gly和ser的接头连接。
在一些实施例中,所述多特异性或多功能多肽具有以下构型:间皮素的所述fab的轻链(例如,vl–cl1)融合至cd40l,从n-至c-末端,任选地包含在所述fab与所述cd40l之间的gly-ser接头。
在一些实施例中,所述多特异性或多功能分子包含fap(例如,人fap)的抗体分子和il-15或il-2分子。在一些实施例中,所述抗体分子包括针对fap的具有轻链和重链的fab。在一些实施例中,fap的所述fab的重链进一步包含第一fc区,所述第一fc区在所述第一fc区的fc界面具有成对空腔-突起(杵臼结构)的成员。
在一些实施例中,所述多功能或多特异性分子具有以下构型:fap的所述fab的重链(例如,vh–ch1)融合至第一fc区(例如,ch2至ch3),从n-至c-末端。
在一些实施例中,所述il-15或il-2分子(例如,人il-15或il-2分子)进一步包含第二fc区,所述第二fc区在所述第二fc区的fc界面具有成对空腔-突起(杵臼结构)的第二成员,例如经由包含gly和ser的接头连接。
在一些实施例中,所述多特异性或多功能多肽具有以下构型:il-15或il-2分子-第二fc区(例如,ch2至ch3),从n-至c-末端,例如,其中所述il-15或il-2分子和所述第二fc区经由包含gly和ser的接头连接。
在一些实施例中,所述多特异性或多功能多肽进一步包含免疫细胞衔接子。在一些实施例中,所述免疫细胞衔接子包括cd40配体。在一些实施例中,所述免疫细胞增强子连接(例如,共价连接)至所述第二fc区和所述il-15或il-2分子(例如,人il-15或il-2分子),所述第二fc区具有所述成对空腔-突起(杵臼结构)的第二成员,任选地在所述il-15或il-2分子与所述第二fc区之间、和/或在所述第二fc区与所述免疫细胞增强子之间包含接头,所述接头包含gly和ser。
在一些实施例中,所述多特异性或多功能多肽具有以下构型:il-15或il-2分子-第二fc区(例如,ch2至ch3)-免疫细胞增强子,从n-至c-末端,任选地在所述il-15或il-2分子与所述第二fc区之间、和/或在所述第二fc区与所述免疫细胞增强子之间包含接头,所述接头包含gly和ser。
在一些实施例中,所述多特异性或多功能多肽进一步包含第二免疫细胞增强子。在一些实施例中,所述第二免疫细胞增强子包括b7h6分子。在一些实施例中,所述第二免疫细胞增强子连接(例如,共价连接)至所述第一fc区和所述fab的重链,所述第一fc区在所述第一fc区的fc界面具有所述成对空腔-突起(杵臼结构)的第一成员,任选地在所述b7h6分子与所述第一fc区之间包含接头,所述接头包含gly和ser。
在一些实施例中,所述多特异性或多功能多肽包含实体瘤抗原或基质抗原的靶向抗体分子、和至少两种免疫细胞增强子。在一些实施例中,所述抗体分子与间皮素或fap结合。在一些实施例中,所述免疫细胞增强子是tlr激动剂(例如,tlr9激动剂)或sting激动剂和针对ox40的抗体分子。在一些实施例中,所述sting激动剂包含环状二核苷酸,例如环状二-gmp(cdgmp)、环状二-amp(cdamp)、或其组合,任选地具有2’,5’或3’,5’磷酸酯键,并且任选地,其中所述sting激动剂与所述靶向抗体或所述免疫细胞增强子偶联(例如,直接缀合)。在一些实施例中,所述tlr激动剂包含未甲基化的cpg序列。
在一些实施例中,所述多特异性或多功能多肽包含具有对间皮素或fap的第一结合特异性、和对ox40的第二结合特异性的双特异性抗体。
在任何前述多特异性分子的一些实施例中,所述肿瘤靶向部分选自癌抗原的抗体分子,所述癌抗原选自间皮素、pdl1、her3、igf1r或fap。在一些实施例中,所述多特异性分子包含两种或三种癌抗原的两种或三种抗体分子,所述癌抗原选自间皮素、pdl1、her3、igf1r或fap。在一些实施例中,所述肿瘤靶向部分与pdl1结合并抑制pdl1与其配体(例如,pd1)的相互作用。在其他实施例中,所述肿瘤靶向部分与pdl1结合并不抑制pdl1与其配体(例如,pd1)的相互作用。
在一些实施例中,所述第一和第二肿瘤靶向部分分别是抗间皮素抗体分子和抗pdl1抗体分子。在一些实施例中,所述第二和第一肿瘤靶向部分分别是抗间皮素抗体分子和抗pdl1抗体分子。
在一些实施例中,所述第一和第二肿瘤靶向部分分别是抗fap抗体分子和抗pdl1抗体分子。在一些实施例中,所述第二和第一肿瘤靶向部分分别是抗fap抗体分子和抗pdl1抗体分子。
在一些实施例中,所述第一和第二肿瘤靶向部分分别是抗her3抗体分子和抗igf1r抗体分子。在一些实施例中,所述第二和第一肿瘤靶向部分分别是抗her3抗体分子和抗igf1r抗体分子。
在任何前述多特异性分子的一些实施例中,所述免疫细胞衔接子选自nkp30的抗体分子、nkp46的抗体分子、cd40l、或41bbl。
在任何前述多特异性分子的一些实施例中,所述细胞因子分子是il-2分子(例如,il-2或其功能变体)、il-15分子(例如,il-15或其功能变体)、或il-21分子(例如,il-21或其功能变体)。
在任何前述多特异性分子的一些实施例中,所述基质修饰分子选自透明质酸酶(例如,透明质酸酶1)或其功能变体、或明胶酶或其功能变体。
在一个实施例中,所述多特异性分子包含抗间皮素肿瘤靶向部分(例如,抗间皮素fab)和il-2(或其功能变体)。
在一个实施例中,所述多特异性分子包含抗间皮素肿瘤靶向部分(例如,抗间皮素fab)、il-2(或其功能变体)、和抗nkp30nk细胞衔接子部分(例如,抗nkp30fab或scfv)。
在一个实施例中,所述多特异性分子包含抗间皮素肿瘤靶向部分(例如,抗间皮素fab)和抗nkp30nk细胞衔接子部分(例如,抗nkp30fab或scfv)。
在一个实施例中,所述多特异性分子包含抗间皮素肿瘤靶向部分(例如,抗间皮素fab)和抗pdl1肿瘤靶向部分(例如,抗pdl1fab)。
在一个实施例中,所述多特异性分子包含抗间皮素肿瘤靶向部分(例如,抗间皮素fab)、抗pdl1肿瘤靶向部分(例如,抗pdl1fab)、和il-2(或其功能变体)。
在一个实施例中,所述多特异性分子包含抗间皮素肿瘤靶向部分(例如,抗间皮素fab)、抗pdl1肿瘤靶向部分(例如,抗pdl1fab)、和抗nkp46nk细胞衔接子部分(例如,抗nkp46fab或scfv)。
在一个实施例中,所述多特异性分子包含抗间皮素肿瘤靶向部分(例如,抗间皮素fab)、抗pdl1肿瘤靶向部分(例如,抗pdl1fab)、抗nkp46nk细胞衔接子部分(例如,抗nkp46fab或scfv)、和il-2(或其功能变体)。
在一个实施例中,所述多特异性分子包含抗her3肿瘤靶向部分(例如,抗her3fab)、抗igf1r肿瘤靶向部分(例如,抗igf1rfab)、和il-2(或其功能变体)。
在一个实施例中,所述多特异性分子包含抗her3肿瘤靶向部分(例如,抗her3fab)、抗igf1r肿瘤靶向部分(例如,抗igf1rfab)、抗nkp46nk细胞衔接子部分(例如,抗nkp46fab或scfv)、和il-2(或其功能变体)。
在一个实施例中,所述多特异性分子包含抗her3肿瘤靶向部分(例如,抗her3fab)和抗igf1r肿瘤靶向部分(例如,抗igf1rfab)。
在一个实施例中,所述多特异性分子包含抗fap肿瘤靶向部分(例如,抗fapfab)和透明质酸酶1(或其功能变体)。
在一个实施例中,所述多特异性分子包含抗fap肿瘤靶向部分(例如,抗fapfab)、il-2(或其功能变体)、和透明质酸酶1(或其功能变体)。
在一个实施例中,所述多特异性分子包含抗fap肿瘤靶向部分(例如,抗fapfab)、抗pdl1肿瘤靶向部分(例如,抗pdl1fab)、和透明质酸酶1(或其功能变体)。
在一个实施例中,所述多特异性分子包含抗fap肿瘤靶向部分(例如,抗fapfab)、抗pdl1肿瘤靶向部分(例如,抗pdl1fab)、il-2(或其功能变体)、和透明质酸酶1(或其功能变体)。
在一个实施例中,所述多特异性分子包含抗pdl1肿瘤靶向部分(例如,抗pdl1fab)、抗nkp46nk细胞衔接子部分(例如,抗nkp46fab或scfv)、il-2(或其功能变体)、和透明质酸酶1(或其功能变体)。
在一个实施例中,所述多特异性分子包含抗fap肿瘤靶向部分(例如,抗fapfab)和明胶酶(或其功能变体)。
在一个实施例中,所述多特异性分子包含抗fap肿瘤靶向部分(例如,抗fapfab)、抗pdl1肿瘤靶向部分(例如,抗pdl1fab)、il-2(或其功能变体)、和明胶酶(或其功能变体)。
在一个实施例中,所述多特异性分子包含抗间皮素肿瘤靶向部分、il-21或其功能变体、41bb-l、和cd40l。
在一个实施例中,所述多特异性分子包含抗fap肿瘤靶向部分和cd40l。
在一个实施例中,所述多特异性分子包含抗fap肿瘤靶向部分和il-15。
在一个实施例中,所述多特异性分子包含抗间皮素肿瘤靶向部分(例如,抗间皮素fab)和il-2(或其功能变体)。
在一个实施例中,所述多特异性分子包含抗间皮素肿瘤靶向部分(例如,抗间皮素fab)、il-2(或其功能变体)、和抗nkp30nk细胞衔接子部分(例如,抗nkp30fab或scfv)。
在一个实施例中,所述多特异性分子包含抗间皮素肿瘤靶向部分(例如,抗间皮素fab)和抗nkp30nk细胞衔接子部分(例如,抗nkp30fab或scfv)。
在一个实施例中,所述多特异性分子包含il-2(或其功能变体)。
在一个实施例中,所述多特异性分子包含抗间皮素肿瘤靶向部分(例如,抗间皮素fab)和抗pdl1肿瘤靶向部分(例如,抗pdl1fab)。
在一个实施例中,所述多特异性分子包含抗间皮素肿瘤靶向部分(例如,抗间皮素fab)、抗pdl1肿瘤靶向部分(例如,抗pdl1fab)、和il-2(或其功能变体)。
在一个实施例中,所述多特异性分子包含抗间皮素肿瘤靶向部分(例如,抗间皮素fab)、抗pdl1肿瘤靶向部分(例如,抗pdl1fab)、和抗nkp46nk细胞衔接子部分(例如,抗nkp46fab或scfv)。
在一个实施例中,所述多特异性分子包含抗间皮素肿瘤靶向部分(例如,抗间皮素fab)、抗pdl1肿瘤靶向部分(例如,抗pdl1fab)、抗nkp46nk细胞衔接子部分(例如,抗nkp46fab或scfv)、和il-2(或其功能变体)。
在一个实施例中,所述多特异性分子包含抗her3肿瘤靶向部分(例如,抗her3fab)、抗igf1r肿瘤靶向部分(例如,抗igf1rfab)、和il-2(或其功能变体)。
在一个实施例中,所述多特异性分子包含抗her3肿瘤靶向部分(例如,抗her3fab)、抗igf1r肿瘤靶向部分(例如,抗igf1rfab)、和抗nkp46nk细胞衔接子部分(例如,抗nkp46fab或scfv)。
在一个实施例中,所述多特异性分子包含抗her3肿瘤靶向部分(例如,抗her3fab)、抗igf1r肿瘤靶向部分(例如,抗igf1rfab)、和抗cd3t细胞衔接子部分(例如,抗cd3fab或scfv)。
在一个实施例中,所述多特异性分子包含抗her3肿瘤靶向部分(例如,抗her3fab)、抗igf1r肿瘤靶向部分(例如,抗igf1rfab)、抗nkp46nk细胞衔接子部分(例如,抗nkp46fab或scfv)、和il-2(或其功能变体)。
在一个实施例中,所述多特异性分子包含抗her3肿瘤靶向部分(例如,抗her3fab)、抗igf1r肿瘤靶向部分(例如,抗igf1rfab)、抗cd3t细胞衔接子部分(例如,抗cd3fab或scfv)、和il-2(或其功能变体)。
在一个实施例中,所述多特异性分子包含抗her3肿瘤靶向部分(例如,抗her3fab)和抗igf1r肿瘤靶向部分(例如,抗igf1rfab)。
在一个实施例中,所述多特异性分子包含抗her3肿瘤靶向部分(例如,抗her3fab)、抗igf1r肿瘤靶向部分(例如,抗igf1rfab)、和il-7(或其功能变体)。
在一个实施例中,所述多特异性分子包含抗her3肿瘤靶向部分(例如,抗her3fab)、抗igf1r肿瘤靶向部分(例如,抗igf1rfab)、抗cd3t细胞衔接子部分(例如,抗cd3fab或scfv)、和il-7(或其功能变体)。
在一个实施例中,所述多特异性分子包含抗her3肿瘤靶向部分(例如,抗her3fab)、抗igf1r肿瘤靶向部分(例如,抗igf1rfab)、抗nkp46nk细胞衔接子部分(例如,抗nkp46fab或scfv)、和il-7(或其功能变体)。
在一个实施例中,所述多特异性分子包含抗fap肿瘤靶向部分(例如,抗fapfab)和透明质酸酶1(或其功能变体)。
在一个实施例中,所述多特异性分子包含抗fap肿瘤靶向部分(例如,抗fapfab)、il-2(或其功能变体)、和透明质酸酶1(或其功能变体)。
在一个实施例中,所述多特异性分子包含抗fap肿瘤靶向部分(例如,抗fapfab)、抗pdl1肿瘤靶向部分(例如,抗pdl1fab)、il-2(或其功能变体)、和透明质酸酶1(或其功能变体)。
在一个实施例中,所述多特异性分子包含抗fap肿瘤靶向部分(例如,抗fapfab)、抗pdl1肿瘤靶向部分(例如,抗pdl1fab)、和透明质酸酶1(或其功能变体)。
在一个实施例中,所述多特异性分子包含抗pdl1肿瘤靶向部分(例如,抗pdl1fab)、抗nkp46nk细胞衔接子部分(例如,抗nkp46fab或scfv)、il-2(或其功能变体)、和透明质酸酶1(或其功能变体)。
在一个实施例中,所述多特异性分子包含抗fap肿瘤靶向部分(例如,抗fapfab)和明胶酶(或其功能变体)。
在一个实施例中,所述多特异性分子包含抗fap肿瘤靶向部分(例如,抗fapfab)、抗pdl1肿瘤靶向部分(例如,抗pdl1fab)、il-2(或其功能变体)、和明胶酶(或其功能变体)。
在另一方面,本披露提供了编码本文描述的任何多特异性或多功能分子多肽的分离的核酸分子。
在另一方面,本披露提供了分离的核酸分子,所述分离的核酸分子包含编码本文描述的任何多特异性或多功能分子的核苷酸序列、或与其基本上同源(例如,与其至少95%至99.9%相同)的核苷酸序列。
在另一方面,本披露提供了包含一种或多种本文描述的任何核酸分子的载体(例如,表达载体)。
在另一方面,本披露提供了包含本文描述的核酸分子或载体的宿主细胞。
在另一方面,本披露提供了制备(例如,产生)本文描述的多特异性或多功能分子多肽的方法,所述方法包括在适合的条件(例如,适合于基因表达和/或同源或异源二聚化的条件)下培养本文描述的宿主细胞。
在另一方面,本披露提供了包含本文描述的多特异性或多功能分子多肽和药学上可接受的载体、赋形剂、或稳定剂的药物组合物。
在另一方面,本披露提供了治疗癌症的方法,所述方法包括向有需要的受试者给予本文描述的多特异性或多功能分子多肽,其中将所述多特异性抗体以治疗有效量给予以治疗所述癌症。
在一些实施例中,所述癌症是实体瘤癌症、或转移病灶。在一些实施例中,所述实体瘤癌症是胰腺癌(例如,胰腺腺癌)、乳腺癌、结肠直肠癌、肺癌(例如,小细胞或非小细胞肺癌)、皮肤癌、卵巢癌、或肝癌中的一种或多种。在一些实施例中,所述癌症是血液癌。
在一些实施例中,所述方法进一步包括给予第二治疗性治疗。在一些实施例中,第二治疗性治疗包括治疗剂(例如,化疗剂、生物剂、激素疗法)、放射、或手术。在一些实施例中,治疗剂选自:化疗剂、或生物剂。
除非另外定义,本文中使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常所理解的相同的含义。虽然类似或等同于本文中描述的那些的方法和材料可以用于本发明的实践或测试中,但是下面描述了合适的方法和材料。本文提及的所有出版物、专利申请、专利和其他参考文献通过引用以其整体而并入。在发生冲突的情况下,以包括定义的本说明书为准。另外,所述材料、方法和实例仅仅是说明性的并不意在是限制性的。
根据以下详细描述和权利要求书,本发明的其他特征和优点将是显而易见的。
附图说明
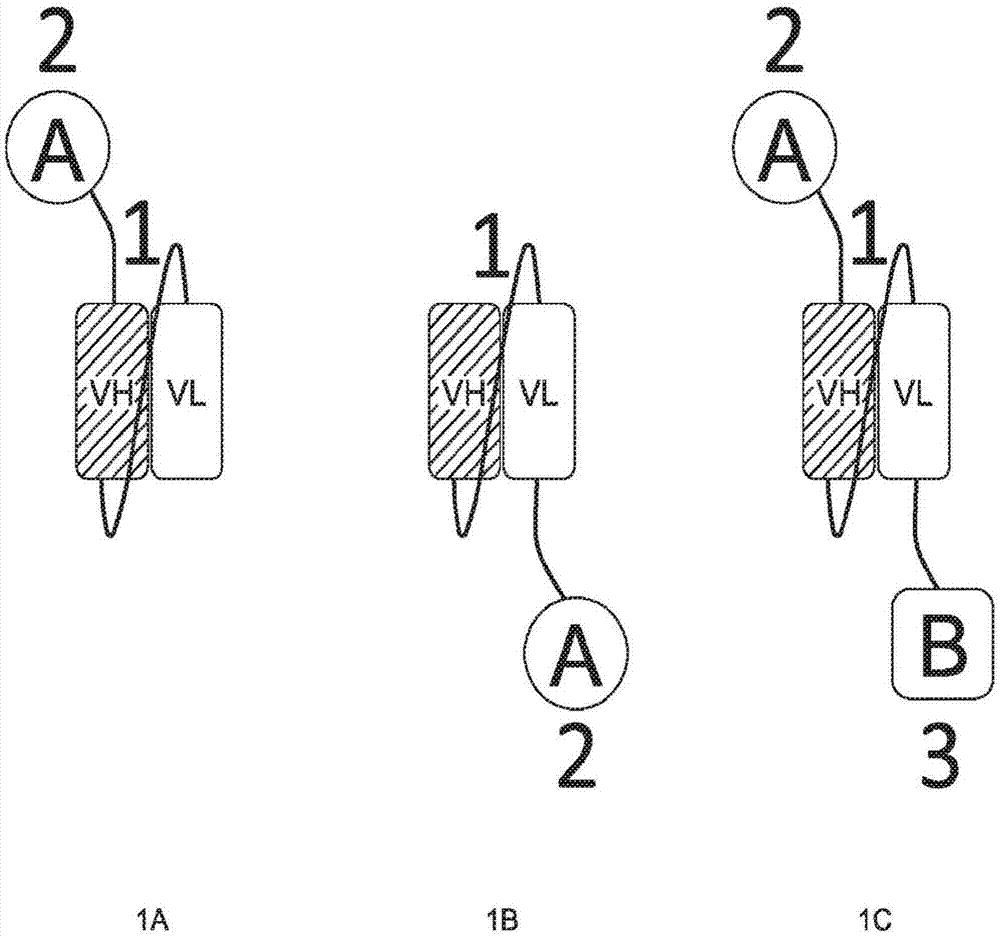
图1a-1c描绘了包含单多肽链(例如,基于scfv的形式)的多特异性分子的图示。双特异性和三特异性分子可以包含scfv核心。配偶体a可以连接至vh的n-末端或vl的c-末端(分别为图1a或图1b),任选地通过接头连接,其中配偶体a对应于双特异性形式中的结合部分2。配偶体a可以是抗体分子(例如,单链抗体分子(例如,scfv)或fab)、受体分子、配体分子(例如,受体配体、或细胞因子分子),例如如本文描述的。在一些实施例中,结合部分1和结合部分2可以各自独立地选自肿瘤靶向部分、细胞因子分子、t细胞衔接子、nk细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子。在一些实施例中,结合部分1是如本文描述的肿瘤靶向部分,例如与癌抗原结合的scfv;并且对应于结合部分2的配偶体a可以选自细胞因子分子、t细胞衔接子、nk细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子,例如如本文描述的。
在三特异性形式的实施例中,配偶体a和b分别作为结合部分2和3例如经由接头连接至scfv(图1c)。配偶体a和配偶体b可以独立地是抗体分子(例如,单链抗体分子(例如,scfv)或fab)、受体分子、配体分子(例如,受体配体、或细胞因子分子),例如如本文描述的。在一些实施例中,结合部分1、结合部分2和结合部分3可以各自独立地选自肿瘤靶向部分、细胞因子分子、t细胞衔接子、nk细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子。在一些实施例中,结合部分1是如本文描述的肿瘤靶向部分,例如与癌抗原结合的scfv;并且配偶体a和b各自独立地选自细胞因子分子、t细胞衔接子、nk细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子,例如如本文描述的。
配偶体a可以是基质修饰部分,例如如本文描述的。在一些实施例中,结合部分1是肿瘤靶向部分且结合部分2是基质修饰部分。在一些实施例中,结合部分1是如本文描述的肿瘤靶向部分,例如与癌抗原结合的scfv;并且对应于结合部分2的配偶体a是基质修饰部分,例如如本文描述的。在三特异性形式的实施例中,配偶体a和b分别作为结合部分2和3例如经由接头连接至scfv(图1c)。三特异性分子添加融合配偶体b(结合部分3),其可以是细胞因子分子、t细胞衔接子、nk细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子。融合配偶体a和b可以分别在fab的重链和轻链上或scfv的轻链和重链上。在一些实施例中,配偶体a是基质修饰部分,例如如本文描述的。在一些实施例中,结合部分1是肿瘤靶向部分且结合部分2是基质修饰部分。
图2a-2c描绘了包含单多肽链(例如,基于scfv的形式)的多特异性分子的图示。双特异性和三特异性分子可以包含scfv核心。配偶体a可以连接至vh的c末端或vl的n末端(分别为图2a或图2b),任选地通过接头连接,其中配偶体a对应于双特异性形式中的结合部分2。配偶体a可以是抗体分子(例如,单链抗体分子(例如,scfv)或fab)、受体分子、配体分子(例如,受体配体、或细胞因子分子),例如如本文描述的。在一些实施例中,结合部分1是如本文描述的肿瘤靶向部分,例如与癌抗原结合的scfv;并且对应于结合部分2的配偶体a选自细胞因子、t细胞衔接子、nk细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子,例如如本文描述的。在一些实施例中,结合部分1和结合部分2可以各自独立地选自肿瘤靶向部分、细胞因子分子、t细胞衔接子、nk细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子。
在三特异性形式的实施例中,配偶体a和b分别作为结合部分2和3例如经由接头连接至scfv(图1c)。配偶体a和配偶体b可以独立地是抗体分子(例如,单链抗体分子(例如,scfv)或fab)、受体分子、配体分子(例如,受体配体、或细胞因子分子),例如如本文描述的。在一些实施例中,结合部分1、结合部分2和结合部分3可以各自独立地选自肿瘤靶向部分、细胞因子分子、t细胞衔接子、nk细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子。在一些实施例中,结合部分1是如本文描述的肿瘤靶向部分,例如与癌抗原结合的scfv;并且配偶体a和b各自独立地选自细胞因子分子、t细胞衔接子、nk细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子,例如如本文描述的。
配偶体a可以连接至vh的c末端或vl的n末端(分别为图2a或图2b),任选地通过接头连接,其中配偶体a对应于双特异性形式中的结合部分2。在一些实施例中,结合部分1是肿瘤靶向部分且结合部分2是基质修饰部分。在一些实施例中,结合部分1是如本文描述的肿瘤靶向部分,例如与癌抗原结合的scfv;并且对应于结合部分2的配偶体a是基质修饰部分,例如如本文描述的。在三特异性形式的实施例中,配偶体a和b分别作为结合部分2和3例如经由接头连接至scfv(图2c)。三特异性分子添加融合配偶体b(结合部分3),其可以是细胞因子分子、t细胞衔接子、nk细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子。融合配偶体a和b可以分别在fab的重链和轻链上或scfv的轻链和重链上。在一些实施例中,配偶体a是基质修饰部分,例如如本文描述的。在一些实施例中,结合部分1是肿瘤靶向部分且结合部分2是基质修饰部分。
图3a-3c描绘了包含第一和第二多肽链(例如,具有c-末端融合物的基于fab的形式)的多特异性分子的图示。双特异性和三特异性分子可以包含fab核心。fab的vh和vl可以作为分子的结合部分1起作用。配偶体a可以连接至cl或ch1的c-末端(分别为图3a或图3b),任选地通过接头连接,其中配偶体a对应于双特异性形式中的结合部分2。配偶体a可以是抗体分子(例如,单链抗体分子(例如,scfv)或fab)、受体分子、配体分子(例如,受体配体、或细胞因子分子),例如如本文描述的。在一些实施例中,结合部分1和结合部分2可以各自独立地选自肿瘤靶向部分、细胞因子分子、t细胞衔接子、nk细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子。在一些实施例中,结合部分1是如本文描述的肿瘤靶向部分,例如与癌抗原结合的fab;并且对应于结合部分2的配偶体a选自细胞因子、t细胞衔接子、nk细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子,例如如本文描述的。
在三特异性形式的实施例中,配偶体a和b分别作为结合部分2和3例如经由接头连接至fab的c-末端(图3c)。配偶体a和配偶体b可以各自独立地是抗体分子(例如,单链抗体分子(例如,scfv)或fab)、受体分子、配体分子(例如,受体配体、或细胞因子分子),例如如本文描述的。在一些实施例中,结合部分1、结合部分2和结合部分3可以各自独立地选自肿瘤靶向部分、细胞因子分子、nk细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子。在一些实施例中,结合部分1是如本文描述的肿瘤靶向部分,例如与癌抗原结合的scfv;并且配偶体a和b各自独立地选自细胞因子分子、t细胞衔接子、nk细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子,例如如本文描述的。
fab的vh和vl作为分子的结合部分1起作用。可以融合至(通过接头连接)cl或ch1的c-末端的融合配偶体a(分别为图3a和图3b)是双特异性形式中的结合部分2。在双特异性形式的一些实施例中,结合部分1是肿瘤靶向fab且融合配偶体a(结合部分2)是基质修饰分子。三特异性形式可以在fab的c-末端上具有分别作为结合部分2和3的融合配偶体a和b(图3c)。三特异性分子添加融合配偶体b(结合部分3),其可以是细胞因子分子、t细胞衔接子、nk细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子。融合配偶体a和b可以分别在fab的重链和轻链上或fab的轻链和重链上。
图4a-4c描绘了包含第一和第二多肽链(例如,具有n-末端融合物的基于fab的形式)的多特异性分子的图示。描绘的双特异性和三特异性分子包含fab核心。fab的vh和vl可以作为分子的结合部分1起作用。配偶体a可以连接至vl或vh的n-末端(分别为图4a或图4b),任选地通过接头连接,其中配偶体a对应于双特异性形式中的结合部分2。配偶体a可以是抗体分子(例如,单链抗体分子(例如,scfv)或fab)、受体分子、配体分子(例如,受体配体、或细胞因子分子),例如如本文描述的。在一些实施例中,结合部分1和结合部分2可以各自独立地选自肿瘤靶向部分、细胞因子分子、t细胞衔接子、nk细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子。在一些实施例中,结合部分1是如本文描述的肿瘤靶向部分,例如与癌抗原结合的fab;并且对应于结合部分2的配偶体a选自细胞因子、t细胞衔接子、nk细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子,例如如本文描述的。
在三特异性形式的实施例中,配偶体a和b分别作为结合部分2和3例如经由接头连接至fab的n-末端(图4c)。配偶体a和配偶体b可以独立地是抗体分子(例如,单链抗体分子(例如,scfv)或fab)、受体分子、配体分子(例如,受体配体、或细胞因子分子),例如如本文描述的。在一些实施例中,结合部分1、结合部分2和结合部分3可以各自独立地选自肿瘤靶向部分、细胞因子分子、t细胞衔接子、nk细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子。在一些实施例中,结合部分1是如本文描述的肿瘤靶向部分,例如与癌抗原结合的fab;并且对应于结合部分2和结合部分3的配偶体a和配偶体b各自独立地选自细胞因子、t细胞衔接子、nk细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子,例如如本文描述的。
双特异性和三特异性分子可以包含fab核心。fab的vh和vl可以作为分子的结合部分1起作用。可以融合至(通过接头连接)cl或ch1的n-末端的融合配偶体a(分别为图4a和图4b)是双特异性形式中的结合部分2。在双特异性形式的实施例中,结合部分1是肿瘤靶向fab且融合配偶体a(结合部分2)是基质修饰分子。在实施例中,三特异性形式在fab的c-末端上具有分别作为结合部分2和3的融合配偶体a和b(图4c)。三特异性分子添加融合配偶体b(结合部分3),其可以是细胞因子分子、t细胞衔接子、nk细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子。融合配偶体a和b可以分别在fab的重链和轻链上或fab的轻链和重链上。
图5a-5c描绘了包含第一和第二多肽链(例如,基于fc的形式)的多特异性分子的图示。在显示的实施例中,多特异性分子包含异源二聚体fc核心(杵臼结构(knob-in-hole,kih))。双特异性分子可以具有配偶体a和b,其分别描绘为结合部分1和2(图5a)。配偶体a和配偶体b可以各自独立地是抗体分子(例如,单链抗体分子(例如,scfv)或fab)、受体分子、配体分子(例如,受体配体或细胞因子分子),例如如本文描述的。配偶体a和配偶体b可以连接至异源二聚体fc核心的第一或第二成员、或每个成员。在一个实施例中,配偶体a连接至第一fc分子的–ch2-ch3-区的n-末端,并且配偶体b连接至第二fc分子的–ch2-ch3-区的n-末端。可替代地,配偶体a连接至第一fc分子的–ch2-ch3-区的c-末端,并且配偶体b连接至第二fc分子的–ch2-ch3-区的c-末端。可替代地,配偶体a可以连接至异源二聚体fc核心的第一成员的n-末端,并且配偶体b可以连接至异源二聚体fc核心的第二成员的c-末端。在其他实施例中,配偶体b可以连接至异源二聚体fc核心的第一成员的n-末端,并且配偶体a可以连接至异源二聚体fc核心的第二成员的c-末端。在一些实施例中,结合部分1和结合部分2可以各自独立地选自肿瘤靶向部分、细胞因子分子、t细胞衔接子、nk细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子。在一些实施例中,结合部分1是肿瘤靶向部分,并且结合部分2选自细胞因子分子、t细胞衔接子、nk细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子。
示例性三特异性和四特异性分子分别描绘在图5b和5c中。可以将一个或两个另外的配偶体c和d(其可以分别是单个或多个结合部分3和4)添加至前述分子上。配偶体a、配偶体b、配偶体c和配偶体d可以独立地是抗体分子(例如,单链抗体分子(例如,scfv)或fab)、受体分子、配体分子(例如,受体配体、或细胞因子分子),例如如本文描述的。在一些实施例中,可以将配偶体c和配偶体d添加至fc核心的第一和第二成员的c-末端,从而分别形成结合特异性3和4。在一些实施例中,配偶体a-d(分别对应于结合特异性1-4)各自独立地选自肿瘤靶向部分、细胞因子分子、t细胞衔接子、nk细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子,例如如本文描述的。在一个实施例中,配偶体a。在实施例中,配偶体a是肿瘤靶向部分,并且配偶体b、配偶体c和d各自独立地选自细胞因子分子、t细胞衔接子、nk细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子。
双特异性分子可以具有配偶体a和b,其分别描绘为结合部分1和2(图5a)。配偶体a和配偶体b可以各自独立地是基质修饰部分、酶分子、抗体分子(例如,单链抗体分子(例如,scfv)或fab)、受体分子、配体分子(例如,受体配体或细胞因子分子),例如如本文描述的。配偶体a和配偶体b可以连接至异源二聚体fc核心的第一或第二成员、或每个成员。在一个实施例中,配偶体a连接至第一fc分子的–ch2-ch3-区的n-末端,并且配偶体b连接至第二fc分子的–ch2-ch3-区的n-末端。可替代地,配偶体a连接至第一fc分子的–ch2-ch3-区的c-末端,并且配偶体b连接至第二fc分子的–ch2-ch3-区的c-末端。可替代地,配偶体a可以连接至异源二聚体fc核心的第一成员的n-末端,并且配偶体b可以连接至异源二聚体fc核心的第二成员的c-末端。在其他实施例中,配偶体b可以连接至异源二聚体fc核心的第一成员的n-末端,并且配偶体a可以连接至异源二聚体fc核心的第二成员的c-末端。在一些实施例中,结合部分1是肿瘤靶向部分且结合部分2是基质修饰部分。在其他实施例中,结合部分2是肿瘤靶向部分且结合部分1是基质修饰部分。
示例性三特异性和四特异性分子分别描绘在图5b和5c中。可以将一个或两个另外的配偶体c和d(其可以分别是单个或多个结合部分3和4)添加至前述分子上。配偶体a、配偶体b、配偶体c和配偶体d可以独立地是抗体分子(例如,单链抗体分子(例如,scfv)或fab)、受体分子、配体分子(例如,受体配体、或细胞因子分子),例如如本文描述的。在一些实施例中,可以将配偶体c和配偶体d添加至fc核心的第一和第二成员的c-末端,从而分别形成结合特异性3和4。在一些实施例中,配偶体a-d(分别对应于结合特异性1-4)各自独立地选自肿瘤靶向部分、细胞因子分子、t细胞衔接子、nk细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子、或基质修饰部分,例如如本文描述的。在一些实施例中,配偶体a、b、c、或d之一是基质修饰部分,配偶体a、b、c、或d之一是肿瘤靶向部分,并且剩余的两个配偶体各自独立地选自肿瘤靶向部分、细胞因子分子、t细胞衔接子、nk细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子。
图6描绘了双特异性分子的示例性示意图,所述双特异性分子包含对应于结合位点#1的与结合位点#2融合的fab。在实施例中,结合位点#1是肿瘤靶向部分,例如与癌抗原(例如,肿瘤或基质抗原)结合;并且结合位点#2选自细胞因子分子、或作为免疫细胞衔接子的配体分子或scfv(例如,与免疫细胞抗原结合)。在实施例中,双特异性分子包含两个不连续多肽,其中第一多肽从n-至-c具有以下构型:与例如肿瘤或基质抗原结合的fab的vh-ch1任选地经由接头融合至结合位点#2;并且第二多肽从n-至-c具有以下构型:与例如肿瘤或基质抗原结合的fab的vl-cl。
图7描绘了双特异性分子的示例性示意图,所述双特异性分子包含对应于结合位点#1的任选地经由接头连接至免疫球蛋白恒定区的第一成员(例如,第一fc分子)的fab;以及任选地经由接头连接至fc分子的第二成员的结合位点#2。在实施例中,结合位点#1是肿瘤靶向部分,例如与肿瘤或基质抗原结合;并且结合位点#2选自细胞因子分子、或免疫细胞衔接子(例如,与免疫细胞抗原结合的配体分子、或scfv)。在实施例中,双特异性分子包含三个不连续多肽,其中第一多肽从n-至-c具有以下构型:与例如肿瘤或基质抗原结合的fab的vh-ch1任选地经由接头连接至fc分子的第一成员(例如,第一ch2-ch3区,任选地包含突起或杵);第二多肽从n-至-c具有以下构型:与例如肿瘤或基质抗原结合的fab的vl-cl;并且第三多肽从n-至-c具有以下构型:结合位点#2(例如,细胞因子分子、与例如免疫细胞抗原结合的配体分子、或scfv),任选地经由接头连接至fc分子的第二成员(例如,第二ch2-ch3区,任选地包含臼或空腔)。在实施例中,fc分子的第一和第二成员促进双特异性分子的异源二聚化。
图8a-8c描绘了三特异性分子的示例性示意图,所述三特异性分子包含对应于结合位点#1的与结合位点#2和结合位点#3融合的fab。在实施例中,结合位点#1是肿瘤靶向部分,例如与肿瘤或基质抗原结合;并且结合位点#2和#3独立地选自细胞因子分子、或免疫细胞衔接子(例如,与免疫细胞抗原结合的配体分子或scfv)。在实施例中,图8a中的三特异性分子包含两个不连续多肽,其中第一多肽从n-至-c具有以下构型:与例如肿瘤或基质抗原结合的fab的vh-ch1任选地经由接头连接至结合位点#3(例如,选自细胞因子分子、配体或scfv);并且第二多肽从n-至-c具有以下构型:与例如肿瘤或基质抗原结合的fab的vl-cl融合至与例如免疫细胞抗原结合的scfv(例如,从n-至-c,scfv的vh-vl)。图8b描绘了可替代的构型,其中第一多肽从n-至-c具有以下构型:与例如肿瘤或基质抗原结合的fab的vh-ch1任选地经由接头连接至细胞因子分子;并且第二多肽从n-至-c具有以下构型:与例如肿瘤或基质抗原结合的fab的vl-cl连接至配体或scfv(例如,与例如免疫细胞结合的配体或scfv)。图8c描绘了可替代的构型,其中第一多肽从n-至-c具有以下构型:与例如肿瘤或基质抗原结合的fab的vh-ch1任选地经由接头连接至与例如第一免疫细胞结合的配体或scfv;并且第二多肽从n-至-c具有以下构型:与例如肿瘤或基质抗原结合的fab的vl-cl任选地经由接头连接至与例如第二免疫细胞结合的配体或scfv。
图9a-9b描绘了三特异性分子的示例性示意图,所述三特异性分子包含对应于结合位点#1的fab、结合位点#2、结合位点#3,其各自例如经由接头连接至免疫球蛋白结合结构域的第一和第二成员,例如第一和第二fc分子。在实施例中,三特异性分子包含图9a-9b中显示的三个不连续多肽。在图9a中显示的实施例中,第一多肽从n-至-c具有以下构型:与例如肿瘤或基质抗原结合的fab的vh-ch1例如经由接头连接至fc分子的第一成员(例如,第一fc分子的ch2-ch3区的n-末端,任选地包含突起或空腔),所述第一成员可以任选地进一步包含任选地经由接头连接至第一fc分子的c-末端的结合位点#3;第二多肽从n-至-c方向包含结合位点#2,其例如经由接头连接至fc分子的第二成员(例如,第二fc分子的ch2-ch3区的n-末端,任选地包含突起或空腔);并且第三多肽从n-至-c包含:与例如结合肿瘤或基质抗原的fab的vl-cl。在图9b中显示的实施例中,第一多肽从n-至-c具有以下构型:与例如肿瘤或基质抗原结合的fab的vh-ch1例如经由接头连接至fc分子的第一成员(例如,第一fc分子的ch2-ch3区的n-末端,任选地包含突起或空腔);第二多肽从n-至-c方向包含结合位点#2,其例如经由接头连接至fc分子的第二成员(例如,第二fc分子的ch2-ch3区的n-末端,任选地包含突起或空腔),所述第二成员可以任选地进一步包含任选地经由接头连接至第二fc分子的c-末端的结合位点#3;并且第三多肽从n-至-c包含:与例如结合肿瘤或基质抗原的fab的vl-cl。在前述实施例中,结合位点#1于肿瘤或基质抗原结合;并且结合位点#2和#3独立地选自细胞因子分子、或免疫细胞衔接子(例如,与免疫细胞抗原结合的配体分子或scfv)。在实施例中,fc分子的第一和第二成员促进三特异性分子的异源二聚化。
图10a-10c描绘了四特异性分子的示例性示意图,所述四特异性分子包含对应于结合位点#1的fab、结合位点#2、结合位点#3、和结合位点#4,其各自例如经由接头连接至免疫球蛋白恒定区的第一和第二成员,例如第一和第二fc分子。在实施例中,四特异性分子包含图10a-10c中显示的三个不连续多肽。在图10a中显示的实施例中,第一多肽从n-至-c具有以下构型:与例如肿瘤或基质抗原结合的fab的vh-ch1例如经由接头连接至fc分子的第一成员(例如,第一fc分子的ch2-ch3区的n-末端,任选地包含突起或空腔),所述第一成员可以任选地进一步包含任选地经由接头连接至第一fc分子的c-末端的结合位点#3);第二多肽从n-至-c方向包含结合位点#2,其例如经由接头连接至fc分子的第二成员(例如,第二fc分子的ch2-ch3区的n-末端,任选地包含突起或空腔),所述第二成员可以任选地进一步包含任选地经由接头连接至第二fc分子的c-末端的结合位点#4;并且第三多肽从n-至-c包含:与例如结合肿瘤或基质抗原的fab的vl-cl。在图10a中描绘的实施例中,结合位点#1与肿瘤或基质抗原结合;并且结合位点#2、#3和#4独立地选自细胞因子分子、与例如免疫细胞抗原结合的配体分子、或scfv。在图10a中描绘的实施例中,结合位点#1与肿瘤或基质抗原结合;并且结合位点#2、#3和#4独立地选自细胞因子分子、与例如免疫细胞抗原结合的配体分子、或scfv。在图10b中描绘的实施例中,结合位点#1与肿瘤或基质抗原结合;结合位点#2描绘了连接至(例如经由接头)第二fc成员的n-末端的nk细胞衔接子(例如,scfv),例如在vh-vl方向上从n-至c-末端;结合位点#3描绘了连接至(例如经由接头)第一fc成员的c-末端的细胞因子分子或免疫细胞衔接子(例如,scfv);并且结合位点#4描绘了与例如免疫细胞抗原结合的连接至(例如经由接头)第二fc成员的c-末端的配体分子、或scfv。在图10c中描绘的实施例中,结合位点#1与肿瘤或基质抗原结合;结合位点#2描绘了连接至(例如经由接头)第二fc成员的n-末端的nk细胞衔接子(例如,scfv),例如在vh-vl方向上从n-至c-末端;结合位点#3描绘了连接至(例如经由接头)第一fc成员的c-末端的配体分子或免疫细胞衔接子(例如,scfv);并且结合位点#4描绘了与例如免疫细胞抗原结合的连接至(例如经由接头)第二fc成员的c-末端的配体分子、或scfv。在任何前述四特异性分子的实施例中,fc分子的第一和第二成员促进四特异性分子的异源二聚化。
图11a-11c描绘了示例性三特异性分子。图11a显示了三特异性分子的图示,所述三特异性分子包含针对间皮素肿瘤抗原的fab分子,其中第一多肽包含经由接头连接至il-15细胞因子的fab的重链vh-ch1,并且fab的第二多肽包含经由接头连接至cd40配体(cd40l)的轻链vl-cl。图11b从n-至c-方向提供了如下的氨基酸序列:任选的信号肽(以斜体显示),随后是fab的重链vh-ch1(对于vh和ch1分别以下划线和黑体显示),经由gly-ser接头(以虚下划线显示)连接至人il-15细胞因子(以常规字体显示)。图11c从n-至c-方向提供了如下的氨基酸序列:任选的信号肽(以斜体显示),随后是fab的κ轻链vl-cl(对于vl和cl分别以下划线和黑体显示),经由gly-ser接头(以虚下划线显示)连接至人cd40l(以常规字体显示)。
图12a-12d描绘了示例性双特异性分子,所述双特异性分子包含基质靶标的fab和细胞因子分子,其各自例如经由接头连接至免疫球蛋白恒定区的第一和第二成员,例如第一和第二fc分子。图12a显示了双特异性分子的图示,所述双特异性分子包含针对基质抗原的fab分子,其中第一多肽包含连接至具有空腔的第一fc分子的基质抗原的fab的重链vh-ch1;第二多肽包含连接至具有突起的第二fc分子的il-15细胞因子;并且第三多肽包含基质抗原的fab的轻链vl-cl。图12b从n-至c-方向提供了如下的氨基酸序列:任选的信号肽(以斜体显示),随后是人il-15细胞因子(以下划线显示),并且进一步包含连接至具有突起的第二fc分子(以常规字体显示)的任选的gly-ser接头(以虚下划线显示)。图12c从n-至c-方向提供了如下的氨基酸序列:任选的信号肽(以斜体显示),随后是基质抗原fap的fab的重链vh-ch1(对于vh和ch1分别以下划线和黑体显示),连接至具有空腔的第一fc分子(以常规字体显示)。图12d从n-至c-方向提供了如下的氨基酸序列:任选的信号肽(以斜体显示),随后是基质抗原fap的fab的κ轻链vl-cl(对于vl和cl分别以下划线和黑体显示)。
图13a-13d描绘了示例性四特异性分子,所述四特异性分子包含基质靶标的fab、两种免疫细胞衔接子、和细胞因子分子,其各自例如经由接头连接至免疫球蛋白恒定区的第一和第二成员,例如第一和第二fc分子。图13a显示了四特异性分子的图示,所述四特异性分子包含针对基质抗原的fab分子,其中第一多肽包含连接至具有空腔的第一fc分子的基质抗原的fab的重链vh-ch1,并且进一步包含第一免疫细胞衔接子,例如b7h6;第二多肽包含任选地经由gly-ser接头连接至具有突起的第二fc分子的il-15细胞因子,并且进一步包含(例如经由gly-ser接头)第二免疫细胞衔接子,例如cd40l;并且第三多肽包含基质抗原的fab的轻链vl-cl。图13b从n-至c-方向提供了如下的氨基酸序列:任选的信号肽(以斜体显示),随后是人il-15细胞因子(以下划线显示),进一步包含连接至具有突起的第二fc分子(以黑体显示)的任选的gly-ser接头(以虚下划线显示),其进一步包括例如连接至人cd40l氨基酸序列(以常规字体显示)的任选的gly-ser接头(以虚下划线显示)。图13c从n-至c-方向提供了如下的氨基酸序列:任选的信号肽(以斜体显示),随后是基质抗原fap的fab的重链vh-ch1(对于vh和ch1分别以下划线和黑体显示),连接至具有空腔的第一fc分子(以常规字体显示),其进一步包括例如连接至人b7h6氨基酸序列(以下划线显示)的任选的gly-ser接头(以虚下划线显示)。图13d从n-至c-方向提供了如下的氨基酸序列:任选的信号肽(以斜体显示),随后是基质抗原fap的fab的κ轻链vl-cl(对于vl和cl分别以下划线和常规字体显示)。
图14a-14b描绘了示例性四特异性分子,所述四特异性分子包含间皮素的fab(分子a)、两种免疫细胞衔接子、41bb配体(分子c)和cd40配体(分子d)、和细胞因子分子(分子b),其各自例如经由接头连接至免疫球蛋白恒定区的第一和第二成员,例如第一和第二fc分子(杵臼结构(kih),fc第一成员和fc臼第二成员)。图14a-14b显示了四特异性分子的图示,所述四特异性分子包含针对间皮素抗原的fab分子,其中第一多肽包含连接至在ch3区具有突起(杵)的第一fc分子的间皮素抗原的fab的重链vh-ch1,并且进一步包含第一免疫细胞衔接子,例如41bb配体;第二多肽包含任选地经由gly-ser接头连接至具有空腔(臼)的第二fc分子的il-21细胞因子,并且进一步包含(例如经由gly-ser接头)第二免疫细胞衔接子,例如cd40l;并且第三多肽包含间皮素抗原的fab的轻链vl-cl(分子a)。显示了以下氨基酸序列:
(i)分别对应于间皮素结合fab的重链和轻链的分子a(a_hmeso_ss1_fab);
(ii)对应于人il-21的分子b;
(iii)分子b与第二fc区之间的接头(分子b至kih_fc接头);
(iv)第一fc区与分子c之间的接头(kih_fc至分子c接头);(v)对应于人41bb配体的分子c;
(vi)第二fc区与分子d之间的接头(kih_fc至分子d接头);
(vii)对应于人cd40l的分子c;
(viii)第一成员fc区(fc杵),从n至c方向包含间皮素fab的vh、ch2-ch3氨基酸序列(包括在位置354处的c取代为s且在位置366处的t取代为w),随后是gly-ser接头和人41bb配体;以及
(ix)第二成员fc区(fc臼),从n至c方向包含人il-21、gly-ser接头、ch2-ch3氨基酸序列(包括在位置349处的y取代为c,在位置366处的t取代为s,在位置368处的l取代为a,在位置407处的y取代为v),随后是gly-ser接头和人cd40l。
图15a-15j是示例性双特异性抗体分子的图示。图15a是利用“杵臼结构”异源二聚化的双特异性抗体的图示。图15b是利用共有轻链的双特异性抗体的图示。图15c是igg-fab双特异性抗体的图示。图15d是igg-dsscfv2双特异性抗体的图示。图15e是dvd双特异性抗体的图示。图15f是双抗体的图示。图15g是dart双特异性抗体的图示。图15h是tandab双特异性抗体的图示。图15i是fab-scfv2双特异性抗体的图示。图15j是fab-scfv双特异性抗体的图示。编码图15a-15j中描绘的分子的每个结构单元的对应的mrna描绘于抗体分子下方。
图16描绘了双特异性分子的示例性示意图,所述双特异性分子包含对应于结合位点#1的与结合位点#2融合的fab。在实施例中,结合位点#1是肿瘤靶向部分,例如与癌抗原(例如,肿瘤或基质抗原)结合;并且结合位点#2是基质修饰部分。在实施例中,双特异性分子包含两个不连续多肽,其中第一多肽从n-至-c具有以下构型:与例如癌抗原结合的fab的vh-ch1任选地经由接头融合至结合位点#2;并且第二多肽从n-至-c具有以下构型:与例如癌抗原(例如,肿瘤或基质抗原)结合的fab的vl-cl。
图17描绘了双特异性分子的示例性示意图,所述双特异性分子包含对应于结合位点#1的任选地经由接头连接至免疫球蛋白恒定区的第一成员(例如,第一fc分子)的fab;以及任选地经由接头连接至fc分子的第二成员的结合位点#2。在实施例中,结合位点#1是肿瘤靶向部分,例如与肿瘤或基质抗原结合;并且结合位点#2是基质修饰部分。在实施例中,双特异性分子包含三个不连续多肽,其中第一多肽从n-至-c具有以下构型:与例如肿瘤或基质抗原结合的fab的vh-ch1任选地经由接头连接至fc分子的第一成员(例如,第一ch2-ch3区,任选地包含突起或杵);第二多肽从n-至-c具有以下构型:与例如肿瘤或基质抗原结合的fab的vl-cl;并且第三多肽从n-至-c具有以下构型:结合位点#2(基质修饰部分),任选地经由接头连接至fc分子的第二成员(例如,第二ch2-ch3区,任选地包含臼或空腔)。在实施例中,fc分子的第一和第二成员促进双特异性分子的异源二聚化。
图18描绘了三特异性分子的示例性示意图,所述三特异性分子包含对应于结合位点#1的与结合位点#2和结合位点#3融合的fab。在实施例中,结合位点#1是肿瘤靶向部分,例如与肿瘤或基质抗原结合;结合位点#2选自细胞因子分子、或免疫细胞衔接子(例如,与免疫细胞抗原结合的配体分子、或scfv);并且结合位点#3是基质修饰部分。在实施例中,图18中的三特异性分子包含两个不连续多肽,其中第一多肽从n-至-c具有以下构型:与例如肿瘤或基质抗原结合的fab的vh-ch1任选地经由接头连接至结合位点#3(基质修饰部分);并且第二多肽从n-至-c具有以下构型:与例如肿瘤或基质抗原结合的fab的vl-cl融合至与例如免疫细胞抗原结合的scfv(例如,从n-至-c,scfv的vh-vl)。
图19a-19b描绘了三特异性分子的示例性示意图,所述三特异性分子包含对应于结合位点#1的fab、结合位点#2、结合位点#3,其各自例如经由接头连接至免疫球蛋白结合结构域的第一和第二成员,例如第一和第二fc分子。在实施例中,三特异性分子包含图19a-19b中显示的三个不连续多肽。在图19a中显示的实施例中,第一多肽从n-至-c具有以下构型:与例如肿瘤或基质抗原结合的fab的vh-ch1例如经由接头连接至fc分子的第一成员(例如,第一fc分子的ch2-ch3区的n-末端,任选地包含突起或空腔),所述第一成员可以任选地进一步包含任选地经由接头连接至第一fc分子的c-末端的结合位点#3;第二多肽从n-至-c方向包含结合位点#2,其例如经由接头连接至fc分子的第二成员(例如,第二fc分子的ch2-ch3区的n-末端,任选地包含突起或空腔);并且第三多肽从n-至-c包含:与例如结合肿瘤或基质抗原的fab的vl-cl。在图19b中显示的实施例中,第一多肽从n-至-c具有以下构型:与例如肿瘤或基质抗原结合的fab的vh-ch1例如经由接头连接至fc分子的第一成员(例如,第一fc分子的ch2-ch3区的n-末端,任选地包含突起或空腔);第二多肽从n-至-c方向包含结合位点#2,其例如经由接头连接至fc分子的第二成员(例如,第二fc分子的ch2-ch3区的n-末端,任选地包含突起或空腔),所述第二成员可以任选地进一步包含任选地经由接头连接至第二fc分子的c-末端的结合位点#3;并且第三多肽从n-至-c包含:与例如结合肿瘤或基质抗原的fab的vl-cl。在前述实施例中,结合位点#1于肿瘤或基质抗原结合;结合位点#2选自细胞因子分子、或免疫细胞衔接子(例如,与免疫细胞抗原结合的配体分子、或scfv);并且结合位点#3是基质修饰部分。在实施例中,fc分子的第一和第二成员促进三特异性分子的异源二聚化。
图20描绘了四特异性分子的示例性示意图,所述四特异性分子包含对应于结合位点#1的fab、结合位点#2、结合位点#3、和结合位点#4,其各自例如经由接头连接至免疫球蛋白恒定区的第一和第二成员,例如第一和第二fc分子。在实施例中,四特异性分子包含三个不连续多肽。在所述实施例中,第一多肽从n-至-c具有以下构型:与例如肿瘤或基质抗原结合的fab的vh-ch1例如经由接头连接至fc分子的第一成员(例如,第一fc分子的ch2-ch3区的n-末端,任选地包含突起或空腔),所述第一成员可以任选地进一步包含任选地经由接头连接至第一fc分子的c-末端的结合位点#3);第二多肽从n-至-c方向包含结合位点#2,其例如经由接头连接至fc分子的第二成员(例如,第二fc分子的ch2-ch3区的n-末端,任选地包含突起或空腔),所述第二成员可以任选地进一步包含任选地经由接头连接至第二fc分子的c-末端的结合位点#4;并且第三多肽从n-至-c包含:与例如结合肿瘤或基质抗原的fab的vl-cl。在图10中描绘的实施例中,结合位点#1与肿瘤或基质抗原结合;结合位点#2和#4独立地选自细胞因子分子、与例如免疫细胞抗原结合的配体分子、或scfv;并且结合位点#3是基质修饰部分。
图21.多特异性分子1的凝胶。
图22.多特异性分子2的凝胶。
图23.多特异性分子3的凝胶。
图24.多特异性分子4的凝胶。
图25.多特异性分子5的凝胶。
图26.多特异性分子6的凝胶。
图27.多特异性分子7的凝胶。
图28.多特异性分子8的凝胶。
图29.多特异性分子9的凝胶。
图30.多特异性分子10的凝胶。
图31.多特异性分子11的凝胶。
图32.多特异性分子12的凝胶。
图33.多特异性分子13的凝胶。
图34.多特异性分子14的凝胶。
图35.多特异性分子15的凝胶。
图36.多特异性分子16的凝胶。
图37.多特异性分子17的凝胶。
图38.多特异性分子18的凝胶。
图39.多特异性分子19的凝胶。
图40.多特异性分子20的凝胶。
图41.多特异性分子21的凝胶。
图42.多特异性分子22的凝胶。
图43.多特异性分子1的尺寸排阻色谱图。
图44.多特异性分子5的尺寸排阻色谱图。
图45.多特异性分子11的尺寸排阻色谱图。
图46.多特异性分子12的尺寸排阻色谱图。
图47.多特异性分子13的尺寸排阻色谱图。
图48.与人间皮素(从seqidno:181产生)结合的多特异性分子1(圆形,实线)、多特异性分子2(菱形,点划线)、和多特异性分子3(方形,虚线)的elisa。
图49.与人间皮素(从seqidno:181产生)结合的多特异性分子5(圆形,实线)、多特异性分子6(菱形,短点划线)、多特异性分子7(方形,虚线)、和多特异性分子8(三角形,长点划线)的elisa。
图50.与人间皮素(从seqidno:181产生)结合的多特异性分子9(圆形,实线)、多特异性分子11(菱形,短点划线)、多特异性分子10(方形,虚线)、和多特异性分子12(三角形,长点划线)的elisa。
图51.与人pd1l1(从seqidno:178产生)结合的多特异性分子5(圆形,实线)、多特异性分子6(菱形,长点划线)、多特异性分子7(方形,虚线)、和多特异性分子9(三角形,短点划线)的elisa。
图52.与人pd1l1(从seqidno:178产生)结合的多特异性分子11(圆形,实线)、多特异性分子8(菱形,长点划线)、多特异性分子10(方形,虚线)、和多特异性分子12(三角形,短点划线)的elisa。
图53.与人il2rα(从seqidno:182产生)结合的多特异性分子1(圆形,实线)、多特异性分子2(菱形,点划线)、和多特异性分子4(方形,虚线)的elisa。
图54.与人il2rα(从seqidno:182产生)结合的多特异性分子6(圆形,实线)、多特异性分子8(菱形,长点划线)、多特异性分子10(方形,虚线)、和多特异性分子12(三角形,短点划线)的elisa。
图55.与人nkp30(从seqidno:180产生)的多特异性分子2(圆形,实线)和多特异性分子3(菱形,点划线)的elisa。
图56.与人nkp46(从seqidno:179产生)的多特异性分子7(圆形,实线)、多特异性分子9(菱形,点划线)、和多特异性分子11(方形,虚线)的elisa。
图57.与人nkp46(从seqidno:179产生)的多特异性分子8(圆形,实线)、多特异性分子10(菱形,点划线)、和多特异性分子11(方形,虚线)的elisa。
图58.多特异性分子1(圆形,实线)、多特异性分子2(菱形,虚线)、多特异性分子3(方形,点划线)、和多特异性分子4(三角形,点划线和虚线)的细胞杀伤曲线。
图59.多特异性分子1(实心黑色)、多特异性分子2(斜线)、多特异性分子3(白色)、和多特异性分子4(点状)的ifnγ的细胞因子释放。
图60.多特异性分子5(圆形)、多特异性分子6(菱形,短点划线)、多特异性分子7(方形,虚线)、和多特异性分子8(三角形,长点划线)的细胞杀伤曲线。
图61.多特异性分子5(圆形)、多特异性分子6(菱形,短点划线)、多特异性分子9(方形,虚线)、和多特异性分子10(三角形,长点划线)的细胞杀伤曲线。
图62.多特异性分子5(圆形)、多特异性分子6(菱形,短点划线)、多特异性分子11(方形,虚线)、和多特异性分子12(三角形,长点划线)的细胞杀伤曲线。
图63.多特异性分子22与人间皮素(来自seqidno:181)的结合。
图64.多特异性分子22与人pd1l1(来自seqidno:178)的结合。
图65.与人il2rα(从seqidno:182产生)结合的多特异性分子13(圆形,实线)、多特异性分子16(菱形,短点划线)、多特异性分子17(方形,虚线)、和多特异性分子22(三角形,长点划线)的elisa。
图66.与人nkp46(从seqidno:179产生)结合的多特异性分子14(圆形,实线)、多特异性分子21(菱形,短点划线)、和多特异性分子22(方形,虚线)的elisa。
图67.多特异性分子18(圆形,实线)、多特异性分子13(菱形,短点划线)、多特异性分子14(方形,虚线)、和多特异性分子16(三角形,长点划线)的细胞杀伤曲线。
图68.多特异性分子18(实心黑色)、多特异性分子13(点状)、多特异性分子14(白色)、和多特异性分子16(斜线)的ifnγ的细胞因子释放。
图69.多特异性分子18(圆形,实线)、多特异性分子13(菱形,短点划线)、多特异性分子15(方形,虚线)、和多特异性分子17(三角形,长点划线)的细胞杀伤曲线。
图70.多特异性分子18(实心黑色)、多特异性分子13(点状)、多特异性分子15(白色)、和多特异性分子17(斜线)的ifnγ的细胞因子释放。
图71.多特异性分子18(圆形,实线)、多特异性分子15(方形,虚线)、和多特异性分子20(三角形,长点划线)的细胞杀伤曲线。
图72.多特异性分子18(实心黑色)、多特异性分子15(白色)、和多特异性分子20(斜线)的ifnγ的细胞因子释放。
图73.多特异性分子18(圆形,实线)、多特异性分子14(方形,虚线)、和多特异性分子21(三角形,长点划线)的细胞杀伤曲线。
图74.多特异性分子18(实心黑色)、多特异性分子14(白色)、和多特异性分子21(斜线)的ifnγ的细胞因子释放。
图75.多特异性分子23(圆形,实线)和多特异性分子22(菱形,点划线)的细胞杀伤曲线。
图76.多特异性分子23(实心黑色)和多特异性分子22(斜线)的ifnγ的细胞因子释放。
图77.多特异性分子24的凝胶。
图78.多特异性分子25的凝胶。
图79.多特异性分子26的凝胶。
图80.多特异性分子27的凝胶。
图81.多特异性分子28的凝胶。
图82.多特异性分子29的凝胶。
图83.多特异性分子30的凝胶。
图84.多特异性分子31的凝胶。
图85.多特异性分子32的凝胶。
图86.多特异性分子24的尺寸排阻色谱图。
图87.多特异性分子25的尺寸排阻色谱图。
图88.多特异性分子26的尺寸排阻色谱图。
图89.多特异性分子28的尺寸排阻色谱图。
图90.多特异性分子29的尺寸排阻色谱图。
图91.多特异性分子30的尺寸排阻色谱图。
图92.多特异性分子31的尺寸排阻色谱图。
图93.与来自seqidno:178的人pdl1的多特异性分子27(圆形,实线)、多特异性分子28(菱形,短点划线)、多特异性分子29(方形,虚线)、和多特异性分子32(三角形,长点划线)的elisa。
图94.与来自seqidno:225的人fap的多特异性分子24(圆形,实线)、多特异性分子25(菱形,短点划线)、多特异性分子26(方形,虚线)、和多特异性分子27(三角形,长点划线)的elisa。
图95.与来自seqidno:225的人fap的多特异性分子28(圆形,实线)、多特异性分子30(菱形,短点划线)、多特异性分子31(方形,虚线)、和多特异性分子32(三角形,长点划线)的elisa。
图96.多特异性分子29与从seqidno:179产生的人nkp46的结合。
图97.与来自seqidno:182的人il2rα的多特异性分子25(圆形,实线)、多特异性分子28(菱形,短点划线)、多特异性分子29(方形,虚线)、和多特异性分子32(三角形,长点划线)的elisa。
图98.多特异性分子24(圆形)、多特异性分子25(菱形)、和多特异性分子26(方形)的透明质酸酶活性的比浊酶测定,其中透明质酸的降解导致吸光度降低。
图99.多特异性分子27(圆形)、多特异性分子28(菱形)、和多特异性分子29(方形)的透明质酸酶活性的比浊酶测定,其中透明质酸的降解导致吸光度降低。
图100.透明质酸酶活性的基于凝胶的测定,其中白色条带代表降解的透明质酸。泳道1是梯,泳道2是多特异性分子24,泳道3是多特异性分子25,泳道4是多特异性分子26,泳道5是多特异性分子27,泳道6是多特异性分子28,且泳道7是多特异性分子29。
图101.多特异性分子30(圆形)、多特异性分子31(菱形)、和多特异性分子32(方形)的iv型胶原酶活性,其中明胶酶的降解导致荧光增加。
具体实施方式
本文披露了多特异性分子(本文也称为“多功能分子”),所述分子包含多种(例如,两种或更多种)结合特异性(或功能性),其中第一结合特异性选择性地定位于癌细胞,例如,所述第一结合特异性包含肿瘤靶向部分;并且第二(或第三、或第四)结合特异性包含以下中的一种或两种:免疫细胞衔接子(例如,选自t细胞衔接子、nk细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子中的一种、两种、三种、或全部);和/或细胞因子分子。在一个实施例中,多特异性分子是双特异性(或双功能)分子、三特异性(或三功能)分子、或四特异性(或四功能)分子。不受理论束缚,预期本文披露的多特异性分子在癌细胞的存在下定位(例如,桥接)和/或激活免疫细胞(例如,选自nk细胞、b细胞、树突细胞或巨噬细胞的免疫效应细胞)。预期使用本文描述的多特异性分子在癌细胞的存在下增加免疫细胞的接近度和/或活性以增强针对靶癌细胞的免疫应答,从而提供更有效的癌症疗法。因此,本文尤其提供了包含前述部分的多特异性分子(例如,多特异性抗体分子)、编码所述多特异性分子的核酸、产生前述分子的方法、以及使用前述分子靶向癌症的方法。
披露了新颖的多功能(例如,多特异性)分子,所述分子包含(i)基质修饰部分和(ii)肿瘤靶向部分(例如,抗体分子、配体分子、或受体分子)。不受理论束缚,据信本文披露的多功能分子尤其靶向(例如,定位于)癌症位点,并改变肿瘤基质,例如改变癌症位点附近的肿瘤微环境。多功能分子可以进一步包含以下中的一种或两种:免疫细胞衔接子(例如,选自t细胞衔接子、nk细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子中的一种、两种、三种、或全部);和/或细胞因子分子。因此,本文尤其提供了包含前述部分的多功能(例如,多特异性)分子、编码所述分子的核酸、产生前述分子的方法、以及使用前述分子靶向癌症的方法。
本文还披露了新颖的多功能(例如,多特异性)分子,所述分子包含(i)基质修饰部分和(ii)肿瘤靶向部分(例如,抗体分子、配体分子、或受体分子)。不受理论束缚,据信本文披露的多功能分子尤其靶向(例如,定位于)癌症位点,并改变肿瘤基质,例如改变癌症位点附近的肿瘤微环境。多功能分子可以进一步包含以下中的一种或两种:免疫细胞衔接子(例如,选自t细胞衔接子、nk细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子中的一种、两种、三种、或全部);和/或细胞因子分子。因此,本文尤其提供了包含前述部分的多功能(例如,多特异性)分子、编码所述分子的核酸、产生前述分子的方法、以及使用前述分子靶向癌症的方法。
定义
在一些实施例中,多特异性分子包含肿瘤靶向部分。如本文所用,“肿瘤靶向部分”是指识别癌细胞中的靶标或与其缔合(例如,与其结合)的结合剂。肿瘤靶向部分可以是与癌抗原(例如,肿瘤和/或基质抗原)结合的抗体分子、受体分子(例如,全长受体、受体片段、或其融合物(例如,受体-fc融合物))、或配体分子(例如,全长配体、配体片段、或其融合物(例如,配体-fc融合物))。在实施例中,肿瘤靶向部分特异性与靶肿瘤结合,例如优先与靶肿瘤结合。例如,当肿瘤靶向部分是抗体分子时,其与癌抗原(例如,肿瘤抗原和/或基质抗原)结合,解离常数小于约10nm,并且更典型地10pm–100pm。
在一些实施例中,多特异性分子包含免疫细胞衔接子。“免疫细胞衔接子”是指结合和/或激活免疫细胞(例如,参与免疫应答的细胞)的一种或多种结合特异性。在实施例中,免疫细胞选自t细胞、nk细胞、b细胞、树突细胞、和/或巨噬细胞。免疫细胞衔接子可以是与免疫细胞抗原(例如,nk细胞抗原、b细胞抗原、树突细胞抗原、和/或巨噬细胞抗原)结合的抗体分子、受体分子(例如,全长受体、受体片段、或其融合物(例如,受体-fc融合物))、或配体分子(例如,全长配体、配体片段、或其融合物(例如,配体-fc融合物))。在实施例中,免疫细胞衔接子特异性与靶免疫细胞结合,例如优先与靶免疫细胞结合。例如,当免疫细胞衔接子是抗体分子时,其与免疫细胞抗原(例如,nk细胞抗原、b细胞抗原、树突细胞抗原、和/或巨噬细胞抗原)结合,解离常数小于约10nm,并且更典型地10pm–100pm。
在一些实施例中,多特异性分子包含细胞因子分子。如本文所用,“细胞因子分子”是指全长细胞因子、细胞因子的片段或或细胞因子的变体;进一步包含受体结构域(例如,细胞因子受体二聚化结构域)的细胞因子;或引起天然存在的细胞因子的至少一种活性的细胞因子受体的激动剂,例如细胞因子受体的抗体分子(例如,激动性抗体)。在一些实施例中,细胞因子分子选自白介素-2(il-2)、白介素-7(il-7)、白介素-12(il-12)、白介素-15(il-15)、白介素-18(il-18)、白介素-21(il-21)、或干扰素γ、或其片段或变体、或任何前述细胞因子的组合。细胞因子分子可以是单体或二聚体。在实施例中,细胞因子分子可以进一步包含细胞因子受体二聚化结构域。在其他实施例中,细胞因子分子是细胞因子受体的激动剂,例如选自il-15ra或il-21r的细胞因子受体的抗体分子(例如,激动性抗体)。
如本文所用,如在例如抗体分子、细胞因子分子、受体分子(包括全长的天然存在的分子)、以及变体(例如,功能变体(例如,截断物、片段、突变(例如,基本上相似的序列)或其衍生化形式)中使用的术语“分子”只要保留未经修饰的(例如,天然存在的)分子的至少一种功能和/或活性。
在一些实施例中,多功能分子包含基质修饰部分。如本文所用,“基质修饰部分”是指能够改变(例如,降解)基质的组分的试剂,例如蛋白质(例如,酶)。在实施例中,基质的组分选自例如ecm组分,例如糖胺聚糖,例如透明质酸(hyaluronan)(也称为透明质酸(hyaluronicacid)或ha)、硫酸软骨素、软骨素、硫酸皮肤素、硫酸肝素、肝素、巢蛋白、生腱蛋白、聚集蛋白聚糖和硫酸角蛋白;或细胞外蛋白,例如胶原、层粘连蛋白、弹性蛋白、纤维蛋白原、纤连蛋白、和玻连蛋白。
术语“功能变体”是指与天然存在的序列具有基本上相同的氨基酸序列的多肽,或由基本上相同的核苷酸序列编码并且能够具有天然存在的序列的一种或多种活性的多肽。
某些术语定义如下。
如本文所用,冠词“一个/种(a)”和“一个/种(an)”是指冠词的一个/种或多于一个/种(例如,是指至少一个/种)语法宾语。当在本文中结合术语“包含(comprising)”使用时,词语“一个/种(a)”或“一个/种(an)”的使用可以意指“一个/种(one)”,但是还与“一个/种或多个/种(oneormore)”、“至少一个/种(atleastone)”、以及“一个/种或多于一个/种(oneormorethanone)”的含义一致。
如本文所用,“约”和“大约”通常意指考虑到测量的性质或精度,测量的量的可接受程度的误差。示例性误差程度在值的给定范围的百分之(%)20内,典型地在10%内,并且更典型地在5%内。
如本文所用,“抗体分子”是指包含至少一个免疫球蛋白可变结构域序列的蛋白质,例如免疫球蛋白链或其片段。抗体分子涵盖抗体(例如,全长抗体)和抗体片段。在一个实施例中,抗体分子包括全长抗体、或全长免疫球蛋白链的抗原结合或功能片段。例如,全长抗体是天然存在的或通过正常免疫球蛋白基因片段重组过程形成的免疫球蛋白(ig)分子(例如,igg抗体)。在实施例中,抗体分子是指免疫球蛋白分子的免疫活性的抗原结合部分,如抗体片段。抗体片段(例如,功能片段)是抗体的一部分,例如fab、fab′、f(ab′)2、f(ab)2、可变片段(fv)、结构域抗体(dab)、或单链可变片段(scfv)。功能抗体片段与完整(例如,全长)抗体识别的抗原相同的抗原结合。术语“抗体片段”或“功能片段”还包括由可变区组成的分离的片段,如由重链和轻链的可变区组成的“fv”片段或其中轻链和重链可变区通过肽接头连接的重组单链多肽分子(“scfv蛋白”)。在一些实施例中,抗体片段不包括没有抗原结合活性的抗体部分,如fc片段或单个氨基酸残基。示例性抗体分子包括全长抗体和抗体片段(例如,dab(结构域抗体)、单链、fab、fab’、和f(ab’)2片段、和单链可变片段(scfv))。
如本文所用,“免疫球蛋白可变结构域序列”是指可以形成免疫球蛋白可变结构域的结构的氨基酸序列。例如,序列可以包括天然存在的可变结构域的全部或部分氨基酸序列。例如,序列可以包括或可以不包括一个、两个、或更多个n-或c-末端氨基酸,或者可以包括与蛋白质结构的形成相容的其他改变。
在实施例中,抗体分子是单特异性的,例如,其包含对单一表位的结合特异性。在一些实施例中,抗体分子是多特异性的,例如,其包含多个免疫球蛋白可变结构域序列,其中第一免疫球蛋白可变结构域序列对第一表位具有结合特异性,并且第二免疫球蛋白可变结构域序列对第二表位具有结合特异性。在一些实施例中,抗体分子是双特异性抗体分子。如本文所用,“双特异性抗体分子”是指对多于一种(例如,两种、三种、四种、或更多种)表位和/或抗原具有特异性的抗体分子。
如本文所用,“抗原”(ag)是指可以引起免疫应答(例如,涉及某些免疫细胞的激活和/或抗体产生)的分子。包括几乎所有蛋白质或肽的任何大分子都可以是抗原。抗原也可以衍生自基因组重组体或dna。例如,包含编码能够引起免疫应答的蛋白质的核苷酸序列或部分核苷酸序列的任何dna编码“抗原”。在实施例中,抗原不需要仅由基因的全长核苷酸序列编码,抗原也不需要由基因编码。在实施例中,抗原可以是合成的或可以衍生自生物样品,例如组织样品、肿瘤样品、细胞或具有其他生物组分的流体。如本文所用,“肿瘤抗原”或可互换地“癌抗原”包括存在于癌症上或与癌症相关的任何分子,例如可以引起免疫应答的癌细胞或肿瘤微环境。如本文所用,“免疫细胞抗原”包括存在于免疫细胞上或与免疫细胞相关的可以引起免疫应答的任何分子。
抗体分子的“抗原结合位点”或“结合部分”是指参与抗原结合的抗体分子(例如,免疫球蛋白(ig)分子)的部分。在实施例中,抗原结合位点由重链(h)和轻链(l)的可变(v)区的氨基酸残基形成。在重链和轻链的可变区内的三个高度相异区段(称为高变区)布置在称为“框架区”(fr)的更保守的侧翼区段之间。fr是天然存在于免疫球蛋白中的高变区之间并与其相邻的氨基酸序列。在实施例中,在抗体分子中,轻链的三个高变区和重链的三个高变区在三维空间中相对于彼此布置以形成抗原结合表面,其与结合抗原的三维表面互补。每条重链和轻链的三个高变区称为“互补决定区”或“cdr”。框架区和cdr已被定义和描述在例如kabat,e.a.等人(1991)sequencesofproteinsofimmunologicalinterest[免疫学感兴趣的蛋白质序列],第五版,u.s.departmentofhealthandhumanservices[美国健康与人类服务部],nih公开号91-3242,和chothia,c.等人(1987)j.mol.biol.[分子生物学杂志]196:901-917。每条可变链(例如,可变重链和可变轻链)通常由三个cdr和四个fr组成,从氨基末端到羧基末端按以下氨基酸顺序排列:fr1、cdr1、fr2、cdr2、fr3、cdr3、和fr4。
如本文所用,“癌症”可以涵盖所有类型的致癌过程和/或癌性生长。在实施例中,癌症包括原发性肿瘤以及转移性组织或恶性转化的细胞、组织或器官。在实施例中,癌症涵盖癌症的所有组织病理学和阶段(例如,侵袭性/严重性的阶段)。在实施例中,癌症包括复发性和/或抗性癌症。术语“癌症”和“肿瘤”可互换地使用。例如,这两个术语都涵盖实体瘤和液体瘤。如本文所用,术语“癌症”或“肿瘤”包括癌变前以及恶性癌症和肿瘤。
如本文所用,“免疫细胞”是指在免疫系统中起作用(例如,以保护免受感染剂和外来物质)的各种细胞中的任何一种。在实施例中,此术语包括白细胞(例如嗜中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞)、淋巴细胞和单核细胞。天然白细胞包括吞噬细胞(例如,巨噬细胞、嗜中性粒细胞、和树突细胞)、肥大细胞、嗜酸性粒细胞、嗜碱性粒细胞和自然杀伤细胞。天然白细胞通过经由接触攻击较大的病原体或通过吞噬然后杀死微生物来识别和消除病原体,并且是适应性免疫应答的激活的介质。适应性免疫系统的细胞是特殊类型的白细胞,称为淋巴细胞。b细胞和t细胞是重要类型的淋巴细胞,并且衍生自骨髓中的造血干细胞。b细胞参与体液免疫应答,而t细胞参与细胞介导的免疫应答。术语“免疫细胞”包括免疫效应细胞。
“免疫效应细胞”,如该术语在本文中使用,是指参与免疫应答(例如,促进免疫效应子应答)的细胞。免疫效应细胞的实例包括但不限于t细胞(例如,α/βt细胞和γ/δt细胞)、b细胞、自然杀伤(nk)细胞、自然杀伤t(nkt)细胞、和肥大细胞。
术语“效应子功能”或“效应子应答”是指细胞的专门功能。t细胞的效应子功能例如可以是包括细胞因子的分泌的细胞溶解活性或辅助活性。
本发明的组合物和方法涵盖具有指定的序列、或与其基本上相同或相似的序列(例如,与指定的序列至少85%、90%、95%或更高相同的序列)的多肽和核酸。在氨基酸序列的上下文中,在本文中使用术语“基本上相同”来指含有足够或最少数量的如下氨基酸残基的第一氨基酸,所述氨基酸残基i)与第二氨基酸序列中的比对的氨基酸残基相同,或ii)是第二氨基酸序列中的比对的氨基酸残基的保守取代,使得第一和第二氨基酸序列可以具有共有结构域和/或共同功能活性。例如,含有共有结构域的氨基酸序列与参考序列(例如,本文提供的序列)具有至少约85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性。
在核苷酸序列的上下文中,在本文中使用术语“基本上相同”来指含有足够或最少数量的如下核苷酸的第一核酸序列,所述核苷酸与第二核酸序列中的比对的核苷酸相同,使得第一和第二核苷酸序列编码具有共同功能活性的多肽,或编码共有结构多肽结构域或共同功能多肽活性。例如,核苷酸序列与参考序列(例如,本文提供的序列)具有至少约85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性。
序列之间的同源性或序列同一性(所述术语在本文中可互换地使用)的计算如下进行。
为了测定两个氨基酸序列、或两个核酸序列的百分比同一性,出于最佳比对的目的将序列比对(例如,可以在第一和第二氨基酸或核酸序列中的一个或两个中引入空位以用于最佳比对,并且出于比较目的,非同源序列可以忽略)。在一个优选的实施例中,出于比较目的比对的参考序列长度是参考序列长度的至少30%,优选地至少40%,更优选地至少50%、60%,并且甚至更优选地至少70%、80%、90%、100%。然后比较对应的氨基酸位置或核苷酸位置处的氨基酸残基或核苷酸。当第一序列中的位置被与第二序列中的对应位置相同的氨基酸残基或核苷酸占据时,则所述分子在该位置是相同的(如本文所用,氨基酸或核酸“同一性”等同于氨基酸或核酸“同源性”)。
两个序列之间的百分比同一性是所述序列共享的相同位置的数量的函数,考虑了空位数量以及每个空位的长度,需要引入它们以用于两个序列的最佳比对。
序列比较和两个序列之间百分比同一性的测定可以使用数学算法来完成。在一个优选的实施例中,使用needleman和wunsch((1970)j.mol.biol.[分子生物学杂志]48:444-453)算法使用blossum62矩阵或pam250矩阵,16、14、12、10、8、6、或4的空位权重和1、2、3、4、5、或6的长度权重来测定两个氨基酸序列之间的百分比同一性,所述算法已并入gcg软件包(可在http://www.gcg.com获得)中的gap程序中。在还另一个优选的实施例中,使用gcg软件包(可在http://www.gcg.com获得)中的gap程序,使用nwsgapdna.cmp矩阵以及40、50、60、70、或80的空位权重和1、2、3、4、5、或6的长度权重来测定两个核苷酸序列之间的百分比同一性。一组特别优选的参数(除非另有说明,否则应使用的参数)是blossum62评分矩阵,空位罚分为12,空位延伸罚分为4,并且移码空位罚分为5。
两个氨基酸或核苷酸序列之间的百分比同一性可以使用e.meyers和w.miller((1989)cabios[生物科学中的计算机应用],4:11-17)的算法,使用pam120权重残基表、12的空位长度罚分和4的空位罚分来测定,所述算法已并入align程序(版本2.0)中。
本文描述的核酸和蛋白质序列可以用作“查询序列”以对公共数据库进行检索,例如来鉴定其他家族成员或相关序列。可以使用altschul等人(1990)j.mol.biol.[分子生物学杂志]215:403-10的nblast和xblast程序(版本2.0)来执行这样的检索。可以用nblast程序,得分=100、字长=12执行blast核苷酸检索,以获得与本发明的核酸(例如,seqidno:1)分子同源的核苷酸序列。可以用xblast程序,得分=50,字长=3执行blast蛋白质检索,以获得与本发明的蛋白质分子同源的氨基酸序列。为了获得用于比较目标的有空位的比对,可以利用如在altschul等人,(1997)nucleicacidsres.[核酸研究]25:3389-3402中所述的gappedblast。当利用blast和gappedblast程序时,可以使用各程序(例如,xblast和nblast)的默认参数。参见http://www.ncbi.nlm.nih.gov。
应理解,本发明的分子可以具有另外的保守或非必需氨基酸取代,其对所述分子的功能没有实质性影响。
术语“氨基酸”旨在包括包含氨基官能团和酸官能团并且能够包含在天然存在的氨基酸的聚合物中的所有分子(无论是天然的还是合成的)。示例性氨基酸包括天然存在的氨基酸;或其类似物、衍生物和同类物;具有变体侧链的氨基酸类似物;以及任何前述的任何一种的所有立体异构体。如本文所用,术语“氨基酸”包括d-或l-光学异构体和肽模拟物。
“保守氨基酸取代”是氨基酸残基被具有类似侧链的氨基酸残基替换的取代。在本领域中已经定义了具有类似侧链的氨基酸残基家族。这些家族包括具有碱性侧链的氨基酸(例如,赖氨酸、精氨酸、组氨酸)、具有酸性侧链的氨基酸(例如,天冬氨酸、谷氨酸)、具有不带电荷的极性侧链的氨基酸(例如,甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸)、具有非极性侧链的氨基酸(例如,丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸、色氨酸)、具有β-分支侧链的氨基酸(例如,苏氨酸、缬氨酸、异亮氨酸)以及具有芳香族侧链的氨基酸(例如,酪氨酸、苯丙氨酸、色氨酸、组氨酸)。
术语“多肽”、“肽”和“蛋白质”(如果是单链的话)在本文中可互换地使用来指具有任何长度的氨基酸聚合物。聚合物可以是直链或支链的,它可以包含经修饰的氨基酸,并且它可以被非氨基酸中断。所述术语还涵盖已修饰的氨基酸聚合物;例如,二硫键形成、糖基化、脂化、乙酰化、磷酸化或任何其他操纵,如与标记组分缀合。多肽可以从天然来源分离,可以通过重组技术从真核或原核宿主中产生,或者可以是合成程序的产物。
术语“核酸”、“核酸序列”、“核苷酸序列”、或“多核苷酸序列”、和“多核苷酸”可互换地使用。它们是指具有任何长度的核苷酸(脱氧核糖核苷酸或核糖核苷酸)的聚合形式或其类似物。多核苷酸可以是单链或双链的,并且如果是单链的话,则可以是编码链或非编码(反义)链。多核苷酸可以包含经修饰的核苷酸,如甲基化的核苷酸和核苷酸类似物。核苷酸序列可以被非核苷酸组分中断。多核苷酸可以在聚合之后诸如通过与标记组分缀合来进一步修饰。核酸可以是重组多核苷酸、或基因组、cdna、半合成或合成来源的多核苷酸,其在自然界中不存在或以非天然排列连接至另一个多核苷酸。
如本文所用,术语“分离的”是指从其原始或天然环境(例如,其天然存在的自然环境)中去除的材料。例如,存在于活动物中的天然存在的多核苷酸或多肽不是分离的,但是通过人为干预从天然系统中的一些或全部共存材料分离的相同多核苷酸或多肽是分离的。此类多核苷酸可以是载体的一部分和/或此类多核苷酸或多肽可以是组合物的一部分,并且仍然是分离的,因为此类载体或组合物不是其天然存在的环境的一部分。
本发明的各个方面在下面进一步详细地描述。另外的定义贯穿说明书而陈述。
抗体分子
在一个实施例中,抗体分子与癌抗原(例如,肿瘤抗原或基质抗原)结合。在一些实施例中,癌抗原是例如哺乳动物(例如,人)癌抗原。在其他实施例中,抗体分子与免疫细胞抗原(例如,哺乳动物(例如,人)免疫细胞抗原)结合。例如,抗体分子与癌抗原或免疫细胞抗原上的表位(例如,线性或构象表位)特异性结合。
在一个实施例中,抗体分子是单特异性抗体分子并结合单一表位。例如,具有多个免疫球蛋白可变结构域序列的单特异性抗体分子,其中的每个序列结合相同的表位。
在一个实施例中,抗体分子是多特异性抗体分子,例如,其包含多个免疫球蛋白可变结构域序列,其中所述多个的第一免疫球蛋白可变结构域序列具有对第一表位的结合特异性,并且所述多个的第二免疫球蛋白可变结构域序列具有对第二表位的结合特异性。在一个实施例中,第一和第二表位在相同抗原(例如,相同的蛋白质(或多聚体蛋白的亚基))上。在一个实施例中,第一和第二表位重叠。在一个实施例中,第一和第二表位不重叠。在一个实施例中,第一和第二表位在不同的抗原(例如,不同的蛋白质(或多聚体蛋白的不同亚基))上。在一个实施例中,多特异性抗体分子包含第三、第四或第五免疫球蛋白可变结构域。在一个实施例中,多特异性抗体分子是双特异性抗体分子、三特异性抗体分子、或四特异性抗体分子。
在一个实施例中,多特异性抗体分子是双特异性抗体分子。双特异性抗体对不多于两种抗原具有特异性。双特异性抗体分子的特征在于具有对第一表位的结合特异性的第一免疫球蛋白可变结构域序列、和具有对第二表位的结合特异性的第二免疫球蛋白可变结构域序列。在一个实施例中,第一和第二表位在相同抗原(例如,相同的蛋白质(或多聚体蛋白的亚基))上。在一个实施例中,第一和第二表位重叠。在一个实施例中,第一和第二表位不重叠。在一个实施例中,第一和第二表位在不同的抗原(例如,不同的蛋白质(或多聚体蛋白的不同亚基))上。在一个实施例中,双特异性抗体分子包含对第一表位具有结合特异性的重链可变结构域序列和轻链可变结构域序列、以及对第二表位具有结合特异性的重链可变结构域序列和轻链可变结构域序列。在一个实施例中,双特异性抗体分子包含对第一表位具有结合特异性的半抗体、和对第二表位具有结合特异性的半抗体。在一个实施例中,双特异性抗体分子包含对第一表位具有结合特异性的半抗体或其片段、和对第二表位具有结合特异性的半抗体或其片段。在一个实施例中,双特异性抗体分子包含对第一表位具有结合特异性的scfv或fab或其片段、以及对第二表位具有结合特异性的scfv或fab或其片段。
在一个实施例中,抗体分子包括双抗体、和单链分子、以及抗体的抗原结合片段(例如,fab、f(ab’)2、和fv)。例如,抗体分子可以包含重(h)链可变结构域序列(在本文缩写为vh)、和轻(l)链可变结构域序列(在本文缩写为vl)。在一个实施例中,抗体分子包含重链和轻链或由其组成(本文称为半抗体)。在另一个实例中,抗体分子包含两个重(h)链可变结构域序列和两个轻(l)链可变结构域序列,从而形成两个抗原结合位点(如fab、fab’、f(ab’)2、fc、fd、fd’、fv、单链抗体(例如scfv)、单可变结构域抗体、双体(dab)(二价和双特异性)、和嵌合(例如,人源化)抗体),其可以通过修饰完整抗体或使用重组dna技术从头合成的抗体产生。这些功能抗体片段保留了与其各自的抗原或受体选择性结合的能力。抗体和抗体片段可以来自包括但不限于igg、iga、igm、igd、和ige的任何类别的抗体,并且可以来自抗体的任何亚类(例如,igg1、igg2、igg3、和igg4)。抗体分子的制剂可以是单克隆或多克隆的。抗体分子也可以是人抗体、人源化抗体、cdr移植的抗体或体外产生的抗体。抗体可以具有选自例如igg1、igg2、igg3、或igg4的重链恒定区。抗体还可以具有选自例如κ或λ的轻链。术语“免疫球蛋白”(ig)与术语“抗体”在本文中可互换地使用。
抗体分子的抗原结合片段的实例包括:(i)fab片段,由vl、vh、cl和ch1结构域组成的单价片段;(ii)f(ab')2片段,包含由二硫键在铰链区连接的两个fab片段的双价片段;(iii)由vh和ch1结构域组成的fd片段;(iv)由抗体单臂的vl和vh结构域组成的fv片段;(v)由vh结构域组成的双抗体(dab)片段;(vi)骆驼科动物或骆驼化可变结构域;(vii)单链fv(scfv)(参见例如,bird等人(1988)science[科学]242:423-426;和huston等人(1988)proc.natl.acad.sci.usa[美国国家科学院院刊]85:5879-5883);(viii)单结构域抗体。使用本领域技术人员已知的常规技术获得这些抗体片段,并且按照与完整抗体相同的方式筛选所述片段的实用性。
抗体分子包括完整分子及其功能片段。抗体分子的恒定区可以被改变(例如,突变)以修饰抗体的性质(例如,以增加或减少以下中的一种或多种:fc受体结合、抗体糖基化、半胱氨酸残基的数量、效应细胞功能、或补体功能)。
抗体分子也可以是单结构域抗体。单结构域抗体可以包括其互补决定区是单结构域多肽的一部分的抗体。实例包括但不限于重链抗体、天然缺乏轻链的抗体、衍生自常规4链抗体的单结构域抗体、工程化抗体和除抗体衍生的那些之外的单结构域支架。单结构域抗体可以是任何现有技术、或任何未来的单结构域抗体。单结构域抗体可以衍生自任何物种,包括但不限于小鼠、人、骆驼、美洲驼、鱼、鲨鱼、山羊、兔、和牛。根据本发明的另一方面,单结构域抗体是天然存在的单结构域抗体,称为缺乏轻链的重链抗体。例如,此类单结构域抗体披露在wo9404678中。出于清楚的原因,这种衍生自天然缺乏轻链的重链抗体的可变结构域在本文中称为vhh或纳米抗体,以将其与四链免疫球蛋白的常规vh区分开。这种vhh分子可以是衍生自骆驼科物种(例如骆驼、美洲驼、单峰骆驼、羊驼和原驼)中产生的抗体。除骆驼科外的其他物种也可以产生天然缺乏轻链的重链抗体;此类vhh在本发明的范围内。
vh和vl区可以被细分为散布有更保守区(被称为“构架区”(fr或fw))的高变区(被称为“互补决定区”(cdr))。
框架区和cdr的范围已经通过许多方法精确定义(参见,kabat,e.a.等人(1991)sequencesofproteinsofimmunologicalinterest[免疫学上感兴趣的蛋白质序列],第五版,u.s.departmentofhealthandhumanservices[美国健康与人类服务部],nih公开号91-3242;chothia,c.等人(1987)j.mol.biol.[分子生物学杂志]196:901-917;以及由牛津分子abm抗体建模软件(oxfordmolecular'sabmantibodymodellingsoftware)使用的abm定义)。通常参见例如,proteinsequenceandstructureanalysisofantibodyvariabledomains[抗体可变结构域的蛋白质序列和结构分析]在:antibodyengineeringlabmanual[抗体工程实验室手册](编辑:duebel,s.和kontermann,r.,施普林格出版社(springer-verlag),海德尔堡)。
如本文所用,术语“互补决定区”和“cdr”是指抗体可变区内的赋予抗原特异性和结合亲和力的氨基酸序列。通常,每个重链可变区中有三个cdr(hcdr1、hcdr2、hcdr3),每个轻链可变区中有三个cdr(lcdr1、lcdr2、lcdr3)。
给定cdr的精确氨基酸序列边界可以使用许多已知方案中的任何一种来确定,包括由以下文献描述的那些:kabat等人(1991),“sequencesofproteinsofimmunologicalinterest[免疫学上感兴趣的蛋白质序列],”第5版publichealthservice,nationalinstitutesofhealth[美国国立卫生研究院,公共卫生服务部],贝塞斯达,马里兰州(“kabat”编号方案),al-lazikani等人,(1997)jmb273,927-948(“chothia”编号方案)。如本文所用,根据“chothia”数字方案定义的cdr有时也称为“高变环”。
例如,在kabat下,重链可变结构域(vh)中的cdr氨基酸残基编号为31-35(hcdr1)、50-65(hcdr2)、和95-102(hcdr3);并且轻链可变结构域(vl)中的cdr氨基酸残基编号为24-34(lcdr1)、50-56(lcdr2)、和89-97(lcdr3)。在chothia下,vh中的cdr氨基酸编号为26-32(hcdr1)、52-56(hcdr2)、和95-102(hcdr3);并且vl中的氨基酸残基编号为26-32(lcdr1)、50-52(lcdr2)、和91-96(lcdr3)。
每个vh和vl典型地包括三个cdr和四个fr,以下列顺序从氨基末端至羧基末端排列:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4。
抗体分子可以是多克隆或单克隆抗体。
如本文所用,术语“单克隆抗体”或“单克隆抗体组合物”是指具有单一分子组成的抗体分子的制剂。单克隆抗体组合物对特定表位显示单一的结合特异性和亲和力。单克隆抗体可以通过杂交瘤技术或通过不使用杂交瘤技术的方法(例如,重组方法)制备。
可以重组地产生抗体,例如通过噬菌体展示或通过组合方法产生。
用于产生抗体的噬菌体展示和组合方法是本领域已知的(如描述在例如,ladner等人美国专利号5,223,409;kang等人国际公开号wo92/18619;dower等人国际公开号wo91/17271;winter等人国际公开wo92/20791;markland等人国际公开号wo92/15679;breitling等人国际公开wo93/01288;mccafferty等人国际公开号wo92/01047;garrard等人国际公开号wo92/09690;ladner等人国际公开号wo90/02809;fuchs等人(1991)bio/technology[生物技术]9:1370-1372;hay等人(1992)humantibodhybridomas[人类抗体杂交瘤]3:81-85;huse等人(1989)science[科学]246:1275-1281;griffths等人(1993)emboj[欧洲分子生物学学会杂志]12:725-734;hawkins等人(1992)jmolbiol[分子生物学杂志]226:889-896;clackson等人(1991)nature[自然]352:624-628;gram等人(1992)pnas[美国国家科学院院刊]89:3576-3580;garrad等人(1991)bio/technology[生物技术]9:1373-1377;hoogenboom等人(1991)nucacidres[核酸研究]19:4133-4137;和barbas等人(1991)pnas[美国国家科学院院刊]88:7978-7982,将所有这些的内容通过引用并入本文)。
在一个实施例中,抗体是全人抗体(例如,在已经基因工程化为从人免疫球蛋白序列产生抗体的小鼠中制备的抗体),或非人抗体,例如啮齿动物(小鼠或大鼠)、山羊、灵长类动物(例如,猴)、骆驼抗体。优选地,非人抗体是啮齿动物(小鼠或大鼠)抗体。产生啮齿动物抗体的方法是本领域已知的。
可以使用携带人免疫球蛋白基因而不是小鼠系统的转基因小鼠产生人单克隆抗体。来自用感兴趣的抗原免疫的这些转基因小鼠的脾细胞用于产生分泌人mab的杂交瘤,所述人mab对来自人蛋白质的表位具有特异性亲和力(参见例如,wood等人国际申请wo91/00906;kucherlapati等人pct申请wo91/10741;lonberg等人国际申请wo92/03918;kay等人国际申请92/03917;lonberg,n.等人1994nature[自然]368:856-859;green,l.l.等人1994naturegenet.[自然遗传学]7:13-21;morrison,s.l.等人1994proc.natl.acad.sci.usa[美国国家科学院院刊]81:6851-6855;bruggeman等人1993yearimmunol[免疫学年报]7:33-40;tuaillon等人1993pnas[美国国家科学院院刊]90:3720-3724;bruggeman等人1991eurjimmunol[欧洲免疫学杂志]21:1323-1326)。
抗体分子可以是可变区或其一部分(例如,cdr)在非人生物(例如,大鼠或小鼠)中产生的抗体分子。嵌合抗体、cdr移植的抗体、和人源化抗体属于本发明。在非人生物(例如,大鼠或小鼠)中产生并且然后在例如可变框架或恒定区中修饰以降低在人中的抗原性的抗体分子属于本发明。
“有效人”蛋白质是基本上不引起中和抗体应答(例如,人抗鼠抗体(hama)应答)的蛋白质。hama在许多情况下可能是有问题的,例如,如果抗体分子被重复给予,例如在治疗慢性或复发性疾病病症中。由于来自血清的抗体清除增加(参见例如,saleh等人,cancerimmunol.immunother.[癌症免疫学与免疫疗法],32:180-190(1990)),并且还由于潜在的过敏反应(参见例如,lobuglio等人,hybridoma[杂交瘤],5:5117-5123(1986)),hama应答可能使重复的抗体给予无效。
嵌合抗体可以通过本领域已知的重组dna技术产生(参见robinson等人,国际专利公开pct/us86/02269;akira等人,欧洲专利申请184,187;taniguchi,m.,欧洲专利申请171,496;morrison等人,欧洲专利申请173,494;neuberger等人,国际申请wo86/01533;cabilly等人美国专利号4,816,567;cabilly等人,欧洲专利申请125,023;better等人(1988science[科学]240:1041-1043);liu等人(1987)pnas[美国国家科学院院刊]84:3439-3443;liu等人,1987,j.immunol.[免疫学杂志]139:3521-3526;sun等人(1987)pnas[美国国家科学院院刊]84:214-218;nishimura等人,1987,canc.res.[癌症研究]47:999-1005;wood等人(1985)nature[自然]314:446-449;和shaw等人,1988,j.natlcancerinst.[国家癌症研究所杂志]80:1553-1559)。
人源化抗体或cdr移植的抗体的至少一个或两个但通常所有三个受体cdr(重和/或轻免疫球蛋白链)将被供体cdr替换。抗体可以用至少一部分非人cdr替换,或者仅一些cdr可以用非人cdr替换。仅需要替换用来与抗原结合所需的cdr数量。优选地,供体将是啮齿动物抗体(例如,大鼠或小鼠抗体),并且受体将是人框架或人共有框架。典型地,提供cdr的免疫球蛋白称为“供体”,并且提供框架的免疫球蛋白称为“受体”。在一个实施例中,供体免疫球蛋白是非人(例如,啮齿动物)免疫球蛋白。受体框架是天然存在的(例如,人)框架或共有框架,或与其约85%或更高,优选90%、95%、99%或更高相同的序列。
如本文所用,术语“共有序列”是指由相关序列家族中最频繁出现的氨基酸(或核苷酸)形成的序列(参见例如,winnaker,fromgenestoclones[从基因到克隆](verlagsgesellschaft,魏因海姆,德国1987))。在蛋白质家族中,共有序列中的每个位置被在家族中该位置最频繁出现的氨基酸占据。如果两个氨基酸同样频繁地出现,则任一个都可以包含在共有序列中。“共有框架”是指共有免疫球蛋白序列中的框架区。
可以通过本领域已知的方法将抗体分子人源化(参见例如,morrison,s.l.,1985,science[科学]229:1202-1207,oi等人,1986,biotechniques[生物技术]4:214,以及queen等人us5,585,089、us5,693,761和us5,693,762,将所有这些的内容通过引用特此并入)。
可以通过cdr移植或cdr取代产生人源化抗体分子或cdr移植的抗体分子,其中可以替换免疫球蛋白链的一个、两个或所有cdr。参见例如,美国专利5,225,539;jones等人1986nature[自然]321:552-525;verhoeyan等人1988science[科学]239:1534;beidler等人1988j.immunol.[免疫学杂志]141:4053-4060;winterus5,225,539,将所有这些的内容通过引用明确地特此并入。winter描述了可用于制备本发明的人源化抗体的cdr移植方法(于1987年3月26日提交的英国专利申请gb2188638a;winterus5,225,539),将其内容通过引用明确地并入。
特定氨基酸已被取代、缺失或添加的人源化抗体分子也在本发明的范围内。从供体中选择氨基酸的标准描述于us5,585,089,例如us5,585,089的第12-16栏,例如us5,585,089的第12-16栏,将其内容通过引用特此并入。用于人源化抗体的其他技术描述在于1992年12月23日公布的padlan等人ep519596a1中。
抗体分子可以是单链抗体。单链抗体(scfv)可以是工程化的(参见例如,colcher,d.等人(1999)annnyacadsci[纽约科学院年报]880:263-80;和reiter,y.(1996)clincancerres[临床癌症研究]2:245-52)。单链抗体可以被二聚化或多聚化以产生对相同靶蛋白的不同表位具有特异性的多价抗体。
在还其他实施例中,抗体分子具有选自例如以下的重链恒定区:igg1、igg2、igg3、igg4、igm、iga1、iga2、igd、和ige的重链恒定区;具体地,选自例如igg1、igg2、igg3、和igg4的(例如,人)重链恒定区。在另一个实施例中,抗体分子具有选自例如以下的轻链恒定区:κ或λ的(例如,人)轻链恒定区。恒定区可以被改变(例如,突变)以修饰抗体的性质(例如,以增加或减少以下中的一种或多种:fc受体结合、抗体糖基化、半胱氨酸残基的数量、效应细胞功能、和/或补体功能)。在一个实施例中,抗体具有:效应子功能;并且可以固定补体。在其他实施例中,抗体不:募集效应细胞;或固定补体。在另一个实施例中,抗体结合fc受体的能力降低或没有这种能力。例如,其是不支持与fc受体的结合的同种型或亚型、片段或其他突变体,例如,它具有诱变的或缺失的fc受体结合区。
改变抗体恒定区的方法是本领域已知的。通过用不同的残基替换抗体恒定部分中的至少一个氨基酸残基可以产生功能改变(例如对效应配体(如细胞上的fcr)或补体的c1组分的亲和力改变)的抗体(参见例如,ep388,151a1、美国专利号5,624,821和美国专利号5,648,260,将所有这些的内容通过引用特此并入)。可以描述相似类型的改变,如果应用于鼠、或其他物种,免疫球蛋白将减少或消除这些功能。
抗体分子可以衍生化或连接到另一种功能分子(例如,另一种肽或蛋白质)。如本文所用,“衍生化”抗体分子是已经修饰的抗体分子。衍生化方法包括但不限于添加荧光部分、放射性核苷酸、毒素、酶或亲和配体(如生物素)。因此,本发明的抗体分子旨在包括本文描述的抗体的衍生化和以另外的方式修饰的形式,包括免疫粘附分子。例如,抗体分子可以功能性地连接(通过化学偶联、遗传融合、非共价结合或以另外的方式)到可介导抗体或抗体部分与另一种分子(如链霉亲和素核心区或多组氨酸标签)的缔合的一种或多种其他分子实体,如另一种抗体(例如,双特异性抗体或双抗体)、可检测的试剂、细胞毒性剂、药剂和/或蛋白质或肽。
通过交联两种或更多种抗体(相同类型或不同类型的抗体,例如以产生双特异性抗体)来产生一种类型的衍生化抗体分子。合适的交联剂包括具有由适当的间隔基分开的两个明显反应性基团的异双功能的(例如,间马来酰亚胺基苯甲酰基-n-羟基琥珀酰亚胺酯)或同双功能的(例如,辛二酸二琥珀酰亚胺酯)那些。此类接头从伊利诺伊州罗克福德的皮尔斯化学公司(piercechemicalcompany)可得。
多特异性抗体分子
本文定义的多特异性和多功能分子的示例性结构贯穿全文描述。示例性结构进一步描述于:weidleu等人(2013)theintriguingoptionsofmultispecificantibodyformatsfortreatmentofcancer[多特异性抗体形式治疗癌症的有趣选择].cancergenomics&proteomics[癌症基因组学和蛋白质组学]10:1-18(2013);和spiessc等人(2015)alternativemolecularformatsandtherapeuticapplicationsforbispecificantibodies[双特异性抗体的可替代分子形式和治疗应用].molecularimmunology[分子免疫学]67:95-106;将其中每个的全部内容通过引用并入本文)。
在实施例中,多特异性抗体分子可以包含多于一个抗原结合位点,其中不同的位点对不同的抗原具特异性。在实施例中,多特异性抗体分子可以结合相同抗原上的多于一个(例如,两个或更多个)表位。在实施例中,多特异性抗体分子包含对靶细胞(例如,癌细胞)具特异性的抗原结合位点以及对免疫效应细胞具特异性的不同的抗原结合位点。在一个实施例中,多特异性抗体分子是双特异性抗体分子。双特异性抗体分子可以分为五个不同的结构组:(i)双特异性免疫球蛋白g(bsigg);(ii)附有另外的抗原结合部分的igg;(iii)双特异性抗体片段;(iv)双特异性融合蛋白;和(v)双特异性抗体缀合物。
bsigg是对于每种抗原单价的形式。示例性bsigg形式包括但不限于crossmab、daf(二合一)、daf(四合一)、dutamab、dt-igg、杵臼结构共有lc(knobs-in-holescommonlc)、杵臼结构组件(knobs-in-holesassembly)、电荷对(chargepair)、fab臂交换(fab-armexchange)、seedbody、三功能抗体(triomab)、luz-y、fcab、κλ体(κλ-body)、正交fab(orthogonalfab)。参见spiess等人mol.immunol.[分子免疫学]67(2015):95-106。示例性bsigg包括卡妥索单抗(catumaxomab)(费森尤斯生物技术公司(freseniusbiotech),特莱恩制药公司(trionpharma),neopharm公司),其含有抗cd3臂和抗epcam臂;和厄妥索单抗(ertumaxomab)(neoviibiotech公司,费森尤斯生物技术公司),其靶向cd3和her2。在一些实施例中,bsigg包含工程化以用于异源二聚化的重链。例如,可以使用“杵臼结构(knobs-into-holes)”策略、seed平台、共有重链(例如,在κλ体中),并使用异源二聚体fc区使重链工程化进行异源二聚化。参见spiess等人mol.immunol.[分子免疫学]67(2015):95-106。已经用于避免bsigg中同源二聚体重链配对的策略包括杵臼结构、duobody、azymetric、电荷对、ha-tf,seedbody和差异蛋白a亲和力。参见同上。bsigg可以通过在不同宿主细胞中单独表达组分抗体并且随后纯化/组装成bsigg来产生。bsigg还可以通过在单个宿主细胞中表达组分抗体来产生。可以使用亲和色谱法(例如,使用蛋白质a和顺序ph洗脱)纯化bsigg。
附有另外的抗原结合部分的igg是双特异性抗体分子的另一种形式。例如,通过将另外的抗原结合单元附加到单特异性igg上(例如,在重链或轻链的n-或c-末端)可以将单特异性igg工程化为具有双特异性。示例性的另外的抗原结合单元包括单结构域抗体(例如,可变重链或可变轻链)、工程化蛋白质支架、和配对的抗体可变结构域(例如,单链可变片段或可变片段)。参见同上。附加的igg形式的实例包括双可变结构域igg(dvd-ig)、igg(h)-scfv、scfv-(h)igg、igg(l)-scfv、scfv-(l)igg、igg(l,h)-fv、igg(h)-v、v(h)-igg、igg(l)-v、v(l)-igg、kihigg-scfab、2scfv-igg、igg-2scfv、scfv4-ig、zybody、和dvi-igg(四合一)。参见spiess等人mol.immunol.[分子免疫学]67(2015):95-106。igg-scfv的实例是mm-141(梅里马克制药公司(merrimackpharmaceuticals)),其结合igf-1r和her3。dvd-ig的实例包括abt-981(艾伯维公司(abbvie)),其结合il-1α和il-1β;以及abt-122(艾伯维公司),其结合tnf和il-17a。
双特异性抗体片段(bsab)是缺乏一些或全部抗体恒定结构域的双特异性抗体分子的形式。例如,一些bsab缺乏fc区。在实施例中,双特异性抗体片段包含通过允许bsab在单个宿主细胞中有效表达的肽接头连接的重链和轻链区。示例性双特异性抗体片段包括但不限于纳米抗体、纳米抗体-has、bite、双抗体、dart、tandab、sc双抗体(scdiabody)、sc双抗体-ch3、双抗体-ch3、三抗体(triplebody)、微型抗体(miniantibody)、迷你抗体(minibody)、tribi迷你抗体、scfv-ch3kih、fab-scfv、scfv-ch-cl-scfv、f(ab’)2、f(ab’)2-scfv2、scfv-kih、fab-scfv-fc、四价hcab、sc双抗体-fc、双抗体-fc、串联scfv-fc、和胞内抗体。参见同上。例如,bite形式包含串联scfv,其中组分scfv与t细胞上的cd3和癌细胞上的表面抗原结合。
双特异性融合蛋白包括连接至其他蛋白质的抗体片段,例如以增加另外的特异性和/或功能性。双特异性融合蛋白的实例是immtac,其包含连接至识别hla呈递的肽的亲和力成熟的t细胞受体的抗cd3scfv。在实施例中,对接锁定(dock-and-lock,dnl)方法可以用于产生具有更高效价的双特异性抗体分子。此外,与白蛋白结合蛋白或人血清白蛋白的融合物可以延长抗体片段的血清半衰期。参见同上。
在实施例中,化学缀合(例如,抗体和/或抗体片段的化学缀合)可以用于产生bsab分子。参见同上。示例性双特异性抗体缀合物包括covx体形式,其中低分子量药物与每个fab臂或抗体或其片段中的单个反应性赖氨酸位点特异性缀合。在实施例中,缀合改善了低分子量药物的血清半衰期。示例性的covx体是cvx-241(nct01004822),其包含与抑制vegf或ang2的两种短肽缀合的抗体。参见同上。
抗体分子可以通过在宿主系统中重组表达例如至少一种或多种组分来产生。示例性宿主系统包括真核细胞(例如,哺乳动物细胞(例如,cho细胞)、或昆虫细胞(例如,sf9或s2细胞))和原核细胞(例如,大肠杆菌)。双特异性抗体分子可以通过在不同宿主细胞中单独表达组分并且随后纯化/组装来产生。可替代地,可以通过在单个宿主细胞中表达组分来产生抗体分子。双特异性抗体分子的纯化可以通过各种方法进行,如亲和色谱法,例如使用蛋白质a和顺序ph洗脱。在其他实施例中,亲和标签可以用于纯化,例如含组氨酸的标签、myc标签、或链霉亲和素标签。
cdr移植的支架
在实施例中,抗体分子是cdr移植的支架结构域。在实施例中,支架结构域基于纤连蛋白结构域,例如纤连蛋白iii型结构域。纤连蛋白iii型(fn3)结构域的整体折叠与最小功能抗体片段(抗体重链的可变结构域)的整体折叠密切相关。fn3末端有三个环;bc、de和fg环的位置大致对应于抗体vh结构域的cdr1、2和3的位置。fn3没有二硫键;因此,与抗体及其片段不同,fn3在还原条件是是稳定的(参见例如,wo98/56915;wo01/64942;wo00/34784)。fn3结构域可以被修饰(例如,使用本文描述的cdr或高变环)或改变,例如以选择与本文描述的抗原/标记物/细胞结合的结构域。
在实施例中,支架结构域(例如,折叠结构域)基于抗体,例如通过从单克隆抗体的重链可变结构域缺失三条β链而产生的“迷你抗体”支架(参见例如,tramontano等人,1994,jmol.recognit.[分子识别杂志]7:9;和martin等人,1994,emboj.[欧洲分子生物学学会杂志],13:5303-5309)。“迷你抗体”可以用于呈现两个高变环。在实施例中,支架结构域是v样结构域(参见例如,coia等人wo99/45110)或衍生自tendamistatin的结构域,所述tendamistatin是由两个二硫键保持在一起的74个残基的六链β折叠夹心)(参见例如,mcconnell和hoess,1995,jmol.biol.[分子生物学杂志]250:460)。例如,tendamistatin的环可以被修饰(例如,使用cdr或高变环)或改变,例如以选择与本文描述的标记物/抗原/细胞结合的结构域。另一个示例性支架结构域是衍生自ctla-4的细胞外结构域的β夹心结构(参见例如,wo00/60070)。
其他示例性支架结构域包括但不限于t细胞受体;mhc蛋白;细胞外结构域(例如,纤连蛋白iii型重复、egf重复);蛋白酶抑制剂(例如,kunitz结构域、大肠杆菌素(ecotin)、bpti等等);tpr重复;三叶结构(trifoilstructure);锌指结构域;dna结合蛋白;特别是单体dna结合蛋白;rna结合蛋白;酶,例如蛋白酶(特别是灭活的蛋白酶)、rna酶;伴侣蛋白,例如硫氧还蛋白、和热休克蛋白;和细胞内信号传导结构域(如sh2和sh3结构域)。参见例如,us20040009530和us7,501,121,通过引用并入本文。
在实施例中,例如通过以下标准中的一个或多个评估和选择支架结构域:(1)氨基酸序列,(2)若干同源结构域的序列,(3)三维结构,和/或(4)ph、温度、盐度、有机溶剂、氧化剂浓度范围内的稳定性数据。在实施例中,支架结构域是小的稳定的蛋白质结构域,例如少于100个、70个、50个、40个或30个氨基酸的蛋白质。结构域可以包含一个或多个二硫键或者可以螯合金属(例如,锌)。
基于抗体的融合物
可以产生多种形式,其包含附接于抗体的n或c末端的另外的结合实体。与单链或二硫键稳定的fv或fab的这些融合物导致产生对每种抗原具有二价结合特异性的四价分子。scfv和scfab与igg的组合使得能够产生可以识别三种或更多种不同抗原的分子。
抗体-fab融合物
抗体-fab融合物是双特异性抗体,其包含第一靶标的传统抗体和第二靶标的与抗体重链的c末端融合的fab。通常,抗体和fab将具有共有轻链。通过(1)工程化靶融合物的dna序列,并且(2)将靶dna转染到合适的宿主细胞中来表达融合蛋白可以产生抗体融合物。似乎抗体-scfv融合物可以通过在ch3结构域的c-末端与scfv的n-末端之间的(gly)-ser接头连接,如通过以下文献描述的:coloma,j.等人(1997)naturebiotech[自然生物技术]15:159。
抗体-scfv融合物
抗体-scfv融合物是包含传统抗体和与抗体重链的c末端融合的具有独特特异性的scfv的双特异性抗体。scfv可以直接或经由接头肽通过scfv的重链与c末端融合。通过(1)工程化靶融合物的dna序列,并且(2)将靶dna转染到合适的宿主细胞中来表达融合蛋白可以产生抗体融合物。似乎抗体-scfv融合物可以通过在ch3结构域的c-末端与scfv的n-末端之间的(gly)-ser接头连接,如通过以下文献描述的:coloma,j.等人(1997)naturebiotech[自然生物技术]15:159。
可变结构域免疫球蛋白dvd
相关形式是双可变结构域免疫球蛋白(dvd),其由v结构域的n末端上的第二特异性位置(place)的vh和vl结构域通过较短的接头序列组成。
其他示例性的多特异性抗体形式包括例如描述在以下的那些:us20160114057a1、us20130243775a1、us20140051833、us20130022601、us20150017187a1、us20120201746a1、us20150133638a1、us20130266568a1、us20160145340a1、wo2015127158a1、us20150203591a1、us20140322221a1、us20130303396a1、us20110293613、us20130017200a1、us20160102135a1、wo2015197598a2、wo2015197582a1、us9359437、us20150018529、wo2016115274a1、wo2016087416a1、us20080069820a1、us9145588b、us7919257、和us20150232560a1。利用全抗体-fab/scfab形式的示例性的多特异性分子包括描述在以下的那些:us9382323b2、us20140072581a1、us20140308285a1、us20130165638a1、us20130267686a1、us20140377269a1、us7741446b2、和wo1995009917a1。利用结构域交换形式的示例性的多特异性分子包括描述在以下的那些:us20150315296a1、wo2016087650a1、us20160075785a1、wo2016016299a1、us20160130347a1、us20150166670、us8703132b2、us20100316645、us8227577b2、us20130078249。
含fc的实体(微型抗体)
含fc的实体(也称为微型抗体)可以通过将scfv融合至恒定重链区结构域3的c-末端(ch3-scfv)和/或融合至具有不同特异性的抗体的铰链区(scfv-铰链-fc)来产生。还可以制备具有与igg的ch3结构域的c-末端融合的二硫键稳定的可变结构域(没有肽接头)的三价实体。
含fc的多特异性分子
在一些实施例中,本文披露的多特异性分子包含免疫球蛋白恒定区(例如,fc区)。示例性fc区可以选自igg1、igg2、igg3或igg4的重链恒定区;更具体地,人igg1、igg2、igg3、或igg4的重链恒定区。
在一些实施例中,免疫球蛋白链恒定区(例如,fc区)被改变(例如,突变)以增加或减少以下中的一种或多种:fc受体结合、抗体糖基化、半胱氨酸残基的数量、效应细胞功能、或补体功能。
在其他实施例中,第一和第二免疫球蛋白链恒定区(例如,第一和第二fc区)的界面被改变(例如,突变),以增加或减少二聚化,例如相对于非工程化界面(例如,天然存在的界面)。例如,免疫球蛋白链恒定区(例如,fc区)的二聚化可以通过提供第一和第二fc区的fc界面与以下的一种或多种来增强:成对的突起-空腔(“杵臼结构”)、静电相互作用、或链交换,使得形成更大比率的异源多聚体比同源多聚体,例如相对于非工程化界面。
在一些实施例中,多特异性分子包含在选自例如人igg1的fc区的以下中的一个或多个的位置处的成对的氨基酸取代:347、349、350、351、366、368、370、392、394、395、397、398、399、405、407、或409。例如,免疫球蛋白链恒定区(例如,fc区)可以包含选自以下的成对的氨基酸取代:t366s、l368a、或y407v(例如,对应于空腔或臼)、和t366w(例如,对应于突起或杵)。
在其他实施例中,多功能分子包含半衰期延长剂,例如人血清白蛋白或人血清白蛋白的抗体分子。
异源二聚化抗体分子和制备方法
已经披露了产生多特异性抗体的各种方法以解决不正确的重链配对的问题。下面描述了示例性方法。示例性的多特异性抗体形式以及制备所述多特异性抗体的方法披露在例如,speiss等人molecularimmunology[分子免疫学]67(2015)95–106;和klein等人mabs[单克隆抗体]4:6,653–663;2012年11月/12月;将其中每个的全部内容通过引用并入本文。
异源二聚化的双特异性抗体基于天然igg结构,其中两个结合臂识别不同的抗原。通过强制重链异源二聚化结合最小化轻链错配(例如,共有轻链)的技术产生能够定义单价(和同时)抗原结合的igg衍生形式。可以使用例如杵臼结构或链交换工程化的结构域(seed)获得强制重链异源二聚化。
杵臼结构
如描述在us5,731,116、us7,476,724和ridgway,j.等人(1996)prot.engineering[蛋白质工程]9(7):617-621中的杵臼结构广泛地涉及:(1)突变一种或两种抗体的ch3结构域以促进异源二聚化;并且(2)在促进异源二聚化的条件下组合突变的抗体。“杵”或“突起”典型地通过用较大的氨基酸替换亲本抗体中的小氨基酸(例如,t366y或t366w)来产生;“臼”或“空腔”通过用较小的氨基酸替换亲本抗体中的较大残基(例如,y407t、t366s、l368a和/或y407v)来产生。
对于包含fc结构域的双特异性抗体,可以利用将特定突变引入重链的恒定区以促进fc部分的正确异源二聚化。若干此类技术在以下文献中综述:klein等人(mabs[单克隆抗体](2012)4:6,1-11),将其内容通过引用以其整体并入本文。这些技术包括“杵臼结构”(kih)方法,其涉及将庞大的残基引入抗体重链之一的ch3结构域之一中。此庞大的残基适合配对的重链的另一个ch3结构域中的互补“臼”,以促进重链的正确配对(参见例如,us7642228)。
示例性kih突变包括“杵”重链中的s354c、t366w,以及“臼”重链中的y349c、t366s、l368a、y407v。其他示例性kih突变以及另外的任选的稳定化fc半胱氨酸突变提供在表1中。
表19.示例性fckih突变和任选的半胱氨酸突变
由igawa和tsunoda提供了其他fc突变,他们鉴定了一条链的ch3结构域中的3个带负电荷的残基,其与另一条链的ch3结构域中的三个带正电荷的残基配对。这些特异性带电残基对是:e356-k439、e357-k370、d399-k409,反之亦然。通过在链a中引入以下三个突变中的至少两个:e356k、e357k和d399k,以及链b中的k370e、k409d、k439e,单独地或与新鉴定的二硫键组合,他们能够有利于非常有效的异源二聚化同时抑制同源二聚化(martenst等人anovelone-armedantic-metantibodyinhibitsglioblastomagrowthinvivo[新颖的单臂抗met抗体抑制体内胶质母细胞瘤的生长].clincancerres[癌症临床研究]2006;12:6144-52;pmid:17062691)。xencor基于组合结构计算和序列信息定义了41个变体对,随后筛选最大异源二聚化,从而定义了链a上的s364h、f405a(ha)和链b上的y349t、t394f(tf)的组合(mooregl等人anovelbispecificantibodyformatenablessimultaneousbivalentandmonovalentco-engagementofdistincttargetantigens[新颖的双特异性抗体形式能够同时实现不同靶抗原的二价和单价共同衔接].mabs[单克隆抗体]2011;3:546-57;pmid:22123055)。
促进多特异性抗体的异源二聚化的其他示例性fc突变包括在以下参考文献中描述的那些,将其中每个的内容通过引用并入本文:wo2016071377a1、us20140079689a1、us20160194389a1、us20160257763、wo2016071376a2、wo2015107026a1、wo2015107025a1、wo2015107015a1、us20150353636a1、us20140199294a1、us7750128b2、us20160229915a1、us20150344570a1、us8003774a1、us20150337049a1、us20150175707a1、us20140242075a1、us20130195849a1、us20120149876a1、us20140200331a1、us9309311b2、us8586713、us20140037621a1、us20130178605a1、us20140363426a1、us20140051835a1和us20110054151a1。
还已将稳定化半胱氨酸突变与kih和促进异源二聚化的其他fc变体组合使用,参见例如us7183076。其他示例性半胱氨酸修饰包括例如披露在以下us20140348839a1、us7855275b2、和us9000130b2中的那些。
链交换工程化的结构域(seed)
通过设计链交换工程化的结构域(seed)c(h)3异源二聚体来支持双特异性和不对称融合蛋白的设计的异源二聚体fc平台是已知的。人igg和igac(h)3结构域的这些衍生物产生互补的人seedc(h)3异源二聚体,其由人iga和iggc(h)3序列的交替区段组成。当在哺乳动物细胞中表达时,所得的seedc(h)3结构域配对优先缔合以形成异源二聚体。seedbody(sb)融合蛋白由[igg1铰链]-c(h)2-[seedc(h)3]组成,其可以与一种或多种融合配偶体基因地连接(参见例如,davisjh等人seedbodies:fusionproteinsbasedonstrandexchangeengineereddomain(seed)ch3heterodimersinanfcanalogueplatformforasymmetricbindersorimmunofusionsandbispecificantibodies[seedbodies:不对称结合物或免疫融合物和双特异性抗体的fc模拟平台中的基于链交换工程化的结构域(seed)ch3异源二聚体的融合蛋白].proteinengdessel[蛋白质工程设计与选择]2010;23:195-202;pmid:20299542和us8871912,将其中每个的内容通过引用并入本文)。
duobody
产生具有正确重链配对的双特异性抗体的“duobody”技术是已知的。duobody技术涉及在产生后交换反应中产生稳定的双特异性人igg1抗体的三个基本步骤。在第一步中,使用标准哺乳动物重组细胞系分别产生两种igg1,每种igg1在第三恒定(ch3)结构域中含有单个匹配的突变。随后,根据用于回收和纯化的标准方法纯化这些igg1抗体。在产生和纯化(产生后)后,将两种抗体在定制的实验室条件下重组,产生具有非常高产率(典型地>95%)的双特异性抗体产物(参见例如,labrijn等人,pnas[美国国家科学院院刊]2013;110(13):5145-5150和labrijn等人natureprotocols[自然实验手册]2014;9(10):2450-63,将其中每个的内容通过引用并入本文)。
静电相互作用
披露了制备多特异性抗体的方法:使用ch3氨基酸改变与带电荷的氨基酸,使得同源二聚体形成是静电不利的。ep1870459和wo2009089004描述了在宿主细胞中共表达不同抗体结构域时有利于异源二聚体形成的其他策略。在这些方法中,构成重链恒定结构域3(ch3)(即两个ch3结构域中的ch3-ch3界面)的一个或多个残基被带电荷的氨基酸替换,使得同源二聚体形成是静电不利的并且异源二聚化是静电有利的。使用静电相互作用制备多特异性分子的另外的方法描述在以下参考文献中,将其中每个的内容通过引用并入本文,这些参考文献包括us20100015133、us8592562b2、us9200060b2、us20140154254a1、和us9358286a1。
共有轻链
需要避免轻链错配以产生双特异性igg的同源制剂。实现这一点的一种方式是通过使用共有轻链原理,即将共享一条轻链但仍具有分离的特异性的两种结合剂组合。增强从单体混合物形成所希望的双特异性抗体的示例性方法是通过提供共有可变轻链以与双特异性抗体的每个异聚可变重链区相互作用。产生具有共有轻链的双特异性抗体的组合物和方法例如披露在us7183076b2、us20110177073a1、ep2847231a1、wo2016079081a1、和ep3055329a1,将其中每个的内容通过引用并入本文。
crossmab
减少轻链错配的另一种选择是crossmab技术,其通过在双特异性抗体的一半的fab中交换ch1和cl结构域来避免非特异性l链错配。此类交叉变体保留结合特异性和亲和力,但使两个臂如此不同以防止l链错配。crossmab技术(如klein等人,同上综述)涉及重链与轻链之间的结构域交换,以促进正确配对的形成。简而言之,为了通过使用两个不同的轻链-重链对构建可与两种抗原结合的双特异性igg样crossmab抗体,应用两步修饰方法。首先,使用异源二聚化方法(例如,杵臼结构(kih)技术)将二聚化界面工程化到每条重链的c-末端,以确保仅有效地形成来自一种抗体(例如抗体a)和第二抗体(例如抗体b)的两条不同重链的异源二聚体。接下来,将一种抗体的恒定重1(ch1)和恒定轻(cl)结构域交换(抗体a),保持可变重链(vh)和可变轻链(vl)结构域一致。ch1和cl结构域的交换确保经修饰的抗体(抗体a)轻链将仅与经修饰的抗体(抗体a)重链有效二聚化,而未经修饰的抗体(抗体b)轻链将仅与未经修饰的抗体(抗体b)重链有效地二聚化;因此,仅有效地形成所希望的双特异性crossmab(参见例如,cain,c.scibx4(28);doi:10.1038/scibx.2011.783,将其内容通过引用并入本文)。
共有重链
增强从单体混合物形成所希望的双特异性抗体的示例性方法是通过提供共有可变重链以与双特异性抗体的每个异聚可变轻链区相互作用。产生具有共有重链的双特异性抗体的组合物和方法披露在例如us20120184716、us20130317200、和us20160264685a1中,将其中每个的内容通过引用并入本文。
氨基酸修饰
产生具有正确轻链配对的多特异性抗体的可替代的组合物和方法包括各种氨基酸修饰。例如,zymeworks描述了在ch1和/或cl结构域中具有一个或多个氨基酸修饰、在vh和/或vl结构域中具有一个或多个氨基酸修饰、或其组合的异源二聚体,其是轻链和重链之间的界面的一部分,并在每条重链和所希望的轻链之间产生优先配对,使得当异源二聚体对的两条重链和两条轻链在细胞中共表达时,第一异源二聚体的重链优先与轻链中的一条而不是另一条配对(参见例如,wo2015181805)。其他示例性方法描述在wo2016026943(argen-x)、us20150211001、us20140072581a1、us20160039947a1、和us20150368352中。
λ/κ形式
可以使用包含λ轻链多肽和κ轻链多肽的多特异性分子(例如,多特异性抗体分子)以允许异源二聚化。用于产生包含λ轻链多肽和κ轻链多肽的双特异性抗体分子的方法披露在于2016年9月23日提交的ussn62/399,319中,通过引用以其整体并入本文。
在实施例中,多特异性分子包括多特异性抗体分子,例如包含两种结合特异性的抗体分子,例如双特异性抗体分子。多特异性抗体分子包含:
对第一表位具特异性的λ轻链多肽1(llcp1);
对第一表位具特异性的重链多肽1(hcp1);
对第二表位具特异性的κ轻链多肽2(klcp2);以及
对第二表位具特异性的重链多肽2(hcp2)。
术语“λ轻链多肽1(llcp1)”,如该术语在本文中使用,是指包含足够轻链(lc)序列使得当与同源重链可变区组合时可介导与其表位的特异性结合并与hcp1复合的多肽。在一个实施例中,其包含ch1区的全部或片段。在一个实施例中,llcp1包含lc-cdr1、lc-cdr2、lc-cdr3、fr1、fr2、fr3、fr4、和ch1,或来自其的足够的序列以介导其表位的特异性结合并与hcp1复合。llcp1与其hcp1一起提供对第一表位的特异性(而klcp2与其hcp2一起提供对第二表位的特异性)。如本文其他地方所述,llcp1对hcp1的亲和力高于对hcp2的亲和力。
术语“κ轻链多肽2(klcp2)”,如该术语在本文中使用,是指包含足够轻链(lc)序列使得当与同源重链可变区组合时可介导与其表位的特异性结合并与hcp2复合的多肽。在一个实施例中,其包含ch1区的全部或片段。在一个实施例中,klcp2包含lc-cdr1、lc-cdr2、lc-cdr3、fr1、fr2、fr3、fr4、和ch1,或来自其的足够的序列以介导其表位的特异性结合并与hcp2复合。klcp2与其hcp2一起提供对第二表位的特异性(而llcp1与其hcp1一起提供对第一表位的特异性)。
术语“重链多肽1(hcp1)”,如该术语在本文中使用,是指包含足够重链(hc)序列(例如,hc可变区序列)使得当与同源llcp1组合时可介导与其表位的特异性结合并与hcp1复合的多肽。在一个实施例中,其包含ch1区的全部或片段。在一个实施例中,其包含ch2和/或ch3区的全部或片段。在一个实施例中,hcp1包含hc-cdr1、hc-cdr2、hc-cdr3、fr1、fr2、fr3、fr4、ch1、ch2、和ch3,或来自其的足够的序列,以:(i)介导其表位的特异性结合并与llcp1复合,(ii)优先复合至llcp1而不是klcp2,如本文描述的;以及(iii)优先复合至hcp2而不是另一种hcp1分子,如本文描述的。hcp1与其llcp1一起提供对第一表位的特异性(而klcp2与其hcp2一起提供对第二表位的特异性)。
术语“重链多肽2(hcp2)”,如该术语在本文中使用,是指包含足够重链(hc)序列(例如,hc可变区序列),使得当与同源llcp1组合时可介导与其表位的特异性结合并与hcp1复合的多肽。在一个实施例中,其包含ch1区的全部或片段。在一个实施例中,其包含ch2和/或ch3区的全部或片段。在一个实施例中,hcp1包含hc-cdr1、hc-cdr2、hc-cdr3、fr1、fr2、fr3、fr4、ch1、ch2、和ch3,或来自其的足够的序列,以:(i)介导其表位的特异性结合并与klcp2复合,(ii)优先复合至klcp2而不是llcp1,如本文描述的;以及(iii)优先复合至hcp1而不是另一种hcp2分子,如本文描述的。hcp2与其klcp2一起提供对第二表位的特异性(而llcp1与其hcp1一起提供对第一表位的特异性)。
在本文披露的多特异性抗体分子的一些实施例中:
llcp1对hcp1的亲和力高于对hcp2的亲和力;和/或
klcp2对hcp2的亲和力高于对hcp1的亲和力。
在实施例中,llcp1对hcp1的亲和力足够大于其对hcp2的亲和力,使得在预选条件下(例如,在例如ph7的水性缓冲液中、在例如ph7的盐水中)或在生理条件下,至少75%、80%、90%、95%、98%、99%、99.5%、或99.9%的多特异性抗体分子具有与hcp1复合或相接的llcp1。
在本文披露的多特异性抗体分子的一些实施例中:
hcp1对hcp2的亲和力大于对第二hcp1分子的亲和力;和/或
hcp2对hcp1的亲和力大于对第二hcp2分子的亲和力。
在实施例中,hcp1对hcp2的亲和力足够大于其对第二hcp1分子的亲和力,使得在预选条件下(例如,在例如ph7的水性缓冲液中、在例如ph7的盐水中)或在生理条件下,至少75%、80%、90%、95%、98%、99%、99.5%或99.9%的多特异性抗体分子具有与hcp2复合或相接的hcp1。
在另一方面,本文披露了用于制备或产生多特异性抗体分子的方法。所述方法包括:
(i)提供第一重链多肽(例如,包含第一重链可变区(第一vh)、第一ch1、第一重链恒定区(例如,第一ch2、第一ch3、或两者)中的一个、两个、三个或全部的重链多肽);
(ii)提供第二重链多肽(例如,包含第二重链可变区(第二vh)、第二ch1、第二重链恒定区(例如,第二ch2、第二ch3、或两者)中的一个、两个、三个或全部的重链多肽);
(iii)提供与第一重链多肽(例如,第一vh)优先缔合的λ链多肽(例如,λ轻可变区(vlλ)、λ轻恒定链(vlλ)、或两者);并且
(iv)提供与第二重链多肽(例如,第二vh)优先缔合的κ链多肽(例如,λ轻可变区(vlκ)、λ轻恒定链(vlκ)、或两者),
在(i)-(iv)相关的情况下。
在实施例中,第一和第二重链多肽形成增强异源二聚化的fc界面。
在实施例中,将(i)-(iv)(例如,编码(i)-(iv)的核酸)引入单个细胞(例如,单个哺乳动物细胞,例如cho细胞)中。在实施例中,(i)-(iv)在细胞中表达。
在实施例中,将(i)-(iv)(例如,编码(i)-(iv)的核酸)引入不同的细胞(例如,不同的哺乳动物细胞,例如两个或更多个cho细胞)中。在实施例中,(i)-(iv)在细胞中表达。
在一个实施例中,所述方法进一步包括纯化细胞表达的抗体分子,例如使用λ特异性纯化和/或κ特异性纯化,例如亲和色谱法。
在实施例中,所述方法进一步包括评估细胞表达的多特异性抗体分子。例如,可以通过本领域已知的技术(包括质谱法)分析经纯化的细胞表达的多特异性抗体分子。在一个实施例中,将经纯化的细胞表达的抗体分子切割(例如,用木瓜蛋白酶消化)以产生fab部分并使用质谱法评估。
在实施例中,所述方法以高产率(例如,至少75%、80%、90%、95%、98%、99%、99.5%或99.9%)产生正确配对的κ/λ多特异性(例如,双特异性)抗体分子。
在其他实施例中,多特异性(例如,双特异性)抗体分子包含:
(i)第一重链多肽(hcp1)(例如,包含第一重链可变区(第一vh)、第一ch1、第一重链恒定区(例如,第一ch2、第一ch3、或两者)中的一个、两个、三个或全部的重链多肽),例如,其中hcp1与第一表位结合;
(ii)第二重链多肽(hcp2)(例如,包含第二重链可变区(第二vh)、第二ch1、第二重链恒定区(例如,第二ch2、第二ch3、或两者)中的一个、两个、三个或全部的重链多肽),例如,其中hcp2与第二表位结合;
(iii)与第一重链多肽(例如,第一vh)优先缔合的λ轻链多肽(llcp1)(例如,λ轻可变区(vll)、λ轻恒定链(vll)、或两者),例如,其中llcp1与第一表位结合;以及
(iv)与第二重链多肽(例如,第二vh)优先缔合的κ轻链多肽(klcp2)(例如,λ轻可变区(vlk)、λ轻恒定链(vlk)、或两者),例如,其中klcp2与第二表位结合。
在实施例中,第一和第二重链多肽形成增强异源二聚化的fc界面。在实施例中,多特异性抗体分子具有第一结合特异性,所述第一结合特异性包含异源二聚化至与fc恒定的ch2-ch3结构域(具有杵修饰)连接的第一重链可变区的杂合vl1-cl1,并且具有第二结合特异性,所述第二结合特异性包含异源二聚化至与fc恒定的ch2-ch3结构域(具有臼修饰)连接的第二重链可变区的杂合vlk-clk。
示例性的多特异性构型:
在一些实施例中,多特异性分子包含第一和第二不连续多肽,其中:
(i)第一多肽例如在n-至c-方向上包含与例如癌抗原(例如,实体瘤、基质或血液抗原)结合的肿瘤靶向部分,例如抗体分子(例如,第一抗原结构域的第一部分,例如fab分子的第一vh-ch1),所述肿瘤靶向部分任选地经由接头连接至细胞因子分子或免疫细胞衔接子,例如与免疫细胞抗原结合的抗体分子,例如scfv;并且
(ii)第二多肽例如在n-至c-方向上包含第一抗原结构域的第二部分,例如fab的第一vl-cl,所述第二部分与例如肿瘤或基质抗原(例如,由第一vh-ch1结合的相同的肿瘤或基质抗原)结合。在一些实施例中,多特异性分子包含任选地经由接头连接至scfv的fab分子。在实施例中,多特异性分子是双特异性分子。
在其他实施例中,多特异性分子包含第一、第二和第三不连续多肽,其中:
(i)第一多肽例如在n-至c-方向上包含与例如肿瘤或基质抗原结合的肿瘤靶向部分,例如抗体分子(例如,第一抗原结构域的第一部分,例如fab分子的第一vh-ch1),所述肿瘤靶向部分任选地经由接头连接至第一结构域,所述第一结构域促进第一与第二多肽之间的关联(例如,第一免疫球蛋白恒定结构域(例如,如本文描述的第一fc分子));
(ii)第二多肽例如在n-至c-方向上包含细胞因子分子或免疫细胞衔接子(例如,与免疫细胞抗原结合的抗体分子,例如scfv),所述细胞因子分子或免疫细胞衔接子任选地经由接头连接至第二结构域,所述第二结构域促进第一与第二多肽之间的关联(例如,第二免疫球蛋白恒定结构域(例如,如本文描述的第二fc分子));并且
(iii)第三多肽例如在n-至c-方向上包含第一抗原结构域的第二部分,例如fab的第一vl-cl,所述第二部分与例如肿瘤或基质抗原(例如,由第一vh-ch1结合的相同的肿瘤或基质抗原)结合。在一些实施例中,多特异性分子包含任选地经由接头连接至第一fc分子的fab分子、任选地经由接头连接至第二fc分子的细胞因子或免疫细胞衔接子(例如,scfv)。在实施例中,多特异性分子是双特异性分子。
在其他实施例中,多特异性分子包含第一、第二和第三不连续多肽,其中:
(i)第一多肽例如在n-至c-方向上包含与例如癌抗原结合的肿瘤靶向部分,例如抗体分子(例如,第一抗原结构域的第一部分,例如fab分子的第一vh-ch1),所述肿瘤靶向部分任选地经由接头连接至第一结构域,所述第一结构域促进第一与第二多肽之间的关联(例如,第一免疫球蛋白恒定结构域(例如,如本文描述的第一fc分子));
(ii)第二多肽例如在n-至c-方向上包含细胞因子分子或免疫细胞衔接子(例如,与免疫细胞抗原结合的抗体分子,例如scfv),所述细胞因子分子或免疫细胞衔接子任选地经由接头连接至第二结构域,所述第二结构域促进第一与第二多肽之间的关联(例如,第二免疫球蛋白恒定结构域(例如,如本文描述的第二fc分子));并且
(iii)第三多肽例如在n-至c-方向上包含第一抗原结构域的第二部分,例如fab的第一vl-cl,所述第二部分与例如肿瘤或基质抗原(例如,由第一vh-ch1结合的相同的肿瘤或基质抗原)结合。在一些实施例中,多特异性分子包含任选地经由接头连接至第一fc分子的fab分子、任选地经由接头连接至第二fc分子的细胞因子或免疫细胞衔接子(例如,scfv),
其中第一或第二多肽进一步包含细胞因子分子或免疫细胞衔接子,所述细胞因子分子或免疫细胞衔接子任选地共价连接至第一或第二免疫球蛋白恒定结构域的c-末端。在实施例中,多特异性分子是三特异性分子。
在其他实施例中,多特异性分子包含第一、第二和第三不连续多肽,其中:
(i)第一多肽例如在n-至c-方向上包含与例如肿瘤或基质抗原结合的肿瘤靶向部分,例如抗体分子(例如,第一抗原结构域的第一部分,例如fab分子的第一vh-ch1),所述肿瘤靶向部分任选地经由接头连接至第一结构域,所述第一结构域促进第一与第二多肽之间的关联(例如,第一免疫球蛋白恒定结构域(例如,如本文描述的第一fc分子));
(ii)第二多肽例如在n-至c-方向上包含细胞因子分子或免疫细胞衔接子(例如,与免疫细胞抗原结合的抗体分子,例如scfv),所述细胞因子分子或免疫细胞衔接子任选地经由接头连接至第二结构域,所述第二结构域促进第一与第二多肽之间的关联(例如,第二免疫球蛋白恒定结构域(例如,如本文描述的第二fc分子));并且
(iii)第三多肽例如在n-至c-方向上包含第一抗原结构域的第二部分,例如fab的第一vl-cl,所述第二部分与例如肿瘤或基质抗原(例如,由第一vh-ch1结合的相同的肿瘤或基质抗原)结合。在一些实施例中,多特异性分子包含任选地经由接头连接至第一fc分子的fab分子、任选地经由接头连接至第二fc分子的细胞因子或免疫细胞衔接子(例如,scfv),
其中第一和第二多肽进一步包含细胞因子分子、免疫细胞衔接子或两者,所述细胞因子分子、免疫细胞衔接子或两者任选地共价连接至第一或第二免疫球蛋白恒定结构域的c-末端。在实施例中,多特异性分子是四特异性分子。
在其他实施例中,多特异性分子包含第一和第二多肽,其中第一多肽例如在n至c方向上包含:
肿瘤靶向部分;
(任选地)促进第一和第二多肽的关联的结构域,例如fc分子;以及
包含免疫细胞衔接子或细胞因子分子的第一多肽;并且,其中第二多肽例如在n至c方向上包含:
肿瘤靶向部分、或其亚基;
(任选地)促进第一和第二多肽的关联的结构域,例如fc分子;以及
包含免疫细胞衔接子或细胞因子分子的第二多肽,
其中第一和第二多肽是不同的。
在实施例中,第一多肽的肿瘤靶向部分包含肿瘤靶向分子(例如,fab)的轻链可变结构域;并且第二多肽的肿瘤靶向部分包含肿瘤靶向分子(例如,fab)的重链可变结构域。
在其他实施例中,第一多肽的第一肿瘤靶向部分包含肿瘤靶向分子(例如,fab)的重链可变结构域;并且第二多肽的第二肿瘤靶向部分包含肿瘤靶向分子(例如,fab)的轻链可变结构域。
在其他实施例中,第一多肽的第一肿瘤靶向部分包含肿瘤靶向分子(例如,fab)的轻链可变结构域;并且第二多肽的第二肿瘤靶向部分包含肿瘤靶向分子(例如,fab)的重链可变结构域。
在其他实施例中,第一多肽的肿瘤靶向部分包括肿瘤靶向scfv;并且第二多肽的肿瘤靶向部分包括肿瘤靶向scfv。
在其他实施例中,多特异性分子包含:
a)第一多肽,所述第一多肽包含:
促进第一和第二多肽的关联的第一结构域,例如第一fc分子;和
选自以下的两种多肽:肿瘤靶向部分;免疫细胞衔接子;或细胞因子分子;以及
b)第二多肽,所述第二多肽包含:
促进第一和第二多肽的关联的第二结构域,例如第二fc分子;和
选自以下的两种多肽:肿瘤靶向部分;免疫细胞衔接子;或细胞因子分子,
其中多特异性分子包含肿瘤靶向部分;免疫细胞衔接子;和细胞因子分子。在实施例中,多特异性分子包括以下中的一种:
(i)肿瘤靶向部分;免疫细胞衔接子;和两种细胞因子分子;
(ii)肿瘤靶向部分;两种免疫细胞衔接子;和细胞因子分子;或者
(iii)两种肿瘤靶向部分;免疫细胞衔接子;和细胞因子分子。
在其他实施例中,多特异性分子包含第一多肽和第二多肽,其中:
i)第一多肽例如在n-c或c-n方向上包含肿瘤靶向部分;促进第一和第二多肽的关联的第一结构域,例如第一fc分子;和免疫细胞衔接子;
ii)第一多肽例如在n-c或c-n方向上包含肿瘤靶向部分;促进第一和第二多肽的关联的第一结构域,例如第一fc分子;和细胞因子分子;或者
iii)第一多肽例如在n-c或c-n方向上包含细胞因子;促进第一和第二多肽的关联的第一结构域,例如第一fc分子;和免疫细胞衔接子;并且
iv)第二多肽例如在n-c或c-n方向上包含肿瘤靶向部分;促进第一和第二多肽的关联的第二结构域,例如第二fc分子;和免疫细胞衔接子;
ii)第二多肽例如在n-c或c-n方向上包含肿瘤靶向部分;促进第一和第二多肽的关联的第二结构域,例如第二fc分子;和细胞因子分子;或者
iii)第二多肽例如在n-c或c-n方向上包含细胞因子;促进第一和第二多肽的关联的第二结构域,例如第二fc分子;和免疫细胞衔接子。
本申请的另外的特征和实施例包括以下中的一个或多个。
在另一方面,本发明的特征在于多特异性(例如,二特异性或三特异性)分子,所述分子在n末端至c末端方向上包含下式:
r1-(任选地l1)-r2-(任选地l2)-r3;
r1-(任选地l1)-r3-(任选地l2)-r2;
r2-(任选地l1)-r1-(任选地l2)-r3;
r2-(任选地l1)-r3-(任选地l2)-r1;
r3-(任选地l1)-r1-(任选地l2)-r2;或者
r3-(任选地l1)-r2-(任选地l2)-r1;
其中:
(i)r1是如本文描述的肿瘤靶向部分,其中r1仅当r2和r3存在时可以是0,或者r1包含1种、2种或更多种肿瘤靶向部分(例如,相同或不同的肿瘤靶向部分);
(ii)r2是如本文描述的免疫细胞衔接子,其中r2仅当r1和r3存在时可以是0,或者r2包含1种、2种或更多种免疫细胞衔接子(例如,相同或不同的免疫细胞衔接子);
(iii)r3是如本文描述的细胞因子分子,其中r3仅当r1和r2存在时可以是0,或者r3包含1种、2种或更多种细胞因子分子(例如,相同或不同的细胞因子分子);并且
(iv)任选地,l1和/或l2是本文描述的任何接头。
在一些实施例中,r1和/或r2是全抗体(例如,包含至少一条、优选两条完整的重链和至少一条、优选两条完整的轻链的抗体)、或抗原结合片段(例如,fab、f(ab')2、fv、单链fv片段、单结构域抗体、双抗体(dab)、二价抗体、或双特异性抗体或其片段、其单结构域变体、或骆驼科动物抗体)。
在其他实施例中,r1和r2选自共有轻链双特异性igg;双重作用fab(daf)、crossmab、igg-dssc-fv2、dvd(双可变结构域)、igg-dsfv、igg-scfab、scfab-dsscfv、fv2-fc、fab-scfv2、fab-scfv、scfv-scfv、完整抗体-fab、完整抗体-scfv、双抗体、dart(双重亲和力重靶向分子)、或tandab。
在其他实施例中,多特异性分子进一步包含r4,其中r4是第二肿瘤靶向部分;第二免疫细胞衔接子(例如,nk细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子);或第二细胞因子分子。
在其他实施例中,多特异性分子可以进一步包含l3,其中l3是接头(例如,本文描述的接头)。
在一些实施例中,r4是全抗体(例如,包含至少一条、优选两条完整的重链和至少一条、优选两条完整的轻链的抗体)、或抗原结合片段(例如,fab、f(ab')2、fv、单链fv片段、单结构域抗体、双抗体(dab)、二价抗体、或双特异性抗体或其片段、其单结构域变体、或骆驼科动物抗体)。
在其他实施例中,r1和r4是共有轻链双特异性igg;双重作用fab(daf)、crossmab、igg-dssc-fv2、dvd(双可变结构域)、igg-dsfv、igg-scfab、scfab-dsscfv、fv2-fc、fab-scfv2、fab-scfv、scfv-scfv、完整抗体-fab、完整抗体-scfv、双抗体、dart(双重亲和力重靶向分子)、或tandab。
在其他实施例中,r2和r4是共有轻链双特异性igg;双重作用fab(daf)、crossmab、igg-dssc-fv2、dvd(双可变结构域)、igg-dsfv、igg-scfab、scfab-dsscfv、fv2-fc、fab-scfv2、fab-scfv、scfv-scfv、完整抗体-fab、完整抗体-scfv、双抗体、dart(双重亲和力重靶向分子)、或tandab。
在另一方面,本发明的特征在于包含r1和r2的多特异性分子,其中:
(i)r1是本文描述的肿瘤靶向部分,例如,r1包含1种、2种或更多种肿瘤靶向部分(例如,相同或不同的肿瘤靶向部分);
(ii)r2是本文描述的细胞因子分子,例如,r2包含1种、2种或更多种细胞因子分子(例如,相同或不同的细胞因子分子);并且
(iii)任选地,l1和/或l2是本文描述的接头。
在一些实施例中,r1是抗fapfab,并且r2是il-15多肽。在一些实施例中,r1和r2经由例如包含第一和第二fc的杵臼结构fc二聚体(例如,如在图xa中显示)二聚化。在一些实施例中,第一fc包含选自以下的氨基酸取代:t366s;l368a;或y407v。在一些实施例中,第二fc包含选自以下的氨基酸取代:t366w。
在另一方面,本发明的特征在于包含r1、r2、和r3的多特异性分子,其中:
(i)r1是本文描述的肿瘤靶向部分,例如,r1包含1种、2种或更多种肿瘤靶向部分(例如,相同或不同的肿瘤靶向部分);
(ii)r2是本文描述的免疫细胞衔接子,例如,r2包含1种、2种或更多种免疫细胞衔接子(例如,相同或不同的免疫细胞衔接子);
(iii)r3是本文描述的细胞因子分子,例如,r3包含1种、2种或更多种细胞因子分子(例如,相同或不同的细胞因子分子);并且
(iv)任选地,l1和/或l2是本文描述的接头。
在一些实施例中,r1是抗间皮素fab,r2是il-15多肽,并且r3是cd40l多肽。在一些实施例中,r1和r2经由例如包含第一和第二fc的杵臼结构fc二聚化。在一些实施例中,第一fc包含在位置366、368和/或407的例如选自以下的氨基酸取代:t366s;l368a;或y407v。在一些实施例中,第二fc包含在位置366的氨基酸取代,例如t366w。
在另一方面,本发明的特征在于包含r1、r2、r3、和r4的多特异性分子,其中:
(i)r1是本文描述的肿瘤靶向部分;
(ii)r2和r4各自是本文描述的第一和第二免疫细胞衔接子;
(iii)r3是本文描述的细胞因子分子;并且
(iv)任选地,l1和/或l2是本文描述的接头。
在一些实施例中,r1是抗fapfab,r3是il-15多肽,r2是cd40l多肽,并且r4是b7h6多肽。在一些实施例中,r1、r2、r3、和r4经由fc二聚体二聚化。在一些实施例中,fc包含选自以下的氨基酸取代:t366s;l368a;或y407v。在一些实施例中,fc包含选自以下的氨基酸取代:t366w。
肿瘤靶向部分
本披露尤其提供了多特异性(例如,二特异性、三特异性、四特异性)分子,所述分子包含(例如,被工程化为含有)将分子指向肿瘤细胞的一种或多种肿瘤特异性靶向部分。
在某些实施例中,本文披露的多特异性分子包含肿瘤靶向部分。肿瘤靶向部分可以选自抗体分子(例如,如本文描述的抗原结合结构域)、受体或受体片段、或配体或配体片段、或其组合。在一些实施例中,肿瘤靶向部分与肿瘤细胞(例如,存在于肿瘤细胞表面上的分子,例如抗原)缔合(例如,与其结合)。在某些实施例中,肿瘤靶向部分将本文披露的多特异性分子靶向(例如,指向)癌症(例如,癌症或肿瘤细胞)。在一些实施例中,癌症选自血液癌、实体癌、转移性癌症、或其组合。
在一些实施例中,多特异性分子(例如,肿瘤靶向部分)与实体瘤抗原或基质抗原结合。实体瘤抗原或基质抗原可以存在于实体瘤、或其转移病灶上。在一些实施例中,实体瘤选自以下中的一种或多种:胰腺癌(例如,胰腺腺癌)、乳腺癌、结肠直肠癌、肺癌(例如,小细胞或非小细胞肺癌)、皮肤癌、卵巢癌、或肝癌。在一个实施例中,实体瘤是纤维化的或促结缔织增生的实体瘤。例如,实体瘤抗原或基质抗原可以存在于肿瘤上,例如由具有以下中的一种或多种代表的一类肿瘤:有限的肿瘤灌注、压缩的血管或纤维化的肿瘤间质。
在某些实施例中,实体瘤抗原选自以下中的一种或多种:pdl1、cd47、间皮素、神经节苷脂2(gd2)、前列腺干细胞抗原(psca)、前列腺特异性膜抗原(pmsa)、前列腺特异性抗原(psa)、癌胚抗原(cea)、ron激酶、c-met、未成熟层粘连蛋白受体、tag-72、bing-4、钙激活的氯通道2、细胞周期蛋白-b1、9d7、ep-cam、epha3、her2/neu、端粒酶、sap-1、存活素、ny-eso-1/lage-1、prame、ssx-2、melan-a/mart-1、gp100/pmel17、酪氨酸酶、trp-1/-2、mc1r、β-连环蛋白、brca1/2、cdk4、cml66、纤连蛋白、p53、ras、tgf-β受体、afp、eta、mage、muc-1、ca-125、bage、gage、ny-eso-1、β-连环蛋白、cdk4、cdc27、cd47、α辅肌动蛋白-4、trp1/gp75、trp2、gp100、melan-a/mart1、神经节甘脂、wt1、epha3、表皮生长因子受体(egfr)、cd20、mart-2、mart-1、muc1、muc2、mum1、mum2、mum3、na88-1、npm、oa1、ogt、rcc、rui1、rui2、sage、trg、trp1、tsta、叶酸受体α、l1-cam、caix、egfrviii、gpa33、gd3、gm2、vegfr、整合素(整合素αvβ3、整合素α5β1)、碳水化合物(le)、igf1r、epha3、trailr1、trailr2、或rankl。
在一些实施例中,实体瘤抗原选自:pdl1、间皮素、cd47、gd2、pmsa、psca、cea、ron激酶、或c-met。
在一个实施例中,肿瘤靶向部分包括与间皮素结合的抗体分子(例如,fab或scfv)。在一些实施例中,间皮素的抗体分子包含来自以下的重链可变结构域序列的一个、两个、三个cdr:
qvqlqqsgpelekpgasvkisckasgysftgytmnwvkqshgkslewiglitpyngassynqkfrgkatltvdkssstaymdllsltsedsavyfcarggydgrgfdywgqgttvtvss(seqidno:1),或密切相关的cdr,例如与seqidno:1的cdr序列具有至少一个氨基酸改变,但不超过两个、三个或四个改变(例如,取代、缺失、或插入,例如保守取代)的cdr。
在一些实施例中,间皮素的抗体分子包含选自以下的一个、两个、三个cdr:gysftgytmn(seqidno:2);litpyngassynqkfrg(seqidno:3);和ggydgrgfdy(seqidno:4),或密切相关的cdr,例如具有至少一个氨基酸改变,但不超过两个、三个或四个改变(例如,取代、缺失、或插入,例如保守取代)的cdr。
在一些实施例中,间皮素的抗体分子由三个cdr(其中cdr1包含gysftgytmn(seqidno:2);cdr2包含:litpyngassynqkfrg(seqidno:3);并且cdr3包含ggydgrgfdy(seqidno:4))、或密切相关的cdr(例如,具有至少一个氨基酸改变,但不超过两个、三个或四个改变(例如,取代、缺失、或插入,例如保守取代)的cdr)组成。
在一些实施例中,间皮素的抗体分子由三个cdr(其中cdr1由gysftgytmn(seqidno:2)组成;cdr2由litpyngassynqkfrg(seqidno:3)组成;并且cdr3由ggydgrgfdy(seqidno:4)组成)、或密切相关的cdr(例如,具有至少一个氨基酸改变,但不超过两个、三个或四个改变(例如,取代、缺失、或插入,例如保守取代)的cdr)组成。
在实施例中,间皮素的抗体分子包含以下的重链可变结构域序列:
qvqlqqsgpelekpgasvkisckasgysftgytmnwvkqshgkslewiglitpyngassynqkfrgkatltvdkssstaymdllsltsedsavyfcarggydgrgfdywgqgttvtvss(seqidno:1)、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:1的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在实施例中,间皮素的抗体分子是fab并且进一步包含具有以下氨基酸序列的重链恒定区(ch1):
astkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrvepkscdktht(seqidno:5)、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:5的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。在一些实施例中,抗体分子进一步包含信号肽,例如包含以下氨基酸序列的信号肽:mefglswvflvalfrgvqc(seqidno:6)。
可替代地,或与本文披露的间皮素的重链组合,间皮素的抗体分子包含来自以下的轻链可变结构域序列的一个、两个、三个cdr:
dieltqspaimsaspgekvtmtcsasssvsymhwyqqksgtspkrwiydtsklasgvpgrfsgsgsgnsysltissveaeddatyycqqwsgypltfgagtkleik(seqidno:7),或密切相关的cdr,例如与seqidno:7的cdr序列具有至少一个氨基酸改变,但不超过两个、三个或四个改变(例如,取代、缺失、或插入,例如保守取代)的cdr。
在一些实施例中,间皮素的抗体分子包含来自以下的一个、两个、三个cdr:sasssvsymh(seqidno:8);dtsklas(seqidno:9);和qqwsgyplt(seqidno:10),或密切相关的cdr,例如具有至少一个氨基酸改变,但不超过两个、三个或四个改变(例如,取代、缺失、或插入,例如保守取代)的cdr。
在一些实施例中,间皮素的抗体分子由三个cdr(其中cdr1包含sasssvsymh(seqidno:8);cdr2包含:dtsklas(seqidno:9);并且cdr3包含qqwsgyplt(seqidno:10))、或密切相关的cdr(例如,具有至少一个氨基酸改变,但不超过两个、三个或四个改变(例如,取代、缺失、或插入,例如保守取代)的cdr)组成。
在一些实施例中,间皮素的抗体分子由三个cdr(其中cdr1由sasssvsymh(seqidno:8)组成;cdr2由dtsklas(seqidno:9)组成;并且cdr3由qqwsgyplt(seqidno:10)组成)、或密切相关的cdr(例如,具有至少一个氨基酸改变,但不超过两个、三个或四个改变(例如,取代、缺失、或插入,例如保守取代)的cdr)组成。
在一些实施例中,间皮素的抗体分子包含以下的轻链可变结构域序列:dieltqspaimsaspgekvtmtcsasssvsymhwyqqksgtspkrwiydtsklasgvpgrfsgsgsgnsysltissveaeddatyycqqwsgypltfgagtkleik(seqidno:7)、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:7的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在一些实施例中,间皮素的抗体分子是fab并且进一步包含具有以下氨基酸序列的轻链恒定区(cl1):
rtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec(seqidno:11)、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:11的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。在实施例中,抗体分子进一步包含信号肽,例如包含以下氨基酸序列的信号肽:mkyllptaaagllllaaqpama(seqidno:12)。
在其他实施例中,多特异性分子(例如,肿瘤靶向部分)与基质抗原结合。在实施例中,基质抗原选自以下中的一种或多种:成纤维细胞激活蛋白酶(fap)、tgf-β、透明质酸、胶原(例如,胶原iv)、生腱蛋白c、或生腱蛋白w。
在一个实施例中,肿瘤靶向部分包括与fap(例如,人fap)结合的抗体分子(例如,fab或scfv)。在一些实施例中,fap的抗体分子包含来自图12c中以下划线描绘的重链可变结构域序列(seqidno:13)的一个、两个、三个cdr,或密切相关的cdr,例如与seqidno:13的cdr序列具有至少一个氨基酸改变,但不超过两个、三个或四个改变(例如,取代、缺失、或插入,例如保守取代)的cdr。在一些实施例中,fap的抗体分子包含在图12c中以下划线描绘的重链可变结构域序列(seqidno:13)、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:13的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在实施例中,fap的抗体分子是fab并且进一步包含具有以下氨基酸序列的重链恒定区(ch1):
astkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrvepksc(seqidno:14)、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:14的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。在实施例中,抗体分子进一步包含信号肽,例如包含以下氨基酸序列的信号肽:mefglswvflvalfrgvqcev(seqidno:15)。
可替代地,或与本文披露的fap的重链组合,fap的抗体分子包含来自图12d中以下划线描绘的轻链可变结构域序列(seqidno:16)的一个、两个、三个cdr,或密切相关的cdr,例如与seqidno:16的cdr序列具有至少一个氨基酸改变,但不超过两个、三个或四个改变(例如,取代、缺失、或插入,例如保守取代)的cdr。在一些实施例中,fap的抗体分子包含在图12d中以下划线描绘的轻链可变结构域序列(seqidno:16)、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:16的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在实施例中,fap的抗体分子是fab并且进一步包含具有以下氨基酸序列的轻链恒定区(cl1):
rtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec(seqidno:11)、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:11的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。在一些实施例中,抗体分子进一步包含信号肽,例如包含以下氨基酸序列的信号肽:mkyllptaaagllllaaqpama(seqidno:12)。
在其他实施例中,多特异性分子(例如,肿瘤靶向部分)与存在于血液癌(例如,白血病或淋巴瘤)的表面上的分子(例如,抗原)结合。在一些实施例中,血液癌是b细胞或t细胞恶性肿瘤。在一些实施例中,血液癌选自以下中的一种或多种:霍奇金淋巴瘤、非霍奇金淋巴瘤(例如,b细胞淋巴瘤、弥漫性大b细胞淋巴瘤、滤泡性淋巴瘤、慢性淋巴细胞白血病、套细胞淋巴瘤、边缘区b细胞淋巴瘤、伯基特淋巴瘤、淋巴浆细胞性淋巴瘤、毛细胞白血病)、急性髓性白血病(aml)、慢性髓性白血病、骨髓增生异常综合征(mds)、多发性骨髓瘤、或急性淋巴细胞白血病。在实施例中,癌症不是急性髓性白血病(aml)或骨髓增生异常综合征(mds)。在实施例中,血液抗原选自cd19、cd33、cd123、或cd20。在实施例中,血液抗原不是cd33。在实施例中,血液抗原选自cd19、cd20、cd33、cd47、cd123、cd20、cd99、cd30、bcma、cd38、cd22、slamf7、或ny-eso1。
细胞因子分子
细胞因子通常是例如通过信号转导途径影响细胞活性的多肽。因此,多特异性或多功能多肽的细胞因子是有用的,并且可以与受体介导的信号传导相关,所述信号传导传递来自细胞膜外部的信号以调节细胞内的应答。细胞因子是作为免疫应答的介质的蛋白质信号传导化合物。它们控制许多不同的细胞功能,包括增殖、分化和细胞存活/凋亡;细胞因子也参与包括病毒感染和自身免疫疾病的若干病理生理过程。细胞因子在各种刺激下由先天性(单核细胞、巨噬细胞、树突细胞)和适应性(t细胞和b细胞)免疫系统的多种细胞合成。细胞因子可以分为两组:促炎的和抗炎的。包括ifnγ、il-1、il-6和tnf-α的促炎细胞因子主要地衍生自天然免疫细胞和th1细胞。包括il-10、il-4、il-13和il-5的抗炎细胞因子从th2免疫细胞合成。
本披露尤其提供了多特异性(例如,二特异性、三特异性、四特异性)蛋白质,所述蛋白质包含(例如,被工程化为含有)一种或多种细胞因子分子,例如免疫调节(例如,促炎)细胞因子及其变体(例如,功能变体)。因此,在一些实施例中,细胞因子分子是白介素或其变体(例如,功能变体)。在一些实施例中,白介素是促炎细胞因子白介素。在一些实施例中,白介素选自白介素-2(il-2)、白介素-12(il-12)、白介素-15(il-15)、白介素-18(il-18)、白介素-21(il-21)、白介素-7(il-7)、或干扰素γ。在一些实施例中,细胞因子分子是促炎细胞因子。
在某些实施例中,细胞因子是单链细胞因子。在某些实施例中,细胞因子是多链细胞因子(例如,细胞因子包含2条或更多条(例如,2条)多肽链)。示例性多链细胞因子是il-12。
有用的细胞因子的实例包括但不限于gm-csf、il-1α、il-1β、il-2、il-3、il-4、il-5、il-6、il-7、il-8、il-10、il-12、il-21、ifn-α、ifn-β、ifn-γ、mip-1α、mip-1β、tgf-β、tnf-α、和tnfβ。在一个实施例中,多特异性或多功能多肽的细胞因子是选自以下的组的细胞因子:gm-csf、il-2、il-7、il-8、il-10、il-12、il-15、il-21、ifn-α、ifn-γ、mip-1α、mip-1β和tgf-β。在一个实施例中,多特异性或多功能多肽的细胞因子是选自以下的组的细胞因子:il-2、il-7、il-10、il-12、il-15、ifn-α、和ifn-γ。在某些实施例中,将细胞因子突变以去除n-和/或o-糖基化位点。糖基化的消除增加了在重组生产中可获得的产物的均一性。
在一个实施例中,多特异性或多功能多肽的细胞因子是il-2。在一个具体的实施例中,il-2细胞因子可以引起选自下组的一种或多种细胞反应,该组由以下组成:激活的t淋巴细胞的增殖、激活的t淋巴细胞的分化、细胞毒性t细胞(ctl)活性、激活的b细胞的增殖、激活的b细胞的分化、自然杀伤(nk)细胞的增殖、nk细胞的分化、由激活的t细胞或nk细胞分泌细胞因子、和nk/淋巴细胞激活的杀伤剂(lak)抗肿瘤细胞毒性。在另一个具体的实施例中,il-2细胞因子是突变型il-2细胞因子,其对il-2受体的α-亚基具有降低的结合亲和力。与β-和γ-亚基(也分别称为cd122和cd132)一起,α-亚基(也称为cd25)形成异源三聚体高亲和力il-2受体,而仅由β-和γ-亚基组成的二聚体受体被称为中间亲和力il-2受体。如在pct专利申请号pct/ep2012/051991(将其通过引用以其整体并入本文)中描述的,与野生型il-2多肽相比,对il-2受体的α-亚基具有减少的结合的突变型il-2多肽具有降低的诱导调节性t细胞中的il-2信号传导能力,诱导t细胞中的较少的激活诱导的细胞死亡(aicd),并且在体内具有降低的毒性特征。在根据本发明的多特异性或多功能多肽中使用这种具有降低的毒性的细胞因子特别有利,由于存在fc结构域而具有长的血清半衰期。在一个实施例中,根据本发明的多特异性或多功能多肽的突变型il-2细胞因子包含至少一个氨基酸突变,与未突变的il-2细胞因子相比,所述氨基酸突变降低或消除突变型il-2细胞因子对il-2受体的α-亚基(cd25)的亲和力,但是保留突变型il-2细胞因子对中间亲和力il-2受体(由il-2受体的β和γ亚基组成)的亲和力。在一个实施例中,一个或多个氨基酸突变是氨基酸取代。在一个具体的实施例中,突变型il-2细胞因子在选自对应于人il-2的残基42、45、和72的位置的一个、两个或三个位置处包含一个、两个或三个氨基酸取代。在一个更具体的实施例中,突变型il-2细胞因子在对应于人il-2的残基42、45和72的位置处包含三个氨基酸取代。在一个甚至更具体的实施例中,突变型il-2细胞因子是包含氨基酸取代f42a、y45a和l72g的人il-2。在一个实施例中,突变型il-2细胞因子另外在对应于人il-2的位置3的位置处包含氨基酸突变,其消除了il-2的o-糖基化位点。具体地,所述另外的氨基酸突变是用丙氨酸残基替换苏氨酸残基的氨基酸取代。在本发明中有用的特定的突变型il-2细胞因子在对应于人il-2的残基3、42、45和72的位置处包含四个氨基酸取代。具体的氨基酸取代是t3a、f42a、y45a和l72g。如pct专利申请号pct/ep2012/051991和所附实例中所证明的,所述四重突变型il-2多肽(il-2qm)没有表现出对cd25的可检测结合,表现出降低的诱导t细胞凋亡的能力、降低的诱导t-reg细胞中的il-2信号传导的能力、和降低的体内毒性特征。然而,它保留了在效应细胞中激活il-2信号传导、诱导效应细胞的增殖、和通过nk细胞产生ifn-γ作为次级细胞因子的能力。
根据任何以上实施例的il-2或突变型il-2细胞因子可以包含另外的突变,其提供另外的优势,如增加的表达或稳定性。例如,位置125处的半胱氨酸可以用中性氨基酸(如丙氨酸)替换,以避免二硫键桥接的il-2二聚体的形成。因此,在某些实施例中,根据本发明的多特异性或多功能多肽的il-2或突变型il-2细胞因子在对应于人il-2的残基125的位置处包含另外的氨基酸突变。在一个实施例中,所述另外的氨基酸突变是氨基酸取代c125a。
在一个具体的实施例中,多特异性或多功能多肽的il-2细胞因子包含seqidno:227[aptssstkktqlqlehllldlqmilnginnyknpkltrmltfkfympkkatelkhlqcleeelkpleevlnlaqsknfhlrprdlisninvivlelkgsettfmceyadetativeflnrwitfaqsiistlt]的多肽序列。在另一个具体的实施例中,多特异性或多功能多肽的il-2细胞因子包含seqidno:228[apassstkktqlqlehllldlqmilnginnyknpkltrmltakfampkkatelkhlqcleeelkpleevlngaqsknfhlrprdlisninvivlelkgsettfmceyadetativeflnrwitfaqsiistlt]的多肽序列。
在另一个实施例中,多特异性或多功能多肽的细胞因子是il-12。在一个具体的实施例中,所述il-12细胞因子是单链il-12细胞因子。在一个甚至更具体的实施例中,单链il-12细胞因子包含seqidno:229[iwelkkdvyvveldwypdapgemvvltcdtpeedgitwtldqssevlgsgktltiqvkefgdagqytchkggevlshsllllhkkedgiwstdilkdqkepknktflrceaknysgrftcwwlttistdltfsvkssrgssdpqgvtcgaatlsaervrgdnkeyeysvecqedsacpaaeeslpievmvdavhklkyenytssffirdiikpdppknlqlkplknsrqvevsweypdtwstphsyfsltfcvqvqgkskrekkdrvftdktsatvicrknasisvraqdryyssswsewasvpcsggggsggggsggggsrnlpvatpdpgmfpclhhsqnllravsnmlqkarqtlefypctseeidheditkdktstveaclpleltknesclnsretsfitngsclasrktsfmmalclssiyedlkmyqvefktmnakllmdpkrqifldqnmlavidelmqalnfnsetvpqkssleepdfyktkiklcillhafriravtidrvmsylnas]的多肽序列。在一个实施例中,il-12细胞因子可以引起选自下组的一种或多种细胞反应,该组由以下组成:nk细胞的增殖、nk细胞的分化、t细胞的增殖、以及t细胞的分化。
在另一个实施例中,多特异性或多功能多肽的细胞因子是il-10。在一个具体的实施例中,所述il-10细胞因子是单链il-10细胞因子。在一个甚至更具体的实施例中,单链il-10细胞因子包含seqidno:230[spgqgtqsenscthfpgnlpnmlrdlrdafsrvktffqmkdqldnlllkeslledfkgylgcqalsemiqfyleevmpqaenqdpdikahvnslgenlktlrlrlrrchrflpcenkskaveqvknafnklqekgiykamsefdifinyieaymtmkirnggggsggggsggggsggggsspgqgtqsenscthfpgnlpnmlrdlrdafsrvktffqmkdqldnlllkeslledfkgylgcqalsemiqfyleevmpqaenqdpdikahvnslgenlktlrlrlrrchrflpcenkskaveqvknafnklqekgiykamsefdifinyieaymtmkirn]的多肽序列。在另一个具体的实施例中,il-10细胞因子是单体il-10细胞因子。在一个更具体的实施例中,单体il-10细胞因子包含seqidno:231[spgqgtqsenscthfpgnlpnmlrdlrdafsrvktffqmkdqldnlllkeslledfkgylgcqalsemiqfyleevmpqaenqdpdikahvnslgenlktlrlrlrrchrflpcengggsggkskaveqvknafnklqekgiykamsefdifinyieaymtmkirn]的多肽序列。在一个实施例中,il-10细胞因子可以引起选自下组的一种或多种细胞反应,该组由以下组成:细胞因子分泌的抑制、抑制通过抗原呈递细胞进行的抗原呈递、减少氧自由基释放、和抑制t细胞增殖。根据本发明的多特异性或多功能多肽,其中细胞因子是特别地有用于下调炎症(例如在治疗炎性病症中)的il-10。
在另一个实施例中,多特异性或多功能多肽的细胞因子是il-15。在一个具体的实施例中,所述il-15细胞因子是突变型il-15细胞因子,其对il-15受体的α-亚基具有降低的结合亲和力。不希望受理论束缚,与野生型il-15多肽相比,对il-15受体的α-亚基具有减少的结合的突变型il-15多肽具有降低的结合整个身体的成纤维细胞的能力,导致改善的药代动力学和毒性特征。在根据本发明的多特异性或多功能多肽中使用具有降低的毒性的细胞因子(如描述的突变型il-2和突变型il-15效应子部分)特别有利,由于存在fc结构域而具有长的血清半衰期。在一个实施例中,根据本发明的多特异性或多功能多肽的突变型il-15细胞因子包含至少一个氨基酸突变,与未突变的il-15细胞因子相比,所述氨基酸突变降低或消除突变型il-15细胞因子对il-15受体的α-亚基的亲和力,但是保留突变型il-15细胞因子对中间亲和力il-15/il-2受体(由il-15/il-2受体的β-和γ-亚基组成)的亲和力。在一个实施例中,氨基酸突变是氨基酸取代。在一个具体的实施例中,突变型il-15细胞因子在对应于人il-15的残基53的位置处包含氨基酸取代。在一个更具体的实施例中,突变型il-15细胞因子是包含氨基酸取代e53a的人il-15。在一个实施例中,突变型il-15细胞因子另外在对应于人il-15的位置79的位置处包含氨基酸突变,其消除了il-15的n-糖基化位点。具体地,所述另外的氨基酸突变是用丙氨酸残基替换天冬酰胺残基的氨基酸取代。在一个甚至更具体的实施例中,il-15细胞因子包含seqidno:232[nwvnvisdlkkiedliqsmhidatlytesdvhpsckvtamkcfllelqvislasgdasihdtvenliilannslssngavtesgckeceeleeknikeflqsfvhivqmfints]的多肽序列。在一个实施例中,il-15细胞因子可以引起选自下组的一种或多种细胞反应,该组由以下组成:激活的t淋巴细胞的增殖、激活的t淋巴细胞的分化、细胞毒性t细胞(ctl)活性、激活的b细胞的增殖、激活的b细胞的分化、自然杀伤(nk)细胞的增殖、nk细胞的分化、由激活的t细胞或nk细胞分泌细胞因子、和nk/淋巴细胞激活杀伤剂(lak)抗肿瘤细胞毒性。
在多特异性或多功能多肽中作为效应子部分有用的突变型细胞因子分子可以使用本领域熟知的遗传或化学方法通过缺失、取代、插入或修饰来产生。遗传方法可以包括编码dna序列的位点特异性诱变、pcr、基因合成等。可以例如通过测序验证正确的核苷酸变化。取代或插入可以涉及天然以及非天然氨基酸残基。氨基酸修饰包括熟知的化学修饰方法,如添加或去除糖基化位点或碳水化合物附接等。
在一个实施例中,多特异性或多功能多肽的细胞因子(特别是单链细胞因子)是gm-csf。在一个具体的实施例中,gm-csf细胞因子可以引起粒细胞、单核细胞或树突细胞的增殖和/或分化。在一个实施例中,多特异性或多功能多肽的细胞因子(特别是单链细胞因子)是ifn-α。在一个具体的实施例中,ifn-α细胞因子可以引起选自下组的一种或多种细胞反应,该组由以下组成:抑制病毒感染的细胞中的病毒复制、和上调主要组织相容性复合物i(mhci)的表达。在另一个具体的实施例中,ifn-α细胞因子可以抑制肿瘤细胞的增殖。在一个实施例中,多特异性或多功能多肽的细胞因子(特别是单链细胞因子)是ifnγ。在一个具体的实施例中,ifn-γ细胞因子可以引起选自以下的组的一种或多种细胞反应:增加的巨噬细胞活性、增加的mhc分子表达、以及增加的nk细胞活性。在一个实施例中,多特异性或多功能多肽的细胞因子(特别是单链细胞因子)是il-7。在一个具体的实施例中,il-7细胞因子可以引起t和/或b淋巴细胞的增殖。在一个实施例中,多特异性或多功能多肽的细胞因子(特别是单链细胞因子)是il-8。在一个具体的实施例中,il-8细胞因子可以引起嗜中性粒细胞的趋化性。在一个实施例中,多特异性或多功能多肽的细胞因子(特别是单链细胞因子)是mip-1α。在一个具体的实施例中,mip-1α细胞因子可以引起单核细胞和t淋巴细胞的趋化性。在一个实施例中,多特异性或多功能多肽的细胞因子(特别是单链细胞因子)是mip-1β。在一个具体的实施例中,mip-1β细胞因子可以引起单核细胞和t淋巴细胞的趋化性。在一个实施例中,多特异性或多功能多肽的细胞因子(特别是单链细胞因子)是tgf-β。在一个具体的实施例中,tgf-β细胞因子可以引起选自下组的一种或多种细胞反应,该组由以下组成:单核细胞的趋化性、巨噬细胞的趋化性、激活的巨噬细胞中il-1表达的上调、和激活的b细胞中iga表达的上调。
在一个实施例中,本发明的多特异性或多功能多肽与细胞因子受体结合,解离常数(kd)比对照细胞因子大至少约1倍、1.5倍、2倍、2.5倍、3倍、3.5倍、4倍、4.5倍、5倍、5.5倍、6倍、6.5倍、7倍、7.5倍、8倍、8.5倍、9倍、9.5倍或10倍。在另一个实施例中,多特异性或多功能多肽与细胞因子受体结合,kd比对应的包含两种或更多种效应子部分的多特异性或多功能多肽大至少2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、或10倍。在另一个实施例中,多特异性或多功能多肽与细胞因子受体结合,解离常数kd比对应的包含两种或更多种细胞因子的多特异性或多功能多肽大约10倍。
在一些实施例中,本文披露的多特异性分子包含细胞因子分子。在实施例中,细胞因子分子包括全长细胞因子、细胞因子的片段或细胞因子的变体;细胞因子受体结构域,例如细胞因子受体二聚化结构域;或细胞因子受体的激动剂,例如细胞因子受体的抗体分子(例如,激动性抗体)。
在一些实施例中,细胞因子分子选自il-2、il-12、il-15、il-18、il-7、il-21、或干扰素γ、或其片段或变体、或任何前述细胞因子的组合。细胞因子分子可以是单体或二聚体。在实施例中,细胞因子分子可以进一步包含细胞因子受体二聚化结构域。
在其他实施例中,细胞因子分子是细胞因子受体的激动剂,例如选自il-15ra或il-21r的细胞因子受体的抗体分子(例如,激动性抗体)。
在一个实施例中,细胞因子分子是il-15,例如人il-15(例如,包含以下氨基酸序列:
nwvnvisdlkkiedliqsmhidatlytesdvhpsckvtamkcfllelqvislesgdasihdtvenliilannslssngnvtesgckeceeleeknikeflqsfvhivqmfints(seqidno:17)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:17的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在一些实施例中,细胞因子分子包含受体二聚化结构域,例如il15rα二聚化结构域。在一个实施例中,il15rα二聚化结构域包含以下氨基酸序列:
maprrargcrtlglpalllllllrppatrgitcpppmsvehadiwvksyslysreryicnsgfkrkagtssltecvl(seqidno:18)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:18的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。在一些实施例中,多特异性分子的细胞因子分子(例如,il-15)和受体二聚化结构域(例如,il15rα二聚化结构域)例如经由接头(例如,gly-ser接头,例如包含氨基酸序列sggsggggsgggsggggslq(seqidno:19)的接头)共价连接。在其他实施例中,多特异性分子的细胞因子分子(例如,il-15)和受体二聚化结构域(例如,il15rα二聚化结构域)不是共价连接的,例如是非共价缔合的。
在其他实施例中,细胞因子分子是il-2,例如人il-2(例如,包含以下氨基酸序列:
aptssstkktqlqlehllldlqmilnginnyknpkltrmltfkfympkkatelkhlqcleeelkpleevlnlaqsknfhlrprdlisninvivlelkgsettfmceyadetativeflnrwitfcqsiistlt(seqidno:20)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:20的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在其他实施例中,细胞因子分子是il-18,例如人il-18(例如,包含以下氨基酸序列:
yfgklesklsvirnlndqvlfidqgnrplfedmtdsdcrdnaprtifiismykdsqprgmavtisvkcekistlscenkiisfkemnppdnikdtksdiiffqrsvpghdnkmqfesssyegyflacekerdlfklilkkedelgdrsimftvqned(seqidno:21)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:21的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在其他实施例中,细胞因子分子是il-21,例如人il-21(例如,包含以下氨基酸序列:
qgqdrhmirmrqlidivdqlknyvndlvpeflpapedvetncewsafscfqkaqlksantgnneriinvsikklkrkppstnagrrqkhrltcpscdsyekkppkeflerfksllqkmihqhlssrthgseds(seqidno:22)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:22的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在还其他实施例中,细胞因子分子是干扰素γ,例如人干扰素γ(例如,包含以下氨基酸序列:
qdpyvkeaenlkkyfnaghsdvadngtlflgilknwkeesdrkimqsqivsfyfklfknfkddqsiqksvetikedmnvkffnsnkkkrddfekltnysvtdlnvqrkaiheliqvmaelspaaktgkrkrsqmlfrg(seqidno:23)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:23的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。免疫细胞衔接子
本文披露的多特异性分子的免疫细胞衔接子可以介导与免疫细胞(例如,免疫效应细胞)的结合、和/或其激活。在一些实施例中,免疫细胞选自nk细胞、b细胞、树突细胞、或巨噬细胞衔接子、或其组合。在一些实施例中,免疫细胞衔接子选自t细胞衔接子、nk细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子中的一种、两种、三种、或全部、或其组合。免疫细胞衔接子可以是免疫系统的激动剂。在一些实施例中,免疫细胞衔接子可以是抗体分子、配体分子(例如,进一步包含免疫球蛋白恒定区(例如,fc区)的配体)、小分子、核苷酸分子。
自然杀伤细胞衔接子
自然杀伤(nk)细胞以抗体非依赖性方式识别和破坏肿瘤和病毒感染的细胞。nk细胞的调节是通过激活和抑制nk细胞表面上的受体来介导的。激活受体的一个家族是包括nkp30、nkp44和nkp46的天然细胞毒性受体(ncr)。ncr通过识别癌细胞上的硫酸乙酰肝素来启动肿瘤靶向。nkg2d是在激活的杀伤(nk)细胞上提供刺激性和共刺激性先天免疫应答从而导致细胞毒活性的受体。dnam1是参与由细胞毒性t淋巴细胞(ctl)和nk细胞介导的细胞间粘附、淋巴细胞信号传导、细胞毒性和淋巴因子分泌的受体。dap10(也称为hcst)是与klrk1缔合以在淋巴和骨髓细胞中形成激活受体klrk1-hcst的跨膜衔接蛋白;此受体在触发针对表达细胞表面配体(如mhci类链相关的mica和micb、和u(任选地l1)6结合蛋白(ulbp))的靶细胞的细胞毒性中起主要作用;klrk1-hcst受体在针对肿瘤的免疫监视中起作用,并且是肿瘤细胞的细胞溶解所必需的;实际上,不表达klrk1配体的黑色素瘤细胞逃脱了由nk细胞介导的免疫监视。cd16是igg的fc区的受体,其结合复合的或聚集的igg以及单体igg,从而介导抗体依赖性细胞毒性(adcc)和其他抗体依赖性应答,如吞噬作用。
在一些实施例中,nk细胞衔接子是病毒血凝素(ha),ha是在流感病毒表面上发现的糖蛋白。它负责使病毒与膜上具有唾液酸的细胞(如上呼吸道中的细胞或红细胞)结合。ha具有至少18种不同的抗原。这些亚型命名为h1到h18。ncr可以识别病毒蛋白。已经显示nkp46能够与流感的ha和副粘病毒(包括仙台病毒和新城疫病毒)的ha-na相互作用。除nkp46外,nkp44也可以与不同流感亚型的ha功能性地相互作用。
本披露尤其提供了多特异性(例如,二特异性、三特异性、四特异性)蛋白质,所述蛋白质被工程化为含有介导与nk细胞的结合和/或其激活的一种或多种nk细胞衔接子。因此,在一些实施例中,nk细胞衔接子选自结合至(例如,激活)以下的抗原结合结构域或配体:nkp30、nkp40、nkp44、nkp46、nkg2d、dnam1、dap10、cd16(例如,cd16a、cd16b、或两者)、crtam、cd27、psgl1、cd96、cd100(sema4d)、nkp80、cd244(也称为slamf4或2b4)、slamf6、slamf7、kir2ds2、kir2ds4、kir3ds1、kir2ds3、kir2ds5、kir2ds1、cd94、nkg2c、nkg2e、或cd160。
在一个实施例中,nk细胞衔接子是nkp30的配体是b7-6,例如包含以下的氨基酸序列:
dlkvemmaggtqitplndnvtifcnifysqplnitsmgitwfwksltfdkevkvfeffgdhqeafrpgaivspwrlksgdaslrlpgiqleeageyrcevvvtplkaqgtvqlevvaspasrllldqvgmkenedkymcessgfypeainitwekqtqkfphpieisedvitgptiknmdgtfnvtsclklnssqedpgtvyqcvvrhaslhtplrsnftltaarhslsetektdnfs(seqidno:24)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:24的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在其他实施例中,nk细胞衔接子是作为病毒ha的nkp44或nkp46的配体。病毒血凝素(ha)是在病毒表面上的糖蛋白。ha蛋白允许病毒经由唾液酸糖部分与细胞膜结合,这有助于病毒膜与细胞膜的融合(参见例如,eurjimmunol.[欧洲免疫学杂志]2001年9月;31(9):2680-9“recognitionofviralhemagglutininsbynkp44butnotbynkp30[通过nkp44而不是nkp30识别病毒血凝素]”;和nature[自然].2001年2月22日;409(6823):1055-60“recognitionofhaemagglutininsonvirus-infectedcellsbynkp46activateslysisbyhumannkcells[通过nkp46识别病毒感染的细胞上的血凝素激活人nk细胞进行的裂解]”,将其中每个的内容通过引用并入本文)。
在其他实施例中,nk细胞衔接子是选自mica、micb、或ulbp1的nkg2d的配体,例如,其中:
(i)mica包含以下氨基酸序列:
ephslrynltvlswdgsvqsgfltevhldgqpflrcdrqkcrakpqgqwaedvlgnktwdretrdltgngkdlrmtlahikdqkeglhslqeirvceihednstrssqhfyydgelflsqnletkewtmpqssraqtlamnvrnflkedamktkthyhamhadclqelrrylksgvvlrrtvppmvnvtrseasegnitvtcrasgfypwnitlswrqdgvslshdtqqwgdvlpdgngtyqtwvatricqgeeqrftcymehsgnhsthpvpsgkvlvlqshw(seqidno:25)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:25的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列;
(ii)micb包含以下氨基酸序列:
aephslrynlmvlsqdesvqsgflaeghldgqpflrydrqkrrakpqgqwaedvlgaktwdtetedltengqdlrrtlthikdqkgglhslqeirvceihedsstrgsrhfyydgelflsqnletqestvpqssraqtlamnvtnfwkedamktkthyramqadclqklqrylksgvairrtvppmvnvtcsevsegnitvtcrassfyprnitltwrqdgvslshntqqwgdvlpdgngtyqtwvatrirqgeeqrftcymehsgnhgthpvpsgkvlvlqsqrtd(seqidno:26)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:26的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列;或者
(iii)ulbp1包含以下氨基酸序列:
gwvdthclcydfiitpksrpepqwcevqglvderpflhydcvnhkakafaslgkkvnvtktweeqtetlrdvvdflkgqlldiqvenlipiepltlqarmsceheahghgrgswqflfngqkfllfdsnnrkwtalhpgakkmtekweknrdvtmffqkislgdckmwleeflmyweqmldptkppslapg
(seqidno:27)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:27的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在其他实施例中,nk细胞衔接子是选自nectin2或necl5的dnam1的配体,例如,其中:
(i)nectin2包含以下氨基酸序列:
qdvrvqvlpevrgqlggtvelpchllppvpglyislvtwqrpdapanhqnvaafhpkmgpsfpspkpgserlsfvsakqstgqdteaelqdatlalhgltvedegnytcefatfpkgsvrgmtwlrviakpknqaeaqkvtfsqdpttvalciskegrppariswlssldweaketqvsgtlagtvtvtsrftlvpsgradgvtvtckvehesfeepalipvtlsvryppevsisgyddnwylgrtdatlscdvrsnpeptgydwsttsgtfptsavaqgsqlvihavdslfnttfvctvtnavgmgraeqvifvretpntagagatgg(seqidno:28)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:28的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列;或者
(ii)necl5包含以下氨基酸序列:
wpppgtgdvvvqaptqvpgflgdsvtlpcylqvpnmevthvsqltwarhgesgsmavfhqtqgpsyseskrlefvaarlgaelrnaslrmfglrvedegnytclfvtfpqgsrsvdiwlrvlakpqntaevqkvqltgepvpmarcvstggrppaqitwhsdlggmpntsqvpgflsgtvtvtslwilvpssqvdgknvtckvehesfekpqlltvnltvyyppevsisgydnnwylgqneatltcdarsnpeptgynwsttmgplppfavaqgaqllirpvdkpinttlicnvtnalgarqaeltvqvkegppsehsgisrn(seqidno:29)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:29的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在还其他实施例中,nk细胞衔接子是作为nkg2d的衔接物(adapter)的dap10的配体(参见例如,procnatlacadsciusa.[美国国家科学院院刊]2005年5月24日;102(21):7641–7646;和blood[血液],2011年9月15日第118卷,第11期,将其中每个的全部内容通过引用并入本文)。
在其他实施例中,nk细胞衔接子是作为cd16a/b配体的cd16的配体,例如进一步包含抗体fc区的cd16a/b配体(参见例如,frontimmunol.[免疫学前沿]2013;4:76讨论了抗体如何使用fc通过cd16触发nk细胞,将其全部内容并入本文)。
在其他实施例中,nk细胞衔接子是作为necl2的crtam的配体,例如,其中necl2包含以下氨基酸序列:
qnlftkdvtviegevatiscqvnksddsviqllnpnrqtiyfrdfrplkdsrfqllnfssselkvsltnvsisdegryfcqlytdppqesyttitvlvpprnlmidiqkdtavegeeievnctamaskpattirwfkgntelkgkseveewsdmytvtsqlmlkvhkeddgvpvicqvehpavtgnlqtqrylevqykpqvhiqmtyplqgltregdaleltceaigkpqpvmvtwvrvddempqhavlsgpnlfinnlnktdngtyrceasnivgkahsdymlyvydppttippptttttttttttttiltiitdsrageegsiravdh(seqidno:30)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:30的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在其他实施例中,nk细胞衔接子是作为cd70的cd27的配体,例如,其中cd70包含以下氨基酸序列:
qrfaqaqqqlpleslgwdvaelqlnhtgpqqdprlywqggpalgrsflhgpeldkgqlrihrdgiymvhiqvtlaicssttasrhhpttlavgicspasrsisllrlsfhqgctiasqrltplargdtlctnltgtllpsrntdetffgvqwvrp(seqidno:31)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:31的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在其他实施例中,nk细胞衔接子是作为l-选择素(cd62l)的psgl1的配体,例如,其中l-选择素包含以下氨基酸序列:
wtyhysekpmnwqrarrfcrdnytdlvaiqnkaeieylektlpfsrsyywigirkiggiwtwvgtnkslteeaenwgdgepnnkknkedcveiyikrnkdagkwnddachklkaalcytascqpwscsghgecveiinnytcncdvgyygpqcqfviqcepleapelgtmdcthplgnfsfssqcafscsegtnltgieettcgpfgnwsspeptcqviqceplsapdlgimncshplasfsftsactficsegteligkkkticessgiwsnpspicqkldksfsmikegdyn(seqidno:32)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:32的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在其他实施例中,nk细胞衔接子是作为necl5的cd96的配体,例如,其中necl5包含以下氨基酸序列:
wpppgtgdvvvqaptqvpgflgdsvtlpcylqvpnmevthvsqltwarhgesgsmavfhqtqgpsyseskrlefvaarlgaelrnaslrmfglrvedegnytclfvtfpqgsrsvdiwlrvlakpqntaevqkvqltgepvpmarcvstggrppaqitwhsdlggmpntsqvpgflsgtvtvtslwilvpssqvdgknvtckvehesfekpqlltvnltvyyppevsisgydnnwylgqneatltcdarsnpeptgynwsttmgplppfavaqgaqllirpvdkpinttlicnvtnalgarqaeltvqvkegppsehsgisrn(seqidno:29)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:30的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在其他实施例中,nk细胞衔接子是作为cd72的cd100(sema4d)的配体,例如,其中cd72包含以下氨基酸序列:
rylqvsqqlqqtnrvlevtnsslrqqlrlkitqlgqsaedlqgsrrelaqsqealqveqrahqaaegqlqacqadrqktketlqseeqqrraleqklsnmenrlkpfftcgsadtccpsgwimhqkscfyisltsknwqesqkqcetlssklatfseiypqshsyyflnsllpnggsgnsywtglssnkdwkltddtqrtrtyaqsskcnkvhktwswwtlesescrsslpyicemtafrfpd(seqidno:33)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:33的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在其他实施例中,nk细胞衔接子是作为clec2b(aicl)的nkp80的配体,例如,其中clec2b(aicl)包含以下氨基酸序列:
kltrdsqslcpydwigfqnkcyyfskeegdwnsskyncstqhadltiidnieemnflrrykcssdhwiglkmaknrtgqwvdgatftksfgmrgsegcaylsddgaatarcyterkwicrkrih(seqidno:34)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:34的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在其他实施例中,nk细胞衔接子是作为cd48的cd244的配体,例如,其中cd48包含以下氨基酸序列:
qghlvhmtvvsgsnvtlniseslpenykqltwfytfdqkivewdsrkskyfeskfkgrvrldpqsgalyiskvqkednstyimrvlkktgneqewkiklqvldpvpkpvikiekiedmddncylklscvipgesvnytwygdkrpfpkelqnsvlettlmphnysrcytcqvsnsvsskngtvclsppctlars(seqidno:35)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:35的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
t细胞衔接子
本披露尤其提供了多特异性(例如,二特异性、三特异性、四特异性)蛋白质,所述蛋白质被工程化为含有介导与t细胞的结合和/或其激活的一种或多种t细胞衔接子。因此,在一些实施例中,t细胞衔接子选自结合至(例如,并且在一些实施例中激活)以下中的一种或多种的抗原结合结构域或配体:cd3、tcrα、tcrβ、tcrγ、tcrζ、icos、cd28、cd27、hvem、light、cd40、4-1bb、ox40、dr3、gitr、cd30、tim1、slam、cd2、或cd226。在其他实施例中,t细胞衔接子选自结合至且不激活以下中的一种或多种的抗原结合结构域或配体:cd3、tcrα、tcrβ、tcrγ、tcrζ、icos、cd28、cd27、hvem、light、cd40、4-1bb、ox40、dr3、gitr、cd30、tim1、slam、cd2、或cd226。在一些实施例中,t细胞衔接子与cd3结合。
b细胞、巨噬细胞和树突细胞衔接子
广泛地说,b细胞(也称为b淋巴细胞)是一类淋巴细胞亚型的白细胞。它们通过分泌抗体在适应性免疫系统的体液免疫组分中起作用。另外,b细胞呈递抗原(它们也被分类为专职抗原呈递细胞(apc))并分泌细胞因子。巨噬细胞是经由吞噬作用吞噬和消化细胞碎片、外来物质、微生物、癌细胞的一类白细胞。除了吞噬作用外,它们在非特异性防御(先天性免疫)中起重要作用,并且还通过募集其他免疫细胞(如淋巴细胞)来帮助启动特异性防御机制(适应性免疫)。例如,它们作为t细胞的抗原呈递物是重要的。除了增加炎症和刺激免疫系统,巨噬细胞还发挥重要的抗炎作用并且可以通过释放细胞因子减少免疫反应。树突细胞(dc)是在加工抗原材料中起作用并将其在细胞表面上呈递给免疫系统的t细胞的抗原呈递细胞。
本披露尤其提供了多特异性(例如,二特异性、三特异性、四特异性)蛋白质,所述蛋白质包含(例如,被工程化为含有)介导与b细胞、巨噬细胞、和/或树突细胞的结合和/或其激活的一种或多种b细胞、巨噬细胞、和/或树突细胞衔接子。
因此,在一些实施例中,免疫细胞衔接子包括选自以下中的一种或多种的b细胞、巨噬细胞、和/或树突细胞衔接子:cd40配体(cd40l)或cd70配体;与cd40或cd70结合的抗体分子;ox40的抗体分子;ox40配体(ox40l);toll样受体的激动剂(例如,如本文描述的,例如tlr4(例如,组成型活性tlr4(catlr4))、或tlr9激动剂);41bb;cd2;cd47;或sting激动剂、或其组合。
在一些实施例中,所述b细胞衔接子是cd40l、ox40l、或cd70配体、或与ox40、cd40或cd70结合的抗体分子。
在一些实施例中,巨噬细胞衔接子是cd2激动剂。在一些实施例中,巨噬细胞衔接子是结合至以下的抗原结合结构域:cd40l或结合cd40的抗原结合结构域或配体、toll样受体(tlr)(例如,tlr9或tlr4(例如,catlr4(组成型活性tlr4)))激动剂(例如,如本文描述的)、cd47、或sting激动剂。在一些实施例中,sting激动剂是环状二核苷酸,例如环状二-gmp(cdgmp)或环状二-amp(cdamp)。在一些实施例中,sting激动剂是生物素酰化的。
在一些实施例中,树突细胞衔接子是cd2激动剂。在一些实施例中,树突细胞衔接子是结合至以下中的一种或多种的配体、受体激动剂、或抗体分子:ox40l、41bb、tlr激动剂(例如,如本文描述的)(例如,tlr9激动剂、tlr4(例如,catlr4(组成型活性tlr4))、cd47、或和sting激动剂。在一些实施例中,sting激动剂是环状二核苷酸,例如环状二-gmp(cdgmp)或环状二-amp(cdamp)。在一些实施例中,sting激动剂是生物素酰化的。
在其他实施例中,免疫细胞衔接子介导与b细胞、巨噬细胞、和/或树突细胞中的一种或多种的结合、或其激活。示例性b细胞、巨噬细胞、和/或树突细胞衔接子可以选自以下中的一种或多种:cd40配体(cd40l)或cd70配体;与cd40或cd70结合的抗体分子;ox40的抗体分子;ox40配体(ox40l);toll样受体激动剂(例如,tlr4(例如,组成型活性tlr4(catlr4))或tlr9激动剂);41bb激动剂;cd2;cd47;或sting激动剂、或其组合。
在一些实施例中,b细胞衔接子选自cd40l、ox40l、或cd70配体、或与ox40、cd40或cd70结合的抗体分子中的一种或多种。
在其他实施例中,巨噬细胞衔接子选自以下中的一种或多种:cd2激动剂;cd40l;ox40l;与ox40、cd40或cd70结合的抗体分子;toll样受体(例如,tlr4(例如,组成型活性tlr4(catlr4)))激动剂或其片段;cd47激动剂;或sting激动剂。
在其他实施例中,树突细胞衔接子选自以下中的一种或多种:cd2激动剂、ox40抗体、ox40l、41bb激动剂、toll样受体(例如,tlr4,例如组成型活性tlr4(catlr4))激动剂或其片段、cd47激动剂、或sting激动剂。
在一个实施例中,ox40l包含以下氨基酸序列:
qvshrypriqsikvqfteykkekgfiltsqkedeimkvqnnsviincdgfylislkgyfsqevnislhyqkdeeplfqlkkvrsvnslmvasltykdkvylnvttdntslddfhvnggelilihqnpgefcvl(seqidno:36)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:36的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在另一个实施例中,cd40l包含以下氨基酸序列:
mqkgdqnpqiaahviseasskttsvlqwaekgyytmsnnlvtlengkqltvkrqglyyiyaqvtfcsnreassqapfiaslclkspgrferillraanthssakpcgqqsihlggvfelqpgasvfvnvtdpsqvshgtgftsfgllkl(seqidno:37)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:37的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在还其他实施例中,sting激动剂包含环状二核苷酸,例如环状二-gmp(cdgmp)、环状二-amp(cdamp)、或其组合,任选地具有2’,5’或3’,5’磷酸酯键。
在一个实施例中,免疫细胞衔接子包括例如包含以下氨基酸序列的41bb配体:
acpwavsgaraspgsaasprlregpelspddpaglldlrqgmfaqlvaqnvllidgplswysdpglagvsltgglsykedtkelvvakagvyyvffqlelrrvvagegsgsvslalhlqplrsaagaaalaltvdlppassearnsafgfqgrllhlsagqrlgvhlhteararhawqltqgatvlglfrvtpeipaglpsprse(seqidno:38)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:38的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
toll样受体
toll样受体(tlr)是进化上保守的受体,是果蝇toll蛋白的同源物,并且识别高度保守的结构基序,称为病原体相关微生物模式(pathogen-associatedmicrobialpattern,pamp)(其仅由微生物病原体表达)、或危险相关分子模式(danger-associatedmolecularpattern,damp)(其是从坏死或垂死细胞释放的内源性分子)。pamp包括各种细菌细胞壁组分,如脂多糖(lps)、肽聚糖(pgn)和脂肽、以及鞭毛蛋白、细菌dna和病毒双链rna。damp包括细胞内蛋白,如热休克蛋白以及来自细胞外基质的蛋白质片段。通过对应的pamp或damp刺激tlr启动信号传导级联,导致转录因子(如ap-1、nf-κb和干扰素调节因子(irf))的激活。通过tlr进行的信号传导导致多种细胞反应,包括产生干扰素(ifn)、促炎细胞因子和指导适应性免疫应答的效应细胞因子。tlr涉及许多炎症和免疫疾病并在癌症中发挥作用(rakoff-nahoums.和medzhitovr.,2009.toll-likereceptorsandcancer[toll样受体和癌症].natrevscancer[癌症自然评论]9:57-63)。
tlr是i型跨膜蛋白,其特征在于含有富含亮氨酸的重复(lrr)的细胞外结构域以及含有称为toll/il-1受体(tir)结构域的保守区的胞质尾区。已经表征了10种人tlr和12种鼠tlr,人中是tlr1至tlr10,并且鼠中是tlr1至tlr9、tlr11、tlr12和tlr13,tlr10的同源物是假基因。tlr2对于识别来自革兰氏阳性细菌的各种pamp(包括细菌脂蛋白、脂质甘露聚糖和脂磷壁酸)是必不可少的。tlr3涉及病毒衍生的双链rna。tlr4主要由脂多糖激活。tlr5检测细菌鞭毛蛋白,并且tlr9是对未甲基化cpgdna反应所必需的。最后,tlr7和tlr8识别小的合成抗病毒分子,并且据报道单链rna是它们的天然配体。据报道,tlr11识别致肾盂肾炎大肠杆菌和来自刚地弓形虫的profilin样蛋白。tlr的特异性谱系(repertoire)显然通过tlr彼此异源二聚化的能力而扩展。例如,tlr2和tlr6的二聚体是对二酰化脂蛋白的反应所必需的,而tlr2和tlr1相互作用以识别三酰化脂蛋白。tlr的特异性还受各种衔接物和辅助分子(如响应于lps与tlr4形成复合物的md-2和cd14)的影响。
tlr信号传导由至少两种不同的途径组成:导致炎性细胞因子的产生的myd88依赖性途径,以及与ifn-β刺激和树突细胞成熟相关的myd88非依赖性途径。除tlr3外,myd88依赖性途径对所有tlr都是常见的(adachio.等人,1998.targeteddisruptionofthemyd88generesultsinlossofil-1-andil-18-mediatedfunction[myd88基因的靶向破坏导致il-1和il-18介导的功能丧失].immunity[免疫].9(1):143-50)。在通过pamp或damp激活后,tlr异源或同源二聚化,从而经由细胞质tir结构域诱导衔接蛋白的募集。通过使用不同的衔接分子,个体tlr诱导不同的信号传导反应。tlr4和tlr2信号传导需要衔接物tirap/mal,其参与myd88依赖性途径。tlr3通过衔接物trif/ticam-1以myd88非依赖性方式响应于双链rna而触发ifn-β的产生。tram/ticam-2是参与myd88非依赖性途径的另一种衔接分子,其功能仅限于tlr4途径。
tlr3、tlr7、tlr8和tlr9识别病毒核酸并诱导i型ifn。导致i型ifn诱导的信号传导机制取决于激活的tlr而不同。它们涉及干扰素调节因子(irf),已知在抗病毒防御、细胞生长和免疫调节中起关键作用的转录因子家族。三种irf(irf3、irf5和irf7)作为病毒介导的tlr信号传导的直接转导物起作用。tlr3和tlr4激活irf3和irf7,而tlr7和tlr8激活irf5和irf7(doyles.等人,2002.irf3mediatesatlr3/tlr4-specificantiviralgeneprogram[irf3介导tlr3/tlr4特异性抗病毒基因程序].immunity[免疫].17(3):251-63)。此外,已经显示由tlr9配体cpg-a刺激的i型ifn产生由pi(3)k和mtor介导(costa-mattiolim.和sonenbergn.2008.rappingproductionoftypeiinterferoninpdcsthroughmtor[通过mtor在pdc中快速产生i型干扰素].natureimmunol.[自然免疫]9:1097-1099)。
tlr-9
tlr9识别dna分子中的未甲基化cpg序列。与细菌基因组或病毒dna相比,脊椎动物基因组上的cpg位点相对较少(约1%)。tlr9由免疫系统的很多细胞(如b淋巴细胞、单核细胞、自然杀伤(nk)细胞、和浆细胞样树突细胞)表达。tlr9在细胞内(在内体区室内)表达并且通过与富含cpg基序的dna结合来提醒免疫系统病毒和细菌感染。tlr9信号导致启动促炎反应(其导致细胞因子(如i型干扰素和il-12)的产生)的细胞的激活。
tlr激动剂
tlr激动剂可以激动一种或多种tlr,例如人tlr-1、2、3、4、5、6、7、8、9、或10中的一种或多种。在一些实施例中,本文描述的辅助剂是tlr激动剂。在一些实施例中,tlr激动剂特异性激动人tlr-9。在一些实施例中,tlr-9激动剂是cpg部分。如本文所用,cpg部分是具有以下序列的线性二核苷酸:5'—c—磷酸—g—3',即仅由一个磷酸分开的胞嘧啶和鸟嘌呤。
在一些实施例中,cpg部分包含至少1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个、25个、26个、27个、28个、29个、30个、或更多个cpg二核苷酸。在一些实施例中,cpg部分由1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个、25个、26个、27个、28个、29个、或30个cpg二核苷酸组成。在一些实施例中,cpg部分具有1个-5个、1个-10个、1个-20个、1个-30个、1个-40个、1个-50个、5个-10个、5个-20个、5个-30个、10个-20个、10个-30个、10个-40个、或10个-50个cpg二核苷酸。
在一些实施例中,tlr-9激动剂是合成odn(寡脱氧核苷酸)。cpgodn是在特定序列背景(cpg基序)中含有未甲基化cpg二核苷酸的短合成单链dna分子。与在基因组细菌dna中发现的天然磷酸二酯(po)骨架相反,cpgodn具有部分或完全硫代磷酸酯化的(ps)骨架。有三个主要类别的cpgodn:类别a、b和c,其免疫刺激活性不同。cpg-aodn的特征在于含有po中心cpg的回文基序和经ps修饰的3'聚-g串。它们诱导来自pdc的高ifn-α产生,但是为tlr9依赖性nf-κb信号传导和促炎细胞因子(例如il-6)产生的弱刺激物。cpg-bodn含有具有一个或多个cpg二核苷酸的完整ps骨架。它们强烈激活b细胞和tlr9依赖性nf-κb信号传导,但弱刺激ifn-α分泌。cpg-codn组合了类别a和类别b的特征。它们含有完整的ps骨架和含cpg的回文基序。c类cpgodn诱导来自pdc的强ifn-α产生以及b细胞刺激。
基质修饰部分
实体瘤具有模拟正常组织的结构的独特结构,并且包含两个不同但相互依赖的区室:实质(肿瘤细胞)以及肿瘤细胞诱导且分散于其中的基质。所有肿瘤都有基质并需要基质用于营养支持和去除废物。在肿瘤生长为细胞悬浮液(例如,白血病、腹水肿瘤)的情况下,将血浆用作基质(connollyjl等人,tumorstructureandtumorstromageneration[肿瘤结构与肿瘤基质产生].在:kufedw等人编辑holland-freicancermedicine[holland-frei癌症医学].第6版.哈密尔顿:bcdecker出版社;2003)。基质包括多种细胞类型,包括成纤维细胞/肌成纤维细胞、神经胶质细胞、上皮细胞、脂肪细胞、血管细胞、平滑肌细胞、和免疫细胞以及细胞外基质(ecm)和细胞外分子(lihanchen等人tumormicroenvironment:theroleofthetumorstromaincancer[肿瘤微环境:肿瘤基质在癌症中的作用].jofcellularbiochemistry[细胞生物化学杂志]101:805-815(2007))。
本文描述的基质修饰部分包括能够降解基质的组分的部分(例如,蛋白质,例如酶),所述组分是例如ecm组分,例如糖胺聚糖,例如透明质酸(hyaluronan)(也称为透明质酸(hyaluronicacid)或ha)、硫酸软骨素、软骨素、硫酸皮肤素、硫酸肝素、肝素、巢蛋白、生腱蛋白、聚集蛋白聚糖和硫酸角蛋白;或细胞外蛋白,例如胶原、层粘连蛋白、弹性蛋白、纤维蛋白原、纤连蛋白、和玻连蛋白。
基质修饰酶
在一些实施例中,基质修饰部分是酶。例如,基质修饰部分可以包括但不限于透明质酸酶、胶原酶、软骨素酶、基质金属蛋白酶(例如,巨噬细胞金属弹性蛋白酶)。
透明质酸酶
透明质酸酶是在整个动物界发现的一组中性活性酶和酸性活性酶。透明质酸酶在底物特异性和作用机制方面不同。有三个一般类型的透明质酸酶:(1)哺乳动物型透明质酸酶(ec3.2.1.35),其为内切-β-n-乙酰基己糖胺酶,以四糖和六糖为主要终产物。它们具有水解和转糖苷酶活性,并且可以降解透明质酸和硫酸软骨素;(2)细菌透明质酸酶(ec4.2.99.1)降解透明质酸,并且在不同程度上降解硫酸软骨素和硫酸皮肤素。它们是内切-β-n-乙酰基己糖胺酶,通过β消除反应起作用,主要产生二糖终产物;(3)来自水蛭、其他寄生虫和甲壳类动物的透明质酸酶(ec3.2.1.36)是内切-β-葡糖醛酸糖苷酶,通过β1-3键的水解产生四糖和六糖终产物。
哺乳动物透明质酸酶可以进一步分为两组:(1)中性活性酶和(2)酸性活性酶。在人基因组中有六种透明质酸酶样基因,hyal1、hyal2、hyal3、hyal4、hyalp1和ph20/spam1。hyalp1是假基因,并且尚未显示hyal3对任何已知底物具有酶活性。hyal4是软骨素酶并对透明质酸缺乏活性。hyal1是原型酸性活性酶,并且ph20是原型中性活性酶。酸性活性透明质酸酶(如hyal1和hyal2)在中性ph下缺乏催化活性。例如,hyal1在ph4.5下在体外没有催化活性(frost和stern,“amicrotiter-basedassayforhyaluronidaseactivitynotrequiringspecializedreagents[基于微量滴定的透明质酸酶活性测定不需要专门的试剂]”,analyticalbiochemistry[分析生物化学],第251卷,第263-269页(1997))。hyal2是酸性活性酶,在体外具有非常低的比活性。
在一些实施例中,透明质酸酶是哺乳动物透明质酸酶。在一些实施例中,透明质酸酶是重组人透明质酸酶。在一些实施例中,透明质酸酶是中性活性透明质酸酶。在一些实施例中,透明质酸酶是中性活性可溶性透明质酸酶。在一些实施例中,透明质酸酶是重组ph20中性活性酶。在一些实施例中,透明质酸酶是重组ph20中性活性可溶性酶。在一些实施例中,透明质酸酶是糖基化的。在一些实施例中,透明质酸酶具有至少一个n-连接的聚糖。可以使用本领域技术人员已知的常规方法产生重组透明质酸酶,例如us7767429,将其全部内容通过引用并入本文。
在一些实施例中,透明质酸酶是rhuph20(也称为
在本文提供的任何方法中,抗透明质酸剂可以是降解透明质酸的试剂,或者可以是抑制透明质酸的合成的试剂。例如,抗透明质酸剂可以是透明质酸降解酶。在另一个实例中,抗透明质酸剂或是抑制透明质酸合成的试剂。例如,抗透明质酸剂是抑制透明质酸合成的试剂,如针对ha合酶的正义或反义核酸分子,或者是小分子药物。例如,抗透明质酸剂是4-甲基伞形酮(mu)或其衍生物、或来氟米特或其衍生物。此类衍生物包括例如4-甲基伞形酮(mu)的衍生物,其是6,7-二羟基-4-甲基香豆素或5,7-二羟基-4-甲基香豆素。
在本文提供的方法的另外的实例中,透明质酸降解酶是透明质酸酶。在一些实例中,透明质酸降解酶是ph20透明质酸酶或缺乏c-末端糖基磷脂酰肌醇(gpi)附接位点或gpi附接位点的一部分的其截短形式。在具体的实例中,透明质酸酶是选自以下的ph20:人、猴、牛、绵羊、大鼠、小鼠或豚鼠ph20。例如,透明质酸降解酶是人ph20透明质酸酶,其是中性活性且n-糖基化的,并且选自(a)作为全长ph20或作为ph20的c-末端截短形式的透明质酸酶多肽,其中所述截短形式至少包含seqidno:39的氨基酸残基36-464,如36-481、36-482、36-483,其中全长ph20具有seqidno:39所示的氨基酸序列;或(b)包含如下氨基酸序列的透明质酸酶多肽,所述氨基酸序列与seqidno:39所示的氨基酸序列的多肽或截短形式具有至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更多序列同一性;或(c)包含氨基酸取代的(a)或(b)的透明质酸酶多肽,其中所述透明质酸酶多肽具有与seqidno:39所示的多肽或其对应的截短形式具有至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更多序列同一性的氨基酸序列。在示例性实例中,透明质酸降解酶是包含指定为rhuph20的组合物的ph20。
在其他实例中,抗透明质酸剂是通过与聚合物缀合而修饰的透明质酸降解酶。聚合物可以是peg,并且抗透明质酸剂是peg化的透明质酸降解酶。因此,在本文提供的方法的一些实例中,将透明质酸降解酶通过与聚合物缀合来修饰。例如,将透明质酸降解酶与peg缀合,因此透明质酸降解酶是peg化的。在示例性实例中,透明质酸降解酶是peg化的ph20酶(pegph20)。在本文提供的方法中,皮质类固醇可以是选自以下的糖皮质激素:可的松、地塞米松、氢化可的松、甲基泼尼松龙、泼尼松龙和泼尼松。
软骨素酶
软骨素酶是在整个动物界中发现的酶,其通过内切糖苷酶反应降解糖胺聚糖,特别是软骨素和硫酸软骨素。在一些实施例中,软骨素酶是哺乳动物软骨素酶。在一些实施例中,软骨素酶是重组人软骨素酶。在一些实施例中,软骨素酶是hyal4。其他示例性软骨素酶包括软骨素酶abc(衍生自普通变形杆菌;日本专利申请公开号6-153947,t.yamagata等人j.biol.chem.[生物化学杂志],243,1523(1968),s.suzuki等人,j.biol.chem.[生物化学杂志],243,1543(1968))、软骨素酶ac(衍生自肝素黄杆菌;t.yamagata等人,j.biol.chem.[生物化学杂志],243,1523(1968))、软骨素酶acii(衍生自金黄节杆菌(arthrobacteraurescens);k.hiyama和s.okada,j.biol.chem.[生物化学杂志],250,1824(1975),k.hiyama和s.okada,j.biochem.[生物化学杂志](东京),80,1201(1976))、透明质酸酶aciii(衍生自黄杆菌属物种hp102;hirofumimiyazono等人,seikagaku,61,1023(1989))、软骨素酶b(衍生自肝素黄杆菌;y.m.michelacci和c.p.dietrich,biochem.biophys.res.commun.[生物化学与生物物理学研究通讯],56,973(1974),y.m.michelacci和c.p.dietrich,biochem.j.[生物化学杂志],151,121(1975),kenichimaeyama等人,seikagaku,57,1189(1985))、软骨素酶c(衍生自黄杆菌属物种hp102;hirofumimiyazono等人,seikagaku,61,1023(1939))等。
基质金属蛋白酶
基质金属蛋白酶(mmp)是锌依赖性内肽酶,其是参与细胞外基质(ecm)降解的主要蛋白酶。mmp能够降解多种细胞外分子和许多生物活性分子。已经在人中鉴定了24种mmp基因,其可以基于结构域组织和底物偏好分为六组:胶原酶(mmp-1、mmp-8和mmp-13)、明胶酶(mmp-2和mmp-9)、溶基质素(mmp-3、mmp-10和mmp-11)、基质溶解因子(mmp-7和mmp-26)、膜型(mt)-mmp(mmp-14、mmp-15、mmp-16、mmp-17、mmp-24和mmp-25)及其他(mmp-12、mmp-19、mmp-20、mmp-21、mmp-23、mmp-27和mmp-28)。在一些实施例中,基质修饰部分是人重组mmp(例如,mmp-1、mmp-2、mmp-3、mmp-4、mmp-5、mmp-6、mmp-7、mmp-8、mmp-9、mmp-10、mmp-11、mmp-12、mmp-13、mmp-14、mmp-15、mmp-16、mmp-17、mmp-18、mmp-19、mmp-20、mmp-21、mmp-22、mmp-23、或mmp-24)。
胶原酶
三种哺乳动物胶原酶(mmp-1、mmp-8、和mmp-13)是能够切割胶原细胞外基质的主要分泌型内肽酶。除了纤维状胶原外,胶原酶还可以切割若干其他基质和包括生长因子的非基质蛋白。胶原酶被合成为无活性的前体形式,并且一旦被激活,它们的活性被特异性金属蛋白酶组织抑制剂(timp)以及非特异性蛋白酶抑制剂抑制(ala-ahor等人biochimie.[生物化学]collagenasesincancer[癌症中的胶原酶].2005年3月-4月;87(3-4):273-86)。在一些实施例中,基质修饰部分是胶原酶。在一些实施例中,胶原酶是人重组胶原酶。在一些实施例中,胶原酶是mmp-1。在一些实施例中,胶原酶是mmp-8。在一些实施例中,胶原酶是mmp-13。
巨噬细胞金属弹性蛋白酶
巨噬细胞金属弹性蛋白酶(mme,也称为mmp-12)是mmp的溶基质素亚组的成员,并且催化可溶性和不可溶性弹性蛋白的水解,并且是基质和非基质底物的广泛选择,所述基质和非基质底物包括iv型胶原、纤连蛋白、层粘连蛋白、玻连蛋白、巢蛋白、乙酰肝素、和硫酸软骨素(erja
示例性的多特异性分子
本披露尤其涉及新颖的多特异性分子,所述多特异性分子包含(i)肿瘤靶向部分;以及以下中的一种或两种:(ii)免疫细胞衔接子(例如,选自nk细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子中的一种、两种、三种、或全部);和/或(iii)细胞因子分子。不受理论束缚,预期本文披露的多特异性分子在癌细胞处靶向(例如,定位、桥接和/或激活)免疫细胞(例如,选自nk细胞、b细胞、树突细胞或巨噬细胞的免疫效应细胞)。预期使用本文描述的多特异性分子增加免疫细胞的接近度和/或活性增强针对癌细胞的免疫应答,从而提供更有效的癌症疗法。因此,本文尤其提供了包含前述部分的多特异性分子(例如,多特异性抗体分子)、编码所述多特异性分子的核酸、产生前述分子的方法、以及使用前述分子靶向癌症的方法。
因此,在一方面,本披露的特征在于多特异性分子,所述多特异性分子包含:
(i)肿瘤靶向部分,例如与癌抗原(例如,实体瘤抗原、基质抗原、或血液抗原)结合的肿瘤靶向部分;以及
以下中的一种或两种:
(ii)例如选自nk细胞衔接子、t细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子中的一种、两种、三种、或全部的免疫细胞衔接子;或者
(iii)细胞因子分子。
在一个实施例中,多特异性分子包含两种特异性或功能,例如,其是双特异性或双功能分子,例如,其包含:
i)肿瘤靶向部分和细胞因子分子;或者
ii)肿瘤靶向部分和免疫细胞衔接子。
在其他实施例中,多特异性分子包含三种或四种特异性或功能,例如,其是三特异性或四特异性分子。示例性的三特异性和四特异性分子包含:
(i)一种肿瘤靶向部分、一种免疫细胞衔接子、和一种细胞因子分子;
(ii)一种肿瘤靶向部分和两种免疫细胞衔接子(例如,相同或不同的免疫细胞衔接子);
(iii)一种肿瘤靶向部分和两种细胞因子(例如,相同或不同的细胞因子);
(iv)一种肿瘤靶向部分、两种免疫细胞衔接子(例如,相同或不同的免疫细胞衔接子)、和一种细胞因子分子;
(v)一种肿瘤靶向部分、一种免疫细胞衔接子、和两种细胞因子分子(例如,相同或不同的细胞因子分子);
(vi)一种肿瘤靶向部分和三种免疫细胞衔接子(例如,相同或不同的免疫细胞衔接子);
(vii)一种肿瘤靶向部分和三种细胞因子分子(例如,相同或不同的细胞因子分子);
(viii)两种肿瘤靶向部分(例如,相同或不同的靶向部分)和一种免疫细胞衔接子;
(ix)两种肿瘤靶向部分(例如,相同或不同的靶向部分)和一种细胞因子分子;以及
(ix)两种肿瘤靶向部分(例如,相同或不同的靶向部分)、一种免疫细胞衔接子、和一种细胞因子分子。
在一些实施例中,多特异性分子包含单链抗体分子(例如,单结构域抗体、scfv、骆驼科动物抗体、或鲨鱼抗体)、和第二部分。在一些实施例中,多特异性分子从n至c方向包含scfv的vh至vl,所述scfv任选地经由接头连接至第二部分(例如,如在图1a和1b中所示);scfv可以形成第一结合特异性(在图1a-1b中描绘为结合部分“1”)。在一些实施例中,第二部分(在图1a-1b中描绘为配偶体a)从n-至c-方向位于scfv的vh区之前(例如,如在图1a中所示)、或从n-至c-方向位于scfv的vl区之后(例如,如在图1b中所示);第二部分可以形成第二结合特异性(在图1a-1b中描绘为结合部分“2”)。在其他实施例中,多特异性分子从n至c方向包含scfv的vl至vh,所述scfv任选地经由接头连接至第二部分(例如,如在图2a和2b中所示);scfv可以形成第一结合特异性(在图2a-2b中描绘为结合部分“1”)。在一些实施例中,第二部分(在图2a-2b中描绘为配偶体a)从n-至c-方向位于scfv的vl区之前(例如,如在图2a中所示)、或从n-至c-方向位于scfv的vh区之后(例如,如在图2b中所示);第二部分可以形成第二结合特异性(在图2a-2b中描绘为结合部分“2”)。在实施例中,scfv可以是肿瘤靶向部分(例如,与癌抗原(例如,实体瘤、基质、或血液抗原)结合),或者可以是免疫细胞衔接子(例如,与免疫细胞抗原结合)。在其他实施例中,第二部分(例如,图1a-1b或2a-2b中描绘为配偶体a)是肿瘤靶向部分(例如,在scfv不是肿瘤靶向部分的实施例中)、免疫细胞衔接子(例如,在scfv不是免疫细胞衔接子的实施例)、或细胞因子分子(例如,如本文描述的)。在实施例中,配偶体a可以是抗体分子(例如,单链抗体分子(例如,scfv)或fab)、受体分子、配体分子(例如,受体配体或细胞因子分子),例如如本文描述的。在一个实施例中,肿瘤靶向部分是癌细胞抗原的scfv,并且第二部分选自细胞因子分子或免疫细胞衔接子。在一些实施例中,第二部分是第二抗体分子(例如,第二scfv或fab)、受体分子、配体分子(例如,受体配体或细胞因子分子)。
在其他实施例中,多特异性分子是三特异性或三功能的,其包含单链多肽(例如,连续的单多肽链)、或由其组成。例如,多特异性分子可以包含肿瘤靶向部分(例如,如本文描述的对癌抗原(例如,实体瘤、基质、或血液抗原)的第一结合特异性)、如本文描述的细胞因子分子、和免疫细胞衔接子(例如,如本文描述的对免疫细胞抗原的第二结合特异性)、或任何前述的至少2种的任何组合。
在一些实施例中,多特异性分子包含单链抗体分子(例如,单结构域抗体、scfv、骆驼科动物抗体、或鲨鱼抗体)、和第二部分。在一些实施例中,多特异性分子从n至c方向包含scfv的vh至vl,所述scfv任选地经由接头连接至第二部分和/或第三部分(例如,如在图1c中所示);scfv可以形成第一结合特异性(在图1c中描绘为结合部分“1”)。在一些实施例中,分别地,第二或第三部分(在图1c中描绘为配偶体a和b)从n-至c-方向位于scfv的vh区之前(例如,如在图1c中所示),并且第三部分(配偶体b)从n-至c-方向位于scfv的vl区之后(例如,如在图1c中所示);第二和第三部分可以形成第二和第三结合特异性(在图1c中分别描绘为结合部分“2”和结合部分“3”)。在其他实施例中,多特异性分子从n至c方向包含scfv的vl至vh,所述scfv任选地经由接头连接至第二部分和/或第三部分(例如,如在图2c中所示)。在一些实施例中,第二部分(在图2c中描绘为配偶体a)从n-至c-方向位于scfv的vl区之前(例如,如在图2c中所示),并且第三部分(配偶体b)从n-至c-方向位于scfv的vh区之后(例如,如在图2c中所示);第二和第三部分可以形成第二和第三结合特异性(在图2c中分别描绘为结合部分“2”和结合部分“3”)。在实施例中,任何前述多特异性分子的scfv可以是肿瘤靶向部分(例如,与癌抗原(例如,实体瘤、基质或血液抗原)结合),或者可以是免疫细胞衔接子(例如,与免疫细胞抗原结合)。在实施例中,第二部分和第三部分(例如,在图1c或2c中描绘为配偶体a和配偶体b)独立地选自肿瘤靶向部分、免疫细胞衔接子、或细胞因子分子(例如,如本文描述的)。在实施例中,配偶体a和/或配偶体b可以是抗体分子(例如,单链抗体分子(例如,scfv)或fab)、受体分子、或配体分子(例如,受体配体或细胞因子分子),例如如本文描述的。在一个实施例中,肿瘤靶向部分是癌细胞抗原的scfv,并且第二部分和第三部分独立地选自细胞因子分子或免疫细胞衔接子。在一些实施例中,第二和第三部分独立地选自第二抗体分子(例如,第二scfv或fab)、受体分子、或配体分子(例如,受体配体或细胞因子分子)。
在一些实施例中,多特异性分子不由与cd16(fcγriii)结合的nk细胞衔接子的单链多肽(即,scfv)、和肿瘤靶向部分(即,靶向cd33的scfv)组成。在其他实施例中,多特异性分子不由与cd16结合的scfv的单链多肽、il-15细胞因子、和靶向cd33的scfv组成。
在实施例中,多特异性分子是双特异性或双功能分子,其中第一和第二多肽(i)和(ii)是不连续的,例如是两条独立的多肽链。在实施例中,第一和第二多肽具有如在图3a-3b或图4a-4b中所示的构型。在实施例中,第一和第二多肽形成第一结合特异性,例如抗原结合结构域(例如,在图3a-3b和图4a-4b中描绘为结合部分“1”)。在实施例中,第二部分(描绘为配偶体a)例如经由接头连接至第一多肽或第二多肽。在实施例中,第二部分形成第二结合特异性(例如,在图3a-3b和图4a-4b中描绘为结合部分“2”)。
在图3a-3b中描绘的一个实施例中,第二部分(例如,配偶体a)例如经由接头连接至第二多肽的c-末端(例如,第二多肽的cl区的c-末端)(例如,如在图3a中所示)。在其他实施例中,第二部分(例如,配偶体a)例如经由接头连接至第一多肽的c-末端(例如,第一多肽的ch1区的c-末端)(例如,如在图3b中所示)。
在图4a-4b中描绘的另一个实施例中,第二部分(例如,配偶体a)例如经由接头连接至第二多肽的n-末端(例如,第二多肽的vl区的n-末端)(例如,如在图4a中所示)。在其他实施例中,第二部分(例如,配偶体a)例如经由接头连接至第一多肽的n-末端(例如,第一多肽的vh区的n-末端)(例如,如在图4b中所示)。
在实施例中,第一和第二多肽(例如,vh和vl区)可以形成结合部分(例如,图3a-3b和4a-4b中的结合部分1);例如,第一和第二多肽可以是肿瘤靶向部分(例如,与癌抗原(例如,实体瘤、基质或血液抗原)结合),或者可以是免疫细胞衔接子(例如,与免疫细胞抗原结合)。在实施例中,第二部分(例如,在图3a-3b和4a-4b中描绘为配偶体a)形成第二结合部分,例如,其选自肿瘤靶向部分、免疫细胞衔接子、或细胞因子分子(例如,如本文描述的)。在实施例中,第二部分(例如,配偶体a)可以是抗体分子(例如,单链抗体分子(例如,scfv)或fab)、受体分子、配体分子(例如,受体配体或细胞因子分子),例如如本文描述的。在一个实施例中,多特异性分子包含fab分子,并且第二部分选自第二抗体分子(例如,scfv或第二fab)、受体分子、或受体配体分子、或细胞因子分子。在一个实施例中,肿瘤靶向部分是癌细胞抗原的fab,并且第二部分选自细胞因子分子或免疫细胞衔接子。在一些实施例中,第二部分是第二抗体分子(例如,第二scfv或fab)、受体分子、或受体配体分子、或细胞因子分子。
在实施例中,多特异性分子是双特异性或双功能分子,其中第一和第二多肽(i)和(ii)是不连续的,例如是两条独立的多肽链。在实施例中,第一和第二多肽具有如在图3a-3b或图4a-4b中所示的构型。在实施例中,第二部分(描绘为配偶体a)例如经由接头连接至第一多肽或第二多肽(例如,第一多肽或第二多肽的n-末端或c-末端)。
在图3a-3b中描绘的双特异性或双功能分子的一个实施例中,第二部分(例如,配偶体a)例如经由接头连接至第二多肽的cl区(例如,cl区的c-末端)(例如,如在图3a中所示)。在其他实施例中,第二部分(例如,配偶体a)例如经由接头连接至第一多肽的ch1区(例如,ch1区的c-末端)(例如,如在图3b中所示)。
在图4a-4b中描绘的双特异性或双功能分子的另一个实施例中,第二部分(例如,配偶体a)例如经由接头连接至第二多肽的vl区(例如,vl区的n-末端)(例如,如在图4a中所示)。在其他实施例中,第二部分(例如,配偶体a)例如经由接头连接至第一多肽的vh区(例如,vh区的n-末端)(例如,如在图4b中所示)。
在双特异性或双功能分子的实施例中,第一和第二多肽(例如,vh和vl区)可以形成结合部分(例如,在图3a-3b和4a-4b中的结合部分1);例如,第一和第二多肽可以是肿瘤靶向部分(例如,与癌抗原(例如,肿瘤、基质或血液抗原)结合),或者可以是免疫细胞衔接子(例如,与免疫细胞抗原结合)。在实施例中,第二部分(例如,在图3a-3b和4a-4b中描绘为配偶体a)形成第二结合部分,例如,其选自肿瘤靶向部分、免疫细胞衔接子、或细胞因子分子(例如,如本文描述的)。在实施例中,第二部分(例如,配偶体a)可以是抗体分子(例如,单链抗体分子(例如,scfv)或fab)、受体分子、或配体分子(例如,受体配体或细胞因子分子),例如如本文描述的。在一个实施例中,多特异性分子包含fab分子,并且第二部分选自第二抗体分子(例如,scfv或第二fab)、受体分子、或配体分子(例如,细胞因子分子)。在一个实施例中,肿瘤靶向部分是癌细胞抗原的fab,并且第二部分选自细胞因子分子或免疫细胞衔接子。在一些实施例中,第二部分是第二抗体分子(例如,第二scfv或fab)、受体分子、受体配体分子、或细胞因子分子。
在其他实施例中,多特异性分子是三特异性或三功能分子,其中第一和第二多肽(i)和(ii)是不连续的,例如是两条独立的多肽链。在实施例中,第一和第二多肽具有如在图3c和4c中所示的构型。在实施例中,第二部分和第三部分(分别描绘为配偶体a和b)分别例如经由接头连接至第一多肽和第二多肽的c-末端、n-末端、或两者。在一个实施例中,第二部分和第三部分分别连接至第二和第一多肽(或第一和第二多肽)的c-末端。在另一个实施例中,第二部分和第三部分分别连接至第二和第一多肽(或第一和第二多肽)的n-末端。在一个实施例中,第二部分和第三部分分别连接至第二和第一多肽(或第一和第二多肽)的n-和c-末端。本披露旨在包括任何构型,包括图3c和4c中示例的那些。
在图3c-4c中描绘的三特异性或三功能分子的一个实施例中,第二部分(例如,对应于第二结合特异性“2”的配偶体a)例如经由接头连接至第二多肽的c-末端(例如,第二多肽的cl区的的c-末端)(例如,如在图3c中所示),并且第三部分(例如,对应于第三结合特异性“3”的配偶体b)例如经由接头连接至第一多肽的c-末端(例如,第一多肽的ch1区的c-末端)(例如,如在图3c中所示)。
在图3c-4c中描绘的三特异性或三功能分子的另一个实施例中,第二部分(例如,对应于第二结合特异性“2”的配偶体a)例如经由接头连接至第二多肽的n-末端(例如,第二多肽的vl区的n-末端)(例如,如在图4c中所示),并且第三部分(例如,对应于第三结合特异性“3”的配偶体b)例如经由接头连接至第一多肽的n-末端(例如,第一多肽的vh区的n-末端)(例如,如在图4c中所示)。
在三特异性或三功能分子的另一个实施例中,第二部分(例如,对应于第二结合特异性“2”的配偶体a)例如经由接头连接至第二多肽的n-末端(例如,第二多肽的vl区的n-末端),并且第三部分(例如,对应于第三结合特异性“3”的配偶体b)例如经由接头连接至第一多肽的c-末端(例如,第一多肽的ch1区的c-末端)。
在三特异性或三功能分子的另一个实施例中,第二部分(例如,对应于第二结合特异性“2”的配偶体a)例如经由接头连接至第二多肽的c-末端(例如,第二多肽的cl区的n-末端),并且第三部分(例如,对应于第三结合特异性“3”的配偶体b)例如经由接头连接至第一多肽的n-末端(例如,第一多肽的vh区的n-末端)。
在三特异性或三功能分子的实施例中,第一和第二多肽(例如,vh和vl区)可以形成第一结合特异性(例如,图3c和4c中的结合部分“1”);例如,第一和第二多肽可以是肿瘤靶向部分(例如,与癌抗原(例如,实体瘤、基质或血液抗原)结合),或者可以是免疫细胞衔接子(例如,与免疫细胞抗原结合)。在实施例中,第二部分和第三部分(例如,图3c和4c中描绘为配偶体a和b)形成第二和第三结合特异性,例如,其独立地选自肿瘤靶向部分、免疫细胞衔接子、或细胞因子分子(例如,如本文描述的)。在实施例中,第二和第三结合特异性(例如,配偶体a和b)可以独立地是抗体分子(例如,单链抗体分子(例如,scfv)或fab)、受体分子、配体分子(例如,受体配体或细胞因子分子),例如如本文描述的。在一个实施例中,多特异性分子包含fab分子,并且第二部分和第三部分独立地选自第二抗体分子(例如,scfv或第二fab)、受体分子、或配体分子(例如,受体配体或细胞因子分子)。在一些实施例中,第一结合特异性、第二结合特异性和第三结合特异性可以各自独立地选自肿瘤靶向部分、细胞因子分子、nk细胞衔接子、t细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子。在一个实施例中,肿瘤靶向部分是癌细胞抗原的fab,并且第二和第三部分独立地选自细胞因子分子或免疫细胞衔接子。在一个实施例中,肿瘤靶向部分是癌细胞抗原的fab;第二部分是细胞因子分子;并且第三部分是免疫细胞衔接子。
在一个实施例中,多特异性分子包含至少两种或至少三种或至少四种不连续多肽,其中:
(i)第一多肽从n-至c-方向包含第一免疫球蛋白恒定区(例如,连接至ch3区的ch2)(例如,第一fc区);并且
(ii)第二多肽从n-至c-方向包含第二免疫球蛋白恒定区(例如,连接至ch3区的ch2)(例如,第二fc区)。
在实施例中,多特异性分子是双特异性或双功能分子,其中第一和第二多肽(i)和(ii)是不连续的,例如是两条独立的多肽链。在一些实施例中,第一和第二多肽(i)和(ii)包含在选自例如人igg1的fc区的以下中的一个或多个的位置处的成对的氨基酸取代:347、349、350、351、366、368、370、392、394、395、397、398、399、405、407、或409。例如,第一免疫球蛋白链恒定区(例如,第一fc区)可以包含选自以下的氨基酸取代:t366s、l368a、或y407v(例如,对应于空腔或臼),并且第二免疫球蛋白链恒定区(例如,第二fc区)包含t366w(例如,对应于突起或杵)。在一些实施例中,第一和第二多肽是异源二聚体第一和第二fc区的第一和第二成员。
在实施例中,第一和第二多肽形成双特异性分子。在一些实施例中,第一多肽包含第一结合特异性(例如,图5a中的配偶体a或结合特异性1),并且第二多肽包含第二结合特异性(例如,图5a中的配偶体b或结合特异性2)。在实施例中,第一和第二结合特异性(分别为配偶体a和配偶体b)各自独立地选自抗体分子(例如,单链抗体分子(例如,scfv)或fab)、受体分子、配体分子(例如,受体配体或细胞因子分子),例如如本文描述的。在实施例中,第一和第二结合特异性连接至第一或第二多肽、或每种多肽(例如,异源二聚体fc分子的一个或两个成员)。在一个实施例中,第一结合特异性(例如,配偶体a)连接至第一多肽的n-末端(例如,第一fc分子的–ch2-ch3-区),并且第二结合特异性(例如,配偶体b)连接至第二多肽的n-末端(例如,第二fc分子的–ch2-ch3-区)。可替代地,第一结合特异性(例如,配偶体a)连接至第一多肽的c-末端(例如,第一fc分子的–ch2-ch3-区),并且第二结合特异性(例如,配偶体b)连接至第二多肽的c-末端(例如,第二fc分子的–ch2-ch3-区)。可替代地,第一结合特异性(例如,配偶体a)连接至第一多肽的n-末端(例如,第一fc分子的–ch2-ch3-区),并且第二结合特异性(例如,配偶体b)连接至第二多肽的c-末端(例如,第二fc分子的–ch2-ch3-区)。在其他实施例中,第二结合特异性(例如,配偶体b)连接至第一多肽的n-末端(例如,第一fc分子的–ch2-ch3-区),并且第一结合特异性(例如,配偶体a)连接至第二多肽的c-末端(例如,第二fc分子的–ch2-ch3-区)。在一个实施例中,第一–ch2-ch3区包含突起或杵,并且第二–ch2-ch3区包含空腔或臼(例如,如在图5a中描绘)。
在一些实施例中,双特异性分子的第一和第二结合特异性(结合部分1和结合部分2)可以各自独立地选自肿瘤靶向部分、细胞因子分子、t细胞衔接子、nk细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子。在一些实施例中,第一结合特异性是肿瘤靶向部分,并且第二结合特异性选自细胞因子分子、nk细胞衔接子、t细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子。
在图5a中显示的一些实施例中,双特异性分子可以具有配偶体a和b,其分别描绘为第一和第二结合特异性(结合部分1和2)(图5a)。第一和第二结合特异性可以各自独立地是抗体分子(例如,单链抗体分子(例如,scfv)或fab)、受体分子、配体分子(例如,受体配体或细胞因子分子),例如如本文描述的。在一些实施例中,第一结合特异性是肿瘤靶向部分,并且第二结合特异性选自细胞因子分子、nk细胞衔接子、t细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子。
在实施例中,第一和第二多肽形成三特异性或四特异性分子(例如,如分别在图5b-5c中描绘)。
在三特异性分子的一些实施例中,第一多肽包含第一结合特异性(例如,图5b中的配偶体a或结合部分1),并且第二多肽包含第二结合特异性(例如,图5b中的配偶体b或结合特异性2),其中第一或第二多肽进一步包含第三结合特异性(例如,图5b中的配偶体c或结合部分3)。在实施例中,第一和第二结合特异性连接至第一或第二多肽、或每种多肽(例如,异源二聚体fc分子的一个或两个成员)。在一个实施例中,第一和第二结合特异性分别例如经由接头连接至第一和第二多肽的n-末端,并且第三结合特异性例如经由接头连接至第一或第二多肽的c-末端。在一个实施例中,第三结合特异性例如经由接头连接至第一多肽的c-末端(例如,在图5b中描绘的第一–ch2-ch3区的c-末端)。在一个实施例中,第三结合特异性例如经由接头连接至第二多肽的c-末端(例如,第二–ch2-ch3区的c-末端)。在一个实施例中,第一–ch2-ch3区包含突起或杵,并且第二–ch2-ch3区包含臼或空腔(例如,如在图5b中描绘)。
在实施例中,第一、第二和第三结合特异性(分别为配偶体a、配偶体b、和配偶体c)各自独立地选自抗体分子(例如,单链抗体分子(例如,scfv)或fab)、受体分子、配体分子(例如,受体配体或细胞因子分子),例如如本文描述的。在一个实施例中,第一结合特异性(例如,配偶体a)连接至第一多肽的n-末端(例如,第一fc分子的–ch2-ch3-区);第二结合特异性(例如,配偶体b)连接至第二多肽的n-末端(例如,第二fc分子的–ch2-ch3-区);并且第三结合特异性(例如,配偶体c)连接至第一多肽的c-末端(例如,第二fc分子的–ch2-ch3-区)。在其他实施例中,第一结合特异性(例如,配偶体a)连接至第一多肽的n-末端(例如,第一fc分子的–ch2-ch3-区);第二结合特异性(例如,配偶体b)连接至第二多肽的n-末端(例如,第一fc分子的–ch2-ch3-区);并且第三结合特异性(例如,配偶体c)连接至第二多肽的c-末端(例如,第二fc分子的–ch2-ch3-区)。第一、第二和第三结合特异性可以独立地是抗体分子(例如,单链抗体分子(例如,scfv)或fab)、受体分子、配体分子(例如,受体配体、或细胞因子分子),例如如本文描述的。在一些实施例中,第一、第二和第三结合特异性(配偶体a-c,分别对应于结合部分1-3)各自独立地选自肿瘤靶向部分、细胞因子分子、nk细胞衔接子、t细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子,例如如本文描述的。在实施例中,第一结合特异性是肿瘤靶向部分,并且第二和第三结合特异性各自独立地选自细胞因子分子、nk细胞衔接子、t细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子。
在四特异性分子的一些实施例中,第一多肽包含第一结合特异性(例如,图5c中的配偶体a或结合部分1)和第三结合特异性(例如,图5c中的配偶体c或结合部分3),并且第二多肽包含第二结合特异性(例如,图5c中的配偶体b或结合特异性2)和第四结合特异性(例如,图5c中的配偶体d或结合部分4)。在一个实施例中,第一和第二结合特异性分别例如经由接头连接至第一和第二多肽的n-末端,并且第三和第四结合特异性分别例如经由接头连接至第一和第二多肽的c-末端。本披露涵盖对第一或第二多肽的n-或c-末端的结合特异性的任何排列。在一个实施例中,第一结合特异性(例如,配偶体a)例如经由接头连接至第一多肽的n-末端(例如,在图5c中描绘的第一–ch2-ch3区的n-末端);第二结合特异性(例如,配偶体b)例如经由接头连接至第二多肽的n-末端(例如,在图5c中描绘的第二–ch2-ch3区的n-末端);第三结合特异性(例如,配偶体c)例如经由接头连接至第一多肽的c-末端(例如,在图5c中描绘的第一–ch2-ch3区的c-末端);并且第四结合特异性(例如,配偶体d)例如经由接头连接至第二多肽的c-末端(例如,第二–ch2-ch3区的c-末端)。在一个实施例中,第一–ch2-ch3区包含突起或杵,并且第二–ch2-ch3区包含空腔或臼(例如,如在图5c中描绘)。在实施例中,第一、第二、第三和第四结合特异性(分别为配偶体a、配偶体b、配偶体c和配偶体d)各自独立地选自抗体分子(例如,单链抗体分子(例如,scfv)或fab)、受体分子、配体分子(例如,受体配体或细胞因子分子),例如如本文描述的。第一、第二、第三和第四结合特异性可以独立地是抗体分子(例如,单链抗体分子(例如,scfv)或fab)、受体分子、配体分子(例如,受体配体、或细胞因子分子),例如如本文描述的。在一些实施例中,第一、第二、第三和第四结合特异性(配偶体a-d,分别地对应于结合部分1-4)各自独立地选自肿瘤靶向部分、细胞因子分子、nk细胞衔接子、t细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子,例如如本文描述的。在实施例中,第一结合特异性是肿瘤靶向部分,并且第二、第三和第四结合特异性各自独立地选自细胞因子分子、nk细胞衔接子、t细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子。
在一个实施例中,多特异性分子是包含两种不连续的第一和第二多肽的双特异性分子。在实施例中,第一和第二多肽分别包含第一和第二结合位点,其独立地选自抗体分子(例如,单链抗体分子(例如,scfv)或fab)、受体分子、配体分子(例如,受体配体、或细胞因子分子),例如如本文描述的。在一些实施例中,第一和第二结合特异性(分别为结合位点1-2)各自独立地选自肿瘤靶向部分、细胞因子分子、nk细胞衔接子、t细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子,例如如本文描述的。在一些实施例中,第一多肽从n-至-c具有以下构型:与例如肿瘤或基质抗原(例如,结合位点#1)结合的第一抗原结构域的第一部分(例如,fab分子的第一vh-ch1),任选地经由接头连接至第二结合特异性(例如,结合位点#2);并且第二多肽从n-至-c具有以下构型:与例如癌抗原(例如,由第一vh-ch1结合的相同的癌抗原,例如结合位点#1)结合的第一抗原结构域的第二部分,例如fab的第一vl-cl(例如,此构型的实例在图6中描绘)。在一个实施例中,双特异性分子包含对应于第一结合特异性(结合位点#1)的任选地经由接头连接至第二结合特异性(例如,结合位点#2)的fab。在一些实施例中,第一结合特异性(例如,图6中的结合位点#1)是肿瘤靶向部分,例如与癌抗原(例如,肿瘤或基质抗原)结合;并且第二结合特异性(例如,图6中的结合位点#2)选自细胞因子分子、或免疫细胞衔接子(例如,选自与免疫细胞抗原结合的受体、受体配体分子或抗体分子(例如,scfv))。在抗体分子是scfv的实施例中,scfv能以vh-vl或vl-vh构型连接至第一多肽的c-末端。
在另一个实施例中,多特异性分子是双特异性分子,其包含两种或至少三种不连续的第一和第二多肽,其中:
(i)第一多肽从n-至c-方向包含第一结合特异性(例如,第一抗体分子),任选地经由接头连接至第一免疫球蛋白恒定区(例如,连接至ch3区的ch2)(例如,第一fc区);
(ii)第二多肽从n-至c-方向包含第二免疫球蛋白恒定区(例如,连接至ch3区的ch2)(例如,第二fc区);并且
(任选地)(iii)第三多肽包含第一抗体分子或第二抗体分子的一部分。
在实施例中,第一和第二多肽分别包含第一和第二结合特异性(例如,位点),其独立地选自抗体分子(例如,单链抗体分子(例如,scfv)或fab)、受体分子、配体分子(例如,受体配体、或细胞因子分子),例如如本文描述的。在一些实施例中,第一和第二结合特异性(分别为结合位点1-2)各自独立地选自肿瘤靶向部分、细胞因子分子、nk细胞衔接子、t细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子,例如如本文描述的。
在一些实施例中,第一多肽从n-至-c具有以下构型:
(a)与例如癌抗原(例如,实体瘤、基质或血液抗原)(例如,结合位点#1)结合的第一抗原结构域的第一部分(例如,fab分子的第一vh-ch1),任选地经由接头连接至第一免疫球蛋白恒定区(例如,连接至ch3区的ch2)(例如,第一fc区);
(b)第二结合特异性(例如,第二结合位点),其选自细胞因子分子、或免疫细胞衔接子,任选地经由接头连接至第二免疫球蛋白恒定区(例如,连接至ch3区的ch2)(例如,第二fc区);并且
(c)第三多肽从n-至-c具有以下构型:与例如癌抗原(例如,实体瘤、基质或血液抗原)(例如,由第一vh-ch1结合的相同的癌抗原,例如结合位点#1)结合的第一抗原结构域的第二部分,例如fab的第一vl-cl(例如,此构型的实例在图7中描绘)。
在一个实施例中,双特异性分子包含对应于第一结合特异性(结合位点#1)的任选地经由接头连接至第一fc区的fab、和任选地经由接头连接至第二fc区的第二结合特异性(例如,结合位点#2)。在一些实施例中,第一结合特异性(例如,图7中的结合位点#1)是肿瘤靶向部分,例如与癌抗原(例如,肿瘤或基质抗原)结合;并且第二结合特异性(例如,图7中的结合位点#2)选自细胞因子分子、或免疫细胞衔接子(例如,选自与免疫细胞抗原结合的受体、配体分子或抗体分子(例如,scfv))。在抗体分子是scfv的实施例中,scfv能以vh-vl或vl-vh构型连接至第一多肽的c-末端。
在实施例中,第一免疫球蛋白恒定区(例如,第一ch2-ch3区)包含突起或杵,例如如本文描述的。
在实施例中,第二免疫球蛋白恒定区(例如,第二ch2-ch3区)包含空腔或臼。在实施例中,第一和第二免疫球蛋白恒定区促进双特异性分子的异源二聚化。
在一个实施例中,多特异性分子是包含两种不连续的第一和第二多肽的三特异性分子。在实施例中,第一和第二多肽分别包含第一、第二和第三结合特异性,其独立地选自抗体分子(例如,单链抗体分子(例如,scfv)或fab)、受体分子、配体分子(例如,受体配体、或细胞因子分子),例如如本文描述的。在一些实施例中,第一、第二和第三结合特异性(分别为结合位点1-3)各自独立地选自肿瘤靶向部分、细胞因子分子、nk细胞衔接子、t细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子,例如如本文描述的。
在一些实施例中,第一多肽从n-至-c具有以下构型:
(i)与例如肿瘤或基质抗原(例如,结合位点#1)结合的第一抗原结构域的第一部分(例如,fab分子的第一vh-ch1),任选地经由接头连接至第二结合特异性(例如,结合位点#3,例如细胞因子、配体或第二抗体分子,例如scfv);并且
(ii)第二多肽从n-至-c具有以下构型:与例如肿瘤或基质抗原(例如,由第一vh-ch1结合的相同的肿瘤或基质抗原,例如结合位点#1)结合的第一抗原结构域的第二部分(例如,fab的第一vl-cl),任选地经由接头连接至第三结合特异性(例如,结合位点#2,例如细胞因子、配体或第二抗体分子,例如scfv)(例如,此构型的实例在图8a-8c中描绘)。
在一个实施例中,双特异性分子包含对应于第一结合特异性(结合位点#1)的任选地经由接头连接至第二和第三结合特异性(例如,结合位点#2和#3)的fab。在一些实施例中,第一结合特异性(例如,图8a-8c中的结合位点#1)是肿瘤靶向部分,例如与癌抗原(例如,肿瘤、基质或血液抗原)结合;并且第二和第三结合特异性(例如,图8a-8c中的结合位点#2和#3)独立地选自细胞因子分子、或免疫细胞衔接子(例如,选自与免疫细胞抗原结合的受体、配体分子或抗体分子(例如,scfv))。在一个实施例中,第一结合特异性(例如,图8a中的结合位点#1)是肿瘤靶向部分,例如与癌抗原(例如,肿瘤、基质或血液抗原)结合;第二结合特异性(例如,图8a中的结合位点#3)选自细胞因子分子、或免疫细胞衔接子(例如,选自与免疫细胞抗原结合的受体、配体分子或抗体分子(例如,scfv));并且第三结合特异性(例如,图8a中的结合位点#2)是与免疫细胞抗原结合的抗体分子(例如,scfv)。在其他实施例中,第一结合特异性(例如,图8b中的结合位点#1)是肿瘤靶向部分,例如与癌抗原(例如,肿瘤、基质或血液抗原)结合;第二结合特异性(例如,图8b中的结合位点#3)选自细胞因子分子、或免疫细胞衔接子(例如,选自与免疫细胞抗原结合的受体、配体分子或抗体分子(例如,scfv));并且第三结合特异性(例如,图8b中的结合位点#2)是与免疫细胞抗原结合的配体或抗体分子(例如,scfv)。在其他实施例中,第一结合特异性(例如,图8c中的结合位点#1)是肿瘤靶向部分,例如与癌抗原(例如,肿瘤、基质或血液抗原)结合;第二结合特异性(例如,图8c中的结合位点#3)是免疫细胞衔接子,例如选自与免疫细胞抗原结合的受体、配体分子或抗体分子(例如,scfv);并且第三结合特异性(例如,图8c中的结合位点#2)是与免疫细胞抗原结合的配体或抗体分子(例如,scfv)。在抗体分子是scfv的实施例中,scfv能以vh-vl或vl-vh构型连接至第一多肽的c-末端。
在另一个实施例中,多特异性分子是三特异性分子,其包含两种或至少三种不连续的第一和第二多肽,其中:
(i)第一多肽从n-至c-方向包含第一结合特异性(例如,第一抗体分子),任选地经由接头连接至第一免疫球蛋白恒定区(例如,连接至ch3区的ch2)(例如,第一fc区);
(ii)第二多肽从n-至c-方向包含第二结合特异性,任选地经由接头连接至第二免疫球蛋白恒定区(例如,连接至ch3区的ch2)(例如,第二fc区);并且
(任选地)(iii)第三多肽包含第一抗体分子或第二抗体分子的一部分,
其中第一或第二多肽进一步包含第三结合特异性。
在实施例中,第一和第二多肽分别包含第一、第二和第三结合特异性(例如,位点),其独立地选自抗体分子(例如,单链抗体分子(例如,scfv)或fab)、受体分子、配体分子(例如,受体配体、或细胞因子分子),例如如本文描述的。在一些实施例中,第一、第二和第三结合特异性(分别为结合位点1-3)各自独立地选自肿瘤靶向部分、细胞因子分子、nk细胞衔接子、t细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子,例如如本文描述的。
在一些实施例中,第一多肽从n-至-c具有以下构型:
(a)与例如肿瘤或基质抗原(例如,结合位点#1)结合的第一抗原结构域的第一部分(例如,fab分子的第一vh-ch1),任选地经由接头连接至第一免疫球蛋白恒定区(例如,连接至ch3区的ch2)(例如,第一fc区);
(b)第二结合特异性(例如,第二结合位点),其选自细胞因子分子、或免疫细胞衔接子,任选地经由接头连接至第二免疫球蛋白恒定区(例如,连接至ch3区的ch2)(例如,第二fc区);并且
(c)第三多肽从n-至-c具有以下构型:与例如肿瘤或基质抗原(例如,由第一vh-ch1结合的相同的肿瘤或基质抗原,例如结合位点#1)结合的第一抗原结构域的第二部分(例如,fab的第一vl-cl),
其中第一或第二多肽进一步包含第三结合特异性,其任选地经由接头连接至第一或第二免疫球蛋白恒定区(例如,连接至ch3区的ch2)(例如,第一或第二fc区)。在一个实施例中,第三结合特异性任选地经由接头连接至第一免疫球蛋白恒定区(例如,连接至ch3区的ch2)(例如,第一fc区)。在另一个实施例中,第三结合特异性任选地经由接头连接至第二免疫球蛋白恒定区(例如,连接至ch3区的ch2)(例如,第二fc区)。这些构型的实例在图9a-9b中描绘。
在一个实施例中,三特异性分子包含对应于第一结合特异性(结合位点#1)的任选地经由接头连接至第一fc区的fab;以及任选地经由接头连接至第二fc区的第二结合特异性(例如,结合位点#2),其进一步包含第三结合特异性(例如,结合位点#3)(例如,如在图9a中描绘)。在其他实施例中,三特异性分子包含对应于第一结合特异性(结合位点#1)的任选地经由接头连接至第一fc区的fab,其进一步包含第三结合特异性(例如,结合位点#3);以及任选地经由接头连接至第二fc区的第二结合特异性(例如,结合位点#2)(例如,如在图9b中描绘)。
在一些实施例中,(a)第一结合特异性(例如,图9a-9b中的结合位点#1)是肿瘤靶向部分,例如与癌抗原(例如,肿瘤或基质抗原)结合;(b)第二结合特异性(例如,图9a-9b中的结合位点#2)选自细胞因子分子、或免疫细胞衔接子(例如,选自与免疫细胞抗原结合的受体、配体分子或抗体分子(例如,scfv));并且(c)第三结合特异性(例如,图9a-9b中的结合位点#3)选自细胞因子分子、或免疫细胞衔接子(例如,选自与免疫细胞抗原结合的受体、配体分子或抗体分子(例如,scfv))。在抗体分子是scfv的实施例中,scfv能以vh-vl或vl-vh构型连接至第一多肽的c-末端。
在实施例中,第一免疫球蛋白恒定区(例如,第一ch2-ch3区)包含突起或杵,例如如本文描述的。
在实施例中,第二免疫球蛋白恒定区(例如,第二ch2-ch3区)包含空腔或臼。在实施例中,第一和第二免疫球蛋白恒定区促进双特异性分子的异源二聚化。
在另一个实施例中,多特异性分子是四特异性分子,其包含两种或至少三种不连续的第一和第二多肽,其中:
(i)第一多肽从n-至c-方向包含第一结合特异性(例如,第一抗体分子),任选地经由接头连接至第一免疫球蛋白恒定区(例如,连接至ch3区的ch2)(例如,第一fc区);
(ii)第二多肽从n-至c-方向包含第二结合特异性,任选地经由接头连接至第二免疫球蛋白恒定区(例如,连接至ch3区的ch2)(例如,第二fc区);并且
(任选地)(iii)第三多肽包含第一抗体分子或第二抗体分子的一部分,
其中第一或第二多肽进一步包含第三和第四结合特异性。
在实施例中,第一和第二多肽分别包含第一、第二、第三和第四结合特异性(例如,位点),其独立地选自抗体分子(例如,单链抗体分子(例如,scfv)或fab)、受体分子、配体分子(例如,受体配体、或细胞因子分子),例如如本文描述的。在一些实施例中,第一、第二、第三和第四结合特异性(分别为结合位点1-4)各自独立地选自肿瘤靶向部分、细胞因子分子、nk细胞衔接子、t细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子,例如如本文描述的。
在一些实施例中,第一多肽从n-至-c具有以下构型:
(a)与例如肿瘤或基质抗原(例如,结合位点#1)结合的第一抗原结构域的第一部分(例如,fab分子的第一vh-ch1),任选地经由接头连接至第一免疫球蛋白恒定区(例如,连接至ch3区的ch2)(例如,第一fc区);
(b)第二结合特异性(例如,第二结合位点),其选自细胞因子分子、或免疫细胞衔接子,任选地经由接头连接至第二免疫球蛋白恒定区(例如,连接至ch3区的ch2)(例如,第二fc区);并且
(c)第三多肽从n-至-c具有以下构型:与例如肿瘤或基质抗原(例如,由第一vh-ch1结合的相同的肿瘤或基质抗原,例如结合位点#1)结合的第一抗原结构域的第二部分(例如,fab的第一vl-cl),
其中第一和第二多肽进一步分别包含第三和第四结合特异性,其各自任选地经由接头连接至第一和第二免疫球蛋白恒定区(例如,连接至ch3区的ch2)(例如,第一和第二fc区)。在一个实施例中,第三结合特异性任选地经由接头连接至第二免疫球蛋白恒定区(例如,连接至ch3区的ch2)(例如,第二fc区);并且第四结合特异性任选地经由接头连接至第一免疫球蛋白恒定区(例如,连接至ch3区的ch2)(例如,第一fc区)。这些构型的实例在图10a-10c中描绘。
在一个实施例中,四特异性分子包含对应于第一结合特异性(结合位点#1)的任选地经由接头连接至第一fc区的fab,其进一步包含第四结合特异性(例如,结合位点#4);以及任选地经由接头连接至第二fc区的第二结合特异性(例如,结合位点#2),其进一步包含第三结合特异性(例如,结合位点#3)(例如,如在图10a中描绘)。在其他实施例中,四特异性分子包含对应于第一结合特异性(结合位点#1)的任选地经由接头连接至第一fc区的fab,其进一步包含第三结合特异性(例如,结合位点#3);以及任选地经由接头连接至第二fc区的第二结合特异性(例如,结合位点#2),其进一步包含第四结合特异性(例如,结合位点#4)。
在一些实施例中,(a)第一结合特异性(例如,图10a-10c中的结合位点#1)是肿瘤靶向部分,例如与癌抗原(例如,肿瘤、基质或血液抗原)结合;并且第二、第三和第四结合特异性(例如,图10a中的结合位点#2-4)各自独立地选自细胞因子分子、或免疫细胞衔接子(例如,选自与免疫细胞抗原结合的受体、配体分子或抗体分子(例如,scfv))。在抗体分子是scfv的实施例中,scfv能以vh-vl或vl-vh构型连接至第一多肽的c-末端。
在一个实施例中,(a)第一结合特异性(例如,图10b中的结合位点#1)是肿瘤靶向部分,例如与癌抗原(例如,肿瘤、基质或血液抗原)结合;(b)第二结合特异性(例如,图10b中的结合位点#2)是选自与免疫细胞抗原结合的受体、配体分子或抗体分子(例如,scfv)的免疫细胞衔接子(例如,nk细胞衔接子);(c)第三结合特异性(例如,图10b中的结合位点#3)是细胞因子分子或免疫细胞衔接子;并且(d)第四结合特异性(例如,图10b中的结合位点#4)是选自与免疫细胞抗原结合的配体分子或抗体分子(例如,scfv)的免疫细胞衔接子(例如,巨噬细胞或树突细胞衔接子)。在抗体分子是scfv的实施例中,scfv能以vh-vl或vl-vh构型连接至第一多肽的c-末端。
在一个实施例中,(a)第一结合特异性(例如,图10c中的结合位点#1)是肿瘤靶向部分,例如与癌抗原(例如,肿瘤或基质抗原)结合;(b)第二结合特异性(例如,图10c中的结合位点#2)是选自与免疫细胞抗原结合的受体、配体分子或抗体分子(例如,scfv)的免疫细胞衔接子(例如,nk细胞衔接子);(c)第三结合特异性(例如,图10c中的结合位点#3)是选自与免疫细胞抗原结合的配体分子或抗体分子(例如,scfv)的免疫细胞衔接子(例如,巨噬细胞或树突细胞衔接子);并且(d)第四结合特异性(例如,图10c中的结合位点#4)是选自与免疫细胞抗原结合的配体分子或抗体分子(例如,scfv)的免疫细胞衔接子(例如,巨噬细胞或树突细胞衔接子)。在抗体分子是scfv的实施例中,scfv能以vh-vl或vl-vh构型连接至第一多肽的c-末端。
在实施例中,第一免疫球蛋白恒定区(例如,第一ch2-ch3区)包含突起或杵,例如如本文描述的。
在实施例中,第二免疫球蛋白恒定区(例如,第二ch2-ch3区)包含空腔或臼。在实施例中,第一和第二免疫球蛋白恒定区促进双特异性分子的异源二聚化。
肿瘤靶向部分
在一个实施例中,肿瘤靶向部分包括与间皮素结合的抗体分子(例如,fab或scfv)。在一些实施例中,间皮素的抗体分子包含来自以下的重链可变结构域序列的一个、两个、三个cdr:
qvqlqqsgpelekpgasvkisckasgysftgytmnwvkqshgkslewiglitpyngassynqkfrgkatltvdkssstaymdllsltsedsavyfcarggydgrgfdywgqgttvtvss(seqidno:1),或密切相关的cdr,例如与seqidno:1的cdr序列具有至少一个氨基酸改变,但不超过两个、三个或四个改变(例如,取代、缺失、或插入,例如保守取代)的cdr。
在一些实施例中,间皮素的抗体分子包含选自以下的一个、两个、三个cdr:gysftgytmn(seqidno:2);litpyngassynqkfrg(seqidno:3);和ggydgrgfdy(seqidno:4),或密切相关的cdr,例如具有至少一个氨基酸改变,但不超过两个、三个或四个改变(例如,取代、缺失、或插入,例如保守取代)的cdr。
在一些实施例中,间皮素的抗体分子由三个cdr(其中cdr1包含gysftgytmn(seqidno:2);cdr2包含:litpyngassynqkfrg(seqidno:3);并且cdr3包含ggydgrgfdy(seqidno:4))、或密切相关的cdr(例如,具有至少一个氨基酸改变,但不超过两个、三个或四个改变(例如,取代、缺失、或插入,例如保守取代)的cdr)组成。
在一些实施例中,间皮素的抗体分子由三个cdr(其中cdr1由gysftgytmn(seqidno:2)组成;cdr2由litpyngassynqkfrg(seqidno:3)组成;并且cdr3由ggydgrgfdy(seqidno:4)组成)、或密切相关的cdr(例如,具有至少一个氨基酸改变,但不超过两个、三个或四个改变(例如,取代、缺失、或插入,例如保守取代)的cdr)组成。
在实施例中,间皮素的抗体分子包含以下的重链可变结构域序列:
qvqlqqsgpelekpgasvkisckasgysftgytmnwvkqshgkslewiglitpyngassynqkfrgkatltvdkssstaymdllsltsedsavyfcarggydgrgfdywgqgttvtvss(seqidno:1)、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:1的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。在实施例中,间皮素的抗体分子是fab并且进一步包含具有以下氨基酸序列的重链恒定区(ch1):
astkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrvepkscdktht(seqidno:5)、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:5的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。在一些实施例中,抗体分子进一步包含信号肽,例如包含以下氨基酸序列的信号肽:mefglswvflvalfrgvqc(seqidno:6)。
可替代地,或与本文披露的间皮素的重链组合,间皮素的抗体分子包含来自以下的轻链可变结构域序列的一个、两个、三个cdr:
dieltqspaimsaspgekvtmtcsasssvsymhwyqqksgtspkrwiydtsklasgvpgrfsgsgsgnsysltissveaeddatyycqqwsgypltfgagtkleik(seqidno:7),或密切相关的cdr,例如与seqidno:7的cdr序列具有至少一个氨基酸改变,但不超过两个、三个或四个改变(例如,取代、缺失、或插入,例如保守取代)的cdr。
在一些实施例中,间皮素的抗体分子包含来自以下的一个、两个、三个cdr:sasssvsymh(seqidno:8);dtsklas(seqidno:9);和qqwsgyplt(seqidno:10),或密切相关的cdr,例如具有至少一个氨基酸改变,但不超过两个、三个或四个改变(例如,取代、缺失、或插入,例如保守取代)的cdr。
在一些实施例中,间皮素的抗体分子由三个cdr(其中cdr1包含sasssvsymh(seqidno:8);cdr2包含:dtsklas(seqidno:9);并且cdr3包含qqwsgyplt(seqidno:10))、或密切相关的cdr(例如,具有至少一个氨基酸改变,但不超过两个、三个或四个改变(例如,取代、缺失、或插入,例如保守取代)的cdr)组成。
在一些实施例中,间皮素的抗体分子由三个cdr(其中cdr1由sasssvsymh(seqidno:8)组成;cdr2由dtsklas(seqidno:9)组成;并且cdr3由qqwsgyplt(seqidno:10)组成)、或密切相关的cdr(例如,具有至少一个氨基酸改变,但不超过两个、三个或四个改变(例如,取代、缺失、或插入,例如保守取代)的cdr)组成。
在一些实施例中,间皮素的抗体分子包含以下的轻链可变结构域序列:dieltqspaimsaspgekvtmtcsasssvsymhwyqqksgtspkrwiydtsklasgvpgrfsgsgsgnsysltissveaeddatyycqqwsgypltfgagtkleik(seqidno:7)、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:7的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在一些实施例中,间皮素的抗体分子是fab并且进一步包含具有以下氨基酸序列的轻链恒定区(cl1):
rtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec(seqidno:11)、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:11的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。在实施例中,抗体分子进一步包含信号肽,例如包含以下氨基酸序列的信号肽:mkyllptaaagllllaaqpama(seqidno:12)。
在其他实施例中,多特异性分子(例如,肿瘤靶向部分)与基质抗原结合。在实施例中,基质抗原选自以下中的一种或多种:成纤维细胞激活蛋白酶(fap)、tgf-β、透明质酸、胶原(例如,胶原iv)、生腱蛋白c、或生腱蛋白w。
在一个实施例中,肿瘤靶向部分包括与fap(例如,人fap)结合的抗体分子(例如,fab或scfv)。在一些实施例中,fap的抗体分子包含来自图12c中以下划线描绘的重链可变结构域序列(seqidno:13)的一个、两个、三个cdr,或密切相关的cdr,例如与seqidno:13的cdr序列具有至少一个氨基酸改变,但不超过两个、三个或四个改变(例如,取代、缺失、或插入,例如保守取代)的cdr。在一些实施例中,fap的抗体分子包含在图12c中以下划线描绘的重链可变结构域序列(seqidno:13)、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:13的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在实施例中,fap的抗体分子是fab并且进一步包含具有以下氨基酸序列的重链恒定区(ch1):
astkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrvepksc(seqidno:14)、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:14的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。在实施例中,抗体分子进一步包含信号肽,例如包含以下氨基酸序列的信号肽:mefglswvflvalfrgvqcev(seqidno:15)。
可替代地,或与本文披露的fap的重链组合,fap的抗体分子包含来自图12d中以下划线描绘的轻链可变结构域序列(seqidno:16)的一个、两个、三个cdr,或密切相关的cdr,例如与seqidno:16的cdr序列具有至少一个氨基酸改变,但不超过两个、三个或四个改变(例如,取代、缺失、或插入,例如保守取代)的cdr。在一些实施例中,fap的抗体分子包含在图12d中以下划线描绘的轻链可变结构域序列(seqidno:16)、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:16的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在实施例中,fap的抗体分子是fab并且进一步包含具有以下氨基酸序列的轻链恒定区(cl1):
rtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec(seqidno:11)、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:11的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。在一些实施例中,抗体分子进一步包含信号肽,例如包含以下氨基酸序列的信号肽:mkyllptaaagllllaaqpama(seqidno:12)。
免疫细胞衔接子
在一个实施例中,nk细胞衔接子是nkp30的配体是b7-6,例如包含以下的氨基酸序列:
dlkvemmaggtqitplndnvtifcnifysqplnitsmgitwfwksltfdkevkvfeffgdhqeafrpgaivspwrlksgdaslrlpgiqleeageyrcevvvtplkaqgtvqlevvaspasrllldqvgmkenedkymcessgfypeainitwekqtqkfphpieisedvitgptiknmdgtfnvtsclklnssqedpgtvyqcvvrhaslhtplrsnftltaarhslsetektdnfs(seqidno:24)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:24的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在其他实施例中,nk细胞衔接子是选自mica、micb、或ulbp1的nkg2d的配体,例如,其中:
(i)mica包含以下氨基酸序列:
ephslrynltvlswdgsvqsgfltevhldgqpflrcdrqkcrakpqgqwaedvlgnktwdretrdltgngkdlrmtlahikdqkeglhslqeirvceihednstrssqhfyydgelflsqnletkewtmpqssraqtlamnvrnflkedamktkthyhamhadclqelrrylksgvvlrrtvppmvnvtrseasegnitvtcrasgfypwnitlswrqdgvslshdtqqwgdvlpdgngtyqtwvatricqgeeqrftcymehsgnhsthpvpsgkvlvlqshw(seqidno:25)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:25的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列;
(ii)micb包含以下氨基酸序列:
aephslrynlmvlsqdesvqsgflaeghldgqpflrydrqkrrakpqgqwaedvlgaktwdtetedltengqdlrrtlthikdqkgglhslqeirvceihedsstrgsrhfyydgelflsqnletqestvpqssraqtlamnvtnfwkedamktkthyramqadclqklqrylksgvairrtvppmvnvtcsevsegnitvtcrassfyprnitltwrqdgvslshntqqwgdvlpdgngtyqtwvatrirqgeeqrftcymehsgnhgthpvpsgkvlvlqsqrtd(seqidno:26)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:26的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列;或者
(iii)ulbp1包含以下氨基酸序列:
gwvdthclcydfiitpksrpepqwcevqglvderpflhydcvnhkakafaslgkkvnvtktweeqtetlrdvvdflkgqlldiqvenlipiepltlqarmsceheahghgrgswqflfngqkfllfdsnnrkwtalhpgakkmtekweknrdvtmffqkislgdckmwleeflmyweqmldptkppslapg
(seqidno:27)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:27的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在其他实施例中,nk细胞衔接子是选自nectin2或necl5的dnam1的配体,例如,其中:
(i)nectin2包含以下氨基酸序列:
qdvrvqvlpevrgqlggtvelpchllppvpglyislvtwqrpdapanhqnvaafhpkmgpsfpspkpgserlsfvsakqstgqdteaelqdatlalhgltvedegnytcefatfpkgsvrgmtwlrviakpknqaeaqkvtfsqdpttvalciskegrppariswlssldweaketqvsgtlagtvtvtsrftlvpsgradgvtvtckvehesfeepalipvtlsvryppevsisgyddnwylgrtdatlscdvrsnpeptgydwsttsgtfptsavaqgsqlvihavdslfnttfvctvtnavgmgraeqvifvretpntagagatgg(seqidno:28)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:28的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列;或者
(ii)necl5包含以下氨基酸序列:
wpppgtgdvvvqaptqvpgflgdsvtlpcylqvpnmevthvsqltwarhgesgsmavfhqtqgpsyseskrlefvaarlgaelrnaslrmfglrvedegnytclfvtfpqgsrsvdiwlrvlakpqntaevqkvqltgepvpmarcvstggrppaqitwhsdlggmpntsqvpgflsgtvtvtslwilvpssqvdgknvtckvehesfekpqlltvnltvyyppevsisgydnnwylgqneatltcdarsnpeptgynwsttmgplppfavaqgaqllirpvdkpinttlicnvtnalgarqaeltvqvkegppsehsgisrn(seqidno:29)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:29的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在还其他实施例中,nk细胞衔接子是作为nkg2d的衔接物的dap10的配体(参见例如,procnatlacadsciusa.[美国国家科学院院刊]2005年5月24日;102(21):7641–7646;和blood[血液],2011年9月15日第118卷,第11期,将其中每个的全部内容通过引用并入本文)。
在其他实施例中,nk细胞衔接子是作为cd16a/b配体的cd16的配体,例如进一步包含抗体fc区的cd16a/b配体(参见例如,frontimmunol.[免疫学前沿]2013;4:76讨论了抗体如何使用fc通过cd16触发nk细胞,将其全部内容并入本文)。
在其他实施例中,nk细胞衔接子是作为necl2的crtam的配体,例如,其中necl2包含以下氨基酸序列:
qnlftkdvtviegevatiscqvnksddsviqllnpnrqtiyfrdfrplkdsrfqllnfssselkvsltnvsisdegryfcqlytdppqesyttitvlvpprnlmidiqkdtavegeeievnctamaskpattirwfkgntelkgkseveewsdmytvtsqlmlkvhkeddgvpvicqvehpavtgnlqtqrylevqykpqvhiqmtyplqgltregdaleltceaigkpqpvmvtwvrvddempqhavlsgpnlfinnlnktdngtyrceasnivgkahsdymlyvydppttippptttttttttttttiltiitdsrageegsiravdh(seqidno:30)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:30的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在其他实施例中,nk细胞衔接子是作为cd70的cd27的配体,例如,其中cd70包含以下氨基酸序列:
qrfaqaqqqlpleslgwdvaelqlnhtgpqqdprlywqggpalgrsflhgpeldkgqlrihrdgiymvhiqvtlaicssttasrhhpttlavgicspasrsisllrlsfhqgctiasqrltplargdtlctnltgtllpsrntdetffgvqwvrp(seqidno:31)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:31的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在其他实施例中,nk细胞衔接子是作为l-选择素(cd62l)的psgl1的配体,例如,其中l-选择素包含以下氨基酸序列:
wtyhysekpmnwqrarrfcrdnytdlvaiqnkaeieylektlpfsrsyywigirkiggiwtwvgtnkslteeaenwgdgepnnkknkedcveiyikrnkdagkwnddachklkaalcytascqpwscsghgecveiinnytcncdvgyygpqcqfviqcepleapelgtmdcthplgnfsfssqcafscsegtnltgieettcgpfgnwsspeptcqviqceplsapdlgimncshplasfsftsactficsegteligkkkticessgiwsnpspicqkldksfsmikegdyn(seqidno:32)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:32的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在其他实施例中,nk细胞衔接子是作为necl5的cd96的配体,例如,其中necl5包含以下氨基酸序列:
wpppgtgdvvvqaptqvpgflgdsvtlpcylqvpnmevthvsqltwarhgesgsmavfhqtqgpsyseskrlefvaarlgaelrnaslrmfglrvedegnytclfvtfpqgsrsvdiwlrvlakpqntaevqkvqltgepvpmarcvstggrppaqitwhsdlggmpntsqvpgflsgtvtvtslwilvpssqvdgknvtckvehesfekpqlltvnltvyyppevsisgydnnwylgqneatltcdarsnpeptgynwsttmgplppfavaqgaqllirpvdkpinttlicnvtnalgarqaeltvqvkegppsehsgisrn(seqidno:29)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:29的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在其他实施例中,nk细胞衔接子是作为cd72的cd100(sema4d)的配体,例如,其中cd72包含以下氨基酸序列:
rylqvsqqlqqtnrvlevtnsslrqqlrlkitqlgqsaedlqgsrrelaqsqealqveqrahqaaegqlqacqadrqktketlqseeqqrraleqklsnmenrlkpfftcgsadtccpsgwimhqkscfyisltsknwqesqkqcetlssklatfseiypqshsyyflnsllpnggsgnsywtglssnkdwkltddtqrtrtyaqsskcnkvhktwswwtlesescrsslpyicemtafrfpd(seqidno:33)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:33的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在其他实施例中,nk细胞衔接子是作为clec2b(aicl)的nkp80的配体,例如,其中clec2b(aicl)包含以下氨基酸序列:
kltrdsqslcpydwigfqnkcyyfskeegdwnsskyncstqhadltiidnieemnflrrykcssdhwiglkmaknrtgqwvdgatftksfgmrgsegcaylsddgaatarcyterkwicrkrih(seqidno:34)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:34的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在其他实施例中,nk细胞衔接子是作为cd48的cd244的配体,例如,其中cd48包含以下氨基酸序列:
qghlvhmtvvsgsnvtlniseslpenykqltwfytfdqkivewdsrkskyfeskfkgrvrldpqsgalyiskvqkednstyimrvlkktgneqewkiklqvldpvpkpvikiekiedmddncylklscvipgesvnytwygdkrpfpkelqnsvlettlmphnysrcytcqvsnsvsskngtvclsppctlars(seqidno:35)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:35的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在其他实施例中,树突细胞衔接子选自以下中的一种或多种:cd2激动剂、ox40抗体、ox40l、41bb激动剂、toll样受体(例如,tlr4,例如组成型活性tlr4(catlr4))激动剂或其片段、cd47激动剂、或sting激动剂。
在一个实施例中,ox40l包含以下氨基酸序列:
qvshrypriqsikvqfteykkekgfiltsqkedeimkvqnnsviincdgfylislkgyfsqevnislhyqkdeeplfqlkkvrsvnslmvasltykdkvylnvttdntslddfhvnggelilihqnpgefcvl(seqidno:36)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:36的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在另一个实施例中,cd40l包含以下氨基酸序列:
mqkgdqnpqiaahviseasskttsvlqwaekgyytmsnnlvtlengkqltvkrqglyyiyaqvtfcsnreassqapfiaslclkspgrferillraanthssakpcgqqsihlggvfelqpgasvfvnvtdpsqvshgtgftsfgllkl(seqidno:37)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:37的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在还其他实施例中,sting激动剂包含环状二核苷酸,例如环状二-gmp(cdgmp)、环状二-amp(cdamp)、或其组合,任选地具有2’,5’或3’,5’磷酸酯键。
在一个实施例中,免疫细胞衔接子包括例如包含以下氨基酸序列的41bb配体:
acpwavsgaraspgsaasprlregpelspddpaglldlrqgmfaqlvaqnvllidgplswysdpglagvsltgglsykedtkelvvakagvyyvffqlelrrvvagegsgsvslalhlqplrsaagaaalaltvdlppassearnsafgfqgrllhlsagqrlgvhlhteararhawqltqgatvlglfrvtpeipaglpsprse(seqidno:38)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:38的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
细胞因子分子
在一些实施例中,本文披露的多特异性分子包含细胞因子分子。在实施例中,细胞因子分子包括全长细胞因子、细胞因子的片段或细胞因子的变体;细胞因子受体结构域,例如细胞因子受体二聚化结构域;或细胞因子受体的激动剂,例如细胞因子受体的抗体分子(例如,激动性抗体)。在一些实施例中,细胞因子是单链细胞因子。在一些实施例中,细胞因子包含2条或者2条或更多条多肽链。示例性多链细胞因子分子是il12。
在一些实施例中,细胞因子分子选自白介素-2(il-2)、白介素-12(il-12)、白介素-15(il-15)、白介素-18(il-18)、白介素-21(il-21)、白介素-7(il-7)、或干扰素γ、或其片段或变体、或任何前述细胞因子的组合。细胞因子分子可以是单体或二聚体。在实施例中,细胞因子分子可以进一步包含细胞因子受体二聚化结构域。
在其他实施例中,细胞因子分子是细胞因子受体的激动剂,例如选自il-15ra或il-21r的细胞因子受体的抗体分子(例如,激动性抗体)。
在一个实施例中,细胞因子分子是il-15,例如人il-15(例如,包含以下氨基酸序列:
nwvnvisdlkkiedliqsmhidatlytesdvhpsckvtamkcfllelqvislesgdasihdtvenliilannslssngnvtesgckeceeleeknikeflqsfvhivqmfints(seqidno:17)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:17的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在一些实施例中,细胞因子分子包含受体二聚化结构域,例如il15rα二聚化结构域。在一个实施例中,il15rα二聚化结构域包含以下氨基酸序列:maprrargcrtlglpalllllllrppatrgitcpppmsvehadiwvksyslysreryicnsgfkrkagtssltecvl(seqidno:40)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:40的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。在一些实施例中,多特异性分子的细胞因子分子(例如,il-15)和受体二聚化结构域(例如,il15rα二聚化结构域)例如经由接头(例如,gly-ser接头,例如包含氨基酸序列sggsggggsgggsggggslq(seqidno:19)的接头)共价连接。在其他实施例中,多特异性分子的细胞因子分子(例如,il-15)和受体二聚化结构域(例如,il15rα二聚化结构域)不是共价连接的,例如是非共价缔合的。
在其他实施例中,细胞因子分子是il-2,例如人il-2(例如,包含以下氨基酸序列:
aptssstkktqlqlehllldlqmilnginnyknpkltrmltfkfympkkatelkhlqcleeelkpleevlnlaqsknfhlrprdlisninvivlelkgsettfmceyadetativeflnrwitfcqsiistlt(seqidno:20)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:20的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在其他实施例中,细胞因子分子是il-18,例如人il-18(例如,包含以下氨基酸序列:
yfgklesklsvirnlndqvlfidqgnrplfedmtdsdcrdnaprtifiismykdsqprgmavtisvkcekistlscenkiisfkemnppdnikdtksdiiffqrsvpghdnkmqfesssyegyflacekerdlfklilkkedelgdrsimftvqned(seqidno:41)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:41的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在其他实施例中,细胞因子分子是il-21,例如人il-21(例如,包含以下氨基酸序列:
qgqdrhmirmrqlidivdqlknyvndlvpeflpapedvetncewsafscfqkaqlksantgnneriinvsikklkrkppstnagrrqkhrltcpscdsyekkppkeflerfksllqkmihqhlssrthgseds(seqidno:22)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:22的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在还其他实施例中,细胞因子分子是干扰素γ,例如人干扰素γ(例如,包含以下氨基酸序列:
qdpyvkeaenlkkyfnaghsdvadngtlflgilknwkeesdrkimqsqivsfyfklfknfkddqsiqksvetikedmnvkffnsnkkkrddfekltnysvtdlnvqrkaiheliqvmaelspaaktgkrkrsqmlfrg(seqidno:23)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:23的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
接头
本文披露的多特异性分子可以进一步包含接头,例如在以下中的一种或多种之间的接头:靶向部分与细胞因子分子、靶向部分与免疫细胞衔接子、细胞因子分子与免疫细胞衔接子、细胞因子分子与免疫球蛋白链恒定区(例如,fc区)、靶向部分与免疫球蛋白链恒定区、或免疫细胞衔接子与免疫球蛋白链恒定区。在实施例中,接头选自:可切割接头、不可切割接头、肽接头、柔性接头、刚性接头、螺旋接头、或非螺旋接头、或其组合。
在一个实施例中,多特异性分子可以包含一个、两个、三个或四个接头,例如肽接头。在一个实施例中,肽接头包含gly和ser。示例性肽接头在本文披露的附图(例如,图11b-11c、12b、13b-c、14a-b)中描绘,例如,肽接头选自:ggggs(seqidno:42);ggggsggggs(seqidno:43);ggggsggggsggggs(seqidno:44);或dvpsgpgggggsggggs(seqidno:45)。
示例性的多特异性构型:
在一些实施例中,本文披露的任何多特异性分子可以包含:
(i)肿瘤靶向部分,其包括:
(a)针对选自以下的实体瘤抗原的抗体分子:间皮素、gd2、pmsa、cea、ron激酶、或c-met;和/或
(b)针对选自以下的基质抗原的抗体分子:fap、透明质酸、胶原iv、生腱蛋白c、或生腱蛋白w;或者
(c)针对实体瘤抗原的抗体分子和针对基质抗原的抗体分子的组合;以及
(ii)以下中的一种或两种:
(a)选自以下中的一种、两种、三种、或全部的免疫细胞衔接子:cd40l或cd70配体;与cd40或cd70结合的抗体分子;ox40的抗体分子;ox40l;b7h6、41bb配体(41bbl)、或sting激动剂、或其组合;或者
(b)选自il-2、il-12、il-15、il-18、il-7、或il-21、其片段或变体、或细胞因子受体的抗体分子(例如,il-15ra、或il-21r的抗体(例如,激动性抗体))、或任何前述的组合的细胞因子分子。
在一些实施例中,肿瘤靶向部分是与间皮素、psca或fap结合的抗体分子。在一些实施例中,免疫细胞衔接子是与nkp30或cd16结合的抗体分子。在其他实施例中,免疫细胞衔接子选自cd40配体(cd40l)、b7h6或41bb配体(41bbl)。在其他实施例中,细胞因子分子选自il-15或il-21、或细胞因子受体的激动剂(例如,il-15ra或il-21r的抗体分子(例如,激动性抗体))。
在一些实施例中,双特异性分子选自:(i)间皮素的抗体分子和nkp30的抗体分子;(ii)间皮素的抗体分子和cd16的抗体分子;(iii)psca的抗体分子和nkp30的抗体分子;(iv)psca的抗体分子和cd16的抗体分子;(v)fap的抗体分子和nkp30的抗体分子;(vi)fap的抗体分子和cd16的抗体分子;(vii)fap的抗体分子和il-15分子;(viii)fap的抗体分子和il-15ra的抗体分子(例如,激动性抗体);(ix)fap的抗体分子和il-21的抗体分子(例如,激动性抗体);或(x)fap的抗体分子和的il-21r的抗体分子(例如,激动性抗体)。
在其他实施例中,三特异性分子包含肿瘤靶向部分,所述肿瘤靶向部分选自间皮素的抗体分子、psca的抗体分子或fap的抗体分子;免疫细胞衔接子,例如选自nkp30的抗体分子或cd16的抗体分子的nk细胞衔接子;或选自cd40l、ox40l、或cd40的抗体分子或ox40的抗体分子的巨噬细胞衔接子;以及细胞因子分子,所述细胞因子分子选自il-15、il-21、il-15ra的抗体或il-21r的抗体。示例性组合包括但不限于:(i)间皮素的抗体分子;cd40l多肽;和il-15分子;(ii)间皮素的抗体分子;cd40l多肽;和il-15分子;(iii)间皮素的抗体分子;与nkp30结合的抗体分子;和il-15分子;(iv)间皮素的抗体分子;与cd16结合的抗体分子;和il-15分子;(v)psca的抗体分子;与nkp30结合的抗体分子;和il-15分子;(vi)psca的抗体分子;与cd16结合的抗体分子;和il-15分子;(vii)psca的抗体分子;与cd16结合的抗体分子;和il-21分子;或(viii)间皮素的抗体分子;与cd16结合的抗体分子;和il-21分子。
在其他实施例中,四特异性分子包含(i)间皮素(例如,人间皮素)的抗体分子;cd40l多肽;il-15分子;和b7h6;(ii)fap(例如,人间皮素)的抗体分子;cd40l多肽;il-15分子;和b7h6;或(iii)间皮素(例如,人间皮素)的抗体分子;cd40l多肽;il-21分子;和41bbl。
在一些实施例中,多特异性分子包含间皮素(例如,人间皮素)的抗体分子;cd40l多肽;和il-15分子。在一个实施例中,抗体分子包括针对间皮素的具有轻链和重链的fab。在实施例中,针对间皮素的fab的重链进一步包含il-15分子(例如,人il-15分子),任选地,其中fab和il-15分子例如经由包含gly和ser的接头连接。在一些实施例中,多特异性分子具有以下构型:针对间皮素的fab的重链(例如,vh–ch1)至il-15,从n-至c-末端,任选地包含在fab与il-15之间的gly-ser接头。在一些实施例中,多特异性分子包含以下氨基酸序列:
qvqlqqsgpelekpgasvkisckasgysftgytmnwvkqshgkslewiglitpyngassynqkfrgkatltvdkssstaymdllsltsedsavyfcarggydgrgfdywgqgttvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrvepkscdkthtggggsggggsggggsnwvnvisdlkkiedliqsmhidatlytesdvhpsckvtamkcfllelqvislesgdasihdtvenliilannslssngnvtesgckeceeleeknikeflqsfvhivqmfints(seqidno:46)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:46的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在实施例中,间皮素的fab的轻链进一步包含cd40l,任选地,其中fab和cd40l例如经由包含gly和ser的接头连接。在一个实施例中,多特异性分子具有以下构型:间皮素的fab的轻链(例如,vl–cl1)融合至cd40l,从n-至c-末端,任选地包含在fab与cd40l之间的gly-ser接头。在实施例中,多特异性分子包含以下氨基酸序列:
dieltqspaimsaspgekvtmtcsasssvsymhwyqqksgtspkrwiydtsklasgvpgrfsgsgsgnsysltissveaeddatyycqqwsgypltfgagtkleikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgecdvpsgpgggggsggggsmqkgdqnpqiaahviseasskttsvlqwaekgyytmsnnlvtlengkqltvkrqglyyiyaqvtfcsnreassqapfiaslclkspgrferillraanthssakpcgqqsihlggvfelqpgasvfvnvtdpsqvshgtgftsfgllkl(seqidno:47)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:47的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在其他实施例中,多特异性分子包含fap(例如,人fap)的抗体分子、和il-15分子。在一些实施例中,抗体分子包括针对fap的具有轻链和重链的fab。fap的fab的重链可以进一步包含第一fc区,所述第一fc区在第一fc区的fc界面具有成对空腔-突起(杵臼结构)的成员。例如,多特异性分子可以具有以下构型:fap的fab的重链(例如,vh–ch1)融合至第一fc区(例如,ch2至ch3),从n-至c-末端,例如包含以下氨基酸序列:qvqlvqsgaevkkpgasvkvscktsrytfteytihwvrqapgqrlewigginpnngipnynqkfkgrvtitvdtsastaymelsslrsedtavyycarrriaygydeghamdywgqgtlvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvctlppsreemtknqvslscavkgfypsdiavewesngqpennykttppvldsdgsfflvskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk(seqidno:48)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:48的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在实施例中,fap的fab的轻链包含以下氨基酸序列:
divmtqspdslavslgeratinckssqsllysrnqknylawyqqkpgqppkllifwastresgvpdrfsgsgfgtdftltisslqaedvavyycqqyfsypltfgqgtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec,(seqidno:49)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:49的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在实施例中,il-15分子(例如,人il-15分子)进一步包含第二fc区,所述第二fc区在第二fc区的fc界面具有成对空腔-突起(杵臼结构)的第二成员,例如经由包含gly和ser的接头连接。在一个实施例中,多特异性分子具有以下构型:il-15分子-第二fc区(例如,ch2至ch3),从n-至c-末端,例如,其中il-15分子和第二fc区经由包含gly和ser的接头连接,例如包含以下氨基酸序列:
nwvnvisdlkkiedliqsmhidatlytesdvhpsckvtamkcfllelqvislesgdasihdtvenliilannslssngnvtesgckeceeleeknikeflqsfvhivqmfintsggggsdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppcreemtknqvslwclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk,(seqidno:50)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:50的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在其他实施例中,包含fap(例如,人fap)的抗体分子、和il-15分子的多特异性分子进一步包含免疫细胞衔接子,例如如本文描述的(例如,cd40配体)。在一些实施例中,免疫细胞增强子连接(例如,共价连接)至第二fc区和il-15分子(例如,人il-15分子),所述第二fc区具有成对空腔-突起(杵臼结构)的第二成员,任选地在il-15分子与第二fc区之间、和/或在第二fc区与免疫细胞增强子之间包含接头,所述接头包含gly和ser。在实施例中,多特异性分子具有以下构型:il-15分子-第二fc区(例如,ch2至ch3)–免疫细胞增强子,从n-至c-末端,任选地在il-15分子与第二fc区之间、和/或在第二fc区与免疫细胞增强子之间包含接头,所述接头包含gly和ser,例如,其包含以下氨基酸序列:
nwvnvisdlkkiedliqsmhidatlytesdvhpsckvtamkcfllelqvislesgdasihdtvenliilannslssngnvtesgckeceeleeknikeflqsfvhivqmfintsggggsdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppcreemtknqvslwclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgkggggsmqkgdqnpqiaahviseasskttsvlqwaekgyytmsnnlvtlengkqltvkrqglyyiyaqvtfcsnreassqapfiaslclkspgrferillraanthssakpcgqqsihlggvfelqpgasvfvnvtdpsqvshgtgftsfgllkl,(seqidno:51)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:51的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在其他实施例中,包含fap(例如,人fap)的抗体分子、il-15分子、和cd40配体的多特异性分子进一步包含第二免疫细胞增强子,例如b7h6分子。在一些实施例中,第二免疫细胞增强子连接(例如,共价连接)至第一fc区和fab的重链,所述第一fc区在第一fc区的fc界面具有成对空腔-突起(杵臼结构)的第一成员,任选地在b7h6分子与第一fc区之间包含接头,所述接头包含gly和ser。在实施例中,多特异性分子具有以下构型:fap的fab的重链(例如,vh–ch1)融合至-第一fc区(例如,ch2至ch3)融合至–b7h6分子,从n-至c-末端,任选地在第一fc区与b7h6分子之间包含接头,所述接头包含gly和ser,例如包含以下氨基酸序列:
qvqlvqsgaevkkpgasvkvscktsrytfteytihwvrqapgqrlewigginpnngipnynqkfkgrvtitvdtsastaymelsslrsedtavyycarrriaygydeghamdywgqgtlvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvctlppsreemtknqvslscavkgfypsdiavewesngqpennykttppvldsdgsfflvskltvdksrwqqgnvfscsvmhealhnhytqkslslspgkggggsdlkvemmaggtqitplndnvtifcnifysqplnitsmgitwfwksltfdkevkvfeffgdhqeafrpgaivspwrlksgdaslrlpgiqleeageyrcevvvtplkaqgtvqlevvaspasrllldqvgmkenedkymcessgfypeainitwekqtqkfphpieisedvitgptiknmdgtfnvtsclklnssqedpgtvyqcvvrhaslhtplrsnftltaarhslsetektdnfs(seqidno:52)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:52的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在另一方面,本发明的特征在于多特异性分子,所述多特异性分子包含:
包含以下的第一氨基酸序列:nwvnvisdlkkiedliqsmhidatlytesdvhpsckvtamkcfllelqvislesgdasihdtvenliilannslssngnvtesgckeceeleeknikeflqsfvhivqmfintsggggsdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppcreemtknqvslwclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk(seqidno:50)或与其基本上同源的氨基酸序列,其中所述氨基酸序列包含il-15多肽、接头、和免疫球蛋白fc;
包含以下的第二氨基酸序列:
qvqlvqsgaevkkpgasvkvscktsrytfteytihwvrqapgqrlewigginpnngipnynqkfkgrvtitvdtsastaymelsslrsedtavyycarrriaygydeghamdywgqgtlvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvctlppsreemtknqvslscavkgfypsdiavewesngqpennykttppvldsdgsfflvskltvdksrwqqgnvfscsvmhealhnhytqkslslspgkggggs(seqidno:53)或与其基本上同源的氨基酸序列,其中所述氨基酸序列包含fab的抗fap重链和免疫球蛋白fc;以及
包含以下的第三氨基酸序列:
divmtqspdslavslgeratinckssqsllysrnqknylawyqqkpgqppkllifwastresgvpdrfsgsgfgtdftltisslqaedvavyycqqyfsypltfgqgtkveik
rtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec(seqidno:54)或与其基本上同源的氨基酸序列,其中所述氨基酸序列包含抗fapfab的人κ轻链。
在一些实施例中,第一氨基酸序列进一步包含:mefglswvflvalfrgvqc(seqidno:6)或与其基本上同源的氨基酸序列。在一些实施例中,第二氨基酸序列进一步包含:mefglswvflvalfrgvqcev(seqidno:15)或与其基本上同源的氨基酸序列。在一些实施例中,第三氨基酸序列进一步包含:mkyllptaaagllllaaqpama(seqidno:12)或与其基本上同源的氨基酸序列。
在另一方面,本发明的特征在于多特异性分子,所述多特异性分子包含:
包含以下的第一氨基酸序列:
mefglswvflvalfrgvqc
nwvnvisdlkkiedliqsmhidatlytesdvhpsckvtamkcfllelqvislesgdasihdtvenliilannslssngnvtesgckeceeleeknikeflqsfvhivqmfintsggggsdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppcreemtknqvslwclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk(seqidno:50)或与其基本上同源的氨基酸序列,其中所述氨基酸序列包含前导肽、il-15、接头、和免疫球蛋白fc;
包含以下的第二氨基酸序列:
mefglswvflvalfrgvqcevqvqlvqsgaevkkpgasvkvscktsrytfteytihwvrqapgqrlewigginpnngipnynqkfkgrvtitvdtsastaymelsslrsedtavyycarrriaygydeghamdywgqgtlvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvctlppsreemtknqvslscavkgfypsdiavewesngqpennykttppvldsdgsfflvskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk(seqidno:55)或与其基本上同源的氨基酸序列,其中所述氨基酸序列包含前导肽、fab的抗fap重链和免疫球蛋白fc;以及
包含以下的第三氨基酸序列:
divmtqspdslavslgeratinckssqsllysrnqknylawyqqkpgqppkllifwastresgvpdrfsgsgfgtdftltisslqaedvavyycqqyfsypltfgqgtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec(seqidno:49)或与其基本上同源的氨基酸序列,其中所述氨基酸序列包含前导肽和抗fapfab的人κ轻链。
在另一方面,本发明的特征在于多特异性分子,所述多特异性分子包含:
包含以下的第一氨基酸序列:
qvqlqqsgpelekpgasvkisckasgysftgytmnwvkqshgkslewiglitpyngassynqkfrgkatltvdkssstaymdllsltsedsavyfcarggydgrgfdywgqgttvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrvepkscdkthtggggsggggsggggsnwvnvisdlkkiedliqsmhidatlytesdvhpsckvtamkcfllelqvislesgdasihdtvenliilannslssngnvtesgckeceeleeknikeflqsfvhivqmfints(seqidno:46)或与其基本上同源的氨基酸序列,其中所述氨基酸序列包含fab的抗间皮素重链、接头、和il-15;以及
包含以下的第二氨基酸序列:
dieltqspaimsaspgekvtmtcsasssvsymhwyqqksgtspkrwiydtsklasgvpgrfsgsgsgnsysltissveaeddatyycqqwsgypltfgagtkleik
rtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec
dvpsgpgggggsggggsmqkgdqnpqiaahviseasskttsvlqwaekgyytmsnnlvtlengkqltvkrqglyyiyaqvtfcsnreassqapfiaslclkspgrferillraanthssakpcgqqsihlggvfelqpgasvfvnvtdpsqvshgtgftsfgllkl(seqidno:56)或与其基本上同源的氨基酸序列,其中所述氨基酸序列包含抗间皮素fab的人κ轻链、接头、和cd40l。
在一些实施例中,第一氨基酸序列进一步包含:mefglswvflvalfrgvqc(seqidno:6)或与其基本上同源的氨基酸序列。在一些实施例中,第二氨基酸序列进一步包含:mkyllptaaagllllaaqpama(seqidno:12)或与其基本上同源的氨基酸序列。
在另一方面,本发明的特征在于多特异性分子,所述多特异性分子包含:
包含以下的第一氨基酸序列:
mefglswvflvalfrgvqcqvqlqqsgpelekpgasvkisckasgysftgytmnwvkqshgkslewiglitpyngassynqkfrgkatltvdkssstaymdllsltsedsavyfcarggydgrgfdywgqgttvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrvepkscdkthtggggsggggsggggsnwvnvisdlkkiedliqsmhidatlytesdvhpsckvtamkcfllelqvislesgdasihdtvenliilannslssngnvtesgckeceeleeknikeflqsfvhivqmfints(seqidno:46)或与其基本上同源的氨基酸序列,其中所述氨基酸序列包含前导肽、fab的抗间皮素重链、接头、和il-15;以及
包含以下的第二氨基酸序列:
mkyllptaaagllllaaqpama
dieltqspaimsaspgekvtmtcsasssvsymhwyqqksgtspkrwiydtsklasgvpgrfsgsgsgnsysltissveaeddatyycqqwsgypltfgagtkleikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgecdvpsgpgggggsggggsmqkgdqnpqiaahviseasskttsvlqwaekgyytmsnnlvtlengkqltvkrqglyyiyaqvtfcsnreassqapfiaslclkspgrferillraanthssakpcgqqsihlggvfelqpgasvfvnvtdpsqvshgtgftsfgllkl(seqidno:47)或与其基本上同源的氨基酸序列,其中所述氨基酸序列包含前导肽、抗间皮素fab的人κ轻链、接头、和cd40l。
在另一方面,本发明的特征在于多特异性分子,所述多特异性分子包含:
包含以下的第一氨基酸序列:
nwvnvisdlkkiedliqsmhidatlytesdvhpsckvtamkcfllelqvislesgdasihdtvenliilannslssngnvtesgckeceeleeknikeflqsfvhivqmfints
ggggsdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppcreemtknqvslwclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgkggggsmqkgdqnpqiaahviseasskttsvlqwaekgyytmsnnlvtlengkqltvkrqglyyiyaqvtfcsnreassqapfiaslclkspgrferillraanthssakpcgqqsihlggvfelqpgasvfvnvtdpsqvshgtgftsfgllkl(seqidno:51)或与其基本上同源的氨基酸序列,其中所述氨基酸序列包含il-15、接头、和免疫球蛋白fc、接头、和cd40l;
包含以下的第二氨基酸序列:
qvqlvqsgaevkkpgasvkvscktsrytfteytihwvrqapgqrlewigginpnngipnynqkfkgrvtitvdtsastaymelsslrsedtavyycarrriaygydeghamdywgqgtlvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvctlppsreemtknqvslscavkgfypsdiavewesngqpennykttppvldsdgsfflvskltvdksrwqqgnvfscsvmhealhnhytqkslslspgkggggs
dlkvemmaggtqitplndnvtifcnifysqplnitsmgitwfwksltfdkevkvfeffgdhqeafrpgaivspwrlksgdaslrlpgiqleeageyrcevvvtplkaqgtvqlevvaspasrllldqvgmkenedkymcessgfypeainitwekqtqkfphpieisedvitgptiknmdgtfnvtsclklnssqedpgtvyqcvvrhaslhtplrsnftltaarhslsetektdnfs(seqidno:52)或与其基本上同源的氨基酸序列,其中所述氨基酸序列包含fab的抗b7h6重链和免疫球蛋白fc、接头、和b7h6;以及
包含以下的第三氨基酸序列:
divmtqspdslavslgeratinckssqsllysrnqknylawyqqkpgqppkllifwastresgvpdrfsgsgfgtdftltisslqaedvavyycqqyfsypltfgqgtkveik
rtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec(seqidno:57)或与其基本上同源的氨基酸序列,其中所述氨基酸序列包含抗fapfab的人κ轻链。
在一些实施例中,第一氨基酸序列进一步包含:mefglswvflvalfrgvqc(seqidno:6)或与其基本上同源的氨基酸序列。在一些实施例中,第二氨基酸序列进一步包含:mefglswvflvalfrgvqcev(seqidno:15)或与其基本上同源的氨基酸序列。在一些实施例中,第三氨基酸序列进一步包含:mkyllptaaagllllaaqpama(seqidno:12)或与其基本上同源的氨基酸序列。
在另一方面,本发明的特征在于多特异性分子,所述多特异性分子包含:
包含以下的第一氨基酸序列:
mefglswvflvalfrgvqcnwvnvisdlkkiedliqsmhidatlytesdvhpsckvtamkcfllelqvislesgdasihdtvenliilannslssngnvtesgckeceeleeknikeflqsfvhivqmfintsggggsdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppcreemtknqvslwclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgkggggsmqkgdqnpqiaahviseasskttsvlqwaekgyytmsnnlvtlengkqltvkrqglyyiyaqvtfcsnreassqapfiaslclkspgrferillraanthssakpcgqqsihlggvfelqpgasvfvnvtdpsqvshgtgftsfgllkl(seqidno:58)或与其基本上同源的氨基酸序列,其中所述氨基酸序列包含前导肽、il-15、接头、和免疫球蛋白fc、接头、和cd40l;
包含以下的第二氨基酸序列(或与其基本上同源):
mefglswvflvalfrgvqcevqvqlvqsgaevkkpgasvkvscktsrytfteytihwvrqapgqrlewigginpnngipnynqkfkgrvtitvdtsastaymelsslrsedtavyycarrriaygydeghamdywgqgtlvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvctlppsreemtknqvslscavkgfypsdiavewesngqpennykttppvldsdgsfflvskltvdksrwqqgnvfscsvmhealhnhytqkslslspgkggggsdlkvemmaggtqitplndnvtifcnifysqplnitsmgitwfwksltfdkevkvfeffgdhqeafrpgaivspwrlksgdaslrlpgiqleeageyrcevvvtplkaqgtvqlevvaspasrllldqvgmkenedkymcessgfypeainitwekqtqkfphpieisedvitgptiknmdgtfnvtsclklnssqedpgtvyqcvvrhaslhtplrsnftltaarhslsetektdnfs
(seqidno:59)或与其基本上同源的氨基酸序列,其中所述氨基酸序列包含前导肽、fab的抗fap重链和免疫球蛋白fc、接头、和b7h6;以及
包含以下的第三氨基酸序列:
mkyllptaaagllllaaqpamadivmtqspdslavslgeratinckssqsllysrnqknylawyqqkpgqppkllifwastresgvpdrfsgsgfgtdftltisslqaedvavyycqqyfsypltfgqgtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec(seqidno:60)或与其基本上同源的氨基酸序列,其中所述氨基酸序列包含前导肽和抗fapfab的人κ轻链。
示例性的三特异性分子包含针对间皮素肿瘤抗原的fab分子,其中第一多肽包含经由接头连接至il-15细胞因子的fab的重链vh-ch1,并且fab的第二多肽包含经由接头连接至cd40配体(cd40l)的轻链vl-cl(图11a-11c)。图11b从n-至c-方向提供了如下的氨基酸序列:任选的信号肽(以斜体显示),随后是fab的重链vh-ch1(对于vh和ch1分别以下划线和黑体显示),经由gly-ser接头(以斜体显示)连接至人il-15细胞因子(以常规字体显示)。图11c从n-至c-方向提供了如下的氨基酸序列:任选的信号肽(以斜体显示),随后是fab的κ轻链vl-cl(对于vl和cl分别以下划线和黑体显示),经由gly-ser接头(以斜体显示)连接至人cd40l(以橙色显示)。
示例性的双特异性分子包含针对基质抗原的fab分子,其中第一多肽包含连接至具有空腔的第一fc分子的基质抗原的fab的重链vh-ch1;第二多肽包含连接至具有突起的第二fc分子的il-15细胞因子;并且第三多肽包含基质抗原的fab的轻链vl-cl(图12a)。图12b从n-至c-方向提供了如下的氨基酸序列:任选的信号肽(以斜体显示),随后是人il-15细胞因子(以常规字体显示),并且进一步包含连接至具有突起的第二fc分子(以斜体显示)的任选的gly-ser接头(以斜体显示)。图12c从n-至c-方向提供了如下的氨基酸序列:任选的信号肽(以斜体显示),随后是基质抗原fap的fab的重链vh-ch1(对于vh和ch1分别以下划线和黑体显示),连接至具有空腔的第一fc分子(以常规字体显示)。图12d从n-至c-方向提供了如下的氨基酸序列:任选的信号肽(以斜体显示),随后是基质抗原fap的fab的κ轻链vl-cl(对于vl和cl分别以下划线和黑体显示)。
示例性的四特异性分子包含针对间皮素抗原的fab分子,其中第一多肽包含连接至在ch3区具有突起(杵)的第一fc分子的间皮素抗原的fab的重链vh-ch1,并且进一步包含第一免疫细胞衔接子,例如41bb配体;第二多肽包含任选地经由gly-ser接头连接至具有空腔(臼)的第二fc分子的il-21细胞因子,并且进一步包含(例如经由gly-ser接头)第二免疫细胞衔接子,例如cd40l;并且第三多肽包含间皮素抗原的fab的轻链vl-cl(分子a)(图14a-14b)。包括以下氨基酸序列:(i)分别对应于间皮素fab的重链和轻链的分子a(hmeso_ss1_fab);(ii)对应于人il-21的分子b;(iii)分子b与第二fc区之间的接头(分子b至kih_fc接头);(iv)第一fc区与分子c之间的接头(kih_fc至分子c接头);(v)对应于人41bb配体的分子c;(vi)第二fc区与分子d之间的接头(kih_fc至分子d接头);(vii)对应于人cd40l的分子c;(viii)第一成员fc区(fc杵),从n至c方向包含间皮素fab的vh、ch2-ch3氨基酸序列(包括在位置366处的w取代为t),随后是gly-ser接头和人41bb配体;和(ix)第二成员fc区(fc臼),从n至c方向包含人il-21、gly-ser接头、ch2-ch3氨基酸序列(包括在位置366处的s取代为t,在位置368处的a取代为l,在位置407处的v取代为y),随后是gly-ser接头和人cd40l。
示例性的四特异性分子包含针对基质抗原的fab分子,其中第一多肽包含连接至具有空腔的第一fc分子的基质抗原的fab的重链vh-ch1,并且进一步包含第一免疫细胞衔接子(b7h6);第二多肽包含任选地经由gly-ser接头连接至具有突起的第二fc分子的il-15细胞因子,并且进一步包含(例如经由gly-ser接头)第二免疫细胞衔接子(cd40l);并且第三多肽包含基质抗原的fab的轻链vl-cl(图13a)。图13b从n-至c-方向提供了如下的氨基酸序列:任选的信号肽(以斜体显示),随后是人il-15细胞因子(以常规字体显示),进一步包含连接至具有突起的第二fc分子(以常规字体显示)的任选的gly-ser接头(以斜体显示),其进一步包括例如连接至人cd40l氨基酸序列(以斜体显示)的任选的gly-ser接头(以斜体显示)。图13c从n-至c-方向提供了如下的氨基酸序列:任选的信号肽(以斜体显示),随后是基质抗原fap的fab的重链vh-ch1(对于vh和ch1分别以下划线和黑体显示),连接至具有空腔的第一fc分子(以常规字体显示),其进一步包括例如连接至人b7h6氨基酸序列(以蓝色显示)的任选的gly-ser接头(以斜体显示)。图13d从n-至c-方向提供了如下的氨基酸序列:任选的信号肽(以斜体显示),随后是基质抗原fap的fab的κ轻链vl-cl(对于vl和cl分别以下划线和黑体显示)。
包含基质修饰部分的示例性的多特异性分子
本披露尤其涉及新颖的多功能(例如,多特异性)分子,所述分子包含(i)基质修饰部分和(ii)与肿瘤抗原或基质抗原结合的肿瘤靶向部分(例如,抗体分子、配体分子、或受体分子)。不受理论束缚,据信本文披露的多功能分子尤其靶向(例如,定位于)癌症位点,并改变肿瘤基质,例如改变癌症位点附近的肿瘤微环境。多功能分子可以进一步包含以下中的一种或两种:免疫细胞衔接子(例如,选自nk细胞衔接子、t细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子中的一种、两种、三种、或全部);和/或细胞因子分子。因此,本文尤其提供了包含前述部分的多功能(例如,多特异性)分子、编码所述分子的核酸、产生前述分子的方法、以及使用前述分子靶向癌症的方法。
因此,在一方面,本披露的特征在于多功能(例如,双功能)分子,所述分子包含基质修饰部分和例如与癌抗原(例如,实体瘤抗原、基质抗原、或血液抗原)结合的肿瘤靶向部分(例如,抗体分子、配体分子、或受体分子)。
在一些实施例中,多功能分子进一步包含以下中的一种或两种:
(i)例如选自nk细胞衔接子、t细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子中的一种、两种、三种、或全部的免疫细胞衔接子;或者
(ii)细胞因子分子。
在其他实施例中,多功能分子包含三种或四种特异性或功能,例如,其是三特异性或四特异性分子。示例性的三特异性和四特异性分子包含:
(i)一种肿瘤靶向部分、一种基质修饰部分和一种免疫细胞衔接子;
(ii)一种肿瘤靶向部分、一种基质修饰部分和一种细胞因子分子;
(iii)一种肿瘤靶向部分、一种基质修饰部分和两种免疫细胞衔接子(例如,相同或不同的免疫细胞衔接子);
(iv)一种肿瘤靶向部分、一种基质修饰部分和两种细胞因子(例如,相同或不同的细胞因子);
(v)一种肿瘤靶向部分、一种基质修饰部分、一种免疫细胞衔接子、和一种细胞因子分子;
(vi)两种肿瘤靶向部分(例如,相同或不同的靶向部分)和一种基质修饰部分;
(vii)一种肿瘤靶向部分和两种基质修饰部分(例如,相同或不同的基质修饰部分);
(viii)两种肿瘤靶向部分(例如,相同或不同的靶向部分)、一种基质修饰部分和一种免疫细胞衔接子;
(ix)两种肿瘤靶向部分(例如,相同或不同的靶向部分)、一种基质修饰部分和一种细胞因子分子;
(x)一种肿瘤靶向部分、两种基质修饰部分(例如,相同或不同的基质修饰部分)和一种免疫细胞衔接子;以及
(xi)一种肿瘤靶向部分、两种基质修饰部分(例如,相同或不同的基质修饰部分)和一种细胞因子分子。
基质修饰部分
在一些实施例中,基质修饰部分引起以下中的一种或多种:降低基质或细胞外基质(ecm)组分的水平或产生;减少肿瘤纤维化;增加间质肿瘤转运;改善肿瘤灌注;扩大肿瘤微血管;降低肿瘤中的间质液压(ifp);或者减少或增强药剂(例如,癌症治疗剂或细胞疗法)向肿瘤或肿瘤血管的渗透或扩散。
在一些实施例中,降低的基质或ecm组分选自糖胺聚糖或细胞外蛋白、或其组合。在一些实施例中,糖胺聚糖选自透明质酸(hyaluronan)(也称为透明质酸(hyaluronicacid)或ha)、硫酸软骨素、软骨素、硫酸皮肤素、肝素、硫酸肝素、巢蛋白、生腱蛋白、聚集蛋白聚糖和硫酸角蛋白。在一些实施例中,细胞外蛋白选自胶原、层粘连蛋白、弹性蛋白、纤维蛋白原、纤连蛋白、或玻连蛋白。在一些实施例中,基质修饰部分包括降解肿瘤基质或细胞外基质(ecm)的酶分子。在一些实施例中,酶分子选自透明质酸酶分子、胶原酶分子、软骨素酶分子、基质金属蛋白酶分子(例如,巨噬细胞金属弹性蛋白酶)、或任何前述的变体(例如,片段)。术语“酶分子”包括全长酶、酶的片段或变体,例如保留天然存在的酶的至少一种功能特性的酶变体。
在一些实施例中,所述基质修饰部分降低透明质酸的水平或产生。在其他实施例中,基质修饰部分包括透明质酸降解酶、抑制透明质酸合成的试剂、或针对透明质酸的抗体分子。
在一些实施例中,透明质酸降解酶是透明质酸酶分子,例如其全长或变体(例如,其片段)。在一些实施例中,透明质酸降解酶在中性或酸性ph(例如,约4-5的ph)下有活性。在一些实施例中,透明质酸酶分子是哺乳动物透明质酸酶分子(例如,重组人透明质酸酶分子),例如其全长或变体(例如,其片段,例如截短形式)。在一些实施例中,透明质酸酶分子选自hyal1、hyal2、或ph-20/spam1、或其变体(例如,其截短形式)。在一些实施例中,截短形式缺乏c-末端糖基磷脂酰肌醇(gpi)附接位点或gpi附接位点的一部分。在一些实施例中,透明质酸酶分子是糖基化的,例如包含至少一个n-连接的聚糖。
在一些实施例中,透明质酸酶分子包含以下氨基酸序列:
lnfrappvipnvpflwawnapsefclgkfdepldmslfsfigsprinatgqgvtifyvdrlgyypyidsitgvtvnggipqkislqdhldkakkditfympvdnlgmavidweewrptwarnwkpkdvyknrsielvqqqnvqlslteatekakqefekagkdflvetiklgkllrpnhlwgyylfpdcynhhykkpgyngscfnveikrnddlswlwnestalypsiylntqqspvaatlyvrnrvreairvskipdaksplpvfaytrivftdqvlkflsqdelvytfgetvalgasgiviwgtlsimrsmkscllldnymetilnpyiinvtlaakmcsqvlcqeqgvcirknwnssdylhlnpdnfaiqlekggkftvrgkptledleqfsekfycscystlsckekadvkdtdavdvciadgvcidaflkppmeteepqifynaspstls(seqidno:61)、或其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:61的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在一些实施例中,透明质酸酶分子包含:
(i)seqidno:61的36-464的氨基酸序列;
(ii)ph20的36-481、36-482、或36-483的氨基酸序列,其中ph20具有seqidno:61所示的氨基酸序列;或者
(iii)与seqidno:61所示的氨基酸序列的多肽或截短形式具有至少95%至100%序列同一性的氨基酸序列;或者
(iv)相对于seqidno:61所示的氨基酸序列具有30个、20个、10个、5个或更少氨基酸取代的氨基酸序列。在一些实施例中,透明质酸酶分子包含与seqidno:61的氨基酸序列至少95%(例如,至少95%、96%、97%、98%、99%、100%)相同的氨基酸序列。在一些实施例中,透明质酸酶分子由与seqidno:61的核苷酸序列至少95%(例如,至少96%、97%、98%、99%、100%)相同的核苷酸序列编码。
在一些实施例中,透明质酸酶分子是ph20,例如rhuph20。在一些实施例中,透明质酸酶分子是hyal1并且包含以下氨基酸序列:
frgpllpnrpfttvwnantqwclerhgvdvdvsvfdvvanpgqtfrgpdmtifyssqgtypyytptgepvfgglpqnasliahlartfqdilaaipapdfsglavidweawrprwafnwdtkdiyrqrsralvqaqhpdwpapqveavaqdqfqgaarawmagtlqlgralrprglwgfygfpdcynydflspnytgqcpsgiraqndqlgwlwgqsralypsiympavlegtgksqmyvqhrvaeafrvavaagdpnlpvlpyvqifydttnhflpldelehslgesaaqgaagvvlwvswentrtkescqaikeymdttlgpfilnvtsgallcsqalcsghgrcvrrtshpkallllnpasfsiqltpgggplslrgalsledqaqmavefkcrcypgwqapwcerksmw(seqidno:62)、或其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:62的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在一些实施例中,所述透明质酸降解酶(例如,所述透明质酸酶分子)进一步包含聚合物,例如与聚合物(例如,peg)缀合。在一些实施例中,透明质酸降解酶是peg化的ph20酶(pegph20)。在一些实施例中,透明质酸降解酶(例如,透明质酸酶分子)进一步包含选自以下的免疫球蛋白链恒定区(例如,fc区):例如,igg1、igg2、igg3、和igg4的重链恒定区,更具体地,人igg1、igg2、igg3、或igg4的重链恒定区。在一些实施例中,免疫球蛋白恒定区(例如,fc区)连接(例如,共价连接)至透明质酸降解酶(例如,透明质酸酶分子)。在一些实施例中,免疫球蛋白链恒定区(例如,fc区)被改变(例如,突变)以增加或减少以下中的一种或多种:fc受体结合、抗体糖基化、半胱氨酸残基的数量、效应细胞功能、或补体功能。在一些实施例中,透明质酸降解酶(例如,透明质酸酶分子)形成二聚体。
在一些实施例中,基质修饰部分包括透明质酸合成(例如,ha合酶)的抑制剂。在一些实施例中,所述抑制剂包含针对ha合酶的正义或反义核酸分子或是小分子药物。在一些实施例中,所述抑制剂是4-甲基伞形酮(mu)或其衍生物(例如,6,7-二羟基-4-甲基香豆素或5,7-二羟基-4-甲基香豆素)、或来氟米特或其衍生物。
在一些实施例中,基质修饰部分包括针对透明质酸的抗体分子。
在一些实施例中,基质修饰部分包括胶原酶分子(例如,哺乳动物胶原酶分子)、或其变体(例如,片段)。在一些实施例中,胶原酶分子是胶原酶分子iv,例如包含以下的氨基酸序列:
ynffprkpkwdknqityriigytpdldpetvddafarafqvwsdvtplrfsrihdgeadiminfgrwehgdgypfdgkdgllahafapgtgvggdshfdddelwtlgegqvvrvkygnadgeyckfpflfngkeynsctdtgrsdgflwcsttynfekdgkygfcphealftmggnaegqpckfpfrfqgtsydscttegrtdgyrwcgttedydrdkkygfcpetamstvggnsegapcvfpftflgnkyesctsagrsdgkmwcattanydddrkwgfcpdqgyslflvaahefghamglehsqdpgalmapiytytknfrlsqddikgiqelygaspdidlgtgptptlgpvtpeickqdivfdgiaqirgeifffkdrfiwrtvtprdkpmgpllvatfwpelpekidavyeapqeekavffagneywiysastlergypkpltslglppdvqrvdaafnwsknkktyifagdkfwrynevkkkmdpgfpkliadawnaipdnldavvdlqggghsyffkgayylklenqslksvkfgsiksdwlgc(seqidno:63)、或其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:63的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
肿瘤靶向部分
在一些实施例中,肿瘤靶向部分包括与间皮素结合的抗体分子(例如,fab或scfv)。在一些实施例中,间皮素的抗体分子包含来自以下的重链可变结构域序列的一个、两个、三个cdr:
qvqlqqsgpelekpgasvkisckasgysftgytmnwvkqshgkslewiglitpyngassynqkfrgkatltvdkssstaymdllsltsedsavyfcarggydgrgfdywgqgttvtvss(seqidno:1),或密切相关的cdr,例如与seqidno:1的cdr序列具有至少一个氨基酸改变,但不超过两个、三个或四个改变(例如,取代、缺失、或插入,例如保守取代)的cdr。
在一些实施例中,间皮素的抗体分子包含来自以下的一个、两个、三个cdr:gysftgytmn(seqidno:2);litpyngassynqkfrg(seqidno:3);和ggydgrgfdy(seqidno:4),或密切相关的cdr,例如具有至少一个氨基酸改变,但不超过两个、三个或四个改变(例如,取代、缺失、或插入,例如保守取代)的cdr。
在一些实施例中,间皮素的抗体分子由三个cdr(其中cdr1包含gysftgytmn(seqidno:2);cdr2包含:litpyngassynqkfrg(seqidno:3);并且cdr3包含ggydgrgfdy(seqidno:4))、或密切相关的cdr(例如,具有至少一个氨基酸改变,但不超过两个、三个或四个改变(例如,取代、缺失、或插入,例如保守取代)的cdr)组成。
在一些实施例中,间皮素的抗体分子由三个cdr(其中cdr1由gysftgytmn(seqidno:2)组成;cdr2由litpyngassynqkfrg(seqidno:3)组成;并且cdr3由ggydgrgfdy(seqidno:4)组成)、或密切相关的cdr(例如,具有至少一个氨基酸改变,但不超过两个、三个或四个改变(例如,取代、缺失、或插入,例如保守取代)的cdr)组成。
在一些实施例中,间皮素的抗体分子包含以下的重链可变结构域序列:qvqlqqsgpelekpgasvkisckasgysftgytmnwvkqshgkslewiglitpyngassynqkfrgkatltvdkssstaymdllsltsedsavyfcarggydgrgfdywgqgttvtvss(seqidno:1)、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:1的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在一些实施例中,间皮素的抗体分子是fab并且进一步包含具有以下氨基酸序列的重链恒定区(ch1):
astkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrvepkscdktht(seqidno:5)、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:5的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在一些实施例中,抗体分子进一步包含信号肽,例如包含以下氨基酸序列的信号肽:mefglswvflvalfrgvqc(seqidno:6)。
在一些实施例中,间皮素的抗体分子包含来自以下的轻链可变结构域序列的一个、两个、三个cdr:
dieltqspaimsaspgekvtmtcsasssvsymhwyqqksgtspkrwiydtsklasgvpgrfsgsgsgnsysltissveaeddatyycqqwsgypltfgagtkleik(seqidno:7),或密切相关的cdr,例如与seqidno:7的cdr序列具有至少一个氨基酸改变,但不超过两个、三个或四个改变(例如,取代、缺失、或插入,例如保守取代)的cdr。
在一些实施例中,间皮素的抗体分子包含来自以下的一个、两个、三个cdr:sasssvsymh(seqidno:8);dtsklas(seqidno:9);和qqwsgyplt(seqidno:10),或密切相关的cdr,例如具有至少一个氨基酸改变,但不超过两个、三个或四个改变(例如,取代、缺失、或插入,例如保守取代)的cdr。
在一些实施例中,间皮素的抗体分子由三个cdr(其中cdr1包含sasssvsymh(seqidno:8);cdr2包含:dtsklas(seqidno:9);并且cdr3包含qqwsgyplt(seqidno:10))、或密切相关的cdr(例如,具有至少一个氨基酸改变,但不超过两个、三个或四个改变(例如,取代、缺失、或插入,例如保守取代)的cdr)组成。
在一些实施例中,间皮素的抗体分子由三个cdr(其中cdr1由sasssvsymh(seqidno:8)组成;cdr2由dtsklas(seqidno:9)组成;并且cdr3由qqwsgyplt(seqidno:10)组成)、或密切相关的cdr(例如,具有至少一个氨基酸改变,但不超过两个、三个或四个改变(例如,取代、缺失、或插入,例如保守取代)的cdr)组成。
在一些实施例中,间皮素的抗体分子包含以下的轻链可变结构域序列:dieltqspaimsaspgekvtmtcsasssvsymhwyqqksgtspkrwiydtsklasgvpgrfsgsgsgnsysltissveaeddatyycqqwsgypltfgagtkleik(seqidno:7)、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:7的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在一些实施例中,间皮素的抗体分子是fab并且进一步包含具有以下氨基酸序列的轻链恒定区(cl1):
rtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec(seqidno:11)、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:11的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在一些实施例中,抗体分子进一步包含信号肽,例如包含以下氨基酸序列的信号肽:mkyllptaaagllllaaqpama(seqidno:12)。在一些实施例中,信号肽包含seqidno:12的氨基酸序列。在一些实施例中,信号肽包含以下氨基酸序列:metdtlllwvlllwvpgstg(seqidno:64)。在一些实施例中,信号肽包含以下氨基酸序列:mefglswvflvalfrgvqc(seqidno:6)。
在一些实施例中,肿瘤靶向部分包括与fap结合的抗体分子(例如,fab或scfv)。
在一些实施例中,fap的抗体分子包含来自以下的重链可变结构域序列的一个、两个、三个cdr:
qvqlvqsgaevkkpgasvkvscktsrytfteytihwvrqapgqrlewigginpnngipnynqkfkgrvtitvdtsastaymelsslrsedtavyycarrriaygydeghamdywgqgtlvtvss(seqidno:65),或密切相关的cdr,例如与seqidno:65的cdr序列具有至少一个氨基酸改变,但不超过两个、三个或四个改变(例如,取代、缺失、或插入,例如保守取代)的cdr。
在一些实施例中,fap的抗体分子包含选自以下的一个、两个、三个cdr:srytfteytih(seqidno:66);ginpnngipnynqkfkg(seqidno:67);和rriaygydeghamdy(seqidno:68),或密切相关的cdr,例如具有至少一个氨基酸改变,但不超过两个、三个或四个改变(例如,取代、缺失、或插入,例如保守取代)的cdr。
在一些实施例中,fap的抗体分子由三个cdr(其中cdr1包含srytfteytih(seqidno:66);cdr2包含:ginpnngipnynqkfkg(seqidno:67);并且cdr3包含rriaygydeghamdy(seqidno:68))、或密切相关的cdr(例如,具有至少一个氨基酸改变,但不超过两个、三个或四个改变(例如,取代、缺失、或插入,例如保守取代)的cdr)组成。
在一些实施例中,fap的抗体分子由三个cdr(其中cdr1由srytfteytih(seqidno:66)组成;cdr2由ginpnngipnynqkfkg(seqidno:67)组成;并且cdr3由rriaygydeghamdy(seqidno:68)组成)、或密切相关的cdr(例如,具有至少一个氨基酸改变,但不超过两个、三个或四个改变(例如,取代、缺失、或插入,例如保守取代)的cdr)组成。
在一些实施例中,fap的抗体分子包含以下的重链可变结构域序列:
qvqlvqsgaevkkpgasvkvscktsrytfteytihwvrqapgqrlewigginpnngipnynqkfkgrvtitvdtsastaymelsslrsedtavyycarrriaygydeghamdywgqgtlvtvss(seqidno:65)、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:65的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在一些实施例中,fap的抗体分子是fab并且进一步包含具有以下氨基酸序列的重链恒定区(ch1):
astkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrvepksc(seqidno:14)、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:14的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在一些实施例中,抗体分子进一步包含信号肽,例如包含以下氨基酸序列的信号肽:mkyllptaaagllllaaqpama(seqidno:12)。在一些实施例中,信号肽包含seqidno:12的氨基酸序列。在一些实施例中,信号肽包含以下氨基酸序列:metdtlllwvlllwvpgstg(seqidno:16)。在一些实施例中,信号肽包含以下氨基酸序列:mefglswvflvalfrgvqc(seqidno:6)。在一些实施例中,fap的抗体分子包含来自以下的轻链可变结构域序列的一个、两个、三个cdr:
divmtqspdslavslgeratinckssqsllysrnqknylawyqqkpgqppkllifwastresgvpdrfsgsgfgtdftltisslqaedvavyycqqyfsypltfgqgtkveik(seqidno:69),或密切相关的cdr,例如与seqidno:69的cdr序列具有至少一个氨基酸改变,但不超过两个、三个或四个改变(例如,取代、缺失、或插入,例如保守取代)的cdr。
在一些实施例中,fap的抗体分子包含选自以下的一个、两个、三个cdr:kssqsllysrnqknyla(seqidno:70);wastres(seqidno:71);和qqyfsyplt(seqidno:72),或密切相关的cdr,例如具有至少一个氨基酸改变,但不超过两个、三个或四个改变(例如,取代、缺失、或插入,例如保守取代)的cdr。
在一些实施例中,fap的抗体分子由三个cdr(其中cdr1包含kssqsllysrnqknyla(seqidno:70);cdr2包含:wastres(seqidno:71);并且cdr3包含qqyfsyplt(seqidno:72))、或密切相关的cdr(例如,具有至少一个氨基酸改变,但不超过两个、三个或四个改变(例如,取代、缺失、或插入,例如保守取代)的cdr)组成。
在一些实施例中,fap的抗体分子由三个cdr(其中cdr1由kssqsllysrnqknyla(seqidno:70)组成;cdr2由wastres(seqidno:71)组成;并且cdr3由qqyfsyplt(seqidno:72)组成)、或密切相关的cdr(例如,具有至少一个氨基酸改变,但不超过两个、三个或四个改变(例如,取代、缺失、或插入,例如保守取代)的cdr)组成。
在一些实施例中,fap的抗体分子包含以下的轻链可变结构域序列:
divmtqspdslavslgeratinckssqsllysrnqknylawyqqkpgqppkllifwastresgvpdrfsgsgfgtdftltisslqaedvavyycqqyfsypltfgqgtkveik(seqidno:69)、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:69的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在一些实施例中,fap的抗体分子是fab并且进一步包含具有以下氨基酸序列的轻链恒定区(cl1):
rtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec(seqidno:11)、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:11的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在一些实施例中,抗体分子进一步包含信号肽,例如包含以下氨基酸序列的信号肽:mkyllptaaagllllaaqpama(seqidno:12)。在一些实施例中,信号肽包含seqidno:12的氨基酸序列。在一些实施例中,信号肽包含以下氨基酸序列:metdtlllwvlllwvpgstg(seqidno:16)。在一些实施例中,信号肽包含以下氨基酸序列:mefglswvflvalfrgvqc(seqidno:6)。
免疫细胞衔接子
在一些实施例中,nkp30的配体是b7-6,例如包含以下的氨基酸序列:dlkvemmaggtqitplndnvtifcnifysqplnitsmgitwfwksltfdkevkvfeffgdhqeafrpgaivspwrlksgdaslrlpgiqleeageyrcevvvtplkaqgtvqlevvaspasrllldqvgmkenedkymcessgfypeainitwekqtqkfphpieisedvitgptiknmdgtfnvtsclklnssqedpgtvyqcvvrhaslhtplrsnftltaarhslsetektdnfs(seqidno:24)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:24的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在一些实施例中,nkp44或nkp46的配体是病毒ha。
在一些实施例中,dap10的配体是nkg2d的辅助受体。
在一些实施例中,cd16的配体是cd16a/b配体,例如进一步包含抗体fc区的cd16a/b配体。
在一些实施例中,nkg2d的配体选自mica、micb、或ulbp1,例如,其中:(i)mica包含以下氨基酸序列:
ephslrynltvlswdgsvqsgfltevhldgqpflrcdrqkcrakpqgqwaedvlgnktwdretrdltgngkdlrmtlahikdqkeglhslqeirvceihednstrssqhfyydgelflsqnletkewtmpqssraqtlamnvrnflkedamktkthyhamhadclqelrrylksgvvlrrtvppmvnvtrseasegnitvtcrasgfypwnitlswrqdgvslshdtqqwgdvlpdgngtyqtwvatricqgeeqrftcymehsgnhsthpvpsgkvlvlqshw(seqidno:25)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:25的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列;
(ii)micb包含以下氨基酸序列:
aephslrynlmvlsqdesvqsgflaeghldgqpflrydrqkrrakpqgqwaedvlgaktwdtetedltengqdlrrtlthikdqkgglhslqeirvceihedsstrgsrhfyydgelflsqnletqestvpqssraqtlamnvtnfwkedamktkthyramqadclqklqrylksgvairrtvppmvnvtcsevsegnitvtcrassfyprnitltwrqdgvslshntqqwgdvlpdgngtyqtwvatrirqgeeqrftcymehsgnhgthpvpsgkvlvlqsqrtd(seqidno:26)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:26的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列;或者
(iii)ulbp1包含余下氨基酸序列:
gwvdthclcydfiitpksrpepqwcevqglvderpflhydcvnhkakafaslgkkvnvtktweeqtetlrdvvdflkgqlldiqvenlipiepltlqarmsceheahghgrgswqflfngqkfllfdsnnrkwtalhpgakkmtekweknrdvtmffqkislgdckmwleeflmyweqmldptkppslapg(seqidno:27)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:27的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在一些实施例中,dnam1的配体选自nectin2或necl5,例如,其中:
(i)nectin2包含以下氨基酸序列:
qdvrvqvlpevrgqlggtvelpchllppvpglyislvtwqrpdapanhqnvaafhpkmgpsfpspkpgserlsfvsakqstgqdteaelqdatlalhgltvedegnytcefatfpkgsvrgmtwlrviakpknqaeaqkvtfsqdpttvalciskegrppariswlssldweaketqvsgtlagtvtvtsrftlvpsgradgvtvtckvehesfeepalipvtlsvryppevsisgyddnwylgrtdatlscdvrsnpeptgydwsttsgtfptsavaqgsqlvihavdslfnttfvctvtnavgmgraeqvifvretpntagagatgg(seqidno:28)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:28的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列;或者
(ii)necl5包含以下氨基酸序列:
wpppgtgdvvvqaptqvpgflgdsvtlpcylqvpnmevthvsqltwarhgesgsmavfhqtqgpsyseskrlefvaarlgaelrnaslrmfglrvedegnytclfvtfpqgsrsvdiwlrvlakpqntaevqkvqltgepvpmarcvstggrppaqitwhsdlggmpntsqvpgflsgtvtvtslwilvpssqvdgknvtckvehesfekpqlltvnltvyyppevsisgydnnwylgqneatltcdarsnpeptgynwsttmgplppfavaqgaqllirpvdkpinttlicnvtnalgarqaeltvqvkegppsehsgisrn(seqidno:29)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:29的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在一些实施例中,crtam的配体是necl2,例如,其中necl2包含以下氨基酸序列:
qnlftkdvtviegevatiscqvnksddsviqllnpnrqtiyfrdfrplkdsrfqllnfssselkvsltnvsisdegryfcqlytdppqesyttitvlvpprnlmidiqkdtavegeeievnctamaskpattirwfkgntelkgkseveewsdmytvtsqlmlkvhkeddgvpvicqvehpavtgnlqtqrylevqykpqvhiqmtyplqgltregdaleltceaigkpqpvmvtwvrvddempqhavlsgpnlfinnlnktdngtyrceasnivgkahsdymlyvydppttippptttttttttttttiltiitdsrageegsiravdh(seqidno:30)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:30的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在一些实施例中,cd27的配体是cd70,例如,其中cd70包含以下氨基酸序列:
qrfaqaqqqlpleslgwdvaelqlnhtgpqqdprlywqggpalgrsflhgpeldkgqlrihrdgiymvhiqvtlaicssttasrhhpttlavgicspasrsisllrlsfhqgctiasqrltplargdtlctnltgtllpsrntdetffgvqwvrp(seqidno:31)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:31的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在一些实施例中,psgl1的配体是l-选择素(cd62l),例如,其中l-选择素包含以下氨基酸序列:
wtyhysekpmnwqrarrfcrdnytdlvaiqnkaeieylektlpfsrsyywigirkiggiwtwvgtnkslteeaenwgdgepnnkknkedcveiyikrnkdagkwnddachklkaalcytascqpwscsghgecveiinnytcncdvgyygpqcqfviqcepleapelgtmdcthplgnfsfssqcafscsegtnltgieettcgpfgnwsspeptcqviqceplsapdlgimncshplasfsftsactficsegteligkkkticessgiwsnpspicqkldksfsmikegdyn(seqidno:32)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:32的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在一些实施例中,cd96的配体是necl5,例如,其中necl5包含以下氨基酸序列:
wpppgtgdvvvqaptqvpgflgdsvtlpcylqvpnmevthvsqltwarhgesgsmavfhqtqgpsyseskrlefvaarlgaelrnaslrmfglrvedegnytclfvtfpqgsrsvdiwlrvlakpqntaevqkvqltgepvpmarcvstggrppaqitwhsdlggmpntsqvpgflsgtvtvtslwilvpssqvdgknvtckvehesfekpqlltvnltvyyppevsisgydnnwylgqneatltcdarsnpeptgynwsttmgplppfavaqgaqllirpvdkpinttlicnvtnalgarqaeltvqvkegppsehsgisrn(seqidno:29)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:29的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在一些实施例中,cd100(sema4d)的配体是cd72,例如,其中cd72包含以下氨基酸序列:
rylqvsqqlqqtnrvlevtnsslrqqlrlkitqlgqsaedlqgsrrelaqsqealqveqrahqaaegqlqacqadrqktketlqseeqqrraleqklsnmenrlkpfftcgsadtccpsgwimhqkscfyisltsknwqesqkqcetlssklatfseiypqshsyyflnsllpnggsgnsywtglssnkdwkltddtqrtrtyaqsskcnkvhktwswwtlesescrsslpyicemtafrfpd(seqidno:33)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:33的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在一些实施例中,nkp80的配体是clec2b(aicl),例如,其中clec2b(aicl)包含以下氨基酸序列:
kltrdsqslcpydwigfqnkcyyfskeegdwnsskyncstqhadltiidnieemnflrrykcssdhwiglkmaknrtgqwvdgatftksfgmrgsegcaylsddgaatarcyterkwicrkrih(seqidno:34)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:34的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在一些实施例中,cd244的配体是cd48,例如,其中cd48包含以下氨基酸序列:
qghlvhmtvvsgsnvtlniseslpenykqltwfytfdqkivewdsrkskyfeskfkgrvrldpqsgalyiskvqkednstyimrvlkktgneqewkiklqvldpvpkpvikiekiedmddncylklscvipgesvnytwygdkrpfpkelqnsvlettlmphnysrcytcqvsnsvsskngtvclsppctlars(seqidno:35)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:35的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在一些实施例中,免疫细胞衔接子介导与b细胞、巨噬细胞、和/或树突细胞中的一种或多种的结合、或其激活。在一些实施例中,免疫细胞衔接子包括选自以下中的一种或多种的b细胞、巨噬细胞、和/或树突细胞衔接子:cd40配体(cd40l)或cd70配体;与cd40或cd70结合的抗体分子;ox40的抗体分子;ox40配体(ox40l);toll样受体激动剂(例如,tlr4(例如,组成型活性tlr4(catlr4))或tlr9激动剂);41bb激动剂;cd2激动剂;cd47激动剂;或sting激动剂、或其组合。在一些实施例中,b细胞衔接子是cd40l、ox40l、或cd70配体、或与ox40、cd40或cd70结合的抗体分子。在一些实施例中,巨噬细胞衔接子是cd2激动剂;cd40l;ox40l;与ox40、cd40或cd70结合的抗体分子;toll样受体(例如,tlr4(例如,组成型活性tlr4(catlr4))或tlr9)激动剂或其片段;cd47;或sting激动剂。在一些实施例中,树突细胞衔接子是cd2激动剂、ox40抗体、ox40l、41bb激动剂、toll样受体激动剂(例如,tlr4(例如,组成型活性tlr4(catlr4))或tlr9激动剂);cd47激动剂、或sting激动剂。
在一些实施例中,ox40l包含以下氨基酸序列:
qvshrypriqsikvqfteykkekgfiltsqkedeimkvqnnsviincdgfylislkgyfsqevnislhyqkdeeplfqlkkvrsvnslmvasltykdkvylnvttdntslddfhvnggelilihqnpgefcvl(seqidno:36)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:36的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在一些实施例中,cd40l包含以下氨基酸序列:
mqkgdqnpqiaahviseasskttsvlqwaekgyytmsnnlvtlengkqltvkrqglyyiyaqvtfcsnreassqapfiaslclkspgrferillraanthssakpcgqqsihlggvfelqpgasvfvnvtdpsqvshgtgftsfgllkl(seqidno:37)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:37的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在一些实施例中,sting激动剂包含环状二核苷酸,例如环状二-gmp(cdgmp)、环状二-amp(cdamp)、或其组合,任选地具有2’,5’或3’,5’磷酸酯键。
在一个实施例中,免疫细胞衔接子包括例如包含以下氨基酸序列的41bb配体:
acpwavsgaraspgsaasprlregpelspddpaglldlrqgmfaqlvaqnvllidgplswysdpglagvsltgglsykedtkelvvakagvyyvffqlelrrvvagegsgsvslalhlqplrsaagaaalaltvdlppassearnsafgfqgrllhlsagqrlgvhlhteararhawqltqgatvlglfrvtpeipaglpsprse(seqidno:38)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:38的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
细胞因子分子
在一个实施例中,细胞因子分子是il-15,例如人il-15(例如,包含以下氨基酸序列:
nwvnvisdlkkiedliqsmhidatlytesdvhpsckvtamkcfllelqvislesgdasihdtvenliilannslssngnvtesgckeceeleeknikeflqsfvhivqmfints(seqidno:17)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:17的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在一些实施例中,细胞因子分子包含受体二聚化结构域,例如il15rα二聚化结构域。在一个实施例中,il15rα二聚化结构域包含以下氨基酸序列:
maprrargcrtlglpalllllllrppatrgitcpppmsvehadiwvksyslysreryicnsgfkrkagtssltecvl(seqidno:73)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:73的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。在一些实施例中,多特异性分子的细胞因子分子(例如,il-15)和受体二聚化结构域(例如,il15rα二聚化结构域)例如经由接头(例如,gly-ser接头,例如包含氨基酸序列sggsggggsgggsggggslq(seqidno:19)的接头)共价连接。在其他实施例中,多特异性分子的细胞因子分子(例如,il-15)和受体二聚化结构域(例如,il15rα二聚化结构域)不是共价连接的,例如是非共价缔合的。
在其他实施例中,细胞因子分子是il-2,例如人il-2(例如,包含以下氨基酸序列:
aptssstkktqlqlehllldlqmilnginnyknpkltrmltfkfympkkatelkhlqcleeelkpleevlnlaqsknfhlrprdlisninvivlelkgsettfmceyadetativeflnrwitfcqsiistlt(seqidno:20)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:20的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在其他实施例中,细胞因子分子是il-18,例如人il-18(例如,包含以下氨基酸序列:
yfgklesklsvirnlndqvlfidqgnrplfedmtdsdcrdnaprtifiismykdsqprgmavtisvkcekistlscenkiisfkemnppdnikdtksdiiffqrsvpghdnkmqfesssyegyflacekerdlfklilkkedelgdrsimftvqned(seqidno:74)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:74的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在其他实施例中,细胞因子分子是il-21,例如人il-21(例如,包含以下氨基酸序列:
qgqdrhmirmrqlidivdqlknyvndlvpeflpapedvetncewsafscfqkaqlksantgnneriinvsikklkrkppstnagrrqkhrltcpscdsyekkppkeflerfksllqkmihqhlssrthgseds(seqidno:22)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:22的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在还其他实施例中,细胞因子分子是干扰素γ,例如人干扰素γ(例如,包含以下氨基酸序列:
qdpyvkeaenlkkyfnaghsdvadngtlflgilknwkeesdrkimqsqivsfyfklfknfkddqsiqksvetikedmnvkffnsnkkkrddfekltnysvtdlnvqrkaiheliqvmaelspaaktgkrkrsqmlfrg(seqidno:23)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:23的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
接头
在一些实施例中,多功能分子进一步包含接头,例如,肿瘤靶向部分与基质修饰部分、细胞因子分子与免疫球蛋白链恒定区(例如,fc区)、靶向部分与免疫球蛋白链恒定区、或免疫细胞衔接子与免疫球蛋白链恒定区之间的接头。
在一些实施例中,接头选自:可切割接头、不可切割接头、肽接头、柔性接头、刚性接头、螺旋接头、或非螺旋接头。在一些实施例中,接头是肽接头。在一些实施例中,肽接头包含gly和ser。在一些实施例中,肽接头选自ggggs(seqidno:42);ggggsggggsggggs(seqidno:44);和dvpsgpgggggsggggs(seqidno:45)。在一些实施例中,肽接头是接头的a(eaaak)na家族(例如,如描述在proteineng.[蛋白质工程](2001)14(8):529-532中)。这些是刚性螺旋接头,n的范围从2–5。在一些实施例中,肽接头选自aeaaakeaaakaaa(seqidno:75);aeaaakeaaakeaaakaaa(seqidno:76);aeaaakeaaakeaaakeaaakaaa(seqidno:77);和aeaaakeaaakeaaakeaaakeaaakaaa(seqidno:78)。
多功能分子的构型
在一些实施例中,多功能分子包含单链抗体分子(例如,单结构域抗体、scfv、骆驼科动物抗体、或鲨鱼抗体)、和第二部分。在一些实施例中,多功能分子从n至c方向包含scfv的vh至vl,所述scfv任选地经由接头连接至第二部分(例如,如在图1a和1b中所示);scfv可以形成第一结合特异性(在图1a-1b中描绘为结合部分“1”)。在一些实施例中,第二部分(在图1a-1b中描绘为配偶体a)从n-至c-方向位于scfv的vh区之前(例如,如在图1a中所示)、或从n-至c-方向位于scfv的vl区之后(例如,如在图1b中所示);第二部分可以形成第二结合特异性(在图1a-1b中描绘为结合部分“2”)。在其他实施例中,多功能分子从n至c方向包含scfv的vl至vh,所述scfv任选地经由接头连接至第二部分(例如,如在图2a和2b中所示);scfv可以形成第一结合特异性(在图2a-2b中描绘为结合部分“1”)。在一些实施例中,第二部分(在图2a-2b中描绘为配偶体a)从n-至c-方向位于scfv的vl区之前(例如,如在图2a中所示)、或从n-至c-方向位于scfv的vh区之后(例如,如在图2b中所示);第二部分可以形成第二结合特异性(在图2a-2b中描绘为结合部分“2”)。在实施例中,scfv可以是肿瘤靶向部分(例如,与癌抗原(例如,实体瘤、基质、或血液抗原)结合),或者可以是免疫细胞衔接子(例如,与免疫细胞抗原结合)。在其他实施例中,第二部分(例如,图1a-1b或2a-2b中描绘为配偶体a)是基质修饰部分,例如如本文描述的。
在其他实施例中,多功能分子是三特异性或三功能的,其包含单链多肽(例如,连续的单多肽链)、或由其组成。例如,多功能分子可以包含肿瘤靶向部分(例如,如本文描述的对癌抗原(例如,实体瘤、基质、或血液抗原)的第一结合特异性)、基质修饰部分(例如,如本文描述的)、以下中的一种:如本文描述的细胞因子分子、和免疫细胞衔接子(例如,如本文描述的对免疫细胞抗原的第二结合特异性)、或任何前述的任何组合。
在一些实施例中,多功能分子包含单链抗体分子(例如,单结构域抗体、scfv、骆驼科动物抗体、或鲨鱼抗体)、和第二部分。在一些实施例中,多功能分子从n至c方向包含scfv的vh至vl,所述scfv任选地经由接头连接至第二部分和/或第三部分(例如,如在图1c中所示);scfv可以形成第一结合特异性(在图1c中描绘为结合部分“1”)。在一些实施例中,分别地,第二或第三部分(在图1c中描绘为配偶体a和b)从n-至c-方向位于scfv的vh区之前(例如,如在图1c中所示),并且第三部分(配偶体b)从n-至c-方向位于scfv的vl区之后(例如,如在图1c中所示);第二和第三部分可以形成第二和第三结合特异性(在图1c中分别描绘为结合部分“2”和结合部分“3”)。在其他实施例中,多功能分子从n至c方向包含scfv的vl至vh,所述scfv任选地经由接头连接至第二部分和/或第三部分(例如,如在图2c中所示)。在一些实施例中,第二部分(在图2c中描绘为配偶体a)从n-至c-方向位于scfv的vl区之前(例如,如在图2c中所示),并且第三部分(配偶体b)从n-至c-方向位于scfv的vh区之后(例如,如在图2c中所示);第二和第三部分可以形成第二和第三结合特异性(在图2c中分别描绘为结合部分“2”和结合部分“3”)。在实施例中,任何前述多功能分子的scfv可以是肿瘤靶向部分(例如,与癌抗原(例如,实体瘤、基质或血液抗原)结合),或者可以是免疫细胞衔接子(例如,与免疫细胞抗原结合)。在实施例中,第二部分或第三部分(例如,在图1c或2c中描绘为配偶体a和配偶体b)包含基质修饰部分(例如,如本文描述的),其余部分选自第二肿瘤靶向部分、免疫细胞衔接子、或细胞因子分子(例如,如本文描述的)。在实施例中,配偶体a和/或配偶体b可以是抗体分子(例如,单链抗体分子(例如,scfv)或fab)、基质修饰部分、受体分子、或配体分子(例如,受体配体或细胞因子分子),例如如本文描述的。在一个实施例中,肿瘤靶向部分是癌细胞抗原的scfv,第二部分是基质修饰部分(例如,如本文描述的),并且第三部独立地选自细胞因子分子或免疫细胞衔接子。在一些实施例中,第二和第三部分独立地选自基质修饰部分、第二抗体分子(例如,第二scfv或fab)、受体分子、或配体分子(例如,受体配体或细胞因子分子)。
在实施例中,多功能分子是双特异性或双功能分子,其中第一和第二多肽(i)和(ii)是不连续的,例如是两条独立的多肽链。在实施例中,第一和第二多肽具有如在图3a-3b或图4a-4b中所示的构型。在实施例中,第一和第二多肽形成第一结合特异性,例如抗原结合结构域(例如,在图3a-3b和图4a-4b中描绘为结合部分“1”)。在实施例中,第二部分(描绘为配偶体a)例如经由接头连接至第一多肽或第二多肽。在实施例中,第二部分形成第二结合特异性(例如,在图3a-3b和图4a-4b中描绘为结合部分“2”)。
在图3a-3b中描绘的一个实施例中,第二部分(例如,配偶体a)例如经由接头连接至第二多肽的c-末端(例如,第二多肽的cl区的c-末端)(例如,如在图3a中所示)。在其他实施例中,第二部分(例如,配偶体a)例如经由接头连接至第一多肽的c-末端(例如,第一多肽的ch1区的c-末端)(例如,如在图3b中所示)。
在图4a-4b中描绘的另一个实施例中,第二部分(例如,配偶体a)例如经由接头连接至第二多肽的n-末端(例如,第二多肽的vl区的n-末端)(例如,如在图4a中所示)。在其他实施例中,第二部分(例如,配偶体a)例如经由接头连接至第一多肽的n-末端(例如,第一多肽的vh区的n-末端)(例如,如在图4b中所示)。
在实施例中,第一和第二多肽(例如,vh和vl区)可以形成结合部分(例如,图3a-3b和4a-4b中的结合部分1);例如,第一和第二多肽可以是肿瘤靶向部分(例如,与癌抗原(例如,实体瘤、基质或血液抗原)结合),或者可以是免疫细胞衔接子(例如,与免疫细胞抗原结合)。在实施例中,第二部分(例如,图3a-3b和4a-4b中描绘为配偶体a)包含基质修饰部分,例如如本文描述的基质修饰部分。
在实施例中,多特异性分子是双特异性或双功能分子,其中第一和第二多肽(i)和(ii)是不连续的,例如是两条独立的多肽链。在实施例中,第一和第二多肽具有如在图3a-3b或图4a-4b中所示的构型。在实施例中,第二部分(描绘为配偶体a)例如经由接头连接至第一多肽或第二多肽(例如,第一多肽或第二多肽的n-末端或c-末端)。
在图3a-3b中描绘的双特异性或双功能分子的一个实施例中,第二部分(例如,配偶体a)例如经由接头连接至第二多肽的cl区(例如,cl区的c-末端)(例如,如在图3a中所示)。在其他实施例中,第二部分(例如,配偶体a)例如经由接头连接至第一多肽的ch1区(例如,ch1区的c-末端)(例如,如在图3b中所示)。
在图4a-4b中描绘的双特异性或双功能分子的另一个实施例中,第二部分(例如,配偶体a)例如经由接头连接至第二多肽的vl区(例如,vl区的n-末端)(例如,如在图4a中所示)。在其他实施例中,第二部分(例如,配偶体a)例如经由接头连接至第一多肽的vh区(例如,vh区的n-末端)(例如,如在图4b中所示)。
在双特异性或双功能分子的实施例中,第一和第二多肽(例如,vh和vl区)可以形成结合部分(例如,在图3a-3b和4a-4b中的结合部分1);例如,第一和第二多肽可以是肿瘤靶向部分(例如,与癌抗原(例如,肿瘤、基质或血液抗原)结合),或者可以是免疫细胞衔接子(例如,与免疫细胞抗原结合)。在实施例中,第二部分(例如,图3a-3b和4a-4b中描绘为配偶体a)包含基质修饰部分,例如如本文描述的。
在一个实施例中,多特异性分子包含fab分子,并且第二部分选自基质修饰部分、或第二抗体分子(例如,scfv或第二fab)、受体分子、或配体分子(例如,细胞因子分子)。在一个实施例中,肿瘤靶向部分是癌细胞抗原的fab,并且第二部分包含基质修饰部分,任选地进一步包含细胞因子分子或免疫细胞衔接子。在一些实施例中,第二部分是第二抗体分子(例如,第二scfv或fab)、基质修饰部分、受体分子、受体配体分子、或细胞因子分子。
在其他实施例中,多特异性分子是三特异性或三功能分子,其中第一和第二多肽(i)和(ii)是不连续的,例如是两条独立的多肽链。在实施例中,第一和第二多肽具有如在图3c和4c中所示的构型。在实施例中,第二部分和第三部分(分别描绘为配偶体a和b)分别例如经由接头连接至第一多肽和第二多肽的c-末端、n-末端、或两者。在一个实施例中,第二部分和第三部分分别连接至第二和第一多肽(或第一和第二多肽)的c-末端。在另一个实施例中,第二部分和第三部分分别连接至第二和第一多肽(或第一和第二多肽)的n-末端。在一个实施例中,第二部分和第三部分分别连接至第二和第一多肽(或第一和第二多肽)的n-和c-末端。本披露旨在包括任何构型,包括图3c和4c中示例的那些。
在图3c-4c中描绘的三特异性或三功能分子的一个实施例中,第二部分(例如,对应于第二结合特异性“2”的配偶体a)例如经由接头连接至第二多肽的c-末端(例如,第二多肽的cl区的c-末端)(例如,如在图3c中所示),并且第三部分(例如,对应于第三结合特异性“3”的配偶体b)例如经由接头连接至第一多肽的c-末端(例如,第一多肽的ch1区的c-末端)(例如,如在图3c中所示)。
在图3c-4c中描绘的三特异性或三功能分子的另一个实施例中,第二部分(例如,对应于第二结合特异性“2”的配偶体a)例如经由接头连接至第二多肽的n-末端(例如,第二多肽的vl区的n-末端)(例如,如在图4c中所示),并且第三部分(例如,对应于第三结合特异性“3”的配偶体b)例如经由接头连接至第一多肽的n-末端(例如,第一多肽的vh区的n-末端)(例如,如在图4c中所示)。
在三特异性或三功能分子的另一个实施例中,第二部分(例如,对应于第二结合特异性“2”的配偶体a)例如经由接头连接至第二多肽的n-末端(例如,第二多肽的vl区的n-末端),并且第三部分(例如,对应于第三结合特异性“3”的配偶体b)例如经由接头连接至第一多肽的c-末端(例如,第一多肽的ch1区的c-末端)。
在三特异性或三功能分子的另一个实施例中,第二部分(例如,对应于第二结合特异性“2”的配偶体a)例如经由接头连接至第二多肽的c-末端(例如,第二多肽的cl区的n-末端),并且第三部分(例如,对应于第三结合特异性“3”的配偶体b)例如经由接头连接至第一多肽的n-末端(例如,第一多肽的vh区的n-末端)。
在三特异性或三功能分子的实施例中,第一和第二多肽(例如,vh和vl区)可以形成第一结合特异性(例如,图3c和4c中的结合部分“1”);例如,第一和第二多肽可以是肿瘤靶向部分(例如,与癌抗原(例如,实体瘤、基质或血液抗原)结合),或者可以是免疫细胞衔接子(例如,与免疫细胞抗原结合)。在实施例中,第二部分或第三部分(例如,在图3c和4c中描绘为配偶体a和b)包含基质修饰部分(例如,如本文描述的基质修饰部分),并且剩余部分选自肿瘤靶向部分、免疫细胞衔接子、或细胞因子分子(例如,如本文描述的)。在实施例中,第二和第三结合特异性(例如,配偶体a和b)可以独立地是基质修饰部分、酶分子、抗体分子(例如,单链抗体分子(例如,scfv)或fab)、受体分子、配体分子(例如,受体配体或细胞因子分子),例如如本文描述的。在一个实施例中,多功能分子包含fab分子,并且第二部分或第三部分包含基质修饰部分,并且剩余部分选自第二抗体分子(例如,scfv或第二fab)、受体分子、或配体分子(例如,受体配体或细胞因子分子)。在一些实施例中,第一结合特异性、第二结合特异性和第三结合特异性可以各自独立地选自肿瘤靶向部分、基质修饰部分、细胞因子分子、nk细胞衔接子、t细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子。在一个实施例中,肿瘤靶向部分是癌细胞抗原的fab,并且第二或第三部分是基质修饰部分,并且剩余部分选自细胞因子分子或免疫细胞衔接子。
在一个实施例中,多功能分子包含至少两种、至少三种或至少四种不连续多肽,其中:
(i)第一多肽从n-至c-方向包含第一免疫球蛋白恒定区(例如,连接至ch3区的ch2)(例如,第一fc区);并且
(ii)第二多肽从n-至c-方向包含第二免疫球蛋白恒定区(例如,连接至ch3区的ch2)(例如,第二fc区)。
在实施例中,多功能分子是双特异性或双功能分子,其中第一和第二多肽(i)和(ii)是不连续的,例如是两条独立的多肽链。在一些实施例中,第一和第二多肽(i)和(ii)包含在选自例如人igg1的fc区的以下中的一个或多个的位置处的成对的氨基酸取代:347、349、350、351、366、368、370、392、394、395、397、398、399、405、407、或409。例如,第一免疫球蛋白链恒定区(例如,第一fc区)可以包含选自以下的氨基酸取代:t366s、l368a、或y407v(例如,对应于空腔或臼),并且第二免疫球蛋白链恒定区(例如,第二fc区)包含t366w(例如,对应于突起或杵)。在一些实施例中,第一和第二多肽是异源二聚体第一和第二fc区的第一和第二成员。
在实施例中,第一和第二多肽形成双功能(例如,双特异性)分子。在一些实施例中,第一多肽包含第一结合和/或功能特异性(例如,图5a中的配偶体a或结合特异性1),并且第二多肽包含第二结合和/或功能特异性(例如,图5a中的配偶体b或结合特异性2)。在实施例中,第一和第二结合和/或功能特异性(分别为配偶体a和配偶体b)各自独立地选自基质修饰部分、酶分子、抗体分子(例如,单链抗体分子(例如,scfv)或fab)、受体分子、配体分子(例如,受体配体或细胞因子分子),例如如本文描述的。在实施例中,第一和第二结合特异性连接至第一或第二多肽、或每种多肽(例如,异源二聚体fc分子的一个或两个成员)。在一个实施例中,第一结合特异性(例如,配偶体a)连接至第一多肽的n-末端(例如,第一fc分子的–ch2-ch3-区),并且第二结合特异性(例如,配偶体b)连接至第二多肽的n-末端(例如,第二fc分子的–ch2-ch3-区)。可替代地,第一结合和/或功能特异性(例如,配偶体a)连接至第一多肽的c-末端(例如,第一fc分子的–ch2-ch3-区),并且第二结合和/或功能特异性(例如,配偶体b)连接至第二多肽的c-末端(例如,第二fc分子的–ch2-ch3-区)。可替代地,第一结合特异性(例如,配偶体a)连接至第一多肽的n-末端(例如,第一fc分子的–ch2-ch3-区),并且第二结合特异性(例如,配偶体b)连接至第二多肽的c-末端(例如,第二fc分子的–ch2-ch3-区)。在其他实施例中,第二结合和/或功能特异性(例如,配偶体b)连接至第一多肽的n-末端(例如,第一fc分子的–ch2-ch3-区),并且第一结合和/或功能特异性(例如,配偶体a)连接至第二多肽的c-末端(例如,第二fc分子的–ch2-ch3-区)。在一个实施例中,第一–ch2-ch3区包含突起或杵,并且第二–ch2-ch3区包含空腔或臼(例如,如在图5a中描绘)。
在一些实施例中,双功能分子的第一和第二结合和/或功能特异性(结合部分1和结合部分2)可以各自独立地选自基质修饰部分、肿瘤靶向部分、细胞因子分子、nk细胞衔接子、t细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子。在一些实施例中,第一结合和/或功能特异性是肿瘤靶向部分,并且第二结合和/或功能特异性是基质修饰部分。在其他实施例中,第一结合和/或功能特异性是免疫细胞衔接子,并且第二结合和/或功能特异性是基质修饰部分,例如,其中免疫细胞衔接子选自细胞因子分子、nk细胞衔接子、t细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子。
在图5a中显示的一些实施例中,双特异性分子可以具有配偶体a和b,其分别描绘为第一和第二结合和/或功能特异性(结合部分1和2)(图5a)。第一和第二结合和/或功能特异性可以各自独立地是基质修饰部分、酶分子、抗体分子(例如,单链抗体分子(例如,scfv)或fab)、受体分子、配体分子(例如,受体配体或细胞因子分子),例如如本文描述的。在一些实施例中,第一结合和/或功能特异性是肿瘤靶向部分,并且第二结合和/或功能特异性是基质修饰部分。在其他实施例中,第一结合和/或功能特异性是免疫细胞衔接子,并且第二结合和/或功能特异性是基质修饰部分,例如,其中免疫细胞衔接子选自细胞因子分子、nk细胞衔接子、t细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子。
在实施例中,第一和第二多肽形成三功能(例如,三特异性)、或四功能(例如,四特异性)分子(例如,分别如在图5b-5c中描绘)。
在三功能(例如,三特异性)分子的一些实施例中,第一多肽包含第一结合和/或功能特异性(例如,图5b中的配偶体a或结合部分1),并且第二多肽包含第二结合和/或功能特异性(例如,图5b中的配偶体b或结合特异性2),其中第一或第二多肽进一步包含第三结合和/或功能特异性(例如,图5b中的配偶体c或结合部分3)。在实施例中,第一和第二结合和/或功能特异性连接至第一或第二多肽、或每种多肽(例如,异源二聚体fc分子的一个或两个成员)。在一个实施例中,第一和第二结合和/或功能特异性分别例如经由接头连接至第一和第二多肽的n-末端,并且第三结合和/或功能特异性例如经由接头连接至第一或第二多肽的c-末端。在一个实施例中,第三结合和/或功能特异性例如经由接头连接至第一多肽的c-末端(例如,在图5b中描绘的第一–ch2-ch3区的c-末端)。在一个实施例中,第三结合和/或功能特异性例如经由接头连接至第二多肽的c-末端(例如,第二–ch2-ch3区的c-末端)。在一个实施例中,第一–ch2-ch3区包含突起或杵,并且第二–ch2-ch3区包含臼或空腔(例如,如在图5b中描绘)。
在实施例中,第一、第二和第三结合和/或功能特异性(分别为配偶体a、配偶体b、和配偶体c)各自独立地选自基质修饰部分、酶分子、抗体分子(例如,单链抗体分子(例如,scfv)或fab)、受体分子、配体分子(例如,受体配体或细胞因子分子),例如如本文描述的。在一个实施例中,第一结合和/或功能特异性(例如,配偶体a)连接至第一多肽的n-末端(例如,第一fc分子的–ch2-ch3-区);第二结合和/或功能特异性(例如,配偶体b)连接至第二多肽的n-末端(例如,第二fc分子的–ch2-ch3-区);并且第三结合和/或功能特异性(例如,配偶体c)连接至第一多肽的c-末端(例如,第二fc分子的–ch2-ch3-区)。在其他实施例中,第一结合和/或功能特异性(例如,配偶体a)连接至第一多肽的n-末端(例如,第一fc分子的–ch2-ch3-区);第二结合和/或功能特异性(例如,配偶体b)连接至第二多肽的n-末端(例如,第一fc分子的–ch2-ch3-区);并且第三结合和/或功能特异性(例如,配偶体c)连接至第二多肽的c-末端(例如,第二fc分子的–ch2-ch3-区)。第一、第二和第三结合和/或功能特异性可以各自独立地是基质修饰部分、酶分子、抗体分子(例如,单链抗体分子(例如,scfv)或fab)、受体分子、配体分子(例如,受体配体、或细胞因子分子),例如如本文描述的。在一些实施例中,第一、第二和第三结合和/或功能特异性(配偶体a-c,分别对应于结合部分1-3)各自独立地选自肿瘤靶向部分、基质修饰部分、细胞因子分子、nk细胞衔接子、t细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子,例如如本文描述的。在实施例中,第一结合和/或功能特异性是肿瘤靶向部分,第二结合和/或功能特异性是基质修饰部分,并且第三结合和/或功能特异性选自细胞因子分子、nk细胞衔接子、t细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子。
在四功能(例如,四特异性)分子的一些实施例中,第一多肽包含第一结合和/或功能特异性(例如,图5c中的配偶体a或结合部分1)和第三结合和/或功能特异性(例如,图5c中的配偶体c或结合部分3),并且第二多肽包含第二结合和/或功能特异性(例如,图5c中的配偶体b或结合特异性2)和第四结合和/或功能特异性(例如,图5c中的配偶体d或结合部分4)。在一个实施例中,第一和第二结合特异性分别例如经由接头连接至第一和第二多肽的n-末端,并且第三和第四结合特异性分别例如经由接头连接至第一和第二多肽的c-末端。本披露涵盖对第一或第二多肽的n-或c-末端的结合和/或功能特异性的任何排列。在一个实施例中,第一结合和/或功能特异性(例如,配偶体a)例如经由接头连接至第一多肽的n-末端(例如,在图5c中描绘的第一–ch2-ch3区的n-末端);第二结合和/或功能特异性(例如,配偶体b)例如经由接头连接至第二多肽的n-末端(例如,在图5c中描绘的第二–ch2-ch3区的n-末端);第三结合和/或功能特异性(例如,配偶体c)例如经由接头连接至第一多肽的c-末端(例如,在图5c中描绘的第一–ch2-ch3区的c-末端);并且第四结合和/或功能特异性(例如,配偶体d)例如经由接头连接至第二多肽的c-末端(例如,第二–ch2-ch3区的c-末端)。在一个实施例中,第一–ch2-ch3区包含突起或杵,并且第二–ch2-ch3区包含空腔或臼(例如,如在图5c中描绘)。在实施例中,第一、第二、第三和第四结合和/或功能特异性(分别为配偶体a、配偶体b、配偶体c和配偶体d)各自独立地选自基质修饰部分、酶分子、抗体分子(例如,单链抗体分子(例如,scfv)或fab)、受体分子、配体分子(例如,受体配体或细胞因子分子),例如如本文描述的。第一、第二、第三和第四结合和/或功能特异性可以各自独立地是基质修饰部分、酶分子、抗体分子(例如,单链抗体分子(例如,scfv)或fab)、受体分子、配体分子(例如,受体配体、或细胞因子分子),例如如本文描述的。在一些实施例中,第一、第二、第三和第四结合和/或功能特异性(配偶体a-d,分别对应于结合部分1-4)各自独立地选自肿瘤靶向部分、基质修饰部分、细胞因子分子、nk细胞衔接子、t细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子,例如如本文描述的。在实施例中,第一结合和/或功能特异性是肿瘤靶向部分,第二结合和/或功能特异性是基质修饰部分,并且第三和第四结合和/或功能特异性各自独立地选自细胞因子分子、nk细胞衔接子、t细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子。
在一个实施例中,多功能分子是包含两种不连续的第一和第二多肽的双特异性分子。在实施例中,第一和第二多肽分别包含第一和第二结合位点,其独立地选自基质修饰部分、酶分子、抗体分子(例如,单链抗体分子(例如,scfv)或fab)、受体分子、配体分子(例如,受体配体、或细胞因子分子),例如如本文描述的。在一些实施例中,第一和第二结合和/或功能特异性(分别为结合位点1-2)各自独立地选自基质修饰部分、肿瘤靶向部分、细胞因子分子、nk细胞衔接子、t细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子,例如如本文描述的。在一些实施例中,第一多肽从n-至-c具有以下构型:与例如癌抗原(例如,结合位点#1)结合的第一抗原结构域的第一部分(例如,fab分子的第一vh-ch1),任选地经由接头连接至第二结合和/或功能特异性(例如,结合位点#2,例如基质修饰部分,例如如本文描述的);并且第二多肽从n-至-c具有以下构型:与例如癌抗原(例如,由第一vh-ch1结合的相同的癌抗原,例如结合位点#1)结合的第一抗原结构域的第二部分,例如fab的第一vl-cl(例如,此构型的实例在图16中描绘)。在一个实施例中,双特异性分子包含对应于第一结合和/或功能特异性(结合位点#1)的任选地经由接头连接至第二结合和/或功能特异性(例如,结合位点#2,例如基质修饰部分,例如如本文描述的)的fab。在一些实施例中,第一结合和/或功能特异性(例如,图16中的结合位点#1)是肿瘤靶向部分,例如与癌抗原(例如,肿瘤或基质抗原)结合;并且第二结合和/或功能特异性(例如,图16中的结合位点#2)是基质修饰部分,例如如本文描述的。
在另一个实施例中,多功能分子是双功能(例如,双特异性)分子,其包含两种或至少三种不连续的第一和第二多肽,其中:
(i)第一多肽从n-至c-方向包含第一结合和/或功能特异性(例如,第一抗体分子),任选地经由接头连接至第一免疫球蛋白恒定区(例如,连接至ch3区的ch2)(例如,第一fc区);
(ii)第二多肽从n-至c-方向包含第二免疫球蛋白恒定区(例如,连接至ch3区的ch2)(例如,第二fc区);并且
(任选地)(iii)第三多肽包含第一抗体分子或第二抗体分子的一部分。
在实施例中,第一和第二多肽分别包含第一和第二结合和/或功能特异性(例如,位点),其独立地选自基质修饰部分、酶分子、抗体分子(例如,单链抗体分子(例如,scfv)或fab)、受体分子、配体分子(例如,受体配体、或细胞因子分子),例如如本文描述的。在一些实施例中,第一和第二结合和/或功能特异性(分别为结合位点1-2)是肿瘤靶向部分和基质修饰部分,例如如本文描述的。
在一些实施例中,第一多肽从n-至-c具有以下构型:
(a)与例如癌抗原(例如,实体瘤、基质或血液抗原)(例如,结合位点#1)结合的第一抗原结构域的第一部分(例如,fab分子的第一vh-ch1),任选地经由接头连接至第一免疫球蛋白恒定区(例如,连接至ch3区的ch2)(例如,第一fc区);
(b)作为基质修饰部分的第二结合和/或功能特异性(例如,第二结合位点),任选地经由接头连接至第二免疫球蛋白恒定区(例如,连接至ch3区的ch2)(例如,第二fc区);并且
(c)第三多肽从n-至-c具有以下构型:与例如癌抗原(例如,实体瘤、基质或血液抗原)(例如,由第一vh-ch1结合的相同的癌抗原,例如结合位点#1)结合的第一抗原结构域的第二部分,例如fab的第一vl-cl(例如,此构型的实例在图7中描绘)。
在一个实施例中,双功能(例如,双特异性)分子包含对应于第一结合和/或功能特异性(结合位点#1)的任选地经由接头连接至第一fc区的fab、和任选地经由接头连接至第二fc区的第二结合和/或功能特异性(例如,结合位点#2,例如基质修饰部分,例如如本文描述的)。
在一些实施例中,第一结合和/或功能特异性(例如,图17中的结合位点#1)是肿瘤靶向部分,例如与癌抗原(例如,肿瘤或基质抗原)结合;并且第二结合和/或功能特异性(例如,图17中的结合位点#2)是基质修饰部分,例如如本文描述的。
在实施例中,第一免疫球蛋白恒定区(例如,第一ch2-ch3区)包含突起或杵,例如如本文描述的。
在实施例中,第二免疫球蛋白恒定区(例如,第二ch2-ch3区)包含空腔或臼。在实施例中,第一和第二免疫球蛋白恒定区促进双特异性分子的异源二聚化。
在一个实施例中,多功能分子是三功能(例如,三特异性)分子,其包含两种不连续的第一和第二多肽。在实施例中,第一和第二多肽分别包含第一、第二和第三结合和/或功能特异性,其独立地选自基质修饰部分、酶分子、抗体分子(例如,单链抗体分子(例如,scfv)或fab)、受体分子、配体分子(例如,受体配体、或细胞因子分子),例如如本文描述的。在一些实施例中,第一、第二和第三结合和/或功能特异性(分别为结合位点1-3)各自独立地选自肿瘤靶向部分、基质修饰部分、细胞因子分子、nk细胞衔接子、t细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子,例如如本文描述的。在一些实施例中,第一结合和/或功能特异性(结合位点1)是肿瘤靶向部分,第二结合和/或功能特异性(结合位点2)是基质修饰部分,并且第三结合和/或功能特异性(结合位点3)选自肿瘤靶向部分、基质修饰部分、细胞因子分子、nk细胞衔接子、t细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子,例如如本文描述的。
在一些实施例中,第一多肽从n-至-c具有以下构型:
(i)与例如癌抗原(例如,结合位点#1)结合的第一抗原结构域的第一部分(例如,fab分子的第一vh-ch1),任选地经由接头连接至第二结合和/或功能特异性(例如,结合位点#3,例如细胞因子、配体或第二抗体分子,例如scfv);并且
(ii)第二多肽从n-至-c具有以下构型:与例如肿瘤或基质抗原(例如,由第一vh-ch1结合的相同的肿瘤或基质抗原,例如结合位点#1)结合的第一抗原结构域的第二部分(例如,fab的第一vl-cl),任选地经由接头连接至第三结合和/或功能特异性(例如,结合位点#2,例如基质修饰部分)(例如,此构型的实例在图18中描绘)。
在一个实施例中,双功能(例如,双特异性)分子包含对应于第一结合和/或功能特异性(结合位点#1)的任选地经由接头连接至第二和第三结合和/或功能特异性(例如,结合位点#2和#3)的fab。在一些实施例中,第一结合和/或功能特异性(例如,图18中的结合位点#1)是肿瘤靶向部分,例如与癌抗原(例如,肿瘤、基质或血液抗原)结合;第二结合和/或功能特异性(例如,图18中的结合位点#2)选自细胞因子分子、或免疫细胞衔接子(例如,选自与免疫细胞抗原结合的受体、配体分子或抗体分子(例如,scfv));并且第三结合和/或功能特异性(例如,结合位点#3)是基质修饰部分。在抗体分子是scfv的实施例中,scfv能以vh-vl或vl-vh构型连接至第一多肽的c-末端。
在另一个实施例中,多功能分子是三功能(例如,三特异性)分子,其包含两种或至少三种不连续的第一和第二多肽,其中:
(i)第一多肽从n-至c-方向包含第一结合特异性(例如,第一抗体分子),任选地经由接头连接至第一免疫球蛋白恒定区(例如,连接至ch3区的ch2)(例如,第一fc区);
(ii)第二多肽从n-至c-方向包含第二结合特异性,任选地经由接头连接至第二免疫球蛋白恒定区(例如,连接至ch3区的ch2)(例如,第二fc区);并且
(任选地)(iii)第三多肽包含第一抗体分子或第二抗体分子的一部分,
其中第一或第二多肽进一步包含第三结合和/或功能特异性。
在实施例中,第一和第二多肽分别包含第一、第二、第三结合和/或功能特异性(例如,位点),其独立地选自基质修饰部分、酶分子、抗体分子(例如,单链抗体分子(例如,scfv)或fab)、受体分子、配体分子(例如,受体配体、或细胞因子分子),例如如本文描述的。在一些实施例中,第一、第二和第三结合和/或功能特异性(分别为结合位点1-3)各自独立地选自肿瘤靶向部分、基质修饰部分、细胞因子分子、nk细胞衔接子、t细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子,例如如本文描述的。在一个实施例中,第一结合和/或功能特异性(结合位点#1)是肿瘤靶向部分,第二结合和/或功能特异性(结合位点#2)是免疫细胞衔接子或细胞因子分子,并且第三结合和/或功能特异性(结合位点#3)是基质修饰部分,例如如在图19a或19b中所示)。
在一些实施例中,第一多肽从n-至-c具有以下构型:
(a)与例如肿瘤或基质抗原(例如,结合位点#1)结合的第一抗原结构域的第一部分(例如,fab分子的第一vh-ch1),任选地经由接头连接至第一免疫球蛋白恒定区(例如,连接至ch3区的ch2)(例如,第一fc区);
(b)第二结合和/或功能特异性(例如,第二结合位点),其选自细胞因子分子、或免疫细胞衔接子,任选地经由接头连接至第二免疫球蛋白恒定区(例如,连接至ch3区的ch2)(例如,第二fc区);并且
(c)第三多肽从n-至-c具有以下构型:与例如肿瘤或基质抗原(例如,由第一vh-ch1结合的相同的肿瘤或基质抗原,例如结合位点#1)结合的第一抗原结构域的第二部分(例如,fab的第一vl-cl),
其中第一或第二多肽进一步包含第三结合和/或功能特异性,其任选地经由接头连接至第一或第二免疫球蛋白恒定区(例如,连接至ch3区的ch2)(例如,第一或第二fc区)。在一个实施例中,第三结合特异性任选地经由接头连接至第一免疫球蛋白恒定区(例如,连接至ch3区的ch2)(例如,第一fc区)。在另一个实施例中,第三结合特异性任选地经由接头连接至第二免疫球蛋白恒定区(例如,连接至ch3区的ch2)(例如,第二fc区)。这些构型的实例在图19a-19b中描绘。
在一个实施例中,三功能(例如,三特异性)分子包含对应于第一结合和/或功能特异性(结合位点#1)的任选地经由接头连接至第一fc区的fab;以及任选地经由接头连接至第二fc区的第二结合和/或功能特异性(例如,结合位点#2),其进一步包含第三结合和/或功能特异性(例如,结合位点#3)(例如,如在图19a中描绘)。在其他实施例中,三功能(例如,三特异性)分子包含对应于第一结合和/或功能特异性(结合位点#1)的任选地经由接头连接至第一fc区的fab,其进一步包含第三结合和/或功能特异性(例如,结合位点#3);以及任选地经由接头连接至第二fc区的第二结合和/或功能特异性(例如,结合位点#2)(例如,如在图19b中描绘)。
在一些实施例中,(a)第一结合和/或功能特异性(例如,图19a-19b中的结合位点#1)是肿瘤靶向部分,例如与癌抗原(例如,肿瘤或基质抗原)结合;(b)第二结合和/或功能特异性(例如,图19a-19b中的结合位点#2)选自细胞因子分子、或免疫细胞衔接子(例如,选自与免疫细胞抗原结合的受体、配体分子或抗体分子(例如,scfv));并且(c)第三结合和/或功能特异性(例如,图19a-19b中的结合位点#3)是基质修饰部分。在抗体分子是scfv的实施例中,scfv能以vh-vl或vl-vh构型连接至第一多肽的c-末端。
在实施例中,第一免疫球蛋白恒定区(例如,第一ch2-ch3区)包含突起或杵,例如如本文描述的。
在实施例中,第二免疫球蛋白恒定区(例如,第二ch2-ch3区)包含空腔或臼。在实施例中,第一和第二免疫球蛋白恒定区促进双特异性分子的异源二聚化。
在另一个实施例中,多功能分子是四功能(例如,四特异性)分子,其包含两种或至少三种不连续的第一和第二多肽,其中:
(i)第一多肽从n-至c-方向包含第一结合和/或功能特异性(例如,第一抗体分子),任选地经由接头连接至第一免疫球蛋白恒定区(例如,连接至ch3区的ch2)(例如,第一fc区);
(ii)第二多肽从n-至c-方向包含第二结合和/或功能特异性,任选地经由接头连接至第二免疫球蛋白恒定区(例如,连接至ch3区的ch2)(例如,第二fc区);并且
(任选地)(iii)第三多肽包含第一抗体分子或第二抗体分子的一部分,
其中第一或第二多肽进一步包含第三和第四结合和/或功能特异性。
在实施例中,第一和第二多肽分别包含第一、第二、第三和第四结合和/或功能特异性(例如,位点),其独立地选自基质修饰部分、酶分子、抗体分子(例如,单链抗体分子(例如,scfv)或fab)、受体分子、配体分子(例如,受体配体、或细胞因子分子),例如如本文描述的。在一些实施例中,第一、第二、第三和第四结合和/或功能特异性(分别为结合位点1-4)各自独立地选自肿瘤靶向部分、基质修饰部分、细胞因子分子、nk细胞衔接子、t细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子,例如如本文描述的。
在一些实施例中,第一多肽从n-至-c具有以下构型:
(a)与例如肿瘤或基质抗原(例如,结合位点#1)结合的第一抗原结构域的第一部分(例如,fab分子的第一vh-ch1),任选地经由接头连接至第一免疫球蛋白恒定区(例如,连接至ch3区的ch2)(例如,第一fc区);
(b)第二结合和/或功能特异性(例如,第二结合位点),其选自细胞因子分子、或免疫细胞衔接子,任选地经由接头连接至第二免疫球蛋白恒定区(例如,连接至ch3区的ch2)(例如,第二fc区);并且
(c)第三多肽从n-至-c具有以下构型:与例如肿瘤或基质抗原(例如,由第一vh-ch1结合的相同的肿瘤或基质抗原,例如结合位点#1)结合的第一抗原结构域的第二部分(例如,fab的第一vl-cl),
其中第一和第二多肽进一步分别包含第三和第四结合和/或功能特异性,其各自任选地经由接头连接至第一和第二免疫球蛋白恒定区(例如,连接至ch3区的ch2)(例如,第一和第二fc区)。在一个实施例中,第三结合和/或功能特异性任选地经由接头连接至第二免疫球蛋白恒定区(例如,连接至ch3区的ch2)(例如,第二fc区)。并且第四结合和/或功能特异性任选地经由接头连接至第一免疫球蛋白恒定区(例如,连接至ch3区的ch2)(例如,第一fc区)。这些构型的实例在图20中描绘。
在一个实施例中,四功能(例如,四特异性)分子包含对应于第一结合和/或功能特异性(结合位点#1)的任选地经由接头连接至第一fc区的fab,其进一步包含第四结合和/或功能特异性(例如,结合位点#4);以及任选地经由接头连接至第二fc区的第二结合和/或功能特异性(例如,结合位点#2),其进一步包含第三结合和/或功能特异性(例如,结合位点#3)(例如,如在图20中描绘)。在其他实施例中,四功能(例如,四特异性)分子包含对应于第一结合和/或功能特异性(结合位点#1)的任选地经由接头连接至第一fc区的fab,其进一步包含第三结合和/或功能特异性(例如,结合位点#3);以及任选地经由接头连接至第二fc区的第二结合和/或功能特异性(例如,结合位点#2),其进一步包含第四结合和/或功能特异性(例如,结合位点#4)。
在一些实施例中,(a)第一结合和/或功能特异性(例如,图20中的结合位点#1)是肿瘤靶向部分,例如与癌抗原(例如,肿瘤、基质或血液抗原)结合;第二和第四结合和/或功能特异性(例如,图20中的结合位点#2和#4)各自独立地选自细胞因子分子、或免疫细胞衔接子(例如,选自与免疫细胞抗原结合的受体、配体分子或抗体分子(例如,scfv));并且第三结合和/或功能特异性(例如,图20中的结合位点#3)是基质修饰部分。在抗体分子是scfv的实施例中,scfv能以vh-vl或vl-vh构型连接至第一多肽的c-末端。
在另一个实施例中,(a)第一结合和/或功能特异性是肿瘤靶向部分,例如与癌抗原(例如,肿瘤、基质或血液抗原)结合;(b)第二结合和/或功能特异性是选自与免疫细胞抗原结合的受体、配体分子或抗体分子(例如,scfv)的免疫细胞衔接子(例如,nk细胞衔接子);(c)第三结合和/或功能特异性是细胞因子分子或免疫细胞衔接子;并且(d)第四结合和/或功能特异性是基质修饰部分。在抗体分子是scfv的实施例中,scfv能以vh-vl或vl-vh构型连接至第一多肽的c-末端。
在一个实施例中,(a)第一结合和/或功能特异性是肿瘤靶向部分,例如与癌抗原(例如,肿瘤或基质抗原)结合;(b)第二结合和/或功能特异性是基质修饰部分;(c)第三结合和/或功能特异性是选自与免疫细胞抗原结合的配体分子或抗体分子(例如,scfv)的免疫细胞衔接子(例如,巨噬细胞或树突细胞衔接子);并且(d)第四结合和/或功能特异性是选自与免疫细胞抗原结合的配体分子或抗体分子(例如,scfv)的免疫细胞衔接子(例如,巨噬细胞或树突细胞衔接子)。在抗体分子是scfv的实施例中,scfv能以vh-vl或vl-vh构型连接至第一多肽的c-末端。
在实施例中,第一免疫球蛋白恒定区(例如,第一ch2-ch3区)包含突起或杵,例如如本文描述的。
在实施例中,第二免疫球蛋白恒定区(例如,第二ch2-ch3区)包含空腔或臼。在实施例中,第一和第二免疫球蛋白恒定区促进双特异性分子的异源二聚化。
在一些实施例中,多功能分子在n末端至c末端方向上包含下式:
r1-(任选地l1)-r2;
r2-(任选地l1)-r1;
其中:
(i)r1包含1种、2种或更多种基质修饰部分,例如如本文描述的相同或不同的基质修饰部分;
(ii)r2包含1种、2种或更多种肿瘤靶向部分,例如如本文描述的相同或不同的肿瘤靶向部分;并且
(iii)任选地,l1是接头(例如,本文描述的接头)。
在一些实施例中,多功能分子进一步包含r3,其中r3包含1种、2种或更多种细胞因子分子,例如本文描述的细胞因子分子。
在一些实施例中,多功能分子进一步包含r4,其中r4包含1种、2种或更多种免疫细胞衔接子(例如,本文描述的nk细胞衔接子、t细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子)。
在一些实施例中,本发明描述了包含本文描述的r1、r2、r3和r4的多功能分子。
在一些实施例中,多功能分子在n末端至c末端方向上包含下式:
r1-(任选地l1)-r2-(任选地l2)-r3/r4;
r1-(任选地l1)-r3/r4-(任选地l2)-r2;
r2-(任选地l1)-r1-(任选地l2)-r3/r4;
r2-(任选地l1)-r3/r4-(任选地l2)-r1;
r3/r4-(任选地l1)-r1-(任选地l2)-r2;或者
r3/r4-(任选地l1)-r2-(任选地l2)-r1;
其中:
(i)r1包含1种、2种或更多种基质修饰部分(例如,本文描述的部分)(例如,相同或不同的基质修饰部分);
(ii)r2包含1种、2种或更多种肿瘤靶向部分(例如,本文描述的部分)(例如,相同或不同的肿瘤靶向部分);
(iii)r3包含1种、2种或更多种细胞因子分子,例如细胞因子分子(例如,本文描述的细胞因子分子)(例如,相同或不同的细胞因子分子);
(iv)r4包含1种、2种或更多种免疫细胞衔接子(例如,nk细胞衔接子、t细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子(例如,本文描述的免疫细胞衔接子));并且
其中:
r3和r4都存在;
r3存在且r4不存在;
r4存在且r3不存在;并且
任选地,l1和/或l2是接头(例如,本文描述的接头)。
在一些实施例中,多功能分子具有以下构型:
(i)基质修饰部分连接至与肿瘤或基质抗原结合的fab的重链(例如,vh–ch1),从n-至c-末端,任选地包含在fab与基质修饰部分之间的gly-ser接头;和/或
(ii)fab的轻链(例如,vl–cl1),从n-至c-末端。
在其他实施例中,针对间皮素的fab(例如,vh–ch1)偶联至透明质酸酶分子或胶原酶分子iv,例如包含以下fab氨基酸序列:
qvqlqqsgpelekpgasvkisckasgysftgytmnwvkqshgkslewiglitpyngassynqkfrgkatltvdkssstaymdllsltsedsavyfcarggydgrgfdywgqgttvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrvepkscdktht(seqidno:79)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:79的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列;以及
透明质酸酶分子或胶原酶分子iv中的一种或两种,例如包含:
(i)以下的透明质酸酶分子氨基酸序列:
frgpllpnrpfttvwnantqwclerhgvdvdvsvfdvvanpgqtfrgpdmtifyssqgtypyytptgepvfgglpqnasliahlartfqdilaaipapdfsglavidweawrprwafnwdtkdiyrqrsralvqaqhpdwpapqveavaqdqfqgaarawmagtlqlgralrprglwgfygfpdcynydflspnytgqcpsgiraqndqlgwlwgqsralypsiympavlegtgksqmyvqhrvaeafrvavaagdpnlpvlpyvqifydttnhflpldelehslgesaaqgaagvvlwvswentrtkescqaikeymdttlgpfilnvtsgallcsqalcsghgrcvrrtshpkallllnpasfsiqltpgggplslrgalsledqaqmavefkcrcypgwqapwcerksmw(seqidno:62)、或其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:62的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列;或者
(ii)seqidno:63的胶原酶分子氨基酸序列、或其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:63的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列,任选地包含在fab与透明质酸酶分子或胶原酶分子iv之间的gly-ser接头。
在一些实施例中,第二多肽包含肿瘤或基质抗原的fab的轻链(例如,vl–cl1)。在一些实施例中,fab的轻链与间皮素结合,例如包含以下氨基酸序列:
dieltqspaimsaspgekvtmtcsasssvsymhwyqqksgtspkrwiydtsklasgvpgrfsgsgsgnsysltissveaeddatyycqqwsgypltfgagtkleikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec(seqidno:80)、或其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:80的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在其他实施例中,针对fap的fab(例如,vh–ch1)偶联至透明质酸酶分子或胶原酶分子iv,例如包含以下fab氨基酸序列:
qvqlvqsgaevkkpgasvkvscktsrytfteytihwvrqapgqrlewigginpnngipnynqkfkgrvtitvdtsastaymelsslrsedtavyycarrriaygydeghamdywgqgtlvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrvepksc(seqidno:81)、或其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:81的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列;以及
透明质酸酶分子或胶原酶分子iv中的一种或两种,例如包含:
(i)以下的透明质酸酶分子氨基酸序列:
frgpllpnrpfttvwnantqwclerhgvdvdvsvfdvvanpgqtfrgpdmtifyssqgtypyytptgepvfgglpqnasliahlartfqdilaaipapdfsglavidweawrprwafnwdtkdiyrqrsralvqaqhpdwpapqveavaqdqfqgaarawmagtlqlgralrprglwgfygfpdcynydflspnytgqcpsgiraqndqlgwlwgqsralypsiympavlegtgksqmyvqhrvaeafrvavaagdpnlpvlpyvqifydttnhflpldelehslgesaaqgaagvvlwvswentrtkescqaikeymdttlgpfilnvtsgallcsqalcsghgrcvrrtshpkallllnpasfsiqltpgggplslrgalsledqaqmavefkcrcypgwqapwcerksmw(seqidno:62)、或其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:62的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列;或者
(ii)seqidno:63的胶原酶分子氨基酸序列、或其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:63的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列,任选地包含在fab与透明质酸酶分子或胶原酶iv分子之间的gly-ser接头。vh的氨基酸序列加下划线,并且ch1的氨基酸序列不加下划线显示。
在一些实施例中,第二多肽包含fap的fab的轻链(例如,vl–cl1)。在一些实施例中,fab的轻链与fap结合,例如包含以下氨基酸序列:
divmtqspdslavslgeratinckssqsllysrnqknylawyqqkpgqppkllifwastresgvpdrfsgsgfgtdftltisslqaedvavyycqqyfsypltfgqgtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec(seqidno:49)、或其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:49的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。vl的氨基酸序列加下划线,并且cl1的氨基酸序列不加下划线显示。
在一些实施例中,多功能分子进一步包含促进第一和第二多肽的关联的第一和第二结构域,例如第一和第二免疫球蛋白链恒定区(例如,第一和第二fc区)。
在一些实施例中,(i)第一多肽具有以下构型:fab的重链(例如,vh–ch1)至第一fc区(例如,ch2至ch3),从n-至c-末端;并且(ii)第二多肽具有以下构型:fab的轻链(例如,vh–ch1)至第二fc区(例如,ch2至ch3),从n-至c-末端。
在一些实施例中,第一免疫球蛋白链恒定区(例如,第一fc区)包含以下氨基酸序列:
dkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvctlppsreemtknqvslscavkgfypsdiavewesngqpennykttppvldsdgsfflvskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk(seqidno:82)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:82的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在一些实施例中,第二免疫球蛋白链恒定区(例如,第二fc区)包含以下氨基酸序列:
dkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppcreemtknqvslwclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk,(seqidno:83)、其片段、或与其基本上相同(例如,与其95%至99.9%相同,或与seqidno:83的氨基酸序列具有至少一个氨基酸改变,但不超过五个、十个或十五个改变(例如,取代、缺失、或插入,例如保守取代))的氨基酸序列。
在一些实施例中,多功能分子进一步包含至少一种细胞因子分子(例如,r3)和/或至少一种免疫细胞衔接子(例如,r4)(例如,nk细胞衔接子、t细胞衔接子、b细胞衔接子、树突细胞衔接子、或巨噬细胞衔接子)。在一些实施例中,基质修饰部分(例如,r1)、肿瘤靶向部分(例如,r2)、以及细胞因子分子(例如,r3)和/或免疫细胞衔接子(例如,r4)中的一种或两种在相同的多肽中,例如,其中例如,在n-至c-方向上,基质修饰部分是第一多肽,肿瘤靶向部分是第二多肽,并且细胞因子分子和/或免疫细胞衔接子中的一种或两种任选地经由接头连接。
在一些实施例中,基质修饰部分(例如,r1)、肿瘤靶向部分(例如,r2)、以及细胞因子分子(例如,r3)和/或免疫细胞衔接子(例如,r4)中的一种或两种在相同的多肽中,例如,其中例如在n-至c-方向上,肿瘤靶向部分是第一多肽,基质修饰部分是第二多肽,并且细胞因子分子和/或免疫细胞衔接子中的一种或两种任选地经由多肽连接。在一些实施例中,基质修饰部分、肿瘤靶向部分、以及细胞因子分子(例如,r3)和/或免疫细胞衔接子(例如,r4)中的一种或两种在不同的多肽中,例如非共价连接的第一和第二多肽。
在一些实施例中,1)第一多肽例如在n-至c-方向上包含第一肿瘤靶向部分(例如,r2)、基质修饰部分(例如,r1)、以及任选地促进第一和第二多肽的关联的第一结构域,例如第一免疫球蛋白链恒定区(例如,第一fc区);2)第二多肽例如在n-至c-方向上包含第二肿瘤靶向部分(例如,r2)、以及任选地促进第一和第二多肽的关联的第二结构域,例如第二免疫球蛋白链恒定区(例如,第二fc区);并且3)第一和/或第二多肽中的一种或两种例如在n-至c-方向上进一步包含细胞因子分子(例如,r3)和/或免疫细胞衔接子(例如,r4)。
在一些实施例中,第一肿瘤靶向部分包含肿瘤靶向抗体分子(例如,fab)的重链可变结构域;并且第二肿瘤靶向部分包含肿瘤靶向抗体分子(例如,fab)的轻链可变结构域。在一些实施例中,第一肿瘤靶向部分包含肿瘤靶向抗体的轻链可变结构域;并且第二多肽的肿瘤靶向部分包含肿瘤靶向抗体的重链可变结构域。
在一些实施例中,多功能分子包含a)第一多肽,所述第一多肽包含:促进第一和第二多肽的关联的结构域,例如fc分子;和两种多肽,一种包含肿瘤靶向部分并且另一种包含基质修饰部分;b)第二多肽,所述第二多肽包含:促进第一和第二多肽的关联的结构域,例如fc分子;以及选自以下的两种多肽:肿瘤靶向部分;免疫细胞衔接子;和细胞因子分子,其中多功能分子包含肿瘤靶向部分和基质修饰部分;以及免疫细胞衔接子或细胞因子分子中的一种或两种。
在一些实施例中,多功能分子包含:肿瘤靶向部分;基质修饰部分;和免疫细胞衔接子;肿瘤靶向部分;基质修饰部分;和细胞因子分子;肿瘤靶向部分;基质修饰部分;免疫细胞衔接子;和细胞因子分子;肿瘤靶向部分;基质修饰部分;和两种免疫细胞衔接子;肿瘤靶向部分;基质修饰部分;和两种细胞因子分子;两种肿瘤靶向部分;基质修饰部分;和免疫细胞衔接子;或肿瘤靶向部分;基质修饰部分;和两种免疫细胞衔接子。
在一些实施例中,多功能分子包含:i)第一多肽例如在n-c或c-n方向上包含肿瘤靶向部分;促进第一和第二多肽的关联的结构域,例如fc分子;和基质修饰部分;ii)第一多肽例如在n-c或c-n方向上包含肿瘤靶向部分;促进第一和第二多肽的关联的结构域,例如fc分子;和细胞因子分子和/或免疫细胞衔接子;或iii)第一多肽例如在n-c或c-n方向上包含细胞因子;促进第一和第二多肽的关联的结构域,例如fc分子;和免疫细胞衔接子;并且iv)第二多肽例如在n-c或c-n方向上包含肿瘤靶向部分;促进第一和第二多肽的关联的结构域,例如fc分子;和基质修饰部分;ii)第二多肽例如在n-c或c-n方向上包含肿瘤靶向部分;促进第一和第二多肽的关联的结构域,例如fc分子;和细胞因子分子和/或免疫细胞衔接子;或iii)第二多肽例如在n-c或c-n方向上包含细胞因子;促进第一和第二多肽的关联的结构域,例如fc分子;和基质修饰部分。
在一些实施例中,肿瘤靶向部分对间皮素或fap具特异性;基质修饰部分包括透明质酸酶分子或胶原酶iv分子、或片段或其变体;细胞因子分子包括il-15分子;免疫细胞衔接子包括cd40l分子;并且免疫细胞衔接子包括b7h6分子。
示例性的多特异性和多功能分子以及对应的核酸和氨基酸序列
表1.核酸序列。
表2.用于构建orf的序列。
表3.orf的核酸序列。
表4.抗原的核酸序列。
表5.氨基酸序列。
表6.全重链和轻链的氨基酸序列。
表7.用于构建多特异性分子的链的氨基酸序列。
表8.抗原的氨基酸序列。
表9.用于产生多特异性分子的序列。
表10.核酸序列。
表11.用于构建orf的序列。
表12.orf的核酸序列。
表13.使用的抗原的dna序列。
表14.氨基酸序列。
表15.全重链和轻链的氨基酸序列。
表16.用于构建多特异性分子的链的氨基酸序列。
表17.抗原的序列。
表18.用于产生多特异性分子的序列。
核酸
本发明的特征还在于核酸,所述核酸包含编码如本文描述的抗体分子的重链和轻链可变区以及cdr或高变环的核苷酸序列。例如,本发明的特征在于分别编码选自本文披露的一种或多种抗体分子的抗体分子的重链和轻链可变区的第一和第二核酸。核酸可以包含如本文表中列出的核苷酸序列、或与其基本上相同的序列(例如,与其至少约85%、90%、95%、99%或更高相同,或与本文表中列出的序列相差不超过3个、6个、15个、30个、或45个核苷酸的序列)。
在某些实施例中,核酸可以包含编码来自重链可变区的至少一个、两个、或三个cdr或者高变环的核苷酸序列,所述重链可变区具有如本文表中列出的氨基酸序列、或与其基本上同源的序列(例如,与其至少约85%、90%、95%、99%或更高相同,和/或具有一个或多个取代(例如,保守取代)的序列)。在其他实施例中,核酸可以包含编码来自轻链可变区的至少一个、两个、或三个cdr或者高变环的核苷酸序列,所述轻链可变区具有如本文表中列出的氨基酸序列、或与其基本上同源的序列(例如,与其至少约85%、90%、95%、99%或更高相同,和/或具有一个或多个取代(例如,保守取代)的序列)。在还另一个实施例中,核酸可以包含编码来自重链和轻链可变区的至少一个、两个、三个、四个、五个、或六个cdr或者高变环的核苷酸序列,所述重链和轻链可变区具有如本文表中列出的氨基酸序列、或与其基本上同源的序列(例如,与其至少约85%、90%、95%、99%或更高相同,和/或具有一个或多个取代(例如,保守取代)的序列)。
在某些实施例中,核酸可以包含编码来自重链可变区的至少一个、两个、或三个cdr或者高变环的核苷酸序列,所述重链可变区具有如本文表中列出的核苷酸序列、与其基本上同源的序列(例如,与其至少约85%、90%、95%、99%或更高相同,和/或能够在本文描述的严格条件下杂交的序列)。在另一个实施例中,核酸可以包含编码来自轻链可变区的至少一个、两个、或三个cdr或者高变环的核苷酸序列,所述轻链可变区具有如本文表中列出的核苷酸序列、或与其基本上同源的序列(例如,与其至少约85%、90%、95%、99%或更高相同,和/或能够在本文描述的严格条件下杂交的序列)。在还另一个实施例中,核酸可以包含编码来自重链和轻链可变区的至少一个、两个、三个、四个、五个、或六个cdr或者高变环的核苷酸序列,所述重链和轻链可变区具有如本文表中列出的核苷酸序列、或与其基本上同源的序列(例如,与其至少约85%、90%、95%、99%或更高相同,和/或能够在本文描述的严格条件下杂交的序列)。
在另一方面,本申请的特征在于含有本文描述的核酸的宿主细胞和载体。核酸可以存在于单个载体中或者相同宿主细胞或分开的宿主细胞中存在的分开的载体中,如下文更详细地描述。
载体
本文进一步提供了包含编码本文描述的抗体分子的核苷酸序列的载体。在一个实施例中,载体包含编码本文描述的抗体分子的核苷酸。在一个实施例中,载体包含本文描述的核苷酸序列。载体包括但不限于病毒、质粒、粘粒、λ噬菌体或酵母人工染色体(yac)。
可以使用许多载体系统。例如,一类载体利用衍生自动物病毒的dna元件,所述动物病毒是例如像牛乳头瘤病毒、多瘤病毒、腺病毒、痘苗病毒、杆状病毒、逆转录病毒(劳氏肉瘤病毒、mmtv或momlv)或sv40病毒。另一类载体利用衍生自rna病毒的rna元件,所述rna病毒是如塞姆利基森林病毒(semlikiforestvirus)、东部马脑炎病毒和黄病毒。
另外,可以通过引入允许选择经转染的宿主细胞的一种或多种标记来选择已将dna稳定整合到其染色体中的细胞。标记物可以提供例如营养缺陷型宿主的原养型(prototropy)、杀生物剂抗性(例如,抗生素)、或对重金属(如铜)的抗性等。选择性标记基因可以直接与待表达的dna序列连接,或通过共转化引入同一细胞中。还可能需要另外的元件来最佳地合成mrna。这些元件可以包括剪接信号、以及转录启动子、增强子、和终止信号。
一旦制备出含有构建体的表达载体或dna序列用于表达,就可以将表达载体转染或引入适当的宿主细胞中。可以采用各种技术来实现这一点,例如像原生质体融合、磷酸钙沉淀、电穿孔、逆转录病毒转导、病毒转染、基因枪、基于脂质的转染或其他常规技术。在原生质体融合的情况下,使细胞在培养基中生长并筛选适当的活性。
用于培养所得经转染的细胞和回收所产生的抗体分子的方法和条件是本领域技术人员已知的,并且可以取决于本说明书中所用的特定表达载体和哺乳动物宿主细胞进行改变或优化。
细胞
在另一方面,本申请的特征在于含有本文描述的核酸的宿主细胞和载体。核酸可以存在于单个载体中或者相同宿主细胞或分开的宿主细胞中存在的分开的载体中。宿主细胞可以是真核细胞(例如,哺乳动物细胞、昆虫细胞、酵母细胞)、或原核细胞(例如,大肠杆菌)。例如,哺乳动物细胞可以是经培养的细胞或细胞系。示例性哺乳动物细胞包括淋巴细胞系(例如,nso)、中国仓鼠卵巢细胞(cho)、cos细胞、卵母细胞、和来自转基因动物的细胞(例如,乳腺上皮细胞)。
本发明还提供了包含编码如本文描述的抗体分子的核酸的宿主细胞。
在一个实施例中,将宿主细胞基因工程化为包含编码抗体分子的核酸。
在一个实施例中,通过使用表达盒对宿主细胞进行基因工程化。短语“表达盒”是指能够影响基因在与此类序列相容的宿主中的表达的核苷酸序列。此类盒可以包含启动子,具有或不具有内含子的开放阅读框、和终止信号。还可以使用在影响表达中必需或有帮助的另外的因子,例如像诱导型启动子。
本发明还提供了包含本文描述的载体的宿主细胞。
细胞可以是但不限于真核细胞、细菌细胞、昆虫细胞或人细胞。合适的真核细胞包括但不限于vero细胞、hela细胞、cos细胞、cho细胞、hek293细胞、bhk细胞和mdckii细胞。合适的昆虫细胞包括但不限于sf9细胞。
用途和组合疗法
本文描述的方法包括通过使用本文描述的多特异性分子(例如,使用本文描述的药物组合物)治疗受试者的癌症。还提供了用于减轻或改善受试者的癌症症状的方法,以及用于抑制癌症生长和/或杀死一种或多种癌细胞的方法。在实施例中,在给予本文描述的或本文描述的药物组合物的受试者中,本文描述的方法减小肿瘤的大小和/或减少癌细胞的数量。
在实施例中,癌症是血液癌。在实施例中,血液癌是白血病或淋巴瘤。如本文所用,“血液癌”是指造血或淋巴组织的肿瘤,例如影响血液、骨髓、或淋巴结的肿瘤。示例性的恶性血液病包括但不限于白血病(例如,急性成淋巴细胞性白血病(all)、急性髓性白血病(aml)、慢性淋巴细胞白血病(cll)、慢性髓细胞性白血病(cml)、毛细胞白血病、急性单核细胞白血病(amol)、慢性粒单核细胞白血病(cmml)、幼年型粒单核细胞白血病(jmml)、或大颗粒淋巴细胞白血病)、淋巴瘤(例如,aids相关的淋巴瘤、皮肤t细胞淋巴瘤、霍奇金淋巴瘤(例如,经典型霍奇金淋巴瘤或结节性淋巴细胞为主型霍奇金淋巴瘤)、蕈样肉芽肿病、非霍奇金淋巴瘤(例如,b细胞非霍奇金淋巴瘤(例如,伯基特淋巴瘤、小淋巴细胞淋巴瘤(cll/sll)、弥漫性大b细胞淋巴瘤、滤泡性淋巴瘤、免疫母细胞性大细胞淋巴瘤、前体b淋巴母细胞淋巴瘤、或套细胞淋巴瘤)或t细胞非霍奇金淋巴瘤(蕈样肉芽肿病、间变性大细胞淋巴瘤、或前体t淋巴母细胞淋巴瘤))、原发性中枢神经系统淋巴瘤、塞扎里氏综合征、华氏巨球蛋白血症)、慢性骨髓增殖性肿瘤、朗格汉斯细胞组织细胞增生症、多发性骨髓瘤/浆细胞肿瘤、骨髓增生异常综合征、或骨髓增生异常/骨髓增生性肿瘤。
在实施例中,癌症是实体癌。示例性实体癌包括但不限于卵巢癌、直肠癌、胃癌、睾丸癌、肛门区癌、子宫癌、结肠癌、直肠癌、肾细胞癌、肝癌、非小细胞肺癌、小肠癌、食管癌、黑色素瘤、卡波西肉瘤、内分泌系统癌症、甲状腺癌、甲状旁腺癌、肾上腺癌、骨癌、胰腺癌、皮肤癌、头颈癌、皮肤或眼内恶性黑色素瘤、子宫癌、脑干胶质瘤、垂体腺瘤、表皮样癌、宫颈鳞状细胞癌、输卵管癌、子宫内膜癌、阴道癌、软组织肉瘤、尿道癌、外阴癌、阴茎癌、膀胱癌、肾癌或输尿管癌、肾盂癌、脊髓轴肿瘤、中枢神经系统(cns)肿瘤、原发性cns淋巴瘤、肿瘤血管生成、所述癌症的转移性病灶、或其组合。
在实施例中,多特异性分子(或药物组合物)以适合于待治疗或预防的疾病的方式给予。给药的数量和频率将由如患者的状况以及患者的疾病的类型和严重性等因素决定。适当的剂量可以通过临床试验确定。例如,当指示“有效量”或“治疗量”时,医生可以考虑肿瘤大小、感染或转移的程度、受试者的年龄、体重和状况的个体差异来确定待给予的药物组合物(或多特异性分子)的精确量。在实施例中,可以将本文描述的药物组合物以104至109个细胞/kg体重(例如105至106个细胞/kg体重)的剂量给予,包括在那些范围内的所有整数值。在实施例中,可以将本文描述的药物组合物以这些剂量多次给予。在实施例中,可以使用免疫疗法中描述的融合技术给予本文描述的药物组合物(参见例如,rosenberg等人,neweng.j.ofmed.[新英格兰医学杂志]319:1676,1988)。
在实施例中,将多特异性分子或药物组合物肠胃外地给予受试者。在实施例中,将细胞静脉内地、皮下地、肿瘤内地、结内地、肌内地、皮内地、或腹膜内地给予受试者。在实施例中,将细胞直接给予(例如,注射)到肿瘤或淋巴结中。在实施例中,将细胞作为输注(例如,如描述在rosenberg等人,neweng.j.ofmed.[新英格兰医学杂志]319:1676,1988)或静脉推注给予。在实施例中,将细胞作为长效可注射配制品给予。
在实施例中,受试者是哺乳动物。在实施例中,受试者是人、猴、猪、狗、猫、牛、绵羊、山羊、兔、大鼠、或小鼠。在实施例中,受试者是人。在实施例中,受试者是儿科受试者,例如小于18岁,例如小于17岁、16岁、15岁、14岁、13岁、12岁、11岁、10岁、9岁、8岁、7岁、6岁、5岁、4岁、3岁、2岁、1岁或以下。在实施例中,受试者是成年人,例如至少18岁,例如至少19岁、20岁、21岁、22岁、23岁、24岁、25岁、25岁-30岁、30-35岁、35岁-40岁、40岁-50岁、50岁-60岁、60岁-70岁、70岁-80岁、或80岁-90岁。
组合疗法
本文披露的多特异性分子可以与第二治疗剂或程序组合使用。
在实施例中,在诊断受试者患有癌症之后(例如,在癌症被从受试者体内消除之前),给予/进行多特异性分子和第二治疗剂或程序。在实施例中,将多特异性分子和第二治疗剂或程序同时地或并行地给予/进行。例如,当第二治疗的递送开始时,仍然发生一种治疗的递送,例如,治疗的给予存在重叠。在其他实施例中,将多特异性分子和第二治疗剂或程序顺序地给予/进行。例如,在开始另一种治疗的递送之前停止递送一种治疗。
在实施例中,组合疗法可以导致比单独使用任一种药剂的单一疗法更有效的治疗。在实施例中,第一和第二治疗的组合比单独的第一或第二治疗更有效(例如,导致症状和/或癌细胞的更大减少)。在实施例中,与作为单一疗法给予时实现类似效果通常所需的第一或第二治疗剂量相比,组合疗法允许使用较低剂量的第一或第二治疗。在实施例中,组合疗法具有部分累加效应、完全累加效应或大于累加效应。
在一个实施例中,将多特异性分子与疗法(例如,癌症疗法)(例如,一种或多种抗癌剂、免疫疗法、光动力疗法(pdt)、手术和/或放射)组合给予。术语“化学疗法”、“化疗剂”和“抗癌剂”在本文中可互换地使用。可以顺序地(有或没有重叠)或同时地给予多特异性分子和疗法(例如,癌症疗法)。在治疗(例如,癌症疗法)过程中,可以连续地或间歇地给予多特异性分子。本文描述的某些疗法可以用于治疗癌症和非癌疾病。例如,使用本文描述的方法和组合物可以增强pdt在癌和非癌病症(例如,结核病)中的功效(综述在例如agostinis,p.等人(2011)cacancerj.clin.[临床医生的癌症杂志]61:250-281)。
抗癌疗法
在其他实施例中,将多特异性分子与低或小分子量化疗剂组合给予。示例性的低或小分子量化疗剂包括但不限于13-顺式-视黄酸(异维甲酸,
在另一个实施例中,将多特异性分子与生物制剂一起给予。在治疗癌症中有用的生物制剂是本领域已知的,并且本发明的结合分子可以例如与此类已知的生物制剂一起给予。例如,fda批准了以下用于治疗乳腺癌的生物制剂:
此外,fda批准了以下用于治疗结肠直肠癌的生物制剂:
对于肺癌的治疗,示例性生物制剂包括
对于多发性骨髓瘤的治疗,示例性生物制剂包括
另外的示例性癌症治疗性抗体包括但不限于3f8、阿巴伏单抗、阿德木单抗(adecatumumab)、阿夫土珠、培阿赛珠单抗(alacizumabpegol)、阿仑单抗
在其他实施例中,将多特异性分子与病毒癌症治疗剂组合给予。示例性病毒癌症治疗剂剂包括但不限于痘苗病毒(vvdd-cdsr)、表达癌胚抗原的麻疹病毒、重组痘苗病毒(tk缺失加gm-csf)、senecavalley病毒-001、新城病毒、柯萨奇病毒a21、gl-onc1、表达ebna1c-末端/lmp2嵌合蛋白的重组修饰的痘苗安卡拉痘苗、表达癌胚抗原的麻疹病毒、g207溶瘤病毒、表达p53的经修饰的痘苗安卡拉疫苗、oncovexgm-csf修饰的单纯性疱疹1病毒、禽痘病毒疫苗载体、重组痘苗前列腺特异性抗原疫苗、人乳头瘤病毒16/18l1病毒样颗粒/as04疫苗、mva-ebna1/lmp2注射疫苗、四价hpv疫苗、四价人乳头瘤病毒(6型、11型、16型、18型)重组疫苗
在其他实施例中,将多特异性分子与纳米药物组合给予。示例性癌症纳米药物包括但不限于
在一些实施例中,将多特异性分子与紫杉醇或紫杉醇配制品(例如,
用于治疗癌症的示例性rnai和反义rna剂包括但不限于calaa-01、sig12dloder(localdrugeluter)、和aln-vsp02。
其他癌症治疗剂剂包括但不限于细胞因子(例如,阿地白介素(il-2,白介素-2,
在一些实施例中,将多特异性分子与酪氨酸激酶抑制剂(例如,受体酪氨酸激酶(rtk)抑制剂)组合使用。示例性酪氨酸激酶抑制剂包括但不限于表皮生长因子(egf)途径抑制剂(例如,表皮生长因子受体(egfr)抑制剂)、血管内皮生长因子(vegf)途径抑制剂(例如,针对vegf的抗体、阿柏西普(vegftrap)、血管内皮生长因子受体(vegfr)抑制剂(例如,vegfr-1抑制剂、vegfr-2抑制剂、vegfr-3抑制剂))、血小板衍生生长因子(pdgf)途径抑制剂(例如,血小板衍生生长因子受体(pdgfr)抑制剂(例如,pdgfr-β抑制剂))、raf-1抑制剂、kit抑制剂和ret抑制剂。在一些实施例中,与ahcm剂组合使用的抗癌剂选自下组,该组由以下组成:阿西替尼(ag013736)、伯舒替尼(ski-606)、西地尼布(recentintm,azd2171)、达沙替尼(
在一个实施例中,将多特异性分子与以下中的一种或多种组合给予:抗血管生成剂、或血管靶向剂或血管破坏剂。示例性抗血管生成剂包括但不限于vegf抑制剂(例如,抗vegf抗体(例如,贝伐单抗);vegf受体抑制剂(例如,伊曲康唑);细胞增殖的抑制剂和/或内皮细胞迁移的抑制剂(例如,羧胺三唑,tnp-470);血管生成刺激剂的抑制剂(例如,苏拉明)等。血管靶向剂(vta)或血管破坏剂(vda)旨在破坏引起中心坏死的癌症肿瘤的脉管系统(血管)(综述在例如thorpe,p.e.(2004)clin.cancerres.[临床癌症研究]第10卷:415-427)。vta可以是小分子。示例性小分子vta包括但不限于使微管不稳定的药物(例如,康普瑞汀a-4磷酸二钠(ca4p)、zd6126、ave8062、oxi4503);和vadimezan(asa404)。
免疫检查点抑制剂
在其他实施例中,本文描述的方法包括将免疫检查点抑制剂与多特异性分子组合使用。所述方法可用于体内疗法方案。
在实施例中,免疫检查点抑制剂抑制检查点分子。示例性检查点分子包括但不限于ctla4、pd1、pd-l1、pd-l2、tim3、lag3、cd160、2b4、cd80、cd86、b7-h3(cd276)、b7-h4(vtcn1)、hvem(tnfrsf14或cd270)、btla、kir、mhci类、mhcii类、gal9、vista、btla、tigit、lair1、和a2ar。参见例如,pardoll.nat.rev.cancer[自然癌症综述]12.4(2012):252-64,通过引用并入本文。
在实施例中,免疫检查点抑制剂是pd-1抑制剂,例如抗pd-1抗体,如纳武单抗(nivolumab)、派姆单抗或pidilizumab。纳武单抗(也称为mdx-1106,mdx-1106-04,ono-4538,或bms-936558)是特异性抑制pd1的全人igg4单克隆抗体。参见例如,us8,008,449和wo2006/121168。派姆单抗(也称为lambrolizumab,mk-3475,mk03475,sch-900475或
在一些实施例中,pd-1抑制剂是免疫粘附素,例如包含融合至恒定区(例如,免疫球蛋白的fc区)的pd-1配体(例如,pd-l1或pd-l2)的细胞外/pd-1结合部分的免疫粘附素。在实施例中,pd-1抑制剂是amp-224(b7-dcig,例如描述在wo2011/066342和wo2010/027827中),一种阻断b7-h1与pd-1之间的相互作用的pd-l2fc融合可溶性受体。
在实施例中,免疫检查点抑制剂是pd-l1抑制剂,例如抗体分子。在一些实施例中,pd-l1抑制剂是yw243.55.s70、mpdl3280a、medi-4736、msb-0010718c、或mdx-1105。在一些实施例中,抗pd-l1抗体是msb0010718c(也称为a09-246-2;默克雪兰诺公司(merckserono)),其是与pd-l1结合的单克隆抗体。示例性人源化抗pd-l1抗体描述在例如wo2013/079174中。在一个实施例中,pd-l1抑制剂是抗pd-l1抗体,例如yw243.55.s70。yw243.55.s70抗体描述在例如wo2010/077634中。在一个实施例中,pd-l1抑制剂是mdx-1105(也称为bms-936559),其描述在例如wo2007/005874中。在一个实施例中,pd-l1抑制剂是mdpl3280a(基因泰克/罗氏公司(genentech/roche)),其是针对pd-l1的人fc-优化的igg1单克隆抗体。参见例如,美国专利号:7,943,743和美国公开号:20120039906。在一个实施例中,pd-l1的抑制剂是具有与yw243.55.s70、mpdl3280a、medi-4736、msb-0010718c、或mdx-1105的序列基本上相同或相似的序列(例如,与其至少85%、90%、95%或更高相同的序列)的抗体分子。
在实施例中,免疫检查点抑制剂是pd-l2抑制剂,例如amp-224(其是阻断pd1与b7-h1之间的相互作用的pd-l2fc融合可溶性受体)。参见例如,wo2010/027827和wo2011/066342。
在一个实施例中,免疫检查点抑制剂是lag-3抑制剂,例如抗lag-3抗体分子。在实施例中,抗lag-3抗体是bms-986016(也称为bms986016;百时美施贵宝公司)。bms-986016和其他人源化抗lag-3抗体描述在例如us2011/0150892、wo2010/019570、和wo2014/008218中。
在实施例中,免疫检查点抑制剂是tim-3抑制剂,例如抗tim3抗体分子,例如描述在美国专利号:8,552,156、wo2011/155607、ep2581113和美国公开号:2014/044728。
在实施例中,免疫检查点抑制剂是ctla-4抑制剂,例如抗ctla-4抗体分子。示例性抗ctla4抗体包括替西木单抗(来自辉瑞公司(pfizer)的igg2单克隆抗体,以前称为ticilimumab,cp-675,206);和伊匹单抗(也称为mdx-010,cas号477202-00-9)。其他示例性抗ctla-4抗体描述在例如美国专利号5,811,097中。
实例
以下实例旨在是说明性的,并不意味着以任何方式进行限制。
针对多特异性分子及其用途的实例
一般方法:
1.质粒的构建。
将编码蛋白质序列的dna优化用于在灰仓鼠(cricetulusgriseus)中表达,合成,并使用gateway克隆而克隆到pcdna3.4-topo(lifetechnologiesa14697)中。所有构建体都含有igκ前导序列(seqidno:84atggaaaccgacacactgctgctgtgggtgctgctcttgtgggtgccaggatctacagga,seqidno16:metdtlllwvlllwvpgstg)。使用的核酸序列在表1中显示。
2.表达和纯化。
将质粒共转染到expi293细胞(lifetechnologiesa14527)或expicho细胞(lifetechnologiesa29127)中。使用1mg多特异性构建体的总dna进行转染,所述多特异性构建体具有1:1杵比臼重链比和3:2轻链比重链比。当需要生物素化时,除多特异性构建体dna外,每升添加250μg的seqidno:226bira。使用线性25,000da聚乙烯亚胺(pei,polysciencesinc23966)与总dna以3:1的比例进行expi293细胞中的转染。将dna和pei各自添加至50ml的optimem(lifetechnologies31985088)培养基中并无菌过滤。将dna和pei合并10分钟并添加至expi293细胞中,细胞密度为1.8–2.8x106个细胞/ml并且存活率为至少95%。根据制造商的说明进行expicho转染。在转染之后使expi293细胞在潮湿的培养箱中在37℃与8%co2下生长5天-7天,并使expicho细胞在32℃与5%co2下生长14天。将细胞通过在4500xg下离心来沉淀并将上清液通过0.2μm膜过滤。将蛋白质a树脂(ge17-1279-03)添加至过滤的上清液中并在室温下孵育1小时-3小时。将树脂填充到柱中,用3x10个柱体积的杜氏磷酸盐缓冲盐水(dpbs,lifetechnologies14190-144)洗涤。用20mm柠檬酸盐、100mmnacl(ph2.9)从柱上洗脱结合的蛋白质。必要时,使用配体亲和力和/或尺寸排阻色谱法在superdex200柱上用dpbs的运行缓冲液进一步纯化蛋白质。
3.elisa测定。
使用pierce96孔链霉亲和素涂覆的高容量板(15500)或nunc-immuno96孔maxisorp板(invitrogen44-2404-21)进行elisa测定。用1x磷酸盐缓冲盐水吐温20(pierce28352)洗涤板,并且然后用10μg/ml捕获蛋白涂覆。在室温下伴随振荡孵育2小时后,将板用1xpbst洗涤并使用1μm–1pm的连续稀释液在a-g行中添加分子。将板孵育30分钟,洗涤,并向每个孔中添加100μl的过氧化物酶缀合的affinipure山羊抗人igg(109-035-008)或链霉亲和素-hrp(r&dsystemsdy998)。将板伴随振荡孵育30分钟,洗涤,并向每个孔中添加100μl的1-stepturbotmb-elisa底物溶液(thermoscientific34022)。将板孵育5分钟,将反应用100μl的1mhcl终止,并在spectramaxi3x读板仪上使用450nm处的吸光度读取板。4.细胞杀伤测定。
为了评估所产生的构建体的活性,进行bxpc3-荧光素酶细胞杀伤测定。将含有荧光素酶(genecopiascl-c012-hlg)的bxpc3细胞在含1μg/ml嘌呤霉素(gibcoa1113802)的rpmi1640(gibco11875119)和10%胎牛血清(gibco10082147)中生长。将细胞用于接种96孔板,每孔15,000个细胞。在孵育一天后,将培养基去除并用含0.5%pen/strep(gibco15140122)的无血清培养基rpmi1640替换。将在无血清培养基中的pbmc(c.t.l.lot#lp_123)以450,000个细胞/孔添加至96孔板的a-g行。将化合物一式三份地添加到列中,在a-f行中浓度范围为1μm至1pm。在测量之前将板孵育6小时或24小时。在进行细胞杀伤测量之前,从每个孔中取出120μl并添加到96孔低结合蛋白板中。这在板中留下80μl,并向每个孔中添加80μl的bright-glo(promegae2610)。然后在spectramaxi3x读板仪上读板。
5.细胞因子释放测定。
对于细胞因子释放测定,用quansys洗涤缓冲液将从细胞杀伤板中取出的上清液稀释5倍。按照制造商的说明,使用quansys人ifnγ(quansys464649hu)单重测定试剂盒。使板在bioradchemidocxrs+上成像,并使用quansysq-view软件进行分析。
实例1
通过用seqidno:116、seqidno:118、和seqidno:119共转染细胞来表达含有靶向间皮素的fab臂和il2效应臂的包含三条不同蛋白质链seqid:168、seqid:169、和seqid:196的多特异性分子1。纯化多特异性分子1,并且最终产物的sds-page凝胶显示在图21中。图43显示了多特异性分子1的尺寸排阻色谱图。用seqidno:181的人间皮素进行的elisa给出112pm的ec50(图48)。图53显示评估了与seqidno:182的人il2受体α的结合并给出111pm的ec50。细胞杀伤测定中的ec50是79pm(图58)。图59显示了测定中多特异性分子1的ifnγ的细胞因子释放数据。
实例2
通过用seqidno:117、seqidno:118、和seqidno:119共转染细胞来表达含有靶向间皮素的fab臂、il2效应臂、和抗nkp30nk细胞衔接子的包含seqid:174、seqid:169、seqid:196的多特异性分子2。纯化多特异性分子2,并且最终产物的sds-page凝胶显示在图22中。用seqidno:181的人间皮素进行的elisa给出1.38nm的ec50(图48)。图53显示了与seqidno:182的人il2受体α的结合,ec50为154pm。与从seqidno:180产生的人nkp30的结合给出230nm的ec50(图55)。细胞杀伤测定中的ec50是4.7pm(图58)。图59显示了测定中多特异性分子2的ifnγ的细胞因子释放数据。
实例3
通过用seqidno:117、seqidno:118、和seqidno:125共转染细胞来表达含有间皮素靶向臂和抗nkp30nk细胞衔接子的包含seqidno:174、seqidno:169、和seqidno:197的多特异性分子3。纯化多特异性分子3,并且最终产物的sds-page凝胶显示在图23中。用seqidno:181的人间皮素进行的elisa给出152pm的ec50(图48)。与从seqidno:180产生的人nkp30的结合给出93.4nm的ec50(图55)。细胞杀伤测定中的ec50是5.9pm(图58)。图59显示了测定中多特异性分子3的ifnγ的细胞因子释放数据。
实例4
通过用seqidno:124和seqidno:119共转染细胞来表达含有il2效应臂的包含seqid:176和seqid:196的多特异性分子4。纯化多特异性分子4,并且最终产物的sds-page凝胶显示在图24中。图53显示评估了与seqidno:182的人il2受体α的结合并给出110pm的ec50。细胞杀伤测定中的ec50是41pm(图58)。图59显示了测定中多特异性分子4的ifnγ的细胞因子释放数据。
实例5
通过用seqidno:122、seqidno:123、seqidno:135、和seqidno:121共转染细胞来表达含有间皮素靶向臂和pdl1靶向臂的包含seqid:172、seqidno:173、seqidno:192、和seqid:171的多特异性分子5。纯化多特异性分子5,并且最终产物的sds-page凝胶显示在图25中。图44显示了多特异性分子5的尺寸排阻色谱图。用seqidno:181的人间皮素进行的elisa给出163nm的ec50(图49)。用seqidno:178的人pdl1进行的elisa给出250pm的ec50(图51)。在细胞杀伤测定中多特异性分子5没有显著作用(图60)。
实例6
通过用seqidno:122、seqidno:123、seqidno:120、和seqidno:121共转染细胞来表达含有间皮素靶向臂、pdl1靶向臂、和il2效应臂的包含seqid:172、seqidno:173、seqidno:177、和seqid:171的多特异性分子6。纯化多特异性分子6,并且最终产物的sds-page凝胶显示在图26中。用seqidno:181的人间皮素进行的elisa给出13.1nm的ec50(图49)。用seqidno:178的人pdl1进行的elisa给出363pm的ec50(图51)。图54显示评估了与seqidno:182的人il2受体α的结合并给出156pm的ec50。多特异性分子6在细胞杀伤测定中展示159pm的ec50,在图60中显示。
实例7
通过用seqidno:136、seqidno:123、seqidno:135、和seqidno:121共转染细胞来表达含有间皮素靶向臂、pdl1靶向臂、和抗nkp46nk细胞衔接子的包含seqid:193、seqid:173、seqidno:192、和seqidno:171的多特异性分子7。纯化多特异性分子7,并且最终产物的sds-page凝胶显示在图27中。用seqidno:181的人间皮素进行的elisa给出2.37nm的ec50(图49)。用seqidno:178的人pdl1进行的elisa给出158pm的ec50(图51)。图56显示了与来自seqidno:179的人nkp46的结合,ec50为450pm。多特异性分子7在细胞杀伤测定中显示出细胞的增殖,ec50为15pm(图60)。
实例8
通过用seqidno:136、seqidno:123、seqidno:135、和seqidno:121共转染细胞来表达含有间皮素靶向臂、pdl1靶向臂、il2效应臂、和抗nkp46nk细胞衔接子的包含seqid:193、seqidno:173、seqidno:192、和seqid:171的多特异性分子8。纯化多特异性分子8,并且最终产物的sds-page凝胶显示在图28中。用seqidno:181的人间皮素进行的elisa给出1.77nm的ec50(图49)。用seqidno:178的人pdl1进行的elisa给出255pm的ec50(图52)。图54显示了与seqidno:182的人il2受体α的结合,ec50为84pm。图57显示了与来自seqidno:179的人nkp46的结合,ec50为670pm。多特异性分子8在细胞杀伤测定中显示出细胞的增殖,ec50为44pm(图60)。
实例9
通过用seqidno:136、seqidno:123、seqidno:135、和seqidno:121共转染细胞来表达含有间皮素靶向臂、pdl1靶向臂、和抗nkp46nk细胞衔接子的包含seqid:193、seqid:173、seqidno:192、和seqidno:171的多特异性分子9。纯化多特异性分子9,并且最终产物的sds-page凝胶显示在图29中。用seqidno:181的蛋白质1进行的elisa给出275nm的ec50(图50)。用seqidno:178的人pdl1进行的elisa给出124pm的ec50(图51)。图56显示了与来自seqidno:179的人nkp46的结合,ec50为6.2nm。多特异性分子9在细胞杀伤测定中显示出细胞的增殖,ec50为84pm(图)。
实例10
通过用seqidno:136、seqidno:123、seqidno:135、和seqidno:121共转染细胞来表达含有间皮素靶向臂、pdl1靶向臂、il2效应臂、和抗nkp46nk细胞衔接子的包含seqid:193、seqidno:173、seqidno:192、和seqid:171的多特异性分子10。纯化多特异性分子10,并且最终产物的sds-page凝胶显示在图30中。用seqidno:181的人间皮素进行的elisa给出263nm的ec50(图50)。用seqidno:178的人pdl1进行的elisa给出1.91nm的ec50(图52)。图54显示了与seqidno:182的人il2受体α的结合,ec50为88pm。图57显示了与来自seqidno:179的人nkp46的结合,ec50为1.8nm。多特异性分子10在细胞杀伤测定中显示出细胞的增殖,ec50为35pm(图61)。
实例11
通过用seqidno:136、seqidno:123、seqidno:135、和seqidno:121共转染细胞来表达含有间皮素靶向臂、pdl1靶向臂、和抗nkp46nk细胞衔接子的包含seqid:193、seqid:173、seqidno:192、和seqidno:171的多特异性分子11。纯化多特异性分子11,并且最终产物的sds-page凝胶显示在图31中。图45显示了多特异性分子11的尺寸排阻色谱图。用seqidno:178的人pdl1进行的elisa给出206pm的ec50(图52)。图56显示了与来自seqidno:179的人nkp46的结合,ec50为8.7nm。多特异性分子11在细胞杀伤测定中显示出细胞的增殖,ec50为119pm(图62)。
实例12
通过用seqidno:136、seqidno:123、seqidno:135、和seqidno:121共转染细胞来表达含有间皮素靶向臂、pdl1靶向臂、il2效应臂、和抗nkp46nk细胞衔接子的包含seqid:193、seqidno:173、seqidno:192、和seqid:171的多特异性分子12。纯化多特异性分子12,并且最终产物的sds-page凝胶显示在图32中。图26显示了多特异性分子12的尺寸排阻色谱图。用seqidno:181的人间皮素进行的elisa给出216nm的ec50(图50)。用seqidno:178的人pdl1进行的elisa给出1.82nm的ec50(图52)。图54显示了与seqidno:182的人il2受体α的结合,ec50为107pm。图57显示了与来自seqidno:179的人nkp46的结合,ec50为19.3nm。多特异性分子12在细胞杀伤测定中显示出细胞的增殖,ec50为16pm(图62)。
实例13
通过用seqidno:dnabh022、seqidno:128、和seqidno:127共转染细胞来表达含有her3靶向臂、igf1r靶向臂、和il2效应臂的包含seqid:187、seqidno:185、和seqid:184的多特异性分子13。纯化多特异性分子13,并且最终产物的sds-page凝胶显示在图33中。图47显示了多特异性分子13的尺寸排阻色谱图。用来自seqidno:182的人il2rα的多特异性分子13的elisa给出85pm的ec50(图65)。细胞杀伤测定中的ec50是14pm(图67)。图68显示了测定中多特异性分子13的ifnγ的细胞因子释放数据。
实例14
通过用seqidno:131、seqidno:126、和seqidno:127共转染细胞来表达含有her3靶向臂、igf1r靶向臂、和抗nkp46nk细胞衔接子的包含seqid:188、seqidno:183、和seqid:184的多特异性分子14。纯化多特异性分子14,并且最终产物的sds-page凝胶显示在图34中。图66显示了与来自seqidno:179的人nkp46的结合,ec50为2.3nm。细胞杀伤测定中的ec50是100pm(图67)。图68显示了测定中多特异性分子14的ifnγ的细胞因子释放数据。
实例15
通过用seqidno:132、seqidno:126、和seqidno:127共转染细胞来表达含有her3靶向臂、igf1r靶向臂、和cd3靶向臂的包含seqid:189、seqidno:183、和seqid:184的多特异性分子15。纯化多特异性分子15,并且最终产物的sds-page凝胶显示在图35中。细胞杀伤测定中的ec50是277pm(图69)。图70显示了测定中多特异性分子15的ifnγ的细胞因子释放数据。
实例16
通过用seqidno:131、seqidno:128、和seqidno:127共转染细胞来表达含有her3靶向臂、igf1r靶向臂、抗nkp46nk细胞衔接子、和il2效应臂的包含seqid:188、seqidno:185、和seqid:184的多特异性分子16。纯化多特异性分子16,并且最终产物的sds-page凝胶显示在图36中。用来自seqidno:182的人il2rα的多特异性分子16的elisa给出167pm的ec50(图65)。细胞杀伤测定中的ec50是330pm(图67)。图68显示了测定中多特异性分子16的ifnγ的细胞因子释放数据。
实例17
通过用seqidno:132、seqidno:128、和seqidno:127共转染细胞来表达含有her3靶向臂、igf1r靶向臂、cd3靶向臂、和il2效应臂的包含seqid:189、seqidno:185、和seqid:184的多特异性分子17。纯化多特异性分子17,并且最终产物的sds-page凝胶显示在图37中。用来自seqidno:182的人il2rα的多特异性分子17的elisa给出116pm的ec50(图65)。细胞杀伤测定中的ec50是18pm(图69)。图70显示了测定中多特异性分子17的ifnγ的细胞因子释放数据。
实例18
通过用seqidno:dnabh022、seqidno:126、和seqidno:127共转染细胞来表达含有her3靶向臂和igf1r靶向臂的包含seqid:187、seqidno:183、和seqid:184的多特异性分子18。纯化多特异性分子18,并且最终产物的sds-page凝胶显示在图38中。细胞杀伤测定中的ec50是28pm(图67)。图68显示了测定中多特异性分子18的ifnγ的细胞因子释放数据。
实例19
通过用seqidno:130、seqidno:129、和seqidno:127共转染细胞来表达含有her3靶向臂、igf1r靶向臂、和il7效应臂的包含seqid:187、seqidno:186、和seqid:184的多特异性分子19。纯化多特异性分子19,并且最终产物的sds-page凝胶显示在图39中。
实例20
通过用seqidno:132、seqidno:129、和seqidno:127共转染细胞来表达含有her3靶向臂、igf1r靶向臂、cd3靶向臂、和il7效应臂的包含seqid:189、seqidno:186、和seqid:184的多特异性分子20。纯化多特异性分子20,并且最终产物的sds-page凝胶显示在图40中。细胞杀伤测定中的ec50是445pm(图71)。图72显示了测定中多特异性分子20的ifnγ的细胞因子释放数据。
实例21
通过用seqidno:133、seqidno:118、seqidno:128、和seqidno:127共转染细胞来表达含有her3靶向臂、igf1r靶向臂、抗nkp46nk细胞衔接子、和il7效应臂的包含seqid:190、seqidno:169、seqidno:186、和seqid:184的多特异性分子21。纯化多特异性分子21,并且最终产物的sds-page凝胶显示在图41中。图46显示了与来自seqidno:179的人nkp46的结合,ec50为1.3nm。细胞杀伤测定中的ec50是770pm(图73)。图74显示了测定中多特异性分子21的ifnγ的细胞因子释放数据。实例22
通过用seqidno:133、seqidno:118、seqidno:135、和seqidno:134共转染细胞来表达含有间皮素靶向臂、pdl1靶向臂与il2效应子、和抗nkp46nk细胞衔接子的包含seqid:190、seqidno:169、seqidno:192、和seqid:191的多特异性分子22。纯化多特异性分子22,并且最终产物的sds-page凝胶显示在图42中。用来自seqidno:181的人间皮素的多特异性分子22的elisa给出310pm的ec50(图63)。图44展示了特异性分子22与来自seqidno:178的人pdl1的结合的数据,ec50为8pm。用来自seqidno:182的人il2rα的多特异性分子22的elisa给出8.2nm的ec50(图65)。图46显示了与来自seqidno:179的人nkp46的结合,ec50为2.4nm。细胞杀伤测定中的ec50是995pm(图75)。图76显示了测定中多特异性分子22的ifnγ的细胞因子释放数据。
实例23
通过用seqidno:116、seqidno:118、seqidno:135、和seqidno:121共转染细胞来表达含有间皮素靶向臂和pdl1靶向臂的包含seqidno:168、seqidno:169、seqidno:192、和seqidno:171的多特异性分子23。纯化多特异性分子23并用于图75中显示的细胞杀伤测定,给出250pm的ec50。图76显示了测定中多特异性分子23的ifnγ的细胞因子释放数据。
针对包含基质修饰部分的多特异性分子及其用途的实例
一般方法:
1.质粒的构建。
将编码蛋白质序列的dna优化用于在灰仓鼠中表达,合成,并使用gateway克隆而克隆到pcdna3.4-topo(lifetechnologiesa14697)中。所有构建体都含有igκ前导序列(seqidno:84atggaaaccgacacactgctgctgtgggtgctgctcttgtgggtgccaggatctacagga,seqidno:64metdtlllwvlllwvpgstg)。使用的核酸序列在表10中显示。
2.表达和纯化。
将质粒共转染到expi293细胞(lifetechnologiesa14527)或expicho细胞(lifetechnologiesa29127)中。使用1mg多特异性构建体的总dna进行转染,所述多特异性构建体具有1:1杵比臼重链比和3:2轻链比重链比。当需要生物素化时,除多特异性构建体dna外,每升添加250μg的seqid:144226bira。使用线性25,000da聚乙烯亚胺(pei,polysciencesinc23966)与总dna以3:1的比例进行expi293细胞中的转染。将dna和pei各自添加至50ml的optimem(lifetechnologies31985088)培养基中并无菌过滤。将dna和pei合并10分钟并添加至expi293细胞中,细胞密度为1.8–2.8x106个细胞/ml并且存活率为至少95%。根据制造商的说明进行expicho转染。在转染之后使expi293细胞在潮湿的培养箱中在37℃与8%co2下生长5天-7天,并使expicho细胞在32℃与5%co2下生长14天。将细胞通过在4500xg下离心来沉淀并将上清液通过0.2μm膜过滤。将蛋白质a树脂(ge17-1279-03)添加至过滤的上清液中并在室温下孵育1小时-3小时。将树脂填充到柱中,用3x10个柱体积的杜氏磷酸盐缓冲盐水(dpbs,lifetechnologies14190-144)洗涤。用20mm柠檬酸盐、100mmnacl(ph2.9)从柱上洗脱结合的蛋白质。必要时,使用配体亲和力和/或尺寸排阻色谱法在superdex200柱上用dpbs的运行缓冲液进一步纯化蛋白质。
3.elisa测定。
使用pierce96孔链霉亲和素涂覆的高容量板(15500)或nunc-immuno96孔maxisorp板(invitrogen44-2404-21)进行elisa测定。用1x磷酸盐缓冲盐水吐温20(pierce28352)洗涤板,并且然后用10μg/ml捕获蛋白涂覆。在室温下伴随振荡孵育2小时后,将板用1xpbst洗涤并使用1μm–1pm的连续稀释液在a-g行中添加分子。将板孵育30分钟,洗涤,并向每个孔中添加100μl的过氧化物酶缀合的affinipure山羊抗人igg(109-035-008)或链霉亲和素-hrp(r&dsystemsdy998)。将板伴随振荡孵育30分钟,洗涤,并向每个孔中添加100μl的1-stepturbotmb-elisa底物溶液(thermoscientific34022)。将板孵育5分钟,将反应用100μl的1mhcl终止,并在spectramaxi3x读板仪上使用450nm处的吸光度读取板。
4.细胞杀伤测定。
为了评估所产生的构建体的活性,进行bxpc3-荧光素酶细胞杀伤测定。将含有荧光素酶(genecopiascl-c012-hlg)的bxpc3细胞在含1μg/ml嘌呤霉素(gibcoa1113802)的rpmi1640(gibco11875119)和10%胎牛血清(gibco10082147)中生长。将细胞用于接种96孔板,每孔15,000个细胞。在孵育一天后,将培养基去除并用含0.5%pen/strep(gibco15140122)的无血清培养基rpmi1640替换。将在无血清培养基中的pbmc(c.t.l.lot#lp_123)以450,000个细胞/孔添加至96孔板的a-g行。将化合物一式三份地添加到列中,在a-f行中浓度范围为1μm至10pm。在测量之前将板孵育6小时或24小时。在进行细胞杀伤测量之前,从每个孔中取出120μl并添加到96孔低结合蛋白板中。这在板中留下80μl,并向每个孔中添加80μl的bright-glo(promegae2610)。然后在spectramaxi3x读板仪上读板。
5.细胞因子释放测定。
对于细胞因子释放测定,用quansys洗涤缓冲液将从细胞杀伤板中取出的上清液稀释5倍。按照制造商的说明,使用quansys人ifnγ(quansys464649hu)单重测定试剂盒。使板在bioradchemidocxrs+上成像,并使用quansysq-view软件进行分析。
6.比浊透明质酸酶测定。
为了测试透明质酸酶活性,如先前描述的进行酶测定(dorfman,a.,ott,m.l.aturbidimetricmethodfortheassayofhyaluronidase[比浊法测定透明质酸酶],journalofbiologicalchemistry[生物化学杂志],1948)。在300mm磷酸钠(ph5.35)中以1mg/ml制备透明质酸(sigma53747)的储备溶液。将含透明质酸酶的构建体在20mm磷酸钠(ph7.0)、77mm氯化钠、0.01%牛血清蛋白(sigmaa6003)中稀释至1mg/ml。将从0.01mg/ml至1mg/ml的酶构建体与1mg/ml透明质酸合并,并在37℃下孵育45分钟。然后将酸化的bsa溶液(24mm乙酸钠、79mm乙酸、0.1%牛血清蛋白,ph3.75)添加至酶和底物中。在室温下孵育10分钟之后,用540nm处的吸光度测量活性。透明质酸酶活性被视为吸光度的降低,因为酶会分解透明质酸。
7.透明质酸酶酶谱。
为了进一步证明透明质酸酶活性,制备含有0.1mg/ml透明质酸(sigma53747)的12%sds-page凝胶。使构建体在凝胶上跑胶,并且然后将凝胶在3%tritonx-100(sigma93443)中孵育一小时。然后将凝胶在测定缓冲液(20mm柠檬酸盐、150mm氯化钠,ph3.5)中在37℃下孵育16小时。使用0.5%alcianblue(sigmab8438)对凝胶染色用于透明质酸酶活性,所述染料将透明质酸染为蓝色并在酶降解透明质酸的地方留下清晰斑点。
8.明胶酶a酶测定。
根据制造商的说明,使用enzchek明胶酶/胶原酶测定试剂盒(molecularprobese-12055)测定含有mmp-2的构建体的酶活性。
实例24
通过用seqidno:202、seqidno:203、和seqidno:207共转染细胞来表达含有靶向fap的fab臂和透明质酸酶臂的包含三条不同蛋白质链seqid:214、seqid:215、和seqid:219的多特异性分子24。纯化多特异性分子23,并且最终产物的sds-page凝胶显示在图77中。多特异性分子23的尺寸排阻色谱图显示在图86中。用从seqidno:225产生的人fap进行elisa并给出144nm的ec50(图94)。图98证明多特异性分子24具有透明质酸酶活性。透明质酸酶酶谱中在蓝色背景上白色条带的存在(图100)进一步证明了多特异性分子24的透明质酸酶活性。
实例25
通过用seqidno:206、seqidno:203、和seqidno:207共转染细胞来表达含有靶向fap的fab臂、il2效应臂、和透明质酸酶臂的包含seqid:218、seqid:215、seqid:219的多特异性分子25。纯化多特异性分子24,并且最终产物的sds-page凝胶显示在图78中。多特异性分子24的尺寸排阻色谱图显示在图87中。用从seqidno:225产生的人fap进行elisa并给出128nm的ec50(图94)。图781显示了多特异性分子25与人il2rα(从seqidno:182产生)的结合,ec50为101nm。图98证明多特异性分子25具有透明质酸酶活性。透明质酸酶酶谱中在蓝色背景上白色条带的存在(图100)进一步证明了多特异性分子25的透明质酸酶活性。
实例26
通过用seqidno:202、seqidno:203、和seqidno:212共转染细胞来表达含有fap靶向臂和透明质酸酶臂的包含seqidno:214、seqidno:215、和seqidno:224的多特异性分子26。纯化多特异性分子25,并且最终产物的sds-page凝胶显示在图79中。多特异性分子25的尺寸排阻色谱图显示在图88中。用从seqidno:225产生的人fap进行elisa并给出18.5nm的ec50(图94)。图98证明多特异性分子26具有透明质酸酶活性。透明质酸酶酶谱中在蓝色背景上白色条带的存在(图100)进一步证明了多特异性分子26的透明质酸酶活性。
实例27
通过用seqidno:121、seqidno:207、和seqidno:208共转染细胞来表达含有pdl1靶向臂、fap靶向臂、和透明质酸酶臂的包含seqid:220、seqid:171、seqidno:219、和seqidno:215的多特异性分子27。纯化多特异性分子26,并且最终产物的sds-page凝胶显示在图80中。用seqidno:178的人pdl1进行的elisa给出52pm的ec50(图93)。用从seqidno:225产生的人fap进行elisa并给出44nm的ec50(图94)。图99证明多特异性分子27具有透明质酸酶活性。透明质酸酶酶谱中在蓝色背景上白色条带的存在(图100)进一步证明了多特异性分子27的透明质酸酶活性。
实例28
通过用seqidno:209、seqidno:121、seqidno:207、和seqidno:208共转染细胞来表达含有pdl1靶向臂、fap靶向臂、il2效应臂、和透明质酸酶臂的包含seqid:221、seqid:171、seqidno:219、和seqidno:215的多特异性分子28。纯化多特异性分子27,并且最终产物的sds-page凝胶显示在图81中。多特异性分子27的尺寸排阻色谱图显示在图90中。用seqidno:178的人pdl1进行的elisa给出0.207nm的ec50(图93)。用从seqidno:225产生的人fap进行elisa并给出69nm的ec50(图95)。图97显示了多特异性分子27与人il2rα(从seqidno:182产生)的结合,ec50为97nm。图99证明多特异性分子28具有透明质酸酶活性。透明质酸酶酶谱中在蓝色背景上白色条带的存在(图100)进一步证明了多特异性分子28的透明质酸酶活性。
实例29
通过用seqidno:209、seqidno:121、seqidno:210、和seqidno:211共转染细胞来表达含有pdl1靶向臂、抗nkp46nk细胞衔接子、il2效应臂、和透明质酸酶臂的包含seqid:221、seqid:171、seqidno:222、和seqidno:223的多特异性分子29。纯化多特异性分子28,并且最终产物的sds-page凝胶显示在图82中。多特异性分子28的尺寸排阻色谱图显示在图91中。用seqidno:178的人pdl1进行的elisa给出的866pm的ec50(图93)。用来自seqidno:179的人nkp46的elisa给出126pm的ec50(图96)。图97显示了多特异性分子6与人il2rα(从seqidno:182产生)的结合,ec50为48nm。图99证明多特异性分子29具有透明质酸酶活性。透明质酸酶酶谱中在蓝色背景上白色条带的存在(图100)进一步证明了多特异性分子29的透明质酸酶活性。
实例30
通过用seqidno:202、seqidno:203、和seqidno:207共转染细胞来表达含有fap靶向臂和明胶酶臂的包含seqid:214、seqid:215、和seqidno:216的多特异性分子30。纯化多特异性分子29,并且最终产物的sds-page凝胶显示在图83中。多特异性分子30的尺寸排阻色谱图显示在图92中。用从seqidno:225产生的人fap进行elisa并给出385nm的ec50(图95)。图101证明多特异性分子30具有胶原酶活性。
实例31
通过用seqidno:202、seqidno:203、和seqidno:d205共转染细胞来表达含有fap靶向臂和明胶酶臂的包含seqid:214、seqid:215、和seqidno:217的多特异性分子31。纯化多特异性分子30,并且最终产物的sds-page凝胶显示在图84中。多特异性分子31的尺寸排阻色谱图显示在图93中。用从seqidno:225产生的人fap进行elisa并给出466nm的ec50(图95)。图101证明多特异性分子31具有胶原酶活性。
实例32
通过用seqidno:209、seqidno:121、seqidno:204、和seqidno:203共转染细胞来表达含有pdl1靶向臂、fap靶向臂、il2效应臂、和明胶酶臂的包含seqid:221、seqid:171、seqidno:216、和seqidno:215的多特异性分子32。纯化多特异性分子31,并且最终产物的sds-page凝胶显示在图85中。用seqidno:178的人pdl1进行的elisa给出155pm的ec50(图93)。用从seqidno:225产生的人fap进行elisa并给出85nm的ec50(图95)。图97显示了多特异性分子32与人il2rα(从seqidno:182产生)的结合,ec50为36nm。图101证明多特异性分子32具有胶原酶活性。
通过引用并入
在本文中提及的所有出版物和专利都通过引用以其整体而特此并入,如同各个单独的出版物或专利被确切地并且单独地指明为通过引用而并入。
等效物
本领域技术人员仅使用常规实验就将认识到或能够确定本文描述的本发明的具体实施例的许多等效物。此类等效物旨在由以下权利要求所涵盖。
- 还没有人留言评论。精彩留言会获得点赞!