用于评估癌症的多重优化错配扩增(MOMA)实时PCR的制作方法
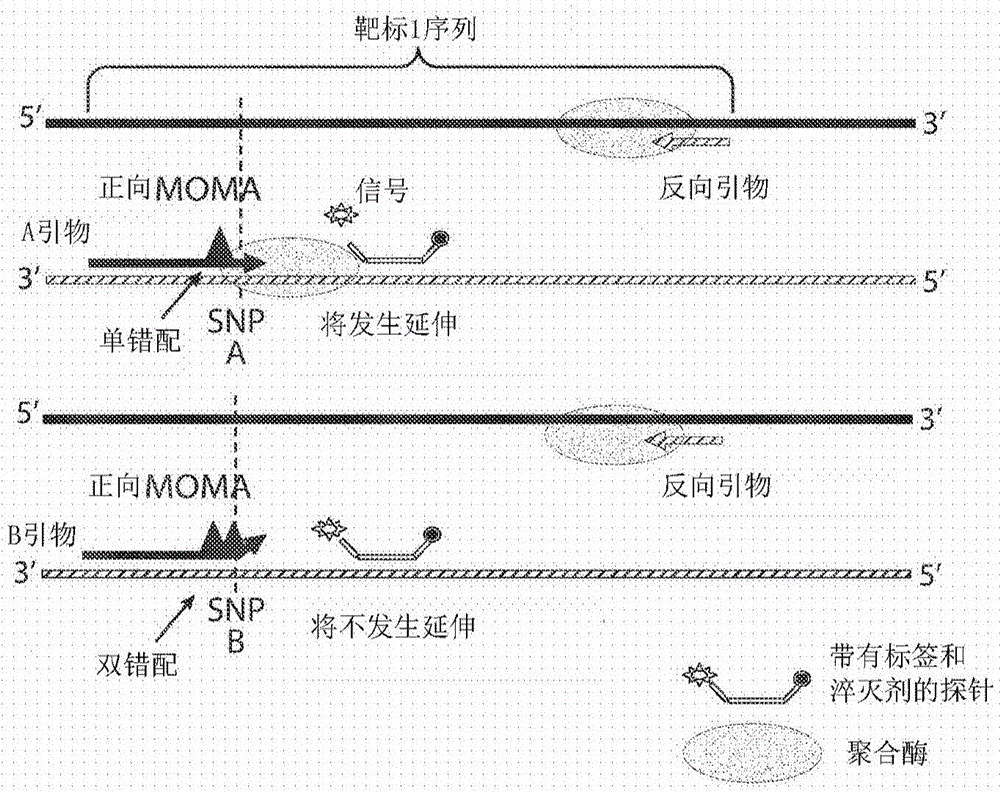
本申请依据35u.s.c.§119(e)要求于2016年4月29日提交的美国临时申请62/330,043的申请日权益,其内容通过引用整体并入本文。本发明涉及用于评估来自对象的样品中非天然核酸的量的方法和组合物。本文中提供的方法和组合物可用于确定例如癌症的病症的风险。本发明还涉及使用多重优化错配扩增(multiplexedoptimizedmismatchamplification,moma)以用于评估非天然无细胞脱氧核糖核酸(非天然无细胞dna,例如癌症特异性无细胞dna)的量的方法和组合物。技术实现要素:本公开内容至少部分地基于以下令人惊讶的发现:可使用多重优化错配扩增来量化来自对象的样品中的低频率非天然核酸。多重优化错配扩增涵盖引物的设计,所述引物可包含用于扩增特定序列的3’倒数第二位错配,和相对于另一序列的双错配。用这样的引物进行扩增可允许定量地确定样品中非天然核酸的量,甚至在非天然核酸的量在异质核酸群中为例如1%或甚至0.5%以下的情况下也如此。本文中提供了与这样的扩增测定相关的方法、组合物和试剂盒。所述方法、组合物或试剂盒可以是本文中分别提供的任一种方法、组合物或试剂盒,包括实施例和附图中的那些中的任一种。在一个方面,提供了一种评估来自对象的样品中癌症特异性核酸的量的方法。在一个实施方案中,所述方法包括对于一种或更多种单核苷酸变体(singlenucleotidevariant,snv)靶标中的每一种,用至少两种引物对对样品或其部分进行基于扩增的定量测定例如聚合酶链反应(pcr)定量测定,其中每种引物对包含正向引物和反向引物,其中所述至少两种引物对中的一种在引物中包含相对于snv靶标之一种等位基因的3’倒数第二位错配,然而包含相对于snv靶标之另一种等位基因的3’双错配,并且特异性地扩增snv靶标之所述一种等位基因,并且所述至少两种引物对中的另一种特异性地扩增snv靶标之所述另一种等位基因,以及获得或提供来自基于扩增的定量测定例如pcr定量测定的结果,以确定样品中癌症特异性核酸的量。在本文中提供的任一种方法、组合物或试剂盒的一个实施方案中,结果在报告中提供。在本文中提供的任一种方法的一个实施方案中,所述方法还包括基于所述结果确定样品中癌症特异性核酸的量。在本文中提供的任一种方法、组合物或试剂盒的一个实施方案中,所述结果包含样品中癌症特异性核酸的量。在一个方面,提供了一种评估来自对象的样品中癌症特异性核酸的量的方法,所述方法包括获得来自对于一种或更多种单核苷酸变体(snv)靶标中的每一种用至少两种引物对对所述样品或其部分进行基于扩增的定量测定例如聚合酶链反应(pcr)定量测定的结果,其中每种引物对包含正向引物和反向引物,其中所述至少两种引物对中的一种在引物中包含相对于所述snv靶标之一种等位基因的3’倒数第二位错配,然而包含相对于所述snv靶标之另一种等位基因的3’双错配,并且特异性地扩增所述snv靶标之所述一种等位基因,并且所述至少两种引物对中的另一种特异性地扩增所述snv靶标之所述另一种等位基因,以及基于所述结果评估癌症特异性核酸的量。在本文中提供的任一种方法、组合物或试剂盒的一个实施方案中,样品中癌症特异性核酸的量基于所述基于扩增的定量测定例如pcr定量测定的结果。在本文中提供的任一种方法、组合物或试剂盒的一个实施方案中,所述结果从报告获得。在本文中提供的任一种方法、组合物或试剂盒的一个实施方案中,所述至少两种引物对中的另一种引物对在引物中也包含相对于所述snv靶标之所述另一种等位基因的3’倒数第二位错配,然而包含相对于所述snv靶标之所述一种等位基因的3’双错配,并且特异性地扩增所述snv靶标之所述另一种等位基因。在本文中提供的任一种方法、组合物或试剂盒的一个实施方案中,所述量是在测定中测量的癌症特异性核酸与野生型核酸或总核酸的比例或百分比。在本文中提供的任一种方法、组合物或试剂盒的一个实施方案中,所述结果是基于扩增的定量测定例如pcr定量测定的信息性结果。在本文中提供的任一种方法、组合物或试剂盒的一个实施方案中,所述量基于所述基于扩增的定量测定例如pcr定量测定的信息性结果。在本文中提供的任一种方法的一个实施方案中,所述方法还包括选择基于扩增的定量测定例如pcr定量测定的信息性结果。在本文中提供的任一种方法、组合物或试剂盒的一个实施方案中,对所选的信息结果求平均值。在本文中提供的任一种方法的一个实施方案中,基于扩增的定量测定例如pcr定量测定的信息性结果是基于对象的基因型选择的。在本文中提供的任一种方法的一个实施方案中,所述方法还包括获得所述对象的基因型。在本文中提供的任一种方法的一个实施方案中,所述方法还包括获得多种snv靶标。在本文中提供的任一种方法的一个实施方案中,所述方法还包括获得针对一种或更多种snv靶标中的每一种的至少两种引物对。在本文中提供的任一种方法、组合物或试剂盒的一个实施方案中,一种或更多种snv靶标是至少1种snv靶标。在本文中提供的任一种方法、组合物或试剂盒的一个实施方案中,一种或更多种snv靶标是至少2种snv靶标。在本文中提供的任一种方法、组合物或试剂盒的一个实施方案中,一种或更多种snv靶标是至少3种snv靶标。在本文中提供的任一种方法、组合物或试剂盒的一个实施方案中,一种或更多种snv靶标是至少4种snv靶标。在本文中提供的任一种方法、组合物或试剂盒的一个实施方案中,一种或更多种snv靶标是至少5种snv靶标。在本文中提供的任一种方法、组合物或试剂盒的一个实施方案中,一种或更多种snv靶标是至少6种snv靶标。在本文中提供的任一种方法、组合物或试剂盒的一个实施方案中,一种或更多种snv靶标是至少7种snv靶标。在本文中提供的任一种方法、组合物或试剂盒的一个实施方案中,一种或更多种snv靶标是至少8种snv靶标。在本文中提供的任一种方法、组合物或试剂盒的一个实施方案中,一种或更多种snv靶标是至少9种snv靶标。在本文中提供的任一种方法、组合物或试剂盒的一个实施方案中,一种或更多种snv靶标是至少10种snv靶标。在本文中提供的任一种方法、组合物或试剂盒的一个实施方案中,一种或更多种snv靶标是至少11种snv靶标。在本文中提供的任一种方法、组合物或试剂盒的一个实施方案中,一种或更多种snv靶标是至少12种snv靶标。在本文中提供的任一种方法、组合物或试剂盒的一个实施方案中,一种或更多种snv靶标是至少13种snv靶标。在本文中提供的任一种方法、组合物或试剂盒的一个实施方案中,一种或更多种snv靶标是至少14种snv靶标。在本文中提供的任一种方法、组合物或试剂盒的一个实施方案中,一种或更多种snv靶标是至少15种snv靶标。在本文中提供的任一种方法、组合物或试剂盒的一个实施方案中,所述一种或更多种snv靶标各自对相同种类的癌症具有特异性。在任一种方法、组合物或试剂盒的一个实施方案中,癌症的种类是胰腺癌。在任一种方法、组合物或试剂盒的一个实施方案中,一种或更多种snv靶标包含kras基因和/或p53基因中的snv靶标。在任一种方法、组合物或试剂盒的一个实施方案中,一种或更多种snv靶标各自对对象中的癌症具有特异性。在任一种方法、组合物或试剂盒的一个实施方案中,至少一种snv靶标对一种癌症具有特异性并且至少一种另外的snv靶标对另一种癌症具有特异性。在本文中提供的任一种方法的一个实施方案中,snv靶标是对象的先前癌症中突变的序列。在本文中提供的任一种方法的一个实施方案中,所述方法还包括获得对象中癌症的基因型。在本文中提供的任一种方法的一个实施方案中,样品中癌症特异性核酸的量为至少0.25%。在本文中提供的任一种方法的一个实施方案中,样品中癌症特异性核酸的量为至少0.5%。在本文中提供的任一种方法的一个实施方案中,样品中癌症特异性核酸的量为至少1%。在本文中提供的任一种方法的一个实施方案中,样品中癌症特异性核酸的量为至少2%。在本文中提供的任一种方法的一个实施方案中,样品中癌症特异性核酸的量为至少5%。在本文中提供的任一种方法的一个实施方案中,癌症特异性核酸是癌症特异性无细胞dna。在本文中提供的任一种方法的一个实施方案中,pcr定量测定是实时pcr测定或数字pcr测定。在本文中提供的任一种方法的一个实施方案中,所述方法还包括基于样品中癌症特异性核酸的量确定对象中的风险。在本文中提供的任一种方法的一个实施方案中,风险是与癌症相关的风险。在本文中提供的任一种方法的一个实施方案中,如果癌症特异性核酸的量大于阈值,则风险升高。在本文中提供的任一种方法的一个实施方案中,如果癌症特异性核酸的量小于阈值,则风险降低。在本文中提供的任一种方法的一个实施方案中,所述方法还包括基于癌症特异性核酸的量选择用于所述对象的治疗。在本文中提供的任一种方法的一个实施方案中,所述方法还包括基于癌症特异性核酸的量治疗所述对象。在本文中提供的任一种方法的一个实施方案中,所述方法还包括基于癌症特异性核酸的量来提供关于针对所述对象的治疗的信息。在本文中提供的任一种方法的一个实施方案中,所述方法还包括随时间或在后续时间点监测或建议监测对象中癌症特异性核酸的量。在本文中提供的任一种方法的一个实施方案中,所述方法还包括基于癌症特异性核酸的量来评价施用于所述对象的治疗的效果。在本文中提供的任一种方法的一个实施方案中,治疗是癌症治疗。在本文中提供的任一种方法的一个实施方案中,所述方法还包括提供或获得样品或其部分。在本文中提供的任一种方法的一个实施方案中,所述方法还包括从样品中提取核酸。在本文中提供的任一种方法的一个实施方案中,所述方法还包括使用snv靶标的引物进行预扩增步骤。所述引物可以与用于确定非天然核酸的量的引物相同或不同。在本文中提供的任一种方法的一个实施方案中,一种或更多种或所有pcr定量测定中的探针与错配引物在相同链上而不在相对链上。在本文中提供的任一种方法的一个实施方案中,样品包含血液、血浆或血清。在一个方面,提供了包含以下的组合物或试剂盒:一种或更多种癌症特异性snv靶标中的每一种的引物对,其中每种引物对在引物中包含相对于所述snv靶标之一种等位基因的3’倒数第二位错配,然而包含相对于所述snv靶标之另一种等位基因的3’双错配,并且在一种或更多种snv靶标中特异性地扩增所述snv靶标之所述一种等位基因。在本文中提供的任一种组合物或试剂盒的一个实施方案中,所述组合物或试剂盒还包含所述一种或更多种癌症特异性snv靶标中的每一种的另一种引物对,其中所述另一种引物对特异性地扩增snv靶标之所述另一种等位基因。在本文中提供的任一种方法、组合物或试剂盒的一个实施方案中,所述一种或更多种癌症特异性snv靶标为至少2、3、4、5、6、7、8、9、10、11、12、13、14或15种snv靶标。在本文中提供的任一种方法、组合物或试剂盒的一个实施方案中,癌症特异性snv靶标各自对相同种类的癌症具有特异性。在本文中提供的任一种方法、组合物或试剂盒的一个实施方案中,癌症的种类是胰腺癌。在本文中提供的任一种方法、组合物或试剂盒的一个实施方案中,癌症特异性snv靶标包含kras基因和/或p53基因中的snv靶标。在本文中提供的任一种方法、组合物或试剂盒的一个实施方案中,癌症特异性snv靶标各自对对象中的癌症具有特异性。在本文中提供的任一种方法、组合物或试剂盒的一个实施方案中,至少一种snv靶标对一种癌症具有特异性并且至少一种另外的snv靶标对另一种癌症具有特异性。在本文中提供的任一种方法、组合物或试剂盒中的任一种的一个实施方案中,每种snv靶标的另一种引物对在引物中还包含相对于所述snv靶标之另一种等位基因的3’倒数第二位错配,然而包含相对于所述snv靶标之一种等位基因的3’双错配,并且特异性地扩增snv靶标之所述另一种等位基因。在本文中提供的任一种组合物或试剂盒的一个实施方案中,组合物或试剂盒还包含缓冲剂。在本文中提供的任一种组合物或试剂盒的一个实施方案中,组合物或试剂盒还包含聚合酶。在本文中提供的任一种组合物或试剂盒的一个实施方案中,组合物或试剂盒还包含探针。在本文中提供的任一种组合物或试剂盒的一个实施方案中,探针是荧光探针。在本文中提供的任一种组合物或试剂盒的一个实施方案中,组合物或试剂盒还包含使用说明书。在本文中提供的任一种组合物或试剂盒的一个实施方案中,使用说明书是用于确定或评估来自有癌症风险、患有癌症或怀疑患有癌症的对象的样品中的癌症特异性核酸的量的说明书。在一个方面,本文中提供的任一种组合物或试剂盒可以用于本文中提供的任一种方法。在一个方面,提供了一种方法,其包括基于本文中提供的任一种方法获得癌症特异性核酸的量,以及基于水平或量评估有癌症风险、患有癌症、怀疑患有癌症或先前曾患有癌症的对象的风险。在本文中提供的任一种方法的一个实施方案中,基于所评估的风险为所述对象选择或提供治疗、或者关于治疗或非治疗的信息。在本文中提供的任一种方法的一个实施方案中,所述方法还包括随时间监测或建议监测对象中癌症特异性核酸的量。在所提供的任一种方法的一个实施方案中,所述方法还包括例如在后续时间点从所述对象获得另一种样品,并对样品进行测试,例如本文中提供的任一种方法。在一个方面,提供了包含本文中提供的一种或更多种结果的报告。在所提供的任一个报告的一个实施方案中,报告是电子形式的。在所提供的任一个报告的一个实施方案中,报告是硬拷贝。在所提供的任一个报告的一个实施方案中,报告是口头给出的。在所提供的任一种方法、组合物或试剂盒的一个实施方案中,错配的引物是正向引物。在所提供的任一种方法、组合物或试剂盒的一个实施方案中,每种snv靶标的引物对的反向引物是相同的。在一个实施方案中,用于本文中提供的方法的任一个实施方案可以是所提供的任一种组合物、试剂盒或报告的实施方案。在一个实施方案中,用于本文中提供的组合物、试剂盒或报告的任一个实施方案可以是本文中提供的任一种方法的实施方案。附图简述附图并非旨在按比例绘制。这些附图仅是举例说明性的,并且不是实现本公开内容所必需的。图1提供了moma引物的示例性的非限制性图。在聚合酶链反应(pcr)测定中,预期发生包含snva的序列的延伸,使得检测到snva,其可随后进行量化。然而,由于双错配而预期不发生snvb的延伸。图2提供了示例性的扩增迹线。图3提供了104种moma靶标的平均背景噪声。图4提供了使用moma的方法的背景噪声的另一些实例。图5提供了实施例中描述的扩增曲线和标准曲线。图6示出了可以用其操作一些实施方案的计算机系统的实例。发明详述公开内容的一些方面涉及用于灵敏地检测和/或量化样品中的非天然核酸的方法。非天然核酸(例如非天然dna)可以在包括癌症在内的多种情况下存在于个体中。本公开内容提供了检测、分析和/或量化从对象(例如有癌症风险的对象或患有癌症的对象)获得的样品中的非天然核酸(例如非天然无细胞dna浓度)的技术。本文中使用的“非天然核酸”是指来自另一来源或是作为见于对象中的核酸的突变形式(就特定序列而言,例如野生型(wt)序列)的核酸。因此,“天然核酸”是并非来自另一来源并且不是见于对象中的核酸的突变形式(就特定序列而言)的核酸。在一些实施方案中,非天然核酸是非天然无细胞dna。“无细胞dna”(或cf-dna)是存在于细胞外部,例如在对象的血液、血浆、血清、尿等中的dna。不希望受任何特定理论或机理的束缚,认为cf-dna是从细胞释放的,例如通过细胞的凋亡而从细胞释放的。非天然核酸的一个实例是来自对象中癌症的核酸。如本文中使用的,本文中提供的组合物和方法可用于确定来自非天然来源的无细胞dna的量,例如癌症特异性的dna或癌症特异性无细胞dna(例如癌症特异性cfdna,cscfdna)的量。本文中提供了可用于测量在序列同一性方面具有差异的核酸的方法和组合物。在一些实施方案中,序列同一性的差异是单核苷酸变体(snv);然而,无论本文中在何处提及snv,天然与非天然核酸之间的任何序列同一性差异均旨在同样适用。因此,本文中提供的任一种方法或组合物可应用于序列同一性不同的天然与非天然核酸。本文中使用的“单核苷酸变体”是指其中在单个核苷酸处存在序列变异的核酸序列。这些snv可以是已知的癌症突变或任何癌症特异的或可以识别癌症的突变。在本文中提供的任一种方法的一些实施方案中,这样的突变是与本文中提供的任一种癌症相关的突变。在本文中提供的任一种方法的一些实施方案中,突变是来自对象患有一次的癌症的突变,并且所述方法是用于监测对象的癌症复发的方法。如本文中所提供的,可以为所提供的任何一种或更多种突变制备引物。其中可发生癌症相关突变的基因的实例可包括肿瘤抑制基因,例如但不限于arhgef12、atm、bcl11b、blm、bmprla、brca1、brca2、cars、cbfa2t3、cdh1、cdk6、cdkn2c、cebpa、chek2、creb1、crebbp、cyld、ddx5、ext1、ext2、fbxw7、fh、f[t3、foxp1、gpc3、idh1、il2、jak2、map2k4、mdm4、men1、mlh1、msh2、nf1、nf2、notch1、npm1、nr4a3、nup98、palb2、pml、pten、rb1、runx1、sdhb、sdhd、smarca4、scarcb1、socs1、stk11、sufu、suz12、syk、tcf3、tnfaip3、tp53、tsc1、tsc2、wrn、wt1、pvhl、apc、cd95、st5、ypel3、st7和st14。另一些实例是癌基因,包括但不限于abl1、abl2、akt1、akt2、atf1、bcl11a、bcl2、bcl3、bcl6、bcr、braf、card11、cblb、cblc、ccnd1、ccnd2、ccnd3、cdx2、ctnnb1、ddb2、ddit3、ddx6、dek、egfr、elk4、erbb2、etv4、etv6、evi1、ewsr1、fev、fgfr1、fgfr1op、fgfr2、fus、golfa5、gopc、hmga1、hmga2、hras、irf4、jun、kit、kras、lck、lmo2、maf、mafb、maml2、mdm2、met、mitf、mll、mpl、myb、mycl1、mycn、ncoa4、nfkb2、nras、ntrk1、nup214、pax8、pdgfb、pik3ca、pim1、plag1、pparg、ptpn11、raf1、rel、ret、ros1、smo、ss18、tcl1a、tet2、tfg、tlx1、pr、usp6、ras、wnt、myc、erk和trk。在一些实施方案中,如本文中提供的snv靶标可以是这些基因中的任一种或更多种的突变序列。其中存在序列同一性变异的核酸序列(例如snv)通常称为“靶标”。本文中使用的“snv靶标”是指其中例如在单个核苷酸处存在序列变异的核酸序列。snv靶标具有多于一种等位基因,并且在优选的实施方案中,snv靶标是双等位基因的。已经发现,通过用对snv靶标具有特异性的引物进行基于扩增的定量测定(例如定量pcr测定)可以甚至在极低水平下量化非天然核酸。在一些实施方案中,通过试图对多种snv靶标用引物进行基于扩增的定量测定(例如定量pcr)来确定非天然核酸的量。“多种snv靶标”是指多于一种snv靶标,其中对于每种靶标存在至少两种等位基因。优选地,在一些实施方案中,预期每种snv靶标是双等位基因的,并且对snv靶标的每种等位基因具有特异性的引物对来特异性扩增每种等位基因的核酸,其中如果样品中存在特定等位基因的核酸,则发生扩增。在本文中提供的任一种方法的一些实施方案中,用引物对对至少1、2、3、4、5、6、7、8、9、10、11、12、13、14或15种靶标进行基于扩增的定量测定,例如定量pcr。在本文中提供的任一种方法的一些实施方案中,用引物对对至少1、2、3、4、5、6、7、8、9或10种但少于15种靶标进行基于扩增的定量测定,例如定量pcr。在本文中提供的任一种方法的一些实施方案中,用引物对对至少2、3、4、5、6、7、8、9、10、11、12、13、14或15种靶标进行基于扩增的定量测定,例如定量pcr。在本文中提供的任一种方法的一些实施方案中,用引物对对至少2、3、4、5、6、7、8、9或10但是少于15种靶标进行基于扩增的定量测定,例如定量pcr。如本文中使用的,一种等位基因可以是靶序列的突变形式,而另一种等位基因是该序列的非突变形式。在本文中提供的任一种方法或组合物的一个实施方案中,可以基于snv靶标将提供信息的知识(例如癌症的基因型的知识)预先选择用于snv靶标的一种或更多种引物对。在这样的实施方案中,对象先前可能患有癌症,并且所述方法用于评估癌症的复发。在这样的实施方案中,对象可能先前已被诊断患有癌症,并且该方法用于随时间监测癌症。在这样的实施方案中,确定癌症的基因型。因此,本文中提供的任一种方法可包括对对象中的癌症进行基因分型或获得基因型的步骤。在本文中提供的任一种方法或组合物的另一个实施方案中,选择针对多种snv靶标的引物对以使得可能有至少一种可提供信息。在这样的实施方案中,在本文中提供的任一种方法中使用癌症特异性snv靶标组的引物对。在一些实施方案中,癌症特异性snv靶标组中的每种对相同种类的癌症具有特异性。癌症可以是本文中提供的或本领域已知的任一种癌症。snv靶标可以是本文中提供的或本领域已知的任一种癌症相关基因中的一种。在另一些实施方案中,该组涉及许多对多种不同类型癌症具有特异性的snv靶标,一种或更多种对一种癌症具有特异性,而一种或更多种对另一种癌症具有特异性等。在一些实施方案中,这样的组可以针对与许多更常见的癌症相关的许多更常见的snv靶标。对于提供的任一种方法或组合物,所述方法或组合物可以针对上述数目的靶标中的任一种。本文中使用的“信息性snv靶标”是其中用本文中提供的引物发生扩增,且其结果提供信息的那些。本文中提供的“信息性结果”是可用于量化样品中非天然和/或天然核酸的水平的结果。在一些实施方案中,信息性结果排除了被认为是“无调用(nocall)”或错误调用结果的结果。由信息性结果,在提供的任一种方法的一些实施方案中,可使用标准曲线来计算等位基因百分比。在提供的任一种方法的一些实施方案中,非天然和/或天然核酸的量分别代表非天然和/或天然核酸的全部信息性结果的平均值。在一些实施方案中,非天然核酸的量或水平(例如比例或百分比)可用主要和次要等位基因的量以及天然核酸的基因型来确定。在本文中提供的任一种方法的一些实施方案中,可以基于对象的天然核酸进行预先基因分型来确定等位基因。用于基因分型的方法是本领域公知的。这些方法包括测序,例如下一代、杂交、微阵列、其他分离技术或pcr测定。本文中提供的任一种方法均可包括获得这样基因型的步骤。本文中使用的“获得”是指通过其可获取相应信息或材料的任何方法。因此,在一些实施方案中,可通过实验方法来获取相应的信息,例如确定天然基因型。在一些实施方案中,相应材料可用多种实验或实验室方法来创建、设计等。相应信息或材料还可通过给予或提供信息(例如在报告中)或材料来获取。在一些实施方案中,材料可通过商业手段(即通过购买)来给予或提供。报告可以是口头、书面(或硬拷贝)或电子形式,例如可被可视化或显示的形式。在一些实施方案中,本文中提供的每个测定的“原始”结果在报告中提供,并且从该报告可采取另外的步骤来确定样品中非天然核酸的量。这些另外的步骤可包括以下中的任意一个或更多个:选择信息性结果,获得天然基因型,计算天然和非天然核酸的信息性结果的等位基因百分比,对等位基因百分比求平均值,等。在另一些实施方案中,报告提供了样品中非天然核酸的量。由所述量,在一些实施方案中,临床医生可随时间评估对象的治疗需求或监测非天然核酸的量的需求。因此,在本文中提供的任一种方法中,所述方法可包括在另多于一个时间点评估对象中非核酸的量。这样的评估可用本文中提供的任一种方法或组合物进行。在一些实施方案中,本文中提供的任一种方法可包括在来自对象的一种或更多种样品中确定或获得核酸(例如总的无细胞dna)的总量的步骤。因此,本文中提供的任何一种或更多种报告还可以包括一种或更多种总核酸(例如总的无细胞dna)的量,并且它是报告中非天然核酸和总核酸的量的组合,临床医生可以通过其评估对对象进行治疗需求或监测对象的需求。本文中提供的基于扩增的定量测定(例如pcr测定)利用多重优化的错配扩增(moma)。可获得用于这样的测定的引物,并且本文中提供的任一种方法均可包括获得用于进行基于扩增的定量测定(例如pcr测定)的一种或更多种引物对的步骤。一般来说,引物具有有利于其用于量化核酸的量的独特特性。例如,引物对的正向引物可在3’核苷酸(例如倒数第二个3’核苷酸)处错配。在提供的任一种方法或组合物的一些实施方案中,这种错配位于3’核苷酸处但与snv位置相邻。在提供的任一种方法或组合物的一些实施方案中,引物相对于snv位置的错配定位如图1所示。一般来说,这样的正向引物即使具有3’错配也能在扩增反应(例如pcr反应)中产生扩增产物(与合适的反向引物联合),从而允许扩增并导致检测到具有相应snv的核酸。如果特定snv不存在并且存在相对于snv靶标的另一种等位基因的双错配,则通常不会产生扩增产物。优选地,在本文中提供的任一种方法或组合物的一些实施方案中,对于每种snv靶标,获得以下引物对,通过所述引物对,可发生每种等位基因的特异性扩增而不扩增其他等位基因。“特异性扩增”是指扩增靶标的特定等位基因,而基本上不扩增另外的核酸或不扩增在背景或噪声以上的另外核酸序列。在一些实施方案中,特异性扩增仅导致扩增特定等位基因。在本文中提供的任一种方法或组合物的一些实施方案中,对于双等位基因的每种snv靶标,存在两种引物对,每种对两种等位基因之一具有特异性,并且因此具有相对于其将要扩增之等位基因的单个错配,然而具有相对于其不扩增之等位基因的双错配(如果这些等位基因的核酸存在的话则为同样)。在本文中提供的任一种方法或组合物的一些实施方案中,错配引物是正向引物。在本文中提供的任一种方法或组合物的一些实施方案中,针对每个snv靶标的两种引物对中的反向引物是相同的。这些概念可用于设计用于本文中提供的任一种组合物和方法的引物对。应理解,正向和反向引物被设计成结合相对链(例如有义链和反义链)以扩增模板的特定基因座的片段。引物对的正向和反向引物可被设计成扩增任意合适大小的核酸片段以检测例如根据本公开内容之snv靶标的等位基因是否存在。本文中提供的任一种方法均可包括用于获得如本文中所述的一种或更多种引物对的一个或更多个步骤。应理解,本文中所述的引物对可用于多重基于扩增的定量测定例如pcr测定。因此,在本文中提供的任一种方法或组合物的一些实施方案中,引物对被设计成在pcr反应中与其他引物对相容。例如,引物对可被设计成在pcr反应中与至少1种、至少2种、至少3种、至少4种、至少5种等其他引物对相容。如本文中使用的,如果引物对能够在同一pcr反应中扩增其靶标,则其在pcr反应中是“相容的”。在一些实施方案中,如果在同一pcr反应中多重进行时,引物对扩增其靶dna被抑制不超过1%、不超过2%、不超过3%、不超过4%、不超过5%、不超过10%、不超过15%、不超过20%、不超过25%、不超过30%、不超过35%、不超过40%、不超过45%、不超过50%或不超过60%,则所述引物对是相容的。引物对可能由于多种原因而不相容,所述原因包括但不限于引物二聚体的形成和与模板上的脱靶位点结合,这可能干扰另外的引物对。因此,本公开内容的引物对可被设计成避免与其他引物对形成二聚体或限制脱靶结合位点的数目。用于设计用于多重pcr测定的引物的示例性方法是本领域已知的或在本文中另外描述。在一些实施方案中,本文中所述的引物对用于在多重基于扩增的定量测定例如pcr测定中量化非天然核酸的量。因此,在本文中提供的任一种方法或组合物的一些实施方案中,引物对被设计成检测二倍体的基因组区域,不包括被设计成检测可能是非二倍体的基因组区域的引物对。在本文中提供的任一种方法或组合物的一些实施方案中,根据本公开内容使用的引物对不检测重复掩蔽区、已知拷贝数可变区或可能是非二倍体的其他基因组区。在本文中提供的任一种方法的一些实施方案中,基于扩增的定量测定是例如通过其扩增核酸并且可确定核酸的量的任何定量测定。这样的测定包括通过其用本文中所述的moma引物扩增核酸并量化的那些。这样的测定包括简单的扩增和检测、杂交技术、分离技术(例如电泳)、下一代测序等。在本文中提供的任一种方法的一些实施方案中pcr是定量pcr意味着可以测定核酸的量。定量pcr包括实时pcr、数字pcr、taqmantm等。在本文中提供的任一种方法的一些实施方案中,pcr是“实时pcr”。这样的pcr是指其中可在扩增过程仍进行的同时在液相中监测反应动力学的pcr反应。与常规pcr相比,实时pcr提供了在扩增反应中同时实时地检测或量化的能力。基于来自特定染料的荧光强度的提高,甚至可在扩增达到其平台期之前确定靶标的浓度。使用多种探针可扩展单探针实时pcr的能力。多重实时pcr使用多种基于探针的测定,其中每种测定可具有经独特的荧光染料标记的特定探针,使得对每个测定观察到不同的颜色。实时pcr仪器可区分由不同染料产生的荧光。不同的探针可用各自具有独特的发射谱的不同染料标记。谱信号用离散的光学装置收集,通过一系列滤光器组,并由检测器阵列收集。染料之间的谱重叠可通过使用纯染料谱通过矩阵代数对实验数据去卷积进行校正。探针可用于本公开内容的方法,特别地可用于包括量化步骤的那些方法。本文中提供的任一种方法可包括在进行pcr测定中使用探针,或者本文中提供的试剂盒的任一种组合物可包含一种或更多种探针。重要的是,在本文中提供的任一种或更多种方法的一些实施方案中,一种或更多种或全部pcr定量测定中的探针与错配引物位于相同链上,而不在相对链上。已发现,将探针这样并入pcr反应中,可提供额外的等位基因特异性区分。作为一个实例,taqmantm探针是在5’端具有famtm或染料标记并且在3’端具有小沟结合剂(minorgroovebinder,mgb)非荧光猝灭剂(non-fluorescentquencher,nfq)的水解探针。taqmantm探针原理一般依赖于聚合酶在与互补探针结合区杂交期间切割双重标记的taqmantm探针的5′-3′核酸外切酶活性和基于荧光团的检测。taqmantm探针可提高定量pcr反应的指数期期间定量测量中检测的特异性。pcr系统通常依赖于荧光染料或报道子(其信号与反应中pcr产物的量成正比地提高)的检测和量化。例如,在最简单和最经济的形式中,所述报道子可以是双链dna特异性染料green(molecularprobes)。sybrgreen是一种与双链dna小沟结合的染料。当sybrgreen染料与双链dna结合时,荧光强度提高。随着产生更多的双链扩增子,sybrgreen染料信号将提高。在本文中提供的任一种方法中,pcr可以是数字pcr。数字pcr涉及将经稀释的扩增产物分配到多个离散的测试位点中,使得大多数的离散测试位点包含零个或一个扩增产物。然后,分析扩增产物以提供样品中所选目的基因组区域的频率的表示。每个离散测试位点分析一个扩增产物产生每个离散测试位点的二元“是或否”结果,从而允许对所选目的基因组区域进行量化,并且确定所选目的基因组区域相对于彼此的相对频率。在某些方面,作为补充或替代,可使用对应于来自预定区域的基因组区域的扩增产物进行多重分析。可使用来自对两个或更多个预定区域进行分析的结果来量化和确定扩增产物的相对频率数目。使用两个或更多个预定区域来确定样品中的频率通过例如扩增效率的变异而降低偏差的可能性,这通过单次检测测定可能不那么明显。使用数字pcr量化dna的方法是本领域已知的,并且先前已经在例如美国专利公开号us20140242582中进行描述。应理解,可对本文中提供的pcr条件进行改进或优化以根据本文中所述的任一种方法工作。通常来说,pcr条件基于所使用的酶、靶模板和/或引物。在一些实施方案中,对pcr反应的一种或更多种组分进行改进或优化。可优化的pcr反应组分的非限制性实例包括模板dna、引物(例如正向引物和反向引物)、脱氧核苷酸(dntp)、聚合酶、镁浓度、缓冲剂、探针(例如,当进行实时pcr时)、缓冲剂和反应体积。在前述任一实施方案中,可使用任何dna聚合酶(催化dna核苷酸聚合成dna链的酶),包括热稳定性聚合酶。合适的聚合酶是本领域技术人员已知的,并且包括大肠杆菌(e.coli)dna聚合酶、大肠杆菌dna聚合酶i的klenow片段、t7dna聚合酶、t4dna聚合酶、t5dna聚合酶、klenow类聚合酶、taq聚合酶、pfudna聚合酶、vent聚合酶、噬菌体29、redtaqtm基因组dna聚合酶、或测序酶。示例性的聚合酶包括但不限于嗜热脂肪芽孢杆菌(bacillusstearothermophilus)poli、水生栖热菌(thermusaquaticus,taq)poli、嗜热古细菌(pyrccoccusfuriosus,pfu)、乌兹炽热球菌(pyrococcuswoesei,pwo)、黄栖热菌(thermusflavus,tfl)、嗜热栖热菌(thermusthermophilus,tth)、里氏栖热菌(thermuslitoris,tli)和海栖热袍菌(thermotogamaritime,tma)。这些酶、这些酶的经修饰形式和酶组合可从供应商商购获得,所述供应商包括roche、invitrogen、qiagen,stratagene和appliedbiosystems。代表性的酶包括(newenglandbiolabs,ipswich,ma)、hotmastertaqtm(eppendorf)、mpx(finnzymes)、(fermentas)、kod(emdbiosciences)、z-taq(takara)和cs3ac/la(klentaq,universitycity,mo)。盐和缓冲剂包括本领域技术人员熟悉的那些,包括分别包含mgcl2,以及tris-hcl和kcl的那些。通常来说,1.5至2.0nm的镁对于taqdna聚合酶是最佳的,然而,最佳的镁浓度可取决于模板、缓冲剂、dna和dntp因为每一种都具有与镁形成螯合物的可能。如果镁[mg2+]的浓度太低,则不能形成pcr产物。如果镁[mg2+]的浓度太高,则可能会发现不期望的pcr产物。在一些实施方案中,镁浓度可通过以0.1mm或0.5mm的增量补充镁浓度直至镁浓度为约5mm来优化。根据本公开内容使用的缓冲剂可包含添加剂,例如表面活性剂、二甲基亚砜(dmso)、甘油、牛血清白蛋白(bsa)和聚乙二醇(peg),以及本领域技术人员熟悉的其他添加剂。核苷酸一般是三磷酸脱氧核糖核苷,例如三磷酸脱氧腺苷(datp)、三磷酸脱氧胞苷(dctp)、三磷酸脱氧鸟苷(dgtp)和三磷酸脱氧胸苷(dttp),其也可以以足够的量添加到反应中用于扩增靶核酸。在一些实施方案中,一种或更多种dntp(例如,datp、dctp、dgtp、dttp)的浓度为约10μm至约500μm,这可取决于pcr反应中产生的pcr产物的长度和数量。在一些实施方案中,根据本公开内容使用的引物是经修饰的。引物可被设计成以高特异性仅与其预期靶标(例如特定snv)结合,并且对其他核苷酸序列差异显示出高度区分。可对引物进行修饰以具有特定的计算出解链温度(tm),例如46℃至64℃的解链温度。为了设计具有期望解链温度的引物,可改变引物的长度和/或可改变引物的gc含量。通常来说,提高引物的gc含量和/或长度将提高引物的tm。相反,降低引物的gc含量和/或长度通常会降低引物的tm。应理解的是,可通过相对于靶标有意地并入错配来修饰引物以相对于其他以高灵敏度检测特定snv(或序列非全同的其他形式)。因此,可通过相对于引物被设计成要结合的特定序列(例如,特定snv)插入一个或更多个错配来对引物进行修饰。在一些实施方案中,可改进或优化pcr反应中使用的引物的浓度。在一些实施方案中,pcr反应中引物(例如正向或反向引物)的浓度可为例如约0.05μm至约1μm。在一些具体实施方案中,每种引物的浓度为约1nm至约1μm。应理解,根据本公开内容的引物可在pcr反应中以相同或不同的浓度使用。例如,引物对中的正向引物可以以0.5μm的浓度使用,而引物对中的反向引物可以以0.1μm使用。引物的浓度可以基于以下因素,包括但不限于引物长度、gc含量、纯度、与靶dna的错配、或形成引物二聚体的可能性。在一些实施方案中,对pcr反应的热分布(thermalprofile)进行改进或优化。pcr热分布改进的非限制性实例包括变性温度和持续时间、退火温度和持续时间,以及延伸时间。pcr反应溶液的温度可在变性状态、退火状态和延伸状态之间顺序地进行预定数目的循环。实际的时间和温度可以是酶、引物和靶标依赖性的。对于任何给定的反应,变性状态在某些实施方案中可为约70℃至约100℃。另外,退火温度和时间可影响引物与靶核酸内特定基因座结合的特异性和效率,并且对于特定的pcr反应可能是重要的。对于任何给定的反应,退火状态在某些实施方案中可为约20℃至约75℃。在一些实施例中,退火状态可为约46℃到64℃。在某些实施方案中,退火状态可在室温(例如,约20℃至约25℃)下进行。延伸温度和时间也可影响等位基因产物产率。对于给定的酶,延伸状态在某些实施方案中可为约60℃至约75℃。由pcr测定来量化等位基因的量可如本文中提供的进行,或者如另外本领域普通技术人员显而易见地进行。作为一个实例,分析扩增迹线的一致性和稳健量化。可使用内标(internalstandard)来将循环阈值转化为输入核酸(例如,dna)的量。等位基因的量可作为性能测定的平均值来计算,并且可针对基因型进行调整。有效扩增的宽范围表明成功检测出低浓度的核酸。已经发现,本文中提供的方法和组合物可用于检测样品中的低水平核酸,例如非天然核酸。因此,本文中提供的方法可用于其中需要检测相对稀少的核酸的样品。在一些实施方案中,本文中提供的任一种方法可用于样品以检测样品中相对于总核苷酸(例如总cf-dna)至少约0.25%的非天然核酸。在一些实施方案中,本文中提供的任一种方法可用于样品以检测样品中相对于总核酸(例如总cf-dna)至少约0.5%的非天然核酸。在一些实施方案中,本文中提供的任一种方法可用于样品以检测样品中相对于总核酸(例如总cf-dna)至少约1%的非天然核酸。在一些实施方案中,本文中提供的任一种方法以可用于样品以检测样品中至少约2%的非天然核酸。在一些实施方案中,本文中提供的任一种方法可用于样品以检测样品中至少约5%的非天然核酸。由于能够甚至在低水平下确定非天然核酸的量,本文中提供的方法和组合物可用于评估对象中(例如对象中的癌症)的风险。如本文中提供的“风险”是指对象中任何不期望病症的存在或不存在或进展,或者这样的病症(例如癌症)的存在或不存在或进展的可能性提高。癌症可以是本文中提供的任一种癌症。本文中提供的,“风险提高”是指对象中任何不期望的病症的存在或进展,或者这样的病症的存在或发展的可能性提高。本文中提供的,“风险降低”是指对象中不存在任何不期望的病症或进展,或者这样的病症的存在或进展的可能性降低(或不存在或非进展的可能性提高)。如本文中所提供的,病症(例如癌症)的早期检测或监测可以促进治疗并改善临床结果。如上所述,所提供的任一种方法可以对患有癌症或肿瘤,或有癌症或肿瘤、癌症或肿瘤的复发或癌症或肿瘤的转移的风险的对象进行。因此,在一些实施方案中,所述对象是怀疑患有癌症、癌症的转移和/或复发的对象。在一些实施方案中,所述对象可以没有显示患有癌症、转移和/或复发的迹象或症状。然而,在一些实施方案中,所述对象可显示与癌症相关的症状。症状的类型将取决于癌症的类型,并且是本领域公知的。癌症包括但不限于白血病、淋巴瘤、骨髓瘤、癌、转移癌、肉瘤、腺瘤、神经系统癌症和泌尿生殖系统癌症。示例性癌症包括但不限于成人和儿童急性淋巴细胞白血病、急性髓性白血病、肾上腺皮质癌、aids相关癌症、肛门癌、阑尾癌、星形细胞瘤、基底细胞癌、胆管癌、膀胱癌、骨癌、骨肉瘤、纤维组织细胞瘤、脑癌、脑干胶质瘤、小脑星形细胞瘤、恶性胶质瘤、室管膜瘤、成神经管细胞瘤、幕上原始神经外胚层肿瘤、下丘脑神经胶质瘤、乳腺癌、男性乳腺癌、支气管腺瘤、伯基特淋巴瘤、类癌瘤、不明原因的癌、中枢神经系统淋巴瘤、小脑星形细胞瘤、恶性胶质瘤、宫颈癌、儿童癌症、慢性淋巴细胞白血病、慢性粒细胞白血病、慢性骨髓增生性疾病、结直肠癌、皮肤t细胞淋巴瘤、子宫内膜癌、室管膜瘤、食管癌、尤文氏家族肿瘤、颅外生殖细胞肿瘤、性腺外生殖细胞瘤、肝外胆管癌、眼内黑素瘤、视网膜母细胞瘤、胆囊癌、胃癌、胃肠道间质瘤、颅外生殖细胞瘤、性腺外生殖细胞瘤、卵巢生殖细胞瘤、妊娠滋养细胞肿瘤、胶质瘤、毛细胞白血病、头颈癌、肝细胞癌、霍奇金淋巴瘤、非霍奇金淋巴瘤、下咽癌、下丘脑和视觉通路胶质瘤、眼内黑素瘤、胰岛细胞瘤、卡波西肉瘤、肾癌、肾细胞癌、喉癌、唇癌与口腔癌、小细胞肺癌、非小细胞肺癌、原发性中枢神经系统淋巴瘤、瓦尔登斯特伦巨球蛋白血症(waldenstrommacroglobulinemia)、恶性纤维组织细胞瘤、成神经管细胞瘤、黑素瘤、梅克尔细胞癌、恶性间皮瘤、鳞状颈癌、多发性内分泌肿瘤综合征、多发性骨髓瘤、毒蕈样霉菌病、骨髓增生异常综合征、骨髓增生性疾病、慢性骨髓增生性疾病、鼻腔和鼻窦癌、鼻咽癌、神经母细胞瘤、口咽癌、卵巢癌、胰腺癌、甲状旁腺癌、阴茎癌、咽癌、嗜铬细胞瘤、松果体母细胞瘤和幕上原始神经外胚层肿瘤、垂体癌、浆细胞肿瘤、胸膜肺母细胞瘤、前列腺癌、直肠癌、横纹肌肉瘤、唾液腺癌、软组织肉瘤、子宫肉瘤、塞扎里综合征、非黑素瘤皮肤癌、小肠癌、鳞状细胞癌、鳞状颈癌、幕上原始神经外胚层肿瘤、睾丸癌、咽喉癌、胸腺瘤和胸腺癌、甲状腺癌、移行细胞癌、滋养细胞肿瘤、尿道癌、子宫癌、子宫肉瘤、阴道癌、外阴癌、和肾母细胞瘤(wilmstumor)。在一些实施方案中,癌症是前列腺癌、膀胱癌、胰腺癌、肺癌、肾癌、乳腺癌或结肠癌。例如,可以通过评估非天然cf-dna例如癌症特异性无细胞dna(cscf-dna)的量来确定对象中的风险。cscf-dna是指可能从癌症中脱落的dna,其序列与癌症的基因型(全部或部分地)匹配。本文中使用的cscf-dna可以指cscf-dna群体中的某一或某些序列,其中该序列与对象cf-dna可区分(例如,在特定核苷酸位置处具有不同序列),或者其可以指整个cscf-dna群体。在一些实施方案中,本文中提供的任一种方法可包括使非天然核酸的提高和/或非天然核酸相对于天然核酸或总核酸的比例或百分比的提高与病症(例如癌症)的风险提高相关联。在本文中提供的任一种方法的一些实施方案中,相关联包括将非天然核酸的水平(例如,浓度、比例或百分比)与阈值进行比较以鉴定病症风险提高或降低的对象。在本文中提供的任一种方法的一些实施方案中,与阈值相比具有非天然核酸的量提高的对象被鉴定为病症的风险提高。在本文中提供的任一种方法的一些实施方案中,与阈值相比非天然核酸的量降低或类似的对象被鉴定为病症的风险降低。本文中使用的“量”是指用于测量核酸的任何定量值,并且可以以绝对量或相对量给出。此外,该量可以是总量、频率、比例、百分比等。本文中使用的术语“水平”可用于代替“量”,但意在指相同类型的值。在本文中提供的任一种方法的一些优选实施方案中,核酸的总量通过本文中提供的moma测定法测定,并且是优选地来自信息性靶标的通过moma测定法测定的天然和非天然核酸计数的量度。在一些实施方案中,核酸的总量通过任何方法测定,例如本文中提供的moma测定法或本领域普通技术人员已知的其他测定法而不是本文中提供的moma测定法。本文中使用的“阈值”是指指示病症的存在或不存在或者风险的存在或不存在的任何预定水平或水平范围。阈值可采用多种形式。其可以是单个截止值,例如中值或平均值。其可基于比较组来建立,例如在一个确定组中的风险是另一个确定组中的风险的两倍的情况下。其可以是一个范围,例如在以下情况下:将测试群体平等地(或不平等地)分组,例如低风险组、中等风险组和高风险组;或者分为四个象限,最低象限是风险最低的对象,最高象限是风险最高的对象。阈值可取决于所选的特定群体。例如,表面健康的群体将具有不同的“正常”范围。作为另一个实例,可由在病症或风险存在之前或者在治疗过程之后的基线值确定阈值。这样的基线可指示对象中与所测试风险或病症不相关的正常或其他状态。在一些实施方案中,阈值可以是所测试对象的基线值。因此,所选择的预定值可将对象所属的类别纳入考虑之中。本领域普通技术人员仅用常规实验即可选择合适的范围和类别。还可随时间监测非天然核酸水平的变化。例如,可使用非天然核酸的量(例如比例或百分比)相对于阈值(例如基线)的改变作为风险(例如与癌症相关的风险)的非侵入性临床指标。这可允许测量临床状态的变异和/或允许计算正常值或基线水平。一般来说,如本文中提供的,非天然核酸的量或水平(例如比例或百分比)可指示与病症(例如癌症)相关的风险的存在或不存在,或者可指示进一步测试或监视的需求。在本文中提供的任一种方法的一个实施方案中,所述方法还可包括用于评估病症例如癌症等的另外的测试。另外的测试可以是本文中提供的任一种方法。在本文中提供的任何一种方法的一些实施方案中,当确定非天然核酸量或水平(例如比率或百分比)高于阈值时,本文中提供的任一种方法还可包括对对象或来自对象的样品进行另外的测试。这样的其他测试可以是本领域普通技术人员已知可用于确定例如在患有、有风险患有或怀疑患有癌症、进展性癌症、癌症的转移或复发等的对象中是否存在或不存在风险的任何其他测试。在一些实施方案中,其他测试是本文中提供的任何一种方法。对怀疑患有癌症、转移和/或复发的对象的示例性另外的测试包括但不限于活检(例如,细针抽吸、核心活检或淋巴结移除)、x射线、ct扫描、超声、mri、内窥镜检查、循环肿瘤细胞水平、全血细胞计数、特定肿瘤生物标志物(例如egfr、er、her2、kras、c-kit、cd20、cd30、pdgfr、braf或psma)的检测,和/或基因分型(例如,brca1、brca2、hnpcc、mlhl、msh2、msh6、pmsl或pms2)。另外的测试的类型将取决于怀疑的癌症/转移/复发的类型并且完全在技术人员的确定范围内。在一些实施方案中,所述方法还可包括对对象进行进一步测试或推荐进行进一步测试,和/或治疗或建议治疗对象。在这些实施方案的一些中,进一步测试是本文中提供的任一种方法。在这些实施方案的一些中,治疗是癌症治疗。在一些实施方案中,以书面形式或电子形式提供信息。在一些实施方案中,信息可以作为计算机可读指令提供。在一些实施例中,可以口头提供信息。如本文中提供的,提供的任一种方法可包括向对象提供治疗或关于治疗的信息的步骤。所述治疗可用于治疗癌症、肿瘤或转移,例如抗癌治疗。这些治疗包括但不限于抗肿瘤剂,例如多西他赛;皮质类固醇类,例如泼尼松或氢化可的松;免疫刺激剂;免疫调节剂;或其某种组合。抗肿瘤剂包括细胞毒性剂、化学治疗剂和作用于肿瘤新血管的药剂。细胞毒性剂包括细胞毒性放射性核素、化学毒素和蛋白质毒素。细胞毒性放射性核素或放射性治疗同位素可以是α发射或β发射。细胞毒性放射性核素也可以发射俄歇电子(auger)和低能电子。合适的化学毒素或化学治疗剂包括烯二炔分子家族的成员,例如加利车霉素(calicheamicin)和埃斯培拉霉素(esperamicin)。化学毒素也可以选自甲氨蝶呤、多柔比星、美法仑、苯丁酸氮芥(chlorambucil)、ara-c、长春地辛、丝裂霉素c、顺铂、依托泊苷、博来霉素和5-氟尿嘧啶。其他抗肿瘤剂包括多拉司他汀(美国专利号6,034,065和6,239,104)及其衍生物。毒素还包括有毒的凝集素、植物毒素例如蓖麻毒素、相思豆毒素、蒴莲根毒蛋白(modeccin)、肉毒毒素(botulina)和白喉毒素。其他化学治疗剂是本领域技术人员已知的。癌症化学治疗剂的实例包括但不限于伊立替康(cpt-11);厄洛替尼;吉非替尼(iressatm);甲磺酸伊马替尼(gleevec);奥沙利铂;蒽环霉素类-伊达比星和柔红霉素;多柔比星;烷基化剂例如美法仑和苯丁酸氮芥;顺铂、甲氨蝶呤和生物碱例如长春地辛和长春碱。在一些实施方案中,本文中构想了另外的或替代的癌症治疗,例如放射和/或手术。可以通过本领域已知的任何方法(参见,例如,harrison′sprincipleofinternalmedicine,mcgrawhillinc.)完成治疗或疗法的施用。优选地,治疗或疗法的施用以治疗有效量发生。施用可以是局部的或系统的。施用可以是肠胃外(例如,静脉内、皮下或皮内)或经口。用于不同施用途径的组合物是本领域公知的(参见例如e.w.martin的remington′spharmaceuticalsciences)。本文中提供的任一种方法可包括从获自对象的样品提取核酸(例如无细胞dna)。这样的提取可使用本领域已知或本文中另外提供的任何方法(参见,例如currentprotocolsinmolecularbiology,最新版本,或qiaamp循环核酸试剂盒或其他合适的可商购获得试剂盒)来进行。描述了用于从血液分离无细胞dna的示例性方法。从对象收集包含抗凝剂(例如edta或dta)的血液。使包含cf-dna的血浆与血液中存在的细胞分离(例如,通过离心或过滤)。可进行任选的第二分离以从血浆中除去任何剩余的细胞(例如,第二离心或过滤步骤)。然后,可使用本领域已知的任何方法,例如使用商用试剂盒(例如由qiagen生产的那些)来提取cf-dna。用于提取cf-dna的其他示例性方法也是本领域已知的(参见,例如cell-freeplasmadnaasapredictorofoutcomeinseveresepsisandsepticshock.clin.chem.2008,第54卷,第1000-1007页;predictionofmycnamplificationinneuroblastomausingserumdnaandreal-timequantitativepolymerasechainreaction.jco2005,第23卷,第5205-5210页;circulatingnucleicacidsinbloodofhealthymaleandfemaledonors.clin.chem.2005,第51卷第1317-1319页;useofmagneticbeadsforplasmacell-freednaextraction:towardautomationofplasmadnaanalysisformoleculardiagnostics.clin.chem.2003,第49卷,第1953-1955页;chiurwk,poonllm,lautk,leungtn,wongemc,loymd.effectsofblood-processingprotocolsonfetalandtotaldnaquantificationinmaternalplasma.clinchem2001;47:1607-1613;和swinkels等effectsofblood-processingprotocolsoncell-freednaquantificationinplasma.clinicalchemistry,2003,第49卷,第3期,525-526)。如本文中使用的,来自对象的样品可以是生物样品。这样的生物样品的实例包括全血、血浆、血清、尿等。在一些实施方案中,可向样品添加另外的核酸,例如标准品。在本文中提供的任一种方法的一些实施方案中,进行预扩增步骤。这样扩增的示例性方法如下,并且这样的方法可包括在本文中提供的任一种方法中。对于约13种靶标使用q5dna聚合酶在pcr中扩增约15ng的无细胞血浆dna,其中合并的引物总共为4μm。样品进行约25个循环。反应总共为25ul。在扩增后,可使用数种方法清洗样品,包括ampure珠清洗、珠纯化、或者简单的exosapittm或zymo。本公开内容还提供了可用于评估样品中非天然核酸的量的组合物或试剂盒。在一些实施方案中,组合物或试剂盒包含一种或更多种引物对。组合物或试剂盒的每种引物对可包含正向引物和反向引物,其中在本文中提供的任一种方法、组合物或试剂盒的一些实施方案中,在一种引物中存在3’错配(例如,在倒数第二个3’核苷酸)。在本文中提供的任一种方法、组合物或试剂盒的一些实施方案中,这种错配位于3’核苷酸处且于与snv位置相邻,并且当不存在特定的snv时,相对于该snv靶标的另一种等位基因存在双错配。在本文中提供的任一种方法、组合物或试剂盒的一些实施方案中,引物对中的错配引物是正向引物。在本文中提供的任一种方法、组合物或试剂盒的一些实施方案中,snv靶标的每种等位基因的反向引物是相同的。在本文中提供的任一种组合物或试剂盒的一些实施方案中,所述组合物包含至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、20、25、30种等这样的引物对。在本文中提供的任一种组合物或试剂盒的一些实施方案中,对于至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15或更多种靶标例如snv靶标(例如,双等位基因snv靶标)中的每种,所述组合物包含至少两种引物对。在本文中提供的任一种组合物或试剂盒的一些实施方案中,对于多于1、2、3、4、5、6、7、8、9或10种但少于15种snv靶标,所述组合物或试剂盒包含至少一种,例如两种引物对。在本文中提供的任一种组合物或试剂盒的一些实施方案中,所述组合物或试剂盒的引物对被设计相容性地用于基于扩增的定量测定,例如定量pcr测定。例如,设计引物对以防止引物二聚体和/或限制脱靶结合位点的数目。应理解的是,组合物或试剂盒的引物对可根据本文中所述的任一种方法进行优化或设计。在一些实施方案中,提供的任一种组合物或试剂盒还包含缓冲剂。在一些实施方案中,缓冲剂包含添加剂,例如表面活性剂、二甲基亚砜(dmso)、甘油、牛血清白蛋白(bsa)和聚乙二醇(peg)或其他pcr反应添加剂。在一些实施方案中,提供的任一种组合物或试剂盒还包含聚合酶,例如组合物或试剂盒可包含大肠杆菌dna聚合酶、大肠杆菌dna聚合酶i的klenow片段、t7dna聚合酶、t4dna聚合酶、t5dna聚合酶、klenow类聚合酶、taq聚合酶、pfudna聚合酶、vent聚合酶、噬菌体29、redtaqtm基因组dna聚合酶或测序酶。在一些实施方案中,提供的任一种组合物或试剂盒还包含一种或更多种dntp(例如,datp、dctp、dgtp、dttp)。在一些实施方案中,提供的任一种组合物或试剂盒还包含探针(例如,taqmantm探针)。本文中使用的“试剂盒”通常限定包含本发明的一种或更多种组合物,和/或与本发明相关的其他组合物的包装或组合件,例如如前所述。本文中提供的任一种试剂盒还可包含至少一个反应管、孔、室等。本文中所述的任一种引物、引物系统(例如用于多种靶标的一组引物)或引物组合物可以以试剂盒的形式提供或包含在试剂盒内。试剂盒的每种组合物可以以液体形式(例如在溶液中)、固体形式(例如干粉)等提供。试剂盒在一些情况下可包括以使得本领域普通技术人员将认识到说明与本发明组合物相关的方式以任何形式与本发明组合物联合提供的说明。说明可包括用于进行本文中提供的任一种方法的说明。说明书可包括使用、调节、混合、稀释、保存、施用、组装、储存、包装和/或制备所述组合物和/或与试剂盒相关的其他组合物的说明。说明可以以本领域普通技术人员可识别的任何形式提供,如用于包含这样的说明的合适载体,例如以任何方式提供的书写或公开的、口头的、可听的(例如电话的)、数字的、光学的、可视的(例如,录像带、dvd等)或电子的通信(包括因特网或基于网络的通信)。本发明的不同方面可单独地、组合或以前文所述实施方案中未具体讨论的多种布置使用,并且因此其应用不限于在先描述中所述的或附图中举例说明的组分的细节和布置。例如,一个实施方案中描述的方面可以以任何方式与其他实施方案中描述的方面组合。此外,本发明的实施方案可作为一种或更多种方法实施,已提供其实例。作为方法的一部分执行的动作可以以任何合适的方式排序。因此,可以构建其中动作以不同于所举例说明的顺序执行的实施方案,其可包括同时进行一些动作,即使在举例说明性实施方案中被示为顺序动作。在权利要求书中使用例如“第一”、“第二”、“第三”等的序数术语来修饰权利要求要素并非自身暗示一个权利要求要素相对于另一个具有任何优先权、优先性或顺序或者其中执行方法动作的时间顺序。这样的术语仅用作标记以区分具有某一名称的一个权利要求要素与具有相同名称(除序数术语的使用之外)的另一个要素。本文中使用的用语和术语是为了描述的目的,并且不应被认为是限制性的。“包括”、“包含”、“具有”、“含有”、“涉及”及其变化形式的使用意味着涵盖其后列出的项目和附加项目。已经详细描述了本发明的数个实施方案,本领域技术人员将容易想到不同的修改和改进。这样的修改和改进旨在落入本发明的精神和范围内。因此,前面的描述仅仅是作为示例,而不是限制性的。以下描述提供了本文中提供的方法的实例。实施例实施例1-momacf-dna测定该示例性测定设计成确定对象血液样品中存在的cscf-dna的百分比。在该实施方案中,将对象的血液样品收集在edta管中并离心以分离血浆和血沉棕黄层(buffycoat)。可将血浆和血沉棕黄层等分到两个单独的15ml锥形管中并冷冻。血浆样品可用于定量基因分型(qgt),而血沉棕黄层可用于对象的基础基因分型(bgt)。该过程的第一步可以是从血浆样品提取无细胞dna(用于qgt)和从血沉棕黄层、全血或组织样品提取基因组dna(gdna)(用于bgt)。可以通过qpcr确定cfdna的总量并将其归一化至目标浓度。该过程称为cf-dna定量。gdna可以使用紫外分光光度法定量并归一化。15ngdna通常可提供准确有效的结果。归一化的患者dna可以用作含有引物对的多重文库pcr扩增反应的输入,每种引物对扩增包括moma靶位点之一的区域。得到的文库可用作bgt或qgt测定的输入,因为它由具有moma靶引物和探针位点的pcr扩增子组成。该步骤可以通过在高度特异性qpcr扩增之前提高每种靶标的拷贝数来提高整个测定的灵敏度。可以使用多重文库与患者样品一起扩增对照和校准品/标准品。在文库扩增后,可以进行酶清除以除去过量的引物和未并入的脱氧核苷酸三磷酸(dntp)以防止干扰下游扩增。在平行的工作流程中,可以制备主混合物(mastermix)并将其转移至384孔pcr板。然后可以用文库稀释缓冲剂将扩增的样品、对照和校准物/标准物稀释至预定的体积和浓度。稀释的样品和对照可以等分到6孔储存器板中,并使用声学液体处理器转移到384孔pcr板。然后将板密封并移至实时pcr扩增和检测系统。moma可以通过靶向在患有癌症的对象和未患癌症的对象之间可能不同的双等位基因snv进行基础和定量基因分型分析二者,从而使其具有高信息性。可以设计moma测定以靶向患者的肿瘤特异性snv,或针对常见的肿瘤特异性snv。定量基因分型分析,与标准曲线一起来定量每种靶标的肿瘤特异性等位基因存在,称为次要物质比例。肿瘤可以是异质的并且携带多种snv或单个肿瘤特异性等位基因。质量控制通过的等位基因比可用于确定每种snv的cscfdna的%。在一些实施方案中,可以对来自每一种信息性靶标的结果求平均值。实施例2-用转移性胰腺癌样品进行moma测定多重文库的生成使用约15ng的输入模板dna和q5高保真dna聚合酶(newenglandbiolabs)在25个循环反应中制备用于13种癌症特异性靶标(包括kras和p53的靶标)的多重文库,得到最终浓度为4μm胰腺癌引物。循环方案如下:在98℃下1个循环30秒;98℃下25个循环10秒,60℃20秒,72℃30秒;在72℃下一个循环2分钟;然后将反应物储存在4℃下。用exosap-ittm(thermofisherscientific)清洗反应,并用1x保存溶液(0.18xtbe和0.2μg/μlbsa)1∶1覆盖。人kras外显子2定量基因分型测定从两名转移性胰腺癌患者和健康对照中分离无细胞dna(cf-dna)。加入对照模板;以每次反应4500个拷贝添加tai5作为99∶1(vv∶rr)混合物。细胞系基因组dna(gdna)(hd272;horizondiagnostics,cambridge,uk)用于突变型人kras外显子2变体dna(50%突变dna)。与野生型(wt)dna(100%wtdna)一起,将两者用于制备混合的人基因组dna样品。对这些重构的dna进行超声处理以模拟无细胞dna(cf-dna)并产生介于0.25%至50.0%之间的理论等位基因频率。使用aptataq主混合物(roche)在3μl反应(1μl样品;2μl主混合物)中建立定量基因分型。将两种引物对用于kras外显子2靶标(一对针对癌症特异性的变体形式,另一对针对参考kras外显子2序列)。用0.5x保存溶液(如上所述)以1∶100稀释样品。将板热封,在室温下旋转3分钟,并使用本领域已知的标准方案进行pcr(lc480,roche)。实验结果在表1和图5中示出。表1.kras外显子2靶标moma结果recon/患者(理论百分比)靶标moma(癌症特异性%)0.000%0.183%0.250%0.289%0.500%0.689%1.000%1.361%5.000%4.778%10.000%9.825%50.000%50.277%wtcfdna0.131%患者1cfdna20.377%患者2cfdna2.058%实施例3-计算机实现的实施方案的实施例在一些实施方案中,上述诊断技术可以通过执行一种或更多种软件设施的一种或更多种计算设备来实现以随时间分析对象的样品、测量样品中的核酸(例如无细胞dna)并基于一种或更多种样品产生诊断结果。图6示出了可以用其操作一些实施方案的计算机系统的实例,但应理解,实施方案不限于使用图6中所示类型的系统来操作。图6的计算机系统包括对象802和可以从对象802获得样品806的临床医生804。如从前述应理解的,样品806可以是用于对象802的任何合适的生物材料样品,其可用于测量对象802(包括血液样品)中核酸(例如无细胞dna)的存在。可以将样品806提供给分析设备808,普通技术人员将从前述内容中理解其将分析样品806以确定(包括估计)样品806和/或对象802中核酸(例如无细胞dna)的总量以及非天然核酸(例如无细胞dna)的量。为了便于说明,将分析设备808描绘为单个设备,但应理解,分析设备808可以采用任何合适的形式,并且在一些实施方案中,可以作为多个设备实现。为了确定样品806和/或对象802中的核酸(例如无细胞dna)的量,分析设备808可以执行上述任何技术,并且不限于进行任何特定的分析。分析设备808可以包括一个或更多个处理器以执行在软件实现中的分析设施,其可以驱动处理器以操作其他硬件并接收由其他硬件执行的任务的结果以确定分析的总结果(其可以是样品806和/或对象802中的核酸(例如无细胞dna)的量)。分析设施可以存储在设备808的一个或更多个计算机可读存储介质中,例如存储器中。在另一些实施方案中,本文中描述的用于分析样品的技术可以部分地或完全地在一个或更多个专用计算机组件(例如专用集成电路(applicationspecificintegratedcircuits,asic))中实现,或者通过可代替软件实施的任何其他合适形式的计算机组件来实现。在一些实施方案中,临床医生804可以直接将样品806提供给分析设备808,并且除了从对象802获得样品806之外还可以操作设备808,而在另一些实施方案中,设备808可以在地理上位于远离临床医生804的位置,并且对象802和样品806可能需要被运送或以其他方式转移到分析设备808的位置。在一些实施方案中,样品806可以(例如,经由任何合适的界面输入)与样品806和/或对象802的标识符、获得样品806的日期和/或时间,或描述或识别样品806的其他信息一起提供给分析设备808。在一些实施方案中,分析设备808可以配置为将对样品806执行的分析的结果提供给计算设备810,计算设备810可以包括可作为数据库或其他合适的数据存储的数据存储810a实现。在一些实施方案中,计算设备810可以作为一种或更多种服务器实现,包括作为例如云服务提供商的分布式计算平台的一种或更多种物理和/或虚拟机。在另一些实施方案中,设备810可以作为台式或膝上型个人计算机、智能移动电话、平板计算机、专用硬件设备或其他计算设备实现。在一些实施方案中,分析设备808可以经由一种或更多种有线和/或无线、本地和/或广域计算机通信网络(包括因特网)将其分析结果传送给设备810。可以使用任何合适的协议传达分析的结果,并且可以与描述或识别样品806的信息,例如样品806和/或对象802的标识符或获得样品806的日期和/或时间一起传达。计算设备810可包括一种或更多种处理器以执行在软件实现中的诊断设施,其可以驱动处理器执行本文中描述的诊断技术。诊断设施可以存储在设备810的一种或更多种计算机可读存储介质,例如存储器中。在另一些实施方案中,本文中描述的用于分析样品的技术可以部分或全部地在一种或更多种专用计算机组件例如专用集成电路(applicationspecificintegratedcircuit,asic)中,或通过可以代替软件实现的任何其他合适形式的计算机组件实现。诊断设施可以接收分析的结果以及描述或识别样品806的信息,并且可以将该信息存储在数据存储810a中。该信息可以与对于对象802的其他信息相关联地存储在数据存储810a中,例如在关于对象802的先前样品的信息先前由诊断设施接收和存储的情况下。关于多个样品的信息可以使用公共标识符(commonidentifier)(例如对象802的标识符)来关联。在一些情况下,数据存储810a可以包括用于多个不同对象的信息。还可以操作诊断设施以分析由用户输入识别的特定对象802的一种或更多种样品806的分析结果,以便确定对象802的诊断。诊断可以是对象802患有、可能患有或可能在将来发展特定病症的风险的结论。诊断设施可以使用上述任何多种实例来确定诊断,包括通过将针对特定样品806确定的核酸(例如无细胞dna)的量与一种或更多种阈值进行比较,或者通过比较对样品806测定的核酸(例如无细胞dna)的量相对于一种或更多种阈值随时间的变化。例如,诊断设施可以通过将一种或更多种样品806的核酸(例如非天然无细胞dna)的量与阈值进行比较来确定对象802的病症的风险。基于与阈值的比较,诊断设施可以产生指示对象802的病症的风险的输出。如从前述应理解的,在一些实施方案中,诊断设施可以配置有不同的阈值,可以将核酸(例如无细胞dna)的量与其进行比较。例如,不同的阈值可以对应于不同的人口统计组(年龄、性别、种族、经济类别、医学史中的特定过程/病症/其他的存在或不存在,或其他人口统计类别)、不同的条件和/或其他参数或参数的组合。在这样的实施方案中,诊断设施可以配置为选择与其比较核酸(例如无细胞dna)的量的阈值,其中不同的阈值存储在计算设备810的存储器中。因此,在基于人口统计组阈值不同的实施方案中,可以基于对象802的人口统计信息进行选择,并且在这些情况下,可以将对象802的人口统计信息提供给诊断设施或使用对象802的标识符通过诊断设施检索(来自另一个计算设备,或可以是与数据存储810a相同或不同的数据储存或来自任何其他合适的来源)。作为补充或替代,可以基于确定风险的条件进行选择,并且诊断设施可以在确定风险之前接收作为输入的条件并使用该条件来选择确定风险的基础的阈值。应理解,在支持多个阈值的实施方案中,诊断设施不限于以任何特定方式选择阈值。在一些实施方案中,诊断设施可以配置为输出以向用户呈现用户界面,该用户界面包括对象802的诊断的风险和/或诊断的基础。诊断的基础可包括例如对于对象802在一种或更多种样品806中检测的核酸(例如无细胞dna)的量。在一些实施方案中,用户界面可包括上面讨论的结果、值、量、图等的任何实例。它们可以包括随着时间推移的结果、值、数量等。例如,在一些实施方案中,用户界面可以包含类似于本文中提供的任一附图中所示的图的图形。在这种情况下,在一些情况下,可以对图表进行注释以向用户指示图表的不同区域如何可对应于可以从图表中显示的数据的分析产生的不同诊断。例如,可以将图表数据所针对的阈值进行比较以确定分析可施加至图表上。与可能通过其他用户界面提供的相比,包括图形,尤其是线条和/或阴影的用户界面可以向用户提供更直观和更快速评阅的界面从而基于核酸(例如无细胞dna)的量确定对象802的风险。然而,应理解,实施方案不限于用任何特定用户界面来实现。在一些实施方案中,诊断设施可以将诊断或用户界面输出至可以由对象802和/或临床医生(可以是临床医生804或其他临床医生)操作的一种或更多种其他计算设备814(包括设备814a,814b)。诊断设施可以经由网络812将诊断和/或用户界面传送至设备814。根据本文中描述的原理操作的技术可以以任何合适的方式实现。上面讨论中包括一系列流程图,示出了基于核酸(例如无细胞dna)的量的分析确定病症的风险之多种方法的步骤和动作。上面讨论的处理和决策块(decisionblocks)表示可以包括在执行这些各种过程的算法中的步骤和动作。从这些过程导出的算法可以实现为与一种或更多种单用途或多用途处理器的操作集成并指导其操作的软件,可以实现为功能等效电路,例如数字信号处理(digitalsignalprocessing,dsp)电路或应用型专用集成电路(application-specificintegratedcircuit,asic),或者可以以任何其他合适的方式实现。应理解,实施方案不限于任何特定电路或任何特定编程语言或编程语言类型的任何特定语法或操作。相反,本领域技术人员可以使用上面的描述来制造电路或实现计算机软件算法以执行实施本文中描述的技术类型的特定装置的处理。还应理解的是,除非本文中另有指示,否则上述步骤和/或动作的特定序列仅仅是对可以实现的算法的说明,并且可以在本文中描述的原理的实现和实施方案中变化。因此,在一些实施方案中,本文中描述的技术可以体现为作为软件计算机可执行指令来实现,其包括如应用软件、系统软件、固件、中间件、嵌入代码或任何其他合适类型的计算机代码。这样的计算机可执行指令可以使用许多合适的编程语言和/或编程或脚本工具中的任一种来编写,并且还可以被编译为在框架或虚拟机上执行的可执行机器语言代码或中间代码。当本文中描述的技术体现为计算机可执行指令时,这些计算机可执行指令可以以任何合适的方式实现,包括作为多种功能设施,每种功能设施提供一种或更多种操作以完成根据这些技术操作的算法的执行。然而,实例化的“功能设施”是计算机系统的结构组件,当用一种或更多种计算机集成并由其执行时,使得一种或更多种计算机执行特定的操作角色。功能设施可以是软件元素的一部分或全部。例如,功能设施可以根据过程、或作为离散过程,或作为任何其他合适的处理单元来实现。如果本文中描述的技术被实现为多种功能设施,则每种功能设施可以以其自己的方式实现;所有这些都不需要以同样的方式实现。另外,这些功能设施可以并行和/或串行地执行(如果适当的话),并且可以使用正在执行其的计算机上的共享存储器,使用消息传递协议,或者以任何其他合适的方式在彼此之间传递信息。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1