用于生物工程组织的组合物和方法与流程
本申请根据35u.s.c.119(e)要求2016年05月11日提交的美国序列号62/335,013和2017年05月03日提交的美国序列号15/586,061的优先权,两个申请的整体通过引用并入本文。
背景技术:
以下关于本发明的背景技术的讨论,仅仅提供来帮助读者了解本发明,并非承认其描述或构成本发明的现有技术。
球状体和类器官培养系统以及其他器官建模方法促进了更接近于在原生组织中发现的细胞构型和极性的形成。虽然完全来源于克隆细胞群的培养物具有某些优势,但在再生医学中越来越认识到三维组织、细胞极性、上皮-间充质相互作用和来自上皮-间充质关系的有助于稳定细胞及其功能的旁分泌信号的重要性。
使器官和类器官组织生长的现有方法局限于小规模模型,因为在缺乏不能模拟模型器官的血管和组织学分区的血管支持和组织的情况下无法维持大量细胞。因此,仍然需要可扩展、稳定的生成生物工程组织(bioengineeredtissue)的方法。
技术实现要素:
本公开的方面涉及用于生产和使用生物工程组织或微器官的组合物、试剂盒和方法以及被配置用于其生成的容器。
本公开的方面涉及用于生成生物工程组织的容器。在一些实施方案中,所述生成包括将上皮细胞和/或间充质细胞引入至生物基质支架(biomatrixscaffold)之中或之上。在一些实施方案中,所述生成包括引入实质和/或非实质细胞。在一些实施方案中,所述细胞是彼此的谱系阶段伴侣(lineagestagepartners)。本公开的方面涉及包含细胞外基质的三维支架,该三维支架依次包含(i)在器官中发现的原生胶原和/或(ii)在器官中发现的血管树的基质残余物。
在一些实施方案中,生物基质支架包含胶原。在一些实施方案中,生物基质支架包含(1)(i)新生(nascent)胶原、(ii)聚集但不交联的胶原分子、(iii)交联的胶原和(iv)与这些不同形式的胶原结合的因子(基质组分、信号分子、其他因子)和/或(2)绝大多数在组织中发现的交联和不交联的原生胶原、以及与这些胶原结合的基质分子和信号分子。在一些实施方案中,生物基质支架是三维的。在一些实施方案中,生物基质支架包含一种或多种胶原相关的基质组分,例如与基质组分相关的层粘连蛋白、巢蛋白、弹性蛋白、蛋白聚糖、透明质酸、非硫酸化糖胺聚糖和硫酸化糖胺聚糖以及生长因子和细胞因子。在一些实施方案中,生物基质支架包含大于50%的在体内发现的基质结合信号分子。在一些实施方案中,基质结合信号分子可以是表皮生长因子(egf)、成纤维细胞生长因子(fgf)、肝细胞生长因子(hgf)、胰岛素样生长因子(igf)、转化生长因子(tgf)、神经生长因子(ngf)、神经营养因子、白细胞介素、白血病抑制因子(lif)、血管内皮细胞生长因子(vegf)、血小板衍生生长因子(pdgf)、干细胞因子(scf)、集落刺激因子(csf)、gm-csf、促红细胞生成素、血小板生成素、肝素结合生长因子、igf结合蛋白、胎盘生长因子和wnt信号。在一些实施方案中,生物基质支架包含组织的血管树的基质残余物。在进一步的实施方案中,所述基质残余物可以在生物工程组织中提供细胞的血管支持。
在一些实施方案中,当细胞处于接种培养基(seedingmedium)中时,所述生成可任选地进一步包括在初始培养期后用分化培养基替换接种培养基。在一些实施方案中,当细胞处于接种培养基中时,它们以多个间隔引入,每个间隔接着一段休息时间。在一些实施方案中,所述间隔约为10分钟以及所述休息时间约为10分钟。在一些实施方案中,接种密度是每克湿重生物基质支架小于或约1200万个细胞并在一个或多个间隔内引入。在一些实施方案中,接种培养基中的细胞以~15ml/min的速率、一个或多个间隔引入。在一些实施方案中,接种培养基中的细胞以10分钟的间隔引入,每个间隔接着10分钟的休息时间。在一些实施方案中,接种培养基中的细胞在三个间隔后以1.3ml/min的速率引入。
在一些实施方案中,接种培养基包括无血清的接种培养基。在一些实施方案中,接种培养基补充有血清,任选地约2%至10%的胎儿血清,例如胎牛血清(fbs)。在一些实施方案中,可能需要培养基的血清补充(例如,从而灭活用于制备细胞悬浮液的酶)。在一些实施方案中,该补充发生在数小时内。
在一些实施方案中,接种培养基包含基础培养基、脂质、胰岛素、转铁蛋白和/或抗氧化剂。在一些实施方案中,接种培养基可包含以下中的一种或多种:基础培养基、低钙(0.3-0.5mm)、无铜、锌和硒、胰岛素、转铁蛋白/fe、以及一种或多种任选地与纯化白蛋白复合的纯化的游离脂肪酸(例如棕榈酸、棕榈油酸、硬脂酸、油酸、亚油酸、亚麻酸)、以及一种或多种脂质结合蛋白(例如高密度脂蛋白(hdl))。在一些实施方案中,可以使用所述接种培养基,该接种培养基包含或保持低氧浓度水平(1-2%)。
在一些实施方案中,在引入步骤之前,将细胞在接种培养基中于4℃下培养4至6小时。在一些实施方案中,所述细胞可以从胎儿或新生儿器官中分离出来。在一些实施方案中,间充质细胞是基质细胞、内皮细胞或造血细胞。在一些实施方案中,细胞可以从成人或儿童供体中分离出来。在一些实施方案中,上皮细胞或实质细胞可以是以下中的任何一种或多种:胆管树干细胞、胆囊来源的干细胞、肝干细胞、成肝细胞、定向(committed)肝细胞和胆管祖细胞、axin2+祖细胞(例如axin2+肝祖细胞)、成熟的实质或上皮细胞、成熟肝细胞、成熟胆管细胞、胰腺干细胞、胰腺定向祖细胞、胰岛细胞、和/或腺泡细胞;和/或间充质或非实质细胞可以是以下中的任何一种或多种:成血管细胞、星状细胞前体、星状细胞、间充质干细胞、周细胞、平滑肌细胞、基质细胞、神经元细胞前体、神经元细胞、内皮细胞前体、内皮细胞、造血细胞前体、和/或造血细胞。在一些实施方案中,上皮细胞或实质细胞可以是干细胞和/或其来自胆管树、肝、胆囊、肝-胰腺共同管(commonduct)的后代,和/或间充质或非实质细胞可以是成血管细胞、内皮细胞和/或星状细胞前体、间充质干细胞、星状细胞、基质细胞、平滑肌细胞、内皮细胞、骨髓来源的干细胞、造血细胞前体、和/或造血细胞。在一些实施方案中,上皮细胞或实质细胞可包括分化的实质细胞,例如但不限于axin2+祖细胞(例如axin2+肝细胞或肝祖细胞)、成熟细胞(例如成熟肝细胞、成熟胆管细胞)、多倍体细胞(例如多倍体肝细胞)和凋亡细胞。在一些实施方案中,成熟细胞可以与窦状内皮细胞相关,其中一些窦状内皮细胞可以是有孔的间充质细胞(例如内皮细胞)。在一些实施方案中,axin2+祖细胞(例如axin2+肝祖细胞)可以与内皮细胞连接。在一些实施方案中,上皮细胞或实质细胞是成熟胰岛,任选地与成熟内皮细胞和/或成熟腺泡细胞相关,和/或任选地与成熟基质相关。在一些实施方案中,上皮与间充质或实质与非实质的细胞比例是80%比20%。在一些实施方案中,细胞是至少50%的干细胞和/或前体细胞。在一些实施方案中,细胞不包含任何终末分化的肝细胞和/或胰腺细胞。在一些实施方案中,上皮细胞或实质细胞可以是干细胞、定向祖细胞、二倍体成体细胞、多倍体成体细胞、和/或终末分化细胞中的一种或多种,和/或间充质或非实质细胞可以是成血管细胞、内皮细胞前体、成熟内皮细胞、基质前体、成熟基质、神经元前体和成熟神经元细胞、造血细胞前体和/或成熟造血细胞中的一种或多种。
在一些实施方案中,细胞的组成可以根据需要的组织进行调整,例如,肝细胞可以以特定比例用于生物工程肝组织,或者胰腺细胞可以以特定比例用于生物工程胰腺组织。例如,对于肝脏,上皮细胞可以是干细胞(例如胆管树干细胞)及其来自胆管树、肝脏、肝-胰腺共同管和/或胆囊的后代、胆管树干细胞、胆囊来源的干细胞、肝干细胞、成肝细胞、定向肝细胞和胆管祖细胞、axin2+祖细胞(例如axin2+肝祖细胞)、成熟肝细胞、和/或成熟胆管细胞的一种或多种;和/或间充质细胞或非实质细胞可以是成血管细胞、星状细胞前体、星状细胞、间充质干细胞、平滑肌细胞、基质细胞、内皮细胞前体、内皮细胞、造血细胞前体、和/或造血细胞中的一种或多种。同样地,这些相同的间充质或非实质细胞可用于胰腺;和/或用于胰腺的上皮细胞可包括胆管树干细胞(例如那些来自肝-胰腺共同管的细胞)、胰腺干细胞、胰腺定向祖细胞、胰岛细胞、干细胞及其来自胆管树、肝-胰共同管或胰腺的后代和/或腺泡细胞。在进一步的实施方案中,对于肝脏,可以排除终末分化的肝细胞,以及,对于胰腺,可以排除终末分化的胰腺细胞。
在一些使用分化培养基的实施方案中,分化培养基包含基础培养基、脂质、胰岛素、转铁蛋白、抗氧化剂、铜、钙、和/或用于增殖和/或维持一种或多种的上皮细胞、间充质细胞、实质细胞和/或非实质细胞(取决于所用的细胞)的一种或多种信号。本公开的方面涉及分化培养基本身。在一些实施方案中,分化培养基可包括kubota培养基;一种或多种脂质结合蛋白(例如hdl)、一种或多种纯化的脂肪酸(例如棕榈酸、棕榈油酸、硬脂酸、油酸、亚油酸、亚麻酸)、一种或多种糖(半乳糖、葡萄糖、果糖)、一种或多种糖皮质激素(例如地塞米松(dexamethasone)或氢化可的松(hydrocortisone))、铜(例如浓度约为10-10至约10-12m);钙(例如浓度为0.6mm);用于增殖和/或维持选自催乳素、生长激素、糖皮质激素、胰高血糖素、甲状腺激素(例如三碘联苯胺(tri-iodothryronine)或t3)、表皮生长因子(egf)、肝细胞生长因子(hgf)、成纤维细胞生长因子(fgf)、胰岛素样生长因子(igf)、白血病抑制因子(lif)、白细胞介素(il)(例如il6和il11)、wnt配体、骨形成蛋白(bmp)、和/或环磷酸腺苷(cyclicadenosinemonophosphate)中的上皮细胞或实质细胞的一种或多种激素和/或生长因子,和/或用于增殖和/或维持选自血管生成素、血管内皮细胞生长因子(vegf)、白细胞介素(il)、干细胞因子(scf)、白血病抑制因子(lif)、集落刺激因子(csf)、血小板生成素、血小板衍生生长因子(pdgf)、促红细胞生成素、胰岛素样生长因子(igf)、成纤维细胞生长因子(fgf)、表皮生长因子(egf)中的间充质或非实质细胞的一种或多种激素和/或生长因子。在一些实施方案中,可以使用所述分化培养基,该分化培养基包含或维持氧水平在约5%。
在一些实施方案中,容器是为流体的流动路径设计的,该流体的流动路径的目的是模拟细胞的血管支持。
本公开的方面涉及生物工程组织,其包含原生肝脏的分区依赖性表型性状特征,所述表型性状包括(a)具有干/祖细胞、二倍体成体细胞和/或相关的间充质或非实质前体细胞的性状的门静脉周围区域,(b)具有具有成熟胆管上皮细胞(例如胆管细胞)和/或相关的成熟星状细胞和基质细胞、成熟实质细胞(例如肝细胞)和/或相关的间充质细胞(例如但不限于窦状内皮细胞和/或周细胞(即平滑肌细胞))的正弦板(sinusoidalplate)的性状的细胞的中间腺泡(mid-acinar)区域,(c)具有终末分化的实质细胞(例如但不限于肝细胞,包括多倍体肝细胞和凋亡肝细胞)和/或相关的间充质细胞(例如但不限于有孔的内皮细胞和/或与内皮细胞连接的二倍体axin2+肝脏祖细胞)的性状的中心周围区域。在一些实施方案中,组织的表型性状包括与门静脉周围区域的二倍体实质和/或间充质细胞相关的性状。在一些实施方案中,组织的表型性状包括在原生肝脏的中间腺泡区域中发现的成熟实质细胞(例如成熟肝实质细胞)和/或间充质细胞(例如窦状内皮细胞)的性状。在一些实施方案中,组织的表型性状包括中心周围区域的实质细胞(例如肝实质细胞)和/或间充质细胞的性状。在一些实施方案中,组织包含以下中的一种或多种(i)与有孔的内皮细胞相关的多倍体肝细胞,和/或(ii)连接中央静脉内皮的门静脉周围二倍体肝祖细胞和/或axin2+肝祖细胞。在一些实施方案中,组织的门静脉周围区域富含包含肝干细胞、成肝细胞和/或定向祖细胞和/或二倍体成体肝细胞的干/祖细胞龛的性状。在一些实施方案中,组织的实质细胞还包含肝细胞和/或胆管细胞的前体和/或成熟形态。在一些实施方案中,组织的间充质细胞还包含星状细胞、周细胞、平滑肌细胞和/或内皮细胞的前体和/或成熟形态。同样地,本公开的方面涉及一种生物工程组织,其包含原生胰腺的分区依赖性表型性状特征、和/或其包含与胰腺头部中的胰腺细胞相关的分区和/或与胰腺尾部中的胰腺细胞相关的分区。在一些实施方案中,间充质细胞包括基质、平滑肌细胞、内皮细胞和造血细胞;在进一步的实施方案中,这些间充质细胞可以指示分区依赖性性状。
其他方面涉及三维微器官。非限制性实施例包括在本公开的容器中生成的或由本公开的生物工程组织组成的三维微器官。本文还考虑了用于生成和培养这些微器官的试剂盒。
本文还提供了评估用于器官的治疗的方法,包括将治疗施用至生物工程组织或三维微器官。
附图说明
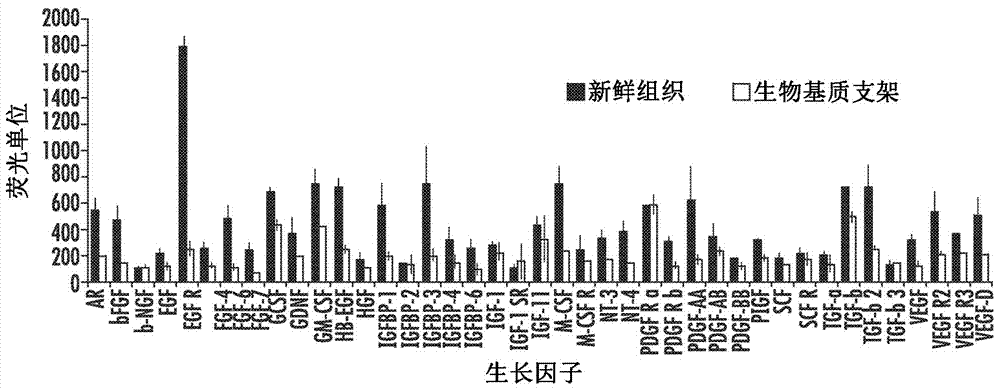
图1显示了脱细胞后生物基质支架的表征。a)与新鲜组织中的相比,生物基质支架中不同生长因子的保留百分比。b-e)通过扫描电子显微镜(sem)成像生物基质支架的超微结构。b)包含门静脉(pv)、肝动脉(ha)和胆管(箭头)的门静脉三联管。c)生物基质支架中腺泡的正弦区域表明它没有细胞。d-e)胶原束(*)和与胶原结合的粘附分子(箭头)。f-o)识别肝脏腺泡内适当的带状位置的基质分子的免疫组织化学。p)与新鲜组织中相比,支架中胶原含量的定量分析。
图2描绘了从三种胎儿肝脏组织中获得并用于生物反应器的细胞之间相对基因表达的rna测序数据。
图3显示了培养14天后人胎儿肝脏干/祖细胞的组织学。a-d)位于门静脉周围区域的细胞标志物。g)显示糖原储存的肝细胞的过碘酸希夫(periodicacid-shiff,pas)染色。h)肝细胞为cyp3a4(一种p450代谢酶)阳性。i)衬套血管的内皮细胞的sem图像。插入的图像是cd31(也称为血小板内皮细胞粘附分子,pecam))阳性的内皮细胞的图像。
图4描绘了胎儿肝脏、生物反应器组织(bio_t14)和成人肝脏样本的rna测序相对表达。a)基质金属肽酶(mmp)(例如mmp-2和-9)是参与基质重塑的酶。b-e)细胞外基质分子的表达。与其他样本相比,在生物反应器中生长的细胞表达显着更高水平的ecm分子(p<0.05)。[bio_t14=生物反应器编号t14)。
图5描绘了在门静脉周围区域中发现的描绘细胞的标志物的rna测序相对基因表达。在生物反应器中培养的细胞有显著降低的干细胞和成肝细胞标志物的基因表达,以及胆管细胞标志物的增加p<0.05。这表明向更成熟的表型转变。p<0.05。
图6描绘了在中心周围区域中发现的描绘细胞的标志物的rna测序相对基因表达。与干细胞和祖细胞标志物的减少平行,在生物反应器中培养的细胞继续向成熟肝表型分化,这通过与成熟的代谢性状相关的基因增加的表达证明。p<0.05。
图7显示了表达测定的结果:a)与反馈回路和信号转导通路(称为saivador/warts/hippo(swh)通路,其调节器官大小并涉及hippo(“hippopotamus-like”)激酶和yap(yes相关蛋白))相关的基因的rna测序表达。与胎儿和成人肝脏相比,在生物反应器中培养的细胞显示hippo激酶的减少和yap及相关靶向基因的增加,表明正在进行的再生过程。b)培养14天后生物基质支架中血管生成标志物的基因表达和胎儿肝脏血管内皮细胞的sem图像。c)造血和内皮干细胞标志物(例如内皮转录因子、gata-2、干细胞因子受体(scr)和白细胞介素7r(il7r)和成熟的造血基因(例如重组激活基因1(ragl))、cd3(t细胞共受体)和集落刺激因子(csf))的相对基因表达。生物反应器样本具有类似于在成人肝脏中发现的cd3的基因表达水平,并且具有升高的rag1表达,两者都与t细胞相关。csf(由骨髓细胞表达的基因)显着高于胎儿和成人肝脏。p<0.05。
图8显示了各种测定的结果:a)细胞活力由乳酸脱氢酶(ldh)、全长角蛋白18(fl-k18,坏死指标)和裂解细胞角蛋白18(cck18,细胞凋亡指标)指示;以及b)培养中14天内甲胎蛋白(afp)和白蛋白的细胞产生以及尿素的分泌。白蛋白水平的上升和下降似乎补充了细胞凋亡数据,暗示了细胞周期现象和再生反应。
图9显示了在生物反应器中培养并经历糖异生或糖酵解的细胞。葡萄糖的产生或消耗的变化也可对应于组织工程化肝脏的发育变化。糖异生发生在前体和门静脉周围细胞中,而糖酵解与中心周围区域的细胞相关。b)多变量分析表明,生物反应器的代谢行为虽然趋势相似,但仍处于代谢功能的不同阶段。c)变量投影重要性指标(variableimportanceinprojection,vip)图显示了有助于分离的代谢物。vip>1.0被认为是重要的。
图10a-f是培养14天后组织工程化肝脏中细胞的透射电子显微镜(tem)图像。a-c)几个肝细胞样细胞形成胆小管(bc)和它们之间的正弦空间(箭头)。b)在胆小管周围可见可能的分泌小泡(箭头)。d)细胞粘附于生物基质支架。e,f)细胞之间的连接复合体包括细胞桥粒、粘附素和间隙连接(箭头)。
图11是大鼠肝脏中脱细胞过程,并产生用于生物反应器实验的生物基质支架的图像。
图12描绘了在设计用于生物反应器的无血清、激素限定的培养基(bio-liv-hdm)或市售的肝细胞维持培养基(hmm)中培养时肝细胞分泌的白蛋白和尿素。
详细说明
在下文中将更全面地描述根据本公开的实施方案。然而,本公开的各方面可以以不同的形式实施,并且不应理解为限于如本文所述的实施方案。相反,提供这些实施方案是为了使本公开彻底和完整,并且将本发明的范围完全传达给本领域技术人员。在此说明中使用的术语仅用于描述特定的实施方案,并不旨在加以限制。
除非另有定义,否则本文使用的所有术语(包括技术和科学术语)与本技术所属的技术领域的普通技术人员的普遍理解有相同的含义。进一步理解的是,术语(如在常用词典中定义的那些)应解释为与其在本申请和相关领域的上下文中的含义一致,并且不应以理想化或过于正式的形式解释,除非在此明确定义。例如,描述符可用于指代表现出特定器官的特征的生物材料(例如组织、类器官、样本),例如,“肝脏的(hepatic)”的使用描述了肝脏来源的组织或肝样类器官。虽然下面没有明确定义,但这些术语应根据它们的共同含义进行解释。
本说明中使用的术语仅用于描述特定的实施方案,并不旨在限制本发明。本文提及的所有出版物、专利申请、专利和其他参考文献都通过引用整体并入。
除非另有说明,否则本技术的实践将采用组织培养、免疫学、分子生物学、微生物学、细胞生物学和重组dna的常规技术,这些技术在本领域的技术范围内。参见例如sambrookandrusselleds.(2001)molecularcloning:alaboratorymanual,3rdedition;theseriesausubeletal.eds.(2007)currentprotocolsinmolecularbiology;theseriesmethodsinenzymology(academicpress,inc.,n.y.);macphersonetal.(1991)pcr1:apracticalapproach(irlpressatoxforduniversitypress);macphersonetal.(1995)pcr2:apracticalapproach;harlowandlaneeds.(1999)antibodies,alaboratorymanual;freshney(2005)cultureofanimalcells:amanualofbasictechnique,5thedition;gaited.(1984)oligonucleotidesynthesis;u.s.patentno.4,683,195;hamesandhigginseds.(1984)nucleicacidhybridization;anderson(1999)nucleicacidhybridization;hamesandhigginseds.(1984)transcriptionandtranslation;immobilizedcellsandenzymes(irlpress(1986));perbal(1984)apracticalguidetomolecularcloning;millerandcaloseds.(1987)genetransfervectorsformammaliancells(coldspringharborlaboratory);makridesed.(2003)genetransferandexpressioninmammaliancells;mayerandwalkereds.(1987)immunochemicalmethodsincellandmolecularbiology(academicpress,london);以及herzenbergetal.eds(1996)weir'shandbookofexperimentalimmunology。
除非上下文另有说明,否则明确意图的是本文所述的本发明的各种特征可以以任何组合使用。此外,在一些实施方案中,本公开还预期可排除或省略如本文所述的任何特征或特征的组合。为了说明这一点,如果说明书陈述了复合物包含组分a、b和c,则明确旨在可以省略和单独地或以任何组合方式放弃a、b或c中的任何一个或其组合。
所有的数值指定,例如ph、温度、时间、浓度和分子量,包括范围,都是适当地按1.0或0.1的增量(+)或(-)变化、或者按+/-15%、或者10%、或者5%、或者2%变化的近似值。需要了解的是,尽管并不总是明确地指出,但是所有的数值指定前面都有“约”一词。还需要了解的是,尽管并不总是明确地说明,但是本文所描述的试剂仅仅是示例性的,并且其等效物在本领域中是已知的。
定义
如本发明的说明书和权利要求中使用的,单数形式“一个/一种”和“所述”旨在包含复数形式,除非上下文另有明确规定。
当指代诸如量或浓度(例如,生物基质支架中的总蛋白质中的胶原的百分比)等的可测量值时,本文使用的术语“约”意指包括指定的量的20%、10%、5%、1%、0.5%或甚至0.1%的变化。
当用于描述本公开的任何组分、范围、剂型等的选择时,术语“可接受的”、“有效的”或“足够的”意指所述组分、范围、剂型等适用于本公开的目的。
同样如本文所使用的,“和/或”是指并且涵盖一个或多个相关所列项目的任何和所有可能的组合,以及当以替代(“或”)解释时的缺乏组合。
术语“生物工程的”在本文中用于描述经工程改造以具有与天然存在的器官或组织相似或相同的生物学特性的人造器官或组织。在某些方面,这可能需要特定装置的工程的使用;在其他方面,这可能需要各种生物因子的使用。
术语“生物基质支架”是指富含细胞外基质的分离的组织提取物,并且如本文所述地保留在生物组织中天然存在的胶原和/或胶原结合因子中的一些(任选地许多或大多数)。在一些实施方案中,生物基质支架包含以下物质、由以下物质组成、或基本上由以下物质组成:胶原、纤连蛋白、层粘连蛋白、巢蛋白、整联蛋白(integrin)、弹性蛋白、蛋白聚糖、糖胺聚糖(硫酸化和非硫酸化的-包括透明质酸)及其任何组合,所有这些都是生物基质支架的一部分(例如,包括在术语生物基质支架中)。
在一些实施方案中,生物基质支架缺乏可检测量的特定的胶原、纤连蛋白、层粘连蛋白、巢蛋白、弹性蛋白、蛋白聚糖、糖胺聚糖和/或其任何组合。在一些实施方案中,基本上保留了所有胶原和胶原结合因子,并且在其他实施方案中,生物基质支架包含已知在组织中的所有胶原。
生物基质支架可以包含至少约50%、60%、70%、75%、80%、85%、90%、95%、97%、98%、99%、99.5%或100%的在天然生物组织中发现的以任何组合形式存在的胶原、胶原相关的基质组分、和/或基质结合生长因子、激素和/或细胞因子。在一些实施方案中,生物基质支架包含生物组织的至少95%的胶原和大多数胶原相关的基质组分和基质结合生长因子、激素和/或细胞因子。本文描述的胶原可以是新生的(新形成的)、非交联的胶原。如本文所公开的,胶原由3条如毛发般编织成三螺旋的氨基酸链组成(由3个氨基酸支配的区域:[甘氨酸-脯氨酸-x](其中x可以是许多不同氨基酸中的任何一个)),这3条氨基酸链形成胶原的纤维样结构域,并且分子的末端具有氨基酸化学成分,这种化学成分对于不同的胶原类型是独特的,并产生球状结构域。胶原分子可以被分泌;自组装以形成胶原纤维(聚集的胶原分子);与非胶原基质组分和与信号分子(细胞因子、生长因子)自组装;并且然后交联以形成细胞外基质。示例性的胶原及其提取方法在下文中简要描述。
某些胶原分子具有对29种已知胶原类型中的每一种都是独特的氨基酸化学成分。胶原从细胞中分泌,然后分子的一端或两端通过特定的肽酶除去,随后多个胶原分子聚集以形成胶原纤维或原纤维。例外的是“网络胶原”,其保留球状结构域,然后端对端聚集以形成胶原分子网络(即具有铁丝网状结构)。在聚集成纤维或成网络后,胶原通过赖氨酰氧化酶(lysyloxidase)的作用进行交联,赖氨酰氧化酶是一种细胞外铜依赖性酶,它在胶原分子之间(以及弹性蛋白分子之间)产生共价结合,从而产生构成非常稳定的胶原和任何结合至胶原的物质的聚集体的交联形式。纤维状胶原中每个原纤维的胶原分子数和网络胶原中的连接模式由特定胶原类型的确切的氨基酸化学成分决定。
提取组织以将处于不溶状态的不交联和交联的胶原分离,可以利用中性ph和盐浓度等于或高于1m的缓冲液来完成;将不交联的胶原保持为不溶物所需的盐的确切浓度取决于胶原的类型。例如,在皮肤中大量存在的i型和iii型胶原需要大约1m的盐;相反,在羊膜中的胶原(例如v型胶原)需要3.5-4.5m的盐;肝脏中不交联以及交联的胶原需要至少3.4m的盐。因此,制备富含细胞外基质的提取物的大多数方法不能保留所有胶原,尤其是那些不交联的胶原。另外,一些方法使用了a)降解基质组分的酶和/或b)使不交联的胶原和与其结合的任何因子溶解的低盐或无盐缓冲液(例如蒸馏水)。因此,对于基质支架存在多种形式的提取物,其含有交联的胶原和与这些交联的胶原结合但是没有或具有最小量的不交联的胶原及其相关因子的任何因子。尽管主要或仅单独分离交联的胶原的提取物也具有粘附分子和信号分子,但由于它们在交联基质内的取向和位置而不容易与细胞相互作用。相比之下,不交联的胶原与其他基质组分和与信号分子自组装,其所有都可用于与细胞相互作用。在一些实施方案中,制备本公开的生物基质支架使得避免低离子强度缓冲液,以保留交联和非交联的胶原。
在一些实施方案中,本公开的生物基质支架基本上包含所有胶原,该胶原包括新生(新形成的)胶原、交联前聚集的胶原分子、以及交联的胶原。此外,生物基质支架可任选地包含其他基质组分加上与这些胶原结合或结合基质组分的信号分子。在一些实施方案中,生物基质支架中胶原的比例与生物基质支架所源自的组织中的比例相似或相同。模拟原始组织的新生胶原的合适百分比的非限制性实施例包括但不限于至少约或约0.05%、0.1%、0.5%、1%、5%、10%、15%、20%、25%、30%、35%、40%、45%或50%。
如本文所述,“生物组织的大多数胶原相关的基质组分和基质结合生长因子、激素和/或细胞因子”是指生物基质支架保留在天然(例如未加工的)生物组织中发现的胶原相关的基质成分和基质结合生长因子、激素和/或细胞因子中的约50%、60%、70%、75%、80%、85%、90%、95%、97%、98%、99%、99.5%或100%。术语“粉末的”或“粉状的”在本文中可互换使用,描述已研磨成粉末的生物基质支架。术语“三维生物基质支架”是指保留其原生三维结构的脱细胞支架。这种三维支架可以是整个支架或其冷冻切片。
术语“缓冲液”和/或“冲洗介质”在本文中使用是指在制备生物基质支架中使用的试剂。
如本文所使用的,术语“细胞”是指真核细胞。在一些实施方案中,该细胞是动物来源的并且可以是干细胞或体细胞。术语“细胞群”是指一组具有相同或不同来源的相同或不同细胞类型的一种或多种细胞。在一些实施方案中,该细胞群可以来源于细胞系;在一些实施方案中,该细胞群可以来源于器官或组织样本。
本文使用的术语“祖细胞”或“前体”广义地定义为包括干细胞及其后代;在本公开的一些方面,术语“干/祖细胞”在本文中可与“祖先(progenitor)”、“祖细胞(progenitorcell)”或“前体”互换使用。“后代”可包括可以分化成导向一种或多种成熟细胞类型的特定谱系的多能干细胞或单能定向细胞。祖细胞的非限制性实施例包括但不限于任何组织类型的胚胎干(es)细胞、诱导多能干(ips)细胞、胚层干细胞、确定的干细胞(determinedstemcells)、围产期干细胞(perinatalstemcells)、羊水来源的干细胞、间充质干细胞、短暂增值细胞(transitamplifyingcells)、或定向祖细胞。当与诸如“单能的”、“多能的”和/或“定向的”描述符一起使用时,指示了细胞分化成一种或多种成体的能力——例如,胚胎干细胞是多能的并且能够产生3个胚层(外胚层、中胚层、内胚层)的所有成体;确定的干细胞是多能的并且能够产生2个或更多个成体;而星状细胞前体或内皮祖细胞是单能祖细胞的实施例,因此致力于特定的细胞谱系。
如本文所使用的,“实质细胞”通常是器官的上皮细胞。在肝脏中,它们可包含肝细胞和胆管细胞;在胰腺中,它们可包含腺泡细胞和胰岛;在肝脏和胰腺以及其他内胚层器官(例如甲状腺、肠、肺)中,它们可以来源于内胚层干细胞。它们的表型性状与在肝脏腺泡的区域1中的细胞中发现的最早的性状组是谱系依赖的,其转变为中间腺泡区(肝脏的区域2)中的细胞性状,并且终止于中心周围区域(肝脏的区域3)中的终末分化细胞。此外,新近发现,与形成中央静脉的内皮细胞相连的二倍体实质细胞群具有单能祖细胞特性。非限制性示例性实质细胞是胆管树干细胞、肝干细胞、成肝细胞、定向肝细胞和胆管祖细胞、axin2+祖细胞(例如axin2+肝祖细胞)、成熟实质细胞(肝细胞、胆管细胞、以及其干细胞亚群的多能或单能衍生物)。进一步的非限制性实施例包括胆管树干细胞(尤其是来自肝-胰腺共同管的胆管树干细胞)、胰腺干细胞、来自肝-胰腺共同管和来自胰腺导管腺的胰腺定向祖细胞、胰岛和腺泡细胞。这些示例性实施方案可以分别用于例如肝脏和胰腺中。
如本文所使用的,“非实质细胞”是来源于包括成熟的中胚层和外胚层细胞类型的中胚层和外胚层干细胞及其谱系后代的细胞。中胚层干细胞衍生的后代包括成血管细胞、内皮细胞和星状细胞前体细胞群、成熟的内皮细胞、成熟的星状细胞、基质细胞、平滑肌细胞、周细胞、造血干细胞和祖细胞及其包括kupffer细胞、自然杀伤细胞(pit细胞)、骨髓细胞、淋巴细胞和各种其他造血细胞的后代。外胚层干细胞后代包括神经元前体和成熟的神经元细胞。
本领域已知“上皮细胞”是衍生自上皮的细胞。如本文所使用的,术语“间充质细胞”是指起源于中胚层的那些非实质细胞。存在构成组织的关系中心的上皮-间充质伴侣关系(epithelial-mesenchymalpartnership),并且它可以是谱系依赖的;即上皮干细胞与间充质干细胞合作,并且它们的后代以协调的方式成熟。该关系通过由动态地及协同地作用以调节上皮细胞和间充质细胞的生物学反应的可溶性信号和细胞外基质组分组成的信号(旁分泌信号)的“串扰(cross-talk)”来维持。例如,成血管细胞(间充质干细胞群中的一种)与肝干细胞合作。它们产生与肝细胞谱系合作的内皮细胞前体及其后代,并且同时产生与胆管细胞谱系合作的星状细胞前体及其后代。星状细胞群和内皮细胞群经历与之平行的成熟过程,并与它们所结合的上皮细胞协调。因此,这些细胞的表型特性是谱系依赖性的,并且取决于这些细胞是处于谱系的早期、中期还是晚期而不同。这大致解释为细胞是来自肝脏腺泡的区域1(早期)、区域2(中期)还是区域3(晚期)。非限制性示例性非实质细胞是成血管细胞、间充质干细胞、星状细胞前体、星状细胞、周细胞、基质细胞、平滑肌细胞、神经元细胞前体、神经元细胞、内皮细胞前体、内皮细胞、造血细胞前体和造血细胞。
术语“胆管树干细胞”(btsc)是指在整个胆管树(包括在胆囊)中发现的具有转变为肝和/或胰腺干细胞及其后代祖细胞的能力的干细胞。它们存在于壁外胆囊周围腺体(peribiliarygland,pbg)(拴在胆管表面)和壁内pbg中(在胆管壁内)。pbg相关的btsc的后代存在于胆囊中,并且位于与肠隐窝相似的龛中的胆囊绒毛的底部。存在多个btsc亚群并形成转变为在大肝内胆管的pbg中发现的肝干细胞(hpsc)的谱系,并连接到导管板(胎儿和新生儿组织),并转化为hering管(小儿和成人组织)。hpsc产生位于hering管的临近或附近的成肝细胞,并转变为成熟为肝细胞和胆管细胞的定向肝细胞祖细胞和胆管细胞祖细胞。此外,存在btsc的后代,其产生在整个胆管树中但主要在肝胰腺共同管的pbg内发现的胰腺干细胞,并且;这些细胞依次转变为在胰腺内的胰腺导管腺体中发现的定向胰腺祖细胞。所有btsc亚群的生物标志物包括内胚层转录因子(sox9、sox17、foxl1、hnf4-α、oecut2、pdx1)、多能性基因(例如oct4、sox2、nanog、sall4、klf4、klf5、bmi-1);cd44的亚型(isoform)中的一种或多种(cd44和cd44v)、透明质酸受体亚型;cxcr4;itgb1(cd29)、itga6(cd49f)、itgb4和细胞角蛋白8和18。cd44的亚型(例如cd44s)更多地由干细胞和成熟细胞表达,而多种cd44变体亚型(cd44v)则主要在干细胞亚群中表达。此外,目前已确定了3个阶段的btsc亚群:第1阶段btsc表达钠碘同向转运体(sodiumiodidesymporter,nis)、在干细胞中也发现的某些cd44v亚型、以及cxcr4;它们不表达lgr5或epcam;第2阶段btsc表达在干细胞中发现的cd44变体的特定亚型,较少的nis但获得lgr5的表达,而非epcam的表达;第3阶段btsc(唯一在胆囊中发现的以及在整个胆管树中也发现的btsc)表达lgr5和epcam以及在更成熟的细胞中发现的cd44v和cd44s的混合物。第3阶段btsc是肝干细胞祖细胞和胰腺干细胞的前体。
术语“肝干细胞”(hpsc)是指在将胆管树的大肝内胆管的pbg的末端连接到肝细胞板的hering管中发现的干细胞。hpsc保留自我复制的能力并且是多能的。这些细胞的生物标志物包括上皮细胞粘附分子(epcam;在细胞质和质膜上发现)、神经细胞粘附分子(ncam)和非常低水平(如有)的白蛋白。它们表达sox9、sox17、cd29(itbg1)、hnf4-α、onecut2、低至中等水平的一种或多种多能性基因(oct4、sox2、nanog、klf5、sall4)并表达细胞角蛋白8、18和19。它们不表达pdx1或甲胎蛋白(afp)或p450-a7或分泌腺受体(sr)。
术语“成肝细胞”是指能够产生肝细胞和胆管细胞的双能肝干细胞。它们在允许btsc和hpsc的自我复制的条件下具有最小的自我复制能力。尽管如此,它们将广泛地与使用附加细胞因子和生长因子的治疗分开,但这些划分可包括一定程度的分化。这些细胞的特征是生物标记物谱与hpsc和btsc重叠但区别于hpsc和btsc。它包括hnf4-α、cps1、apob、epcam(主要在质膜上)、p450-a7、细胞角蛋白7、19、8和18、分泌腺受体、白蛋白、高水平的afp、细胞间粘附分子(icam-1)的表达,但不包括ncam、dlk1和最少的(如有)多能性基因的表达。
本文使用的术语“定向祖细胞”是指产生单细胞类型的单能祖细胞,例如定向肝细胞祖细胞(通常通过白蛋白、afp、糖原、icam-1、涉及糖原合成的各种酶的表达而识别)并产生肝细胞。定向的胆(或胆管细胞)祖细胞(通常通过epcam、细胞角蛋白7和19、水通道蛋白(aquaporin)、cftr、与胆汁转运的产生(胆汁盐由肝细胞合成)相关的膜泵的表达而识别)产生胆管细胞。
当用于描述细胞时,描述符“成熟的”是指分化的细胞。例如,“成熟的肝细胞”是指肝脏中的主要实质细胞,它在门静脉周围区域中将是二倍体,在中间腺泡区域中是二倍体和多倍体的混合物,以及在中心周围区域中主要是多倍体。基因表达谱可能是区域谱系依赖性的并包括区域1基因(代表性的是转铁蛋白mrna(没有翻译成蛋白质的能力)、连接蛋白28(connexin28)和参与糖原合成的酶),区域2基因(代表性的是酪氨酸转氨酶(tyrosineaminotransferase)、能够翻译成蛋白质的转铁蛋白mrna,以及最高表达水平的白蛋白),以及区域3基因(代表性的是晚期p450,如p450-3a4,以及与凋亡相关的基因)。参见例如turneretalhumanhepaticstemcellandliverlineagebiology.hepatoiogy,2011;53:1035-1045(更详细的基因列表,其中基因以与肝腺泡区相关的模式表达),通过引用并入本文。区域3中最后的实质细胞层由连接至中央静脉的内皮的二倍体、axin2+、单能肝祖细胞组成。
术语“成血管细胞”用于描述产生内皮细胞、星状细胞和具有相关间充质干细胞的周细胞的多能前体。这些细胞可以表达一种或多种生物标志物,例如cd117、vegf-受体、vanwillebrand因子、cd133。参见例如geevarghesea.andhermani.,translres.2014;163(4):296-306(讨论间充质谱系之间的生物标志物的重叠),通过引用并入本文。成血管细胞也可产生间充质干细胞(msc),再产生周细胞(包裹在内皮细胞周围并且其收缩性有助于将血液从区域1移动至区域3,然后进入中央静脉的平滑肌细胞的形式)。它们产生涉及血管发生的许多因子,这些因子包括肝细胞生长因子(hgf)、血管内皮生长因子(vegf)、内皮素、igfii、表皮生长因子(egf)、酸性成纤维细胞生长因子(a-fgf)和神经营养因子。参见geevarghese(2014),图13。
术语“星状细胞前体”是指星状细胞的单能前体;成肝细胞的间充质伴侣之一和定向胆管细胞祖细胞的间充质伴侣。这些细胞的生物标志物包括cd146(也称为mel-cam)、α-平滑肌肌动蛋白和结蛋白。星状细胞前体已知产生成肝细胞和定向祖细胞所需的大量旁分泌信号,该旁分泌信号包括生长因子,例如肝细胞生长因子(hgf)和基质衍生生长因子(sdgf),以及早期谱系阶段基质组分,例如层粘连蛋白和iv型胶原。
术语“内皮细胞前体”是指内皮细胞的单能前体;成肝细胞的另一个间充质伴侣以及定向肝细胞祖细胞的间充质伴侣。这些细胞的生物标志物包括vegf-受体、vanwillebrand因子、cd133和cd31(也称为pecam)。这些细胞已知产生旁分泌信号,这些旁分泌信号也包括生长因子(例如vegf、血管生成素)和基质组分(例如iv型胶原、层粘连蛋白和硫酸类肝素蛋白聚糖(heparansulfateproteoglycan)的形式)。
术语“成熟的星状细胞”用于指胆管细胞的间充质细胞伴侣。这些细胞的生物标记物包括α-平滑肌肌动蛋白和结蛋白。成熟的星状细胞,而非前体,表达如上图所示显着水平的类视黄醇(维生素a衍生物)、胶质纤维酸性蛋白(gfap)、i型和iii型胶原和其他成熟的基质组分、以及成熟的星状细胞的其他标志物。
术语“内皮细胞”用于描述肝细胞的间充质细胞伴侣。它们的表型性状从在门脉三联体(portaltriad)附近与肝细胞形成完整的基底膜转变为引起细胞之间有间隙的有孔的(“窗口”)内皮以及使基质接近中央静脉。生物标记物包括高水平的cd31和vegf-受体。
术语“造血细胞(hematopoieticcell)”(这是英国术语;美国术语是造血的(hemopoietic))是包括在胎儿和围产期的肝脏以及之后在骨髓中产生的细胞的术语,包括但不限于造血干细胞、淋巴细胞、粒细胞、单核细胞、巨噬细胞、血小板、自然杀伤细胞(在肝脏中称为pit细胞)和红细胞。
如本文所使用的,术语“包含”旨在表示组合物和方法包括所列举的要素,但不排除其他要素。如本文所使用的,过渡短语“基本上由……组成”(和语法变体)解释为包含所列举的材料或步骤以及那些不会实质上影响所列举的实施方案的基本和新颖特征的材料和步骤。参见inreherz,537f.2d549,551-52,190u.s.p.q.461,463(ccpa1976)(重点在原文);另见mpep§2111.03。因此,本文所使用的术语“基本上由……组成”不应解释为等同于“包含”。“由......组成”应指不包括其他成分的微量元素和用于施用本公开的组合物的实质方法步骤。由这些过渡术语中的每一个定义的方面都在本公开的范围内。
如本文所使用的,术语“容器”是指特别配置成容纳细胞和/或组织的装置。在一些实施方案中,这种容器可以是设计来容纳生物基质支架的生物反应器。在进一步的实施方案中,容器可以被配置用于使所述支架脱细胞和/或再细胞化的处理。
术语“培养”或“细胞培养”是指在人工、体外环境中细胞的维持,在一些实施方案中是作为贴壁细胞(例如单层培养物)或作为球状体或类器官的漂浮聚集体培养物来维持。术语“球状体”表示全部都是相同的细胞类型的细胞的漂浮聚集体(例如来自细胞系的聚集体);“类器官”是由多种细胞类型组成的细胞的漂浮聚集体。在一些实施方案中,这会是上皮细胞及其间充质伴侣细胞,该间充质伴侣细胞通常是内皮细胞和/或基质细胞。细胞可以是这些细胞类别的干/祖细胞,或者可以是成熟的细胞。“细胞培养系统”在本文中用于指细胞群可以在其中生长的培养条件。
“培养基”在本文中指用于细胞的培养、生长或增殖的营养液。培养基的特征在于功能特性,例如但不限于将细胞维持在特定状态(例如多能状态、静止状态等)、使细胞成熟(在某些情况下,特别是促进祖细胞分化成特定谱系的细胞)的能力。培养基的非限制性实施例是kubota培养基和用于肝脏的激素限定培养基,其在下文中进一步定义。在一些实施方案中,培养基可以是用于将细胞呈现或引入给定环境的“接种培养基”。在其他实施方案中,培养基可以是用于促进细胞的分化的“分化培养基”。此类培养基可以由“基础培养基”或营养物质、矿物质、氨基酸、糖和微量元素的混合物组成,并且可用于细胞离体的维持。
更具体地,“基础培养基”是由组合物中的氨基酸、糖、脂质、维生素、矿物质、盐和各种营养物质组成的、模拟细胞周围的组织液的化学成分的缓冲液。此类培养基可任选地补充有血清以提供驱动生物过程(例如增殖、分化)所需的必要信号分子(激素、生长因子)。尽管血清可以与培养中使用的细胞类型自体同源(autologous),但最常见的是来自通常被屠宰用于农业或食品目的动物的血清,例如来自牛、绵羊、山羊、马等的血清。补充有血清的培养基可任选地称为血清补充培养基(serumsupplementedmedia,ssm)。
许多市售的基础培养基的形式可用于上皮干/祖细胞,但必须进行修饰以维持细胞中的干性性状(stemnesstrait)。研究(kubotaetal,pnas,2000;97(22):12132-12137)表明,为了保持内胚层上皮细胞处于未分化状态,即作为干细胞,可以使用以下培养基:无血清;低氧水平(1-2%);无铜;没有细胞因子和生长因子;钙水平低于0.5mm;补充有胰岛素和转铁蛋白/fe;具有与相关的载体分子(例如白蛋白)和最佳地(但不是严格要求)脂蛋白(例如高密度脂蛋白)复合的纯化的游离脂肪酸的混合物。这种用于干细胞的优化培养基已开发用于内胚层干细胞,并且在下文中定义为“kubota培养基”。它使内胚层干细胞能够以自我复制的方式扩增数月。(kubotaandreidpnas2000;97(22):12132-12137)如果细胞在kubota培养基中并且在透明质酸的基质上或在透明质酸的水凝胶中或在补充有透明质酸的培养基中培养,则上皮细胞作为干细胞的稳定性可以任选地增强。y.wang,h.l.yao,c.b.cuietal,hepatology.2010;52(4):1443-54,us8,802,081通过引用并入本文。
前体的后期成熟谱系阶段,例如成肝细胞和定向祖细胞,自我复制能力有限,但它们具有相当大的扩增能力;这种扩增的条件由用各种生长因子和细胞因子(如hgf、egf,fgf、il-6、il-11的形式和其他)补充kubota培养基以及使用包括iii型和/或iv型胶原和层粘连蛋白的基质(matrixsubstrata)组成。(参见例如kubotaandreidpnas2000;97(22):12132-12137;turneretal;journalofbiomedicalbiomaterials.2000;82(1):pp.156-168;y.wang,h.l.yao,c.b.cuietal.hepatology.2010oct52(4):1443-54,通过引用并入本文)。
如本文所使用的,“分化”是指特定条件引起细胞成熟为产生成体特异性基因产物的成体细胞类型。
当提及特定分子、生物或细胞材料时,术语“等效物”或“生物等效物”可互换使用,并且指那些具有最小同源性而仍保持所需结构或功能的物质。
如本文所使用的,术语“表达”是指多核苷酸转录为mrna的过程和/或转录的mrna随后被翻译成肽、多肽或蛋白质的过程。如果多核苷酸来源于基因组dna,则表达可包括在真核细胞中mrna的剪接。基因的表达水平可以通过测量细胞或组织样本中mrna或蛋白质的量来确定;此外,可以确定多个基因的表达水平以建立用于特定样本的表达谱。
本文使用的术语“细胞外基质”或“ecm”是指由细胞分泌的各种生物活性分子组成的复合支架,其与一个或多个细胞表面相邻,并参与包含其的细胞和组织或器官的结构性和/或功能性支持。特定的基质组分及其浓度可能与特定的组织类型、组织学结构、器官和其他超细胞结构相关。与本公开相关的细胞外基质的组分包括但不限于胶原、胶原相关的基质组分和生长因子。
示例性胶原包括任何和所有类型的胶原,例如但不限于i型至xxix型胶原。生物基质支架可以包含至少约50%、60%、70%、75%、80%、85%、90%、95%、97%、98%、99%、99.5%或更多的一种或多种在原生生物组织中发现的胶原。在一些实施方案中,胶原是交联的和/或不交联的。生物基质支架中胶原的量可通过本领域已知的和本文所描述的各种方法测定,例如但不限于测定羟脯氨酸(hydroxyproline)含量。确定胶原是交联还是非交联的特性的示例性方法也存在,如那些依赖于观察它的溶解特性的方法。参见例如d.r.eyre,*m.weisandj.wu.advancesincollagencross-linkanalysismethods,2009;45(1):65-74(描述通过胶原化学领域中的标准方法进行交联分析)。例如,可以根据胶原是否溶解在1m盐浓度或低于1m盐浓度的缓冲液中来确定它是否交联。
示例性的胶原相关的基质组分包括但不限于粘附分子;粘附蛋白;l-和p-选择蛋白;肝素结合生长相关分子(hb-gam);血小板反应蛋白i型重复(thrombospondintypeirepeat,tsr);淀粉样蛋白p(ap);层粘连蛋白;巢蛋白;纤连蛋白;弹性蛋白;波形蛋白;蛋白聚糖(pg);硫酸软骨素pg(chondroitinsulfate,cs-pg);硫酸皮肤素-pg(dermatansulfate-pg,ds-pg);富含亮氨酸的小蛋白聚糖(slrp)家族的成员,例如双糖链蛋白聚糖(biglycan)和核心蛋白聚糖(decorin);肝素-pg(hp-pg);硫酸乙酰肝素-pg(hs-pg),例如磷脂酰肌醇蛋白聚糖(glypican)、多配体蛋白聚糖(syndecan)和基底膜蛋白聚糖(perlecan);以及糖胺聚糖(gag),例如透明质酸、硫酸乙酰肝素、硫酸软骨素、硫酸角蛋白和肝素。
在一些实施方案中,生物基质支架包含以下物质、由以下物质组成、或基本上由以下物质组成:与各种基质组分(以任何组合)结合的胶原、纤连蛋白、层粘连蛋白、巢蛋白、弹性蛋白、蛋白聚糖、糖胺聚糖(gag)、生长因子、激素和细胞因子。生物基质支架可以包含至少约50%、70%、75%、80%、85%、90%、95%、97%、98%、99%、99.5%或更多的一种或多种在天然生物组织中发现的胶原相关的基质组分、激素和/或细胞因子;和/或可具有以在天然生物组织中发现的至少约50%、70%、75%、80%、85%、90%、95%、97%、98%、99%、99.5%或更多的浓度存在的这些组分中的一种或多种。
在一些实施方案中,生物基质支架包含已知在组织中的胶原相关的基质组分、激素和/或细胞因子中的全部或大多数。在其他实施方案中,生物基质支架以下物质、基本上由以下物质组成、或由以下物质组成:浓度接近在天然生物组织中发现的浓度(例如在天然组织中发现的约50%、60%、70%、75%、80%、85%、90%、95%、98%或100%的浓度)的一种或多种胶原相关的基质组分、激素和/或细胞因子。
示例性的基质结合信号分子包括但不限于表皮生长因子(egf)、成纤维细胞生长因子(fgf)、肝细胞生长因子(hgf)、胰岛素样生长因子(igf)、转化生长因子(tgf)、神经生长因子(ngf)、神经营养因子、白细胞介素、白血病抑制因子(lif)、血管内皮细胞生长因子(vegf)、血小板衍生生长因子(pdgf)、骨形态发生因子、干细胞因子(scf)、集落刺激因子(csf)、gm-csf、促红细胞生成素、血小板生成素、肝素结合生长因子、igf结合蛋白、胎盘生长因子和wnt信号。
示例性的细胞因子包括但不限于白细胞介素、淋巴因子、单核因子、集落刺激因子、趋化因子、干扰素和肿瘤坏死因子(tnf)。生物基质支架可以包含至少约20%、30%、40%、50%、60%、70%、75%、80%、85%、90%、95%、97%、98%、99%、99.5%、100%或更多(以任何组合)的一种或多种在天然生物组织中发现的基质结合生长因子和/或细胞因子;和/或可具有以在天然生物组织中发现的至少约20%、30%、40%、50%、60%、70%、75%、80%、85%、90%、95%、97%、98%、99%、99.5%、100%或更多的浓度存在的这些生长因子和/或细胞因子(以任何组合)的一种或多种。
在一些实施方案中,生物基质支架包含生理水平或接近生理水平的已知在天然组织中和/或在组织中检测到的基质结合生长因子、激素和/或细胞因子中的许多或大多数,并且在其他实施方案中,生物基质支架包含一种或多种浓度与天然生物组织中发现的那些生理浓度相似或接近(例如,相比之下相差不超过约50%、40%、30%、25%、20%、25%、20%、15%、10%、5%、4%、3%、2%、1%、0.5%)的基质结合的生长因子、激素和/或细胞因子。存在于生物基质支架中的生长因子或细胞因子的量或浓度可通过本领域已知的和本文所描述的各种方法测定,例如但不限于各种抗体测定和生长因子测定的方法。
如本文所使用的,术语“功能性的”可用于修饰任何分子、生物或细胞材料,以使其达到特定的、指定的效果。
本文使用的术语“基因”意在广泛包括转录成rna分子的任何核酸序列,无论rna是编码的(例如mrna)还是非编码的(例如ncrna)。
如本文所使用的,当提及使本公开的微器官或工程化组织存在的方法步骤时,术语“生成”及其等效物(例如正在生产、已生成等)可与“产生”及其等效物互换使用。
本文使用的“用于肝脏的激素限定培养基(hormonallydefinedmediumforliver)”或“hdm-l”包括用于干细胞向成熟细胞分化的经典因子;这种培养基通常由补充有激素、生长因子和各种营养物质的混合物的基础培养基组成,并利用无血清进行特定细胞类型(例如实质细胞)的扩增或分化。在一些实施方案中,它可以通过向kubota培养基(用于干细胞)补充细胞的分化所需的附加激素和因子来制备。用于这种分化培养基的示例性生长因子公开于y.wang,h.l.yao,c.b.cuietal.hepatology.2010oct52(4):1443-54和美国专利号8,404,483(通过引用整体并入本文)。本公开的方面涉及在整个设计用于分化实质和非实质谱系和/或上皮和间充质谱系的干细胞和祖细胞以产生成熟肝组织的实验中指定为“bio-liv-hdm”的特定hdm-l。此外,bio-liv-hdm-l还补充了包括间充质细胞(星状细胞、周细胞、内皮细胞,前体和成熟形式)、神经元细胞(前体和成熟形式)以及造血细胞(前体和成熟形式)的各种非实质细胞类型所需的生长因子和激素。
如本文所使用的,术语“透明质酸(hyaluronanacid)”是指由通过β1-4、β1-3键连接的葡萄糖胺和糖醛酸(gluronicacid)的二糖单元及其盐组成的糖醛酸和氨基糖[1-3]的聚合物。因此,术语透明质酸是指天然和合成的透明质酸。
本文使用的“水凝胶”意指由聚合物链形成的三维网络,所述聚合物链在所述三维网络内保留水介质的显著部分而不溶于所述水介质中。
本文使用的术语“分离的”是指基本上不含其他材料的分子或生物制剂或细胞材料。
本文使用的“kubota培养基”是指设计用于内胚层干细胞并使它们能够以分裂的自我复制模式(aself-replicativemodeofdivision)克隆性地扩增的无血清、激素限定的培养基(例如,在透明质酸基质上或在含有透明质酸的缓冲液中)。kubota培养基可指任何包含无铜、低钙(<0.5mm)、胰岛素、转铁蛋白/fe、与纯化的白蛋白结合的纯化的游离脂肪酸的混合物、以及任选地高密度脂蛋白的基础培养基。kubota培养基或它的等效物不含血清且仅含有纯化和限定的激素、生长因子和营养物质的混合物。在某些实施方案中,培养基由包含无铜、低钙(<0.5mm)的无血清基础培养基(例如,rpmi1640或dme/f12)组成并补充有胰岛素(5μg/ml)、转铁蛋白/fe(5μg/ml)、高密度脂蛋白(10μg/ml)、硒(10-10m)、锌(10-12m)、烟酰胺(5μg/ml)和与纯化的白蛋白形式结合的纯化的游离脂肪酸的混合物。用于制备这种培养基的非限制性示例性方法已在别处公开,例如kubotah,reidlm,proceedingsofthenationalacademyofsciences(usa)2000;97:12132-12137,y.wang,h.l.yao,c.b.cuietal.hepatology.2010;52(4):1443-54,turneretal;journalofbiomedicalbiomaterials.2000;82(1):pp.156-168;y.wang,h.l.yao,c.b.cuietal.hepatology.2010oct52(4):1443-54,其公开内容通过引用并入本文。kubota培养基可通过提供特定因子和补充剂以允许在无血清的条件下进行特异性扩增来设计用于特定的细胞类型。例如,被修饰以用于与成肝细胞一起使用的kubota培养基被设计用于成肝细胞及其后代、定向祖细胞,并在无血清的条件下促进它们的扩增。所述扩增可与自我复制一起发生,但通常是与最小的(如有)自我复制一起发生。如果细胞位于iv型胶原和层粘连蛋白的基质上,则培养基尤其有效。
术语“核酸”、“多核苷酸”和“寡核苷酸”可互换使用并指任何长度的核苷酸(脱氧核糖核苷酸或核糖核苷酸或其类似物)的聚合形式。多核苷酸可具有任何三维结构并且可以表现出已知或未知的任何功能。以下是多核苷酸的非限制性实施例:基因或基因片段(例如探针、引物、est或sage标签)、外显子、内含子、信使rna(mrna)、转运rna、核糖体rna、rnai、核酶、cdna、重组多核苷酸、分支多核苷酸(branchedpolynucleotide)、质粒、载体、任何序列的分离dna、任何序列的分离rna、核酸探针和引物。
多核苷酸可包含修饰的核苷酸,例如甲基化核苷酸和核苷酸类似物。如果存在,则核苷酸结构的修饰可以在所述多核苷酸的组装之前或之后进行。核苷酸序列可被非核苷酸组分打断。多核苷酸可在聚合后进一步修饰,例如通过与标记组分结合。该术语还指双链和单链分子。除非另有说明或要求,否则该技术的任何方面即是多核苷酸包括双链形式和已知或预测构成双链形式的两种互补单链形式中的每一种。
如本文所使用的,术语“器官”是个体有机体的特定部分的结构,其中个体有机体的某个或多个功能是局部进行的并且在形态上是分离的。器官的非限制性实施例包括皮肤、血管、角膜、胸腺、肾、心脏、肝脏、脐带、肠、神经、肺、胎盘、胰腺、甲状腺和脑。器官可以用作组织来源,例如,胎儿、新生儿、小儿、儿童或成人器官可用于获得本公开的用途的目标细胞群。
术语“蛋白质”、“肽”和“多肽”可互换使用,并且在其最广泛的意义上是指氨基酸、氨基酸类似物或肽模拟物的两个或更多个子单元的化合物。子单元可以由肽键连接。在另一方面,子单元可以由其他键连接,例如酯,醚等。蛋白质或肽必须含有至少两个氨基酸,并且对可包含蛋白质或肽的序列的最大氨基酸数量没有限制。本文使用的术语“氨基酸”是指天然和/或非天然或合成的氨基酸,包括甘氨酸以及d和l光学异构体、氨基酸类似物和肽模拟物。
如本文所使用的,术语“对象/受试者”是指任何动物。在一些实施方案中,对象可以是哺乳动物;在进一步的实施方案中,对象可以是人、小鼠或大鼠。
术语“组织”在本文中用于指活体或死亡有机体的组织或来源于或设计来模拟活体或死亡有机体的任何组织。所述组织可以是健康的、患病的和/或具有基因突变。本文使用的术语“天然组织”或“生物组织”及其变体是指以其自然状态存在或以其来源于有机体时未经修饰的状态存在的生物组织。“微器官”是指模仿“天然组织”的一段“生物工程组织”。
生物组织可包括任何单个组织(例如,可相互连接的细胞集合)或构成有机体的器官或身体的部分或部位的一组组织。组织可以包括同类的(homogeneous)细胞物质,或者它可以是复合结构,例如在包括胸腔在内的身体部位中发现的复合结构,例如该胸腔可以包括肺组织、骨骼组织和/或肌肉组织。示例性组织包括但不限于来源于肝、肺、甲状腺、皮肤、胰腺、血管、膀胱、肾、脑、胆管树、十二指肠、腹主动脉、髂静脉、心脏和肠(包括其任何组合)的组织。
如本文所使用的,“治疗”对象中的疾病是指(1)防止症状或疾病发生在易患或尚未表现出疾病的症状的对象中;(2)抑制疾病或阻止其发展;或(3)改善或引起疾病或疾病的症状的消退。如本领域所理解的,“治疗”是用于获得有益或期望结果(包括临床结果)的方法。出于本技术的目的,有益或期望的结果可包括一种或多种,但不限于,一种或多种症状的缓解或改善、病症(包括疾病)的程度的减轻、病症(包括疾病)的稳定的(即不恶化)状态、病症(包括疾病)的延迟或减缓、病症(包括疾病)的进展、改善或缓解、状态和缓解(无论是部分还是全部),无论是可检测的还是不可检测的。
缩略词
本公开的部分使用首字母缩略词来指代某些术语。细胞群的首字母缩略词在本文中可以用小写字母表示,以指示物种:r=大鼠;m=小鼠;h=人。如果分子的首字母缩略词是以斜体印刷的,则它指的是该基因;如果是普通字体,那么它指的是由该基因编码的蛋白质。
以下是本文使用的缩略词的非限制性列表:acox,酰基辅酶a氧化酶;apol6,载脂蛋白l6;afp,甲胎蛋白,由成肝细胞表达的特征基因;asma,α-平滑肌肌动蛋白;alb,白蛋白;alt,丙氨酸转氨酶;ast,天冬氨酸氨基转移酶;cck18,裂解的半胱天冬酶k18,当它分泌时,是细胞坏死的标志;c/ebp,ccaat/增强子结合蛋白α;cd,共同的决定因素(commondeterminant);cd31,血小板内皮细胞抗原(或pecam),是内皮细胞的表面标志物;cd34,造血干/祖细胞抗原;cd45,在大多数造血细胞亚群中发现的常见白细胞抗原;cd133,prominin,在内皮细胞和实质细胞前体上发现的表面标志物;csf,集落刺激因子;cyp,催化许多与药物代谢和/或胆固醇、类固醇和脂质的合成相关的反应的细胞色素p450单氧酶;存在在实质细胞的早期谱系阶段中表达的形式(cyp3a7和可能是cyp1b1)和其他在实质细胞的晚期谱系阶段表达的形式(例如cyp1a1、cyp2c8、cyp3a4);ck,细胞角蛋白;ck7,与胆管细胞相关的细胞角蛋白;ck8和18,与所有上皮细胞相关的细胞角蛋白;egf,表皮生长因子;epcam,上皮细胞粘附分子;fbs,胎牛血清;fgf,成纤维细胞生长因子;bfgf,碱性成纤维细胞生长因子;gag,糖胺聚糖,碳水化合物链,是二聚体(糖醛酸和氨基糖)的聚合物,大多数具有特定的硫酸化作用模式,并且在信号转导过程中与蛋白质协同发挥多种作用;gata,具有与dna序列的锌结合dna结合域的转录因子,gata;gata-2,gata结合蛋白2,是造血基因表达的调节因子;hb,成肝细胞;hdl,高密度脂蛋白;hgh,人生长激素;hgf,肝细胞生长因子;hpsc,肝干细胞;hdm,激素限定的培养基;h&e,苏木精和曙红;hnf,肝细胞核因子;hnflα,在所有肝实质前体中表达的肝细胞核因子同源框(homeobox)a;hnflb,肝细胞核因子同源框b,发现涉及肝胰腺规范的发育(developmentallyinhepato-pancreaticspecification);hplc,高效液相色谱;igf,胰岛素样生长因子,与胰岛素具有同源性,根据与它们相关的特定gag可作为有丝分裂原或分化信号;igf-i,胰岛素样生长因子i,众所周知是成人肝细胞中的关键调节因子;igf-ii,胰岛素样生长因子ii,胎儿肝细胞中的主要调节因子;il,白细胞介素;il7-r,白细胞介素7的受体,在淋巴细胞的发育中起关键作用;jag1,jaggedl,也称为cd339,是命运决定中涉及的notch信号通路中的关键基因;k18,总细胞角蛋白18,如果被细胞释放则表明细胞死亡或坏死;km,kubota培养基;lgr5,富含亮氨酸重复序列的g蛋白偶联受体5,是在肠、肝和胰腺中重要的干细胞标记物;ldh,乳酸脱氢酶;ldlr,低密度脂蛋白(ldl)受体;lyve-1,淋巴内皮透明质酸细胞受体;mst1,巨噬细胞刺激1;mmp,基质金属蛋白酶(或肽酶);mmp2,基质金属蛋白酶-2,72kdaiv型胶原酶或明胶酶a(gela);mmp9,基质金属肽酶9,也称为92kdaiv型胶原酶或明胶酶b(gelb),是一种基质素,一类参与细胞外基质降解的锌-金属蛋白酶家族的酶;mrp2,多药耐药相关蛋白2;nmr,核磁共振;par,蛋白酶激活受体;pas,过碘酸希夫(periodicacid-schiff);pdgf,血小板衍生生长因子;rag1,重组激活基因1;sem,扫描电子显微镜;scf,干细胞因子;sctr,分泌素受体;slc4a2,溶质载体家族4(阴离子交换剂),成员2;tgf,转化生长因子;tem,透射电子显微镜;vegf,血管内皮细胞生长因子。
实施本公开的方式
本公开的方面涉及用于生成生物工程组织的组合物和方法以及配置用于其生成的容器。
具体实施方案涉及一种用于生成生物工程组织的方法,包括:(a)将接种培养基中的细胞悬浮液引入至生物基质支架之中或之上;以及(b)在初始培养期之后用分化培养基替换接种培养基。在一些实施方案中,该方法在专门设计用于实施这种方法的容器中进行。本公开的方面涉及所述容器。在一些实施方案中,该容器配置有专门设计用于模拟细胞的血管支持的流动路径。在进一步的实施方案中,这可以通过使用包含血管树的基质残余物的三维生物基质支架来实现。
在一些实施方案中,接种发生在接着一段休息时间的多个间隔中;这些间隔和休息时间可以在约1至约15分钟的持续时间内变化,例如,约1分钟、2分钟、3分钟、4分钟、5分钟、6分钟、7分钟、8分钟、9分钟、10分钟、11分钟、12分钟、13分钟、14分钟、和/或15分钟。引入的细胞数量及其浓度也可以不同。例如,在一些实施方案中,可以在给定间隔内引入每克湿重支架约1000至1200万个细胞。在一些实施方案中,对于给定数量的间隔(一个、两个、三个、四个或更多个间隔),引入速率可以是15ml/分钟,然后在所述给定数量的间隔后减少至例如1.3ml/min的速率。
在一些实施方案中,细胞和接种培养基可以在引入之前预培养,例如,在4°c下预培养4至6小时。
在一些实施方案中,生物基质支架可以源自特定的有机体,该有机体可以与祖细胞源自的有机体相同或不同。
在一些实施方案中,可以从生物组织通过以下方法来制备生物基质支架:用多种缓冲液和冲洗介质灌注生物组织样本,以使组织脱细胞以仅保留或主要保留细胞外基质组分,从组织产生基质的支架并且维持组织的组织学的内部结构。在替代的实施方案中,可以从商业来源获得完整的生物基质支架。
可以根据组织的期望特征来选择可用于产生生物工程组织的培养基,例如,可以在某些刺激祖细胞群分化和/或生长成特定器官或组织类型的细胞的因子的存在下选择培养物,例如y.wang,h.l.yao,c.b.cuietal.hepatology.2010oct52(4):1443-54中所描述的,通过引用整体并入本文。此外,在生成生物工程组织的生成过程的不同阶段,不同的培养基可能是相关的,例如,接种培养基或分化培养基。
在美国申请号12/213,100和美国专利号8,404,483中公开了关于使用因子和其他培养基组分以获得特定结果的进一步公开内容,其通过引用整体并入本文。在某些实施方案中,培养基是促进细胞分化的培养基。
在一些实施方案中,培养基还包含一种或多种细胞生长或分化因子,如上文所述的那些。
在一些实施方案中,接种培养基包含以下中的一种或多种:浓度在约0.3mm至0.5mm的钙、微量元素(例如硒和锌,但不是铜)、纯化的游离脂肪酸(例如棕榈酸、棕榈油酸、硬脂酸、油酸、亚油酸、亚麻酸)的混合物、一种或多种脂质结合蛋白(例如hdl)、胰岛素、以及转铁蛋白/fe。在一些实施方案中,接种培养基包含任选地用于灭活用于制备细胞悬浮液的酶的血清。这种血清的非限制性实施例是胎牛血清(fbs)。在添加血清的一些实施方案中,通常在约6小时至24小时内和/或尽快用无血清培养基(例如无血清hdm)替换。
在一些实施方案中,分化培养基包含以下中的一种或多种:浓度至少约为0.5mm的钙、微量元素、乙醇胺、谷胱甘肽、抗坏血酸、矿物质、氨基酸和丙酮酸钠、纯化的游离脂肪酸的混合物、一种或多种脂质结合蛋白(例如hdl)、一种或多种糖、一种或多种糖皮质激素、胰岛素、转铁蛋白/fe、一种或多种激素和/或生长因子,例如但不限于用于增殖和/或维持实质细胞的那些(催乳素、生长激素、胰高血糖素和甲状腺激素(例如三碘代苏氨酸或t3)、表皮生长因子(egf)、肝细胞生长因子(hgf)、成纤维细胞生长因子(fgf)、胰岛素样生长因子(igf)、骨形态发生蛋白、wnt配体和环磷酸腺苷)和/或用于增殖和/或维持非实质细胞的那些(血管生成素、血管内皮细胞生长因子(vegf)、神经生长因子、干细胞因子、白血病抑制因子(lif)、集落刺激因子(csf)、促血小板生成素、血小板衍生生长因子(pdgf)、红细胞生成素、胰岛素样生长因子(igf)、成纤维细胞生长因子(fgf)、以及表皮生长因子(egf))。
在一些实施方案中,细胞悬浮液可以源自特定的有机体,该有机体可以与生物基质支架源自的有机体相同或不同。干细胞或祖细胞可以从商业来源获得,包括但不限于直接商业零售商或储存库,例如americatypeculturecollection(atcc,http://www.atcc.org/)。替代地,本领域公开了从样本中产生和/或分离干细胞或祖细胞的方法。示例性方法包括通过引用整体并入本文的美国申请号12/926161中公开的方法。非限制性示例性细胞来源包括肝脏、胆管树、胆囊、肝-胰腺共同管、胰腺、十二指肠、骨髓和内皮(例如来自胆管树或胆囊的肝或胆管树干细胞、骨髓干细胞和内皮干细胞)。其他实施例包括来自任何来源的胚胎干(es)细胞或诱导多能干(ips)细胞。
在一些实施方案中,悬浮细胞群可以是同源细胞群(仅包含相同类型的细胞)、或异源细胞群(包含不同类型的细胞)。培养悬浮液的细胞群中细胞的数量和浓度可以根据悬浮细胞、培养基、培养物大小、所需的器官/组织特征和其他相关因素来确定。在一些实施方案中,祖细胞群中的细胞数量由干/祖细胞的生长速率和分化条件决定。在一些实施方案中,干/祖细胞群中的细胞数量由培养基中存在的生长因子和其他组分决定。
在一些实施方案中,细胞悬浮液包含实质细胞(例如btsc、hpsc、成肝细胞、胰腺干细胞、肝或胰腺定向祖细胞、肝细胞、胆管细胞、胰岛、腺泡细胞)和非实质细胞,其中非实质细胞包括间充质细胞亚群(例如成血管细胞、星状细胞或内皮细胞的前体,成熟星状细胞或成熟内皮细胞)、神经元前体和成熟的神经元细胞、以及造血细胞前体和成熟造血细胞(例如淋巴细胞、骨髓细胞、自然杀伤细胞、血小板、红细胞的前体或它们的成熟对应物)。在一些实施方案中,这些细胞的比例为约10%/90%、20%/80%、30%/70%、40%/60%、50%/50%、60%/40%、70%/30%、80%/20%和10%/90%。在一些实施方案中,细胞悬浮液可包含至少约50%的前体和/或干细胞。在一些实施方案中,细胞悬浮液不包含终末分化的肝细胞。
在一些实施方案中,培养物的基因或蛋白质表达可以在足以产生生物工程组织的时间内监测。在某些实施方案中,可以将在特定时间点的培养的祖细胞群的基因或蛋白质表达谱与选自以下的细胞群的基因或蛋白质表达谱进行比较:(i)在更早或更晚的时间点的培养的祖细胞群,(ii)祖细胞的对照样本群,(iii)来源于器官或组织的分化细胞群。同样地,可以将组织的组织学与期望的靶组织的早期或晚期发育阶段进行比较。
不受理论的束缚,设想在足以产生生物工程组织的时间内,培养的细胞的基因或蛋白质表达谱和/或组织学将转变为类似于源自器官或组织或其低分化前体的分化细胞群体的基因或蛋白质表达谱和/或组织学。
本公开的方面涉及包含支架源自的器官的血管树的基质残余物的三维生物基质支架。在一些实施方案中,所述支架还包含在支架源自的器官中发现的原生胶原。
本公开的另一方面涉及使用本公开的组合物和方法生产的生物工程组织和/或微器官。在一些实施方案中,所得组织显示原生肝脏的成熟谱系依赖性或分区依赖性表型性状,例如但不限于(a)门静脉周围区域,(b)具有实质细胞和间充质细胞的正弦板的区域。表型性状可以进一步包括与二倍体细胞相关的门静脉周围性状、在原生肝脏的中间腺泡区域中发现的成熟实质和间充质细胞的性状、中心周围区域的实质和间充质细胞的性状。生物工程组织和/或微器官可以进一步包括(i)与有孔的内皮细胞相关的多倍体肝细胞和/或(ii)与中央静脉的内皮相连的二倍体肝细胞和/或与星状细胞相关的胆管细胞。如果生物工程组织和/或微器官被设计用于胰腺,那么它可以进一步包括腺泡和胰岛细胞。
在一些实施方案中,生物工程组织和/或微器官的门静脉周围区域富含包含肝干细胞、成肝细胞和定向祖细胞的干/祖细胞龛的性状。在一些实施方案中,生物工程组织和/或微器官的实质细胞还包含年轻(二倍体)肝细胞和胆管细胞。在一些实施方案中,门静脉周围区域的生物工程组织和/或微器官的间充质细胞还包含星状细胞、周细胞、平滑肌细胞和内皮细胞的前体。在一些实施方案中,生物工程组织和/或微器官的中间腺泡区域富含包含成熟肝细胞和胆管细胞的成熟实质细胞的性状。在一些实施方案中,生物工程组织和/或微器官的实质细胞还包含肝细胞和胆管细胞。在一些实施方案中,门静脉周围区域的生物工程组织和/或微器官的间充质细胞还包含星状细胞、周细胞、平滑肌细胞、神经元细胞和内皮细胞。在一些实施方案中,生物工程组织和/或微器官的中心周围区域富含成熟实质细胞、肝细胞的性状,这些细胞表达晚期基因,如晚期p450(例如p450-3a),其中一些是多倍体以及一些正在经历细胞凋亡。在一些实施方案中,生物工程组织和/或微器官的中心周围区域的间充质细胞还包含有孔的内皮细胞。
在一些实施方案中,本公开的生物工程组织和/或三维微器官可适用于体内或离体使用。潜在用途的非限制性实施例包括用于研究组织成形、细胞迁移、克隆谱系、细胞命运潜力(cellfatepotential)、跨物种发育时间和细胞类型特异性基因组表达的研究用途;类器官作为模型用于针对特定器官的高通量药物筛选、细胞替代疗法或其他类型的器官特异性治疗的用途;以及移植。
本公开的方面还提供了包含用于生成生物工程组织或微器官的适当容器和/或培养基的试剂盒。在进一步的实施方案中,试剂盒可以进一步包含关于如何生成生物工程组织或微器官的说明书。
实施例
以下实施例是可用于实施本公开的各种情况的程序非限制性的和说明性的实施例。另外,本公开的所有参考文献都通过引用整体并入本文。
用于本公开的研究的试剂和用品获得自以下公司:abeam,cambridge,ma;acdlabs,toronto,ca;acrisantibodies,inc.,sandiego,ca;advancedbioscienceresourcesinc.(abr),rockville,md;agilenttechnologies,santaclara,ca;alpcodiagnostics,salem,nh;bdpharmingen,sanjose,ca;bectondickenson,franklinlakes,nj;bethyllaboratories,montgomery,tx;bioassaysystems,hayward,ca;cambridge;isotopelaboratories,tewksbury,ma;carlzeissmicroscopy,thornwood,ny;carolinaliquidchemistries,corp.,winston-salem,nc;charlesriverlaboratoriesinternational,inc.,wilmington,ma;chenomx,alberta,canada;cole-parmer,court;vernonhills,il;diapharma,westchestertownship,oh;fisherscientific,pittsburgh,pa;gatan,inc.,pleasanton,ca;illumina,sandiego,ca;ingenuity,redwoodcity,ca;lifetechnologiescorp.,grandisland,ny;lifespanbiosciences,inc.,seattle,wa;moleculardevices,sunnyvale,ca;olympusscientificsolutionsamericascorp.,waltham,ma;polysciences,inc.,warrington,pa;researchtrianglelabs(trl),researchtrianglepark,nc;r&dsystems,minneapolis,mn;raybiotech,norcross,ga;santacruzbiotechnology,inc.,dallas,tx;sigmaaldrich,st.louis,mo;tousimisresearchcorp.,rockville,md;qiagen,germantown,md;umetrics,umea,sweden。
实施例1-人肝细胞的来源和加工
人胎儿肝脏由妊娠的选择性终止获得,并由认可机构(anaccreditedagency)abr提供。实验中使用的组织来自17-19周之间的胎儿。该研究方案由北卡罗来纳大学教堂山分校(theuniversityofnorthcarolinaatchapelhill)的人类研究机构审查委员会(irb)审查和批准。人胎肝细胞悬浮液的制备方法在先前的出版物中有描述。简而言之,首先将肝脏机械地均化,然后酶促地分散到补充有0.1%牛血清白蛋白(bsa)、1nm硒、300u/mliv型胶原酶、0.3mg/ml脱氧核糖核酸酶和抗生素的rpmi-1640的细胞悬浮液中。在32°c下进行消化,伴以频繁搅拌30-60分钟。大多数组织需要两轮消化,然后在4°c下以1100rpm离心。将细胞团合并并重悬于细胞洗液(含有0.1%bsa、1nm硒和抗生素的rpmi-1640)中。将细胞悬浮液在4°c下以300rpm离心5分钟以除去红细胞。将细胞团再次重悬于细胞洗液中,并通过70μm尼龙细胞过滤器(bectondickenson)过滤。分离1×106个细胞的等分试样并进行rna处理,并用作使用qrt-pcr(t=0)的测定的对照。
成人组织(n=3)从triangleresearchlaboratories(trl)获得,作为快速冷冻组织,并通过rna测序用作mrna表达的对照。按照制造商的说明使用qiagenrneasyminikit(qiagen)处理细胞的rna。将来自3个供体的结果平均用于胎肝干/祖细胞(t=0)和生物反应器(t=14天)之间的比较。从trl获得的新鲜分离的成人肝细胞悬浮液,用于比较传统使用的肝细胞培养基与设计用于在生物反应器实验(bio-liv-hdm)中的肝分化的激素限定的无血清培养基(hde)。将三板6孔夹心培养物(每个人类供体一个板)在两种不同的培养基条件下培养7天。从每个供体制备每种条件下一式三份的培养物。
实施例2–生物基质支架的制备与分析
大鼠肝脏的脱细胞。wistar大鼠(体重250-300g)从查尔斯河实验室(charlesriverlaboratories)获得,并饲养在由unc实验动物管理部门(uncdivisionoflaboratoryanimalmanagement)管理的动物设施中。将它们随意喂食直至用于实验。所有实验工作均由unc机构动物使用和护理委员会指南(uncinstitutionalanimaluseandcarecommitteeguidelines)批准并执行。
用于使肝脏脱细胞以生成生物基质支架的方案已在此前描述了。wangy.,etal.(2011)hepatology53:293-305;gessner,r.c.etal.(2013)biomaterials34:9341-9351。用氯胺酮-甲苯噻嗪(ketamine-xylazine)麻醉雄性大鼠,并打开它们的腹腔。门静脉用20-gauge导管插管,从而为肝脏的脉管系统提供灌注入口,并且横切腔静脉和肝动脉,从而为灌注提供出口。将肝脏从腹腔取出并置于灌注生物反应器中。通过用300ml的无血清dmem/f12(gibco)冲洗肝脏来除去血液。然后用高盐缓冲液(nacl)灌注90分钟;肝脏中已知胶原类型的溶解度常数为3.4mnacl,足以使与胶原结合的任何基质组分和细胞因子/生长因子或胶原结合的基质组分全部处于不溶状态。用无血清dmem/f12冲洗肝脏15分钟以除去脱脂缓冲液,然后用100ml的dnase(1mg/100ml;fisher)和rnase(5mg/100ml;sigma)灌注以除去任何残留的核酸污染物。最后一步是用无血清dmem/f12冲洗支架1小时以除去任何残留的盐或核酸酶。图11提供了图像。通过masterflex蠕动泵(cole-parmer)以1.3ml/min灌注生物基质支架2小时,使用的kubota培养基补充有10%的胎牛血清(fbs),从而为细胞接种准备支架。在准备之后立即接种胎肝细胞。如果已充分处理细胞悬浮液来除去用于制备细胞悬浮液的酶,则可以去掉使用ssm准备支架的这一步骤。
胶原分析。基于羟脯氨酸(hyp)含量评估生物基质支架中胶原的量。将新鲜肝脏(n=5)和生物基质支架(n=6)的样本快速冷冻并粉碎成粉末。用高效液相色谱(hplc)定量每个总蛋白质的胶原含量,并且基于300个残基/胶原的羟脯氨酸值估计总胶原。用cytofluorspectramax250多孔板读取器(moleculardevices)单独进行测定。羟脯氨酸含量用于评估脱细胞后胶原保留的程度。这些分析使用hplc进行以比较来自新鲜组织的胶原与来自生物基质支架(脱细胞组织)的胶原的量。结果表示为羟脯氨酸(胶原蛋白特异性氨基酸)的质量。确定在大鼠肝脏脱细胞后存在~99%的所有胶原(图1p)。
生物基质的免疫组织化学。将生物基质支架包埋在oct中并快速冷冻用于冷冻切片。将冷冻切片在室温下解冻1小时,然后在10%缓冲甲醛中固定。固定后,将切片在1x磷酸盐缓冲盐水(pbs)中洗涤3次,然后在室温下用3%的h2o2封闭内源性过氧化物酶15分钟。用1xpbs洗涤后,再在室温下用2.5%的马血清在pbs中封闭切片1小时。加入在pbs中的2.5%马血清中稀释的一抗,并在4°c培养过夜。第二天早上,用pbs冲洗切片3次,并在室温下与二抗培养30分钟。使用novared底物(vector)作为显影剂,其根据制造商的说明制备。使用olympus1x70显微镜(olympus)拍摄图像。生物基质支架的苏木精和曙红染色显示脱细胞后没有剩余细胞(数据未示出)。脱细胞后进行生物基质支架的dna/rna含量的进一步分析,确定dna/rna水平可忽略不计。
组织学表明胶原i、iii、iv、v和vi的存在以及它们在腺泡上的传统位置(图1f-j)。在脱细胞过程中保持的高渗透压使胶原保持不溶,因此胶原存在于生物基质支架中。阿尔新(alcian)蓝染色也定性地表明蛋白聚糖(细胞外基质的主要成分)也存在(图lk,l);它们被称为生长因子和细胞因子的化学支架,并影响这些因子的可用性和活性。在脱细胞后,在适当的带状位置鉴定基底膜细胞粘附分子(弹性蛋白、纤连蛋白和层粘连蛋白)(图1m-o)。弹性蛋白和层粘连蛋白均在hhpsc和其他肝前体所在的门静脉周围区域发现。在整个基质中,跨所有区域鉴定纤连蛋白。
生长因子。分析大鼠肝脏(新鲜组织)和大鼠肝脏生物基质支架(脱细胞组织)的样本中基质结合的生长因子和细胞因子的存在和浓度。将样本在液氮中快速冷冻,在液氮温度下粉碎成粉末并送至raybiotech进行分析。使用raybiotech®人类生长因子阵列g1系列(humangrowthfactorarraysglseries,raybiotech)进行半定量生长因子测定,并以荧光强度单位(fr7s)报告结果。从非特异性结合和标准化至蛋白质浓度的阴性对照发现fiu水平降低。在新鲜的非脱细胞的大鼠肝脏组织(n=3)中测定40种生长因子,并与生物基质肝脏支架(n=3)中的生长因子进行比较。对重复的数据取平均值。虽然该测定法是为人类生长因子开发的,但是在与大鼠生长因子的交叉反应中存在足够的重叠,从而允许其用于大鼠组织。对新鲜组织和生物基质支架的三个样本的40个生长因子进行分析(图1a)。分析显示,体内组织中发现的所有生长因子均保留在生物基质支架提取物中;尽管它们中的大多数水平低于体内水平,但它们仍处于足以与生理学相关的水平。尤其重要的是与血管生成相关的生长因子的存在,例如多种形式的fgf、pdgf和vegf;以及那些对细胞增殖和分化很重要的生长因子,例如egf、肝素结合egf、hgf、igfi和ii及其结合蛋白、以及tgf。这些生长因子的可用性对于许多不同的生物学功能(有丝分裂以及组织特异性基因表达)都很重要。
扫描电子显微镜(sem)。脱细胞的肝脏生物基质的成像显示,存在原生肝脏的脉管系统结构的保留,包括完整的门脉三联体(图1b)。如图1b所示,胆管、肝动脉和门静脉都很明显。此外,通常容纳肝实质的蜂窝状结构保持完整但没有细胞(图1c)。诸如弹性蛋白、胶原i和iii的基质分子也可通过sem鉴定(图1d,e)。
实施例3–培养基
所有培养基都无菌过滤(0.22μm过滤器)并在使用前在4°c下保持在黑暗中。基础培养基和胎牛血清(fbs)购自gibco/invitrogen。所有生长因子均购自r&dsystems。除了那些说明的试剂外,所有其他试剂均来自sigma。用于培养基比较研究的传统肝细胞维持培养基(hmm)购自triangleresearchlaboratories(trl)并含有补充有hepes、glutamax、its+(胰岛素、转铁蛋白和硒)、地塞米松和青霉素-链霉素(penicillin-streptomycin)的william'se培养基。
接种培养基。kubota培养基是一种完全限定的、设计用于内皮干/祖细胞的克隆、自我复制扩增的无血清培养基。无血清用于胎肝细胞的单层培养或类器官培养。kubota培养基已被证明对鼠、啮齿动物和人肝干/祖细胞的培养物选择有效。该培养基由rpmi-1640组成,其含有无铜、低钙(0.3mm)、1nm硒、0.1%牛血清白蛋白(纯化的,游离脂肪酸;v部分)、4.5mm烟酰胺、0.1nm七水硫酸锌、5μg/ml转铁蛋白/fe、5μg/ml胰岛素、10μg/ml高密度脂蛋白和纯化的游离脂肪酸的混合物。它的制备在方法综述中详细介绍。wauthier,e.etal.hepaticstemcellsandhepatoblasts:identification,isolationandexvivomaintenancemethodsforcellbiology(methodsforstemcells)86,137-225(2008)。当用于建立生物工程肝脏时,kubota培养基暂时补充有10%的fbs以克服用于制备肝细胞悬浮液的酶,然后转换为适用于实质和非实质细胞的最佳分化并称为bio-liv-hdm的无血清、激素限定的培养基。
分化培养基以生成人肝组织(bio-liv-hdm)。细胞在接种培养基中、在含有kubota培养基的hdm中培养最初36小时后,在生物反应器中培养14天,该kubota培养基补充有地塞米松(0.04mg/l)、催乳素(10iu/l)、胰高血糖素(1mg/l)、烟酰胺(10mm)、三碘化甲状腺原氨酸(t3,67ng/l)、表皮生长因子(egf,20ng/ml)、高密度脂蛋白(hdl,10mg/l)、肝细胞生长因子(hgf,20ng/ml)、人生长激素(hgh,3.33ng/ml)、血管内皮生长因子(veg-f,20ng/ml)、胰岛素样生长因子(igf,20ng/ml)、环磷酸腺苷(2.45mg/l)、碱性成纤维细胞生长因子(bfgf,20ng/ml)、半乳糖(0.16克)、血管生成素(0.2mg/ml)、游离脂肪酸混合物、l-谷氨酰胺和抗生素。该hdm在接种后3天开始,然后每2天更换一次。所有试剂均从r&dsystems获得。在添加2mm氨后,bio-liv-hdm证明在白蛋白产生和尿素分泌方面比传统肝细胞维持培养基(hmm)更成功(图12)。但是,白蛋白的结果并没有显著的差异,因为一个人供体样本与其他2个供体相比表达极高水平的白蛋白,导致高标准的偏差。在未来将通过成人肝脏供体的其他制备来澄清统计学的显着性,从而最小化此处报道的标准偏差。所有三个供体在尿素分泌方面表现相当。bio-liv-hdm中的样本在第1、4、6和7天显着更高(p<0.05)。
实施例4–生物工程肝组织的生成
将人肝干/祖细胞分离并在4°c下和在kubota培养基中储存4小时直至接种。这些细胞通过蠕动泵经过门静脉的基质残余物灌注引入,并接种在补充有10%fbs的kubota培养基(接种培养基)中。大约90×106个总细胞以20分钟的间隔灌注到支架中。在每个间隔期间,30×106个细胞以15ml/min灌注10分钟,然后休息10分钟(0ml/min)。以上重复3次。将所有细胞引入基质支架后,将流速降至1.3ml/min,并用接种培养基灌注支架36小时。接种后,收集接种培养基,用血细胞计数器计数培养基中剩余的任何细胞。然后将培养基更换为分化培养基(bio-liv-hdm),其后每2天更换一次。将重新接种的基质支架在生物反应器中培养长达14天。14天后,将重新接种的基质支架的叶片冷冻用于组织学和免疫组织化学,固定用于扫描电子显微镜(sem)和透射电子显微镜(tem),或快速冷冻用于rna测序(t=14天)。这些生物反应器的分析以bio_fl724、bio_fl728或bio_fl732表示,代表用这些细胞接种的生物反应器。接种36小时后,~99%的细胞附着在基质上,这通过血细胞计数器收集并计数的接种培养基中缺乏的细胞证明(数据未列出)。用苏木精和曙红(h&e)染色后,在血管周围和整个薄壁组织中发现大量细胞(数据未示出)。在培养14天后进行的sem成像显示衬在脉管系统上的内皮细胞(图3i和图7b)。
组织学。(图3)显示通过免疫细胞化学和免疫荧光鉴定的蛋白质的位置和表达。成熟标志物的表达表明在培养14天后胎肝细胞的分化和重组。在门静脉周围区域1中,细胞表达epcam和ck19,生物标志物在肝干细胞和成肝细胞中共表达,并发现在胆管周围。该区还含有表达afp的细胞,afp是成肝细胞的生物标志物。在该图中显示了已经开始发育的肝细胞索(hepaticcord),以及e-钙粘蛋白的表达,e-钙粘蛋白是肝细胞极性的标志物,位于肝细胞形成细胞-细胞连接的位点。在肝细胞的腔侧鉴定出胆汁转运标志物mrp2,有助于鉴定细胞极性。似乎这些细胞围绕在胆管周围,表明潜在的胆功能,例如胆汁的分泌。通过过碘酸希夫(pas)染色鉴定的糖原储存在实质内的细胞中也是明显的。糖原可在整个腺泡的肝细胞中发现,但是在门静脉周围区域中的糖原含有最高水平的糖原储存。沿着带状梯度,在薄壁组织中发现细胞,其表达代表周围中心区域(区域3)的标志物,例如cyp3a4和白蛋白(发现在所有区域中)。一般而言,大多数细胞获得与通常在门静脉周围区域发现的细胞和在中间腺泡和中心周围区域发现的成熟细胞一致的分化状态。
除了肝实质细胞谱系的细胞之外,发现通过它们的结蛋白表达鉴定的星状细胞,以及窦状内皮细胞、lyve-1+细胞定位于支架中对应于体内那些位置的位置。星状细胞通常与其上皮伴侣共定位,这是参与有丝分裂和特化细胞功能的旁分泌信号传导所必需的。在组织学图中这些细胞的形状很细,因为细胞在包裹细胞的过程中被挤压(显示阳性对照图片以供参考)。在血管结构周围发现表达α-平滑肌肌动蛋白(αsma)的细胞。αsma阳性细胞可能是周细胞,可以被激活与在血管内壁发现的内皮细胞、cd31+细胞一起增殖。它们通过免疫组织化学和sem均可观察到(图3i)。ki67染色可见增殖明显(数据未示出),并且主要在位于血管周围的细胞中发现。较大的细胞对ki67没有染色阳性,因此被认为处于非增殖性、完全成熟的状态。
测序。我们对来自三种不同生物反应器的样本进行了配对末端高通量rna测序,每个样本平均获得~2亿个配对末端读数,其中平均-87%独特地映射到人类基因组。通过分析rna测序数据已经鉴定了许多功能方面和分化阶段。首先,很明显生物反应器内的细胞正在重塑基质,可通过mmp-2和mmp-9(基质降解酶,图4a)的表达增加以及胶原蛋白、层粘连蛋白、纤连蛋白和基底膜蛋白(图4b-e)的表达增加来识别。这些基因的mrna表达水平在生物反应器中均显著高于胎儿和成人肝脏样本中的mrna表达水平(p<0.05),但基底膜蛋白除外,其生物反应器仅显着高于成人肝细胞,并且层粘连蛋白10和11,其中样本之间没有显着差异。还有迹象表明,生物反应器中胎儿肝脏来源的干/祖细胞已经分化来代表所有成熟的实质细胞谱系阶段,通过胎儿基因的表达降低和更成熟基因的上调显而易见(图5和6)。与胎儿细胞相比,胎儿基因(例如lgr5和epcam,肝干细胞的已知标志物)在生物反应器样本中的表达水平显着较低,分别具有3.4和1.2倍的变化(图5)。同样地,与生物反应器样本和成人肝脏组织相比,最知名的鉴定成肝细胞afp的基因在胎儿组织中高出11倍以上;生物反应器和成人肝脏组织中的水平之间没有显着差异。
相反,与胎儿组织相比,生物反应器样本中成熟肝脏标记物的基因表达水平在不到一周内稳定上升,表明肝实质细胞谱系的成熟发育。在区域1中,与胎儿和成人肝脏样本相比,成熟胆道标志物ck7、slc4a2、jag1、hnf1b和sctr(图6)均上调。与胎肝细胞相比,最显着增加的是ck7、jag1和sctr,分别大于98、1.75和1.85倍。在生物反应器样本中上调的代谢功能区3标志物的表达水平包括成熟形式的p450基因(cyp1a1、cyp-1b1和cyp-2c8);所有基因相对于胎儿细胞至少增加>3倍;udp-葡萄糖醛酸转移酶utg1a1,与胎儿细胞相比增加了~10倍;以及基因参与脂质和胆固醇代谢(acox3、apol6、ldlr),尽管仅在ldlr显着升高。与胎儿肝脏样本相比,生物反应器组织中cyp3a7(胎儿形式的p450)的表达降低超过4倍,这进一步表明了这种成熟(数据未示出)。成熟肝细胞的另一标记物c/ebp在生物反应器中也增加,尽管不显着,并且与胎儿肝脏相比,hnf4a表达没有观察到变化。
在生物反应器中测量的基因表达水平,虽然主要是表明在胎儿肝脏之外的成熟水平,但在大多数情况下仍然不同于成人组织中的表达水平。这表明培养中的额外时间或修饰的培养条件(例如血清的使用进一步减少、氧化作用的更大调节)是进一步成熟所必需的。考虑到这一点,yap、相关靶向基因和hippo的基因表达水平都表明再生过程是活跃的。与胎儿和成人肝脏相比,生物反应器中mst1(一种hippo激酶)的基因表达水平显着降低;平行地,与胎儿和成人肝脏相比,生物反应器中的yap信号传导基因均显着增加(图7a)。血管生成标志物的基因表达表明,生物反应器组织正在经历血管生成和血管发生(图7b)。与胎肝细胞相比,生物反应器样本中vegf、vegf-b和cd133的表达水平均增加,显示出vegf和cd133的特别显着差异(p<0.05)。
基于rna测序数据,存在造血分化的建议(图7c)。早期造血干细胞的标记物(gata-2、scf和il-7r)在生物反应器样本中下调,从胎儿组织中发现的水平转变为与成人肝脏中相匹配的水平。同时,淋巴和骨髓谱系中成熟造血细胞的遗传谱也在胎儿肝脏、生物反应器和成人肝脏之间不同。生物反应器样本的cd3基因表达水平与成人肝脏中的基因表达水平相似;ragl表达上升(两种基因(rag1和cd3)均与t细胞相关),并且csf表达(由骨髓细胞表达)与胎儿和成人肝脏相比显着更高。这些标记物指示可能的造血功能,但需要更广泛的分析以允许准确的解释。
细胞活力。在第2、4、6、8、10、12和14天评估用于评估肝细胞健康的氨基转移酶alt和ast。在该实验过程中的任何时间都没有alt水平超过检测下限(数据未示出)。因此,确定它不是该离体模型系统的敏感生物标志物。bio_fl724是唯一在培养的整个时间内具有可测量的ast水平超过检测下限(4u/l)的生物反应器(数据未示出)。每个生物反应器的ldh水平(图8a)最初较高但随时间降低。但是,在培养的第一天之后,在每个时间点的ldh测量值显着低于初始测量值(p<0.05)。该数据的解释是,在最初几天,由于来自分离步骤和/或接种过程的压力,存在具有更大周转的细胞。在这个恢复期后,细胞产生表型性状,表明快速的肝脏器官形成。
培养基中的全长k18(fl-k18)水平(因此,从细胞分泌或释放)对于坏死是特异性的;所有生物反应器中的值均高于基线(25.3u/l)。在所有三个生物反应器中fl-k18水平的趋势相似。第2天的水平显着高(图8a),并且假定是由于分离步骤造成的细胞应激或损伤。在第2天后,水平显着降低,第4天和第6天显着低于第2天的初始读数(p<0.05)。fl-k18的初始下降提示培养中坏死细胞较少,可能是对完全细胞死亡的反应,特别是在bio_fl728和bio_fl732的情况下,其余细胞表明有更健康的细胞可供选择。但是,在8-12天期间fl-k18有所增加,然后水平再次下降。
检测到的cck18水平(图8a)遵循与fl-k18水平类似的趋势,其中水平在第6天左右开始上升,在第8天左右达到峰值然后降低。尽管该数据可能表明高凋亡条件,但在培养的整个时间内水平没有显着差异,表明细胞凋亡随时间没有显着增加。
总体而言,描述细胞活力和健康的数据表明,当分离和接种过程中受损的细胞被清除时,细胞经历2-3天的短暂时间,然后稳定剩余细胞,然后分化。
fl-k18和cck18的增加也对应于所有三个生物反应器中细胞分泌白蛋白的增加。假设这种增加是由于终末分化的多倍体肝细胞作为正常细胞周期过程的一部分经历凋亡所致。在凋亡的这个峰值之后,cck18水平立即下降,这表明前体细胞正在经历成熟以替换丢失的中心周围的肝细胞。
(图8b)。每个生物反应器在第2天(样本收集的第一天)显示出不同的afp起始水平,对应于胎肝细胞在t=0时基因表达的差异。无论afp的初始值如何,随着时间的推移,产量急剧下降。
白蛋白(图8b)。所有三个生物反应器中的白蛋白产量水平初始较低,但随着时间的推移稳定上升,在第6-10天之间有显着更高的水平(p<0.05)。各个生物反应器产生的白蛋白的实际量不同,但生产增加的总趋势在所有生物反应器中是一致的。该水平在第8天达到峰值并在第10天降低。假设上升和下降对应于细胞分化为晚期谱系阶段,由白蛋白的高产量指示的细胞。它们随后经历细胞凋亡,这导致白蛋白产生减少,因为前体细胞继续再生过程。这些数据的解释也得到了在各自时间点上测量的cck18水平的支持。
尿素(图8b)。不同于afp和白蛋白的生产,尿素水平在14天的过程中没有显着变化。所有三个生物反应器在第2天具有最大量的尿素分泌并且此后稍微减少。到第10天,尿素水平显着低于第2天的初始值(p<0.05),尽管总体而言似乎分泌物随时间保持稳定。
细胞代谢组学。细胞的功能通过代谢活性进行评估,并通过核磁共振(mr)光谱法测量(图9)。进行主成分分析(pca,图9b),表明与第三种生物反应器bio_fl732相比,两种生物反应器bio_fl724和bio_fl732在培养中的响应更相似。在所有生物反应器中,细胞消耗并代谢在培养基中提供的葡萄糖、谷氨酰胺、丙酮酸和乙酸,并将它们转化为乳酸的产生(图9a)。这些行动最终显示细胞正在进行糖酵解并进入克雷布循环(krebcycle)。bio_fl724在第2天立即活跃,并且bio_fl728在第6天具有相似的趋势。第三个生物反应器bio_fl732在第8天开始代谢活跃,尽管其水平远低于其他两个生物反应器。这表明存在滞后时间,其中两个生物反应器bio_fl728和bio_fl732需要从接种过程中可能的应激中恢复,或者细胞在分离后不像bio_fl724那样健康并且需要更多时间来代谢活跃。vip图(图9c)显示了有助于分离的代谢物。vip>=1.0被认为是重要的。
透射电子显微镜(tem)。通过tem进一步评估各自生物反应器中细胞的组织。为了起作用,上皮细胞必须形成细胞-细胞连接,这些连接有助于细胞极性、与邻近细胞的细胞信号传导以及与基质的相互作用。连接复合物的组分(图10e,f)通过tem成像显示,肝细胞聚集在一起形成在它们之间具有胆小管的片或板(图10a-c),这是用于运输分泌的胆汁的基本排列。在这些肝细胞样细胞之间观察到正弦空间(图10a),并且在胆小管空间周围看到可能的分泌囊泡(图10b)。除了肝细胞外,还有几种具有物理特征的细胞提示分化过程中的内皮细胞、星状细胞(ito)细胞和干细胞,通过tem鉴定(数据未示出)。在整个生物基质支架中细胞的接种不均匀,导致tem图像中指示的器官形成过程中发现具有不同细胞阶段的位点。在与细胞无关的图像中可见脂肪滴(数据未示出),这可能表示在制备用于成像的样本期间的细胞破裂,或者可能在培养中的细胞的老化过程中发生细胞破裂,类似于在坏死和凋亡数据中表现的。
实施例5–支架中胶原的表征
冲洗组织以使血液和间质液的量最小化。大多数纤维胶原不能用人们使用的典型初始冲洗液提取:磷酸盐缓冲盐水(pbs)。但是,不交联的胶原和相关的基质组分,包括前胶原、胶原单体(形成原纤维之前)和非原纤维胶原类型(例如iv型,vi型),可以用pbs提取。因此,初始冲洗是用基础培养基(氨基酸、营养素、脂质、维生素、微量元素等的混合物)进行的,并且离子强度不会导致胶原进入溶液。
其他人使用的脱脂步骤和组织进行脱脂的长时间(有时是几小时甚至几天)。sds非常紧密地与基质结合并使其具有毒性。triton-x和其他此类强力洗涤剂可溶解各种基质组分。一个步骤使用sds,然后使用triton-x,这个步骤可以产生“非常干净”的支架,但事实上,它们看起来“干净”是因为已经丢失了很多。因此,低浓度的胆汁盐、脱氧胆酸钠和与磷脂酶的组合引起快速且非常温和的脱脂。脱脂在20-30分钟内进行。
使用低离子强度缓冲液(1mnacl以下的缓冲液)进行提取致使不交联的胶原的显着损失;那些在1mnacl下的保留一些胶原(主要是i型胶原)但不是全部(不是网络胶原)。因此,本方法不会丢失任何胶原(纤维状或网状;交联的或不交联的),并且因此保留与它们结合的所有物质。相反,使用蒸馏水的方法可能失去除溶解在水中的高度交联的胶原以及与其结合的组分之外的所有组分。
根据本领域的方法标准除去核酸。
通过分离生物基质支架获得的区别的特征在于收集上清液、透析它们、冻干它们,并通过氨基酸、交联、western印迹和生长因子分析测量它们中的胶原含量。这将确定通过此方法保留的胶原。平行提取采用以下来进行:a)pbs;b)低离子强度缓冲液;c)在各种脱脂方法之后;d)蒸馏水。收集来自这些步骤中的每一个的上清液并进行氨基酸分析,以评估胶原是否损失以及损失的程度。当确定胶原量很大时,用[3h]-nabh4处理上清液中的胶原,水解并对其进行交联分析。此外,进行抗体的western印迹分析,以确定交联的程度和存在的胶原的类型。进一步地,将进行生长因子分析以表征所得支架。
示例性实施方案
以下提供了非限制性示例性实施方案:
[1]一种用于生成生物工程组织的容器,其中所述生成包括将上皮细胞和间充质细胞引入至生物基质支架之中或之上,其中所述生物基质支架包含胶原。
[2]根据[1]所述的容器,其中所述上皮细胞和间充质细胞是成熟的(maturational)谱系伴侣。
[3]根据[1]或[2]所述的容器,其中所述上皮细胞和间充质细胞处于接种培养基中,并且在初始培养期后用分化培养基替换所述接种培养基。
[4]根据[3]所述的容器,其中所述分化培养基包含:
a.基础培养基,
b.脂质、胰岛素、转铁蛋白、抗氧化剂,
c.铜,
d.钙,
e.用于增殖或维持上皮细胞的一种或多种信号,和/或
f.用于增殖或维持间充质细胞的一种或多种信号。
[5]根据[3]或[4]所述的容器,其中所述接种培养基不含血清或补充有约2%至10%的胎儿血清,任选地在数小时的持续时间内。
[6]根据[3]至[5]所述的容器,其中所述接种培养基包含:
a.基础培养基,
b.脂质,
c.胰岛素,
d.转铁蛋白,
e.抗氧化剂。
[7]根据[3]至[6]中任一项所述的容器,其中所述接种培养基中的所述上皮细胞和间充质细胞在引入所述生物基质支架之前在所述接种培养基中于4℃培养4-6小时。
[8]根据[1]至[7]中任一项所述的容器,其中所述生物基质支架是三维的。
[9]根据[1]至[8]中任一项所述的容器,其中所述生物基质支架中的胶原包括(i)新生胶原、(ii)聚集但不交联的胶原分子、(iii)交联的胶原。
[10]根据[1]至[9]中任一项所述的容器,其中所述接种培养基中的所述上皮细胞和间充质细胞以多个间隔引入,每个间隔接着一段休息时间。
[11]根据[10]所述的容器,其中所述间隔约为10分钟以及所述休息时间约为10分钟。
[12]根据[10]或[11]所述的容器,其中接种密度高达每克湿重的生物基质支架约1200万个细胞并在一个或多个间隔期间引入。
[13]根据[10]至[12]中任一项所述的容器,其中所述接种培养基中的上皮细胞和间充质细胞或非实质细胞以~15ml/min的速率、一个或多个间隔引入。
[14]根据[10]至[13]中任一项所述的容器,其中所述接种培养基中的上皮细胞和间充质细胞以10分钟的间隔引入,每个间隔接着10分钟的休息时间。
[15]根据[10]至[14]中任一项所述的容器,其中所述接种培养基中的上皮细胞和间充质细胞在三个间隔之后以1.3ml/min的速率引入。
[16]根据[1]至[15]中任一项所述的容器,其中所述上皮细胞和间充质细胞包括从胎儿或新生儿器官分离的细胞。
[17]根据[1]至[15]中任一项所述的容器,其中所述上皮细胞和间充质细胞包括从成人或儿童供体分离的细胞。
[18]根据[1]至[17]中任一项所述的容器,其中所述上皮细胞和间充质细胞包括:
a.上皮细胞,其包括干细胞、定向祖细胞、二倍体成体细胞、多倍体成体细胞、和/或终末分化细胞中的一种或多种
和/或
b.间充质细胞,其包括成血管细胞、内皮细胞前体、成熟内皮细胞、星状细胞前体、成熟星状细胞、基质前体、成熟基质、平滑肌细胞、造血细胞前体、和/或成熟造血细胞中的一种或多种。
[19]根据[1]至[18]中任一项所述的容器,其中所述上皮细胞和间充质细胞包括:
a.上皮细胞,其包括胆管树干细胞、胆囊来源的干细胞、肝干细胞、成肝细胞、定向肝细胞和胆管祖细胞、axin2+祖细胞(如axin2+肝祖细胞)、成熟实质细胞(例如肝细胞、胆管细胞)、胰腺干细胞、以及胰腺定向祖细胞、胰岛细胞、和/或腺泡细胞中的一种或多种,和/或
b.间充质细胞,其包括成血管细胞、星状细胞前体、星状细胞、间充质干细胞、周细胞、平滑肌细胞、基质细胞、内皮细胞前体、内皮细胞、造血细胞前体、和/或造血细胞中的一种或多种。
[20]根据[1]至[19]中任一项所述的容器,其中所述上皮细胞包括干细胞及其来自胆管树、肝、胰腺、肝胰共同管、和/或胆囊的后代的一种或多种,和/或间充质细胞包括成血管细胞、内皮细胞和星状细胞的前体、间充质干细胞、星状细胞、基质、平滑肌细胞、内皮细胞、骨髓来源的干细胞、造血细胞前体、和/或造血细胞中的一种或多种。
[21]根据[1]至[20]中任一项所述的容器,其中所述上皮细胞和间充质细胞分别由约80%的上皮细胞和20%的间充质细胞组成。
[22]根据[1]至[21]中任一项所述的容器,其中所述上皮细胞和间充质细胞包含至少50%的干细胞和/或前体细胞。
[23]根据[1]至[22]中任一项所述的容器,其中所述上皮细胞和间充质细胞不包含任何终末分化的肝细胞和/或胰腺细胞。
[24]根据[1]至[23]中任一项所述的容器,其中所述生物基质支架包含一种或多种胶原相关的基质组分,该胶原相关的基质组分包含与基质组分相关的层粘连蛋白、巢蛋白、弹性蛋白、蛋白聚糖、透明质酸、非硫酸化糖胺聚糖、硫酸化糖胺聚糖、生长因子和/或细胞因子中的一种或多种。
[25]根据[1]至[24]中任一项所述的容器,其中所述生物基质支架包含大于20-50%的体内发现的基质结合的信号分子。
[26]根据[1]至[25]中任一项所述的容器,其中所述生物基质支架包含组织的血管树的基质残余物,和/或其中所述基质残余物在所述生物工程组织中提供细胞的血管支持。
[27]一种包含细胞外基质的三维支架,其依次包含(i)在器官中发现的原生胶原和/或(ii)在器官中发现的血管树的基质残余物。
[28]一种在[1]至[26]中任一项所述的容器中生成的三维微器官。
[29]一种生物工程组织,其包含原生肝脏的分区依赖性表型性状特征,所述表型性状包括(a)具有干/祖细胞、二倍体成体细胞和/或相关的间充质前体细胞的性状的门静脉周围区域,(b)具有具有成熟实质细胞和间充质细胞的正弦板性状的细胞的中间腺泡区域,和/或(c)具有终末分化上皮细胞和与有孔内皮细胞相关的凋亡细胞和/或连接至中央静脉的内皮细胞的axin2+肝祖细胞的性状的中心周围区域。
[30]根据[29]所述的生物工程组织,其中所述表型性状还包括与门静脉周围区域的二倍体上皮细胞和/或间充质细胞相关的性状。
[31]根据[29]或[30]所述的生物工程组织,其中所述表型性状还包括在原生肝脏的中间腺泡区域中发现的成熟上皮细胞和/或间充质细胞的性状。
[32]根据[29]至[31]中任一项所述的生物工程组织,其中所述表型性状还包括中心周围区域的上皮细胞或实质细胞和/或间充质细胞的性状。
[33]根据[29]至[32]中任一项所述的生物工程组织,还包括:(i)与有孔内皮细胞相关的多倍体肝细胞,和/或(ii)连接至中央静脉的内皮的二倍体肝祖细胞(例如axin2+细胞)。
[34]根据[29]至[33]中任一项所述的生物工程组织,其中所述门静脉周围区域富含包含肝干细胞、成肝细胞、定向祖细胞、和/或二倍体成体肝细胞的干/祖细胞龛的性状。
[35]根据[29]至[34]中任一项所述的生物工程组织,其中所述上皮细胞和间充质细胞还包括包含肝细胞和/或胆管细胞的前体和/或成熟形式的上皮细胞。
[36]根据[29]至[35]中任一项所述的生物工程组织,其中所述上皮细胞和间充质细胞还包括包含星状细胞、周细胞、平滑肌细胞、基质、内皮细胞和/或造血细胞的前体和/或成熟形式的间充质细胞。
[37]一种包括[29]至[36]中任一项所述的生物工程组织的三维微器官。
[38]在[1]至[26]中任一项所述的容器中生成的[37]所述的三维微器官。
[39]一种用于在[1]至[26]中任一项所述的容器中培养微器官的试剂盒,其带有附带的说明书。
[40]一种评估用于器官的治疗的方法,包括将治疗施用至[29]至[38]中任一项所述的生物工程组织或三维微器官。
[41]一种用于上皮细胞和间充质细胞的分化培养基,包含:
a.含有脂质、胰岛素、转铁蛋白、抗氧化剂的基础培养基,
b.铜,
c.钙,
d.用于增殖和/或维持上皮细胞的一种或多种信号,和/或
e.用于增殖和/或维持间充质细胞的一种或多种信号。
[42]根据[41]所述的分化培养基,其中所述基础培养基是kubota培养基。
[43]根据[41]或[42]所述的分化培养基,还包含一种或多种脂质结合蛋白。
[44]根据[43]所述的分化培养基,其中所述一种或多种脂质结合蛋白是高密度脂蛋白(hdl)。
[45]根据[41]至[44]中任一项所述的分化培养基,还包含一种或多种纯化的脂肪酸。
[46]根据[45]所述的分化培养基,其中所述一种或多种纯化的脂肪酸包括棕榈酸、棕榈油酸、硬脂酸、油酸、亚油酸、和/或亚麻酸。
[47]根据[41]至[46]中任一项所述的分化培养基,还包含一种或多种糖。
[48]根据[47]所述的分化培养基,其中所述一种或多种糖包括半乳糖、葡萄糖、和/或果糖。
[49]根据[41]至[48]中任一项所述的分化培养基,还包含一种或多种糖皮质激素。
[50]根据[49]所述的分化培养基,其中所述一种或多种糖皮质激素包括地塞米松和/或氢化可的松。
[51]一种生物工程组织,其包含原生胰腺的分区依赖性表型性状特征和/或包含与胰腺头部中的胰腺细胞相关的分区和/或与胰腺尾部中的胰腺细胞相关的分区。
- 还没有人留言评论。精彩留言会获得点赞!