细胞培养装置以及细胞培养方法与流程
本发明涉及一种用于对细胞进行3d培养的装置和方法,例如,能够对类器官分析和/或细胞培养物进行可控的且可靠的血管化和/或灌注的多孔板。同样,本发明提供用于产生3d培养的细胞的方法和用于使培养的细胞的血管化/对培养的细胞进行灌注的方法,以及由该装置和方法产生的分析板及其用途。
背景技术:
近年来,在类器官培养领域,用于药物检测和疾病模拟的预测性表型模型取得了长足发展。类器官是三维的器官芽,通常包括同样存在于人体内的大多数特化细胞。在实际使用中,在体外环境中模拟胚胎再生发育过程中的组织培养和分化使得干细胞分化为各种不同的分化的细胞。
这种类器官的一个众所周知的例子是小肠类器官(shoichidateandtoshirosato,mini-gutorganoids:reconstitutionofthestemcellniche,annu.rev.celldev.biol.,2015,vol.31:269-289)。生长因子和信号分子(例如,wnt通路激动剂(例如wnt3a、r-spondin、chir99021)、bmp/tgf通路抑制剂(例如noggin)、egf)的混合物以及基底膜提取物(基质胶或类似物)的环境确保了原代肠隐窝的培养、肠干细胞龛的维持以及细胞向例如杯状细胞、肠上皮细胞和肠内分泌细胞分化的潜能。这样就产生了具有二代肠形态特点的三维结构,包括隐窝和绒毛结构。已建立了类似的三维培养物用于原代人食管、胃、结肠、肝脏和胰腺的培养。
近来,在由诱导多能性干细胞生长脑类器官这一方面已取得进展。悬浮球体在连续振动条件下的长期培养产生了具有诸如前脑和后脑特征之类的特定部分的所谓的迷你脑[cerebralorganoidsmodelhumanbraindevelopmentandmicrocephaly,m.a.lancaster,etal.nature2013,501,373–379]。最近,如下的肾小球培养方式已取得了突破性进展,该肾小球培养方式使用复杂的培养方案,在细胞迁移系统(transwellsystem)上从诱导多能性干细胞开始,这种肾小球的培养方式同样产生了存在于人肾小球中的高度特化的细胞[kidneyorganoidsfromhumanipscellscontainmultiplelineagesandmodelhumannephrogenesis,m.takasatoetal.,nature2015,526,564–568]。
类器官培养或更一般而言,3d细胞培养可以以多种方式进行。3d球体可以在所谓的悬挂式滴板(参见例如wo2010/031194)或低粘附微量滴定板中形成。尽管据称这些球体显著提高了对标准细胞培养的预测性,但是它并不适用于大多数类器官培养。原因在于类器官通常需要细胞外基质成分,例如不存在于悬挂式滴板或低粘附板的球体中的基质胶(matrigel)或胶原蛋白。同时,还开发了3d细胞培养模型,在该3d细胞培养模型中细胞生长嵌入至细胞外基质中的。这种方法增强了分化的功能的表达并改善了组织结构(pampalonietal.(2007).natrevmolcellbiol8:839-84)。
典型的类器官生长平台包括标准培养皿、微量滴定板,在某些情况下还包括来自corning的
微流体细胞培养是一项日益重要的技术,其在药物筛选、组织培养、毒性筛选和生物学研究中得到应用。
本领域已知许多微流体系统、装置、方法和制造工艺,包括专利申请文献例如wo2008/079320、wo2013/151616、wo2010/086179、wo2012/120101中公开的微流体系统、装置、方法和制造工艺,或者从例如mimetas(莱顿,荷兰,(例如,organoplate;www.mimetas.com))商业上可获得的微流体系统、装置、方法和制造工艺。虽然这些申请和文献不应当显示出对本文的任何权利要求的具体限制,但是这些文献提供了有用的背景材料。
在anoveldynamicneonatalblood-brainbarrieronachip.s.deosarkar,b.prabhakarpandian,b.wang,j.b.sheffield,b.krynska,m.kiani.plosone,2015中,开发了一种产生血管的微流体装置,该微流体装置采用筛状结构将内皮细胞从星形胶质细胞中分离出来,尝试产生血脑屏障型结构。在wo2007/008609a2中,使用类似的筛状结构来形成细胞聚集体,以建立出更好地模拟例如肝脏生理学的组织形态。
上述微流体细胞培养的例子均无法实现在ecm中培养出具有可灌注的明显血管的类器官。
由于缺少支持类器官和胚胎体生长的技术手段,类器官和胚胎体生长的发展受到阻碍。培养技术非常繁琐并且各个器官之间的差异巨大。首先,本领域需要一种标准装置,其最好能够与多孔滴定板的现行标准相兼容。其次,因为密集的细胞团需要富氧、富营养的培养基以防止核心坏死,因此,灌注流体或搅拌对于使这种类器官生长超过一定尺寸而言显得至关重要。第三,细胞外基质(ecm)对于准确分化而言可能是关键因素,但培养方案并不完全与ecm凝胶培养相兼容。最重要的是,迄今为止,胚胎体和类器官的生长由于缺少血管系统而受到很大的限制。这限制了类器官的最大尺寸。
因此,本领域还需要一种能够对ecm支持的类器官或胚胎体进行灌注培养的系统,该系统优选地能够使类器官血管化并且使血管系统能够灌注。该平台还应与当日读数和处理设备相兼容。
本发明的目的在于解决上述需求中的一部分或全部需求。
技术实现要素:
根据本发明的第一方面,本文提供一种包括微流体网络的细胞培养装置,该微流体网络包括:
微流体层,其包括基底、微流体通道和盖子;
类器官隔间,其通过所述盖子上的孔延伸进入所述微流体层并与所述微流体通道流体连通;以及
毛细管压力屏障,其基本与所述盖子上的孔对齐并将所述微流体网络分成包括所述类器官隔间的第一子体积和包括所述微流体通道的至少一部分的第二子体积。
根据本发明的第二方面,本文提供一种用于培养细胞或细胞聚集体的方法,包括:
a)将凝胶液滴或凝胶前体的液滴引入至第一方面的装置的类器官隔间中,所述凝胶液滴或凝胶前体的液滴任选地包括一种或多种类型的细胞或细胞聚集体;
b)使所述凝胶液滴或凝胶前体的液滴被所述毛细管压力屏障限制;
c)使所述凝胶液滴或凝胶前体的液滴固化或凝胶化;
d)使所述微流体通道加载有流体;以及
e)任选地培养固化凝胶中存在的一种或多种类型的细胞或细胞聚集体。
根据本发明的第三方面,本文提供一种分析板,包括带有由所述毛细管压力屏障限制至所述类器官隔间的凝胶的第一方面的装置,其中所述凝胶包括一个或多个细胞或细胞聚集体。
根据本发明的第四方面,本文提供一种试剂盒,包括:
本发明的第三方面的分析板;以及
一种或多种用于诱导血管生成的促血管生成化合物。
根据本发明的第五方面,本文提供一种血管化细胞聚集体的方法,包括:
将凝胶液滴或凝胶前体的液滴引入至微流体细胞培养装置中并使所述凝胶液滴或凝胶前体的液滴被所述装置中存在的毛细管压力屏障限制;
使所述凝胶或凝胶前体固化或凝胶化以形成固化凝胶;
将载液中的内皮细胞悬浮液引入至所述微流体细胞培养装置的微流体通道中,所述微流体通道与所述固化凝胶流体连通;
使所述内皮细胞至少在所述微流体通道中形成至少一个微血管;
在所述固化凝胶的上表面上引入一个或多个细胞或细胞聚集体;以及
允许或促进所述至少一个微血管和所述一个或多个细胞或细胞聚集体之间的定向血管生成。
根据本发明的第六方面,本文提供一种微流体细胞培养装置,其包括可灌注的血管网络,该血管网络包括:
具有入口和出口的微流体通道;
细胞外基质凝胶,其设置成容纳待在其上表面被血管化的至少一个细胞;
其中,所述微流体通道与所述细胞外基质凝胶流体连通并且所述微流体通道包括衬于所述微流体通道的内表面的内皮细胞的血管网络。
根据本发明的第七方面,本文提供一种微流体细胞培养装置,包括:
具有入口和出口的微流体通道;
细胞外基质,其具有设置在其上表面上的生物组织;
其中,所述微流体通道包括衬于所述微流体通道的内表面的且延伸穿过所述细胞外基质至所述生物组织的内皮细胞的血管网络。
根据本发明的第八方面,本文提供一种试剂盒,包括:
本发明的第六方面或第七方面的微流体细胞培养装置;以及
一种或多种用于诱导血管生成的促血管生成化合物。
本发明的各个其他方面涉及第一方面、第三方面、第四方面、第六方面至第八方面的应用。
定义
在整个说明书和权利要求书中使用涉及本发明的装置、方法、用途和其他各个方面的各种不同的术语。除非另有说明,这些术语具有本发明所属技术领域中的通用含义。其他具体定义的术语应以与本文提供的定义一致的方式解释。虽然在实施本发明时可使用与本文描述的那些方法和材料相似或等同的任何方法和材料,但本文描述优选的材料和方法。
在本文中,除非另有明确说明,“不定冠词(a,an)”和“定冠词(the)”的单数形式还包括复数指示物。因此,例如,提及“细胞”包括两个/种细胞或更多个/种细胞等的组合。
当涉及诸如量,持续时间等可测量值时,本文中使用的术语“约和大约”意在包括特定值的±20%或±10%的变化,更优选地包括特定值的±5%的变化,甚至更优选地包括特定值的±1%的变化,仍更优选地包括特定值的±0.1%的变化,这类变化对于实施本文公开的方法而言是合适的。
本文使用的“包括”被解释为包含性的且开放的,并且不是排除性的。具体而言,该术语和其变形意在包括具体特征、步骤或组分。这些术语不应被解释为排除其他特征、步骤或组分的存在。
本文使用的“示例性”是指“作为实施例、例子或举例说明”,并且不应被解释为排除本文公开的其他配置。
本文使用的术语“微流体通道”是指由顶部基板或盖子覆盖的材料层上的通道或穿过该材料层的通道,其长度、宽度或高度中的至少一个维度在亚毫米范围内。可以理解的是,该术语包括线性通道以及分支的通道或在其路径中具有弯曲或拐角的通道。微流体通道通常包括用于施加一定量的液体的入口。微流体通道中所封闭的体积通常在微升或亚微升范围内。微流体通道通常包括基底(其可为下层材料的上表面)、两侧壁和天花板(其可为覆盖微流体通道的上部基板的下表面),根据需要,该微流体通道具有任何入口、出口和/或通风口配置。
本文使用的“液滴保留结构”和“毛细管压力屏障”可以互换使用,并且该术语的使用涉及装置的如下特征:通过毛细管作用力将液体-空气的弯液面固定在某个位置。
本文使用的“封闭的几何结构”,特别是涉及毛细管压力屏障时使用的“封闭的几何结构”是指如下几何结构,其中,毛细管压力屏障不是具有两端的线性毛细管压力屏障,而是形成闭合回路的毛细管压力屏障。例如,从俯视角度看时,具有封闭的几何结构的毛细管压力屏障可包括圆形毛细管压力屏障或多边形毛细管压力屏障,例如三角形毛细管压力屏障或正方形毛细管压力屏障或五角形毛细管压力屏障等。
本文使用的术语“同心”应理解为是指毛细管压力屏障的任何封闭的几何结构,而不仅仅是指圆形结构。
本文使用的“线性”毛细管压力屏障不应被解释为直线,而应被解释为非封闭的几何结构,即具有两端的线,但其可包括一个或多个弯曲或角度。线性毛细管压力屏障通常在其每一端与微流体通道的侧壁相交。
本文使用的术语“内皮细胞”是指内皮起源的细胞,或分化至如下状态的细胞,在所述状态中,所述细胞表达识别作为内皮细胞的细胞的标志物。
本文使用的术语“上皮细胞”是指上皮起源的细胞,或分化至如下状态的细胞,在所述状态中,所述细胞表达识别作为上皮细胞的细胞的标志物。
本文使用的术语“液滴”是指可能超过或没有超过微流体通道的高度的一定量的液体,其不一定表现为圆形、球形。具体而言,凝胶液滴是指在类器官隔间中的一定量的凝胶。
本文使用的术语“生物组织”是指待在本文所述的方法中培养和/或分析的相同、相似或不同类型的功能上相互关联的细胞的集合。细胞可以是细胞聚集体,或者是来自患者的特定组织样品。例如,术语“生物组织”包括类器官、组织活检、肿瘤组织、切除的组织材料和胚胎体。
本文使用的术语“细胞聚集体”是指相对于通常单层生长的表面附着细胞而言的3d细胞簇。3d细胞簇通常与更加类似于体内的情况相关。相比之下,表面附着细胞可能受到基板性质的极大影响,并且可能发生去分化或向其他细胞类型转变。
本文使用的术语“类器官”是指组织的微型形式,其在体外形成并表现出内源性三维器官结构。
本文使用的术语“移植(transplant或transplantation)”是指将组织(例如组织移植体)或细胞聚集体从一个位置转移到另一个位置,例如从存储容器转移到细胞培养装置。
附图说明
下面将参考附图仅以示例的方式描述本发明,其中:
图1至图3显示了在根据本发明的装置中使用的微流体网络的第一可能结构的垂直剖面图(图1)、水平俯视图(图2)和闭合垂直剖面图(图3);
图4至图6显示了在根据本发明的装置中使用的微流体网络的第二可能结构的垂直剖面图(图4)、水平俯视图(图5)和闭合垂直剖面图(图6);
图7至图9显示了在根据本发明的装置中使用的微流体网络的第三可能结构的垂直剖面图(图7)、水平俯视图(图8)和闭合垂直剖面图(图9);
图10至图12显示了在根据本发明的装置中使用的微流体网络的第四可能结构的垂直剖面图(图10)、水平俯视图(图11)和闭合垂直剖面图(图12);
图13至图15显示了在根据本发明的装置中使用的微流体网络的第五可能结构的垂直剖面图(图13)、水平俯视图(图14)和闭合垂直剖面图(图15);
图16至图18显示了根据本发明的装置中的微流体网络中可使用的毛细管压力屏障的不同形式;
图19和图20显示了根据本发明的装置的仰视图(图19)和垂直剖面图(图20),该装置由本文所述的微流体网络的多孔结构组成;
图21显示了装置的示意图,举例说明了固定在毛细管压力屏障上的液滴的曲面上的液-气表面张力的示例性方向和测量;
图22显示了本发明的培养方法中的步骤的示意图;
图23显示了诱导或允许发生血管生成以及诱导或允许内皮细胞侵入受限液滴中的类器官组合物的示意图;
图24显示了如下方法的示意图,该方法通过调平装置的上游储液器和下游储液器之间的培养基以诱导流体穿过血管化的类器官组合物;
图25显示了通过细胞培养装置的类器官隔间向下观察的高分辨率图像,显示了在通过毛细管压力屏障限制在类器官隔间中的细胞外基质凝胶内的类器官生长;
图26显示了通过细胞培养装置的类器官隔间向下观察的高分辨率图像,显示了限制在图8的装置的类器官隔间中的细胞外基质凝胶内的血管生成;
图27a至图27e显示了本发明的培养方法中的步骤的示意图;
图28a至图28d显示了图27a至图27e中所示的方法的替代方法;
图29显示了在类器官移植到血管床当天放置在血管床上的肾脏类器官的高分辨率图像;
图30显示了在类器官移植到血管床7天后的肾脏类器官的高分辨率图像;
图31显示了在小鼠胚胎肾脏移植体移植到血管床7天后的小鼠胚胎肾脏移植体的高分辨率图像;
图32显示了由肝细胞和rfp标记的huvec组成的肝球体在移植到血管床后第7天的高分辨率图像;
图33显示了图32中所示的同一系统的高分辨率图像,显示了内皮的红色荧光;
图34显示了在根据本发明的装置中使用的微流体网络的可能替代结构的水平顶部;以及
图35显示了在根据本发明的装置中使用的微流体网络的其他两种可能的结构。
具体实施方式
需要强调的是,具体参考附图所示的细节仅作为举例说明,其目的在于解释说明本发明的不同实施方式。为了提供对本发明的原理和概念方面最有用的描述和最易于理解的描述而呈现参考附图所示的细节。就这点而言,不需要尝试比基本理解本发明所需更详细地显示本发明的结构细节。
细胞培养装置
本文描述了一种细胞培养装置。该细胞培养装置优选为多阵列形式/多孔形式,从而能够用于体外细胞分析、药物筛选分析、毒性分析等,具体而言,其是高通量筛选形式。这种多孔培养平板通过在矩形矩阵中布置6-样品孔、12-样品孔、24-样品孔、48-样品孔、96-样品孔、384-样品孔和1536-样品孔而获得,其中,在本发明中,本文所述的微流体网络的多阵列结构存在于细胞培养装置中。在一个实施例中,细胞培养装置与ansi/slas微量滴定板标准格式的一个或多个维度兼容。
因此,细胞培养装置优选具有多个本文所述的微流体网络。在一个实施例中,所述多个微流体网络通过微流体层(如本文中所述)彼此流体连通。在另一个实施例中,所述多个微流体网络彼此不流体连通,换言之,每个微流体网络独立于细胞培养装置上存在的任何其他微流体网络运行。
在一个实施例中,细胞培养装置包括微流体网络,该微流体网络包括:
微流体层,其包括基底、微流体通道和盖子;
类器官隔间,其通过所述盖子上的孔延伸进入所述微流体层并与所述微流体通道流体连通;以及
毛细管压力屏障,其基本与所述盖子上的孔对齐,并将所述微流体网络分成包括所述类器官隔间的第一子体积和包括所述微流体通道的至少一部分的第二子体积。
在一个实施例中,所述细胞培养装置是微流体细胞培养装置,该微流体细胞培养装置包括可灌注的微流体网络或血管网络,所述血管网络包括:
具有入口和出口的微流体通道;
细胞外基质凝胶,其设置成容纳待在其上表面被血管化的至少一个细胞;
其中,所述微流体通道与所述细胞外基质凝胶流体连通,所述微流体通道包括衬于所述微流体通道的内表面的内皮细胞的血管网络。
在一个实施例中,所述细胞外基质凝胶设置成容纳细胞悬浮液或一个或多个细胞聚集体的悬浮液。
在一个实施例中,细胞培养装置是微流体细胞培养装置,包括:
具有入口和出口的微流体通道;
细胞外基质凝胶,其具有设置在其上表面上的生物组织;
其中,所述微流体通道包括衬于所述微流体通道的内表面的且穿过所述细胞外基质延伸至所述生物组织的内皮细胞的血管网络。
在一个实施例中,所述微流体通道与所述细胞外基质流体连通。
通常,细胞培养装置是至少包括微流体通道的微流体细胞培养装置。在本发明的范围内,不同配置的微流体通道或网络是可能的,但可包括例如用于容纳和限制凝胶(例如,细胞外基质)的微流体通道内的体积或子体积或与该微流体通道流体连通的体积或子体积。
细胞培养装置的一个实施例中的微流体网络或每个微流体网络通常包括微流体层、类器官隔间和毛细管压力屏障,下文对其每一个进行详细描述。
微流体层
微流体网络的微流体层包括基底、微流体通道和盖子(本文中也称为覆盖层)并且可以以多种方式制造。
典型的制造方法是将诸如聚二甲基硅氧烷之类的可模塑的材料浇注至模具上,从而将微流体通道压印到硅橡胶材料中。随后,将嵌有通道的橡胶材料放置在玻璃基底层或相同材料的基底层上,从而形成密封。可选地,可在诸如玻璃或硅之类的材料中蚀刻通道结构,然后粘接至顶部或底部基板(本文中也称为基底层和覆盖层)。粘接之后进行的塑料的注塑成型或压花加工是制造微流体通道网络的另一种方式。用于制造微流体通道网络的又一技术是通过光刻蚀方式在光可图案化(photopatternable)的聚合物(例如,su-8或其他干膜或液体电阻)中形成微流体通道网络,然后进行粘接步骤。所提到的粘接是指通过顶部或底部基板封闭通道。粘接技术包括阳极粘接、溶剂粘接、粘合剂粘接和热粘接等。
所述基底,在本文中也称为基底层或底部基板,优选地由刚性材料(例如玻璃)形成,用于为微流体网络的其余部分提供支撑表面。在一个实施例中,基底的尺寸与标准ansi/slas微量滴定板的孔区域的尺寸相同或相似。
根据上述各种制造方法推断,微流体层可包括子层,该子层包括设置在基底层上的微流体通道,或者所述微流体通道在覆盖层或基底层中图案化形成。在使用方向上,微流体子层设置在基底层的上表面上。微流体通道可以形成为穿过设置在基底层上的子材料层的通道。在一个实施例中,子层的材料是位于基底层上的聚合物,并在所述聚合物中形成微流体通道。在一些实施例中,微流体层包括两个或多个微流体通道,所述微流体通道可以通过类器官隔间彼此流体连通。
所述微流体层包括覆盖所述微流体通道的盖子或覆盖层。所述盖子或覆盖层可以由本领域已知的任何合适的材料形成,例如粘接至包括所述微流体通道的子层的玻璃层。在一个实施例中,在覆盖层的限定点上设置有预先形成的洞或孔。这些孔允许微流体层的微流体通道和设置在其上的微流体网络的其他部件之间流体连通。
微流体通道可根据细胞培养装置的微流体网络的任何特定用途的需要设置有一个或多个入口和一个或多个出口或通风口。为了允许流体通过微流体网络进行填充、排空和灌注,微流体通道优选地具有至少一个入口和至少一个出口或通风口。在一个实施例中,所述至少一个入口和至少一个出口或通风口中的每一个优选地形成为或以便于与所述覆盖层中的预先形成的孔流体连通。
类器官隔间
在一种实施方式中,细胞培养装置的微流体网络包括类器官隔间,该类器官隔间通过盖子中的孔延伸进入微流体层并与微流体通道流体连通。类器官隔间至少部分地存在于与微流体层分开的层中。在使用方向上,类器官隔间可至少部分地存在于设置在微流体层的盖子上的单独的层中,例如,下文所述的包括无底孔的用户界面层。
类器官隔间包括一定体积的微流体网络,并且部分地限定为能够容纳流体液滴的空腔或孔。在一个实施例中,类器官隔间在其顶端具有入口或开口(参照使用方向),通过该入口或开口,类器官隔间能够容纳流体。
在一个实施例中,类器官隔间包括在一些微量滴定板上发现的无底孔,该孔具有侧壁,在使用方向上,侧壁向下延伸至盖子的孔。因此,在一个实施例中,类器官隔间包括具有向下延伸的侧壁的孔,以使类器官隔间通过盖子的孔延伸进入微流体层中。
在一个实施例中,类器官隔间的孔可以是覆盖层中孔的延伸,或者可以是覆盖层的顶部上的专用孔结构。在典型的实施方式中,类器官隔间的孔作为具有例如方形、矩形或圆形横截面的微量滴定板中的一个孔存在。在一个实施例中,类器官隔间的孔的内部横截面尺寸基本与覆盖层的孔的横截面尺寸相对应。在一个实施例中,类器官隔间的孔的向下延伸的孔壁与覆盖层的孔相对齐。在一个实施例中,覆盖层的孔比类器官隔间的孔的内部尺寸窄。在一个实施例中,覆盖层的孔大于类器官隔间的孔的内部尺寸。在一个实施例中,如本文所述,类器官隔间部分由类器官隔间的孔的向下延伸并在覆盖层的孔中结束的壁来限定并且部分由与覆盖层的孔对齐的毛细管压力屏障来限定。
类器官隔间优选具有一定的最小体积,以容纳和保留大于1微升、优选大于5微升和更优选大于10微升的液滴。在进一步的实施方式中,例如,为了能够进一步保留额外的生长培养基、试剂、化合物或化学引诱剂,由类器官隔间包围的体积大于待引入的液体组合物的体积。在一个实施例中,类器官隔间包围的体积超过10微升,优选超过50微升,甚至更优选超过100微升。
在一个实施例中,类器官隔间的下部存在于微流体层中,与微流体通道流体连通。类器官隔间的下部可至少部分地通过毛细管压力屏障的存在来限定。如本文所述,毛细管压力屏障可设置在微流体通道的内表面上。在一个实施例中,类器官隔间通过微流体通道内表面上的毛细管压力屏障与微流体通道相交。在一个实施例中,类器官隔间的一部分由具有向下延伸的侧壁的孔来限定并且一部分由一定体积的微流体网络的来限定,该一定体积的微流体网络部分由毛细管压力屏障来限定,下文将对毛细管压力屏障进行描述。
毛细管压力屏障
细胞培养装置的微流体网络包括毛细管压力屏障,该毛细管压力屏障基本上与覆盖层中的孔对齐并将微流体网络分成包括类器官隔间的第一子体积和包括微流体通道的至少一部分的第二子体积。
毛细管压力屏障的功能和模式先前已进行了描述,例如在wo2014/038943a1中进行了描述。从下文所述的示例性实施例中可以明显看出,毛细管压力屏障(本文中也称为液滴保持结构)不应被理解为壁或例如可以填充有包括一个或多个细胞或细胞聚集体的液滴的腔室,而应被理解为由下述结构组成或包括下述结构,该结构确保这种液滴由于表面张力而不会扩散。这个概念被称为弯液面阻塞(meniscuspinning)。因此,可以实现将包括一个或多个细胞或细胞聚集体的液滴稳定地限制在细胞培养装置的类器官隔间中。在一个实施例中,毛细管压力屏障可称为限制性相位引导件(confiningphaseguide),其配置为在细胞培养装置的正常使用期间防止其中的液滴溢出。下文将结合对本发明的方法的描述来描述液滴限制的性质。
在一个实施例中,毛细管压力屏障包括从微流体通道的内表面突出的材料的边缘或脊或微流体通道的内表面中的槽;或由从微流体通道的内表面突出的材料的边缘或脊或微流体通道的内表面中的槽组成。所述边缘或脊的侧壁与所述边缘或脊的顶部之间可呈角度α,该角度α最好尽可能大。为了提供良好的屏障,角度α应大于70°,通常在90°左右。同样的角度α存在于其上具有毛细管压力屏障的微流体通道的内表面和脊侧壁之间。类似的要求也应用于形成为槽的毛细管压力屏障。
毛细管压力屏障的可选形式是对微流体通道内表面具有不同湿润性的材料区域,其由于毛细作用力/表面张力而起到阻止扩散的作用。因此,液体被限制流动超过毛细管压力屏障,并能够在类器官隔间中形成稳定的受限体积。在一个实施例中,微流体通道的内表面包括亲水性材料,而毛细管压力屏障是疏水性材料或较低亲水性材料的区域。在一个实施例中,微流体通道的内表面包含疏水材料,而毛细管压力屏障是亲水性材料或较低疏水性材料的区域。
因此,在本发明的具体实施方式中,毛细管压力屏障选自材料的边缘或脊、槽、孔洞或疏水线或其组合。在另一实施方式中,毛细管压力屏障可由选定间隔的柱子形成,毛细管压力屏障的布置方式界定了被凝胶占据的第一子体积或区域。在一个实施例中,柱子沿着微流体通道的整个高度延伸。
毛细管压力屏障基本上与覆盖层中的孔对齐,从而限制液滴在微流体网络内的扩散。在一个实施例中,毛细管压力屏障位于覆盖层的底面上,基本上与覆盖层中的孔相邻。在一个实施例中,毛细管压力屏障至少部分地由覆盖层中的孔本身形成。
在一个实施例中,毛细管压力屏障设置在微流体通道的内表面上,面向盖子中的孔。在更具体的实施方式中,毛细管压力屏障存在于微流体层的基底或微流体通道的内表面上,其基本与覆盖层中的孔相对或面向覆盖层中的孔。在一个实施例中,在使用方向上,毛细管压力屏障位于类器官隔间的孔的下方或孔壁的下方。在一个实施例中,如之前所定义的,毛细管压力屏障相对于覆盖层中的孔或类器官隔间的孔存在,以将液滴限制在微流体层的与覆盖层的孔和/或类器官隔间的孔对齐的区域。
在一个实施例中,毛细管压力屏障至少部分地限定了微流体层的基底上或微流体通道的基底上的类器官隔间的表面。毛细管压力屏障被配置成将流体限制在包括类器官隔间的第一子体积内。在一个实施例中,毛细管压力屏障包括封闭的几何结构。在一个实施例中,毛细管压力屏障与覆盖层的孔同心。
在一个实施例中,由毛细管压力屏障周长限定的直径或面积大于由覆盖层的孔的周长限定的直径或面积;换言之,毛细管压力屏障围绕覆盖层中的孔并且大于覆盖层中的孔。在另一个实施例中,由覆盖层中的孔的周长限定的直径或面积大于由毛细管压力屏障的周长限定的直径或面积;换言之,覆盖层中的孔围绕毛细管压力屏障并且大于毛细管压力屏障。不管形状如何,在优选的实施方式中,毛细管压力屏障划定包括被引入类器官隔间的孔中的一个或多个细胞或细胞聚集体的液体液滴或凝胶组合物液滴与类器官隔间的基底的接触区域,即,毛细管压力屏障围绕包括一个或多个细胞或细胞聚集体的液滴与类器官隔间的基底的接触区域。
在一个实施例中,毛细压力屏障是基本线性的毛细管压力屏障,其跨越微流体通道的整个宽度,并在每一端与微流体通道的侧壁相交。
作为微流体网络的一部分,毛细管压力屏障将网络分为至少两个子体积,所述子体积中的一个包括培养类器官体的类器官隔间,而另一个子体积包括将类器官隔间连接至微流体网络的其余部分的微流体通道。
第二毛细管压力屏障
在一些实施例中,细胞培养装置的微流体网络具有第二毛细管压力屏障,其形式和功能基本上如上文所述。为避免混淆,当装置中存在第二毛细管压力屏障时所提及的“毛细管压力屏障”应理解为提及“第一毛细管压力屏障”。
在一些实施例中,第二毛细管压力屏障基本上与覆盖层中的孔对齐,以限制流体液滴在微流体网络中的扩散。在一个实施例中,第二毛细管压力屏障位于覆盖层的底面上并基本上邻近覆盖层中的孔。在一个实施例中,第二毛细管压力屏障至少部分地由覆盖层中的孔本身形成。
在一个实施例中,第二毛细管压力屏障设置在微流体通道的内表面上,面向盖子中的孔。在一个更具体的实施方式中,第二毛细管压力屏障存在于微流体层的基底上或微流体通道的内表面上,基本上与覆盖层中的孔相对或相向。在一个实施例中,第二毛细管压力屏障位于类器官隔间的孔的下面或类器官隔间的孔的孔壁的下面。在一个实施例中,第二毛细管压力屏障如先前所定义的那样相对于覆盖层中的孔或类器官隔间的孔存在,以将流体液滴限制在微流体层的与覆盖层中的孔和/或类器官隔间的孔对齐的区域。
在一个实施例中,第二毛细管压力屏障与第一毛细管压力屏障一起至少部分地限定位于微流体层的基底上的或位于微流体通道的基底上的类器官隔间的表面。第二毛细管压力屏障与第一毛细管压力屏障一起配置为将流体限制至包括类器官隔间的第一子体积。在一个实施例中,第二毛细管压力屏障包括封闭的几何结构。在一个实施例中,第二毛细管压力屏障与覆盖层的孔同心和/或与第一毛细管压力屏障同心。在一个实施例中,由第二毛细管压力屏障的周长限定的直径或面积大于由覆盖层的孔的周长和/或第一毛细管压力屏障的周长限定的直径或面积;换言之,第二毛细管压力屏障围绕并大于第一毛细管压力屏障和/或覆盖层的孔。在一个实施例中,第二毛细管压力屏障与第一毛细管压力屏障同心并且在第一毛细管压力屏障的圆周内。在另一个实施例中,由覆盖层的孔的周长限定的直径或面积大于由第二毛细寡压力屏障的周长限定的直径或面积;换言之,覆盖层的孔围绕并大于第二毛细管压力屏障。不管形状如何,在优选的实施方式中,第二毛细管压力屏障划定了包括被引入至类器官隔间中的一个或多个细胞或细胞聚集体的液体液滴或凝胶组合物液滴与类器官隔间的基底的接触区域,即,第二毛细管压力屏障围绕包括一个或多个细胞或细胞聚集体的液滴与类器官隔间的基底的接触区域。
在一个实施例中,第二毛细管压力屏障是基本上线性的毛细管压力屏障,其横跨微流体通道的整个宽度,并在每一端与微流体通道的侧壁相交。在本实施例中,第一毛细管压力屏障和第二毛细管压力屏障可界定与覆盖层的孔对齐的横截面积区域,该横截面积区域也可与覆盖层的孔同心。在本实施例中,第一毛细管压力屏障可被视为将所述微流体网络分为包括类器官隔间的第一子体积和包括微流体通道的第二子体积,第二毛细管压力屏障将所述微流体网络分为包括类器官隔间的第一子体积和包括第二微流体通道的第三子体积。
作为微流体网络的一部分,第二毛细管压力屏障将该网络划分为至少两个子体积和第三子体积,第一个子体积是先前提及的第一子体积,其包括培养类器官体的类器官隔间。在一个实施例中,第三子体积包括与第一子体积分开的微流体通道的一部分,即不包含在第一子体积中。在一个实施例中,第三子体积完全包含在第一子体积内,即第一毛细管压力屏障和第二毛细管压力屏障均为封闭的几何结构,并且第二毛细管压力屏障完全被第一毛细管压力屏障包围。
储液器
在一些实施例中,微流体网络包括与微流体通道的入口流体连通的储液器。储液器的形状或结构可与类器官隔间的孔基本相同,其是为了保留一定体积的液体,例如培养基。在一种典型的实施方式中,储液器能够保留的流体体积大于微流体通道所保留的或微流体通道可保留的流体体积。储液器可以是与设置在微流体层顶部上的无底微量滴定板上的类器官隔间的孔相邻的孔。在其他实施例中,储液器可以是同一微量滴定板上的孔,但在空间上距类器官隔间的孔较远。应当理解的是,只要储液器与类器官隔间的孔之间通过微流体层流体连通,储液器与类器官隔间的孔之间的接近度对细胞培养装置的运行并不重要。
在一些实施例中,微流体网络包括多于一个储液器,例如两个或多于两个储液器,储液器与微流体层流体连通,并与类器官隔间和微流体网络中存在的任何其他储液器流体连通。每个储液器可通过覆盖层中的孔与微流体层流体连通,所述覆盖层中的孔可视情况称为微流体层的入口或出口。在微流体网络中存在至少两个储液器的实施方式中,第一储液器可用于将流体(例如培养基)引入微流体网络,而第二储液器可作为通气孔或溢流室,用于在灌注或调平期间容纳流体,如下文中本发明的方法相关所述。
在一些实施例中,微流体细胞培养装置包括可灌注的微流体网络或血管网络,该血管网络包括:
具有入口和出口的微流体通道;
细胞外基质凝胶,其设置成容纳待在其上表面上被血管化的至少一个细胞;
其中,所述微流体通道与所述细胞外基质凝胶流体连通,并且,所述微流体通道包括衬于所述微流体通道的内表面的内皮细胞的血管网络。
在一些实施例中,细胞外基质凝胶设置成容纳细胞悬浮液,一个或多个细胞聚集体或组织样本。在一些实施例中,如本文所述,所述至少一个待血管化的细胞包括细胞聚集体或生物组织。
在一些实施例中,细胞培养装置是微流体细胞培养装置,包括:
具有入口和出口的微流体通道;
细胞外基质凝胶,其具有设置在其上表面上的生物组织;
其中,所述微流体通道包括衬于所述微流体通道的内表面的并穿过所述细胞外基质延伸至生物组织的内皮细胞的血管网络。
由于存在设置于细胞外基质的上表面上的血管网络和任选的生物组织,这些装置也可被视为分析板,因此,该设备可用于本文所述的分析或方法中。根据本文公开的内容可以理解的是,可以使用下述方法中的任何方法来实现此类装置的生产。在一个实施例中,内皮细胞的血管网络延伸进入细胞外基质凝胶中。任选地,血管网络的延伸是引起血管生成的微血管。
在一个实施例中,生物组织包括类器官、组织活检、肿瘤组织、切除的组织材料或胚胎体。如下文所述,生物组织可包括一个或多个上皮细胞和/或间充质起源细胞或基质细胞。生物组织还可任选地包括内皮细胞。生物组织可包括簇状细胞、打印细胞、类器官、组织活检、肿瘤组织、切除的组织材料、器官移植体或胚胎体,这取决于血管化的组织的最终用途。生物组织可包括获自、衍生自特定组织或器官(例如,肝脏、肾脏、脑、乳腺、肺、皮肤、胰腺、肠道、视网膜或头发)的一种或多种类型的细胞或表现与特定组织或器官(例如,肝脏、肾脏、脑、乳腺、肺、皮肤、胰腺、肠道、视网膜或头发)相关的表型的一种或多种类型的细胞。生物组织可包括或衍生自健康组织或患病组织,并且可从患者获得或衍生自患者。形成血管网络的内皮细胞可从患者获得或衍生自患者,例如与获得或衍生得到生物组织的患者相同的患者。在一个实施例中,内皮细胞包括血液来源的内皮细胞(例如,如natureprotocols7,1709–1715(2012)中所述)或源自干细胞(包括但不限于诱导多能干细胞)的内皮细胞。
在一个实施方式中,如本文所述,微流体通道设置在微流体装置中。例如,微流体通道可设置在微流体层中,所述微流体层进一步包括基底和盖子。微流体细胞培养装置还可包括类器官隔间和毛细管压力屏障,所述类器官隔间通过盖子中的孔延伸进入微流体层并与微流体通道流体连通,所述毛细管压力屏障基本上与盖子中的孔对齐并将微流体网络分为包括所述类器官隔间的第一子体积和包括微流体通道的至少一部分的第二子体积。细胞外基质凝胶可被放置在类器官隔间中并通过毛细管压力屏障被限制在类器官隔间中。
培养细胞或细胞聚集体的方法
本文描述了一种培养细胞或细胞聚集体的方法。通常,该方法包括将包括一种或多种类型的细胞或细胞聚集体的凝胶液滴或凝胶前体的液滴引入微流体细胞培养装置,例如本文所述的装置的类器官隔间中;允许微流体细胞培养装置中的至少一个毛细管压力屏障限制所述凝胶液滴或凝胶前体的液滴;使凝胶液滴或凝胶前体的液滴固化或凝胶化;将流体加载入微流体通道;培养存在于固化凝胶中的一种或多种类型的细胞或细胞聚集体。
在该方法的一个实施例中,微流体细胞培养装置是本文所述的。在该方法中,包括一个或多个细胞或细胞聚集体的第一液体组合物的液滴例如通过形成类器官隔间的一部分的孔的开口被加载至类器官隔间中,并通过一个或多个毛细管压力屏障保持该液滴,从而使凝胶或凝胶前体凝固或凝胶化。形成包括一种或多种类型的细胞或细胞聚集体的细胞外基质凝胶的条件在本领域中是已知的,作为后续培养的条件,这些条件将取决于所使用的细胞的性质和所期望的结果。
凝胶或凝胶前体包括适于细胞培养的本领域已知的任何水凝胶。用于细胞培养的水凝胶可由大量的天然材料和合成材料形成,提供各种不同的机械和化学特性。有关用于水凝胶合成的材料和方法的综述,参见lee和mooney(chemrev2001;101(7):1869–1880)。由天然材料形成的合适的水凝胶促进细胞功能,而由合成材料形成的合适的水凝胶兼容细胞功能。细胞培养用的天然凝胶通常由蛋白质和ecm成分(例如胶原蛋白、纤维蛋白、透明质酸或基质胶(matrigel))以及来源于其他生物源的材料(例如壳聚糖、海藻酸盐或丝纤维)形成。由于这些凝胶衍生自天然来源,因此它们具有固有的生物相容性和生物活性。兼容性合成水凝胶可由纯非天然分子(例如聚乙二醇(peg)、聚乙烯醇和聚(2-羟基甲基丙烯酸乙酯))形成。peg水凝胶已显示出能够维持所封装的细胞的生存能力,并在降解过程中允许ecm沉积,这表明合成凝胶即使没有整合素结合配体也能作为3d细胞培养平台发挥作用。这种惰性凝胶具有高度的可重复性,易于调整机械性能,并且可以简单地进行加工和制造。
凝胶前体可被提供至微流体细胞培养装置,例如,如上所述的装置的类器官隔间。在提供凝胶之后,使凝胶被凝胶化,随后引入另一种流体。合适的(前体)凝胶是本领域众所周知的。举例来说,凝胶前体可以是水凝胶,并且通常是细胞外基质(ecm)凝胶。例如,ecm可以包括胶原蛋白、纤维蛋白原、纤维连接蛋白和/或基底膜提取物(如基质胶(matrigel)或合成凝胶)。举例而言,凝胶前体可通过移液管引入至类器官隔间中。
凝胶或凝胶前体可包括基底膜提取物、源自人或动物组织或细胞培养物的细胞外基质、源自动物组织的细胞外基质、合成的细胞外基质、水凝胶、胶原蛋白、软琼脂、蛋白和市售产品如matrigel。
包括基底层的基底膜是薄的细胞外基质并由细胞外基质组成(例如蛋白质和蛋白聚糖),该细胞外基质是体内上皮细胞的基础。在一个实施例中,基底膜由胶原蛋白iv、层粘连蛋白、内功素、肝素硫蛋白聚糖和许多其他次要成分组成(quaranta等人,curr.opin.cellbiol.6,674-681,1994)。这些成分本身以及完整的基底膜具有生物活性并促进细胞粘附、迁移,并且在许多情况下促进细胞生长和分化。基于基底膜的凝胶的一个实施例被称为基质胶(matrigel)(us4829000)。这种材料作为上皮细胞的基础在体外具有很强的生物活性。
在本发明的方法中使用的许多不同的合适的凝胶是商售的,包括但不限于包括如下成分的那些凝胶:基质胶rgf、bme1、bme1rgf、bme2、bme2rgf、bme3(所有基质胶变体)、胶原蛋白i、胶原蛋白iv、胶原蛋白i和iv的混合物、或胶原蛋白i和iv的混合物、以及胶原蛋白ii和iii、纯基质(puramatix),水凝胶、cell-taktm、胶原蛋白i、胶原蛋白iv、
凝胶或凝胶前体被引入至微流体装置中,例如进入本文所描述的装置的类器官隔间的孔中,并通过毛细管作用力(重力提供潜在辅助)被输送进入微流体层中。凝胶或凝胶前体由微流体装置中的毛细管压力屏障限制,例如限制至包括类器官隔间的网络的第一子体积,然后导致或允许凝胶化。
在一个实施例中,凝胶或凝胶前体预先加载有目标细胞,即细胞存在于凝胶液滴或凝胶前体的液滴中,随后引入至微流体细胞培养装置(例如本文所述的装置的类器官隔间)中并且进行凝胶化。在另一实施例中,在将细胞引入微流体细胞培养装置(例如本文所述的装置的类器官隔间)中后,将细胞插入部分或完全固化的液滴中。因此,可选的培养方法包括将目标细胞接种至细胞培养水凝胶的固化液滴中。
在一个实施例中,凝胶或凝胶前体被引入至微流体细胞培养装置(例如,本文所述的装置的类器官隔间)中并随后被凝胶化,将细胞混合物、组织或细胞聚集体放置在凝胶的顶部。
在一个实施例中,存在于凝胶液滴或凝胶前体的液滴中或顶部上的至少一种类型的细胞或细胞聚集体包括上皮细胞,其在培养过程中可根据培养基的组分、可能存在的其他细胞类型和细胞外基质进行增殖和/或分化。因此,在引入至微流体网络中后,通过使用水性培养基(优选生长培养基)或者通过使用凝胶(前体),使上皮细胞在类器官隔间中增殖和/或分化。一种或多种类型的细胞或细胞聚集体(例如上皮细胞)的培养是通过将培养基引入至微流体通道中并在适当的条件下继续培养来实现的,从而将细胞培养形成类器官或胚胎体。
在另一实施例中,存在于凝胶液滴或凝胶前体的液滴中或顶部上的至少一种类型的细胞或细胞聚集体包括上皮细胞和间充质来源的细胞,例如成纤维细胞、平滑肌细胞、肌成纤维细胞、周细胞、星形胶质细胞、少突胶质细胞等。因此,在引入至微流体网络中(例如类器官隔间中)后,通过使用水性培养基(优选生长培养基)或者通过使用凝胶(前体),使上皮细胞和间充质来源的细胞相互作用并形成可在类器官隔间中增殖和/或分化的组织。
在又一实施例中,存在于凝胶液滴或凝胶前体的液滴中或顶部上的至少一种类型的细胞(例如细胞悬浮液)或细胞聚集体包括上皮细胞和间充质来源的细胞、免疫细胞(例如t细胞、巨噬细胞、kuppfer细胞、树突状细胞、b细胞、粒细胞和肥大细胞)和/或内皮细胞的任何组合。为避免混淆,使用的术语“液滴”不被解释为凝胶具有典型的液滴形式或形状。相反,它被解释为被引入至本文所述的细胞培养装置中并随后限制在本文所述的细胞培养装置中的凝胶的体积。
在形成凝胶之后,本发明的方法包括将第二流体(第二液体组合物)引入或添加至微流体通道中,所述第二流体将与凝胶接触。在一个实施例中,第二流体通过类器官隔间的孔进行加载。在另一实施例中,第二流体通过与微流体通道流体连通的储液器引入至微流体通道中。在一个实施例中,添加的流体体积大于微流体通道中可容纳的流体体积,从而使过量的流体保留在储液器中。凝胶液滴的凝胶状态确保细胞和凝胶保持在原位(stayinposition),同时,微流体通道中的流体和类器官隔间之间自由交换代谢物、营养物和氧。
在细胞悬浮液、组织或细胞聚集体位于凝胶顶部的实施例中,任选地,再施加一定体积的凝胶以包封细胞、组织或细胞聚集体。
本文所提及的细胞“保持在原位”应被理解为是指初始状态,相对于例如在填充第二流体时由于粘性拖曳力而被冲走。不言而喻,本领域技术人员会意识到细胞外基质环境中的细胞仍然能够通过凝胶网络运动。通过焦点粘附(如整合素,肌动蛋白重塑)由细胞基质相互作用促使细胞运动,通过胶原酶和许多其他使细胞能够在细胞外基质环境中运动的机制促使细胞运动。在实验过程中,细胞也可迁移进入ecm凝胶中或从ecm凝胶中迁移出去。
微流体通道还包括通风口,以通过从通道中排出空气而对微流体通道进行适当填充。该通风口可由额外的入口或类器官隔间本身形成。
应该注意的是,通常,流动可存在于整个凝胶中,称为间隙渗流。此外,由于存在例如整合素之类的锚定点,细胞通常具有在整个凝胶中迁移的能力和迁移进入凝胶的能力以及从凝胶中迁移出来的能力。因此,凝胶和流体形成交换表面而无需人工膜。
在本发明的内容中,本发明的目的在于提供细胞培养装置,第一液体组合物通常包括细胞培养水凝胶,该水凝胶一旦固化,将为液滴提供相应的基质结构和硬度。第二流体通常是水性溶液,例如细胞培养基、缓冲溶液或测试溶液,并且在某些实施例中,第二流体也可包括细胞,下文将对此进行描述。
在一个实施例中,引入足够体积的液滴,使得固化凝胶基本上完全位于微流体层内的部分类器官隔间内。在一个实施例中,凝胶化的液滴的体积为使得液滴不会完全阻塞微流体覆盖层中的孔的体积,在这种情况下,孔的未堵塞区域或开放区域可以用作通风口。因此,通风口通常包括覆盖层中的开口或孔,从而允许在通过入口加载微流体通道时排出空气。在一个实施例中,引入足够体积的液滴,使得该液滴被毛细管压力屏障限制,并且使大部分液滴体积容纳在微流体层外部的部分类器官隔间内,例如,其中大部分液滴体积容纳在类器官隔间的孔内。
在特定的实施例中,类器官隔间的两相对侧设置两个储液器,这两个储液器通过第一入口和第二入口与微流体通道流体连通。因此,将流体(例如培养基)引入至第一储液器中使得微流体通道得到填充。一旦填充,微流体通道和储液器中的流体就可被诱导流动。诱导微流体通道和储液器中的流体流动的典型方法是调平两个储液器之间的流体。这通过使一个储液器中的液位高于另一个储液器中的液位来完成或通过将微流体装置放置在某个角度下来完成。随着时间的推移,当系统与大气达到平衡时,流体的两个弯液面(每个储液器中一个)将“调平”。为了提供连续流体,可通过将装置放置在摇摆板上以实现定期的重新调平,该摇摆板定期调整装置的倾斜度。在该具体实施方式中,微流体通道通常从一个入口和储液器进行填充,其中,另一入口和储液器在对微流体网络内的微流体通道进行加载期间充当通风口。可选地,可以通过泵在微流体通道中诱导流动。
在一个实施例中,引入微流体通道的流体可能包括内皮细胞。一般来说,内皮细胞被称为衬于整个循环系统(从心脏到最小的淋巴毛细血管)的内表面的细胞。当与血液接触时,这些细胞被称为血管内皮细胞,当与淋巴系统接触时,它们被称为淋巴内皮细胞。在具体实施方式中,培养方法包括将内皮细胞引入至微流体网络的微流体通道中的步骤,优选使用第二液体组合物,使得或允许所述内皮细胞衬于微流体通道,即,使得或允许内皮细胞在微流体通道内形成血管。
在合适的条件(例如适合促进血管生成的条件)下将内皮细胞引入至微流体通道中不仅可以形成衬于微流体通道内表面的血管组织并在一些情况下形成衬于细胞外基质凝胶内表面(其随后成为可渗透的)的血管组织,而且还可形成新的微血管。适合促进血管生成的条件包括添加促血管生成化合物,例如成纤维细胞生长因子(fgf)、血管内皮生长因子(vegf)、血管生成素-1(ang1)、血管生成素-2(ang2)、佛波醇肉豆蔻-13-乙酸酯(pma)、1-磷酸-鞘氨醇(s1p)、igfbp-2、肝细胞生长因子(hgf)、脯氨酰羟化酶抑制剂(phi)、单核细胞趋化蛋白-1(mcp-1)、碱性成纤维细胞生长因子(bfgf)和肾素等。
当梯度应用促血管生成化合物时,一种或多种促血管生成化合物可被认为充当趋化因子,促进朝向限制性凝胶液滴并在限制性凝胶液滴内的定向血管生成。以这种方式,刺激内皮细胞在微流体层中和凝胶中形成血管组织层,该血管组织层之后经历透化作用并且导致导致新的微血管的形成。一种或多种促血管生成化合物可被添加至凝胶液滴或凝胶前体的液滴中,随后将该液滴引入至类器官隔间中,或者在凝胶液滴形成之后向类器官隔间中添加一种或多种促血管生成化合物。在另一实施例中,一种或多种促血管生成化合物可通过进入微流体通道的另一入口添加至微流体网络,例如在引入培养基的入口下游的入口和/或在类器官隔间下游的入口。
在一个实施例中,任选地,在加载有待培养的一种或多种类型的细胞或细胞聚集体的凝胶(或凝胶前体)已被引入至类器官隔间中之后,将内皮细胞引入至微流体通道中。在一个实施例中,在凝胶(或凝胶前体)已被引入至类器官隔间中并随后加载或覆盖待培养的一种或多种类型的细胞或细胞聚集体之后,将内皮细胞引入至微流体通道中。在其它实施例中,本文所述的方法包括将不含任何细胞或细胞聚集体的凝胶液滴或凝胶前体的液滴引入至类器官隔间中,允许或使得所述凝胶液滴或凝胶前体的液滴凝胶化,将内皮细胞引入至微流体通道中,然后将一种或多种类型的细胞或细胞聚集体引入至固化凝胶中或固化凝胶的顶部上。在一个实施例中,使得或允许内皮细胞在微流体通道内形成血管组织层,随后将一种或多种类型的细胞或细胞聚集体引入至凝胶中或凝胶顶部上。在一个实施例中,通过将适量的包括细胞的凝胶前体添加至固化凝胶的顶部将一种或多种类型的细胞或细胞聚集体引入凝胶中。
如之前所解释的那样,使用毛细管压力屏障能够在类器官隔间中形成稳定的限制体积,从而可以在不移动凝胶或其内容物的情况下添加第二流体。因此,本发明的装置被配置为与其他细胞进行空间上受控的共培养,并且本发明的装置提供控制周围培养基的组分的方法。因此,在本发明的培养方法中,加载入储液器中的流体(本文也称为第二液体)是细胞培养基、测试溶液、缓冲液、其他水凝胶等中的任何一种,并且可任选地包括细胞或细胞聚集体。
本发明的细胞培养装置通过控制引入储液器的组合物能够实现不同的类器官培养模式。例如,引入储液器的流体组合物可以发生改变。流体组合物的改变可以是通过将新的组合物引入至储液器中的一个中并同时将流体从同一微流体网络中的另一储液器中排出直至完成交换而进行的梯度交换。这样的改变可以是通过抽吸储液器中的流体并向储液器中填充新的组合物的不连续的交换。储液器中的流体体积比微流体通道中的流体体积大得多,储液器之间的调平几乎是瞬间发生的,从而确保在过程中用新的流体冲洗微流体网络而无需清空微流体通道网络。
在一个实施例中,在装置中存在的第二毛细管压力屏障甚至允许形成层状凝胶组合物。在这个实施例中,第一毛细管压力屏障(例如圆形毛细管压力屏障)将包括第一凝胶或凝胶前体的液体组合物固定在类器官隔间的基底层上作为固定的液滴。在第一液体组合物凝固之后,将任选地含有细胞的第二凝胶或凝胶前体加载入类器官隔间中。由第二毛细管压力屏障(例如比第一毛细管压力屏障的直径更大、与第一毛细管压力屏障同心并围绕第一毛细管压力屏障的圆形毛细管压力屏障)维持第二组合物。通过这种结构,第二毛细管压力屏障防止第二组合物流入微流体通道中并且第二毛细管压力屏障封装第一凝胶。两个毛细管压力屏障的存在相应地将微流体网络划分为单独的空间体积,并给予用户在微流体网络中产生立体结构的可能性。
上述装置不仅能够控制微流体通道中液体的组分,而且同样能够控制液体的流动行为,例如,该装置提供了在微流体通道中与内皮细胞共培养的可能性,以及管腔的形成和类器官培养物的血管化的可能性。随后可通过一个或多个储液器进行管腔灌注(即血管化)并使液体在所述隔间内开始运动(下文进行描述)。
因此,本文还描述了一种血管化一个或多个细胞或细胞聚集体的方法,该方法总体上包括:将凝胶液滴或凝胶前体的液滴引入至微流体细胞培养装置中并使得所述凝胶液滴或凝胶前体的液滴被装置中存在的毛细管压力屏障所限制;使得凝胶或凝胶前体固化或凝胶化以形成至少部分固化的凝胶;将载液中的内皮细胞悬浮液引入至微流体细胞培养装置的微流体通道中,该微流体通道与固化的凝胶流体连通;使得内皮细胞至少在微流体通道中形成至少一个微血管;在固化凝胶的上表面上引入一个或多个细胞或细胞聚集体;以及允许或促进至少一个微血管和一个或多个细胞或细胞聚集体之间的定向血管生成。
该方法通常在具有毛细管压力屏障的微流体细胞培养装置上实施,以将一种或多种流体限制至装置的分离的子体积。在一个实施例中,该装置例如是本文所述的装置。然而,应当理解,该方法可在微流体细胞培养装置的其他结构上实施,并且下文对该方法的描述不应被解释为仅限于在本文所述的装置上运行。
在该方法的第一步骤中,凝胶液滴或凝胶前体的液滴被引入到微流体细胞培养装置中,由毛细管压力屏障限制所述凝胶液滴或凝胶前体的液滴并使得所述凝胶液滴或凝胶前体的液滴固化或凝胶化,以形成完全或至少部分固化的凝胶。此处提及的固化的凝胶被理解为至少部分固化的凝胶以及完全固化或全部固化的凝胶。与先前所述的方法相反,在本方法中的凝胶液滴或凝胶前体的液滴不含细胞,并且包括如上所述的本领域已知的适合细胞培养的任何水凝胶。
一旦凝胶液滴或凝胶前体的液滴至少部分地固化,但任选地完全固化,就将内皮细胞引入装置的微流体通道中。上文中描述了内皮细胞的引入和促进血管形成(vasculogenesis)和/或血管生成(angiogenesis)的条件,因此不再赘述。内皮细胞可作为合适的载液中的悬浮液被引入,并可允许或使得内皮细胞至少在微流体通道中形成至少一个微血管。在一个实施例中,使得或允许内皮细胞在微流体通道内形成血管组织层,随后将一种或多种类型的细胞或细胞聚集体引入至少部分固化的凝胶中或至少部分固化的凝胶的上表面。
在一个实施例中,微血管衬于微通道的内壁以形成与固化的凝胶的交界面,并延伸至微通道的入口和出口,从而提供微流体通道的完全血管化。在另一个实施例中,微血管延伸进入固化凝胶中。因此,微流体通道中的微血管的形成以及任选地在固化的凝胶中形成微血管提供了血管床,例如可用于容纳生物组织。
本文中描述的血管化一个或多个细胞的方法包括将一个或多个细胞或细胞聚集体(包括一种或多种细胞类型)引入至至少部分固化的凝胶中或其上表面上。在一个实施例中,通过在固化的凝胶的顶部上添加适量的包括细胞的凝胶前体,将一个或多个细胞或细胞聚集体(包括一种或多种细胞类型)引入至至少部分固化的凝胶中或其上表面上。在一个实施例中,将一个或多个细胞或细胞聚集体(包括一种或多种细胞类型)引入至至少部分固化的凝胶中或其上表面上,然后在固化凝胶的上表面上添加适量的凝胶前体。
在合适的条件下,之后可发生在一个或多个细胞或细胞聚集体(包括一种或多种细胞类型)与微血管之间的定向血管生成,导致微流体装置上的一个或多个细胞或细胞聚集体(包括一种或多种细胞类型)的血管化。如前所述,使用一种或多种促血管生成化合物可诱导或促进血管生成。在引入一个或多个细胞或细胞聚集体之后,可以将一种或多种促血管生成化合物添加至至少部分固化的凝胶上。
如前所述,一个或多个细胞或细胞聚集体可包括一个或多个上皮细胞和间充质起源细胞或基质细胞。基于血管化组织的最终用途,一个或多个细胞或细胞聚集体可包括簇状细胞、打印细胞、类器官、组织活检、肿瘤组织、切除的组织材料、器官移植体或胚胎体。一个或多个细胞或细胞聚集体可包括源自或衍生自特定生物组织(例如肝脏、肾脏、脑、乳腺、肺、皮肤、胰腺、肠道、视网膜或头发)的一种或多种类型的细胞或包括表现出与所述特定生物组织(例如肝脏、肾脏、脑、乳腺、肺、皮肤、胰腺、肠道、视网膜或头发)相关的表型的一种或多种类型的细胞。一个或多个细胞或细胞聚集体可包括健康组织或患病组织,并且可从患者获得或衍生自患者。
在一种实施方式中,用于血管化微流体通道和组织的内皮细胞也可从患者获自或衍生自患者。在一种实施方式中,从患者获得或衍生自患者的内皮细胞可包括血液来源的内皮细胞、或源自多能干细胞的内皮细胞。通过使用自体内皮细胞,结合包括来自同一患者的一个或多个细胞或细胞聚集体的生物组织,血管化系统特别适合于个性化医学领域和临床模型和分析方法的开发,以确定或预测患者对特定药剂的可能反应。例如,使用从患者获得的肿瘤组织并使用源自上述患者的内皮细胞对肿瘤组织进行血管化可对患者对化疗的可能反应进行完整分析。此外,将一种或多种类型的患者自身的免疫细胞引入这样的系统中还可以确定对特定药剂的可能的免疫反应。
一个或多个细胞或细胞聚集体可经历前述的培养步骤以允许这些细胞增殖和/或分化。
在一种实施方式中,一个或多个细胞或细胞聚集体完全覆盖至少部分固化的凝胶的上表面,从而在至少部分固化的凝胶的上表面上形成组织屏障层。屏障层可包括单层细胞或多层细胞或细胞聚集体。在一种实施方式中,可以培养单层细胞或多层细胞,以允许在至少一个微血管的血管生成进入至少部分固化的凝胶中之前或之后增殖和/或分化细胞。扁平层状组织的实例包括皮肤组织(包括例如角质细胞、脂肪组织和成纤维细胞)、肠道上皮以及其他上皮组织,例如肺和视网膜。
如上文所述,可将培养基或分化培养基添加至微流体通道中,并可如上文所述实现建立穿过血管网络的流体流动,以允许细胞增殖和/或分化。类似地,可如上文所述控制流体的组分。因此,通过本文所述的方法建立的血管化的、可灌注的网络允许在装置的微流体通道内的微血管中的流体和固化的凝胶顶部的细胞或细胞聚集体之间自由交换代谢物、营养物和氧。
分析板
本发明的另一方面提供一种分析板,其包括本文所述的任何装置。包括血管网络并且任选地还包括生物组织的细胞培养装置也应当被理解为分析板。
分析板可具有由装置中的毛细管压力屏障所限制的凝胶。在一个特定的实施方式中,分析板可具有由毛细管压力屏障限制至装置的类器官隔间的凝胶,其中,凝胶或凝胶状物质包括一个或多个细胞或细胞聚集体。
分析板可包括一个或多个已通过本文所述的方法培养的细胞或细胞聚集体。在一个实施例中,分析板的装置的微流体通道的至少一部分包括血管组织层,该血管组织层包括延伸进入凝胶中的内皮细胞。
分析板的尺寸可与ansi/slas微量滴定板的标准格式一致或兼容。具体而言,分析板的面积或周长的尺寸可与ansi/slas微量滴定板的标准一致。
本文还描述了由本文所述的任何方法产生的分析板或细胞培养装置。
分析
本文所述的分析板可用于分析,其中,将测试溶液引入至微流体网络中并观察测试溶液对细胞、细胞聚集体或类器官或胚胎体的影响。测试溶液可包括药物、候选药物化合物、毒素、食品化合物、化学物质、病毒、细菌或纳米粒子。
在一个实施例中,分析中使用的分析板包括细胞培养装置,所述细胞培养装置包括血管网络,任选地包括来自患者的生物组织。通过使用自体内皮细胞,血管系统特别适合于个性化医学领域和临床分析的发展,以确定或预测患者对特定药剂的可能的反应。例如,使用从患者获得的肿瘤组织并使用源自上述患者的内皮细胞对肿瘤组织进行血管化能够对患者对化疗的可能反应进行完整分析。此外,将一种或多种类型的患者自身免疫细胞引入这样的系统中还可确定对特定药剂的可能的免疫反应。
合适地,可将患者自身的t细胞、b细胞、淋巴细胞、树突细胞、小胶质细胞和单核细胞中的一个或多个与测试药剂一起引入至分析板中的凝胶和生物组织的顶部或通过微流体通道引入至分析板中的凝胶和生物组织的顶部。免疫细胞也可任选地存在于凝胶中。
分析板的其他用途包括基于细胞的体外分析、药物筛选分析或毒性分析。
试剂盒
本发明还提供使用本文所述的细胞培养装置和分析板的试剂盒和物品。在一个实施例中,试剂盒包括本文所述的细胞培养装置或分析板;以及用于诱导血管生成的一种或多种促血管生成化合物。
试剂盒的细胞培养装置或分析板优选地包括血管床,换言之,包括细胞外基质凝胶,该细胞外基质凝胶被布置成容纳待在其上表面上被血管化的至少一个细胞;以及衬于微流体通道的内表面的内皮细胞的血管网络。
试剂盒还可包括包装材料和包含在包装材料中的标签或包装内插页,所述标签或包装内插页提供在细胞培养装置或分析板中使用一种或多种促血管生成化合物诱导血管生成的说明。
一种或多种促血管生成化合物可包括下列中的一种或多种:成纤维细胞生长因子(fgf)、血管内皮生长因子(vegf)、血管生成素-1(ang1)、血管生成素-2(ang2)、佛波醇肉豆蔻-13-乙酸酯(pma)、1-磷酸-鞘氨醇(s1p)、igfbp-2、肝细胞生长因子(hgf)、脯氨酰羟化酶抑制剂(phi)、单核细胞趋化蛋白-1(mcp-1)、碱性成纤维细胞生长因子(bfgf)和肾素等。
试剂盒还可包括附属部件,例如包括用于引入一种或多种促血管生成化合物的合适的培养基的第二容器以及使用所述培养基的说明。
在相关方面,本发明提供如本文所述的细胞培养装置在生产和/或培养细胞或组织、使组织工程化、形成胚胎体、形成类器官等方面的用途。
实施例
现在将参考附图以示例的方式描述本发明。
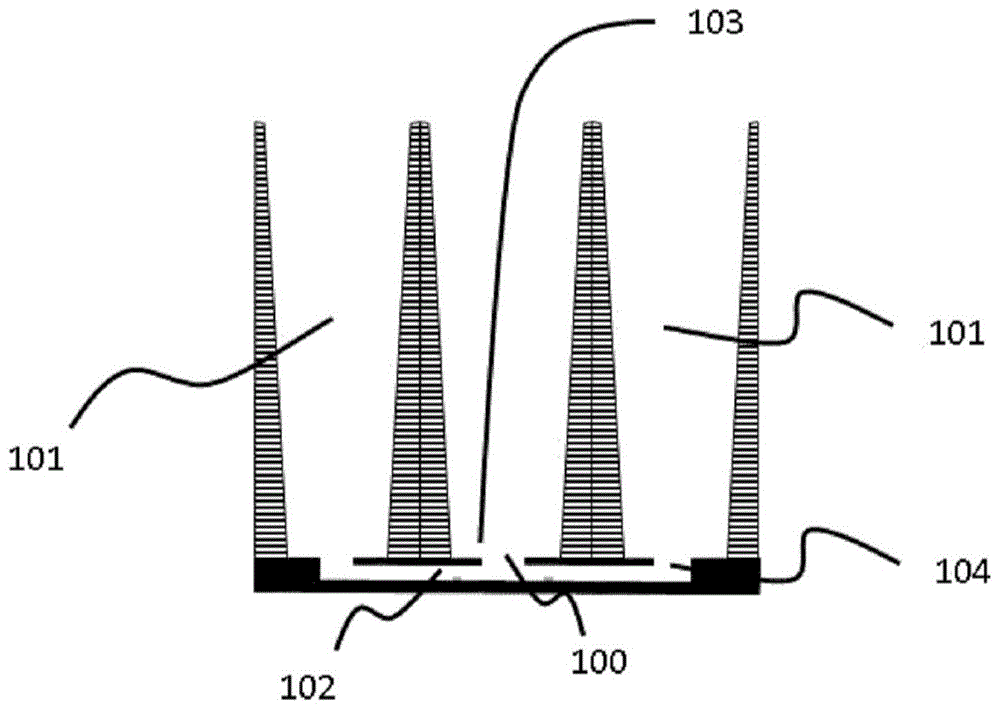
细胞培养装置的第一实施例如图1至图3所示。横跨装置的视图(图1)显示了其两侧设置有两个储液器(101)的中央类器官隔间(103)以及微流体层(显示为实心)中的微流体通道(102),该微流体通道通过微流体层的覆盖层中的入口(104)将储液器与类器官隔间连接。毛细管压力屏障(105)存在于类器官隔间的基底,并且通过微流体层(显示为实心)的覆盖层中的孔(100)可接近该毛细管压力屏障。在这个特定的实施例中,孔的横截面比类器官隔间的向下延伸的壁窄。
当类器官隔间中填充有足够体积的第一液体(凝胶或凝胶前体(106))(包括一种或多种类型的细胞或细胞聚集体,也称为类器官组合物)(106),并且使毛细管压力屏障围绕覆盖层中的孔(100)并具有较大直径时,第一液体将阻塞所述覆盖层中的孔(图3),因此,在将第二流体添加至一个储液器(101)中之后周围的微通道(102)的排气将通过微流体通道(102)和另一个储液器(101)的入口(104)进行。
如俯视图(图2)所示,圆形毛细管压力屏障将微流体网络分为两个子体积。一个子体积(在本实施方式中为毛细管压力屏障内的中央体积)包括用于容纳类器官组合物的类器官隔间(103),而另一子体积由储液器(101)和微流体通道(102)限定,通向并围绕类器官隔间(103)中的类器官组合物。微流体通道(102)在图2中示意性地表示为围绕毛细管压力屏障的实心圆和延伸至储液器(101)的两个线性通道,覆盖层中的孔(100)由虚线表示。
装置和分析板的关键特征之一在于形成两个彼此直接接触的子体积,没有任何中间结构,如壁或膜。此外,通过储液器和微流体通道,甚至可以控制和调节凝胶周围的培养基,例如类器官组合物。图3提供了微流体网络的一部分的垂直横截面的特写视图,显示了基底层上的毛细管压力屏障(105),以及它如何限制第一液体(106)的液滴(为清楚起见,此处描述的类器官组合物没有细胞或细胞聚集体)。毛细管压力屏障(105)的存在防止在将凝胶或凝胶前体(例如类器官组合物)加载至类器官隔间中时凝胶或凝胶前体(例如类器官组合物)填充微流体通道,换言之,在使用中,凝胶或凝胶前体被固定在毛细管压力屏障(105)上。
图2以及后续图中的覆盖层中的孔(100)被描绘成圆形孔。然而,可以理解的是,孔可以有任何形状,优选为圆形和方形。
在可选的实施方式中,如图4至6所示,类器官隔间(103)延伸穿过的覆盖层中的孔(100)被扩大。这样就能够生长出更均匀、直径更大的类器官,而不会受到孔突然限制的阻碍。此外,这还能够通过扩散或间质流动使分子(例如生长因子、成形素、氧、营养素和其他物质)在整个类器官体积中更加均匀地分布。此外,对于类器官血管化的情况,这也使类器官的血管化更加均匀。
为了控制类器官组合物的周围培养基,可能存在微流体通道(102)的额外分支。图7至图9中提供了一个这样的实施例。在该实施方式中,中央类器官隔间(103)以交叉配置的方式(参见图8)连接至四个储液器(101),其中存在两个线性毛细管压力屏障(105),每个毛细管压力屏障部分限定了包括类器官隔间的第一子体积。
在上述所有实施例中,毛细管压力屏障围绕类器官隔间的孔(100),并且其直径或面积大于孔限定的直径或面积。因此,在所有这些实施例中,用凝胶或凝胶前体(例如类器官组合物)加载类器官隔间将导致孔堵塞。在另一可选的实施方式中,毛细管压力屏障(105)位于孔(100)的圆周内(具有较小的直径或周长),例如图12所示。
通过这种结构,凝胶或凝胶前体(例如类器官组合物)将被固定在屏障上,作为稳定的固定液滴。不仅如此,这还会在两种液体之间产生较大的表面接触面积,此外,与上述实施方式不同的是,通过液滴和覆盖层中的孔(100)之间的自由空间可以实现周围微通道的排气。因此,在一个实施例中,毛细管压力屏障位于微流体通道的基底上,但位于孔的圆周内(毛细管压力屏障具有较小的直径)。
添加封闭几何结构的第二毛细管压力屏障甚至允许形成层状凝胶体积组合物,例如类器官体积组合物。图13至图15中提供了这样的实施例。在该实施例中,第一圆形毛细管压力屏障将包括第一凝胶或凝胶前体的液体组合物固定在类器官隔间的基底层上作为固定液滴。在固定第一液体组合物后,将第二组合物(107)装载入类器官隔间中。该第二组合物将被第二毛细管压力屏障(108)维持,从而防止该第二液体填充微流体通道(102)。毛细管压力屏障的存在相应地将微流体网络划分为单独的空间体积,并给予用户微流体网络中产生空间结构的可能性。
本文所述装置中使用的任何毛细管压力屏障可以采用如图16至图18所示的不同形状或形式,包括在类器官隔间的基底或底板处的突出边缘、槽或疏水材料线。图16显示了构造为从底板突出的边缘的毛细管压力屏障,所述边缘可由与底板或基底层不同的材料构成,也可不由与底板或基底层不同的材料构成。图17提供了构造为突出进入底板或基底层的脊或槽的毛细管压力屏障的实施例。图18提供了构造为不同疏水性/亲水性材料的线的毛细管压力屏障的实施例。向着线进行固定,参考不同疏水性/亲水性材料的水平面描述固定屏障的接触角度。
如前所述,该装置优选地与由ansi/slas尺寸定义的微量滴定板的面积兼容或基于该微量滴定板的面积,如图19所示,该图显示了包括128个单独的微流体网络的这种滴定板的仰视图,例如如图1、图4和图13所述。图20显示了图19中的多孔结构的横截面,其中边缘(111)与微量滴定板的轮廓重合。
图21显示了将液滴固定在液滴保持结构上并且液滴不接触覆盖层时所需的尺寸。在这种情况下,在覆盖层高度h处的液滴的外部与毛细管压力屏障的外部之间的水平距离δ1应小于覆盖层中的孔边缘与毛细管压力屏障之间的水平距离δ2。液滴的曲率由其与毛细管压力屏障的垂直表面的接触角度α、毛细管压力屏障的周长和液滴的体积决定。
图22a至图22f中显示了使用本文所述的装置制备和获得具有控制周围培养基能力的细胞的3-d培养物的不同步骤。在第一步中,将包括细胞(112)(图22a)或细胞聚集体(113)(图22b)的第一液体液滴引入至类器官隔间(103)中,将该液滴固定在毛细管压力屏障上并将其凝固(固化、凝胶化)。同样,如上文所述,第一液体组合物通常包括凝胶或凝胶前体,例如细胞培养水凝胶(或其前体),并且包括本领域已知并适合该目的的任何水凝胶。
一旦包括类器官组合物的凝胶液滴凝固,就向微流体通道中加载第二液体(115,图22c);其通常是水性溶液,例如细胞培养基、缓冲溶液、测试溶液或未固化的水凝胶。因此,在该装置内,微流体通道中的包括细胞的凝胶和第二液体的交界面产生没有人工边界的交换表面。
由于可以将细胞培养基引入至微流体通道中,因此同样可以将细胞引入至微流体通道中。图22d显示了一个这样的实施例,其中,将内皮细胞(114)引入至微流体通道中。这些内皮细胞可作为细胞培养基或生长培养基的成分被引入,或可随后引入。在对由此接种的装置进行培养之后,根据第二液体(加载在微流体通道中的液体)的组成,内皮细胞(114)可被血管化或衬于微通道的内表面(即壁、基底和顶部),并也可能衬于ecm凝胶表面(见图22e)。
在进一步的步骤中,培养条件可允许或诱导在微流体通道中形成的血管的血管生成(图22f),并伴随包括类器官组合物的凝胶液滴的侵入和/或毛细血管形成于其中存在的细胞聚集体,类器官或球体内。允许血管生成的培养条件为本领域技术人员已知的,并且包括例如缺氧、机械刺激以及使用如前所述的促血管生成剂(例如,促血管生成蛋白)的化学刺激。
促血管生成剂可添加至微流体通道中的液体组合物中,但同样可通过类器官隔间添加至凝胶液滴的顶部。当添加至类器官隔间内存在的凝胶液滴的顶部时,促血管生成剂会吸引内皮细胞进入凝胶和类器官组合物中。
典型的发芽性混合物包括:vegf、mcp-1、hgf、bfgf、pma、s1p,其中vegf、mcp-1、hgf、bfgf和pma各自的量为37.5ng/ml至150ng/ml,s1p的量为250nm至1000nm。另一种典型的发芽性混合物组分包括s1p500nm、vegf50ng/ml、fgf20ng/ml、pma20ng/ml。
因此,在进一步的实施方式中,培养方法包括细胞培养步骤,其允许或诱导衬于微流体通道的壁和凝胶的内皮细胞的血管生成。以这种方式形成的血管连接微流体通道的入口和出口,衬于通道表面并延伸至包括类器官的凝胶中。
促进血管生成的趋化因子或血管生成剂或不同血管生成剂的组合物(116;图23)可添加至类器官隔间的孔中的凝胶上,或可通过微流体网络的另一个入口添加至类器官隔间的孔中的凝胶上,该微流体网络的另一个入口与微流体通道的如下区域相接触,该区域与衬有血管并仅穿过凝胶的通道区域连通并由此实际上与通道的第一区域相对。促血管生成化合物(或组合物)诱导血管具有可渗透性,通过沿梯度方向的增殖和迁移诱导发芽。任选地,一旦类器官和类器官凝胶体积被完全血管化,还可在微流体通道的第二区域中形成血管结构。
该方法的优选结果是凝胶中的通过微血管进行血管化的类器官,该微血管通过一个或多个微流体通道连接至较大的血管,通过该微流体通道可以施加流动的生长培养基、血清或其它物质。因此,使用该装置,可以共培养第一类细胞和内皮细胞培养物,从而获得存在于类器官组合物凝胶液滴中的细胞聚集体、类器官或球体的血管化模型,该血管化模型通过在微流体通道内形成的内皮血管连接至储液器,其中,所述第一类细胞存在于包括类器官隔间的网络的第一限制子体积中,所述内皮细胞培养物存在于包括微流体通道的第二子体积中。
由微流体通道的血管化形成的血管具有管腔,其是血管的顶端侧,而血管的外侧是基底侧。在一个实例中,将促血管生成化合物或其组合物施加至血管的基底侧以诱导定向血管生成。
因此,与现有的模型不同,本发明的装置的使用诱导培养基流过存在于类器官组合物的凝胶液滴内的细胞聚集体、类器官或球体的血管化模型。
使储液器中的液体处于运动状态的培养方法步骤以及包括使微流体通道中的液体处于运动状态的步骤在内的方法均在本发明的方法的范围内。图24提供了一个简单的实施例,显示了微流体网络的摇摆运动,即,将装置置于倾斜角度下诱导流动,并通过周期性地改变倾斜角度来维持流动,储液器连通(118)中的液位通过微流体通道和血管化的类器官隔间分别上升(119)和下降(117)。
图25显示了在由毛细管压力屏障限制的基质胶ecm中培养肠道类(肠道)类器官的实验结果,通过微流体通道引入流动生长培养基。在第3天和第6天之间,生长培养基没有发生改变,导致细胞死亡。
图26显示了在根据图8的细胞培养装置中诱导血管生成的实验结果。将凝胶液滴引入至类器官隔间(103)中,通过线性毛细管压力屏障(105)固定该液滴,并允许其凝胶化。一旦凝胶化,就将内皮细胞(huvec)引入至微流体通道102/102a中。内皮细胞使得血管在微流体流道内形成,从而衬于通道壁和凝胶。随后,将促血管生成化合物(vegf、fgf、pma和s1p)的组合物添加至凝胶的顶部,刺激凝胶内的血管生成,如在类器官隔间内微血管的形成所证明的那样。为避免混淆,该特定实验是在凝胶内或凝胶顶部没有任何类器官或球体的情况下进行的,因此可以看到凝胶内的血管化。
图27a至图27e中显示了使细胞聚集体血管化的方法的步骤。虽然该特定实施方式说明该方法是在特定结构的微流体细胞培养装置上实施的,但应当理解的是,该方法更普遍地适用于其他结构的微流体细胞培养装置。在第一步中,将没有细胞或细胞聚集体的凝胶液滴或凝胶前体的液滴(106)(图27a)引入至类器官隔间(103)中,将该液滴固定在毛细管压力屏障(105)上并使其凝固(固化、凝胶化)。
一旦凝胶液滴凝固,就可向微流体通道(102)中加载第二液体,通常是水性溶液,例如细胞培养基、缓冲溶液、测试溶液或未固化的水凝胶。因此,在该装置内,微流体通道中的凝胶和第二液体的交界面形成为没有人工边界的交换表面。
由于可以将细胞培养基引入微流体通道中,同样可将细胞引入微流体通道中。图27b中显示了一个这样的实施例,其中,内皮细胞(114)被引入微流体通道中。这些内皮细胞可作为细胞培养基或生长培养基的成分被引入,或可随后引入。在对这样接种的装置进行培养后,根据第二液体(加载在微流体通道中的液体)的组分,内皮细胞(114)可发生血管化或衬于微通道的内表面(即壁、基底和顶部),并且也可能衬于ecm凝胶表面(见图27b)。
在进一步的步骤中,培养条件可以允许或诱导在微流体通道中形成的血管的血管生成(图27c),并伴随在凝胶液滴内形成毛细血管。允许血管生成的培养条件为本领域技术人员已知的,包括例如缺氧、机械刺激和使用如前所述的促血管生成剂(例如,促血管生成蛋白)的化学刺激。
促血管生成剂可添加至微流体通道中的液体组合物中,但同样可通过类器官隔间添加至凝胶液滴的顶部。当将促血管生成剂添加至存在于类器官隔间内的凝胶液滴的顶部时,其吸引内皮细胞进入凝胶。
因此,在进一步的实施方式中,该方法包括允许或诱导内皮细胞的血管生成的细胞培养步骤,所述内皮细胞衬于微流体通道的壁和凝胶。以这种方式形成的血管连接微流体通道的入口和出口,衬于通道表面并延伸至凝胶中。
因此,可将促进血管生成的趋化因子或血管生成剂或不同血管生成剂的组合物(116;图27c)添加至凝胶上。血管生成化合物(或组合物)诱导血管具有渗透性,并通过沿梯度方向的增殖和迁移诱导发芽。
在血管生成进入凝胶的至少一部分后,细胞聚集体(113)可被引入至凝胶的上表面上(图27d)。该步骤可通过将细胞引入合适的载液(例如缓冲液或生长培养基)中的来实现,使得细胞浸没在载液的气液界面之下,如图27d所示。可选地,特别是在诸如类器官或组织移植体等的细胞聚集体的实施例中,该步骤可通过使用本领域已知的操纵和运输细胞的技术(例如微传导技术)在没有任何载液的情况下实现。
最后,通过使用如上所述的一种或多种促血管生成化合物和/或通过细胞聚集体(113)本身的细胞性质,可允许或诱导在形成微血管的内皮细胞(114)和细胞聚集体(113)之间的血管生成(图27e),从而使得各个发芽血管连接形成一个完整的血管系统。
图28a至图28d示出了图27中所示方法的替代方法。图28a和图28b的步骤与图27a和图27b的步骤相对应,因此不作进一步讨论。在微通道(102)的血管化之后,但在微血管的血管生成进入凝胶之前,单层细胞(120)被添加在凝胶的顶部,覆盖其整个上表面(图28c)。虽然图中描述了真正的单层,但应当理解,也可产生多层细胞的沉积,特别是多层组织,任选地是不同的细胞类型。例如,可引入皮肤组织样本、不同类型的皮肤细胞的混合物或干细胞样本,这些干细胞随后可以分化为不同类型的皮肤细胞。
如前所述,微血管的血管生成进入凝胶并进入覆盖凝胶上表面的细胞层可随后受到诱导或促进(图28d)。
与图22中的方法一样,图27和图28中所示的两种方法的结果是由一个或多个细胞或细胞聚集体形成的生物组织,例如凝胶上表面上的类器官,其通过微血管进行血管化,所述微血管通过一个或多个微流体通道连接至更大的血管,通过该微流体通道可以施加流动的生长培养基、血清或其它物质。因此,使用该装置,可以共培养第一类细胞和内皮细胞的培养物,所述第一类细胞存在于包括类器官隔间的网络的第一限制子体积中,所述内皮细胞培养物存在于包括微流体通道的第二子体积中,从而获得存在于凝胶液滴的上表面上的细胞聚集体、类器官或球体的血管化模型,该血管化模型通过在微流体通道内形成的内皮血管连接至储液器。
因此,与现有模型不同,本发明的装置的使用诱导培养基流过存在于凝胶液滴的上表面上的细胞聚集体、类器官或球体的血管化模型。
图29显示了类器官移植到血管床上当天放置在血管床上的肾脏类器官的高分辨率图像。在该图像中,从上方观察,从顶部至底部的白线是毛细管压力屏障的位置,代表细胞外基质凝胶和两个血管化微通道之间的边界,每侧均有一条白线。可以看出,从微通道出来的血管系统已经开始发芽进入细胞外基质凝胶中。
图30显示了类器官移植到血管床上7天后的肾脏类器官的高分辨率图像。从该图像中可以看出,在7天后,已发生广泛的血管生成进入细胞外基质凝胶,同时伴随着来自类器官的血管系统的生长,在一定程度上类器官现在是延伸至微通道中的血管网络的一部分。
图31显示了类器官移植到血管床上7天后的小鼠胚胎肾移植体的高分辨率图像。图像右侧从顶部至底部的暗线是毛细管压力屏障,右侧是微通道,左侧是类器官隔间(包含肾移植体)。白色箭头显示与胚胎小鼠肾脏的未发育的血管系统相连的人脐带静脉内皮细胞(huvec)血管。
图32显示了在移植到血管床上后第7天由肝细胞和rfp标记的huvec组成的肝球体的高分辨率图像,肝球体的内皮与血管床相连。该图像显示了相位对比和红色荧光。
图33显示了图32中所示的同一系统的高分辨率图像,显示了内皮的红色荧光;以及
图34显示了在根据本发明的装置中使用的微流体网络的替代可能结构的水平俯视图。该结构是对图8的修改,在图中所选择的通道和入口为使所有入口都在一行中。由于每个网络在装置上占用的空间较小,该结构相比其他结构特别有利。
图35显示了在根据本发明的装置中使用的微流体网络的两种可选的可能结构的水平俯视图。每种结构在每个类型的多重网络以96孔板的形式使用时特别有利,因为网络中所有的相应的微通道入口都以8个移液管的间距的方式排列成一行,如同所有的凝胶入口和所有相应的微通道出口一样。这允许使用多通道移液(例如由机器人)在一个动作中同时填充多个网络。
实施例方案
现在将描述用于执行本发明的方法的一系列示例性方案。应当理解,这些方案仅作为示例性的,也可使用不同的试剂或条件。
制备凝胶以建立血管支架
为了抑制胶原蛋白的过早聚合,在冰上进行制备凝胶的步骤。在该方法中,凝胶由4mg/ml胶原蛋白i(amsbiocultrex3dcollagenirattail,5mg/ml,cat.3447-020-01),100mmhepes(lifetechnologies,15630-122)和3.7mg/mlnahco3(sigma,cat.s5761-500g)组成。将胶原蛋白与hepes和nahco3混合,并将其分配至如图8所示的微流体网络的类器官隔间的凝胶入口中,并在37℃孵育至少20分钟。凝胶体积将取决于实际应用,但可将少至1μl的胶原蛋白凝胶分配至装置中—在该方法中,胶原蛋白凝胶将产生杯形形状(即具有凹形上表面),这之后有助于定位类器官、组织或细胞聚集体。
将内皮细胞接种至微通道
在凝胶化之后,将内皮细胞(例如,huvec或任何其他内皮细胞源)作为合适培养基(例如来自promocell的内皮细胞生长培养基mv2)中的单细胞悬浮液分配至一个或两个微通道的微通道入口中。适当地,应以至少0.5x106/ml的浓度将2μl内皮细胞分配至每个微通道。当需要两个微通道都血管化时,有如下两种主要的接种方法:
1.连续接种:在该方法中,以至少0.5x10e6/ml的浓度将2μl内皮细胞分配至第一微通道中。在37℃的培养箱中,将板平放至少15分钟,以帮助内皮细胞粘附至凝胶。此后,向同一入口再分配20μl培养基,以避免通道内部的蒸发。接下来,进行第二微通道的接种。以至少0.5x106/ml的浓度将另外2μl内皮细胞分配至第二微通道中。将板平放至少15分钟,以帮助内皮细胞粘附至凝胶。此后,向同一入口再分配20μl培养基,以避免通道内部的蒸发。在静止状态下,在37℃孵育所述板至少1小时。接下来,再向每个微通道入口添加30μl培养基,并向每个微通道出口分配50μl培养基。将板放置在摇摆平台上,最大倾斜角度为7°,间隔为8分钟。
2.同时接种:在该方法中,以至少1x106/ml的浓度将2μl内皮细胞分别分配至两个微通道的每个入口。板在37℃的孵育器中保持静止。15分钟后,向两个入口中的每一个再添加20μl培养基,并在37℃孵育所述板至少1小时。接下来,向每个微通道入口再添加30μl培养基,并向每个微通道出口分配50μl培养基。将板放置在摇摆平台上,最大倾斜角度为7°,间隔为8分钟。
在同时接种的可选方法中,以至少为1x106/ml的浓度将2μl内皮细胞分别分配至两个微通道的每个入口。将板放置在37℃的孵育器中的180°旋转装置(每分钟旋转3次)上。15分钟后,向每个入口再添加20μl培养基,并在37℃的180°旋转装置上孵育所述板至少1小时。接下来,向每个微通道入口再添加30μl培养基,并向每个微通道出口分配50μl培养基。将板放置在摇摆平台上,最大倾斜角度为7°,间隔为8分钟。
根据内皮细胞的行为培养血管1天或2天或3天或更多天,随后诱导血管生成,或者将任何类器官/组织/细胞聚集体放置在凝胶上。在该过程中,可添加促血管生成组合物,以建立血管生成因子的梯度,从而刺激朝向因子来源的发芽形成。
例如,促血管生成因子(例如血管内皮生长因子(vegf)、单核细胞趋化蛋白-1(mcp-1)、肝细胞生长因子(hgf)、碱性成纤维细胞生长因子(bfgf)、肉豆蔻佛波醇乙酸酯(pma)、1-磷酸-鞘氨醇(s1p))可单独或组合用于形成发芽。
在该方法中,可将内皮培养基(例如mv2)中的至少20μl(例如最高至50μl)的促血管生成因子混合物(例如vegf50ng/ml、bfgf20ng/ml、s1p500nm、pma20ng/ml)分配至凝胶入口,以诱导形成发芽。通过血管生成因子混合物诱导血管至少1天,但根据所需的发芽程度,可延长至4天或更长时间。这会在芯片上产生血管床,易于容纳细胞、细胞聚集体、类器官或其他组织。
制备移植体组织:
举例来说,在胚胎第11天从胚胎中分离小鼠胚胎肾脏雏形。所有分离步骤均在补充有1x青霉素/链霉素、25mmhepes和10%fcs的dmem培养基中进行。在该方法中,将20-30μl的第一体积的培养基(培养基:补充有10%fcs、1x谷氨酸、1x1x青霉素/链霉素的dmem)分配至凝胶表面上。
为了将肾脏移植体转移至凝胶中,可以使用毛细管微量移液管。这种通过移液转移组织的方法可以防止组织损伤。转移的组织将沉在板的底部,在凝胶入口开口的中央。如果组织的位置不在凝胶的中央上,可使用小而窄的针(例如bdmicrofine1ml注射器)或精细镊子(例如dumont#5)通过将组织推至所需位置来调节位置。
移植体-血管共培养
可在第0天或在诱导发芽后的任何其他天将移植体组织放置在凝胶的顶部。
移植体组织可在具有促血管生成因子混合物或不具有促血管生成因子混合物的条件下与组织特异性培养基放置在一起。在共培养中,在缺少促血管生成混合物的条件下,组织细胞可能进一步吸引发芽,例如,如果组织本身产生促血管生成因子。在将移植体放入共培养后将促血管生成因子加至培养基中的情况下,这些因子可刺激组织的血管。
可每隔几天培养并监测移植体。可以每天或每二天或甚至每三天通过微通道进行培养基更换。任选地,每次仅可更换一半的培养基,以避免给共培养中的细胞造成负担(在全部培养基体积更换时由突然的ph、渗透压、氧张力等的变化而引起的负担)。
在将组织放置在细胞培养装置中几个小时后,组织附着至凝胶的顶部,覆盖大部分的凝胶表面。为保持组织的位置,可将ecm覆盖物分配至组织的顶部(例如,可以使用与培养基混合的胶原蛋白、基质胶或纤维蛋白凝胶)。例如:在初始培养12-24小时后,从培养基通道中除去所有培养基。将基质胶与冰冷培养基混合,调节基质胶浓度至1-5mg/ml。将20μl的凝胶/培养基混合物分配至组织的顶部,在37℃孵育10分钟。之后,再将30μl温热培养基分配至基质胶覆盖物的顶部。
本文的细胞培养装置包括类器官、组织移植体或其它连接至芯片上的血管网络的生物组织。血管化的程度可以使用显微镜监测,例如用通过荧光标记的内皮细胞(例如用rfp标记的huvec)通过显微镜监测。通过这样的方法产生的系统能够用于任何所需的分析方法,例如本文所述的那些分析方法,在这些分析方法中研究了测试化合物对组织的作用。
上文描述的内容的目的在于教导本领域的普通技术人员如何实施本发明,并不旨在详细描述在阅读本说明书后显而易见的所有修改和变化。然而,本发明的目的在于将所有此类修改和变化均包括在本发明的范围内,本发明的范围由所附的权利要求书所限定。
- 还没有人留言评论。精彩留言会获得点赞!