细胞组织的制造方法及多孔膜与流程
本发明涉及一种细胞组织的制造方法及用于制造细胞组织的多孔膜。
背景技术:
已知有一种为了将细胞或细胞组织移植到活体内而使用的、浓缩细胞的过滤器、用于增殖细胞的支架材料、植入细胞并移植到活体内的种植材料。
例如日本特开2012-006010号公报中公开了一种按大小分离目标细胞的复合多孔膜。例如国际公开第2006/093207号中公开了一种孔以蜂窝状排列在细胞培养面的培养基材。例如日本特开2005-110709号公报中,作为植入骨髓间充质干细胞并分化诱导为成骨细胞之后移植到骨缺损部的骨填补材料,公开了一种将贯穿孔和连通孔组合而成的骨填补材料。例如日本特开2004-216119号公报中,作为供细胞植入并增殖的支架材料,公开了一种具有长形状的孔在厚度方向上沿面方向并列配置且各孔间用小孔连通的结构的多孔性支撑体。例如日本特开2008-199962号公报中公开了一种在具有三维网格结构的多孔膜表面配置有多个细胞粘接性区域及围绕细胞粘接性区域的细胞非粘接性区域的球状体形成用基材。例如日本特开2001-523483号公报中,作为用于植入骨原细胞并增殖的支架材料(scaffold),公开了一种包含相互连结的孔而成的多孔性聚合物支架。例如日本特开2008-307180号公报中,作为将干细胞注射到结构体内部并移植到活体内的移植材料,公开了一种层合以纵横格子状配置的支柱而成的支架。例如日本专利第4437227号公报中公开了一种人造血管,其包含由非水溶性聚合物构成的筒状多孔体、包覆筒状多孔体的内表面的血管内皮细胞、包覆筒状多孔体的外表面的血管平滑肌细胞。
技术实现要素:
发明要解决的技术课题
目前,皮肤、软骨等结构相对简单的细胞组织被人工创造,并在移植治疗现场使用。另一方面,正期待各种细胞由复杂结构形成的器官、代替例如肝脏、胰脏等的人造细胞组织的实用化,为此,需要制造在功能上配置器官特异性细胞且具备血管网和淋巴管网的细胞组织。并且,作为代替动物实验或临床试验的试验用细胞组织,也期待具有类似于活体内的器官的结构的细胞组织。
本发明基于上述情况而完成。
本发明的目的在于提供一种制造具备微米级的网络结构的细胞组织的制造方法及用于制造具备微米级的网络结构的细胞组织的多孔膜。
用于解决技术课题的手段
用于解决上述课题的具体方法包括以下方式。
[1]一种细胞组织的制造方法,其包括在具有设置于表面上的多个开孔和连通彼此相邻的开孔之间的连通孔的多孔膜的开孔以及连通孔的内部培养具有饲养能力的细胞的培养工序。
[2]根据[1]所述的细胞组织的制造方法,其中,培养工序为在开孔及连通孔的内部共同培养具有饲养能力的细胞和血管内皮细胞及淋巴管内皮细胞中的至少任一种的培养工序。
[3]根据[1]所述的细胞组织的制造方法,其中,培养工序为在开孔及连通孔的内部共同培养具有饲养能力的细胞及形成实质器官的细胞的培养工序。
[4]根据[1]所述的细胞组织的制造方法,其中,培养工序为在开孔及连通孔的内部共同培养具有饲养能力的细胞、血管内皮细胞和淋巴管内皮细胞中的至少任一种、及形成实质器官的细胞的培养工序。
[5]根据[1]至[4]中任一项所述的细胞组织的制造方法,其中,具有饲养能力的细胞为间充质干细胞及成纤维细胞中的至少任一种。
[6]根据[1]至[5]中任一项所述的细胞组织的制造方法,其中,多个开孔以蜂窝状配置于多孔膜的表面上。
[7]根据[1]至[6]中任一项所述的细胞组织的制造方法,其中,连通孔遍及多孔膜的整个面方向地设置成大致相同的深度。
[8]根据[1]至[7]中任一项所述的细胞组织的制造方法,其中,连通孔的孔径相对于接种到多孔膜的细胞的长径在50%~500%的范围。
[9]根据[1]至[8]中任一项所述的细胞组织的制造方法,其中,连通孔的孔径在5μm~50μm的范围。
[10]根据[1]至[9]中任一项所述的细胞组织的制造方法,其中,连通孔的孔径的变动系数为30%以下。
[11]根据[1]至[10]中任一项所述的细胞组织的制造方法,其中,开孔在多孔膜的面方向上的长径在10μm~100μm的范围。
[12]根据[1]至[11]中任一项所述的细胞组织的制造方法,其中,开孔的深度在10μm~100μm的范围。
[13]根据[1]至[12]中任一项所述的细胞组织的制造方法,其中,开孔的开口直径在5μm~90μm的范围。
[14]根据[1]至[13]中任一项所述的细胞组织的制造方法,其中,开孔的开口直径的变动系数为20%以下。
[15]根据[1]至[14]中任一项所述的细胞组织的制造方法,其中,该方法在培养工序之前包括离心处理工序,该离心处理工序中,多孔膜的多个开孔在开口的一侧的表面接种细胞之后,在从接种有细胞的一侧的表面朝向相反的一面的方向上施加离心力以使细胞向多个开孔的内部移动。
[16]一种多孔膜,其具有设置于表面上的多个开孔及连通彼此相邻的开孔之间的连通孔,所述多孔膜中,开孔在多孔膜的面方向上的长径在20μm~100μm的范围。
[17]一种多孔膜,其具有设置于表面上的多个开孔及连通彼此相邻的开孔之间的连通孔,所述多孔膜中,开孔的深度在20μm~100μm的范围。
[18]根据[16]或[17]所述的多孔膜,其中,开孔的开口直径在5μm~90μm的范围。
[19]根据[16]至[18]中任一项所述的多孔膜,其中,连通孔的孔径在5μm~50μm的范围。
[20]根据[16]至[19]中任一项所述的多孔膜,其中,多个开孔以蜂窝状配置于多孔膜的表面上。
发明效果
根据本发明,提供一种制造具备微米级的网络结构的细胞组织的制造方法及用于制造具备微米级的网络结构的细胞组织的多孔膜。
附图说明
图1a是表示多孔膜的结构的立体图。
图1b是从图1a中的开口面侧观察的俯视图。
图1c是沿图1b中的c-c线的剖视图。
图1d是沿图1b中的d-d线的剖视图。
图2是表示多孔膜的制造方法的一例的示意图。
图3是多孔膜的扫描型电子显微镜图像。
图4是培养装置的部件及培养装置的一例。
图5a是多孔膜的剖面及表面的扫描型电子显微镜图像。
图5b是多孔膜的剖面及表面的扫描型电子显微镜图像。
图6是从间充质干细胞分化诱导的细胞中的肌动蛋白的荧光免疫染色图像。
图7a是单独培养了血管内皮细胞或共同培养了间充质干细胞和血管内皮细胞的培养第3天的细胞中的cd31的荧光免疫染色图像(低倍率)。
图7b是同样培养第3天的细胞中的cd31的荧光免疫染色图像(高倍率)。
图7c是同样培养第7天的细胞中的cd31的荧光免疫染色图像(高倍率)。
图7d是表示共同培养间充质干细胞和血管内皮细胞时的网络的总长及总面积的曲线图。
图8a是共同培养间充质干细胞或成纤维细胞和血管内皮细胞的培养第3天的细胞中的cd31的荧光免疫染色图像。
图8b是同样培养第7天的细胞中的cd31的荧光免疫染色图像。
图8c是表示培养第3天的网络的总长及总面积的曲线图。
图8d是表示培养第7天的网络的总长及总面积的曲线图。
图9a是使用不同开孔尺寸的多孔膜共同培养间充质干细胞和血管内皮细胞的培养第3天的细胞中的cd31的荧光免疫染色图像(低倍率)。
图9b是同样培养第3天的细胞中的cd31的荧光免疫染色图像(高倍率)。
图9c是同样培养第7天的细胞中的cd31的荧光免疫染色图像(低倍率)。
图9d是同样培养第7天的细胞中的cd31的荧光免疫染色图像(高倍率)。
图9e是表示培养第3天及第7天的网络的总长及总面积的曲线图。
图10a是同时共同培养3种细胞的培养第3天的荧光图像。
图10b是同样培养第3天的细胞中的cd31的荧光免疫染色图像。
图11a是阶段性地共同培养3种细胞的共同培养第3天的荧光图像。
图11b是同样共同培养第3天的细胞中的cd31的荧光免疫染色图像。
图11c是表示共同培养第3天的、同时共同培养、阶段性共同培养的每一个的网络的总长及总面积的曲线图。
具体实施方式
以下,对本发明的实施方式进行说明。这些说明及实施例例示实施方式,但并不限定发明的范围。
在本发明中,使用“~”表示的数值范围表示包含“~”前后所记载的数值分别作为下限值及上限值的范围。
在本发明中,术语“工序”不仅为独立的工序,也可以为不能与其他工序明确区别的情况下,只要能够实现该工序所期望的目的,则包含在本术语中。
在本发明中,在言及组合物中的各成分的量的情况下,在组合物中存在多种属于各成分的物质的情况下,只要没有特别指明,则指组合物中存在的该多种物质的合计量。
在本发明中,以百分率表示变动系数。变动系数是对某一细胞群将标准偏差除以平均而得的值,并且是表示该集团的偏差的程度的指标。
<多孔膜>
本实施方式的细胞组织的制造方法为在活体外制造细胞组织的方法包括在具有设置于表面上的多个开孔和连通彼此相邻的开孔之间的连通孔的多孔膜的开孔及连通孔的内部培养细胞的培养工序。首先,对用于制造细胞组织的多孔膜进行说明。本实施方式的多孔膜作为用于细胞植入并形成组织的支架而发挥功能。
本实施方式的多孔膜具有设置于表面上的多个开孔和连通彼此相邻的开孔之间的连通孔。多孔膜所具备的开孔及连通孔的壁面成为细胞植入的支架。接种到本实施方式的多孔膜的细胞植入在开孔及连通孔的内部,并形成具备微米级的网络结构的细胞组织。
以下,参考附图对多孔膜的一例进行说明。在各附图中,对相同或等效的构成元件及部分赋予相同的参考符号。在以下说明中,“面方向”是指多孔膜的主面方向,“厚度方向”是指多孔膜的厚度方向。在以下说明中,“长径”是指轮廓上的任意2点之间距离中的最大长度,但是,在指定了方向的情况下,是指该方向的任意的2点之间距离中的最大长度。在以下说明中,“开口的中心”是指将开口取为面方向的二维图形时的重心。
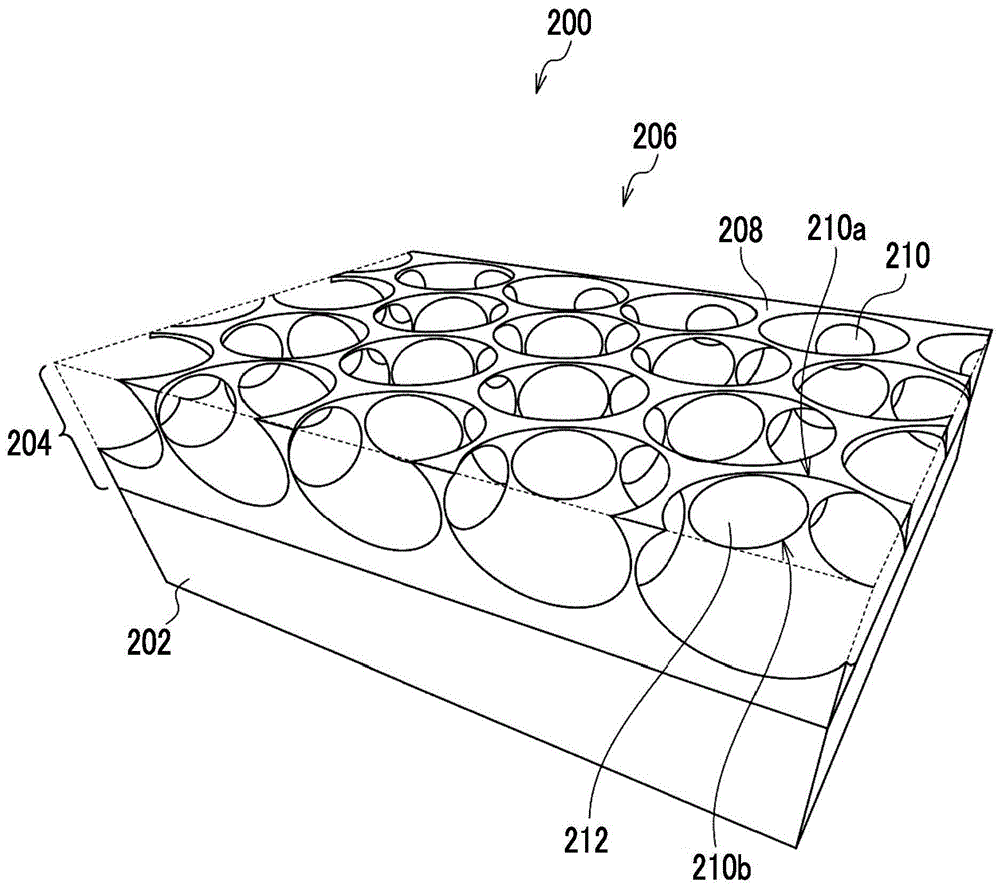
图1a是表示多孔膜的结构的立体图,图1b是从图1a中的开口面侧观察的俯视图,图1c是沿图1b中的c-c线的剖视图,图1d是沿图1b中的d-d线的剖视图。图1a~图1d中示出作为本实施方式的一例的多孔膜200。
多孔膜200为具备沿面方向配置有多个开孔210的多孔层204及支撑多孔层204的支撑体202的层叠体。作为其他例子,多孔膜200不具备支撑体202,也可以为只是多孔层204的单层体。
多孔膜200的多孔层204中,在整个面方向上配置有开孔210。但是,当具有细胞无法与多孔层204接触的区域时,无需在该区域中配置开孔210。
多孔膜200的开口面206为多个开孔210开口的一侧的表面,并且为接种细胞的一侧的表面。在开口面206中,彼此相邻的开孔210的开口之间通过在开口部210a之间延伸的平坦部208而分离。通过开口面206的开孔210的开口,向开孔210及连通孔212的内部供给液体培养基。
各开孔210为不贯穿多孔层204的有底孔。作为其他例子,各开孔210也可以为贯穿多孔层204并将支撑体202的表面作为底面的有底孔。在多孔膜200为多孔层204的单层体的例子中,各开孔210可以为未贯穿多孔层204的有底孔,也可以为贯穿多孔层204的贯穿孔。
作为每个开孔210的形状,例如可列举切下球体的一部分而获得的球缺形状、圆筒形状、圆柱形状、或棱柱形状。作为每个开孔210的开口的形状,例如可列举圆形、椭圆形或多边形。
多个开孔210规则地配置,具体而言,以蜂窝状配置。作为其他例子,多个开孔210也可以以格栅状或面心格栅状配置。多个开孔210的配置也可以是随机的,但从使面方向上的开孔210的密度均匀,且提高多孔膜200中由细胞形成的组织的均匀性的观点考虑,优选多个开孔210规则的配置。规则性配置可间断或可偏移,优选地,以在所有方向上没有间隙地方式连续地重复。蜂窝状的配置是将平行六边形(优选为正六边形)或与此类似的形状作为单位,并且开口的重心位于这些图形的顶点及对角线的交点的配置。格子状的配置为将平行四边形(当然包括正方形、长方形、菱形。优选为正方形)或与此类似的形状作为单位,并且开口的重心位于这些图形的顶点的配置。面心格子状的配置是将平行四边形(当然包括正方形、长方形、菱形。优选为正方形)或与此类似的形状作为单位,并且开口的重心位于这些图形的顶点及对角线的交点的配置。规则地配置的标准与作为配置的单位的平行六边形或平行四边形的面积相关,其变动系数为10%以下。
在多孔膜200中,彼此相邻的开孔210之间在多孔层204的内部通过连通孔212而连通。1个开孔210优选与相邻的所有开孔210连通。多个开孔210以蜂窝状配置的多孔膜200中,1个开孔210优选与相邻的6个开孔210连通,即,1个开孔210优选具有6个连通孔212。
在多孔膜200中,彼此相邻的开孔210之间以使每个壁面的一部分连续的方式配置,连通孔212是被开孔210之间的连结部210b包围的孔。作为其他例子,相邻的开孔210之间是独立的,作为筒状的空隙的连通孔212可以将相邻的开孔210彼此连接。
以下,对多孔膜200的结构的尺寸进行说明。
多个开孔210具有能够供接种到多孔膜200的细胞进入并植入的大小。接种到多孔膜200中的细胞的长径例如为10μm~50μm。
开孔210的开口直径da相对于接种到多孔膜200的细胞的长径优选为50%以上,更优选为80%以上,进一步优选为120%以上。通过为50%以上(更优选为80%以上、进一步优选为120%以上),接种到多孔膜200的细胞能够进入开孔210的内部。具体而言,开孔210的开口直径da优选为5μm以上,更优选为8μm以上,进一步优选为12μm以上。开孔210的开口直径da根据开孔210的优选的配置及大小的关系,优选为90μm以下,更优选为70μm以下,进一步优选为50μm以下。开口直径da为开孔210的开口的长径,开口直径da的范围测量任意选择的10个以上的开口的开口直径并进行确认。
开孔210的开口直径da的变动系数优选为20%以下,越小越优选。开口直径da的变动系数越小,在多孔膜200中由细胞形成的组织的的均匀性越高。
在多孔膜200的细胞培养区域中,开口面206的总面积中所占的开孔210的开口的合计面积的比例优选为20%~90%,更优选为30%~80%,进一步优选为40%~70%。
开孔210的面方向上的长径db优选为10μm~100μm的范围,更优选为20μm~80μm的范围,进一步优选为30μm~60μm的范围。通过为10μm以上(更优选为20μm以上、进一步优选为30μm以上),可确保增殖性的细胞增殖的空间,并且,可确保共同培养的多种细胞共存的空间。通过为100μm以下(更优选为80μm以下、进一步优选为60μm以下),能够形成微米级的网络结构。长径db是在该开口的长轴上(即开口直径da上)且厚度方向上切割开孔210而得的切割面上出现的开孔210的轮廓的面方向的长径。在面方向上各向同性的形状且大致相同(包括相同)的大小的多个开孔210以将正六边形或与此类似的形状作为单位的蜂窝状配置,彼此相邻的开孔210彼此以使每一个壁面的一部分连续的方式配置的多孔膜200中,将彼此相邻的开口之间的中心间距离p1视为长径db。在这种情况下,长径db的范围在使角度偏移大致60度(包括60度)的3个方向上测定并确认合计10个以上的中心间距离p1。关于除上述配置以外的多孔膜,按照上述并根据开孔210的配置的规则性来确认。
开孔210的深度dc优选为10μm~100μm的范围,更优选为20μm~80μm的范围,进一步优选为30μm~60μm的范围。通过为10μm以上(更优选为20μm以上、进一步优选为30μm以上),可确保增殖性的细胞增殖的空间,并且可确保共同培养的多种细胞共存的空间。通过为100μm以下(更优选为80μm以下、进一步优先为60μm以下),由此能够形成微米级的网络结构。深度dc为在各开孔210中从开口面206到开孔210的最深部的距离。多个开孔210以将正六边形或与此类似的形状作为单位的蜂窝状配置的多孔膜200中,在将开口的中心之间连接的线上沿厚度方向切割而得的剖面上出现的开孔210的轮廓中,将从开口面206到开孔210的最深部的距离作为深度dc。在这种情况下,深度dc的范围形成使切割线的角度偏移大致60度(包括60度)的3个切割面并且合计测定并确认10个以上。
连通孔212的孔径dd相对于接种到多孔膜200的细胞的长径优选为50%~500%的范围。连通孔212的孔径dd相对于接种的细胞的长径为50%以上,由此能够使细胞在彼此相邻的开孔210之间移动。从该观点考虑,连通孔212的孔径dd相对于接种的细胞的长径更优选为80%以上,进一步优选为120%以上。另一方面,连通孔212的孔径dd相对于接种的细胞的长径为500%以下,由此植入在连通孔212的细胞数变得适当。从该观点考虑,连通孔212的孔径dd相对于接种的细胞的长径,更优选为400%以下,进一步优选为300%以下。
从上述观点考虑,连通孔212的孔径dd优选为5μm~50μm的范围,更优选为8μm~45μm的范围,进一步优选为12μm~40μm的范围。孔径dd是在将开口的中心之间相连的线上沿厚度方向切割而得的切割面上出现的连通孔212的轮廓中厚度方向的长径。多个开孔210以将正六边形或与此类似的形状作为单位的蜂窝状配置的多孔膜200中,孔径dd的范围形成使切割线的角度偏移大致60度(包括60度)的3个切割面,并且合计测定并确认10个以上。关于除上述配置以外的多孔膜,按照上述并根据开孔210的配置的规则性形成切割面并进行确认。
连通孔212的孔径dd的变动系数优选为30%以下,更优选为20%以下,越小越优选。孔径dd的变动系数越小,多孔膜200中由细胞形成的组织的均匀性越高。
连通孔212优选在整个面方向上以大致相同(包括相同)的深度设置。由此,可确保在多孔膜200中由细胞形成的组织的均匀性。关于大致相同的标准,在用于测定孔径dd的切割面上,从开口面206至连通孔212的最深部的距离的变动系数为10%以下。
平坦部208的宽度w优选比细胞的长径窄。由此,减小在平坦部208上培养的细胞的比例,并增大在开孔210及连通孔212的内部培养的细胞的比例。宽度w是在开口的中心之间测定的平坦部208的长度。
以下,对多孔膜200的原材料进行说明。从细胞的粘接性的观点、活体内的与移植部位的亲和性的观点、活体内的分解或吸收的难易的观点等考虑来选择多孔膜200的原材料。
作为多孔层204的原材料,从通过后述制造方法制造多孔膜200的观点考虑,优选能够溶解于疏水性的有机溶剂中的疏水性聚合物。疏水性的有机溶剂为在25℃的水中的溶解度为10(g/100g水)以下的液体。
作为疏水性聚合物,可列举聚苯乙烯、聚丙烯酸酯、聚甲基丙烯酸酯、聚丙烯酰胺、聚甲基丙烯酰胺、聚氯乙烯、聚偏氯乙烯、聚偏氟乙烯、聚六氟丙烯、聚乙烯基醚、聚乙烯基咔唑、聚乙酸乙烯酯、聚四氟乙烯、聚酯(例如、聚对苯二甲酸乙二醇酯、聚萘二甲酸乙二醇酯、聚丁二酸乙二醇酯、聚丁二酸丁二醇酯、聚乳酸、聚-3-羟基丁酸酯等)、聚内酯(例如聚己内酯等)、聚酰胺或聚酰亚胺(例如尼龙、聚酰胺酸等)、聚氨酯、聚脲、聚丁二烯、聚碳酸酯、聚芳烃、聚砜、聚醚砜、聚环己烷衍生物、纤维素酰化物(例如、三乙酰纤维素、醋酸丙酸纤维素、醋酸丁酸纤维素)等聚合物。从溶剂中的溶解性、光学物性、电气物性、膜强度、弹性等观点考虑,这些聚合物根据需要也可以作为均聚物、共聚物、聚合物共混物或聚合物合金。这些聚合物可单独使用1种或混合2种以上而使用。从活体吸收性的观点考虑,优选为聚乳酸、聚己内酯、聚-3-羟基丁酸酯等。
支撑体202的原材料可以与多孔层204相同也可以不同。作为支撑体202的原材料可列举合成树脂、玻璃、金属等。在用于制造细胞组织时或制造细胞组织之后从支撑体202剥离多孔层204的情况下,优选支撑体202的原材料为与多孔层204不同的原材料。
多孔膜200例如通过依次进行下述工序(a)~工序(e)的制造方法来制造。图2是表示工序(a)~工序(e)中的多孔膜200的剖面的示意图。
[工序(a)]
准备将构成多孔层204的疏水性聚合物溶解于溶剂中而得的涂布液,并将涂布液涂布于支撑体202上而在支撑体202上形成涂膜204a。
涂布液通过混合疏水性聚合物、溶剂、两亲性化合物而制备。作为溶剂,优选疏水性聚合物的良溶剂与疏水性的液体的混合溶剂或作为疏水性聚合物的良溶剂的疏水性有机溶剂。作为后者,可列举三氯甲烷、二氯甲烷、氯仿等卤素类溶剂,也可以在这些溶剂中混合作为疏水性的液体的正己烷、环己烷、正戊烷、正辛烷、正庚烷等烃化合物而使用。
两亲性化合物为具有亲水性基和疏水性基两者的化合物。通过将两亲性化合物掺和到涂布液中,容易在涂膜的表面形成水滴。并且,通过用两亲性化合物控制疏水性聚合物相对于溶剂的分散状态,能够更易于控制水滴的生产。作为两亲性化合物,可列举市售的大量的表面活性剂、二聚体和三聚体等低聚物、聚合物等高分子化合物。作为两亲性化合物,具体而言,例如可列举将聚丙烯酸骨架作为主链,具有作为亲油性侧链的长链脂肪族基(例如十二烷基)及作为亲水性侧链的羧基的化合物;聚乙二醇/聚丙二醇嵌段共聚物;磷脂质;等。
在涂布液中,疏水性聚合物的浓度优选为0.1质量%~10质量%,两亲性化合物的浓度优选为0.01质量%~1质量%。
[工序(b)]
使加湿空气在涂膜204a的整个表面上流动,通过结露现象在涂膜204a上形成水滴210s。此时,控制td和ts中的至少一个,以使在涂膜204a的附近流动的加湿空气的露点td与涂膜204a的表面温度ts的差分δt(=td-ts)满足下述式(1)。
式(1):3℃≤δt≤30℃
[工序(c)]
通过继续供给加湿空气来形成水滴210s。每个水滴210s形成为彼此大致相同(包括相同)的大小。水滴210s随着涂膜204a中所包含的溶剂的蒸发而通过横向毛细作用力而配置成蜂窝状,并且渗入涂膜204a中。与此并列地,随着涂膜204a中所包含的溶剂的蒸发,疏水性聚合物向水滴210s的周围析出。
[工序(d)]
继续供给加湿空气,并使水滴210s生长,直到在涂膜204a中水滴210s彼此隔着两亲性化合物的膜220而密接为止。
[工序(e)]
与溶剂的蒸发同时或使溶剂蒸发之后,使水滴210s蒸发,并将水滴210s进入到涂膜204a中的部分留作开孔210,同时使隔开密接的水滴210s彼此的两亲性化合物的膜220破裂。如此形成多个开孔210配置成蜂窝状且在内部连结的多孔层204。
经过以上工序(a)~工序(e),获得多孔层204和支撑体202的层叠体。可以将多孔层204和支撑体202的层叠体作为多孔膜200,也可以从支撑体202剥离多孔层204并将多孔层204的单层体作为多孔膜200,也可以从支撑体202剥离多孔层204并粘贴到另一支撑体而作为多孔膜200。也可以对接种多孔膜200的细胞的一侧的表面实施基于等离子体放电等的电荷处理。图3是从开口面侧利用扫描型电子显微镜拍摄经过工序(a)~工序(e)制造的多孔膜的一例的照片。
开孔210的开口直径da、长径db和深度dc、连通孔212的孔径dd能够通过调整水滴210s的大小来进行控制。水滴210s的大小的调整能够通过涂膜204a的膜厚、加湿空气中所含的水蒸气量及使水滴210s蒸发的时机而进行调整。
根据上述的制造方法,不使用模具或掩模就能够制造多个开孔以蜂窝状高均匀性地配置的多孔膜。上述的制造方法的详细内容例如记载于日本特开2007-291367号公报、日本特开2009-256624号公报、日本特开2011-074140号公报、日本特开2011-202100号公报中。多孔膜200还能够通过蚀刻、喷砂、压制成形等来制造。
<细胞组织的制造方法>
本实施方式的细胞组织的制造方法为在活体外制造细胞组织的制造方法,并且包括在本发明的多孔膜的开孔及连通孔的内部培养细胞的培养工序。以下,将多孔膜的开孔和连通孔总称为“孔”。
根据本实施方式,本发明的多孔膜所具备的孔充当细胞以微米级的网状排列的轨道,因此形成具备微米级的网络结构的细胞组织。具备微米级的网络结构的细胞组织作为活体内的移植材料,并且作为代替动物实验或临床试验的试验用细胞组织是有用的。细胞组织可以用于每个多孔膜,也可以去除多孔膜的开口周围的平坦部并从多孔膜的孔内取出而使用。细胞组织还能够层叠多个而使用。
本实施方式的培养工序中包括以下实施方式(1)~(4)。
实施方式(1):单独培养具有饲养能力的细胞的培养工序。其中,具有饲养能力的细胞可以为1种,也可以为2种以上。
根据实施方式(1),提供具备饲养细胞的网络结构的细胞组织。通过实施方式(1)制造的细胞组织例如可用作在活体外进行细胞培养时的支架材料或移植到活体内并在移植部位再生组织的支架材料。
作为具有饲养能力的细胞,可列举间充质干细胞、成纤维细胞。间充质干细胞(mesenchymalstemcell,msc)是能够分化为肌细胞、脂肪细胞、软骨细胞等的成体干细胞,还已知具有饲养能力。在培养工序中将对间充质干细胞的分化诱导因子添加到培养基中,还能够使间充质干细胞分化为体细胞(例如肌细胞、脂肪细胞、软骨细胞)。在这种情况下,提供例如具备微米级的网络结构的肌肉组织、脂肪组织或软骨组织等。
实施方式(2):共同培养具有饲养能力的细胞及血管内皮细胞和淋巴管内皮细胞中至少任一个的培养工序。
根据实施方式(2),提供具备血管内皮细胞或淋巴管内皮细胞的网络结构的细胞组织。通过实施方式(2)制造的细胞组织例如用作在活体外进行体细胞的培养时的支架材料或移植到活体内并在移植部位再生组织的支架材料。
作为血管内皮细胞,可列举来自于脐静脉、脐动脉、主动脉、冠状动脉、肺动脉、肺微血管、皮肤微血管等的血管内皮细胞、从多能干细胞分化诱导的血管内皮细胞。作为淋巴管内皮细胞,可列举来自于皮肤微淋巴管、肺微淋巴管等的淋巴管内皮细胞、从多能干细胞分化诱导的淋巴管内皮细胞。通过在培养工序中改变培养基组成,能够控制血管内皮细胞或淋巴管内皮细胞的增殖、迁移、管形成。
实施方式(3):共同培养具有饲养能力的细胞和形成实质器官的细胞的培养工序。
根据实施方式(3),提供具备微米级的网络结构的细胞组织。通过实施方式(3)制造的细胞组织例如用于移植到活体内并补充组织或器官的功能。此外,通过实施方式(3)制造的细胞组织用作代替动物实验或临床试验的试验用细胞组织。
作为实质性器官(parenchymalorgan),可列举肝脏、胰脏、肾脏、脾脏、心脏、肺、乳腺组织、脂肪组织、卵巢、睾丸、胸腺等,作为形成实质器官的细胞,形成这些器官的实质细胞、上皮细胞、腺细胞、脂肪细胞、这些细胞的干细胞或前体细胞等。形成实质器官的细胞可以使用1种,也可以2种以上。作为形成实质器官的细胞的2种以上的组合,例如可列举肝细胞和胆管上皮细胞;胰腺α细胞、胰腺β细胞及胰腺δ细胞;i型肺泡上皮细胞和ii型肺泡上皮细胞;乳腺腺细胞和乳腺导管上皮细胞;等。
作为形成实质器官的细胞,还可列举多能干细胞。多能干细胞是具有能够在保持未分化状态的同时增殖的“自主复制能”和能够分化成所有三胚层系列的“多分化能”的未分化细胞。作为多能干细胞,例如可列举胚胎干细胞(embryonicstemcell:es细胞)、诱导多能干细胞(inducedpluripotentstemcell:ips细胞)、胚胎生殖细胞(embryonicgermcell:eg细胞)、胚胎癌性细胞(embryonalcarcinomacell:ec细胞)、多能成体祖细胞(multipotentadultprogenitorcell:map细胞)、成体多能干细胞(adultpluripotentstemcell:aps细胞)、muse细胞(multi-lineagedifferentiatingstressenduringcell:多系分化持续应激细胞);等。将在培养工序中分化诱导为目标体细胞的分化诱导因子添加到培养基,并使多能干细胞分化为体细胞。
实施方式(4):共同培养具有饲养能力的细胞、血管内皮细胞和淋巴管内皮细胞中的至少任一种、及形成实质器官的细胞的培养工序。
根据实施方式(4),提供在实质器官的细胞组织的表面或内部具备血管内皮细胞或淋巴管内皮细胞的网络结构的细胞组织。通过实施方式(4)制造的细胞组织例如用于移植到活体内并补充组织或器官的功能。此外,通过实施方式(4)制造的细胞组织用作代替动物实验或临床试验的试验用细胞组织。
实施方式(4)的培养工序可以为同时接种3种细胞并同时共同培养3种细胞的培养工序,也可以是阶段性地接种3种细胞并阶段性地共同培养3种细胞的培养工序。作为后者,例如,同时接种具有饲养能力的细胞及血管内皮细胞和淋巴管内皮细胞中的至少任一种,并且培养几天而形成血管内皮细胞或淋巴管内皮细胞的网络结构之后,接种形成实质器官的细胞并继续培养。
培养工序例如在将多个开孔开口的一侧的表面为上而将多孔膜载置于培养容器中,并将细胞悬浮液接种到多孔膜,并且与接种的细胞类型相匹配的培养条件下进行。作为载置多孔膜的培养容器,可列举作为细胞培养用而公知的所有培养容器。作为培养容器的材质,例如可列举树脂(例如、聚苯乙烯、聚碳酸酯、聚酯、丙烯腈-丁二烯-苯乙烯树脂)、玻璃、陶瓷、金属等。作为培养容器的形状,例如可列举多孔板、培养皿、微阵列用板、管、烧瓶、滚筒瓶、袋等。
本实施方式优选包括离心处理工序,在培养工序之前,将细胞接种到多孔膜的多个开孔开口的一侧的表面之后,沿着从接种有细胞的一侧的表面朝向相反的一面的方向施加离心力以将细胞移动到多个开孔的内部。接种到多孔膜的细胞通过离心处理工序转移到多孔膜的开孔内,因此在孔内培养的细胞的比例增大。
本实施方式中包括离心处理工序的情况下,为了易于实施离心处理工序,优选接种将细胞悬浮在相对少量的培养基中的细胞悬浮液并实施离心处理工序。然后,在离心处理工序之后在培养容器内追加培养基。
[培养基、培养条件]
本实施方式中使用的培养基根据成为培养对象的细胞类型从用于培养哺乳类细胞的公知的培养基中选择。作为具体的培养基,例如可列举在dmem(dulbecco'smodifiedeagle'smedium:杜氏改良eagle培养基)、dmem:f-12(dulbecco'smodifiedeaglemedium:nutrientmixturef-12)、emem(eagle'sminimalessentialmedium:伊格尔最小基本培养基)、memα(minimumessentialmediumalpha:极限必需培养基α)、bme(basalmediumeagle:基础细胞培养基)等基本培养基中添加细胞生长因子,根据细胞类型进行优化的培养基。这种培养基能够作为市售品而获得。本实施方式中使用的培养基可以根据共同培养的细胞类型混合多种培养基的培养基。培养基的ph例如为ph7.0~8.0,优选为ph7.3~7.4。
可以在培养基中添加通常添加的各种成分、例如fgf-2(fibroblastgrowthfactor-2:成纤维细胞生长因子-2)、tgf-β(transforminggrowthfactor-β:转化生长因子-β)、egf(epidermalgrowthfactor:表皮生长因子)、vegf(vascularendothelialgrowthfactor:血管内皮生长因子)等细胞生长因子;抗坏血酸、视黄酸等维生素或维生素衍生物;葡萄糖等糖原;氨基酸;亚硒酸钠、氯化钠等无机盐;转铁蛋白等蛋白质;胰岛素等激素;分化抑制因子;分化诱导因子;2-巯基乙醇、二硫苏糖醇等抗氧化剂;青霉素,链霉素等抗生素;等。为了在整个培养中将浓度保持在所期望的范围,上述成分可以在细胞的培养中补充到培养基。从抑制抗原性物质和感染源等混入细胞组织的观点考虑,培养基优选不含有血清及血清替代物。
在本实施方式中的培养工序中,优选适当地更换培养基。在一系列培养工序中使用的培养基也可以不是相同的组成。也可以一边根据共同培养的细胞类型而不同的组成的培养基一边持续进行培养。
共同培养具有饲养能力的细胞(第一细胞)及血管内皮细胞或淋巴管内皮细胞(第二细胞)时或共同培养具有饲养能力的细胞(第一细胞)和形成实质器官的细胞(第二细胞)时的两者的混合比例如为第一细胞的细胞数:第二细胞的细胞数=1:0.5~1:5,优选为第一细胞的细胞数:第二细胞的细胞数=1:1~1:3。
共同培养具有饲养能力的细胞(第一细胞)、血管内皮细胞或淋巴管内皮细胞(第二细胞)及形成实质器官的细胞(第三细胞)时的三者的混合比例如为(第一细胞的细胞数+第二细胞的细胞数):第三细胞的细胞数=1:1~1:10,优选为(第一细胞的细胞数+第二细胞的细胞数):第三细胞的细胞数=1:2~1:5。第一细胞与第二细胞的混合比优选为上述范围。
细胞相对于多孔膜的接种密度例如为1×103cells/cm2~1×106cells/cm2,优选为1×104cells/cm2~1×106cells/cm2。在共同培养多种细胞的情况下,优选将合计的接种密度设为上述范围。
本实施方式中的培养条件可以适用一般的条件。例如,可适用在温度37℃且5%(v/v)co2浓度的恒温箱内的培养。培养期间并无特别限制,优选在细胞的网络结构充分发达的期间进行培养。
实施例
以下列举实施例对发明的实施方式进行详细说明。发明的实施方式不应通过以下所示的实施例而限定性地解释。
以下,“pet”是指聚对苯二甲酸乙二醇酯(polyethyleneterephthalate),“pmma”是指聚甲基丙烯酸甲酯(polymethylmethacrylate),“pdms”是指聚二甲基硅氧烷(polydimethylsiloxane),“sem”是指扫描型电子显微镜(scanningelectronmicroscope),“fbs”是指胎牛血清(fetalbovineserum)。
以下,将多孔膜的开孔和连通孔总称为“孔”。
<多孔膜及培养装置的制作>
[多孔膜]
将聚乳酸5质量份、三氯甲烷94.5质量份、作为两亲性化合物的聚丙烯酰胺系的两亲性聚合物0.5质量份混合而制备了涂布液。将涂布液涂布于pet膜(膜厚188μm)上并在pet膜上形成了涂膜。使加湿空气流过涂膜的整个表面,通过结露现象在涂膜上形成了水滴。继续供给加湿空气,一边使水滴生长一边使水滴渗入涂膜中。一边使水滴生长至涂膜中水滴彼此隔着两亲性化合物的膜密接为止,一边通过涂膜所包含的溶剂的蒸发在水滴的周围析出聚乳酸。接着,停止供给加湿空气,提高气氛温度并使水滴蒸发,将水滴进入涂膜中的部分留作开孔,获得了具备多个开孔以蜂窝状排列并且具有连通结构的由聚乳酸构成的多孔层和pet膜层的多孔膜。通过涂膜的膜厚、加湿空气中所含的水蒸气量及使水滴蒸发的时机调整多孔层中的开孔及连通孔的尺寸,从而获得了表1所示的各多孔膜。
[培养装置]
将多孔膜切成直径23mm的圆形,将环(外径22mm、内径16mm、高度8mm。pmma制、pdms涂布于侧面上)使用双面压敏粘合带(3mcompany的部件号1510、皮肤粘贴用胶带)粘贴到多孔膜的外周部,而制作了带环的多孔膜。将带环的多孔膜浸入70%(v/v)乙醇水溶液中几分钟以进行灭菌,接着用无菌水清洗以去除乙醇。图4中示出多孔膜、环及培养装置的一例。
将带环的多孔膜置于组织培养用皿上,使得多孔膜的pet膜层侧朝下,从而获得了培养装置。为了进行灭菌,对培养装置进行了2小时的紫外线照射。表1中示出各培养装置所具备的多孔膜的结构的尺寸。
图5a是pla10所具备的多孔膜的剖面及表面的sem图像,图5b是pla40所具备的多孔膜的剖面及表面的sem图像。表1所示的所有多孔膜中,相邻的开孔的开口彼此通过平坦部分离,相邻的开孔彼此的各壁面的一部分连续地连通。表1所示的所有多孔膜中,排列在包括聚乳酸的多孔层的开孔不贯穿多孔层。
作为对照用培养装置,准备了代替多孔膜而具备在pet膜上将没有开孔的平坦的包括聚乳酸的层进行层叠而得的层叠体的装置(称为“flat”。)、在组织培养用皿(tissueculturepolystyrene:tcps、直径35mm、商品名:falcon细胞培养皿353001、corningincorporated制)的培养面粘贴环的装置(称为“tcp”。)。
这些培养装置中,环内的底面为培养细胞的培养面,被环包围的底面的面积为2cm2。
<培养实验的材料>
[细胞]
·间充质干细胞:来自于人体(成人)骨髓的正常细胞,从lonzajapan购买。以下称为“msc”。
·成纤维细胞:来自于人体皮肤的正常细胞nhsf46,从rikenbioresourcecenter(3-1-1takanodai,tsukubacity,ibarakiprefecture,japan)分售。
·血管内皮细胞:来自于人新生儿脐静脉的正常细胞,从lonzajapan购买。以下称为“huvec”。
·来自于肝脏的增殖细胞:来自于人体肝癌的细胞hepg2,从rikenbioresourcecenter(3-1-1takanodai,tsukubacity,ibarakiprefecture,japan)分售。
[培养液]
·msc培养基:人体间充质干细胞培养基试剂盒mscgmbulletkit,lonzajapan
·nhsf46培养基:memα+10%fbs
·huvec培养基:人体内皮细胞培养基试剂盒egm-2bulletkit,lonzajapan
·hepg2培养基:dmem+10%fbs
<培养实验1:间充质干细胞的单独培养>
作为培养装置使用tcp、flat、pla3、pla10、pla30,在下述培养条件下单独培养了msc。
·接种密度:1×105cells/disk(5×104cells/cm2)
·接种后的离心处理:对具备多孔膜的培养装置实施旋转半径120mm、转速1100rpm、旋转时间3分钟的离心处理。
·骨分化诱导培养基:hmscdifferentiationbulletkit-osteogenic(商品部件号:pt-3002,lonzajapan)
·脂肪分化诱导培养基:hmscdifferentiationbulletkit-adipogenic(商品部件号:pt-3004,lonzajapan)
·培养液量:1.0ml/disk
·恒温箱:37℃、5%co2
使用msc培养基开始培养,在培养第1天,将骨分化诱导培养基和脂肪分化诱导培养基更换为以1:1进行混合的分化诱导培养基,之后每3天更换分化诱导培养基,培养了合计15天。在分化诱导第14天通过实时pcr(polymerasechainreaction:聚合酶链反应)分析了作为骨细胞的分化标记的runx2及osx、以及作为脂肪细胞的分化标记的c/ebpα及pparγ的表达。并且,在分化诱导第14天进行了肌动蛋白的荧光免疫染色。图6中示出分化诱导第14天的肌动蛋白的荧光免疫染色图像。
从本实验中明确了以下内容。
·细胞的形态根据多孔膜的开孔的大小而改变。pla10及pla30中,细胞在多孔膜的孔内显示出细长的形态。tcp、flat及pla3中,细胞在多孔膜的表面显示出扩展的形态。
·pla3及pla10中的细胞的增殖性与flat相当,pla30中的细胞的增殖性比flat低。由此,表明当细胞侵入多孔膜的孔内时增殖得到抑制。
·实时pcr的分析结果表示在任何培养装置中分化成骨细胞并且分化成脂肪细胞。
<培养实验2:间充质干细胞和血管内皮细胞的共同培养>
作为培养装置使用tcp和pla40,在下述培养条件下,单独培养huvec或共同培养msc和huvec。
·单独培养:huvec的接种密度1×105cells/disk(5×104cells/cm2)。以msc培养基和huvec培养基的混合培养基(msc培养基:huvec培养基=体积比1:2)进行培养。
·共同培养:将msc和huvec混合之后接种。msc的接种密度0.5×105cells/disk、huvec的接种密度1×105cells/disk、合计接种密度1.5×105cells/disk(7.5×104cells/cm2)。以msc培养基与huvec培养基的混合培养基(msc培养基:huvec培养基=体积比1:2)进行培养。
·接种后的离心处理:相对于一半具备多孔膜的培养装置,实施旋转半径120mm、转速1100rpm、旋转时间3分钟的离心处理。
·培养液量:1.0ml/disk
·恒温箱:37℃、5%co2
·培养期间:培养7天。每2天更换一次培养基。
在培养第3天和第7天,进行huvec特异的细胞表面标记即cd31的荧光免疫染色,并使用共聚焦激光显微镜系统(nikoncorporationc2+、10倍物镜)进行了观察。关注细胞组织中网络结构最发达的深度,选择任意10个1.27mm×1.27mm(=1.61mm2)的区域来获取荧光图像,使用图像分析软件(nikon公司nis-elementsbasicresearch)对已获取的荧光图像进行了二进制化处理。分别测量散布在二进制化处理的整个图像中的荧光区域的长径,将其长度相加,进而计算10个区域的合计,作为形成有huvec的网络的总长。分别测量散布在二进制化处理的整个图像中的荧光区域的面积,将其面积相加,进而计算10区域的合计,作为形成有huvec的网络的总面积。
图7a~图7d及表2中示出共聚焦激光显微镜图像及网络的分析结果。在图7a~图7c中,“mono-”是指单独培养,“co-”是指共同培养。在图7a~图7d中,标注“cfg”的图像为实施了离心处理的培养例,未标注“cfg”的图像为未实施离心处理的培养例。
·图7a:培养第3天的cd31的荧光免疫染色图像(低倍率)。
·图7b:培养第3天的cd31的荧光免疫染色图像(高倍率)。
·图7c:培养第7天的cd31的荧光免疫染色图像(高倍率)。
·图7d、表2:共同培养中网络的总长及总面积。
[表2]
从本实验中明确了以下内容。
·huvec是形成血管内膜的细胞,仅用huvec难以形成网状毛细血管的网络,但通过msc和huvec的共同培养形成了网状毛细血管的网络。认为支撑内皮细胞的细胞是内皮细胞形成管腔结构所必需的,msc分泌作用于内皮细胞的细胞因子及能够分化成壁细胞,这表明msc有效地作用于huvec的网状毛细血管的网络的形成。
·网状毛细血管的网络的形成随着时间的推移而进行,在培养第7天,与培养第3天相比,形成了更发达的网络。
·在pla40中,大量的细胞存在于多孔膜的孔内。在pla40中,与tcp相比,形成了发达的网状毛细血管的网络。
·在实施了离心处理的pla40中,与未实施离心处理的pla40相比,网状毛细血管的网络发展得更长。表明通过实施离心处理,转移到多孔膜的孔内的细胞的比例增大。
·在通常的接种操作后的培养中,发现了在培养装置的环周边细胞密度高的倾向,实施离心处理之后的培养中,发现了在整个培养面形成相对均匀的网络。表明接种的细胞通过离心处理转移到多孔膜的孔内,因此抑制细胞转移到环周边。
<培养实验3:间充质干细胞或成纤维细胞和血管内皮细胞的共同培养>
作为培养装置使用tcp、flat、pla40,在下述培养条件下共同培养msc和huvec或共同培养nhsf46和huvec。
·msc和huvec的共同培养:将msc和huvec混合之后进行接种。msc的接种密度0.5×105cells/disk、huvec的接种密度1×105cells/disk、合计接种密度1.5×105cells/disk(7.5×104cells/cm2)。以msc培养基和huvec培养基的混合培养基(msc培养基:huvec培养基=体积比1:2)进行培养。
·nhsf46和huvec的共同培养:将nhsf46和huvec混合之后进行接种。nhsf46的接种密度0.5×105cells/disk、huvec的接种密度1×105cells/disk、合计接种密度1.5×105cells/disk(7.5×104cells/cm2)。以nhsf46培养基和huvec培养基的混合培养基(nhsf46培养基:huvec培养基=体积比1:2)进行培养。
·接种后的离心处理:对具备多孔膜的培养装置实施了旋转半径120mm、转速1100rpm、旋转时间3分钟的离心处理。
·培养液量:1.0ml/disk
·恒温箱:37℃、5%co2
·培养期间:培养第7天。每天更换培养基。
在培养第3天和第7天进行cd31的荧光免疫染色,并使用共聚焦激光显微镜进行了观察。在图8a~图8d及表3中示出显微镜图像及网络的分析结果。
·图8a:培养第3天的cd31的荧光免疫染色图像(高倍率)。
·图8b:培养第7天的cd31的荧光免疫染色图像(高倍率)。
·图8c、表3:培养第3天的网络的总长及总面积。
·图8d、表3:培养第7天的网络的总长及总面积。
[表3]
从本实验中明确了以下内容。
·通过nhsf46和huvec的共同培养,与msc和huvec的共同培养同样地形成了网状毛细血管的网络。
·网状毛细血管的网络随时间的推移而发展。
·在pla40中,与tcp及flat相比,形成了更发展的网络。
<培养实验4:多孔膜的尺寸的研究>
作为培养装置使用tcp、flat、pla3、pla10、pla20、pla40,在下述培养条件下共同培养了msc和huvec。
·接种:将msc和huvec混合之后进行了接种。
·接种密度:msc0.5×105cells/disk、huvec1×105cells/disk、合计1.5×105cells/disk(7.5×104cells/cm2)。
·培养基:msc培养基与huvec培养基的混合培养基、msc培养基:huvec培养基=体积比1:2。
·接种后的离心处理:对具备多孔膜的培养装置实施了旋转半径120mm、转速1100rpm、旋转时间3分钟的离心处理。
·培养液量:1.0ml/disk
·恒温箱:37℃、5%co2
·培养期间:培养7天。每2天更换了培养基。
在培养第3天和第7天进行cd31的荧光免疫染色,并使用共聚焦激光显微镜进行了观察。在图9a~图9e及表4中示出显微镜图像及网络的分析结果。
·图9a:培养第3天的cd31的荧光免疫染色图像(低倍率)。
·图9b:培养第3天的cd31的荧光免疫染色图像(高倍率)。
·图9c:培养第7天的cd31的荧光免疫染色图像(低倍率)。
·图9d:培养第7天的cd31的荧光免疫染色图像(高倍率)。
·图9e、表4:网络的总长及总面积。
[表4]
从本实验中明确了以下内容。
·在pla3及pla10中,细胞在多孔膜的表面显示伸展的形态,未形成网络。
·在pla20中,细胞在多孔膜的表面显示出拉伸的形态,在多孔膜的孔内显示出形成网络的形态。
·在pla40中,形成有网状毛细血管的网络。
·如上述所述,细胞的形态根据多孔膜的开孔的大小而改变。本实验中使用的细胞的长径为20μm左右,这表明若多孔膜的开孔的大小大于或等于细胞尺寸,则细胞在多孔膜的孔内容易形成网络。
<培养实验5:3种细胞的同时共同培养>
作为培养装置使用tcp、pla40在下述培养条件下共同培养了msc、huvec、hepg2。
·接种:将msc和huvec和hepg2混合之后接种。预先用荧光染料celltrackerred标记hepg2。
·接种密度:msc0.5×105cells/disk、huvec1×105cells/disk、hepg25×105cells/disk。
·培养基:msc培养基和huvec培养基和hepg2培养基的混合培养基、msc培养基:huvec培养基:hepg2培养基=体积比1:2:3。
·接种后的离心处理:对具备多孔膜的培养装置实施了旋转半径120mm、转速1100rpm、旋转时间3分钟的离心处理。
·培养液量:1.0ml/disk
·恒温箱:37℃、5%co2
·培养期间:培养3天。每天更换了培养基。
在培养第3天进行cd31的荧光免疫染色,并使用共聚焦激光显微镜观察,分析了由细胞形成的网络。图10a~图10b中示出显微镜图像。
·图10a:培养第3天的荧光图像(绿色荧光与红色荧光的重叠图像)。
·图10b:培养第3天的cd31的荧光免疫染色图像。
从本实验中明确了以下内容。
·在pla40中,细胞形成网络结构,但网络之间的连结状态差。
·msc和huvec和hepg2的3种共同培养与msc和huvec的2种共同培养相比,接种密度高,在多孔膜的孔内高密度地填充有细胞,由此引起细胞的迁移性降低、网络形成的降低或延迟。通过接种密度的优化或培养时间的延长来推测能够形成网络。
<培养实验6:3种细胞的阶段性共同培养>
作为培养装置使用tcp、pla40在下述培养条件下共同培养了msc、huvec及hepg2。
·接种:将msc和huvec混合之后接种,培养3天之后,接种了hepg2。预先用荧光材料celltrackerred标记了hepg2。
·接种密度:msc0.5×105cells/disk、huvec1×105cells/disk、hepg25×105cells/disk。
·接种后的离心处理:对具备多孔膜的培养装置实施了旋转半径120mm、转速1100rpm、旋转时间3分钟的离心处理。
·培养液量:1.0ml/disk
·恒温箱:37℃、5%co2
·培养期间:2种共同培养进行3天,3种共同培养进行3天。
·培养基:从开始培养3天后,以msc培养基与huvec培养基的混合培养基(体积比1:2)进行培养,第1天进行了培养基更换。接种hepg2之后,更换为msc培养基、huvec培养基、hepg2培养基的混合培养基(体积比1:2:3),一边每天更换培养基一边进行培养。
接种hepg2之后第3天进行cd31的荧光免疫染色,从cd31的荧光图像和hepg2的荧光图像分析了由细胞形成的网络。图11a~图11b中示出显微镜图像。图11c及表5中示出分析cd31的荧光图像而获得的网络的总长及总面积。
·图11a:接种hepg2之后的培养第3天的荧光图像(绿色荧光和红色荧光的重叠图像)。
·图11b:接种hepg2之后的培养第3天的cd31的荧光免疫染色图像。
·图11c、表5:3种共同培养第3天中,同时共同培养(培养实验5)、阶段性共同培养(培养实验6)各自的网络的总长及总面积。
[表5]
从本实验中明确了以下内容。
·pla40中,与tcp相比,形成了更细长的网络。
·阶段性共同培养与同时共同培养相比,网络的连结增加。共同培养msc和huvec而预先形成网络之后接种hepg2,这表明对形成高阶网络结构是有效的。
2016年9月27日申请的日本专利申请第2016-188627号公开的全部内容通过参考而被引用于本说明书中。
在本说明书中记载的所有文献、专利申请及技术标准通过参考引用于本发明中,各个文献、专利申请及技术标准作为参考被引用的情况与具体且分别记载的情况程度相同。
- 还没有人留言评论。精彩留言会获得点赞!