活性可控聚合(γ-甲基)-ɑ-亚甲基-γ-丁内酯的方法与流程
本发明属于高分子合成技术领域,具体涉及一种活性可控聚合催化体系,该体系使用Lewis酸作为催化剂,烯醇硅醚作为引发剂可以应用于可再生单体(γ- 甲基)-ɑ-亚甲基-γ-丁内酯((M)MBL)的活性可控聚合,以及两种单体之间的共聚。
背景技术:
能源问题是当今人类社会的主要问题。自从人类开始利用化石能源以来。煤炭,石油和天然气迅速发展成为能源和化学品最主要的来源。目前,大约86%的能源和96%的化学品源自于这些不可再生的石油产品。可以预见在不久的将来石油产品势必不能满足人类社会日益增长的需求。更为严峻的是:根据有关专家预测,以目前的开采速度,地球上已探明的石油储备仅够人类再开采40余年。
目前人类社会大量使用的聚合物材料(如聚乙烯、聚丙烯、聚苯乙烯和聚甲基丙烯酸酯等)都是源自于石油产品。随着石油资源的不断消耗,人类社会将面临的一个巨大的挑战就是如何利用自然界中的可再生资源替代传统的石油基聚合物。因此,以生物质为原料,开发新型单体及其聚合反应工艺,生产可再生聚合物的研究,符合可持续发展战略,越来越受到人们的广泛关注。
作为甲基丙烯酸酯(MMA)的环状类似物,乙烯基环丁内酯:ɑ-亚甲基-γ-丁内酯(MBL)和γ-甲基-ɑ-亚甲基-γ-丁内酯(MMBL)这两个可再生单体的应用前景将非常广阔。MBL又名郁金香内酯,是可以从郁金香中直接提取的一种化合物,MBL的环结构是许多天然产物的基本结构单元。而它的γ-甲基同系物 MMBL可以通过两步过程从生物质衍生物乙酰丙酸合成得到。尽管从结构上它们是石油基单体MMA的环状类似物。然而,由于近乎于平面的五元环状结构的存在(五元环结构使得羰基与双键在环外同侧,而且张力可以提高碳碳双键的能量,同时提供高度的共振稳定结构),使得该类单体的聚合活性远远大于它们的类似物MMA。
更为重要的是由于聚合物链和环内酯单元的相互作用形成的刚性构象结构使得该类聚合物PMBL和PMMBL展示出了比其类似物PMMA更为优越的材料特性。例如,通过自由基聚合所得的无规PMBL的玻璃态转化温度Tg为195℃,这比无规的PMMA的Tg高出了大约90℃;而通过硅阳离子R3Si+催化聚合的无规 PMMBL的Tg高达225℃。另外,相比于PMMA,PMBL和PMMBL展现出了更好的抗溶剂(不溶于一般的有机溶剂如THF,二氯甲烷和甲苯等)、抗热和抗摩擦等性能。
综上,可再生的聚(γ‐甲基)‐ɑ‐亚甲基‐γ‐丁内酯与石油基聚合物的对比优势 如图17所示。
已经知道MBL可通过多种聚合过程发生聚合。其中包括自由基聚合、基团转移聚合、阴离子聚合以及茂金属催化的配位聚合。MBL还能与MMA、苯乙烯、甲氧基苯乙烯和乙烯基噻吩等多种单体实现共聚。相对于MBL而言,对MMBL的聚合反应研究相对较少。现已报道的有自由基乳液聚合或自由基、阴离子和基团转移聚合。该聚合需要较长的反应时间,且很难达到单体完全转化。
技术实现要素:
本发明要解决的技术问题在于,提供一种高效快速地实现可再生的(γ-甲基)-ɑ-亚甲基-γ-丁内酯((M)MBL)的活性可控的催化聚合体系。
本发明的技术方案如下:
一种活性可控聚合(γ-甲基)-ɑ-亚甲基-γ-丁内酯的方法,其特征在于,以烯醇硅醚(简称RSKA,Me2C=C(OMe)OSiR3)为引发剂,以Lewis酸作为催化剂,在极性溶剂的条件下,催化γ-甲基-ɑ-亚甲基-γ-丁内酯(简称MMBL) 和ɑ-亚甲基-γ-丁内酯(简称MBL)的可控活性聚合以及它们的共聚;聚合体系的单体与烯醇硅醚的摩尔比为10~3200:1,反应温度为常温,反应时间为0.2 小时~24小时;
所述的烯醇硅醚结构式为
所述的Lewis酸为三(五氟苯基)铝、三(五氟苯基)硼、三氯化铝、三甲基铝、三乙基铝、三苯基铝、三(对氟苯基)铝、二(2,6-二叔丁基-4-甲基苯氧基)甲基铝;
所述的γ-甲基-ɑ-亚甲基-γ-丁内酯(MMBL)和ɑ-亚甲基-γ-丁内酯(MBL) 为可再生单体,其具体的结构式为
在本发明的一种活性可控聚合(γ-甲基)-ɑ-亚甲基-γ-丁内酯的方法中,所述的烯醇硅醚的结构式优选为
所述的Lewis酸优先为三(五氟苯基)铝和三(五氟苯基)硼。
在本发明的一种活性可控聚合(γ-甲基)-ɑ-亚甲基-γ-丁内酯的方法中,所述的极性溶剂的用量优选为使单体的浓度为0.5~4mol/L,所述的极性溶剂优选为二氯甲烷、四氢呋喃或N,N-二甲基甲酰胺。
本发明利用烯醇硅醚(SKA)为引发剂,利用Lewis酸作为催化剂来活化单体,通过烯醇硅醚与Lewis酸活化的单体反应生成具有烯醇硅醚结构的电中性活性物种,这种活性物种能够实现MMBL和MBL的活性可控聚合。其活性聚合特征由以下几个方面具体说明:1,在保持非常低的分子量分布的情况下所得到的聚合物的分子量能够与理论分子量非常接近;2,在保持非常低的分子量分布的情况下聚合物的分子量随着单体的转化率呈线性增长;3,在保持非常低的分子量分布的情况下所得到的聚合物的分子量随着单体/引发剂的比值呈线性增长;4,能够实现理想的链延伸;5,MMBL与MBL能够实现理想的共聚(包括随机聚合,双嵌段聚合和三嵌段聚合)。
综上,本发明有以下有益效果:
1、本发明的催化体系原料易得、操作方便、反应条件温和、快速、转化率高(可达100%)、无需贵重金属。
2、本发明的催化体系催化剂使用量少(单体与催化剂的摩尔比可以达到 3600:1)。
3、本发明的催化体系所合成的聚合物的分子量随单体与催化剂比例的增加而增大,因而该体系可以实现聚合物的分子量达106g/mol以上级别,分子量分布窄(PDI<1.5)。
4、本发明的催化体系能够很好的在聚合物链末端保持烯醇硅醚活性结构,因此能够实现很好的链延伸。
4、本发明的催化体系可以实现MMBL与MBL之间的共聚(随机共聚和嵌段共聚)。
附图说明
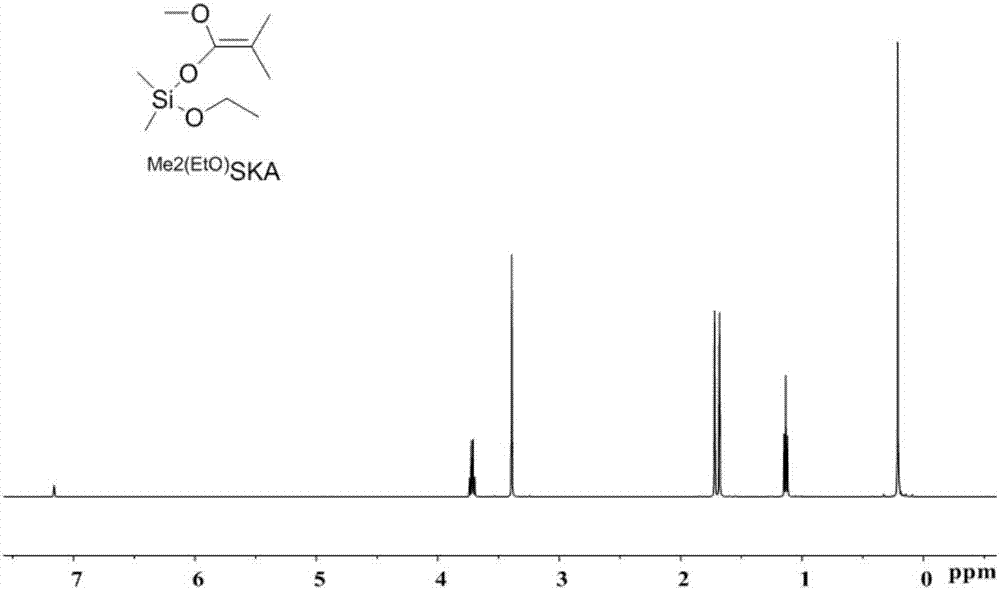
图1是实施例1制备的二甲基乙烯酮-甲基-二甲基乙氧基乙缩醛Me2C=C- (OMe)OSiMe2(EtO)(Me2(EtO)SKA)的1H NMR图。
图2是实施例1制备的二甲基乙烯酮-甲基-二甲基乙氧基乙缩醛Me2C=C- (OMe)OSiMe2(EtO)(Me2(EtO)SKA)的13C NMR图。
图3是实施例2的不同单体/引发剂比例得到的聚合物的凝胶渗透色谱图。
图4是实施例2制备的聚MMBL的MALDI-TOF图及其局部放大图。
图5是实施例2聚MMBL的MALDI-TOF图主要峰的结构分析。
图6是实施例2聚MMBL的MALDI-TOF图次要峰的结构分析。
图7是实施例3的链延伸实验的凝胶渗透色谱图。
图8是实施例4的随机共聚实验的凝胶渗透色谱图。
图9是实施例4的三嵌段共聚实验的凝胶渗透色谱图。
图10是实施例5原位生成的中间体1的1H NMR图。
图11是实施例5原位生成的中间体1的19F NMR图。
图12是实施例5制备的聚MMBL的MALDI-TOF图及其局部放大图。
图13是实施例5聚MMBL的MALDI-TOF图主要峰的结构分析。
图14是实施例5聚MMBL的MALDI-TOF图次要峰的结构分析。
图15是实施例6原位生成的中间体2的1H NMR图。
图16是实施例6原位生成的四面体中间体2的19F NMR图。
图17是可再生的聚(γ-甲基)-ɑ-亚甲基-γ-丁内酯与石油基聚合物的特点对 比图。
具体实施方式
通过以下实施例可以进一步说明本发明,实施例是为了说明本发明而不是限制本发明,本发明的保护范围不限制于此。
实施例1本发明所述的烯醇硅醚的一种具体合成方法
合成二甲基乙烯酮-甲基-二甲基乙氧基乙缩醛Me2C=C(OMe)OSiMe2(EtO) (Me2(EtO)SKA)。
1)合成二甲基乙氧基氯硅烷(Me2(EtO)SiCl)
在充满氮气的手套箱中,取乙醇(5.08mL,90.0mmol)和B(C6F5)3(461mg, 0.90mmol)于200mLSchlenk瓶中,加入二氯甲烷(100mL)并用翻口塞封口,拿出手套箱连于Schlenk线上,冷却至-78℃并保持20min。通过注射器缓慢滴加二甲基氯硅烷(10.0mL,90.0mmol)于体系中。缓慢升至室温(超过30min),真空除去二氯甲烷(注意不要抽掉产物),减压蒸馏得到无色油状产物。得到产物12.48g,产率91%。1H NMR(500MHz,Benzene-d6)δ3.61(q,J=7.0Hz,2H,OCH2), 1.06(t,J=7.0Hz,3H,OCH2CH3),0.26(s,6H,SiMe2).
2)合成二甲基乙烯酮-甲基-二甲基乙氧基乙缩醛Me2C=C(OMe)OSi- Me2(EtO)(Me2(EtO)SKA)。
在充满氮气的手套箱中,取二异丙胺(7.05mL,50.0mmol)于200mLSchlenk 瓶中,加入四氢呋喃(100mL)并用翻口塞封口,拿出手套箱连于Schlenk线上,冷却至0℃。通过注射器缓慢滴加正丁基锂(32.0mL,1.6M于正己烷中,51.2 mmol)于体系中,并在0℃下反应30min后,缓慢加入异丁酸甲酯(5.74mL, 50.0mmol)。待体系于0℃下反应30min后,缓慢滴加二甲基乙氧基氯硅烷 (7.61g,50.0mmol)。并缓慢升至室温,搅拌过夜。真空除去溶剂,加入正己烷并过滤掉固体LiCl,再次抽干正己烷溶剂后减压蒸馏得到最终的无色透明油状物。产物8.79g,产率86%。1H NMR(500MHz,Benzene-d6)δ3.72(q,J=7.0Hz, 2H,OCH2CH3),3.39(s,3H,OMe),1.72(s,3H,=CMe),1.68(s,3H,=CMe),1.13(t, J=7.0Hz,3H,OCH2CH3),0.21(s,6H,SiMe2).(附图1)13C NMR(126MHz, Benzene-d6)δ149.8,90.7,58.6,56.6,18.5,17.1,16.5,-2.5.(附图2)
实施例2γ-甲基-ɑ-亚甲基-γ-丁内酯(MMBL)与ɑ-亚甲基-γ-丁内酯(MBL) 的聚合
聚合反应在手套箱中进行,称取Lewis酸于20毫升反应瓶中,加入MMBL (0.5ml,4.68mmol)或MBL(0.41mL,4.68mmol),待单体与Lewis酸充分反应后,加入二氯甲烷溶剂(加入后溶液总体积为5mL),加入已经称取好的烯醇硅醚(RSKA),并开始计时,搅拌一段时间待单体完全转化后,将反应瓶从手套箱中拿出,加入5%HCl/甲醇溶液终止聚合反应。滤出聚合物,用甲醇充分洗涤, 60℃真空干燥至恒重。所得聚合物的分子量和分子量分布通过凝胶渗透色谱测得。
对聚合物分子量和分子量分布的表征结果显示,该聚合体系能够在保持非常低的分子量分布的情况下使聚合物的分子量随着单体/引发剂的比值呈线性增长。相关GPC图参见附图3。
低分子量的MMBL聚合物(3.1×103g/mol)通过基质辅助激光解吸电离飞行时间质谱(MALDI-TOF)检测(附图4),表明在聚合物的末端依旧保持着烯醇硅醚的结构(附图5),这也是催化聚合体系能够保持活性聚合的原因。链末端的烯醇硅醚结构也能够水解成氢原子(附图6)。
用不同Lewis酸碱以及不同的反应条件对催化得到的结果汇总于表1~2中。
表1.Al(C6F5)3[Al]催化的MMBL的聚合
注:括号内的转化率为通过称量最终聚合的质量计算所得。
表2.B(C6F5)3[B]催化的MMBL和MBL的聚合
实施例3 MMBL的链延伸
聚合反应在手套箱中进行,称取Al(C6F5)3于20毫升反应瓶中,加入MMBL (0.5ml,4.68mmol),待单体与Lewis酸充分反应后,加入四氢呋喃溶剂(加入后溶液总体积为5mL),加入已经称取好的iBuSKA,并开始计时,搅拌一段时间待单体完全转化后,再加入MMBL(0.5ml,4.68mmol),一段时间后使得单体完全转化后再加入MMBL(0.5ml,4.68mmol),待所有单体完全转化后,将反应瓶从手套箱中拿出,加入5%HCl/甲醇溶液终止聚合反应。滤出聚合物,用甲醇充分洗涤,60℃真空干燥至恒重。所得聚合物的分子量和分子量分布通过凝胶渗透色谱测得。
使用iBuSKA与Al(C6F5)3体系进行链延伸实验得到的结果汇总于表3中。相关GPC图参见附图7。这种理想的链延伸实验表明该催化聚合体系能够实现聚合物链末端良好的活性保持。
表3.MMBL聚合的链延伸实验结果
实施例4 MMBL和MBL的共聚
以制备聚(MMBL-嵌段-MBL-嵌段-MMBL)为例:聚合反应在手套箱中进行,称取Lewis酸于20毫升反应瓶中,加入MMBL(0.5ml,4.68mmol),待单体与Lewis酸充分反应后,加入N,N-二甲基甲酰胺溶剂(加入后溶液总体积为5 mL),加入已经称取好的iBuSKA,并开始计时,搅拌一段时间待单体完全转化后,再加入MBL(0.41ml,4.68mmol),一段时间后单体完全转化后再加入MMBL (0.5ml,4.68mmol),待所有单体完全转化后,将反应瓶从手套箱中拿出,加入 5%HCl/甲醇溶液终止聚合反应。滤出聚合物,用甲醇充分洗涤,60℃真空干燥至恒重。所得聚合物的分子量和分子量分布通过凝胶渗透色谱测得。相关均聚物和共聚物的GPC图参见附图8,附图9。
表5 MMBL和MBL的共聚
a随机共聚:两种单体同时加入。
实施例5活性中间体1的表征
在手套箱中,取iBuSKA(3.01mg,0.01mmol)和0.3mLC6D6加入到J. Young-type核磁管中。用移液器取0.3mL Al(C6F5)3·MMA的C6D6溶液 (0.01mmol)加入到核磁管中,混合均匀,反应15min后进行核磁测试。得到中间体Me3SiO(OMe)C=C(Me)CH2CMe2C(OMe)=O···Al(C6F5)3,该化合物有顺反异构体,主要是结构1A与次要结构1B,具体核磁数据如下:1A:1H NMR(500MHz, Benzene-d6)δ3.22(s,3H,OMe),3.08(s,3H,COOMe),2.16(s,2H,CH2),1.35(s,3H, Me),0.97(s,6H,Me2),0.058(s,9H,SiMe3);1B:δ3.27(s,3H,OMe),3.24(s,3H, COOMe),2.18(s,2H,CH2),1.43(s,3H,Me),1.01(s,6H,Me2),0.063(s,9H,SiMe3); (附图10)19F NMR(471MHz,Benzene-d6)δ-122.88(d,J=18.8Hz,6F,o-F), -151.75(t,J=19.7Hz,3F,p-F),-160.94(m,6F,m-F).(附图11)
使用这种二聚体结构聚合得到低分子量的MMBL聚合物(3.3×103g/mol)通过基质辅助激光解吸电离飞行时间质谱(MALDI-TOF)检测(附图12),表明在聚合物的末端依旧保持着烯醇硅醚的结构,而且另一末端为MMA二聚的结构形式(附图13),这表明一方面表明末端能够保持烯醇硅醚结构的特点,更重要的是显示了这种二聚的中间体就是聚合体系的活性物种。与实施例2一样,链末端的烯醇硅醚结构也能够水解成氢原子(附图14)。
实施例6四面体中间体2的分离
在手套箱中,取iBuSKA(3.01mg,0.01mmol)和0.3mLC6D6加入到J. Young-type核磁管中。用移液器取0.3mL Al(C6F5)3·MMBL的C6D6溶液 (0.01mmol)加入到核磁管中,混合均匀,反应15min后进行核磁测试。得到中间体iBu3Si-MMBL-CMe2C(OMe)=O···Al(C6F5)3(2).由于MMBL特殊的环状结构,并没有出现顺反异构体,具体核磁数据如下:1H NMR(500MHz,Benzene-d6) δ4.30(ddq,J=9.4,6.6,6.2Hz,1H,OCH),3.24(s,3H,OMe),2.29(dd,J=12.9,9.4Hz, 1H,CH2),2.27(d,J=14.2Hz,1H,CH2),2.20(d,J=14.3Hz,1H,CH2),1.88(hept,J= 6.7Hz,3H,CH),1.79(dd,J=12.8,6.6Hz,1H,CH2),1.10(d,J=6.2Hz,3H,Me),1.04 (s,3H,Me2),1.03(s,3H,Me2),1.00(d,J=6.6Hz,18H,CHMe2),0.78(d,J=7.0Hz,6H, SiCH2).(附图15)19F NMR(471MHz,Benzene-d6)δ-122.91(d,J=21.3Hz,6F,o-F), -151.63(t,J=19.8Hz,p-F),-160.85(m,6F,m-F).(附图16)。
- 还没有人留言评论。精彩留言会获得点赞!