一种菌黄素合成相关基因及其在构建产无色黄原胶工程菌中的应用的制作方法
本发明属于生物工程技术领域,具体涉及野油菜黄单胞菌野油菜致病变种的菌黄素合成基因,以及该菌黄素合成基因在构建产无色黄原胶工程菌中的应用。
背景技术:
黄原胶是野油菜黄单胞菌野油菜致病变种(xanthomonascampestrispv.campestris,xcc)产生的胞外多糖聚合物,是已经开发的微生物多糖中应用范围最为广泛的一种,其具有良好的增粘性和触变性,对热、酸、碱稳定性高,能够与多种溶剂相容。目前,黄原胶作为助悬剂、增稠剂、乳化剂、稳定剂等,应用于医药、食品、饮料、化妆品、洗涤剂、石油开采等领域中。
菌黄素是黄单胞菌属的重要代谢产物,其为溴化芳基多烯脂类衍生物,具有抗氧化、避免菌体遭受光照损害的功能。菌黄素不溶于水,能够与细胞外膜牢固结合,使得菌落颜色为黄色。在生产黄原胶工艺中,由于黄原胶产品质量标准的要求,需要去除发酵过程中产生的菌体细胞色素,而菌黄素是菌体细胞色素的主要成分,目前,行业内通常采用溶剂化学反应法去除细胞色素,存在着溶剂耗量大、操作繁琐、生产成本高的问题,因而去除细胞色素步骤成为制约黄原胶品质提升以及节约生产成本的重大障碍。
因此,拟通过阻断野油菜黄单胞菌野油菜致病变种的菌黄素合成途径来解决上述问题,从而改善黄原胶产品的外观颜色,节约生产成本。
技术实现要素:
本发明的目的在于:一方面公开一种与菌黄素合成相关的新基因(xc_4092);另一方面是针对新基因(xc_4092),对黄原胶产生菌株(野油菜黄单胞菌野油菜致病变种)进行遗传改造,降低发酵生产过程中菌黄素的合成量,从而提高黄原胶产品品质,节约生产成本。
本发明公开了一种与菌黄素合成相关的基因,即:3-酮脂酰acp还原酶基因(xc_4092),xc_4092的基因序列如seqidno.1所示,由738个核苷酸组成,自5’端的第1~3位核苷酸为该基因的起始密码子atg,自3’端的第736~738位核苷酸为该基因的终止密码子tga。xc_4092基因编码产物具有3-酮脂酰acp还原酶活性,其氨基酸序列如seqidno.2所示,包括245个氨基酸,分子量为24982道尔顿,等电点为7.21;3-酮脂酰acp还原酶能够催化菌黄素合成中的还原反应。
本发明进一步的公开了基因xc_4092在生产无色黄原胶方面的应用,由于xc_4092基因编码产物具有3-酮脂酰acp还原酶活性,能够催化菌黄素合成中的还原反应,因此,通过对黄原胶产生菌进行遗传改造来阻断这个还原反应途径,从而阻断菌黄素的合成,进而能够生产无色黄原胶。
本发明进一步地公开了基因xc_4092在构建生产无色黄原胶工程菌方面的应用。具体包括如下技术方案:
本发明提供了一种生产无色黄原胶的工程菌,其中,出发菌株为野油菜黄单胞菌野油菜致病变种的野生菌株xcc8004,通过失活xcc8004基因组中的基因xc_4092完成基因改造。
进一步的,所述失活的方式为删除或沉默抑制基因xc_4092的全部或部分编码框。
进一步的,生产无色黄原胶的基因工程重组菌是通过采用两次同源重组的基因敲除方法删除所述的野生菌株xcc8004基因组中的基因xc_4092所得。
进一步的,利用两次同源重组的基因敲除方法构建生产无色黄原胶的基因工程重组菌具体包括如下步骤:
s1、构建基因敲除重组质粒;
s2、将步骤s1获得的重组质粒转化e.colis17-1感受态细胞,获得转化子;
s3、采用接合转移方式将重组质粒导入至野油菜黄单胞菌xcc8004中,通过卡那霉素和利福平抗性培养基筛选,获得第一次同源重组菌;
s4、将步骤s3中得到的第一次同源重组菌株进行第二次同源重组培养,利用复制平板法筛选第二次同源重组菌;
s5、pcr法验证步骤s4中得到的第二次同源重组菌,将扩增片段测序,确认需要敲除的基因xc_4092已被删除,成功删除基因xc_4092的第二次同源重组菌即为生产无色黄原胶的基因工程重组菌。
进一步的,所述的步骤s1为:以野油菜黄单胞菌xcc8004的基因组为模板,利用pcr法分别扩增xc_4092基因的上游片段和下游片段,其中,上游片段的引物序列如seqidno.3和seqidno.4所示,下游片段的引物序列如seqidno.5和seqidno.6所示;接着,采用融合pcr法,以xc_4092基因的上、下游片段为模板,以seqidno.3和seqidno.6为引物,将xc_4092基因的上、下游片段连接起来,形成xc_4092基因的缺失片段;再将xc_4092基因的缺失片段酶切后连入自杀质粒pk18mobsacb,获得重组质粒。
进一步的,所述的步骤s5中,pcr验证引物序列如seqidno.7和seqidno.8所示。
进一步的,所述的步骤s5中,验证pcr的程序包括如下:(1)95℃预变性10min;(2)95℃变性1min;(3)56℃退火30s;(4)72℃延伸2.0min;(5)重复(2)~(4)35个循环;(6)72℃,10min。
本发明的有益效果是:
本发明提供了一种与菌黄素合成相关的新基因(xc_4092),可用于黄原胶生成菌株的遗传改造,达到降低发酵生产中菌黄素的合成量、改善黄原胶外观品质的目的。xc_4092基因编码产物具有3-酮脂酰acp还原酶活性,能够催化菌黄素合成中的还原反应。
同时,通过采用现代分子生物学技术对野油菜黄单胞菌xcc8004进行定向改造,采用两次同源重组的方式删除xcc8004基因组中的基因xc_4092,以获得产无色黄原胶的基因工程菌。本发明在国内尚属首例,通过阻断菌黄素合成途径中重要的还原反应,以不能合成菌黄素来改变目前行业内去除黄原胶中菌体细胞色素难的困境,有效地提升了黄原胶产品品质,简化了生产工艺流程,节约了生产成本。
附图说明
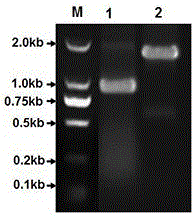
图1为实施例3中步骤s4的验证pcr扩增片段琼脂糖凝胶电泳图。
图2为实施例4中xcc8004和xccyh1在nyg平板上的菌落图。
图3为实施例5中xcc8004和xccyh1的菌体细胞经过处理后的吸收曲线图。
具体实施方式
下面结合附图和具体的实施例对本发明作进一步说明,但不限定本发明的范围。
以下为实施例中涉及到的试剂与材料:
(1)lb液体培养基:蛋白胨10g/l,酵母粉5g/l,氯化钠10g/l;
(2)nyg液体培养基:蛋白胨5g/l,酵母粉3g/l,甘油20g/l;
(3)10%蔗糖nyg液体培养基:蛋白胨5g/l,酵母粉3g/l,甘油20g/l,蔗糖100g/l;
(4)限制性内切酶、dna连接酶、pmd19-t载体、自杀质粒pk18mobsacb、大肠杆菌s17-1等试剂购自宝日医生物技术(北京)有限公司;
(5)pcr引物购自生工生物工程(上海)股份有限公司广州分公司;
(6)野油菜黄单胞菌的野生菌株xcc8004源自华南农业大学保藏中心。野油菜黄单胞菌的野生菌株xcc8004具有利福平抗性。
需要说明的是,若对(1)~(3)配置固体培养基时,需添加15g/l的琼脂粉;此外,(1)~(3)制备抗性培养基时,卡那霉素(km)的工作浓度为30µg/ml,利福平(rif)的工作浓度为50µg/ml。
实施例1:xc_4092基因的克隆
本实施例公开了xc_4092基因的克隆方法,包括如下步骤:
s1、根据xc_4092基因的dna序列,设计扩增引物对:up引物和down引物,up引物序列如seqidno.9所示,down引物序列如seqidno.10所示;
s2、以xcc8004的总dna作为模板,采用up引物和down引物进行pcr扩增,获得约740bp的xc_4092基因片段;
s3、将步骤s2获得的xc_4092基因片段连入pmd19-t载体,在16℃下连接2h,获得质粒pyyh-1;
s4、对步骤s3中的质粒pyyh-1进行测序,证明连入的基因片段正确。
对上述步骤需要说明的是,步骤s2中的pcr扩增程序为:①95℃预变性10min;②95℃变性50s;③56℃退火30s;④72℃延伸1min20s;⑤重复②~④35个循环;⑥72℃,10min。将pcr产物置于4℃条件下保存。pcr反应体系见表1:
表1为实施例1中步骤s2中的pcr反应体系。
步骤s3中连接反应的体系详见表2:
表2为实施例1中步骤s3中的连接反应体系。
实施例2:基因敲除重组质粒的构建
本实施例公开了一种构建基因敲除重组质粒的方法,旨在采用两次同源重组的基因敲除方法删除xcc8004基因组中的基因xc_4092,从而达到构建产无色黄原胶工程菌的目的。xc_4092基因敲除重组质粒的构建方法如下所述:
s1、分别设计xc_4092基因上游片段(约520bp)的pcr引物对p1-f和p2-r,以及xc_4092基因下游片段(约570bp)的pcr引物对p3-f和p4-r;
s2、以xcc8004的总dna为模板,分别pcr扩增xc_4092基因上游片段和xc_4092基因下游片段;
s3、采用融合pcr法,以步骤s2中获得的xc_4092基因上游片段和下游片段为模板,以p1-f和p4-r为引物,将xc_4092基因的上、下游片段连接起来,形成xc_4092基因的缺失片段;
s4、先将步骤s3中获得的xc_4092基因缺失片段酶切,然后将酶切片段连入pk18mobsacb中,测序正确的重组质粒即为用于基因敲除的阻断质粒pyyh-2。
对上述步骤需要说明的是,p1-f的基因序列如seqidno.3所示,p2-r的基因序列如seqidno.4所示,p3-f的基因序列如seqidno.5所示,p4-r的基因序列如seqidno.6所示。
步骤s2中的pcr反应体系与表1相同。pcr扩增程序为:①95℃预变性10min;②95℃变性50s;③56℃退火30s;④72℃延伸1min30s;⑤重复②~④35个循环;⑥72℃,10min。将pcr产物置于4℃条件下保存。
步骤s3中融合pcr扩增程序为:①95℃预变性10min;②95℃变性1min;③56℃退火30s;④72℃延伸2min15s;⑤重复②~④35个循环;⑥72℃,10min。将pcr产物置于4℃条件下保存。融合pcr的反应体系详见表3:
表3为实施例2中步骤s3中的融合pcr反应体系。
步骤s4中用于酶切的酶为ecori和hindiii,酶切温度为37℃,酶切时间为4h。具体的酶切反应体系详见下表4:
表4为实施例2中步骤s4中的酶切反应体系。
步骤s4中酶切后的片段连入pk18mobsacb中,连接温度为16℃,连接时间为12h。具体的连接体系详见表5:
表5为实施例2中步骤s4中的连接反应体系。
实施例3:产无色黄原胶工程菌的构建
本实施例公开了一种产无色黄原胶工程菌的构建方法,即:通过两次同源重组的基因敲除方法构建产无色黄原胶工程菌,包括如下步骤:
s1、利用cacl2诱导法制备感受态大肠杆菌s17-1,将实施例2中的重组质粒pyyh-2导入感受态大肠杆菌s17-1中,获得转化子e.colis17-1/pyyh-2;
s2、将步骤s1中得到的转化子e.colis17-1/pyyh-2以接合转移的方式导入xcc8004,然后采用抗性平板培养,使得pyyh-2上的xc_4092基因缺失片段与xcc8004基因组上的xc_4092基因片段发生同源重组交换,抗性平板上生长的单菌落即为第一同源重组菌;
s3、将步骤s2获得的第一同源重组菌株第二次同源重组培养,通过复制平板法筛选获得第二同源重组菌;
s4、设计pcr验证引物,以第二同源重组菌的基因组为模板,pcr扩增目的基因片段;
s5、将步骤s4中的扩增片段进行测序,确认基因xc_4092已被删除,而成功删除基因xc_4092的第二同源重组菌即为生产无色黄原胶的基因工程重组菌。
对上述步骤需要说明的是,步骤s1中获得转化子e.colis17-1/pyyh-2的具体方法是:①取3μl的pyyh-2加入至100μl的e.colis17-1感受态中,冰浴30min;②冰浴后的体系在42℃下,热激120s;③向热激后的体系中加入1ml无抗lb培养基,37℃培养1h;④将培养液涂布于含有km的lb抗性平板上,37℃培养10h,其上生长出的单菌落即为e.colis17-1/pyyh-2转化子。
步骤s2中,接合转移操作的具体流程为:①挑取e.colis17-1/pyyh-2于液体lb培养基中,37℃振荡培养16h;②挑取xcc8004于nyg液体培养中,30℃振荡培养24h;③分别将①和②中的菌悬液离心并收集菌体,将两种菌体混合于1ml的nyg液体培养基中,洗涤两次后重悬于0.1ml的nyg液体培养基中;④将③中的菌体重悬液滴至无抗nyg平板上,正置培养48h。此外,由于第一同源重组菌具有km和rif抗性,因此,通过在nyg平板中添加km和rif来筛选第一同源重组菌,30℃倒置培养48h,生长出的单菌落即为第一同源重组菌。
步骤s3中,所述的第二次同源重组培养具体操作流程为:①将第一同源重组菌置于无抗nyg液体培养基中振荡培养12~16h,培养温度为30℃;②将①的培养液涂布于添加有rif的10%蔗糖nyg平板上,在30℃下培养48h获得单菌落。而筛选第二同源重组菌的具体流程为:将第二次同源重组培养获得的单菌落对应接种至含km和rif的nyg平板和仅含rif的nyg平板上,对km敏感的单菌落即为第二同源重组菌。
步骤s4中,pcr验证正向引物序列以及反向引物序列分别如seqidno.7和
seqidno.8所示。验证pcr反应体系详见表6,pcr反应程序为:①95℃预变性10min;②95℃变性1min;③56℃退火30s;④72℃延伸2min;⑤重复②~④35个循环;⑥72℃,10min。将pcr产物置于4℃条件下保存。如图1所示,扩增片段大小约为1kb。
表6为实施例3中步骤s4中的验证pcr反应体系。
对于步骤s5,将步骤s4中通过验证pcr获得的扩增片段送至生工生物工程(上海)股份有限公司广州分公司测序,证明xc_4092已被删除,获得基因敲除突变株xccyh1,即为生产无色黄原胶的工程菌。
实施例4:定性分析xccyh1的菌黄素合成能力
本实施例公开了一种利用平板定性方法分析基因敲除突变株xccyh1的菌黄素合成能力,本实施例的参照对象为野生菌株xcc8004,具体步骤如下所述:
s1、分别将xccyh1和xcc8004接种至nyg液体培养基,在30℃下培养24h;
s2、分别取2μl的xccyh1培养液和xcc8004培养液,接种至nyg无抗平板上,在30℃下培养3d,比较xccyh1和xcc8004的菌落颜色。
如图2所示,基因敲除突变株xccyh1在nyg无抗平板上形成的菌落为白色,而xcc8004在nyg无抗平板上形成的菌落为黄色,定性说明基因敲除突变株xccyh1的菌黄素合成途径被阻断,从而不能合成菌黄素。
实施例5:分光光度法分析xccyh1的菌黄素合成能力
本实施例公开了一种利用分光光度法分析基因敲除突变株xccyh1的菌黄素合成能力,本实施例的参照对象为野生菌株xcc8004,具体步骤如下所述:
s1、分别将xccyh1和xcc8004接种至nyg液体培养基中,在30℃下振荡培养2d;
s2、分别取10ml的xccyh1培养液和xcc8004培养液,离心去上清,获得细胞沉淀物;
s3、用1ml的甲醇重悬步骤s2的细胞沉淀物,室温下振荡混匀10min以萃取菌体细胞色素,离心取含有菌体细胞色素的上清液;
s4、通过分光光度计测定步骤s3获得的上清液在400~500nm范围内的吸收值,并通过吸收值的大小判断xccyh1和xcc8004的菌黄素合成能力。
如图3的吸收曲线所示,在445nm处,突变株xccyh1的含有菌体细胞色素的上清液没有特征性吸收峰,od值相较野生菌株xcc8004显著下降,证明突变株xccyh1的菌黄素合成途径被阻断,突变株xccyh1可用作生产无色黄原胶产品的工程菌。需要说明的是,突变株xccyh1的含有菌体细胞色素的上清液在445nm处还存在光吸收现象,是由于其他中间代谢产物所致。
以上所述仅是本发明的优选实施方式,并非对本发明作任何形式上的限制。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
序列表
<110>广东食品药品职业学院
<120>一种菌黄素合成相关基因及其在构建产无色黄原胶工程菌中的应用
<130>1810026hzqt012
<141>2018-01-10
<160>8
<170>siposequencelisting1.0
<210>1
<211>738
<212>dna
<213>野油菜黄单胞菌(xanthomonascampestris)
<400>1
atgagcacatctgttccacagcgccgtgcgctggtcaccggcggtagcggcgatcttggc60
ggtgcgatctgccgtcagctagcggcgcagggccggcacgtccttgtgcatgccaatcgc120
aatctcgcccgggccgaggaagtggtggcgtccatcgtggccgctggcggcagtgccgaa180
gcggtggccttcgatgtggccgatgcgcaggccagtgcggatgcattggcggcgttgctg240
gaggccgggccgatccacatcgtggtcaacaacgccggcatccacgacgatgcgccgatg300
gccggcatgaacgcgcaacagtggcatcgggtcatcgatgtgtcgctgcacggtttcttc360
aatgtcacccaaccgctgctgctgccgatggcgcgcgcgcgctggggccgcatcgtcagc420
gtgtcgtcggtggcggcggtgctgggcaatcgcggccagaccaattacgccgctgccaag480
gccgcgctgcacggcgccagtaaatcgctcgcgcgcgagatggccagccgcggcatcgcc540
gtcaacgtggtcgcaccgggcgtgatcgaaagcgagatggtcggcgacagcttcgcgccg600
gagatgatcaagcagatggtgccggctggccgcgttggcaaacccgacgaagttgccgcg660
ctggtggcgttcctgtgctcggatgtggctggttacatcaacggccaggtgattggcatc720
aacggcggcatgggctga738
<210>2
<211>245
<212>prt
<213>野油菜黄单胞菌(xanthomonascampestris)
<400>2
metserthrservalproglnargargalaleuvalthrglyglyser
151015
glyaspleuglyglyalailecysargglnleualaalaglnglyarg
202530
hisvalleuvalhisalaasnargasnleualaargalaglugluval
354045
valalaserilevalalaalaglyglyseralaglualavalalaphe
505560
aspvalalaaspalaglnalaseralaaspalaleualaalaleuleu
65707580
glualaglyproilehisilevalvalasnasnalaglyilehisasp
859095
aspalaprometalaglymetasnalaglnglntrphisargvalile
100105110
aspvalserleuhisglyphepheasnvalthrglnproleuleuleu
115120125
prometalaargalaargtrpglyargilevalservalserserval
130135140
alaalavalleuglyasnargglyglnthrasntyralaalaalalys
145150155160
alaalaleuhisglyalaserlysserleualaargglumetalaser
165170175
argglyilealavalasnvalvalalaproglyvalilegluserglu
180185190
metvalglyaspserphealaproglumetilelysglnmetvalpro
195200205
alaglyargvalglylysproaspgluvalalaalaleuvalalaphe
210215220
leucysseraspvalalaglytyrileasnglyglnvalileglyile
225230235240
asnglyglymetgly
245
<210>3
<211>26
<212>dna
<213>人工序列(xanthomonascampestris)
<400>3
aattgaattcgcagcgcatcgtggtg26
<210>4
<211>38
<212>dna
<213>人工序列(xanthomonascampestris)
<400>4
gataagcatacctgagaaaatggaaacctcgtcggggc38
<210>5
<211>41
<212>dna
<213>人工序列(xanthomonascampestris)
<400>5
gacgaggtttccattttctcaggtatgcttatcatatttag41
<210>6
<211>30
<212>dna
<213>人工序列(xanthomonascampestris)
<400>6
tataaagcttccctaaactttgccgcactc30
<210>7
<211>20
<212>dna
<213>人工序列(xanthomonascampestris)
<400>7
ccatgtgcctgtgggaagcg20
<210>8
<211>20
<212>dna
<213>人工序列(xanthomonascampestris)
<400>8
taaaacctgcaccttttcgt20
- 还没有人留言评论。精彩留言会获得点赞!