一种高效提取结核杆菌DNA的方法与流程
本发明属于医药制备技术领域,具体涉及一种高效提取结核杆菌dna的方法。
背景技术:
结核杆菌属于分枝杆菌属,其细胞壁中含有大量类脂,占细菌干重的23.77%,其中40%为蜡质。近年发现结核分枝杆菌在细胞壁外尚有一层荚膜,故结核杆菌细胞壁较一般细菌坚固,提取基因组dna变得更加困难。随着二代测序技术的开展,结核杆菌全基因组测序工作也开展的越来越多。这对获得完整干净的结核杆菌dna提出来更高的要求。
现有技术中,一般采用罗氏固体培养基采用结核分枝杆菌的培养,然而,结核分枝杆菌在罗氏固体培养基上长出菌落后需在bsl3级实验室(生物安全三级实验室)中开盖刮菌后进行菌株灭活和dna提取的操作,因为开盖刮菌的过程有可能造成菌株气溶胶进而污染操作环境,容易造成操作人员菌株感染。并且,我国现在的结核病防治机构中bsl3级实验室数量非常有限,使得操作人员的感染风险大大增加。因此急需一种更加安全的菌株处理方式来进行后续dna提取操作。
目前市面上有一些细菌基因组dna提取试剂盒,可以快速获得dna,但是应用于结核杆菌时,效果往往不理想。
例如,cn201410093113.0公开了一种提取结核杆菌dna的方法以及快速准确检测结核分枝杆菌多重耐药性(mμltipledrugresistence,mdr)的试剂盒。该方法包括从由临床样本提取待检dna,应用荧光实时定量pcr确定结核分枝杆菌感染、鉴别是否为耐药性及何种耐药性菌株感染,最终确定病原体感染数量。
cn201510749457.7提供了一种结核杆菌dna的提取纯化方法,包括以下步骤:细菌悬液经ph为8.0的edta洗涤离心弃上清后,加入ph为8.0的tes缓冲液和5%(w/v)的sds溶液,加入ph为8.0的tes缓冲液和5%(w/v)的sds溶液后,置于温水浴30~50min,再置于沸水浴30~50min,最后在冰上放置3~7min,得到混悬液。
前述方案虽对各别样本效果优异,但对于多种实际细菌的提取时,规模化应用受限,效果均不及国内外大型实验室多采用ctab(hexadecyltrimethylammoniumbromide,十六烷基三甲基溴化铵)法提取结核杆菌dna。该方法的原理是在高离子强度的溶液中,ctab与蛋白质和多聚糖形成复合物,只是不能沉淀核酸.通过有机溶剂抽提,去除蛋白、多糖、酚类等杂质后加入乙醇沉淀即可使核酸分离出来。ctab法可以得到纯净的dna,但是耗时长,操作误差大。
技术实现要素:
针对以上技术的不足,提供了一种高效、安全、简便的结核杆菌dna提取方法,包括使用液体培养物,报阳之后灭活,然后再开盖,之后采用改良的ctab方法和硅胶膜离心柱法进行细菌dna提取。
dna提取的原理是经溶菌酶、sds破坏细胞壁后,ctab处理,氯仿抽提后离心去除多糖、多酚和蛋白质。上清中还加入异丙醇离心沉淀基因组dna,然后基因组dna在高离序盐状态下选择性吸附于离心柱内硅基质膜,再通过一系列快速的漂洗-离心的步骤,进一步将多糖、多酚和细胞代谢物、蛋白等杂质去除,最后低盐的洗脱缓冲液将纯净基因组dna从硅基质膜上洗脱。
具体地,本发明通过以下技术手段来实现:
一种高效提取结核杆菌dna的方法,包括,使用液体培养物进行结核杆菌培养,报阳之后灭活,然后再开盖,之后采用改良的ctab方法提取,和硅胶膜离心柱法进行细菌dna分离。
具体的,作为本发明的一种优选技术方案,使用液体培养物进行结核杆菌培养步骤包括:
作为本发明的一种优选技术方案,使用美国bd公司bactecmgit960分枝杆菌培养监测仪,待系统报阳后取出mgit管,直接在水浴90-100℃下灭活30分钟以上,优选95度30分钟灭活后将该培养物作为后续提取dna的样品。通过大量的实验研究发现,由于细菌在灭活后才进行的开盖操作,从而避免了生物安全危害。
作为本发明的一种优选技术方案,采用ctab法和硅胶膜离心柱相结合的方法进行细菌dna分离包括以下步骤:
收集灭活后的菌体,离心,弃上清,菌体沉淀用te重悬,加入溶菌酶,混匀,37℃孵育16-20小时;
加入sds和5μl蛋白酶k溶液,混匀,孵育;
加入nacl和预热的ctab/nacl溶液,旋涡震荡混匀之呈现乳白色,孵育;
加入氯仿/异戊醇(24:1),颠倒混匀;离心;转移上层水相;
加入异丙醇和醋酸钠,混匀;
吸取混匀的液体转入吸附柱中,离心,弃掉废液;
向吸附柱中加入缓冲液gd,离心,弃掉废液;
向吸附柱中加入漂洗液pw,离心,弃掉废液;
将吸附柱置于室温放置数分钟,以彻底晾干吸附材料中残余的漂洗液;
将吸附柱滴加洗脱缓冲液te,室温放置2-5min,离心,收集溶液。
作为前述提取和分离的一种优选技术方案,优选吸附柱cb3、缓冲液gd及漂洗液pw均为天根生物科技有限公司产品,货号分别为rk127,rk118和rk113。
作为前述提取和分离的一种优选技术方案,是通过大量实验研究发现的最佳提取和分离方案,具体地,
(1).13000rcf离心3min,弃上清,菌体沉淀用400μlte重悬,加入50μl溶菌酶(10mg/ml),混匀,37℃孵育16-20小时;
(2).65℃预热ctab/nacl(室温放置会呈凝胶状,用前先在65℃预热,反复加热会影响其效果);
(3).加入70μl10%sds和5μl蛋白酶k(20mg/ml)溶液,混匀,65℃孵育10min;(轻轻混匀);
(4).加入100μl5mnacl和100μl预热的ctab/nacl溶液,旋涡震荡混匀之呈现乳白色,65℃孵育10min;
(5).加入750μl氯仿/异戊醇(24:1),颠倒混匀;12000rpm离心5min;转移上层水相至另一新的离心管;
(6).加入0.6倍体积(约450μl)的异丙醇和0.1体积(约75μl)3mol/l的醋酸钠,轻轻颠倒混匀;
(7).600-700μl混匀的液体转入吸附柱cb3中,12,000rpm(~13,400×g)离心30sec,弃掉废液;
(8).重复步骤5;
(9).向吸附柱cb3中加入500μl缓冲液gd,12,000rpm(~13,400×g)离心30sec,倒掉废液,将吸附柱cb3放入收集管中;
(10).向吸附柱cb3中加入600μl漂洗液pw,12,000rpm(~13,400×g)离心30sec,倒掉废液,将吸附柱cb3放入收集管中;
(11).重复操作步骤7;
(12).将吸附柱cb3放回收集管中,12,000rpm(~13,400×g)离心2min,倒掉废液。将吸附柱cb3置于室温放置数分钟,以彻底晾干吸附材料中残余的漂洗液。
(13).将吸附柱cb3转入一个干净的离心管中,向吸附膜的中间部位悬空滴加50-200μl洗脱缓冲液te,室温放置2-5min,12,000rpm(~13,400×g)离心2min,将溶液收集到离心管中。
与现有技术相比,本发明具有以下有益效果:
1.采用临床上检验中所用的mgit液体培养物,灭活后再开盖进行dna提取的方式,由于灭活后菌株已经没有生物活性,从而避免了生物安全危害。
2.液体培养物与固体培养基相比,培养时间更短,且因为细菌分散在培养基中,更加容易裂解,可提供dna的得率。
3.与商用试剂盒相比,本发明提供的提取方法提取率高,经济实惠。
4.与传统ctab法相比,本方法操作简单,大大节约了实验时间,尤其在处理较大样本量时该优点更加明显。
附图说明
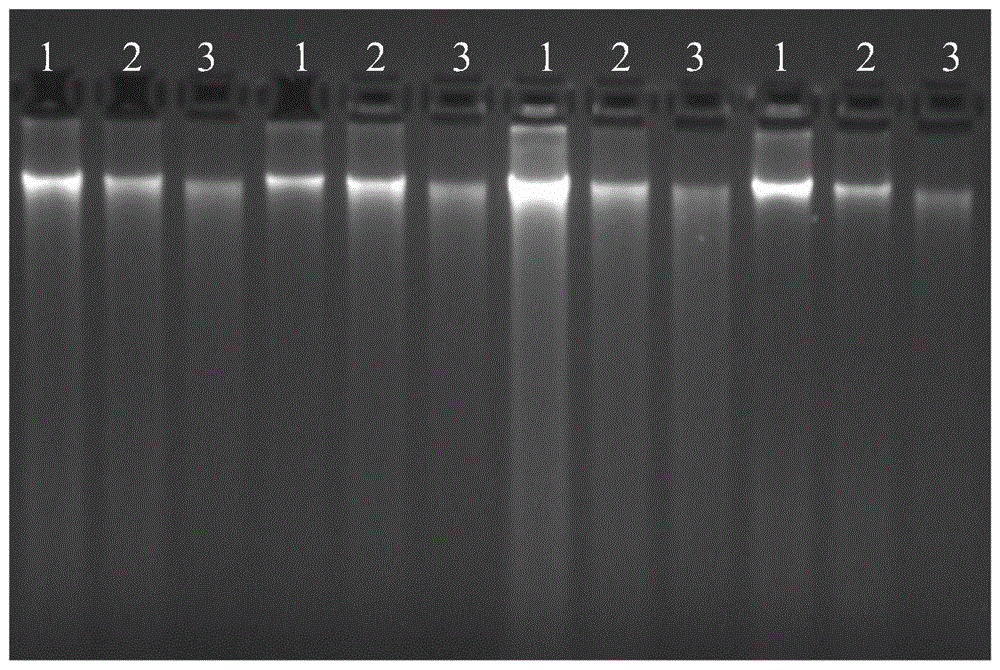
图1,本发明实施例和对比实施例的电泳图,其中,1是传统ctab方法,2是新方法,3是天根试剂盒。
图2,前述实验方法dna拷贝数,纯度及耗时、成本对比表1。
具体实施方式
下面结合实施例和附图对本发明作进一步详细的描述,但发明的实施方式不限于此。
实施例1
使用本发明方法与现有商用试剂盒、传统ctab方法提取结核杆菌dna
使用美国bd公司bactecmgit960分枝杆菌培养监测仪,待系统报阳后取出mgit管。将管子放于水浴锅内,95℃灭活30分钟。取菌株a/b/c/d,样本充分吹打混匀,平均分为三份,分别标记a-1、a-2、a-3,b-1、b-2、b-3,c-1、c-2、c-3,d-1、d-2、d-3。a-1、b-1、c-1、d-1采用传统ctab法提取,a-2、b-2、c-2、d-2采用本发明中的方法提取提取,a-3、b-3、c-3、d-3采用天根细菌基因组提取试剂盒提取。
(1)传统ctab法提取结核杆菌dna
1.13000rcf离心3min,弃上清,菌体沉淀用400μlte重悬,加入50μl溶菌酶(10mg/ml),混匀,37℃孵育16-20小时。
2.65℃预热ctab/nacl(室温放置会呈凝胶状,用前先在65℃预热,反复加热会影响其效果).
3.加入70μl10%sds和5μl蛋白酶k(20mg/ml)溶液,混匀,65℃孵育10min;(轻轻混匀)
4.加入100μl5mnacl和100μl预热的ctab/nacl溶液,旋涡震荡混匀之呈现乳白色,65℃孵育10min;
5.加入750μl氯仿/异戊醇(24:1),颠倒混匀;13000rcf离心5min;转移上层水相至另一新的离心管.
6.加入0.6倍体积(大约450μl)的异丙醇以沉淀dna;-20℃放置30min,3000rcf离心15min;
7.弃上清,留20μl;13000rcf离心5min,移液器吸出剩余液体;
8.60℃干燥20min。
9.用50μlte溶解dna沉淀,60℃孵育20min后4℃备用。
(2)采用天根细菌基因组提取试剂盒(货号dp302)提取
1.13000rcf离心3min,弃上清。
2.加入180μl缓冲液(20mmtris,ph8.0;2mmna2-edta;1.2%triton;终浓度为20mg/ml的溶菌酶(溶菌酶必须用溶菌酶干粉溶解在缓冲液中进行配制,否则会导致溶菌酶无活性)),37℃过夜处理。
3.向管中加入20μlproteinasek溶液,混匀。
4.加入220μl缓冲液gb,振荡15sec,70℃放置10min,溶液应变清亮,简短离心以去除管盖内壁的水珠。
5.加220μl无水乙醇,充分振荡混匀15sec,此时可能会出现絮状沉淀,简短离心以去除管盖内壁的水珠。
6.将上一步所得溶液和絮状沉淀都加入一个吸附柱cb3中(吸附柱放入收集管中),12,000rpm(~13,400×g)离心30sec,倒掉废液,将吸附柱cb3放入收集管中。
7.向吸附柱cb3中加入500μl缓冲液gd(使用前请先检查是否已加入无水乙醇),12,000rpm(~13,400×g)离心30sec,倒掉废液,将吸附柱cb3放入收集管中。
8.向吸附柱cb3中加入600μl漂洗液pw(使用前请先检查是否已加入无水乙醇),12,000rpm(~13,400×g)离心30sec,倒掉废液,吸附柱cb3放入收集管中。
9.重复操作步骤8。
10.将吸附柱cb3放回收集管中,12,000rpm(~13,400×g)离心2min,倒掉废液。将吸附柱
cb3置于室温放置数分钟,以彻底晾干吸附材料中残余的漂洗液。注意:这一步的目的是将吸附柱中残余的漂洗液去除,漂洗液中乙醇的残留会影响后续的酶反应(酶切、pcr等)实验。
11.将吸附柱cb3转入一个干净的离心管中,向吸附膜的中间部位悬空滴加50-200μl洗脱缓冲液te,室温放置2-5min,12,000rpm(~13,400×g)离心2min,将溶液收集到离心管中。
(3)本发明中的方法提取结核杆菌dna
1.13000rcf离心3min,弃上清,菌体沉淀用400μlte重悬,加入50μl溶菌酶(10mg/ml),混匀,37℃孵育16-20小时。
2.65℃预热ctab/nacl(室温放置会呈凝胶状,用前先在65℃预热,反复加热会影响其效果).
3.加入70μl10%sds和5μl蛋白酶k(20mg/ml)溶液,混匀,65℃孵育10min;(轻轻混匀)
4.加入100μl5mnacl和100μl预热的ctab/nacl溶液,旋涡震荡混匀之呈现乳白色,65℃孵育10min;
5.加入750μl氯仿/异戊醇(24:1),颠倒混匀;12000rpm离心5min;转移上层水相至另一新的离心管.
6.加入0.6倍体积(约450μl)的异丙醇和0.1体积(约75μl)3mol/l的醋酸钠,轻轻颠倒混匀。
7.600-700μl混匀的液体转入吸附柱cb3中,12,000rpm(~13,400×g)离心30sec,弃掉废液。
8.重复步骤5。
9.向吸附柱cb3中加入500μl缓冲液gd(使用前请先检查是否已加入无水乙醇),12,000rpm(~13,400×g)离心30sec,倒掉废液,将吸附柱cb3放入收集管中。
10.向吸附柱cb3中加入600μl漂洗液pw(使用前请先检查是否已加入无水乙醇),12,000rpm(~13,400×g)离心30sec,倒掉废液,将吸附柱cb3放入收集管中。
11.重复操作步骤7.
12.将吸附柱cb3放回收集管中,12,000rpm(~13,400×g)离心2min,倒掉废液。将吸附柱cb3置于室温放置数分钟,以彻底晾干吸附材料中残余的漂洗液。
13.将吸附柱cb3转入一个干净的离心管中,向吸附膜的中间部位悬空滴加50-200μl洗脱缓冲液te,室温放置2-5min,12,000rpm(~13,400×g)离心2min,将溶液收集到离心管中。
注:为增加基因组dna的得率,可将离心得到的溶液再加入吸附柱cb3中,室温放置2min,12,000rpm(~13,400×g)离心2min。
实验结果参照图2的表1所示,从结果可以得知:
1.采用临床上检验中所用的mgit液体培养物,灭活后再开盖进行dna提取的方式,由于灭活后菌株已经没有生物活性,从而避免了生物安全危害。
2.液体培养物与固体培养基相比,培养时间更短,且因为细菌分散在培养基中,更加容易裂解,可提高dna的得率。
3.与商用试剂盒相比,本发明提供的提取方法提取率高,纯度高,经济实惠。
4.与传统ctab法相比,本方法操作简单,大大节约了实验时间,尤其在处理较大样本量时该优点更加明显。
其中,od260/280比值指260nm和280nm下吸光光度比值。od是opticaldensity(光密度)的缩写,表示被检测物吸收掉的光密度,od=lg(1/trans),其中trans为检测物的透光值。一般来说od260代表核酸的吸光度,od280代表蛋白质的吸光度。当比值为1.7-2.0之间表示没有被蛋白污染,,而污染值越小,蛋白污染越多,纯度越差。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!