可洗消神经毒剂的酶-聚合物复合物及其制备方法和用途与流程
本发明涉及防化领域,具体涉及酶-聚合物复合物,其可作为神经毒剂的洗消材料。所述复合物能够实现神经毒剂的极快速洗消,且性能温和,对皮肤、设备、环境等无刺激性。
背景技术:
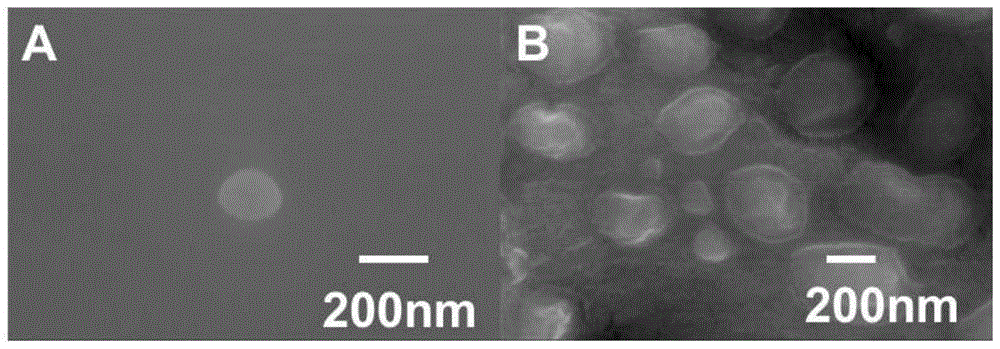
:1.神经毒剂的简介神经毒剂(nerveagent)是化学战剂cwa(chemicalwarfareagents)中的一种,指破坏神经系统正常传导功能的有毒性化学物质。神经毒剂的致伤途径包括皮肤、眼、呼吸道、消化道等,其中皮肤表面积最大,最易沾染毒剂造成中毒甚至死亡。神经毒剂主要分为g类毒剂和v类毒剂,它们的共性是:稳定性,即常温下不易分解;速杀性,即如不及时抢救,可迅速造成伤员死亡。g类毒剂主要包括塔崩ga(tabun)、沙林gb(sarin)、梭曼gd(soman),它的特点是隐蔽性,即无臭无味、无刺激、不易被发现。gd几乎没有特异体内解毒酶,机体染毒后救治非常困难。v类毒剂主要为维埃克斯vx,其特点是长效性,在环境中降解非常缓慢,其使用后施毒区域沾染维持很长时间;高毒性,其毒性极高,是梭曼毒性的十倍。综上原因,为快速从人体、环境中除去神经毒剂,保证平民或作战人员生命安全,针对神经毒剂洗消材料的研究尤其重要。2.神经毒剂的洗消现有针对神经毒剂洗消的方法主要包括:天然洗消、物理洗消、化学洗消和生物洗消。天然洗消主要通过通风、日晒、雨水冲刷、自行蒸发分解等方法对染毒物体上的神经毒剂进行洗消,洗消速度极慢且不可控;物理洗消主要通过活性炭等吸附材料,以吸附、溶剂吸收、高温分解、冲洗等方式进行,可快速洗消,但洗消不彻底,易造成泄露或二次污染;化学洗消主要包括使用含有有效氯的化合物(例如次氯酸盐类或氯胺类等)、碱-醇-胺消毒体系(例如氢氧化钠、碳酸氢钠或乙醇胺等)、氧化剂等材料(例如双氧水),通过化学反应彻底消除毒剂,但是有一定刺激性和腐蚀性,部分材料难以应用于设备和人体;生物洗消,主要通过生物洗消酶催化水解神经毒剂,因其具有高效、环境友好、无腐蚀、无刺激等突出优势,被称为“最理想的洗消剂”。1992年生物化学和分子生物学国际联盟委员会统一将上述生物洗消酶归为磷酸三酯水解酶pth(phosphorictriesterhydrolase),包括以有机磷水解酶oph(organophosphorushydrolase)、甲基对硫磷水解酶(methylparathionhydrolase)和有机磷水解酶c2(ophc2)为代表的磷酸三酯酶pte(phosphotriesterase)类,以二异丙基氟磷酸酯酶dfpase(diisopropyl-fluorophosphatase)、人血清对氧磷酶1(humanserumparaoxonase1,pon1)和有机磷酸酐酶opaa(organophosphorousacidanhydrolase)为代表的二异丙基氟磷酸酯酶dfpase类。其中,以oph为代表的水解酶,以断裂毒剂分子的p-o键为主,以dfpase为代表的水解酶,以断裂毒剂分子的p-o,p-cn键为主。相比于oph酶,dfpase分子量小,易于后期的分离制备和处理,且耐高温不易失活(70度),可反复冻融,有很宽的ph适用范围(6.65-8.2),因此被德国联邦国防军装备。总体上,生物洗消酶的优点是可以在温和条件下高效、特异地催化分解毒剂,对皮肤、身体等刺激性小。生物酶类洗消剂虽温和,但是洗消效率较慢,而神经毒剂又是速杀类毒剂,若采用该类型材料作为皮肤等洗消剂,则会出现酶还在缓慢的洗消毒剂,但人员已经中毒死亡等情况。神经毒剂的高致死率、速杀性对洗消技术和洗消材料提出了较高的要求:(1)洗消剂须对毒剂完全彻底洗消,稍有残留即会造成严重的中毒反应;(2)洗消剂须尽可能在毒剂分子扩散和起效前,在极快速的时间内完成对毒剂分子的洗消,阻止其于皮肤等接触;(3)尽可能性能温和,不刺激和损伤皮肤,不腐蚀和破坏装备,减少对环境的污染。因此,如何设计一种具有高效、快速和低刺激的洗消剂,一直是本领域尚待解决的问题。技术实现要素:在本发明中,除非另有说明,否则本文中使用的科学和技术名词具有本领域技术人员所通常理解的含义。并且,本文中所涉及的实验室操作步骤均为相应领域内广泛使用的常规步骤。同时,为了更好地理解本发明,下面提供相关术语的定义和解释。如本文中使用的,术语dfpase,为二异丙基氟磷酸酯酶。如本文中使用的,术语nas,为n-丙烯酰氧基琥珀酰亚胺。如本文中使用的,术语dmaema,为甲基丙烯酸-2(n,n-二甲基)乙酯。如本文中使用的,术语mba,为n,n’-亚甲基双丙烯酰胺。如本文中使用的,术语kps,为过硫酸钾。如本文中使用的,术语tmeda,为n,n,n',n'-四甲基二乙胺。如本文中使用的,术语nhs,为n-羟基琥珀酰亚胺。如本文中使用的,术语dfpase-dmaema,为二异丙基氟磷酸酯酶-水凝胶复合物。如本文中使用的,术语oph-dmaema,为有机磷水解酶-水凝胶复合物。如本文中使用的,术语f127,为聚氧乙烯/聚氧丙烯/聚氧乙烯两亲嵌段共聚物(pluronicf127,简称为f127)如本文中使用的,术语atch,为碘化硫代乙酰胆碱。如本文中使用的,术语dtnb为5,5-二硫代双硝基苯甲酸。如本文中使用的,术语h,为小时。如本文中使用的,术语min,为分钟。如本文中使用的,术语n,为摩尔数。如本文中使用的,术语m,为摩尔质量,即g/mol。如本文中使用的,术语g,为克数。如本文中使用的,术语v,为体积。为了满足针对神经毒剂的高效、大量、快速、广谱的洗消需求,发明人通过深入的研究和创造性的劳动,得到了本申请的酶-聚合物复合洗消材料,其可以用于针对神经毒剂的极快速洗消,并且温和不刺激皮肤,由此提供了下述发明:在一个方面,本申请提供一种应用于神经毒剂洗消的酶-聚合物复合物,其特征在于,所述酶选自二异丙基氟磷酸酯酶(dfpase)类磷酸三酯水解酶(简称dfpase类酶);所述聚合物为水溶性聚合物。在一些优选的实施方案中,所述dfpase类磷酸三酯水解酶选自dfpase、人血清对氧磷酶1(pon1)和有机磷酸酐酶(opaa)。在一些优选的实施方案中,所述聚合物选自聚甲基丙烯酸-2-(n,n-二甲氨基)乙酯(pdmaema)、聚丙烯酸、f127、吐温、曲拉通x100、plga及其与交联剂形成的交联聚合物。在一些优选的实施方案中,所述聚合物选自聚甲基丙烯酸-2-(n,n-二甲氨基)乙酯(dmaema)、f127及其与交联剂形成的交联聚合物。在一些优选的实施方案中,所述交联剂为n,n’-亚甲基双丙烯酰胺(mba)。在一些优选的实施方案中,所述神经毒剂为有机磷毒剂,包括沙林、塔崩、梭曼和vx,其中优选为梭曼。在一些优选的实施方案中,所述dfpase类酶通过表面氨基引入单体基团。在一些优选的实施方案中,所述单体基团选自-co-(ch2)m-ch=ch2,m选自0-6的整数。在一些优选的实施方案中,所述复合物经连有所述单体基团的dfpase、甲基丙烯酸-2-(n,n-二甲氨基)乙酯以及任选的交联剂聚合而成。在一些优选的实施方案中,所述复合物由所述f127通过连接体-co-(ch2)n-co-与dfpase连接形成,其中n选自0-6的整数。在一些优选的实施方案中,所述复合物的粒径为50-400纳米(例如50-350纳米,50-300纳米,50-250纳米,50-200纳米,50-150纳米,100-350纳米,100-300纳米,100-250纳米,100-200纳米,100-150纳米,150-350纳米,150-300纳米,150-250纳米或150-200纳米)。在一些优选的实施方案中,所述复合物为核壳结构。在一些优选的实施方案中,所述复合物壳层厚度为50-200nm(例如50-150nm,50-100nm或100-150nm)。在另一个方面,本申请提供上述复合物的制备方法,其包括以下步骤:方法1:(1)将所述酶上引入单体基团,而后与所述聚合物的单体以及任选的交联剂发生聚合反应,得到所述复合物粗品;(2)将步骤(1)中得到的复合物粗品透析得到所述复合物;或者,方法2:(1)将所述聚合物上引入连接体,而后将所述引入连接体的聚合物加入酶的水溶液中反应得到所述复合物粗品;(2)将步骤(1)中得到的复合物粗品透析得到所述复合物。在方法1中:在一些优选的实施方案中,所述单体基团选自-co-(ch2)m-ch=ch2,m选自0-6的整数;在一些优选的实施方案中,所述交联剂(如果存在)与下述聚合物的单体的摩尔比为(0.2-1):1(例如0.2:1、0.3:1、0.4:1、0.5:1、0.6:1、0.7:1、0.8:1、0.9:1或1:1):pdmaema、聚丙烯酸;在一些优选的实施方案中,所述聚合反应中还加有引发剂。在一些优选的实施方案中,所述引发剂为过硫酸钾。在一些优选的实施方案中,所述引发剂与聚合物的单体的摩尔比为(0.01-0.5):1(例如0.01:1、0.1:1、0.2:1、0.3:1、0.4:1或0.5:1);在一些优选的实施方案中,所述聚合反应中还加有ph调节剂。在一些优选的实施方案中,所述ph调节剂为n,n,n',n'-四甲基二乙胺。在一些优选的实施方案中,所述ph调节剂的用量为使得反应体系ph=7.5-9.5。在方法2中:在一些优选的实施方案中,所述连接体选自-co-(ch2)n-co-,n选自0-6的整数;在一些优选的实施方案中,所述聚合物选自f127、吐温、曲拉通x100和plga;在一些优选的实施方案中,所述酶的水溶液浓度为0.1-1mg/ml,例如0.1-0.5mg/ml,0.2mg/ml;在一些优选的实施方案中,所述连接体一端与所述酶表面氨基通过酰胺键连接,另一端通过酯键与所述聚合物连接;在一些优选的实施方案中,将所述复合物粗品透析除去分子量为5000以下的小分子杂质。经方法1或2所得复合物为粒径为50-400纳米(例如50-350纳米,50-300纳米,50-250纳米,50-200纳米,50-150纳米,100-350纳米,100-300纳米,100-250纳米,100-200纳米,100-150纳米,150-350纳米,150-300纳米,150-250纳米或150-200纳米)的核壳结构;其壳层厚度为50-200纳米(例如50-150纳米,50-100纳米或100-150纳米)。在另一个方面,本申请提供一种洗消组合物或洗消液,其含有前述的复合物。在另一个方面,本申请提供一种防护装备,其含有前述的复合物或洗消组合物或洗消液。在另一个方面,本申请提供前述的复合物、洗消组合物或洗消液或防护装备在洗消毒剂中的用途。在一些优选的实施方案中,所述毒剂为神经毒剂或糜烂性毒剂。在一些优选的实施方案中,所述神经毒剂为有机磷毒剂,例如选自沙林、塔崩、梭曼和vx,优选为梭曼。在一些优选的实施方案中,所述糜烂性毒剂为芥子气、路易试剂或氮芥气。发明的有益效果本申请的酶-聚合物复合物具有以下有益效果中的一个或多个:本申请提供一种神经毒剂洗消材料,其为酶-聚合物复合物,其能够实现对神经毒剂极快速的洗消,并且温和不刺激皮肤。在某些优选的实施方案中,所述复合物可趋近100%洗消梭曼毒剂。在某些优选的实施方案中,所述复合物可在极短时间内(例如2s内)实现趋近100%的洗消效率。本申请的酶-聚合物复合物安全性高,温和不刺激皮肤。本申请的复合物所使用的纳米载体为天然酶类材料,无免疫原性、生物相容性高,降解产物为多种氨基酸,无毒副作用。与传统的酶高分子固化的合成方案相比,本发明人意外发现改变聚合物和酶的投料顺序(如本申请复合物制备方法2步骤(1)所述)而获得的产品洗消速率提升为2秒内达到100%,远超现有报道。附图说明图1显示了dfpase复合物的扫描电镜照片;其中,图a为dfpase-pdmaema,尺寸在200-300nm左右;图b为dfpase-f127,呈圆形,尺寸在200-300nm左右。图2显示了dfpase复合物的透射电镜照片;其中,图a为dfpase-pdmaema;图b为dfpase-f127;其为核壳结构,中心为深色蛋白,外层为浅色高分子层。图3显示了dfpase复合物的x射线衍射结果。图4显示了高、低剂量下dfpase-pdmaema和dfpase-f127洗消速率。图5显示了常用洗消材料对梭曼洗消速率比较。图6显示了高浓度naoh(图a),dfpase-pdmaema(图b),dfpase-f127(图c)和正常组(图d)对皮肤的刺激性和损伤的病理和照片。图7显示了dfpase-pdmaema和dfpase-f127对大鼠皮肤洗消后体内血酶的抑制率。图8显示了oph-pdmaema的洗消速率。具体实施方式下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。实施例1dfpase-pdmaema的合成1.dfpase的分离和提纯(1)称取新鲜猪肝650g放入烧瓶中,剪成细小碎块,加蒸馏水混合。(2)往其中加入100ml细胞裂解液,使猪肝组织细胞充分破裂。(3)用匀浆机分批匀浆,收集共得到2000ml匀浆液。(4)将匀浆液离心(10000r/min,20min,4℃),收集上清得上清液a共1500ml(悬浊液)。(5)将上清液a热处理。将收集的上清液于60℃水浴10min,而后迅速放入冰块中冷却。而后将其离心(10000r/min,10min,4℃),去除变性蛋白杂质,收集得上清b液1175ml(红色,透亮)。(6)对上清液b过滤,去除杂质。用50ml针管吸取b液,分批次用0.22μm滤膜压滤,共得到c液1160ml。(7)为除去c液中小分子盐类和部分水分,用容量为15ml的超滤管(截留分子量为3000)离心超滤(10000r/min,1h,4℃),共收集得到浓缩后的d液98ml。(8)配α-萘酚重氮盐显色反应试剂,目的是为了确定下一步层析过程中含dfpase的试管位置。其反应原理是:dfpase在一定条件下能够水解α-萘酚乙酯,生成了产物α-萘酚,后者可与稳定的重氮盐快紫b盐(fastvioletbsalt)发生耦合,生成稳定的紫红色化合物,该物质在波长580nm处有较好的吸收值。试剂配制:a.底物溶液:1份0.03mol/lα-萘酚乙酯(叔丁醇:正丁醇=9:1(v:v)为溶剂)+50份0.2mol/l、ph7.4的磷酸缓冲液+49份水(v:v:v)。b.显色试剂:快紫b盐溶解于0.2mol/l、ph7.4的磷酸缓冲液,浓度为0.1%。c.测定方法:将待测溶液加入到底物溶液中,于37℃保温5min后立即加入显色试剂,溶液由无色变成红色,即证明含有dfpase。(9)通过α-萘酚重氮盐显色反应确定步骤(7)中d液(显色)为含dfpase的溶液,d滤出液(不显色)不含dfpase。(10)d滤出液的de52凝胶柱层析分离。分10次,每次约10ml加样,进行de52层析,采用收集器每5ml一管收集样本。通过α-萘酚重氮盐显色法,确定dfpase所在接样试管,并收集,共收集得到e液约141ml。(11)dfpase的g50凝胶柱层析分离。将e液分14批次,每次约10ml加样进行g50层析。通过α-萘酚重氮盐显色法,确定dfpase所在接样试管,并收集,共收集约f液127ml。(12)通过bca蛋白定量法测定f液中dfpase酶的浓度,标准曲线y=0.8978x+0.085,r2=0.997,最终测得dfpase浓度为0.2mg/ml。2.dfpase-pdmaema的合成(1)解冻dfpase(0.2mg/ml)30ml放入梨形瓶中,在避光条件下搅拌(600r/min)。(2)随后称取乙烯酰基引入剂nas25mg溶于500μldmso溶剂中,而后吸取180μl加入上述反应体系中。(3)而后依次缓慢滴入引发剂kps溶液(30μl,10%w/v)、单体dmaema的dmso溶液(40μl,10%w/v)、交联剂mba的dmso溶液(30μl,10%w/v)、酸碱调节剂tmeda的dmso溶液(6μl,10%w/v),在室温条件下避光搅拌(600r/min,6h)。(4)透析袋预处理。首先配置2%w/t的nahco3水溶液500ml,1mm的edta二钠水溶液500ml。随后,将截留分子量为5000的透析袋裁剪成长度为30cm。将该透析袋先后放入上述nahco3和edta二钠两组溶液中分别依次煮沸(100℃,10min),每次煮沸完均用蒸馏水冲洗,并分别称取30ghepes和1.2gnaoh加入到2.5l蒸馏水中,充分搅拌分散溶解配置为透析液待用。(5)产物透析。将(3)反应的溶液加入到透析袋(勿超过透析袋总容积的1/2-1/3),用夹子封闭透析袋两端,随后将其放入透析液中,在室温下低速搅拌(150r/min)。期间每12h更换一次透析液,共更换3次透析液,彻底清除溶液中多余的小分子单体杂质。透析48h后收集透析袋中的溶液,得到产物dfpase-pdmaema,该产物无色透明,共30ml,反应前后整体溶液体积未发生明显变化,将其放入冰箱冷冻储存(-20℃)。实施例2.dfpase-f127的合成(1)称取5gf127放入容积为50ml的两口梨形瓶中,体系密封,抽真空而后充满氮气,后续该梨形瓶中的反应均在充满氮气的体系中进行。将15ml1,4-二氧六环和110μl三乙胺混匀,而后加入97mgdmap彻底溶解,用注射器将该溶液注入上述梨形瓶中,并不断搅拌(1000r/min,90min)。(2)将琥珀酰酐溶液(99mg琥珀酰酐溶于5ml1,4-二氧六环中)通过恒压滴液漏斗缓慢滴入到梨形瓶中,在室温下继续搅拌(1000r/min,41h)。(3)停止搅拌后,将溶液转移到100ml梨形瓶中(溶液接近油状无色)。用旋蒸仪悬蒸(100℃)除去多余的1,4-二氧六环。(4)用乙醚混匀该样本,离心两次(10000r/min,10min),去除未反应的多余杂质,保留沉淀f127-cooh产物,共约5g。(5)将f127-cooh(总量约5g)溶于65ml二氯甲烷中,室温下搅拌(1500r/min,10min)。将800mgedc溶于5ml二氯甲烷中,而后滴入到该反应中继续搅拌30min。(6)将nhs(500mg)溶于10ml二氯甲烷中,滴入到反应体系中,室温搅拌24h,溶液总体积共约80ml,为乳白色悬浊液。(7)溶液混合物用冷乙醚沉淀3次,而后用旋蒸仪旋干(40℃),收集得到乳白色沉淀f127-nhs,干燥后得f127-nhs粉末。(8)dfpase溶液(0.2mg/ml,20ml)中加入f127-nhs粉末800mg(即40mg/ml,20ml),搅拌(1000r/min,16℃)18h。(9)透析,透析方法同实施例1步骤4-5,得到产物dfpase-f127。实施例3dfpase-f127和dfpase-pdmaema的物理学评价(1)形貌表征。分别取微量(约150~200μl)dfpase-f127和dfpase-pdmaema水溶液(dfpase的浓度为0.2mg/ml)和滴于硅片上,室温自然风干。待干燥后,喷镀一层纳米金层以增强样品的导电性,将样品置于扫描电子显微镜(sem)下观察,见图1,可看出,所合成的dfpase-f127和dfpase-pdmaema为尺寸大概在200-300nm左右的纳米颗粒。(2)内部结构表征。取50μldfpase-f127和dfpase-pdmaema水溶液(dfpase的浓度为0.2mg/ml)滴于铜网上自然风干,待完全干燥后,置于透射电子显微镜(tem)观察,见图2,可看出dfpase为直径约为200-300nm的近圆形纳米颗粒;纳米颗粒内核称度高,外层显称度较低,证明该纳米材料为核壳结构。(4)xrd测定。取dfpase-f127和dfpase-pdmaema水溶液(浓度为0.2mg/ml)、dmaema、f127水溶液滴于2*2cm载玻片上,重复滴加多次。待干燥后,将样品置于xrd下观察,结果见图3。f127为无序的结构未出现明显的衍射峰,而合成的dfpase-f127和dfpase-pdmaema在2θ=6.47874°处可见明显的尖峰(蓝色),通过几组衍射峰对比可得知,该峰为合成的复合物的晶格衍射,同样证明,通过f127端基的活化修饰,成功将其与蛋白上的氨基结合,形成纳米复合结构;通过在蛋白上引入单体,随后蛋白参与了自由基聚合反应,在蛋白外层成功修饰了高分子。高分子的引入,在2θ=6.47874°左右形成新的衍射峰,初步证明,该峰的形成,与高分子种类无关,而与所形成的纳米结构有关。实施例4各复合物对神经毒剂的洗消评价具体实验步骤:1.配制洗消反应的溶液试剂(1)饱和联苯胺溶液:过量(1g)联苯胺加入200ml蒸馏水中,70℃水浴1h溶解度增加。而后立即用50ml注射器吸取溶液,用0.22μm滤膜压滤。得到饱和联苯胺溶液200ml。(2)0.25%过硼酸钠溶液:0.5g过硼酸钠加入200ml蒸馏水中,充分溶解。(3)0.01mpbs溶液:用现有0.2mpbs溶液稀释至1/20。(4)丙酮-0.01mpbs溶液:比例为200ml丙酮加入90ml0.01mpbs溶液。共290ml。(5)分别配制各种洗消材料浓度均为0.2mg/ml。2.制作梭曼的联苯胺反应标准线性曲线(标准曲线)。(1)领取梭曼90%纯度10μl,溶于9.99ml蒸馏水中,即稀释1000倍,标定为母液,于冰块中储存。(2)依据不同浓度稀释梭曼编号稀释倍率浓度(v/v)配法11/101*10(-4)0.5ml母液+4.5ml蒸馏水21/201/2*10(-4)1ml①+1ml蒸馏水31/401/4*10(-4)1ml①+3ml蒸馏水41/1201/12*10(-4)1ml③+2ml蒸馏水51/8401/84*10(-4)1ml④+6ml蒸馏水61/58801/588*10(-4)1ml⑤+6ml蒸馏水70蒸馏水(3)联苯胺显色反应:150μl蒸馏水和50μl梭曼(不同浓度)混匀,离心(3000r,1min)后,37℃水浴20min。随后依次加入丙酮+0.01mpbs混合溶液600μl,饱和盐酸联苯胺溶液300μl,0.25%过硼酸钠溶液300μl,混匀。放入37℃烘箱5min,加入96孔板。测定414nm下吸光度值。多余梭曼用浓naoh破坏处理。(4)通过计算,梭曼联苯胺反应标准曲线方程为y=1.4184x+0.0525,r2=0.9992。梭曼浓度在0-0.1μg/μl范围内,其吸光度值在该线性范围内。通过这个方法可以测定残余梭曼的含量。3.dfpase、dfpase-pdmaema和dfpase-f127对梭曼洗消速率取90%纯度的梭曼按上述第2项中方法稀释至5*10-5(v/v),将dfpase、dfpase-pdmaema和dfpase-f127(所有材料中,dfpase浓度均为0.2mg/ml)3.125ml(高浓度组)和0.625ml(低浓度组)分别加入到两个10mlep管中,而后各管分别加入梭曼1.25ml,再加入蒸馏水调至总体积7.5ml,充分混匀,放入三用水箱中水浴(37℃)。每隔一定时间点从该ep管中取200μl,随后依次加入丙酮-0.01mpbs溶液600μl,饱和联苯胺溶液300μl,0.25%过硼酸钠溶液300μl,混匀,而后放入37℃隔水式恒温培养箱(静置5min),将ep管中的溶液加入到96孔板,每孔200μl,放入酶标仪中,测定在414nm波长下的吸光度值。选取一定的时间取点。结果见图4所示,在洗消剂投入瞬间(2s内),高剂量组的dfpase-f127洗消率达到近100%,dfpase-pdmaema洗消率达到90%,低剂量组dfpase-f127和dfpase-pdmaema仅达到20%左右,而单纯的dfpase(与高剂量组同浓度),其在2s内洗消率仅为5%,但随着时间的延长,由于酶的生物催化裂解毒剂,洗消率逐渐增加,在160min达到约70%,说明dfpase一直在逐渐分解毒剂,部分证明其洗消效果源自酶自身对毒剂的催化分解能力,但该效率仍低于同等浓度的dfpase-f127和dfpase-pdmaema。实施例5常见的洗消材料对神经毒剂洗消的评价(1)nahco3对神经毒剂梭曼洗消速率的评价测试样品为nahco3(0.2mg/ml),其余测试方法、各溶剂剂量和样品取点时间同实施例5。(2)naoh对神经毒剂梭曼洗消速率的评价测试样品为naoh(低浓度:0.2mg/ml;高浓度:2mg/ml),其余测试方法、各溶剂剂量和样品取点时间同实施例5。(3)活性炭对神经毒剂梭曼洗消速率的评价测试样品为0.2mg/ml活性炭混悬液。除最后实验步骤中从隔水式恒温培养箱(静置5min)取出后离心(1000r/min)5min,取上清加入200μl到96孔板测定结果外,其余测试方法、各溶剂剂量和样品取点时间同实施例5。(4)h2o2对神经毒剂梭曼洗消速率的评价测试样品为30%h2o2溶液,其余测试方法、各溶剂剂量和样品取点时间同实施例5。(5)洗消结果本实验对目前常见的各种洗消材料进行了测试,为保证实验结果的可对比性,各材料的浓度均为0.2mg/ml,结果如图5所示。在相同浓度下,nahco3随着时间洗消率没有明显变化,洗消率最高达到5.63%;活性炭洗消率随着时间逐渐增加,半小时达到22.76%;而另一种常见洗消材料双氧水,其在最高浓度30%的情况下,也仅能仅达到6.01%的洗消率,在与洗消剂相同浓度下(30%的双氧水稀释约1500倍),无任何洗消效果。低浓度和高浓度的naoh均可在较短时间内达到接近100%的洗消效率,尤其是高浓度naoh;而本实验合成的dfpase-f127和dfpase-pdmaema在洗消瞬间(2秒)随即达到趋近100%的洗消,洗消效率远优于上述几组材料。实施例6对皮肤的安全性评价大鼠麻醉后,平躺固定于实验台上,腹部涂抹脱毛膏去毛后,清洗腹部,并擦干待用。随后滴加30μl待测洗消剂于裸露腹部皮肤上,观察皮肤变化情况,拍照,10分钟后,取该区域皮肤,做病理检查。依次滴加的洗消剂为dfpase-f127,dfpase-pdmaema和高浓度氢氧化钠。从结果上看(图6),氢氧化钠虽然能达到与dfpase-f127和dfpase-pdmaema近似一致的洗消速率(见实施例5),但是其会对皮肤产生严重的碱灼伤,直接破坏表皮层,对皮肤造成了较为严重的损伤,不能直接应用于皮肤的洗消,而dfpase-f127和dfpase-pdmaema对皮肤无刺激性,安全性高。实施例7对小鼠皮肤梭曼染毒后洗消效果的评价1.大鼠麻醉后,平躺固定于实验台上,腹部涂抹脱毛膏去毛后,清洗腹部,并擦干待用。先取血10μl作为每一只受试动物的空白组待测。滴加50μlsoman毒剂(1*10-3v/v)于腹部,随后滴加400μl相应洗消剂(dfpase-f127,dfpase-pdmaema,nahco3)。在腹部贴上一层5*10cm的保鲜膜,确保所有液体浸润于裸露的皮肤上而不溢流出。在10min时间点出采集每只受试动物血样。2.酶活性测定。a.将全血用蒸馏水稀释成(1:100v/v)待测;b.将稀释好的全血分别吸取20μl加入酶标板,空白对照空加入30μlpbs,试验空加入30μlatch(3mm),空白和试验均设复孔,最后各孔用pbs加至100μl;c.37℃恒温箱反应30min;d.各孔加入20μldtnb(0.03%)200μl;e.在415nm波长下测定吸光值x(od);f.根据所测得到的吸光值计算相应各组的毒剂抑制率,计算公式:q=1-x染毒组/x正常组3.结果从图7结果上看,使用传统的洗消剂nahco3,毒剂的抑制率仍然达到近40%的酶抑制率,处于中重度中毒水平,而使用了dfpase-f127和dfpase-pdmaema的洗消剂后毒剂对体内血酶抑制率为13%左右,为轻度中毒水平,不影响受试动物存活。实施例8oph-pdmaema的合成及洗消效率评价(1)配置oph(0.2mg/ml)30ml放入梨形瓶中,在避光条件下搅拌(600r/min)。(2)随后称取乙烯酰基引入剂nas25mg溶于500μldmso溶剂中,而后吸取180μl加入上述反应体系中。(3)而后依次缓慢滴入引发剂kps溶液(30μl,10%w/v)、单体dmam的dmso溶液(40μl,10%w/v)、交联剂mba的dmso溶液(30μl,10%w/v)、酸碱调节剂tmeda的dmso溶液(6μl,10%w/v),在室温条件下避光搅拌(600r/min,6h)。(4)透析袋预处理。首先配置2%w/t的nahco3溶液500ml,1mm的edta二钠水溶液500ml。随后,将截留分子量为5000的透析袋裁剪成长度为30cm。将该透析袋先后放入上述nahco3和edta二钠两组溶液中分别依次煮沸(100℃,10min),每次煮沸完均用蒸馏水冲洗,并分别称取30ghepes和1.2gnaoh加入到2.5l蒸馏水中,充分搅拌分散溶解配置为透析液待用。(5)产物透析。将(3)反应的溶液加入到透析袋(勿超过透析袋总容积的1/2-1/3),用夹子封闭透析袋两端,随后将其放入透析液中,在室温下低速搅拌(150r/min)。期间每12h更换一次透析液,共更换3次透析液,彻底清除溶液中多余的小分子单体杂质。透析48h后收集透析袋中的溶液,得到产物oph-pdmaema,该产物无色透明,共30ml,反应前后整体溶液体积未发生明显变化,将其放入冰箱冷冻储存(-20℃)。(6)取90%纯度的梭曼稀释至5*10-5(v/v),将oph-pdmaema(浓度均为0.2mg/ml)3.125ml加入10mlep管中,而后各管分别加入梭曼1.25ml,再加入蒸馏水调至总体积7.5ml,充分混匀,放入三用水箱中水浴(37℃)。每隔一定时间点从该ep管中取200μl,随后依次加入丙酮-0.01mpbs溶液600μl,饱和联苯胺溶液300μl,0.25%过硼酸钠溶液300μl,混匀,而后放入37℃隔水式恒温培养箱(静置5min),将ep管中的溶液加入到96孔板,每孔200μl,放入酶标仪中,测定在414nm波长下的吸光度值。选取一定的时间取点。结果见图8所示,在洗消剂投入瞬间(2s内),oph-pdmaema达到80%左右。尽管本发明的具体实施方式已经得到详细的描述,根据已经公开的所有教导,本领域技术人员可以对本发明技术方案的细节进行各种修改和替换,这些改变均在本发明的保护范围之内。本发明的全部范围由所附权利要求及其任何等同物给出。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1