一类哌啶并噻吩类小分子有机化合物及其应用的制作方法
本发明属于药物合成领域,涉及一种哌啶并噻吩类小分子有机化合物及应用。
技术背景
癌症是一类严重威胁着人类健康的恶性疾病,据统计总死亡率为23%左右且半个多世纪以来居高不下。随着环境污染、老龄化程度的加重和生活方式改变等多重因素影响,中国已经成为全球新增癌症病例第一的国家。根据《Cancer Statistics in China,2015》统计,全国癌症发病形势严峻,发病率与死亡率均呈持续上升趋势,每年新发癌症病例约429.2万,因癌症死亡病例约281.4万。在未来几十年,中国癌症患者的数量还将持续增多。同时,化疗药物对肿瘤的治疗效果会因肿瘤细胞产生耐药性而大打折扣,导致肿瘤化疗失败,这也是肿瘤治疗领域的关键性难题。
信号转导和转录激活因子(Signal Transducers and Activator of Transcription,STATs)家族是潜在的胞质转录因子,与酪氨酸磷酸化信号通路相偶联,在细胞中起到传递胞浆信号和启动核内基因转录的双重功能,尤其是STAT3,在胚胎发育和细胞增殖分化中起到重要作用(Nature Reviews Cancer 2014)。在正常生理状态下,STAT3的激活是快速而短暂的,仅持续数分钟到几小时,并受到严格的调控,而在许多肿瘤组织中STAT3是持续化激活的,其中包括白血病,多发性骨髓瘤,头颈部鳞状细胞癌、前列腺癌,乳腺癌,肺癌,卵巢癌和胃癌等。同时,STAT3是EGFR、Src和IL-6/JAK等多条致癌性酪氨酸信号通路的汇聚的焦点,可以被多种细胞因子、激素、生长因子等激活发生磷酸化(pSTAT3),进而影响细胞的增殖、分化和凋亡等(Nature Reviews Cancer,2004,4:97-105)。STAT3磷酸化后形成二聚体,移位到细胞核内,与STAT3依赖的基因启动子区域特异DNA反应元件结合,启动目的基因转录,在许多肿瘤中起到了致癌基因的作用。持续激活的STAT3调控多种基因的表达,包括负调控免疫应答因子(如IL-10、VEGF、TGF-β等)以及细胞增殖、凋亡、周期相关的基因(bcl-xl、cyclinD1、mcl-1、survivin、cyclinE等),促进肿瘤细胞增殖、抑制凋亡、诱导血管生成和免疫逃逸监视(J Med Chem,2012,55,6645-6668),在肿瘤的发生、发展过程中起重要的调控作用,同时介导多种化疗药物的耐药(Cancers 2014,6,1986-2011)。据报道,化疗药物通常对STAT3信号通路异常激活的肿瘤耐药细胞治疗效果差,阻断该信号通路能改善甚至逆转肿瘤细胞化疗耐药。与传统的化疗相比,联合传统化疗及STAT3抑制剂组成的新化疗方案,将使肿瘤患者治疗大大受益。因此,STAT3成为肿瘤治疗的重要潜在靶点。
STAT3作为肿瘤治疗的新靶点受到越来越多的关注,如今已有大量关于STAT3抑制剂及其抗肿瘤活性的研究报道,包括核酸类抑制剂如siRNA、反义寡聚核苷酸、G-四联体寡聚脱氧核苷酸、诱饵寡核苷酸和显性负质粒等,阻断STAT3上游的细胞表面受体或酪氨酸激酶抑制剂如IL-6中和抗体、gp130中和抗体、JAK激酶抑制TG-101348、WP1066、INCB018424、S-Ruxolitinib以及EGFR激酶抑制剂吉非替尼、厄洛替尼、阿法替尼等,调控SOCS、PIAS、SHP等STAT3内源性的调控蛋白,以及一些STAT3特异性抑制剂如抑制STAT3二聚化的Stattic和S3I-201,但是目前对STAT3抑制剂抗肿瘤作用的研究大多数还停留在体外活性初筛的水平,在动物体内进行的药理和毒理研究则较少,截止2017年底仅有4个候选化合物进入临床研究阶段,因此寻找结构新颖,高效低毒并具有良好理化性质的新型小分子STAT3抑制剂已成为目前抗肿瘤药物研发领域的热点之一。
目前STAT3抑制剂的研究主要集中在抑制肿瘤细胞增殖方面,对肿瘤耐药方面的研究较少,而目前肿瘤治疗失败的一个主要原因就是肿瘤的多样耐药,因此希望能开发出一类同时具有抗肿瘤生长和逆转耐药作用的小分子STA3抑制剂。本发明立足于如结构式(I)所示的结构模块,创造性地设计和合成了一系列新型小分子STAT3抑制剂,深入研究后发现,此类化合物不仅在体外和体内抑制肿瘤细胞增殖和肿瘤生长,同时也能抑制逆转多种恶性肿瘤细胞的耐药。
技术实现要素:
本发明的目的之一是提供一类结构新颖的活性化合物以及其在制备预防和/或治疗肿瘤包括各种恶性肿瘤药物中的用途,为后续的成药性系统研究奠定坚实基础。
本发明提出一种如式(I)所示的小分子有机化合物或药学上可接受的盐,其结构式如式(I)所示:
其中:
X为C=O或CH2;n为1~3;m为1~3;p为0~2;且p和m之和为3;R1为CN或者COOCH2CH3;
优选地,X为C=O;m=2,n=1,p=1;R1为CN;
Ar为苯环、含一个或多个O,N,S原子的五元或六元芳香基、苯并芳杂环基;所述含一个或多个O,N,S原子的五元或六元芳香基包括噻唑基,噻吩基,呋喃基,吡啶基,吡咯基,吡嗪基,嘧啶基,吡唑基,噁唑基,咪唑基,异噁唑基中的任意一个;所述苯并芳杂环基选自苯并呋喃基,苯并噻吩基,苯并噻唑基,苯并噁唑基,苯并异噁唑基,吲哚基,吲唑基,苯并咪唑基,喹啉基,异喹啉基,喹唑啉基中的任意一个;
R2为Ar上带有的单取代基或多取代基,所述取代基为氢,卤素,羟基,C1-5烷基,C1-5烷氧基,卤代烷基,卤代烷氧基,硝基,氰基,氨基,羧基,C2-8烯基,C2-6炔基,C3-8环烷基,吗啉基,哌嗪基。
优选地,R2为卤素、羟基、甲基、乙基、异丙基、甲氧基、三氟甲基、二氟甲氧基、三氟甲氧基、硝基、氰基、氨基。
本发明所述式(I)中,当m=1,p=2时,其结构如下式(II)所示:
其中:
X为C=O或CH2;n为1~3;R1为CN或者COOCH2CH3;
优选地,X为C=O;n=1;R1为CN;
Ar为苯环、含一个或多个O,N,S原子的五元或六元芳香基、苯并芳杂环基;所述含一个或多个O,N,S原子的五元或六元芳香基包括:噻唑基,噻吩基,呋喃基,吡啶基,吡咯基,吡嗪基,嘧啶基,吡唑基,噁唑基,咪唑基,异噁唑基中的任意一个;所述苯并芳杂环基选自苯并呋喃基,苯并噻吩基,苯并噻唑基,苯并噁唑基,苯并异噁唑基,吲哚基,吲唑基,苯并咪唑基,喹啉基,异喹啉基,喹唑啉基中的任意一个;
R2为Ar上带有的单取代基或多取代基,所述取代基为氢,卤素,羟基,C1-5烷基,C1-5烷氧基,卤代烷基,卤代烷氧基,硝基,氰基,氨基,羧基,C2-8烯基,C2-6炔基,C3-8环烷基,吗啉基,哌嗪基。
优选地,R2为取代基为卤素、羟基、甲基、乙基、异丙基、甲氧基、三氟甲基、二氟甲氧基、三氟甲氧基、硝基、氰基、氨基。
本发明所述式(I)中,当m=3,p=0时,其结构如下式(III)所示:
其中:
X为C=O或CH2;n为1~3;R1为CN或者COOCH2CH3;
优选地,X为C=O;n=1;R1为CN;
Ar为苯环、含一个或多个O,N,S原子的五元或六元芳香基、苯并芳杂环基;所述含一个或多个O,N,S原子的五元或六元芳香基包括:噻唑基,噻吩基,呋喃基,吡啶基,吡咯基,吡嗪基,嘧啶基,吡唑基,噁唑基,咪唑基,异噁唑基中的任意一个;所述苯并芳杂环基选自苯并呋喃基,苯并噻吩基,苯并噻唑基,苯并噁唑基,苯并异噁唑基,吲哚基,吲唑基,苯并咪唑基,喹啉基,异喹啉基,喹唑啉基中的任意一个;
R2为Ar上带有的单取代基或多取代基,所述取代基为氢,卤素,羟基,C1-5烷基,C1-5烷氧基,卤代烷基,卤代烷氧基,硝基,氰基,氨基,羧基,C2-8烯基,C2-6炔基,C3-8环烷基,吗啉基,哌嗪基。
优选地,R2为卤素、羟基、甲基、乙基、异丙基、甲氧基、三氟甲基、二氟甲氧基、三氟甲氧基、硝基、氰基、氨基。
本发明所述式(I)中,当m=2,p=1时,其结构如下式(IV)所示:
其中:
X为C=O或CH2;n为1~3;R1为CN或者COOCH2CH3;
优选地,X为C=O;n=1;R1为CN;
Ar为苯环、含一个或多个O,N,S原子的五元或六元芳香基、苯并芳杂环基;所述含一个或多个O,N,S原子的五元或六元芳香基包括:噻唑基,噻吩基,呋喃基,吡啶基,吡咯基,吡嗪基,嘧啶基,吡唑基,噁唑基,咪唑基,异噁唑基中的任意一个;所述苯并芳杂环基选自苯并呋喃基,苯并噻吩基,苯并噻唑基,苯并噁唑基,苯并异噁唑基,吲哚基,吲唑基,苯并咪唑基,喹啉基,异喹啉基,喹唑啉基中的任意一个;
R2为Ar上带有的单取代基或多取代基,所述取代基为氢,卤素,羟基,C1-5烷基,C1-5烷氧基,卤代烷基,卤代烷氧基,硝基,氰基,氨基,羧基,C2-8烯基,C2-6炔基,C3-8环烷基,吗啉基,哌嗪基。
优选地,R2为卤素、羟基、甲基、乙基、异丙基、甲氧基、三氟甲基、二氟甲氧基、三氟甲氧基、硝基、氰基、氨基。
本发明所述式(IV)中,当R1为氰基时,其结构如下式(V)所示:
其中:
X为C=O或CH2;n为1~3;优选地,X为C=O;n=1;
Ar为苯环、含一个或多个O,N,S原子的五元或六元芳香基、苯并芳杂环基;所述含一个或多个O,N,S原子的五元或六元芳香基包括:噻唑基,噻吩基,呋喃基,吡啶基,吡咯基,吡嗪基,嘧啶基,吡唑基,噁唑基,咪唑基,异噁唑基中的任意一个;所述苯并芳杂环基选自苯并呋喃基,苯并噻吩基,苯并噻唑基,苯并噁唑基,苯并异噁唑基,吲哚基,吲唑基,苯并咪唑基,喹啉基,异喹啉基,喹唑啉基中的任意一个;
R2为Ar上带有的单取代基或多取代基,所述取代基为氢,卤素,羟基,C1-5烷基,C1-5烷氧基,卤代烷基,卤代烷氧基,硝基,氰基,氨基,羧基,C2-8烯基,C2-6炔基,C3-8环烷基,吗啉基,哌嗪基。
优选地,R2为卤素、羟基、甲基、乙基、异丙基、甲氧基、三氟甲基、二氟甲氧基、三氟甲氧基、硝基、氰基、氨基。
本发明所述式(V)中,当X为羰基时,其结构如下式(VI)所示:
其中:
n为1~3;优选地,n=1;
Ar为苯环、含一个或多个O,N,S原子的五元或六元芳香基、苯并芳杂环基;所述含一个或多个O,N,S原子的五元或六元芳香基包括:噻唑基,噻吩基,呋喃基,吡啶基,吡咯基,吡嗪基,嘧啶基,吡唑基,噁唑基,咪唑基,异噁唑基中的任意一个;所述苯并芳杂环基选自苯并呋喃基,苯并噻吩基,苯并噻唑基,苯并噁唑基,苯并异噁唑基,吲哚基,吲唑基,苯并咪唑基,喹啉基,异喹啉基,喹唑啉基中的任意一个;
R2为Ar上带有的单取代基或多取代基,所述取代基为氢,卤素,羟基,C1-5烷基,C1-5烷氧基,卤代烷基,卤代烷氧基,硝基,氰基,氨基,羧基,C2-8烯基,C2-6炔基,C3-8环烷基,吗啉基,哌嗪基。
优选地,R2为卤素、羟基、甲基、乙基、异丙基、甲氧基、三氟甲基、二氟甲氧基、三氟甲氧基、硝基、氰基、氨基。
本发明所述式(V)中,当X为亚甲基时,其结构如下式(VII)所示:
其中:
n为1~3;优选地,n=1;
Ar为苯环、含一个或多个O,N,S原子的五元或六元芳香基、苯并芳杂环基;所述含一个或多个O,N,S原子的五元或六元芳香基包括:噻唑基,噻吩基,呋喃基,吡啶基,吡咯基,吡嗪基,嘧啶基,吡唑基,噁唑基,咪唑基,异噁唑基中的任意一个;所述苯并芳杂环基选自苯并呋喃基,苯并噻吩基,苯并噻唑基,苯并噁唑基,苯并异噁唑基,吲哚基,吲唑基,苯并咪唑基,喹啉基,异喹啉基,喹唑啉基中的任意一个;
R2为Ar上带有的单取代基或多取代基,所述取代基为氢,卤素,羟基,C1-5烷基,C1-5烷氧基,卤代烷基,卤代烷氧基,硝基,氰基,氨基,羧基,C2-8烯基,C2-6炔基,C3-8环烷基,吗啉基,哌嗪基。
优选地,R2为卤素、羟基、甲基、乙基、异丙基、甲氧基、三氟甲基、二氟甲氧基、三氟甲氧基、硝基、氰基、氨基。
本发明还提供由上述式(I)-(VII)所示的哌啶并噻吩类小分子有机化合物或药学上可接受的盐,包括但不限定于这类哌啶并噻吩类小分子有机化合物或其相关类似物与下列酸形成的酸加成盐,其中,所述酸包括盐酸、氢溴酸、硫酸、磷酸、乙酸、酒石酸、水杨酸、柠檬酸、甲磺酸、对甲苯磺酸、乳酸、丙酮酸、马来酸、琥珀酸。
本发明所述式(I)-(VII)所示的哌啶并噻吩类小分子有机化合物或药学上可接受的盐,包括下列化合物:
N-(2-(6-((5-氯-2-呋喃基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(6-((5-溴-2-噻吩基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(6-((2-氯-5-噻唑基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(6-((5-氯-2-噻吩基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(6-((4-溴-2-噻吩基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(6-((5-甲基-2-呋喃基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(6-((3-噻吩基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(6-((2-呋喃基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(6-((3-呋喃基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(6-((2-噻吩基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(6-((5-溴-2-呋喃基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(6-(3-氟苄基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(6-((3-溴-2-噻吩基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(6-((5-甲基-2-噻吩基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(6-((4-溴-2-呋喃基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(6-(3-溴苄基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(6-((5-硝基-2-噻吩基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(6-((2-溴-4-噻唑基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(6-((2-氯-4-噻唑基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(6-((2-溴-5-噻唑基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(6-((5-氰基-2-噻吩基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(6-((4-溴-5-硝基-2-噻吩基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(6-((3-溴-2-噻吩基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(6-((5-硝基-2-呋喃基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(6-(4-溴苄基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(6-(2-溴苄基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(6-((5-氯苯并-[b]噻吩-3-基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(6-(2-氯苄基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(6-(3-甲氧苄基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(6-(3-氯苄基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(6-((2-吡啶基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(6-((3-吡啶基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(6-((4-吡啶基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(6-((1H-2-吡咯基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(6-((1H-3-吲哚基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(6-((2-吡嗪基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(6-((5-嘧啶基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(6-((1H-4-吡唑基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(6-(4-氰基苄基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(6-(3-硝基苄基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(6-(2,4-二氯苄基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(6-(2,5-二氯苄基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(6-(2,6-二氯苄基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(6-(4-甲基苄基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(6-((2-氯-3-噻吩基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(6-(4-三氟甲基苄基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(5-(3-溴苄基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(5-((5-溴-2-呋喃基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(5-((5-溴-2-噻吩基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(5-((5-氯-2-呋喃基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(5-((5-氯-2-噻吩基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(5-((3-溴-2-噻吩基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(5-(3-三氟甲基苄基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(4-((5-溴-2-呋喃基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(4-((5-溴-2-噻吩基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(4-((5-氯-2-呋喃基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
N-(2-(4-((5-氯-2-噻吩基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
6-((5-溴-2-呋喃基)甲基)-2-(1-甲基-1H-吡唑-4-甲酰胺基)-4,5,6,7-四氢噻吩并-[2,3-c]吡啶-3-甲酸乙酯
6-((5-溴-2-噻吩基)甲基)-2-(1-甲基-1H-吡唑-4-甲酰胺基)-4,5,6,7-四氢噻吩并-[2,3-c]吡啶-3-甲酸乙酯
6-((5-溴-2-呋喃基)甲基)-2-(((1-甲基-1H-4-吡唑基)甲基)氨基)-4,5,6,7-四氢噻吩并-[2,3-c]吡啶-3-甲腈
6-(3-溴苄基)-2-(((1-甲基-1H-4-吡唑基)甲基)氨基)-4,5,6,7-四氢噻吩并-[2,3-c]吡啶-3-甲腈
6-((5-溴-2-噻吩基)甲基)-2-(((1-甲基-1H-4-吡唑基)甲基)氨基)-4,5,6,7-四氢噻吩并-[2,3-c]吡啶-3-甲腈
6-((5-氯-2-噻吩基)甲基)-2-(((1-甲基-1H-4-吡唑基)甲基)氨基)-4,5,6,7-四氢噻吩并-[2,3-c]吡啶-3-甲腈
6-((5-氯-2-呋喃基)甲基)-2-(((1-甲基-1H-4-吡唑基)甲基)氨基)-4,5,6,7-四氢噻吩并-[2,3-c]吡啶-3-甲腈。
本发明还提供了一种药物组合物,其含有上述的式(I)-(VII)所示的哌啶并噻吩类小分子有机化合物或药学上可接受的盐,以及药学上可接受的载体。所述药物组合物被配制成可注射流体、气雾剂、乳膏、凝胶剂、丸剂、胶囊剂、糖浆剂、透皮贴剂或赋形剂等。
本发明还提供了由上述式(I)-(VII)所示的哌啶并噻吩类小分子有机化合物或药学上可接受的盐,或所述药物组合物在制备新型STAT3抑制剂中的应用。
本发明还提供了由上述式(I)-(VII)所示的哌啶并噻吩类小分子有机化合物或其相关衍生物的前药。
其中,所述“前药”是指化合物本身可以不完全满足本文所提供化合物的结构要求但是在给患者给药后通过体内变化而产生本文所提供式的化合物。前药的实例包括酯,例如可以通过存在的官能团进行改性,从而修饰在体内被断裂后产生所述的母体化合物。本发明所述哌啶并噻吩类小分子有机化合物还包括以各种连接方式将式(I)所示化合物连接的二聚体及多聚体化合物。
本发明还提供了式(I)-(VII)所示的哌啶并噻吩类小分子有机化合物或药学上可接受的盐,或所述药物组合物在制备预防和/或治疗STAT3介导的疾病药物中的应用。其中,所述疾病包括包含肾纤维化、肺纤维化、类风湿性关节炎、牛皮癣、炎性肺病和炎性肠病等。
本发明还提供了式(I)-(VII)所示的哌啶并噻吩类小分子有机化合物或药学上可接受的盐,或所述药物组合物在制备抗肿瘤的药物中的应用;其中,所述哌啶并噻吩类小分子有机化合物或药学上可接受的盐,或药物组合物用于抑制肿瘤细胞的增殖、生长、迁移和浸润、复发。
本发明还提供了式(I)-(VII)所示的哌啶并噻吩类小分子有机化合物或药学上可接受的盐,或药物组合物在制备抗肿瘤治疗药物中的应用。其中,所述药物用于诱发获得性耐药导致化疗失败后的抗肿瘤治疗的药物中的应用;其中,所述肿瘤包括肺癌细胞、乳腺癌细胞、表皮癌细胞、结肠癌细胞、肝癌细胞、胃癌细胞细胞、前列腺癌细胞、胰腺癌细胞、白血病细胞、卵巢癌细胞、膀胱癌细胞、口腔癌细胞、子宫内膜癌细胞、宫颈癌细胞、脑癌细胞、肾癌细胞、头颈鳞状细胞癌细胞、神经胶质瘤细胞、黑色素瘤细胞和淋巴瘤细胞等。
本发明还提供了式(I)-(VII)所示的哌啶并噻吩类小分子有机化合物或药学上可接受的盐,或药物组合物在制备预防和/或治疗恶性肿瘤的药物中的应用。其中,所述哌啶并噻吩类小分子有机化合物或药学上可接受的盐,或药物组合物用于抑制恶性肿瘤的增殖、生长、浸润、转移、复发;其中,所述恶性肿瘤包括肺癌、乳腺癌、表皮癌、结肠癌、肝癌、胃癌细胞、前列腺癌、胰腺癌、白血病、卵巢癌、膀胱癌、口腔癌、子宫内膜癌、宫颈癌、脑癌、肾癌、头颈鳞状细胞癌、神经胶质瘤癌、黑色素瘤和淋巴瘤等。
本发明还提供了式(I)-(VII)所示的哌啶并噻吩类小分子有机化合物或药学上可接受的盐,或药物组合物在制备调节免疫应答因子以及下游基因的表达药物中的应用;其中,所述免疫应答因子包括IL-10、VEGF、TGF-β、IL-6和CCL22等;其中,所述下游基因包括bcl-xl、cyclinD1、mcl-1、survivin、cyclinE、Cdc2、cyclin B1、m-Ras和E2F-1等。
本发明还提供了式(I)-(VII)所示的哌啶并噻吩类小分子有机化合物或药学上可接受的盐,或药物组合物在制备抑制STAT3磷酸化和二聚化的药物中的应用。
本发明中,所述式(I)-(VII)所示的哌啶并噻吩类小分子有机化合物或药学上可接受的盐,或药物组合物可以单独使用或与其它药物联合使用。
本发明的有益效果在于:本发明提供了一类结构新颖的哌啶并噻吩类小分子有机化合物,或其药物组合在制备预防和/或治疗各种恶性肿瘤生长、转移和复发等疾病药物中的用途,作为STAT3抑制剂在预防和/或治疗STAT3介导的疾病中的用途。
附图说明
图1所示为本发明化合物在不同浓度下对不同人卵巢癌细胞系增殖抑制的效果图。A为效果图,B为统计图。
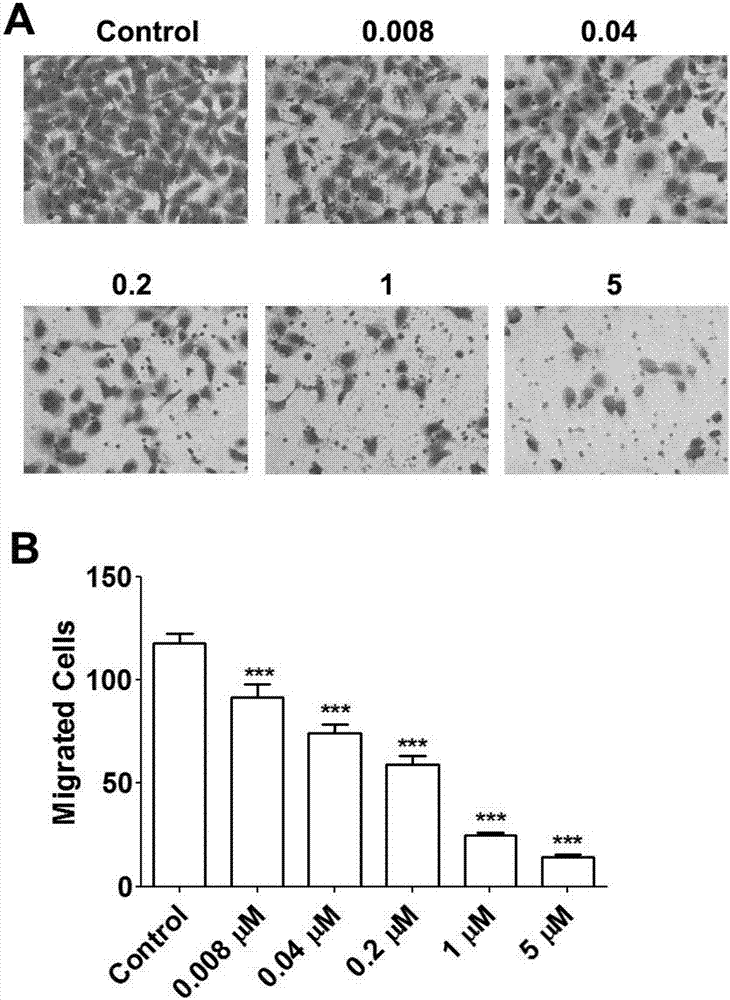
图2所示为本发明化合物在不同浓度下对人卵巢癌细胞系SKOV3迁移抑制的效果图。A为效果图,B为统计图。
图3所示为本发明化合物在不同浓度下对人卵巢癌细胞系SKOV3凋亡诱导的效果图。A为效果图,B为统计图。
图4所示为本发明化合物在不同时间下对人卵巢癌细胞系SKOV3细胞周期阻滞的效果图。A为效果图,B为统计图。
图5所示为本发明化合物在不同浓度下对STAT3的磷酸化抑制效果图,其中A为自然条件下化合物对STAT3磷酸化的抑制效果,B为加入IL-6刺激条件下化合物对STAT3磷酸化的抑制效果。
图6所示为本发明化合物在PDX模型中抑制肿瘤生长的效果图,其中A为给药不同天数后肿瘤体积变化;B为给药不同天数后的小鼠体重变化;图C为给药21天后剥离下来的肿瘤大小图;D为给药21天后肿瘤重量统计图。
具体实施方式
结合以下具体实施例和附图,对本发明作进一步的详细说明,本发明的保护内容不局限于以下实施例。在不背离发明构思的精神和范围下,本领域技术人员能够想到的变化和优点都被包括在本发明中,并且以所附的权利要求书为保护范围。
低温反应装置为EYELA(PSL-1810)磁力搅拌低温恒温水槽;EYELA(N-1100)旋转蒸发仪;实验所得化合物的纯度结果均来自于Agilent 1200series LC system高效液相色谱分析仪(色谱条件:Zorbax XDB-C18(4.6×150nm,5μm),柱40℃,流动相为MeOH/H2O,运行流速1.5mL/min,紫外检测波长为254nm,进样量未10μL);核磁共振波谱仪为Bruker 300或Bruker 500型(内标:TMS,使用溶剂为CDCl3或者DMSO-d6);反应中间体以及终产物的纯化均使用层析色谱柱(所用硅胶200-300目),所使用的硅胶购买于青岛海洋化工厂。所有溶剂在使用前均经过重新蒸馏,所使用的无水溶剂均是按标准方法干燥处理获得;除特别说明外,所有反应均是在氮气保护下进行并用TLC跟踪反应进度,后处理均经过饱和食盐水洗和无水硫酸钠干燥。
实施例一:各个化合物的制备
实施例1-1、N-(2-(6-((5-氯-2-呋喃基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺(ZZ001)的合成
取N-叔丁氧羰基-4-哌啶酮(1.99g,10mmol)和丙二腈(0.73g,11mmol)溶于30mL乙醇中,加入硫单质(363mg,11mmol)和吗啉(1.74g,20mmol)。将混合物加热至回流,搅拌反应2h,溶液变成橙色,有固体生成。将反应物冷却至室温,抽滤,滤饼用冰乙醇洗涤,干燥后得淡黄色固体2-氨基-3-氰基-4,7-二氢噻吩-[2,3-c]吡啶-6(5H)-羧酸叔丁酯(2.50g,粗产率:90%)。
将2-氨基-3-氰基-4,7-二氢噻吩-[2,3-c]吡啶-6(5H)-羧酸叔丁酯(2.50g,9mmol)和1-甲基吡啶-4-羧酸(1.25g,9.9mmol)溶于30mL二氯甲烷中,加入2-氯-1-甲基吡啶碘化物(2.53g,9.9mmol),4-二甲氨基吡啶(242mg,1.98mmol)和三乙胺(4.01g,39.6mmol),50℃下,搅拌反应8h。将混合物冷却至室温,减压蒸去溶剂,用丙酮和水进行重结晶,抽滤,滤饼用少量丙酮洗涤,干燥后得N-(2-(6-叔丁氧羰基-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺(3.00g,粗产率:86%)。
取N-(2-(6-叔丁氧羰基-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺(3.00g,7.74mmol)溶于二氯甲烷中,加入氯化氢的1,4-二氧六环溶液(15.5mL,5mol/L),搅拌反应1h,有白色固体生成。反应结束后抽滤,用少量丙酮洗涤,干燥后得N-(3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶-2-基)-1-甲基-1H-吡唑-4-甲酰胺(2.20g,粗产率:99%)。
取N-(2-(3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺(160mg,0.56mmol)和5-氯呋喃-2-甲醛(219mg,1.68mmol)溶于20mL甲醇中,搅拌1h后,加入氰基硼氢化钠(104mg,1.68mmol),反应结束后,减压除去溶剂,用二氯甲烷和水萃取三次,合并有机相,有机相用无水硫酸钠进行干燥,减压除去有机溶剂,柱层析纯化得到N-(2-(6-((5-氯-2-呋喃基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺(102mg,粗产率:45%)。1H NMR(500MHz,DMSO)δ11.44(s,1H),8.46(s,1H),8.06(s,1H),6.48(d,J=3.3Hz,1H),6.43(d,J=3.0Hz,1H),3.91(s,3H),3.71(s,2H),3.55(s,2H),2.80(t,J=5.4Hz,2H),2.62(t,J=5.1Hz,2H).
实施例1-16、N-(2-(6-(3-溴苄基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺
取N-(2-(3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺(153mg,0.53mmol)和3-溴苄溴(200mg,0.8mmol)溶于20ml丙酮中,加入碳酸铯(518mg,1.59mmol),0℃下反应,反应结束后,减压除去溶剂,用二氯甲烷和水萃取三次,合并有机相,有机相用无水硫酸钠进行干燥,减压除去有机溶剂,柱层析纯化得到N-(2-(6-(3-溴苄基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺(116mg,粗产率:48%)。1H NMR(500MHz,DMSO)δ11.43(s,1H),8.46(s,1H),8.06(s,1H),7.56(s,1H),7.48(d,J=7.8Hz,1H),7.37(d,J=7.6Hz,1H),7.32(m,1H),3.91(s,3H),3.70(s,2H),3.54(s,2H),2.78(t,J=5.4Hz,2H),2.62(t,J=5.3Hz,2H).
实施例1-60、6-((5-溴-2-呋喃基)甲基)-2-(((1-甲基-1H-4-吡唑基)甲基)氨基)-4,5,6,7-四氢噻吩并-[2,3-c]吡啶-3-甲腈
取2-氨基-3-氰基-4,7-二氢噻吩-[2,3-c]吡啶-6(5H)-羧酸叔丁酯(1.45g,5.2mmol)和1,4-二甲基吡唑(859mg,7.8mmol)溶于30mL甲苯中,加热至回流,反应4h。反应结束后,减压蒸除溶剂,加入适量丙酮,有大量固体存在,抽滤,用丙酮洗涤,烘干得到叔丁基(E)-3-氰基-2-(((1-甲基-1H-4-吡唑基)亚甲基)氨基)-4,7-二氢噻吩并-[2,3-c]吡啶-6(5H)-羧酸酯(1.80g,粗产率:93%)。
取叔丁基(E)-3-氰基-2-(((1-甲基-1H-4-吡唑基)亚甲基)氨基)-4,7-二氢噻吩并-[2,3-c]吡啶-6(5H)-羧酸酯(1.80g,4.87mmol)溶于甲醇中,0℃下分批加入硼氢化钠(554mg,14.6mmol),减压除去溶剂,用二氯甲烷和水萃取三次,合并有机相,有机相用无水硫酸钠进行干燥,减压除去有机溶剂,柱层析纯化得到3-氰基-2-(((1-甲基-1H-4-吡唑基)甲基)氨基)-4,7-二氯噻吩并-[2,3-c]吡啶-6(5H)-羧酸叔丁酯(1.73g,粗产率:95%)。
取3-氰基-2-(((1-甲基-1H-4-吡唑基)甲基)氨基)-4,7-二氯噻吩并-[2,3-c]吡啶-6(5H)-羧酸叔丁酯(1.73g,4.63mmol)溶于二氯甲烷中,加入氯化氢的1,4-二氧六环溶液(9.3mL,5mol/L),搅拌反应1h,有白色固体生成。反应结束后抽滤,用少量丙酮洗涤,干燥后得2-(((1-甲基-1H-4-吡唑基)甲基)氨基)-4,5,6,7-四氢噻吩并[2,3-c]吡啶-3-甲腈(1.42g,粗产率:99%)。
取2-(((1-甲基-1H-4-吡唑基)甲基)氨基)-4,5,6,7-四氢噻吩并[2,3-c]吡啶-3-甲腈(160mg,0.38mmol)和5-溴呋喃-2-甲醛(200mg,1.14mmol)溶于20mL甲醇中,搅拌1h后,加入氰基硼氢化钠(72mg,1.14mmol),反应结束后,减压除去溶剂,用二氯甲烷和水萃取三次,合并有机相,有机相用无水硫酸钠进行干燥,减压除去有机溶剂,柱层析纯化得到6-((5-溴-2-呋喃基)甲基)-2-(((1-甲基-1H-4-吡唑基)甲基)氨基)-4,5,6,7-四氢噻吩并-[2,3-c]吡啶-3-甲腈(69mg,粗产率:42%)。1H NMR(500MHz,DMSO)δ7.84(s,1H),7.62(s,1H),7.37(s,1H),6.51(d,J=3.0Hz,1H),6.41(d,J=3.1Hz,1H),4.17(s,2H),3.79(s,3H),3.65(s,2H),3.35(s,2H),2.71(t,J=5.0Hz,2H),2.44(t,J=5.4Hz,2H).
实施例1-61、6-(3-溴苄基)-2-(((1-甲基-1H-4-吡唑基)甲基)氨基)-4,5,6,7-四氢噻吩并-[2,3-c]吡啶-3-甲腈
取2-(((1-甲基-1H-4-吡唑基)甲基)氨基)-4,5,6,7-四氢噻吩并[2,3-c]吡啶-3-甲腈(145mg,0.53mmol)和3-溴苄溴(200mg,0.8mmol)溶于20mL丙酮中,加入碳酸铯(518mg,1.59mmol),0℃下反应,反应结束后,减压除去溶剂,用二氯甲烷和水萃取三次,合并有机相,有机相用无水硫酸钠进行干燥,减压除去有机溶剂,柱层析纯化得到6-(3-溴苄基)-2-(((1-甲基-1H-4-吡唑基)甲基)氨基)-4,5,6,7-四氢噻吩并-[2,3-c]吡啶-3-甲腈(91mg,粗产率:39%)。1H NMR(500MHz,DMSO)δ7.85(s,1H),7.62(s,1H),7.53(s,1H),7.46(d,J=7.7Hz,1H),7.37(s,1H),7.34(d,J=7.4Hz,1H),7.32–7.28(m,1H),4.17(s,2H),3.79(s,3H),3.65(s,2H),3.34(s,2H),2.70(t,J=5.5Hz,2H),2.45(t,J=5.6Hz,2H).
实施例1-1到1-64化合物ZZ-001到ZZ-064的制备方法如下表所示
实施例二:
实施例2-1、luciferase实验
为了构建抑制STAT3转录活性的小分子化合物筛选体系,实验所用质粒为STAT3 response element-luc和Renilla(内参报告基因)。STAT3 response element-luc是在PGL 4.17basic质粒上插入5×STAT3 response element构建而成,插入序列为STAT3特异性识别的DNA序列。当使用STAT3已知的刺激物如IL-6,EGF等处理细胞时,细胞内STAT3会磷酸化进而同源二聚化并结合到STAT3 response element上起始下游报告基因-萤光素酶的表达,而应该荧光素酶可以催化其底物荧光素发出荧光,通过检测荧光的强度便能检测STAT3激活的程度;Renilla内参报告基因带有海肾荧光素酶,能表达海肾荧光素酶,通过该质粒可以确定每组细胞的转染效率是否一致。具体实验流程:24孔板内接种20×103个293T细胞,培养12h后,使用转染试剂lipo2000进行转染,每孔转染量为100ng STAT3 response element-luc和2ng Renilla质粒。转染24h后,去除原本培养基,并将药物(5μM)和IL-6(20ng/mL)一起加入,处理12h后收取细胞进行荧光检测。
结果如表2所示,除少数几个化合物如ZZ028、ZZ037、ZZ040、ZZ055和ZZ057抑制活性较弱外,绝大部分化合物如ZZ001-027、ZZ029-036、ZZ038、ZZ039、ZZ041-054、ZZ056、ZZ058-064均能显著抑制STAT3的活化水平。
表2,不同化合物对STAT3的转录抑制活性
实施例2-2、MTS法测定细胞增殖
96孔细胞培养板中每孔接种2×103个肿瘤细胞,常规培养12h后,依次加入不同浓度梯度或终浓度为5μmol/L(μM)本发明化合物,对照组加入等体积的DMSO(每组设3个复孔)。继续培养72h后,每孔加入20μLMTS溶液,37℃5%CO2培养箱中孵育1h左右。将96孔板置于酶标仪(SPECTRA MAX 190)中,在490nm波长下测定OD值。以对照组细胞活性为100%计算,统计分析药物对于细胞增殖水平的影响。
部分结果如表1所示,本发明的绝大多数化合物在5μmol/L时对卵巢癌细胞SKOV3增殖具有良好的抑制作用,肿瘤细胞活性。
表2,不同化合物对STAT3的转录抑制活性
为检测本发明化合物对不同卵巢癌细胞系的增殖抑制功能,本发明以ZZ002为代表化合物,检测其在不同浓度下对多种卵巢癌细胞系的增殖抑制。并计算各浓度对卵巢癌细胞系的增殖抑制率,在抑制率为50%时所对应的浓度为IC50。
结果如图1所示,本发明化合物对A2780、ES2、SKOV3和SKOV3TR等多种卵巢癌细胞的增殖具有良好的抑制效果,其IC50小于5μmol/L。
实验结果还表明,除ZZ002之外,ZZ003~ZZ016,ZZ018~ZZ044,ZZ047,ZZ048,ZZ050~ZZ054,ZZ056~ZZ064等化合物对这些卵巢癌细胞的增殖同样具有良好的抑制效果,其IC50均小于5μmol/L。
另外,将本发明化合物对肝癌、白血病、肺癌、前列腺癌、皮肤癌、胰腺癌、膀胱癌、肾癌、口腔癌等多种肿瘤细胞进行实验,均取得了显著的抑制效果,同时,本发明化合物对多种正常细胞不存在明显的抑制效果。
实施例2-3、Transwell检测细胞迁移
Transwell迁移实验采用的Boyden小室底部聚碳酸酯薄膜具有大量直径8μm的微孔。将Transwell小室放入24孔板中,Transwell小室内称上室,培养板内称下室。Transwell小室内加入200μL含5×104个SKOV3肿瘤细胞的无血清培养基,下室加入700μL含10%胎牛血清的正常细胞培养基。并在下室中分别加入0,0.008,0.04,0.2,1和5μmol/L的化合物(ZZ002),于37℃5%CO2培养箱中培养12h。将Transwell在4%多聚甲醛室温固定10min,用棉签蘸擦拭transwell小室的上室一面,将未穿膜的细胞擦掉。用2%结晶紫染色10min,PBS洗一次。显微镜下拍照,每孔内随机取上下左右中5个视野计算细胞数。统计比较不同剂量药物对细胞迁移能力的影响。
结果如图2所示,本发明化合物ZZ002在低至0.008μmol/L时仍能显著抑制卵巢癌细胞迁移,半数抑制的有效浓度(IC50)介于0.04-0.2μmol/L之间。
除ZZ002之外,实验结果还表明,ZZ003~ZZ016,ZZ018~ZZ044,ZZ047,ZZ048,ZZ050~ZZ054,ZZ056~ZZ064等化合物同样能显著抑制卵巢癌细胞迁移。
实施例2-4、AnnexinV/PI检测细胞凋亡
将2mL含2×105个卵巢癌SKOV3细胞的细胞悬液接种于6孔细胞培养板中,12h后分别加入0,0.04,0.2,1和5μmol/L的化合物(ZZ002)。于37℃5%CO2培养箱中培养24h。胰酶消化并收集细胞,利用Annexin V/PI试剂盒染色细胞。于BD Calibur机器检测凋亡细胞的比例。
结果如图3所示,本发明化合物可诱导卵巢癌细胞早期凋亡,并且具有浓度依赖性。
实施例2-5、PI染色检测细胞周期分布
将2mL含2×105个卵巢癌SKOV3细胞的细胞悬液接种于6孔细胞培养板中,12h后加入0和5μmol/L的化合物(ZZ002)。于37℃5%CO2培养箱中培养24h和48h。胰酶消化并收集细胞,利用PI染色。于BD Calibur机器检测细胞周期分布。
结果如图4所示,本发明化合物可诱导卵巢癌细胞周期阻滞于G2/M期,并且具有时间依赖性。
另外,通过检测不同浓度下本发明化合物对卵巢癌细胞周期阻滞的水平,表明本发明化合物对肿瘤细胞周期的阻滞具有浓度依赖性。
实施例2-6、Westernblot检测化合物的信号通路
为检测本发明化合物对STAT3信号通路的影响,将8mL含1×106个卵巢癌SKOV3细胞的细胞悬液接种于直径为10cm的细胞培养板中,12h后分别加入0,0.2,1,5和25μmol/L的化合物(ZZ002)。以20μmol/L的BP-1-102作为阳性对照。于37℃5%CO2培养箱中培养24h。为验证本发明化合物对STAT3的活化的影响,8mL含1×106个卵巢癌SKOV3细胞的细胞悬液接种于直径为10cm的细胞培养板中,12h后加入5μmol/L的化合物(ZZ002),20ng/mL IL-6,20μmol/L BP-1-102以及IL-6分别与ZZ002和BP-1-102的联合用药。于37℃5%CO2培养箱中培养24h。冰上用PBS洗3次,用400μL蛋白裂解液RIPA于冰上裂解1h。离心并收集蛋白上清,用BCA法检测蛋白浓度。于分离胶浓度为10%的SDS-PAGE胶电泳检测目的蛋白,每孔上样量为40ug总蛋白。利用STAT3,pSTAT3和GAPDH检测相应蛋白的表达或活化水平。
结果如图5所示,本发明化合物可抑制STAT3的活化,并且具有时间依赖性。
实施例2-7、裸鼠荷瘤实验检测化合物在动物体内的功效
取卵巢癌第三代PDX肿瘤块,切成直径1-2mm的小块,种植于裸鼠背部皮下。7天后开始每天腹腔注射ZZ00225mg/kg裸鼠体重。每周记录2次肿瘤大小和裸鼠体重。用药21天后处死裸鼠,取出肿瘤,称量肿瘤的大小。
结果如图6所示,ZZ002能显著抑制肿瘤的生长,并且毒副作用小。
除ZZ002之外,实验结果还表明ZZ003~ZZ016,ZZ018~ZZ044,ZZ047,ZZ048,ZZ050~ZZ054,ZZ056~ZZ064等化合物均能有效抑制肿瘤的生长。
以下实施例1-2到1-64提供了本发明化合物ZZ-002到ZZ-064的制备方法及产物检测结果。
实施例1-2、N-(2-(6-((5-溴-2-噻吩基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ001类似的方法,将5-氯呋喃-2-甲醛置换为5-溴噻吩-2-甲醛,最后经柱层析纯化后得化合物ZZ002。1H NMR(500MHz,DMSO)δ11.44(s,1H),8.46(s,1H),8.06(s,1H),7.08(d,J=3.4Hz,1H),6.88(d,J=3.0Hz,1H),3.91(s,3H),3.87(s,2H),3.60(s,2H),2.82(t,J=5.3Hz,2H),2.61(t,J=5.1Hz,2H).
实施例1-3、N-(2-(6-((2-氯-5-噻唑基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ001类似的方法,将5-氯呋喃-2-甲醛置换为2-氯-5-甲醛基噻唑,最后经柱层析纯化后得化合物ZZ003。1H NMR(500MHz,DMSO)δ11.44(s,1H),8.46(s,1H),8.06(s,1H),7.61(s,1H),3.91(s,3H),3.89(s,2H),3.62(s,2H),2.82(t,J=5.6Hz,2H),2.61(d,J=4.8Hz,2H).
实施例1-4、N-(2-(6-((5-氯-2-噻吩基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ001类似的方法,将5-氯呋喃-2-甲醛置换为5-氯噻吩-2-甲醛,最后经柱层析纯化后得化合物ZZ004。1H NMR(500MHz,DMSO)δ11.44(s,1H),8.46(s,1H),8.06(s,1H),6.98(d,J=3.4Hz,1H),6.91(d,J=2.9Hz,1H),3.91(s,3H),3.85(s,2H),3.61(s,2H),2.82(d,J=5.2Hz,2H),2.61(d,J=5.2Hz,2H).
实施例1-5、N-(2-(6-((4-溴-2-噻吩基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ001类似的方法,将5-氯呋喃-2-甲醛置换为4-溴噻吩-2-甲醛,最后经柱层析纯化后得化合物ZZ005。1H NMR(500MHz,DMSO)δ11.44(s,1H),8.46(s,1H),8.06(s,1H),7.59(s,1H),7.06(s,1H),3.91(s,3H),3.89(s,2H),3.61(s,2H),2.82(t,J=5.7Hz,2H),2.61(t,J=5.5Hz,2H).
实施例1-6、N-(2-(6-((5-甲基-2-呋喃基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ001类似的方法,将5-氯呋喃-2-甲醛置换为5-甲基呋喃-2-甲醛,最后经柱层析纯化后得化合物ZZ006。1H NMR(500MHz,DMSO)δ11.44(s,1H),8.46(s,1H),8.06(s,1H),6.23(d,J=3.5Hz,1H),6.02(d,J=3.4Hz,1H),3.91(s,3H),3.68(s,2H),3.55(s,2H),2.81(t,J=5.2Hz,2H),2.62(t,J=5.1Hz,2H),2.24(s,3H).
实施例1-7、N-(2-(6-((3-噻吩基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ001类似的方法,将5-氯呋喃-2-甲醛置换为噻吩-3-甲醛,最后经柱层析纯化后得化合物ZZ007。1H NMR(500MHz,DMSO)δ11.42(s,1H),8.45(s,1H),8.05(s,1H),7.51(s,1H),7.38(d,J=3.6Hz,1H),7.09(d,J=4.6Hz,1H),3.91(s,3H),3.70(s,2H),3.52(s,2H),2.76(t,J=5.4Hz,2H),2.61(t,J=5.2Hz,2H).
实施例1-8、N-(2-(6-((2-呋喃基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ001类似的方法,将5-氯呋喃-2-甲醛置换为呋喃-2-甲醛,最后经柱层析纯化后得化合物ZZ008。1H NMR(500MHz,DMSO)δ11.45(s,1H),8.46(s,1H),8.06(s,1H),7.67–7.61(m,1H),6.48–6.42(m,1H),6.42-6.36(m,1H),3.91(s,3H),3.77(s,2H),3.57(s,2H),2.82(t,J=5.5Hz,2H),2.64(t,J=5.2Hz,2H).
实施例1-9、N-(2-(6-((3-呋喃基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ001类似的方法,将5-氯呋喃-2-甲醛置换为呋喃-3-甲醛,最后经柱层析纯化后得化合物ZZ009。1H NMR(500MHz,DMSO)δ11.42(s,1H),8.45(s,1H),8.06(s,1H),7.84–7.26(m,2H),6.48(s,1H),3.91(s,3H),3.55(s,2H),3.51(s,2H),2.75(t,J=5.4Hz,2H),2.60(t,J=5.0Hz,2H).
实施例1-10、N-(2-(6-((2-噻吩基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ001类似的方法,将5-氯呋喃-2-甲醛置换为噻吩-2-甲醛,最后经柱层析纯化后得化合物ZZ010。1H NMR(500MHz,DMSO)δ11.43(s,1H),8.46(s,1H),8.06(s,1H),7.46(d,J=5.0Hz,1H),7.03(d,J=2.9Hz,1H),6.99(dd,J=5.0,3.4Hz,1H),3.91(s,3H),3.75(s,2H),3.58(s,2H),2.81(t,J=5.7Hz,2H),2.61(t,J=5.3Hz,2H).
实施例1-11、N-(2-(6-((5-溴-2-呋喃基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ001类似的方法,将5-氯呋喃-2-甲醛置换为5-溴呋喃-2-甲醛,最后经柱层析纯化后得化合物ZZ011。1H NMR(500MHz,DMSO)δ11.43(s,1H),8.46(s,1H),8.06(s,1H),6.53(d,J=2.9Hz,1H),6.45(d,J=2.7Hz,1H),3.91(s,3H),3.71(s,2H),3.54(s,2H),2.79(t,J=5.5Hz,2H),2.62(t,J=5.6Hz,2H).
实施例1-12、N-(2-(6-(3-氟苄基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ016类似的方法,将3-溴苄溴置换为3-氟苄溴,最后经柱层析纯化后得化合物ZZ012。1H NMR(500MHz,DMSO)δ11.43(s,1H),8.46(s,1H),8.06(s,1H),7.41-7.31(m,1H),7.21-7.17(m,2H),7.10(s,1H),3.91(s,3H),3.72(s,2H),3.54(s,2H),2.78(t,J=5.7Hz,2H),2.62(t,J=5.5Hz,2H).
实施例1-13、N-(2-(6-((3-溴-2-噻吩基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ001类似的方法,将5-氯呋喃-2-甲醛置换为3-溴噻吩-2-甲醛,最后经柱层析纯化后得化合物ZZ013。1H NMR(500MHz,DMSO)δ11.45(s,1H),8.46(s,1H),8.06(s,1H),7.64(d,J=5.3Hz,1H),7.07(d,J=5.3Hz,1H),3.91(s,3H),3.88(s,2H),3.65(s,2H),2.85(t,J=5.7Hz,2H),2.62(t,J=4.8Hz,2H).
实施例1-14、N-(2-(6-((5-甲基-2-噻吩基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ001类似的方法,将5-氯呋喃-2-甲醛置换为5-甲基噻吩-2-甲醛,最后经柱层析纯化后得化合物ZZ014。1H NMR(500MHz,DMSO)δ11.43(s,1H),8.46(s,1H),8.06(s,1H),6.79(d,J=2.9Hz,1H),6.65(d,J=2.1Hz,1H),3.91(s,3H),3.81(s,2H),3.55(s,2H),2.79(t,J=5.3Hz,2H),2.60(t,J=5.0Hz,2H),2.41(s,3H).
实施例1-15、N-(2-(6-((4-溴-2-呋喃基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ001类似的方法,将5-氯呋喃-2-甲醛置换为4-溴呋喃-2-甲醛,最后经柱层析纯化后得化合物ZZ015。1H NMR(500MHz,DMSO)δ11.43(s,1H),8.46(s,1H),8.06(s,1H),7.87(s,1H),6.58(s,1H),3.91(s,3H),3.73(s,2H),3.55(s,2H),2.78(t,J=5.4Hz,2H),2.61(t,J=5.1Hz,2H).
实施例1-17、N-(2-(6-((5-硝基-2-噻吩基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ001类似的方法,将5-氯呋喃-2-甲醛置换为5-硝基噻吩-2-甲醛,最后经柱层析纯化后得化合物ZZ017。1H NMR(500MHz,DMSO)δ11.47(s,1H),8.46(s,1H),8.06(s,1H),8.04(d,J=4.2Hz,1H),7.17(d,J=4.1Hz,1H),4.00(s,2H),3.91(s,3H),3.70(s,2H),2.89(t,J=5.7Hz,2H),2.65(t,J=4.2Hz,2H).
实施例1-18、N-(2-(6-((2-溴-4-噻唑基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ001类似的方法,将5-氯呋喃-2-甲醛置换为2-溴-4-醛基噻唑,最后经柱层析纯化后得化合物ZZ018。1H NMR(500MHz,DMSO)δ11.43(s,1H),8.46(s,1H),8.06(s,1H),7.61(s,1H),3.91(s,3H),3.81(s,2H),3.60(s,2H),2.83(t,J=5.3Hz,2H),2.63(t,J=5.7Hz,2H).
实施例1-19、N-(2-(6-((2-氯-4-噻唑基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ001类似的方法,将5-氯呋喃-2-甲醛置换为2-氯-4-醛基噻唑,最后经柱层析纯化后得化合物ZZ019。1H NMR(500MHz,DMSO)δ11.43(s,1H),8.46(s,1H),8.06(s,1H),7.57(s,1H),3.91(s,3H),3.78(s,2H),3.60(s,2H),2.83(t,J=5.6Hz,2H),2.63(t,J=5.3Hz,2H).
实施例1-20、N-(2-(6-((2-溴-5-噻唑基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ001类似的方法,将5-氯呋喃-2-甲醛置换为2-溴-5-醛基噻唑,最后经柱层析纯化后得化合物ZZ020。1H NMR(500MHz,DMSO)δ11.44(s,1H),8.46(s,1H),8.06(s,1H),7.62(s,1H),3.94(s,2H),3.91(s,3H),3.61(s,2H),2.82(t,J=5.5Hz,2H),2.61(t,J=4.7Hz,2H).
实施例1-21、N-(2-(6-((5-氰基-2-噻吩基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ001类似的方法,将5-氯呋喃-2-甲醛置换为5-氰基噻吩-2-甲醛,最后经柱层析纯化后得化合物ZZ021。1H NMR(500MHz,DMSO)δ11.46(s,1H),8.46(s,1H),8.06(s,1H),7.86(d,J=3.8Hz,1H),7.20(d,J=3.8Hz,1H),4.00(s,2H),3.91(s,3H),3.66(s,2H),2.86(t,J=5.7Hz,2H),2.63(t,J=5.5Hz,2H).
实施例1-22、N-(2-(6-((4-溴-5-硝基-2-噻吩基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ001类似的方法,将5-氯呋喃-2-甲醛置换为4-溴-5-硝基噻吩-2-甲醛,最后经柱层析纯化后得化合物ZZ022。1H NMR(500MHz,DMSO)δ11.47(s,1H),8.47(s,1H),8.07(s,1H),7.37(s,1H),3.91(s,3H),3.72(s,2H),3.53(s,2H),2.92(t,J=5.7Hz,2H),2.65(t,J=4.8Hz,2H).
实施例1-23、N-(2-(6-((3-溴-2-噻吩基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ001类似的方法,将5-氯呋喃-2-甲醛置换为3-溴噻吩-2-甲醛,最后经柱层析纯化后得化合物ZZ023。1H NMR(500MHz,DMSO)δ11.45(s,1H),8.46(s,1H),8.06(s,1H),7.63(d,J=5.4Hz,1H),7.04(d,J=5.4Hz,1H),3.91(s,3H),3.89(s,2H),3.63(s,2H),2.84(t,J=5.7Hz,2H),2.62(t,J=5.5Hz,2H).
实施例1-24、N-(2-(6-((5-硝基-2-呋喃基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ001类似的方法,将5-氯呋喃-2-甲醛置换为5-硝基呋喃-2-甲醛,最后经柱层析纯化后得化合物ZZ024。1H NMR(500MHz,DMSO)δ11.45(s,1H),8.46(s,1H),8.06(s,1H),7.68(d,J=3.7Hz,1H),6.83(d,J=3.7Hz,1H),3.91(s,3H),3.88(s,2H),3.62(s,2H),2.86(t,J=5.5Hz,2H),2.64(t,J=4.9Hz,2H).
实施例1-25、N-(2-(6-(4-溴苄基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ016类似的方法,将3-溴苄溴置换为4-溴苄溴,最后经柱层析纯化后得化合物ZZ025。1H NMR(500MHz,DMSO)δ11.43(s,1H),8.45(s,1H),8.06(s,1H),7.53(d,J=8.2Hz,2H),7.32(d,J=8.0Hz,2H),3.91(s,3H),3.67(s,2H),3.52(s,2H),2.76(t,J=5.0Hz,2H),2.61(t,J=4.3Hz,2H).
实施例1-26、N-(2-(6-(2-溴苄基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ016类似的方法,将3-溴苄溴置换为2-溴苄溴,最后经柱层析纯化后得化合物ZZ026。1H NMR(500MHz,CDCl3)δ8.56(s,1H),8.01(s,1H),7.97(s,1H),7.62–7.57(m,1H),7.56–7.49(m,1H),7.37–7.30(m,1H),7.21–7.14(m,1H),4.01(s,3H),3.85(s,2H),3.69(s,2H),2.94(t,J=4.6Hz,2H),2.78(t,J=4.8Hz,2H).
实施例1-27、N-(2-(6-((5-氯苯并-[b]噻吩-3-基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ016类似的方法,将3-溴苄溴置换为3-溴甲基-5-氯苯并噻吩,最后经柱层析纯化后得化合物ZZ027。1H NMR(500MHz,DMSO)δ11.44(s,1H),8.46(s,1H),8.06(s,1H),8.04(d,J=5.7Hz,1H),8.03(s,1H),7.78(s,1H),7.42(d,J=3.9Hz,1H),3.93(s,2H),3.91(s,3H),3.61(s,2H),2.84(t,J=5.7Hz,2H),2.62(t,J=5.3Hz,2H).
实施例1-28、N-(2-(6-(2-氯苄基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ016类似的方法,将3-溴苄溴置换为2-氯苄溴,最后经柱层析纯化后得化合物ZZ028。1H NMR(500MHz,DMSO)δ11.44(s,1H),8.46(s,1H),8.06(s,1H),7.57–7.52(m,1H),7.48–7.43(m,1H),7.38–7.30(m,2H),3.91(s,3H),3.79(s,2H),3.61(s,2H),2.83(t,J=5.7Hz,2H),2.63(t,J=5.4Hz,2H).
实施例1-29、N-(2-(6-(3-甲氧苄基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ016类似的方法,将3-溴苄溴置换为3-甲氧基苄溴,最后经柱层析纯化后得化合物ZZ029。1H NMR(500MHz,DMSO)δ11.42(s,1H),8.45(s,1H),8.03(s,1H),7.32–7.21(m,1H),6.97–6.89(m,2H),6.84(d,J=8.2Hz,1H),3.91(s,3H),3.75(s,3H),3.66(s,2H),3.52(s,2H),2.76(t,J=5.8Hz,2H),2.61(t,J=5.4Hz,2H).
实施例1-30、N-(2-(6-(3-氯苄基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ016类似的方法,将3-溴苄溴置换为3-氯苄溴,最后经柱层析纯化后得化合物ZZ030。1H NMR(500MHz,DMSO)δ11.43(s,1H),8.45(s,1H),8.05(s,1H),7.42(s,1H),7.40–7.36(m,1H),7.36–7.32(m,2H),3.91(s,3H),3.71(s,2H),3.53(s,2H),2.78(t,J=5.7Hz,2H),2.62(t,J=5.4Hz,2H).
实施例1-31、N-(2-(6-((2-吡啶基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ001类似的方法,将5-氯呋喃-2-甲醛置换为吡啶-2-甲醛,最后经柱层析纯化后得化合物ZZ031。1H NMR(500MHz,DMSO)δ11.43(s,1H),8.57–8.53(m,1H),8.52–8.48(m,1H),8.46(s,1H),8.06(s,1H),7.80–7.74(m,1H),7.42–7.35(m,1H),3.91(s,3H),3.73(s,2H),3.55(s,2H),2.78(t,J=5.5Hz,2H),2.62(t,J=5.5Hz,2H).
实施例1-32、N-(2-(6-((3-吡啶基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ001类似的方法,将5-氯呋喃-2-甲醛置换为吡啶-3-甲醛,最后经柱层析纯化后得化合物ZZ032。1H NMR(500MHz,DMSO)δ11.43(s,1H),8.52(s,1H),8.46(s,1H),8.06(s,1H),7.85–7.73(m,1H),7.53–7.43(m,1H),7.34–7.24(m,1H),3.91(s,3H),3.82(s,2H),3.60(s,2H),2.82(t,J=5.6Hz,2H),2.63(t,J=5.6Hz,2H).
实施例1-33、N-(2-(6-((4-吡啶基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ001类似的方法,将5-氯呋喃-2-甲醛置换为吡啶-4-甲醛,最后经柱层析纯化后得化合物ZZ033。1H NMR(500MHz,DMSO)δ11.44(s,1H),8.56–8.51(m,2H),8.46(s,1H),8.06(s,1H),7.41–7.35(m,2H),3.91(s,3H),3.74(s,2H),3.56(s,2H),2.78(t,J=5.7Hz,2H),2.63(t,J=5.0Hz,2H).
实施例1-34、N-(2-(6-((1H-2-吡咯基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ001类似的方法,将5-氯呋喃-2-甲醛置换为2-吡咯甲醛,最后经柱层析纯化后得化合物ZZ034。1H NMR(500MHz,DMSO)δ11.42(s,1H),10.72(s,1H),8.45(s,1H),8.05(s,1H),6.66(d,J=2.6Hz,1H),5.99–5.94(m,1H),5.93(d,J=2.1Hz,1H),3.91(s,3H),3.62(s,2H),3.48(s,2H),2.73(t,J=5.6Hz,2H),2.60(t,J=5.3Hz,2H).
实施例1-35、N-(2-(6-((1H-3-吲哚基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ001类似的方法,将5-氯呋喃-2-甲醛置换为3-吲哚甲醛,最后经柱层析纯化后得化合物ZZ035。1H NMR(500MHz,DMSO)δ11.40(s,1H),10.97(s,1H),8.44(s,1H),8.05(s,1H),7.65(d,J=7.8Hz,1H),7.36(d,J=8.1Hz,1H),7.30(s,1H),7.13–7.04(m,1H),7.03–6.95(m,1H),3.91(s,3H),3.85(s,2H),3.54(s,2H),2.80(t,J=5.7Hz,2H),2.60(t,J=5.4Hz,2H).
实施例1-36、N-(2-(6-((2-吡嗪基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ001类似的方法,将5-氯呋喃-2-甲醛置换为2-吡嗪甲醛,最后经柱层析纯化后得化合物ZZ036。1H NMR(500MHz,DMSO)δ11.44(s,1H),8.73(s,1H),8.61(d,J=2.5Hz,1H),8.57(d,J=2.6Hz,1H),8.45(s,1H),8.06(s,1H),3.91(s,3H),3.89(s,2H),3.63(s,2H),2.84(t,J=5.7Hz,2H),2.64(t,J=5.3Hz,2H).
实施例1-37、N-(2-(6-((5-嘧啶基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ001类似的方法,将5-氯呋喃-2-甲醛置换为5-嘧啶甲醛,最后经柱层析纯化后得化合物ZZ037。1H NMR(500MHz,DMSO)δ11.44(s,1H),9.12(s,1H),8.84–8.72(m,2H),8.45(s,1H),8.05(s,1H),3.91(s,3H),3.76(s,2H),3.58(s,2H),2.79(t,J=5.7Hz,2H),2.63(t,J=5.8Hz,2H).
实施例1-38、N-(2-(6-((1H-4-吡唑基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ001类似的方法,将5-氯呋喃-2-甲醛置换为1H-吡唑-4-甲醛,最后经柱层析纯化后得化合物ZZ038。1H NMR(500MHz,DMSO)δ12.69(s,1H),11.41(s,1H),8.44(s,1H),8.05(s,1H),7.66(s,1H),7.43(s,1H),3.91(s,3H),3.59(s,2H),3.48(s,2H),2.72(t,J=5.6Hz,2H),2.59(t,J=5.4Hz,2H).
实施例1-39、N-(2-(6-(4-氰基苄基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ016类似的方法,将3-溴苄溴置换为4-氰基苄溴,最后经柱层析纯化后得化合物ZZ039。1H NMR(500MHz,DMSO)δ11.44(s,1H),8.45(s,1H),8.06(s,1H),7.82(d,J=8.1Hz,2H),7.58(d,J=8.1Hz,2H),3.91(s,3H),3.79(s,2H),3.55(s,2H),2.78(t,J=5.7Hz,2H),2.62(t,J=5.5Hz,2H).
实施例1-40、N-(2-(6-(3-硝基苄基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ016类似的方法,将3-溴苄溴置换为3-硝基苄溴,最后经柱层析纯化后得化合物ZZ040。1H NMR(500MHz,CDCl3)δ8.68(s,1H),8.28(s,1H),8.18(d,J=8.1Hz,1H),8.02(s,1H),7.99(s,1H),7.75(d,J=6.5Hz,1H),7.58–7.51(m,1H),4.00(s,3H),3.85(s,2H),3.63(s,2H),2.89(t,J=5.7Hz,2H),2.77(t,J=5.5Hz,2H).
实施例1-41、N-(2-(6-(2,4-二氯苄基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ016类似的方法,将3-溴苄溴置换为2,4-二氯苄溴,最后经柱层析纯化后得化合物ZZ041。1H NMR(500MHz,DMSO)δ11.44(s,1H),8.46(s,1H),8.06(s,1H),7.62(s,1H),7.57(d,J=8.2Hz,1H),7.44(d,J=8.4Hz,1H),3.91(s,3H),3.77(s,2H),3.60(s,2H),2.82(t,J=5.6Hz,2H),2.63(t,J=5.4Hz,2H).
实施例1-42、N-(2-(6-(2,5-二氯苄基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ016类似的方法,将3-溴苄溴置换为2,5-二氯苄溴,最后经柱层析纯化后得化合物ZZ042。1H NMR(500MHz,DMSO)δ7.89(s,1H),7.57(s,1H),7.50(s,1H),7.47(s,1H),7.44(d,J=6.9Hz,1H),7.39(d,J=6.8Hz,1H),3.82(s,3H),3.77(s,2H),3.69(s,2H),2.87(t,J=5.3Hz,2H),2.64(t,J=5.0Hz,2H).
实施例1-43、N-(2-(6-(2,6-二氯苄基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ016类似的方法,将3-溴苄溴置换为2,6-二氯苄溴,最后经柱层析纯化后得化合物ZZ043。1H NMR(500MHz,DMSO)δ11.43(s,1H),8.46(s,1H),8.06(s,1H),7.53–7.47(m,2H),7.39–7.34(m,1H),3.91(s,3H),3.89(s,2H),3.63(s,2H),2.90(t,J=5.5Hz,2H),2.68(t,J=5.4Hz,2H).
实施例1-44、N-(2-(6-(4-甲基苄基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ016类似的方法,将3-溴苄溴置换为4-甲基苄溴,最后经柱层析纯化后得化合物ZZ044。1H NMR(500MHz,DMSO)δ11.42(s,1H),8.45(s,1H),8.05(s,1H),7.23(d,J=7.9Hz,2H),7.15(d,J=7.7Hz,2H),3.91(s,3H),3.64(s,2H),3.49(s,2H),2.75(t,J=5.3Hz,2H),2.60(t,J=5.5Hz,2H),2.30(s,3H).
实施例1-45、N-(2-(6-((2-氯-3-噻吩基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ001类似的方法,将5-氯呋喃-2-甲醛置换为2-氯噻吩-3-甲醛,最后经柱层析纯化后得化合物ZZ045。1H NMR(500MHz,DMSO)δ11.43(s,1H),8.45(s,1H),8.06(s,1H),7.46(d,J=5.7Hz,1H),7.06(d,J=5.7Hz,1H),3.91(s,3H),3.66(s,2H),3.54(s,2H),2.77(t,J=5.7Hz,2H),2.61(t,J=5.5Hz,2H).
实施例1-46、N-(2-(6-(4-三氟甲基苄基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ016类似的方法,将3-溴苄溴置换为4-三氟甲基苄溴,最后经柱层析纯化后得化合物ZZ046。1H NMR(500MHz,DMSO)δ7.89(s,1H),7.73(s,1H),7.70(s,1H),7.58(d,J=8.1Hz,2H),7.52(d,J=8.0Hz,2H),3.82(s,3H),3.79(s,2H),3.61(s,2H),2.79(t,J=5.7Hz,2H),2.64(t,J=5.1Hz,2H).
实施例1-47、N-(2-(5-(3-溴苄基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ016类似的方法,将N-叔丁氧羰基-4-哌啶酮置换为N-叔丁氧羰基-3-哌啶酮,将3-溴苄溴置换4-溴苄溴,最后经柱层析纯化后得化合物ZZ047。1H NMR(500MHz,DMSO)δ11.43(s,1H),8.45(s,1H),8.06(s,1H),7.57(s,1H),7.49(d,J=7.7Hz,1H),7.39(d,J=7.5Hz,1H),7.36–7.30(m,1H),3.91(s,3H),3.73(s,2H),3.44(s,2H),2.76(t,J=5.7Hz,2H),2.72(t,J=5.3Hz,2H).
实施例1-48、N-(2-(5-((5-溴-2-呋喃基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ001类似的方法,将N-叔丁氧羰基-4-哌啶酮置换为N-叔丁氧羰基-3-哌啶酮,将5-氯呋喃-2-甲醛置换为5-溴呋喃-2-甲醛,最后经柱层析纯化后得化合物ZZ048。1H NMR(500MHz,DMSO)δ11.43(s,1H),8.45(s,1H),8.06(s,1H),6.54(d,J=3.0Hz,1H),6.47(d,J=3.1Hz,1H),3.91(s,3H),3.75(s,2H),3.45(s,2H),2.78(t,J=5.4Hz,2H),2.72(t,J=5.0Hz,2H).
实施例1-49、N-(2-(5-((5-溴-2-噻吩基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ001类似的方法,将N-叔丁氧羰基-4-哌啶酮置换为N-叔丁氧羰基-3-哌啶酮,将5-氯呋喃-2-甲醛置换为5-溴噻吩-2-甲醛,最后经柱层析纯化后得化合物ZZ049。1H NMR(500MHz,DMSO)δ11.44(s,1H),8.46(s,1H),8.06(s,1H),7.10(d,J=3.4Hz,1H),6.90(d,J=2.9Hz,1H),3.91(s,3H),3.74(s,2H),3.51(s,2H),2.80(t,J=5.6Hz,2H),2.71((t,J=5.2Hz,2H).
实施例1-50、N-(2-(5-((5-氯-2-呋喃基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ001类似的方法,将N-叔丁氧羰基-4-哌啶酮置换为N-叔丁氧羰基-3-哌啶酮,最后经柱层析纯化后得化合物ZZ050。1H NMR(500MHz,DMSO)δ11.43(s,1H),8.45(s,1H),8.05(s,1H),6.49(d,J=3.0Hz,1H),6.44(d,J=2.8Hz,1H),3.91(s,3H),3.74(s,2H),3.45(s,2H),2.78(t,J=5.4Hz,2H),2.72(t,J=5.2Hz,2H).
实施例1-51、N-(2-(5-((5-氯-2-噻吩基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ001类似的方法,将N-叔丁氧羰基-4-哌啶酮置换为N-叔丁氧羰基-3-哌啶酮,将5-氯呋喃-2-甲醛置换为5-氯噻吩-2-甲醛,最后经柱层析纯化后得化合物ZZ051。1H NMR(500MHz,DMSO)δ11.44(s,1H),8.45(s,1H),8.06(s,1H),6.99(d,J=3.6Hz,1H),6.93(d,J=3.4Hz,1H),3.91(s,3H),3.88(s,2H),3.51(s,2H),2.80(t,J=5.3Hz,2H),2.71(t,J=5.6Hz,2H).
实施例1-52、N-(2-(5-((3-溴-2-噻吩基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ001类似的方法,将N-叔丁氧羰基-4-哌啶酮置换为N-叔丁氧羰基-3-哌啶酮,将5-氯呋喃-2-甲醛置换为3-溴噻吩-2-甲醛,最后经柱层析纯化后得化合物ZZ052。1H NMR(500MHz,DMSO)δ11.44(s,1H),8.39(s,1H),8.01(s,1H),7.63(d,J=5.4Hz,1H),7.05(d,J=5.4Hz,1H),3.92(s,2H),3.90(s,3H),3.53(s,2H),2.82(t,J=5.5Hz,2H),2.70(t,J=5.3Hz,2H).
实施例1-53、N-(2-(5-(3-三氟甲基苄基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ001类似的方法,将N-叔丁氧羰基-4-哌啶酮置换为N-叔丁氧羰基-3-哌啶酮,将3-溴苄溴置换3-三氟甲基苄溴,最后经柱层析纯化后得化合物ZZ053。1H NMR(500MHz,DMSO)δ11.44(s,1H),8.46(s,1H),8.06(s,1H),7.70(s,1H),7.68(d,J=7.6Hz,1H),7.65(d,J=7.8Hz,1H),7.62–7.56(m,1H),3.91(s,3H),3.80(s,2H),3.56(s,2H),2.79(t,J=5.7Hz,2H),2.62(t,J=5.8Hz,2H).
实施例1-54、N-(2-(4-((5-溴-2-呋喃基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ001类似的方法,将N-叔丁氧羰基-4-哌啶酮置换为N-叔丁氧羰基-2-哌啶酮,将5-氯呋喃-2-甲醛置换为5-溴呋喃-2-甲醛,最后经柱层析纯化后得化合物ZZ054。1H NMR(500MHz,CDCl3)δ8.33(s,1H),7.97(s,1H),7.93(s,1H),5.92(d,J=2.7Hz,1H),5.68(d,J=3.1Hz,1H),4.00(s,3H),3.61(s,2H),2.69(t,J=6.3Hz,2H),2.09(t,J=6.0Hz,2H),1.50-1.43(m,2H).
实施例1-55、N-(2-(4-((5-溴-2-噻吩基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ001类似的方法,将N-叔丁氧羰基-4-哌啶酮置换为N-叔丁氧羰基-2-哌啶酮,将5-氯呋喃-2-甲醛置换为5-溴噻吩-2-甲醛,最后经柱层析纯化后得化合物ZZ055。1H NMR(500MHz,CDCl3)δ8.31(s,1H),7.98(s,1H),7.94(s,1H),6.80(d,J=3.7Hz,1H),6.78(d,J=3.7Hz,1H),4.37(s,2H),4.00(s,3H),3.14(t,J=6.6Hz,2H),2.60(t,J=6.3Hz,2H),2.02–1.95(m,2H).
实施例1-56、N-(2-(4-((5-氯-2-呋喃基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ001类似的方法,将N-叔丁氧羰基-4-哌啶酮置换为N-叔丁氧羰基-2-哌啶酮,最后经柱层析纯化后得化合物ZZ056。1H NMR(500MHz,DMSO)δ11.03(s,1H),8.39(s,1H),8.01(s,1H),6.49(d,J=3.1Hz,1H),6.43(d,J=3.1Hz,1H),4.25(s,2H),3.90(s,3H),3.58(t,J=6.4Hz,2H),3.16(t,J=6.2Hz,2H),2.76-2.69(m,2H).
实施例1-57、N-(2-(4-((5-氯-2-噻吩基)甲基)-3-氰基-4,5,6,7-四氢噻吩并-[2,3-c]吡啶基))-1-甲基-1H-吡唑-4-甲酰胺的合成
采用与制备化合物ZZ001类似的方法,将N-叔丁氧羰基-4-哌啶酮置换为N-叔丁氧羰基-2-哌啶酮,将5-氯呋喃-2-甲醛置换为5-氯噻吩-2-甲醛,最后经柱层析纯化后得化合物ZZ057。1H NMR(500MHz,DMSO)δ11.06(s,1H),8.39(s,1H),8.01(s,1H),7.02(d,J=3.7Hz,1H),6.97(d,J=3.7Hz,1H),4.41(s,2H),3.90(s,3H),3.40(t,J=6.3Hz,2H),3.12(t,J=6.0Hz,2H),2.52-2.44(m,2H).
实施例1-58、6-((5-溴-2-呋喃基)甲基)-2-(1-甲基-1H-吡唑-4-甲酰胺基)-4,5,6,7-四氢噻吩并-[2,3-c]吡啶-3-甲酸乙酯的合成
采用与制备化合物ZZ001类似的方法,将丙二腈置换为氰基乙酸乙酯,将5-氯呋喃-2-甲醛置换为5-溴呋喃-2-甲醛,最后经柱层析纯化后得化合物ZZ058。1H NMR(500MHz,DMSO)δ11.46(s,1H),8.39(s,1H),7.90(s,1H),6.53(d,J=3.2Hz,1H),6.43(d,J=3.1Hz,1H),4.31(q,J=7.0Hz,2H),3.93(s,3H),3.68(s,2H),3.52(s,2H),2.79(t,J=5.2Hz,2H),2.71(t,J=5.5Hz,2H),1.33(t,J=7.1Hz,3H).
实施例1-59、6-((5-溴-2-噻吩基)甲基)-2-(1-甲基-1H-吡唑-4-甲酰胺基)-4,5,6,7-四氢噻吩并-[2,3-c]吡啶-3-甲酸乙酯的合成
采用与制备化合物ZZ001类似的方法,将丙二腈置换为氰基乙酸乙酯,将5-氯呋喃-2-甲醛置换为5-溴噻吩-2-甲醛,最后经柱层析纯化后得化合物ZZ059。1H NMR(500MHz,DMSO)δ11.47(s,1H),8.39(s,1H),7.90(s,1H),7.08(d,J=3.7Hz,1H),6.87(d,J=3.6Hz,1H),4.32(q,J=7.1Hz,2H),3.93(s,3H),3.83(s,2H),3.59(s,2H),2.79(t,J=5.7Hz,2H),2.74(t,J=5.4Hz,2H),1.33(t,J=7.1Hz,3H).
实施例1-62、6-((5-溴-2-噻吩基)甲基)-2-(((1-甲基-1H-4-吡唑基)甲基)氨基)-4,5,6,7-四氢噻吩并-[2,3-c]吡啶-3-甲腈的合成
采用与制备化合物ZZ060类似的方法,将5-溴呋喃-2-甲醛置换为5-溴噻吩-2-甲醛,最后经柱层析纯化后得化合物ZZ062。1H NMR(500MHz,DMSO)δ7.86(s,1H),7.62(s,1H),7.37(s,1H),6.96(d,J=3.3Hz,1H),6.88(d,J=2.8Hz,1H),4.18(s,2H),3.79(m,5H),3.41(s,2H),2.74(t,J=5.3Hz,2H),2.44(t,J=5.0Hz,2H).
实施例1-63、6-((5-氯-2-噻吩基)甲基)-2-(((1-甲基-1H-4-吡唑基)甲基)氨基)-4,5,6,7-四氢噻吩并-[2,3-c]吡啶-3-甲腈的合成
采用与制备化合物ZZ060类似的方法,将5-溴呋喃-2-甲醛置换为5-氯噻吩-2-甲醛,最后经柱层析纯化后得化合物ZZ063。1H NMR(500MHz,DMSO)δ7.86(s,1H),7.62(s,1H),7.37(s,1H),7.06(d,J=3.0Hz,1H),6.85(d,J=2.4Hz,1H),4.18(s,2H),3.81(s,2H),3.79(s,3H),3.41(s,2H),2.74(t,J=5.6Hz,2H),2.44(t,J=5.2Hz,2H).
实施例1-64、6-((5-氯-2-呋喃基)甲基)-2-(((1-甲基-1H-4-吡唑基)甲基)氨基)-4,5,6,7-四氢噻吩并-[2,3-c]吡啶-3-甲腈的合成
采用与制备化合物ZZ060类似的方法,将5-溴呋喃-2-甲醛置换为5-氯呋喃-2-甲醛,最后经柱层析纯化后得化合物ZZ064。1H NMR(500MHz,DMSO)δ7.85(s,1H),7.62(s,1H),7.37(s,1H),6.43(d,J=3.4Hz,1H),6.40(d,J=3.0Hz,1H),4.16(s,2H),3.79(s,3H),3.64(s,2H),3.35(s,2H),2.71(t,J=5.1Hz,2H),2.44(t,J=5.6Hz,2H).
本发明保护内容不限于以上实施例。在不背离发明构思的精神和范围下,本领域技术人员能够想到的变化和优点都被包括在本发明中,并且以所附的权利要求书为保护范围。
- 还没有人留言评论。精彩留言会获得点赞!