一种三齿卡宾及其制备方法和应用与流程
本发明涉及涉及一种三齿卡宾及其制备方法和应用,属于有机催化技术领域。
背景技术:
由于n-杂环卡宾类似于富电子的膦配体,且金属卡宾键具有良好的热稳定性,耐水性和耐氧化性等特点,使得n-杂环卡宾在许多情况下可以替代不稳定的膦配体而应用于催化反应中,受到了科学家的广泛关注。
1995年,herrmann等首次报道了n-杂环卡宾过渡金属化合物在催化反应中的应用,并意识到该类金属化合物具有优越的催化性能。自此n-杂环卡宾在金属有机合成和均相催化领域得到了迅速的发展,并成为有机化学领域的研究热点之一。
但是,有关三齿双卡宾配体及其配合物还未见报道。
技术实现要素:
本发明提供一种三齿卡宾,其具有较强的催化性能,能够作为催化剂应用于多种有机反应中。
本发明还提供一种三齿卡宾配合物,其具有较强的催化性能,能够作为催化剂应用于多种有机反应中。
本发明还提供一种上述三齿卡宾的制备方法,合成路线简单,收率高。
本发明还提供一种上述三齿卡宾配合物的制备方法,合成路线简单,成本较低。
本发明还提供一种上述三齿卡宾和三齿卡宾配合物的应用,具有高强度的催化活性,能够应用于多种有机反应中。
本发明提供一种三齿卡宾,其具有式[1]的结构:
其中,r1和r2独立地选自经取代或未经取代的c1-10链烷基、c3-10环烷基、c2-10烯基、c2-10炔基、芳香基。
r1可以选自经取代基a取代或未经取代的c1-10链烷基、c3-10环烷基、c2-10烯基、c2-10炔基、芳香基;其中,链烷基可以是直链烷基也可以是支链烷基;芳香基可以是苯基,也可以是含有多个苯基的基团;取代基a可以是甲基、乙基、羟基等,同时,本发明不限制取代基a的个数,可以对c1-10链烷基、c3-10环烷基、c2-10烯基、c2-10炔基、芳香基中的任意个数的氢原子进行取代。
r2可以选自经取代基a取代或未经取代的c1-10链烷基、c3-10环烷基、c2-10烯基、c2-10炔基、芳香基;其中,链烷基可以是直链烷基也可以是支链烷基;芳香基可以是苯基,也可以是含有多个苯基的基团;取代基a可以是甲基、乙基、羟基等,同时,本发明不限制取代基a的个数,可以对c1-10链烷基、c3-10环烷基、c2-10烯基、c2-10炔基、芳香基中的任意个数的氢原子进行取代。
在本发明中,r1和r2可以相同也可以不同。
根据本发明提供的三齿卡宾,r1和r2独立地选自经取代或未经取代的c1-6链烷基、c3-6环烷基、c2-6烯基、c2-6炔基。
其中,c1-6链烷基包括直链烷基和支链烷基,当为支链烷基时,碳原子个数为3-6。
c1-6直链烷基例如可列举甲基、乙基、丙基、烯丙基、正丁基、正戊基、正己基、正庚基等;
c3-6支链烷基例如可列举异丙基、异丁基、仲丁基、叔丁基、异戊基、异己基等;
c3-6环烷基例如可列举环丙基、环丁基、环戊基、环己基等。
c2-6烯基可以是直链烯基,也可以是支链烯基,并且本发明不限制烯键的数量。
c2-6炔基可以是直链炔基,也可以是支链炔基,并且本发明不限制炔键的数量。
当r1和r2为上述取代基时,还可以利用甲基、乙基对上述r1和r2中的氢原子进行取代。例如,r1和r2还可以为1-甲基-环戊基,2-乙基-丙炔基等。
根据本发明提供的三齿卡宾,r1和r2独立地选自经n个取代基取代的苯基,1≤n≤5且n为整数;
所述取代基包括:c1-6烷基、c2-6烯基、c2-6炔基。
也就是说,r1和r2可以分别为被取代基取代的苯基,并且苯基上取代基的个数可以是1-5个,其中当取代基的个数大于等于2时,取代基可以相同也可以不同。
例如取代基为烃基时,可以为甲基、乙基、丙基、异丙基、丁基、异丁基、叔丁基、戊基、异戊基、己基、乙烯基、丙烯基、1-丁烯基、2-丁烯基、1,3-2戊烯基、乙炔基、丙炔基。
也就是说,r1和r2可以分别为苯基、甲基取代苯基、乙基取代苯基等。
作为非限定性的示例,本发明提供的三齿卡宾可以例如式[a]-式[e]所示的化合物:
经研究表明,在母体为式[1]所表示的三齿双卡宾中,当r1和r2独立选自上述取代基(甲基、苯基、2,6-二异丙基-苯、2,4,6-三甲基-苯)时,能够显著增强该三齿卡宾的催化性能。
本发明还提供一种三齿卡宾配合物,由上述任一所述的三齿卡宾和金属化合物配位制得,所述三齿卡宾配合物具有式[2]的结构:
其中,m为金属化合物。
上述式[2]所表示的化合物为式[1]所表示的化合物与m中的金属配位而得,其中,式[2]中的r1和r2与[1]中的r1和r2具有相同定义,并且m可以为金属卤化物。
由式[2]所表示的化合物具有显著的催化活性,能够作为有机催化反应中的催化剂进行使用。
具体地,金属化合物m为pd(ch3cn)2cl2、ni(pph3)3cl2、au(txt)cl和cui中的一种。
式[2]所表示的化合物可以为以下式[f]所示。
本发明还提供一种上述任一所述的三齿卡宾的制备方法,包括如下步骤:
1,3-r1r2-三氮烯和二丙炔基胺在酸性条件下反应生成1,3-二(1,3-r1r2-1,2,3-三唑)-二甲胺盐;
所述1,3-二(1,3-r1r2-1,2,3-三唑)-二甲胺盐发生消去反应,生成所述三齿卡宾;
其中,所述r1和r2与上述任一所述的三齿卡宾中的r1和r2相同。
在制备1,3-二(1,3-r1r2-1,2,3-三唑)-二甲胺盐时,通常需要先对反应物二丙炔基胺中的氨基进行保护,一般采用boc保护。然后,1,3-r1r2-三氮烯和boc保护的二丙炔基胺作为反应物在例如二氯甲烷的溶剂中,弱酸性低温条件下反应,得到boc保护的1,3-二(1,3-r1r2-1,2,3-三唑)-二甲胺,可提供弱酸性条件的化合物例如可为六氟磷酸钾,可将反应物降温至例如-78℃。然后,将boc保护的1,3-二(1,3-r1r2-1,2,3-三唑)-二甲胺在酸性条件低温条件下脱掉boc保护,得到1,3-二(1,3-r1r2-1,2,3-三唑)-二甲胺盐。
值得注意的是,1,3-二(1,3-r1r2-1,2,3-三唑)-二甲胺盐也可以分步制备,例如先使1-r1-三氮烯和boc保护的二丙炔基胺作为反应物生成1,3-二(1-r1-1,2,3-三唑)-二甲胺,然后将1,3-二(1-r1-1,2,3-三唑)-二甲胺和带有r2的化合物作为反应物进行反应,生成1,3-二(1,3-r1r2-1,2,3-三唑)-二甲胺盐。
最终,使1,3-二(1,3-r1r2-1,2,3-三唑)-二甲胺盐发生消去反应,拔掉含氮五元环上的-ch2上的一个氢原子,生成如式[1]所表示的三齿卡宾。
其中,1,3-r1r2-三氮烯的可以商购也可以自合成,其中自合成的方法参见wirschun,w.;jochims,j.c.synthesis1997,233。
当反应物为1,3-二(2,6-二异丙基-苯)-三氮烯和二丙炔基胺时,式[1]所示的化合物具体为式[a]所示;
当反应物为1,3-二(2,4,6-三甲基-苯)-三氮烯和二丙炔基胺时,式[1]所示的化合物具体为式[b]所示;
当反应物为1-苯基-三氮烯、三氟甲磺酸甲酯和二丙炔基胺时,式[1]所示的化合物具体为式[c]所示;
当反应物为1,3-二甲基-三氮烯和二丙炔基胺时,式[1]所示的化合物具体为式[d]所示;
当反应物为1,3-二乙基-三氮烯和二丙炔基胺时,式[1]所示的化合物具体为式[e]所示;
本发明人经过研究和实验,设计合成了一系列三齿卡宾,并且惊奇地发现,当三齿卡宾具体为上述式[a]-[e]所示时,化合物对小分子活化反应具有显著的催化活性。
本发明还提供一种上述任一所述的三齿卡宾配合物的制备方法,包括以下步骤:
1,3-r1r2-三氮烯和二丙炔基胺在酸性条件下反应生成1,3-二(1,3-r1r2-1,2,3-三唑)-二甲胺盐;
所述1,3-二(1,3-r1r2-1,2,3-三唑)-二甲胺盐发生消去反应,生成所述三齿卡宾;
所述三齿卡宾与金属化合物m反应,生成所述三齿卡宾配合物;
所述金属化合物m可以是金属卤化物。
在上述三齿卡宾配合物的制备方法中,前两步制备三齿卡宾的方法与前述制备三齿卡宾的方法相同,此处不再赘述。也就是说,三齿卡宾配合物的制备方法是在前述三齿卡宾制备方法的基础上增加一步与金属化合物的配位反应,从而生成如式[2]所示的三齿卡宾配合物。
具体地,等物质的量的三齿卡宾与金属化合物作为反应物在例如超干二氯甲烷的溶剂中发生反应,生成如式[2]所示的三齿卡宾配合物。
例如,当三齿卡宾为式[a],且m为pd(ch3cn)2cl2时,生成的式[2]所示的化合物具体为式[f]所示;
当三齿卡宾为式[b],且m为ni(pph3)3cl2时,生成的式[2]所示的化合物具体为式[g]所示;
当三齿卡宾为式[c],且m为au(txt)cl时,生成的式[2]所示的化合物具体为式[h]所示;
当三齿卡宾为式[d],且m为cui时,生成的式[2]所示的化合物具体为式[i]所示;
当三齿卡宾为式[e],且m为pd(ch3cn)2cl2时,生成的式[2]所示的化合物具体为式[j]所示。
可以理解的是,本发明的式[2]所示的化合物并不限定于式[f]-式[j],任何具有空的p轨道的金属化合物都可以与式[1]所示的化合物进行配位,生成本发明的式[2]所示的化合物。
本发明还提供一种上述任一所述的三齿卡宾在有机催化反应中的应用。
具体地,三齿卡宾能够作为催化剂有效的活化小分子反应的发生。
本发明还提供一种上述任一所述的三齿卡宾配合物在有机催化反应中的应用。
具体地,三齿卡宾配合物能够作为催化剂有效的催化suzuki、heck、氢转移反应的发生。
本发明方案的实施,至少具有以下优势:
1、本发明提供的三齿卡宾和三齿卡宾配合物,具有良好的催化活性,尤其在有机催化反应中具有其独特的催化效果,为开发新型催化剂提供了可能;
2、本发明提供的三齿卡宾和三齿卡宾配合物的制备方法,合成路线简单,成本较低,利于工业化实施。
附图说明
图1为本实施1例制备的化合物l1的核磁共振氢谱图;
图2为本实施1例制备的化合物l2的核磁共振氢谱图;
图3为实施例3制备的化合物l3的核磁共振氢谱图;
图4为实施例3制备的化合物l4的核磁共振氢谱图;
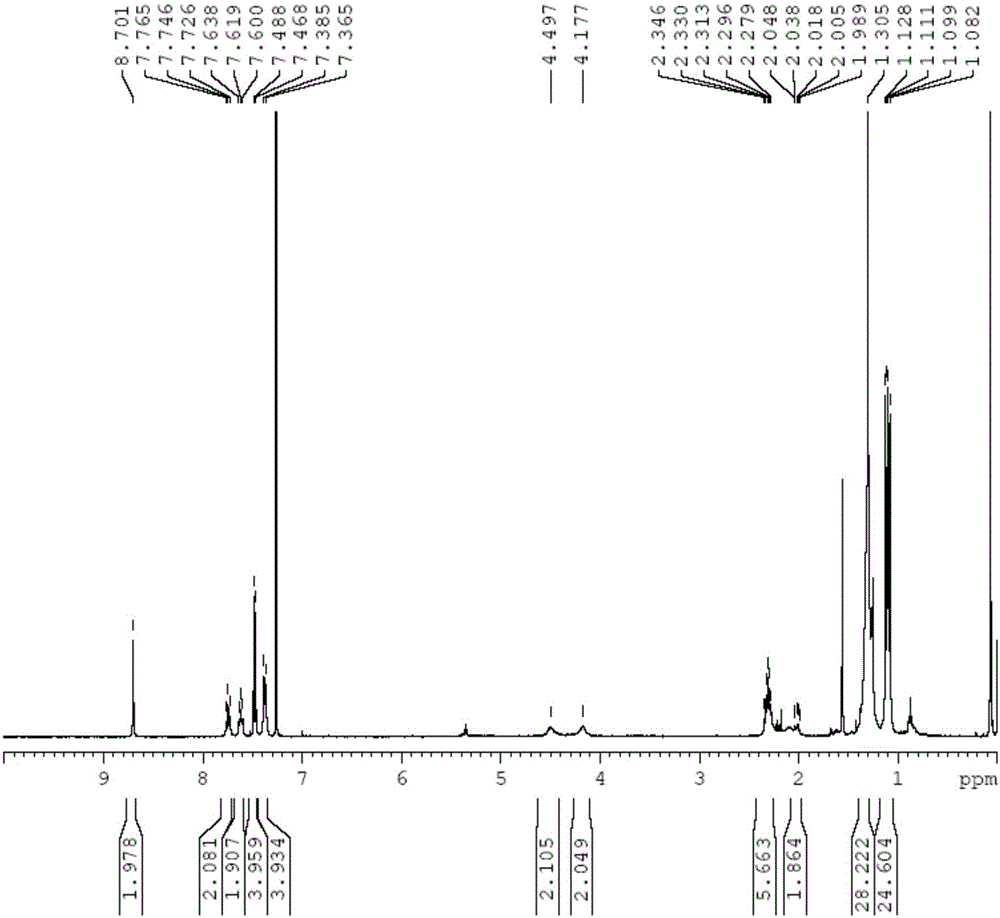
图5为实施例5制备的式[f]所示的化合物的核磁共振氢谱图。
具体实施方式
以下参照本发明实施例来更充分地描述本发明。然而,本发明可以许多不同形式来体现,不应理解为限于本文陈述的实施例。
实施例1
本实施例制备式[a]所示的化合物,包括如下步骤:
1)1,3-二(1,3-二(2,6-二异丙基-苯)-1,2,3-三唑)-二甲胺盐(l2)的制备
在250mlschlenk瓶中加入六氟磷酸钾(1.9g,10.4mmol),加热抽气换n2若干次,待schelenk瓶冷却后加入1,3-二(2,6-二异丙基-苯)-三氮烯(5.0g,13.4mmol),再换气三次,然后降温至-78℃,加入超干二氯甲烷50ml,加入boc保护的二丙炔基胺(10g,5.2mmol),待温度稳定在-78℃后,避光,加入tbuocl(1.30ml,11.4mmol),自行升温,过夜。在通风处抽滤,用二氯甲烷洗涤固体,收集滤液,旋转蒸发除去二氯甲烷,得到白色固体。之后加入100ml乙醚洗涤,得白色固体l13.98g,产率:63%。
在250mlschlenk瓶中加入l1(3.98g,3.3mmol),加热抽气换n2若干次,待schelenk瓶冷却后加入超干二氯甲烷20ml加入三氟甲磺酸1ml,2h后用naoh中和调节ph至8左右。加入50ml二氯甲烷,用30ml水洗涤。二氯甲烷干燥后,旋转蒸发除去,得到白色固体。之后加入100ml乙醚洗涤,得白色固体l22.65g,产率:73%。
图1为实施例1制备的化合物l1的核磁共振氢谱图,表征如下:
1hnmr(cdcl3,400mhz,δppm)8.72(s,2h),7.77(t,j=7.9hz,2h),7.64(t,j=7.7hz,2h),7.50(d,j=7.9hz,4h),7.40(d,j=7.6hz,4h),4.52(s,2h),4.20(s,2h),2.34(sept,j=13.3,6.5hz,6h),2.12(m,2h),1.33(s,33h),1.14(d,j=6.8hz,12h),1.11(d,j=6.8hz,12h).
图2为实施例1制备的化合物l2的核磁共振氢谱图,表征如下:
1hnmr(cdcl3,400mhz,δppm)8.82(s,2h),7.70(d,2h),7.60(d,j=8.2hz,2h),7.40(d,j=7.9hz,4h),7.38(d,j=7.9hz,4h),3.99(s,4h),2.49(sept,j=13.4,6.7hz,4h),2.39(sept,j=13.5,6.7hz,4h),1.34(d,j=3.4hz,12h),1.33(d,14h),1.32(d,j=3.4hz,12h),1.15(d,j=6.9hz,12h),1.12(s,12h).
2)式[a]所示的化合物的制备
在烘干的100mlschlenk瓶中加入l2(558.1mg,0.5mmol),同时加入khmds(200mg,1.0mmol)抽气换n2若干次,加入超干四氢呋喃20ml,反应1小时,甲苯萃取,得到式[a]所示的化合物。
本发明实施例制备的式[a]所示的化合物通过核磁共振氢谱(1hnmr),表征如下:
1hnmr(cdcl3,400mhz,δppm)δ7.71(d,2h),7.61(d,j=8.2hz,2h),7.40(d,j=7.9hz,4h),7.38(d,j=7.9hz,4h),3.99(s,4h),2.48(sept,j=13.4,6.7hz,4h),2.38(sept,j=13.5,6.7hz,4h),1.34(d,j=3.4hz,12h),1.33(d,12h),1.15(d,j=6.9hz,12h),1.12(d,j=6.9hz,12h).
实施例2
本实施例制备式[b]所示的化合物
在实施例1中,将1,3-二(2,6-二异丙基-苯)-三氮烯替换成1,3-二(2,4,6-三甲基-苯)-三氮烯,其余条件与实施例1相同,得到式[b]所示的化合物。
实施例2中制备的式[b]所示的化合物可以通过核磁共振氢谱(1hnmr)测试验证其结构,表征如下:
1hnmr(cdcl3,400mhz,δppm)δ7.06(s,4h),7.05(s,4h),4.00(s,4h),2.36(d,j=2.4hz,12h),2.15(s,12h),2.09(s,12h).
实施例3
本实施例制备式[c]所示的化合物,包括如下步骤:
1)l4的制备
在烘干的100mlschlenk瓶中的dmso:h2o(9:1)混合溶液加入1-苯基-叠氮苯(0.68g,5.7mmol)和碘化亚铜(0.099g,0.5mmol)并搅拌10分钟。加入boc保护的二丙炔基胺(0.5g,2.6mmol)并再搅拌24小时,将反应的混合物加入冰水中,沉淀出固体,过滤出溶剂,沉淀用水和丙酮洗涤,真空干燥,得到白色固体l30.98g,产率:87%。
在烘干的100mlschlenk瓶中的加入l3(86.3mg,0.2mmol),并加入超干二氯甲烷5ml,降温至-78℃,然后加入三氟甲磺酸甲酯(72.2mg,0.44mmol),当反应升至室温,加入三氟甲磺酸(75.0mg,0.50mmol),反应2h之后用二氯甲烷萃取,有机相用无水硫酸镁干燥,旋转蒸发除去二氯甲烷,加入5ml洗涤,真空干燥。得到浅黄色固体l4102.0mg,产率:72%。
图3为实施例3制备的化合物l3的核磁共振氢谱图,表征如下:
1hnmr(cdcl3,400mhz,δppm)9.24(s,2h),7.89(d,j=6.7,2.6hz,4h),7.62(d,j=2.3hz,4h),7.61(s,2h),4.46(s,4h),4.44(s,6h).
图4为实施例3制备的化合物l4的核磁共振氢谱图,表征如下:
1hnmr(cdcl3,400mhz,δppm)δ8.01(s,1h),7.91(s,1h),7.63(d,j=7.7hz,4h),7.41(d,j=7.2hz,4h),7.34(d,j=6.6hz,2h),4.66(s,4h),1.44(s,9h).
2)式[c]所示的化合物的制备
在烘干的100mlschlenk瓶中加入l4(181mg,0.5mmol),同时加入khmds(400mg,1.0mmol)抽气换n2若干次,加入超干四氢呋喃20ml,反应1小时,甲苯萃取,得到式[c]所示的化合物。
本发明实施例制备的式[c]所示的化合物通过核磁共振氢谱(1hnmr),表征如下:
1hnmr(cdcl3,400mhz,δppm)1hnmr(400mhz,cdcl3)δ8.01(s,1h),7.91(s,1h),7.63(d,j=7.7hz,4h),7.41(d,j=7.2hz,4h),7.34(d,j=6.6hz,2h),4.66(s,4h),1.44(s,9h).
实施例4
本实施例制备式[d]所示的化合物
在实施例1中,将1,3-二(2,6-二异丙基-苯)-三氮烯替换成1,3-二甲基-三氮烯,其余条件与实施例1相同,得到式[d]所示的化合物。
实施例4中制备的式[d]所示的化合物可以通过核磁共振氢谱(1hnmr)测试验证其结构,表征如下:
1hnmr(400mhz,cdcl3)δ4.47(s,j=6.6hz,3h),4.45(s,3h),4.35(s,6h),4.43(s,6h).
实施例5
式[f]所示的化合物的制备
在烘干的25mlschlenk瓶中加入式[a]所示的化合物(82mg,0.1mmol),同时加入二乙腈氯化钯(25.7mg,0.1mmol),抽气换n2若干次,加入超干二氯甲烷10ml,避光反应1天,过滤并旋转蒸发除去二氯甲烷,得到式[f]所示的化合物70mg,产率:85%。
图5为实施例5制备的式[f]所示的化合物的核磁共振氢谱图,表征如下:1hnmr(cdcl3,400mhz,δppm)δ7.79(s,1h),7.57(t,j=7.8hz,2h),7.46–7.41(m,4h),7.40(s,2h),7.31(d,j=7.8hz,2h),7.24(d,j=7.8hz,2h),7.19(d,j=7.7hz,2h),4.38(d,j=5.0hz,1h),4.35(d,j=5.0hz,1h),3.95(d,j=8.9hz,1h),3.91(d,j=8.9hz,1h),2.48(sept,j=13.7,6.7hz,4h),2.42(sept,j=13.5,6.6hz,2h),2.22(sept,j=13.5,6.6hz,2h),1.43(d,j=6.7hz,6h),1.39(d,j=6.7hz,6h),1.32(d,j=6.7hz,6h),1.29(d,j=6.7hz,6h),1.12(d,j=6.5hz,12h),1.09(d,j=7.4hz,12h).
将实施例5制备的式[f]所示的化合物进行下述催化活性验证
上式中,cat为催化剂,即为实施例5制备的式[f]所示的化合物。
1、当ar1为
产物利用通过核磁共振氢谱(1hnmr),表征如下:
1hnmr(cdcl3,400mhz,δppm)δ7.58(d,j=7.6hz,2h),7.42(t,j=7.6hz,2h),7.32-7.36(m,2h),7.12-7.21(m,2h),6.89(dd,j=8.2hz,2.4hz,1h),3.84(s,3h).
由上述数据可知,实施例5制备的式[f]所示的化合物能够催化上述反应,得到式[f1]所示的化合物。
2、当ar1为
产物利用通过核磁共振氢谱(1hnmr),表征如下:
1hnmr(cdcl3,400mhz,δppm)δ8.45(s,1h),8.21-8.18(m,1h),7.91(d,j=8.0hz,1h),7.63-7.59(m,3h),7.51-7.41(m,3h).
由上述数据可知,实施例5制备的式[f]所示的化合物能够催化上述反应,得到式[f2]所示的化合物。
3、当ar1为
产物利用通过核磁共振氢谱(1hnmr),表征如下:
1hnmr(cdcl3,400mhz,δppm)δ7.56-7.52(m,4h),7.41(t,j=7.6hz,2h),7.30(t,j=7.4hz,1h),6.98(d,j=8.5hz,2h),3.85(s,3h).
由上述数据可知,实施例5制备的式[f]所示的化合物能够催化上述反应,得到式[f3]所示的化合物。
4、当ar1为
产物利用通过核磁共振氢谱(1hnmr),表征如下:
1hnmr(cdcl3,400mhz,δppm)8.45(s,1h),8.21-8.18(m,1h),7.91(d,j=8.0hz,1h),7.63-7.59(m,3h),7.51-7.41(m,3h).
由上述数据可知,实施例5制备的式[f]所示的化合物能够催化上述反应,得到式[f4]所示的化合物。
5、当ar1为
产物利用通过核磁共振氢谱(1hnmr),表征如下:
1hnmr(cdcl3,400mhz,δppm)δ7.68-7.75(m,4h),7.58-7.61(m,2h),7.47-7.51(m,2h),7.41-7.45(m,1h).
由上述数据可知,实施例5制备的式[f]所示的化合物能够催化上述反应,得到式[f5]所示的化合物。
6、当ar1为
产物利用通过核磁共振氢谱(1hnmr),表征如下:
1hnmr(cdcl3,400mhz,δppm)δ7.70(s,4h),7.60-7.63(m,2h),7.47-7.51(m,2h),7.40-7.44(m,1h).
由上述数据可知,实施例5制备的式[f]所示的化合物能够催化上述反应,得到式[f6]所示的化合物。
7、当ar1为
产物利用通过核磁共振氢谱(1hnmr),表征如下:
1hnmr(cdcl3,400mhz,δppm)δ8.41(t,j=2.0hz,1h),8.16-8.14(m,1h),7.88-7.86(m,1h),7.60-7.56(m,3h),7.04-7.01(m,2h),3.88(s,3h).
由上述数据可知,实施例5制备的式[f]所示的化合物能够催化上述反应,得到式[f7]所示的化合物。
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
- 还没有人留言评论。精彩留言会获得点赞!