一种含磷化合物及其制备和应用的制作方法
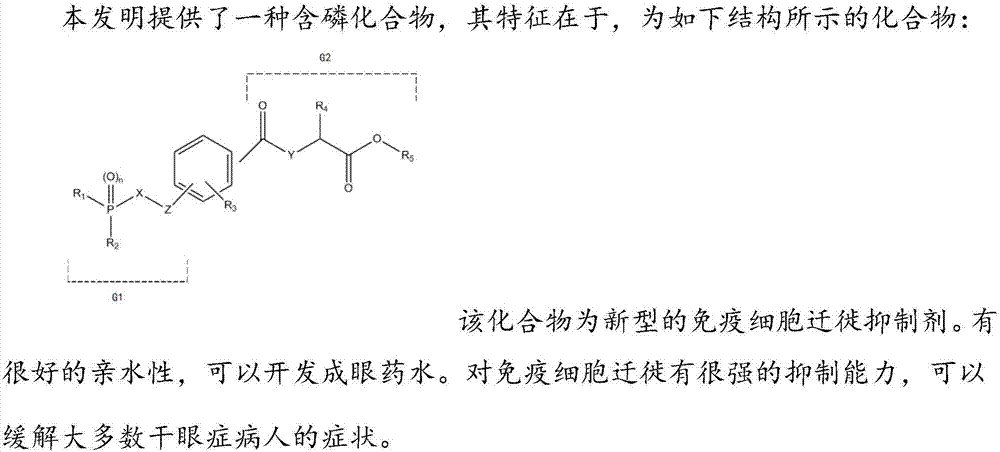
本发明涉及医药化学领域,具体地,涉及一种含磷化合物及其制备方法和在治疗干眼症上的应用。
背景技术:
:眼泪给眼睛持久的润湿和润滑,是维持视力和眼睛舒适度的关键。眼泪由水、油脂、粘液、抗体和一些特定蛋白质(用于抵抗感染)的组成。这些组分由位于眼周围的特殊的腺体分泌。当该眼泪体系中存在不平衡时,人会感觉眼干。干眼综合征为常见的眼表面炎性疾病。患有干眼病的人可能感觉到眼睛疼痛、光敏性、发痒、发红和视力模糊。干眼综合征有多种诱发因素,包括年龄、性别、环境、药物、手术,和全身疾病如自身免疫系统疾病、糖尿病、甲状腺疾病、淋巴瘤等。干眼病如得不到恰当的诊断和治疗可能会导致进一步的并发症如感染、眼表面角质化、角膜溃疡和结膜鳞状化等。故而,干眼症是困扰5-10%人口的很大的疾病,特别是长期工作于计算机前,及中年以后的人群。现今眼科医生门诊超过30%是干眼症病人。中国尽管干眼症患者众多,但迄今没有被批准用于治疗干眼症的药物。病人只能已人造眼泪得到暂时的缓解。因此,急需治疗干眼症的药物。干眼症的发病率和年龄与呈正比,50岁以上人群约20%有不同程度的干眼症;性别也影响干眼症,女性,特别是高龄女性患干眼症远高于男性,这可能和性荷尔蒙的分泌有关;白领工作人员长时间在空调环境下,另外长时间使用屏幕也造成该人群干眼症发病率高。干眼症是一连续的病理过程,病情由轻到重连续发展,且轻、中、重度之间无明显的分界线。尽管干眼症病因复杂,研究发现各种原因引发的干眼症的病理类似:免疫细胞侵润眼睛表面组织引发慢性炎症,造成眼表伤害。目前,欧美市场有两个药物被批准:(1)环孢素a悬浮液。该药是很强大免疫系统抑制药,因此有可能造成对免疫系统的伤害。同时,因为其是悬浮液,存在长期存放稳定性,以及使用时对病人眼睛刺激等问题;(2)lifitigrast,该药2016年12月或得美国fda批准,是免疫细胞迁徙抑制剂,通过阻止免疫细胞进入炎症部位达到治疗效果;但该药亲脂性很高,而且在临床上对>50%的病人没有效果。技术实现要素:本发明为新型的免疫细胞迁徙抑制剂。有很好的亲水性,可以开发成眼药水。对免疫细胞迁徙有很强的抑制能力,可以缓解大多数干眼症病人的症状。本发明提供的一种含磷化合物,其特征在于,为如下结构所示的化合物:r1选自烷基、芳基、苄基及其衍生物;r1中烷基选自如:甲基、乙基、丙基、异丙基、丁基、异丁基、戊基、环戊基、己基、环己基等碳原子数为1-12的支链、支链或环烷基;芳基选自如:苯基、萘基、喹啉基,或苯环上任一或任几个碳为碳原子数为1-3的烷基/苯基/卤素/硝基/氨基/磺酰基/氨基/碳原子数为1-3的烷氧基取代的苯基、萘基或喹啉基;苄基选自如:苯环上任一或任几个碳为碳原子数为1-3的烷基/苯基/卤素/硝基/氨基/磺酰基/碳原子数为1-3的烷基取代的苄基;r2选自羟基、烷基、氢、烷氧基、胺基、烷胺基;r2中烷基选自如:甲基、乙基、丙基、异丙基、环丙基、丁基、异丁基、戊基、环戊基、己基、环己基等碳原子数为1-12的支链、支链或环烷基;烷氧基选自如:甲氧基、乙氧基等碳原子数为1-12的支链、支链或环烷氧基;n选自0或1;x选自碳、氧、氮;在x中,当其为碳时,此处可以为(-ch2-),或(-c(r1r2)-,其中,r1、r2可以为相同或不相同的任意取代基团,如:氢、甲基、乙基等烷基,苯基、苄基等芳香基团,羟基,烷氧基,卤素等;)在x中,当其为氮时,此处可以为(-nh-),或(-n(rn)-,其中,rn可以为任意取代基团,如:甲基、乙基等烷基,苯基、苄基等芳香基团等;)z选自碳、氧、硫、氮;在z中,当其为碳时,此处可以为羰基(-(c=o)-)、烷基(-cnh2n-,其中,n为10以下的自然数)、或(-c(r1r2)-、支链烷基,其中,r1、r2可以为相同或不相同的任意取代基团,如:氢、甲基、乙基等烷基,苯基、苄基等芳香基团,羟基,烷氧基,卤素等;)在z中,当其为氮时,此处可以为(-nh-),或(-n(rn)-,其中,rn可以为任意取代基团,如:甲基、乙基等烷基,苯基、苄基等芳香基团等;)r3为苯环上任一或任几取代的氢、烷基、烷氧基、卤素、氨基、氰基、羟基、硝基、芳基;y选自碳、氧、氮;在y中,当其为碳时,此处可以为(-ch2-),或(-c(r1r2)-,其中,r1、r2可以为相同或不相同的任意取代基团,如:氢、甲基、乙基等烷基,苯基、苄基等芳香基团,卤素等;)在y中,当其为氮时,此处可以为(-nh-),或(-n(rn)-,其中,rn可以为任意取代基团,如:甲基、乙基等烷基,苯基、苄基等芳香基团等);r4选自烷基、烷氧基、芳基、苄基及其衍生物;r5选自氢、烷基、芳基、苄基及其衍生物;g1和g2所代表的取代基团呈间位、对位或邻位的设置于苯环上。进一步地,本发明提供的一种含磷化合物,还具有这样的特点:即、上述芳基选自苯基及其衍生物、萘基及其衍生物、n杂或o杂环苯基及其衍生物、n杂或o杂环萘基及其衍生物;其中,上述衍生物指在芳香环上任一或任几取代的氢、烷基、烷氧基、卤素、氨基、氰基、羟基、硝基、芳基、烷基磺酰基、苯基磺酰基。进一步地,本发明提供的一种含磷化合物,还具有这样的特点:即、上x选自氨(-nh-)、胺(-n(r3)-);上述y选自(-nh-)、胺(-n(rn)-)、铵(-n+(r4r5)-,其中,rn可以为任意取代基团,如:甲基、乙基等烷基,苯基、苄基等芳香基团等),r4、r5可以为相同或不相同的任意取代基团,如:甲基、乙基等烷基,苯基、苄基等芳香基团等,与n+配位的阴离子可选自卤素)。进一步地,本发明提供的一种含磷化合物,还具有这样的特点:即、上述r4选自如下结构所示的基团:n选自0-5的整数;上述a选自硫、碳、氮、氧;上述r42选自芳基、烷基、烷基氨基、烷基磺酰胺基、环烷基、取代的环烷基、杂环烷基、取代的杂环烷基;其中,上述芳基选自6-12元的芳香基及其衍生物、5-12元的芳香环上,任一或任几个碳原子为氧、氮、硫替代的杂芳基;其中,上述衍生物指在芳香环上任一或任几取代的氢、烷基、烷氧基、卤素、氨基、氰基、羟基、硝基、磺酰基、烷基磺酰基、苯基磺酰基。上述杂芳基上还可以具有-n-r422的结构;上述r422为磺酰基、烷基磺酰基、烷基、羟基;上述环烷基为3-12元的环烷基;上述取代的环烷基为环上任一或任几取代的磺酰基、烷基磺酰基、烷基、烷氧基、羟基、氨基、硝基;上述杂环烷基为3-12元的杂环烷基上,任一或任几个碳原子为氧、氮、硫替代;上述杂环烷基上的碳原子还可以为c=o基和/或so和/或so2基替代;上述取代的杂环烷基为环上任一或任几磺酰基、烷基磺酰基、烷基、烷氧基、羟基、氨基、硝基、羰基取代的氮杂、氧杂或硫杂的四元、五元、六元或七元环的环烷基;上述取代的杂环烷基上还可以具有-n-r422的结构;上述r422为磺酰基、烷基磺酰基、烷基、羟基;上述r42还可以选自如下结构的基团:上述r43、r44为相同或不相同的烷基、羟基、羟基取代的碳原子数不大于5的烷基;g3为3-12元的环;上述g3的环上的碳原子还可以部分的为氧、硫、氮、c=o或so2替代;上述r45为g3环上一个或几个取代的烷基、羟基、烷氧基、氨基。进一步地,本发明提供的一种含磷化合物,还具有这样的特点:即、为如下结构所示的化合物:其中,上述c1和c2均为碳原子,其之间的碳键为单键、双键或三键。进一步地,本发明提供的一种含磷化合物,还具有这样的特点:即、为如下结构所示的化合物:r11选自苯环上任一或任几取代的氢、烷基、烷氧基、卤素、氨基、氰基、羟基、硝基;r2选自羟基、烷基、烷氧基、卤素;r3为苯环上任一或任几取代的氢、烷基、烷氧基、卤素、氨基、氰基、羟基、硝基、芳基;y1选自氢、烷基、芳基;r41选自苯环上任一或任几取代的氢、烷基、烷氧基、烷基磺酰基、芳基磺酰基、卤素、氨基、氰基、羟基、硝基;r5选自氢、烷基、芳基、苄基及其衍生物。进一步地,本发明提供的一种含磷化合物,还具有这样的特点:即、为如下结构所示的化合物:其中,x1、x2、x3、x4选自氢、烷基、卤素、羟基。进一步地,本发明提供的一种含磷化合物,还具有这样的特点:即、上述含磷化合物选自如下化合物:(2s)-2-(2,6-二氯-4-(2-(羟基(苯基)磷酰基)乙基)苯甲酰胺基)-3-(3-(甲磺酰基)苯基)丙酸;(2s)-2-(2,6-二氯-4-((羟基(3-羟基苯基)磷酰基)乙炔基)苯甲氨基)-3-(3-(甲磺酰基)苯基)丙酸;(2s)-2-(2,6-二氯-4-(2-(羟基(间羟基苯基)磷酰基)乙基)苯甲酰胺基)-3-(3-(甲磺酰基)苯基)丙酸;(2s)-2-(2,6-二氯-4-(2-(甲氧基(苯基)磷酰基)乙基)苯甲酰胺基)-3-(3-(甲磺酰基)苯基)丙酸;(2s)-2-(2,6-二氯-4-(甲氧基(苯基)磷酰基)乙炔基)苯甲酰胺基)-3-(3-(甲磺酰基)苯基)丙酸;(2s)-2-(2,6-二氯-4-(2-(乙氧基(间羟基苯基)磷酰基)乙基)苯甲酰胺基)-3-(3-(甲磺酰基)苯基)丙酸;(2s)-2-(2,6-二氯-4-((甲氧基(3-羟基苯基)磷酰基)乙炔基)苯甲氨基)-3-(3-(甲磺酰基)苯基)丙酸;(2s)-2-(2,6-二氯-4-(2-(甲氧基(3-羟基苯基)磷酰基)乙基)苯甲氨基)-3-(3-(甲磺酰基)苯基)丙酸;(2s)-2-(2,6-二氯-4-(甲基(苯基)磷酰基)乙炔基)苯甲酰胺基)-3-(3-(甲磺酰基)苯基)丙酸;(2s)-2-(2,6-二氯-4-(2-(甲基(苯基)磷酰基)乙基)苯甲酰胺基)-3-(3-(甲磺酰基)苯基)丙酸;(2s)-2-(2,6-二氯-4-((甲基(3-羟基苯基)磷酰基)乙炔基)苯甲氨基)-3-(3-(甲磺酰基)苯基)丙酸;(2s)-2-(2,6-二氯-4-((甲氧基(3-甲氧基苯基)磷酰基)乙炔基)苯甲氨基)-3-(3-(甲磺酰基)苯基)丙酸;(2s)-2-(2,6-二氯-4-((羟基(3-甲氧基苯基)磷酰基)乙炔基)苯甲氨基)-3-(3-(甲磺酰基)苯基)丙酸。另外,本发明还提供了上述含磷化合物的制备方法,其特征在于:由化合物a和化合物c,依次与化合物b上的活性点位进行反应后获得;其中,上述化合物a为如下结构所示的化合物:上述化合物c为如下结构所示的化合物:上述化合物b为如下结构所示的化合物:其中,l1与l1‘以及l2与l2‘分别为一对可相互发生反应的活性基团,在反应的过程中,通过l1与l1‘反应,l2与l2‘反应获得目标产物;r1选自烷基、芳基、苄基及其衍生物;r2选自羟基、烷基、烷氧基、卤素;n选自1-3的自然数;r3为苯环上任一或任几取代的氢、烷基、烷氧基、卤素、氨基、氰基、羟基、硝基、芳基;r4选自烷基、烷氧基、芳基、苄基及其衍生物;r5选自氢、烷基、芳基、苄基及其衍生物。进一步地,本发明提供的含磷化合物的制备方法,还具有这样的特点:即、上述l1与l1‘以及l2与l2‘之间可以发生,取代反应、加成反应、消除反应或置换反应,从而形成l1与l1‘以及l2与l2‘之间的连接键。进一步地,本发明提供的含磷化合物的制备方法,还具有这样的特点:即、上述l1选自卤素、氨基、氰基、硫基、羟基、烷氧基;上述l1‘选自卤素、炔基、羧基、氨基、氰基、酯基、烷氧基、磺酰氨基基、烷氧基磺酰基;上述l2选自卤素、羧基、氨基、氰基、酯基、烷氧基、磺酰氨基基、烷氧基磺酰基;上述l2‘选自卤素、氨基、硫基、羟基、烷氧基。进一步地,本发明提供的含磷化合物的制备方法,还具有这样的特点:即、上述化合物a与化合物c的摩尔比为1:0.1-10;上述化合物c与化合物b的摩尔比为1:0.1-10。进一步地,本发明提供的含磷化合物的制备方法,还具有这样的特点:即、具体工艺步骤如下所示:步骤一、于磷酸二酯的衍生物中加入卤化试剂,于50-100℃的温度下反应1-5小时后,直接旋干获得底物1;在本步骤中,旨在将磷酸二酯的衍生物制作成具有活性反应基团的底物,如直接选用具有活性基团l1的化合物a的话,可省略该步骤一。在本发明中,磷酸二酯的衍生物为如下结构所示的化合物:r111、r112、r113选自芳基(如:苯基、萘基、喹啉基等芳香基团)、烷基(如:甲基、乙基、丙基、异丙基、环己基、环戊基等烷基基团);卤化试剂一般选用二氯亚砜、光气、溴等提供卤素的试剂;该反应优选在氮气、氩气、氦气等保护气的保护下进行。该反应中,每100mg的磷酸二酯的衍生物,添加的卤化试剂的量为0.5-4ml。步骤二、于0℃以下的温度下,于乙炔基苯甲酸甲酯的衍生物中,依次加入格氏试剂和底物1,反应0.1-2小时,用酸溶液淬灭反应,萃取有机相旋干,得到中间产物1;在本发明中,乙炔基苯甲酸甲酯的衍生物为如下结构所示的化合物:其中,r311选自任一或任几取代的卤素、硝基、芳基(如:苯基、萘基、喹啉基等芳香基团)、烷基(如:甲基、乙基、丙基、异丙基、环己基、环戊基等烷基基团)等;该乙炔基和甲酸甲酯基团可以为对位、邻位或间位;该乙炔基苯甲酸甲酯的衍生物与格氏试剂和底物1的质量比例为1:0.01-10:1:-10;该反应优选在氮气、氩气、氦气等保护气的保护下进行;该反应优选在醚类溶剂中进行;用于淬灭反应的酸优选为无机酸,该酸的浓度优选为0.5-1.5mol/l,该酸的用量优选为反应物总量的0.01-10倍;该萃取用的试剂优选为酯溶剂。步骤三、将中间产物1和脱酯基试剂,在100-150摄氏度的温度下反应2-5小时,加入酸溶液,萃取有机相旋干,得到中间产物2;该中间产物1和脱酯基试剂的质量比为1:0.5-3;该反应优选在氮气、氩气、氦气等保护气的保护下进行;用于淬灭反应的酸优选为无机酸,该酸的浓度优选为0.5-1.5mol/l,该酸的用量优选为反应物总量的0.01-10倍;该萃取用的试剂优选为酯溶剂。步骤四、于中间产物2中,依次加入l2为氨基的化合物c,碱性催化剂,在20-50℃的温度下,反应1-10小时,用酸溶液淬灭反应,萃取有机相旋干,得到含炔基的含磷化合物。该中间产物2、化合物c和碱性催化剂的摩尔比为1:1-5:5-20;用于淬灭反应的酸优选为无机酸,该酸的浓度优选为0.5-1.5mol/l,该酸的用量优选为反应物总量的0.01-10倍;该萃取用的试剂优选为酯溶剂。上述反应过程均适用于不提纯直接进行下一步骤的方案,其每步的产率约为50-95%,总产率约为50-80%。上述过程的具体方程式如下所示:进一步地,本发明提供的一种含磷化合物的制备方法,还具有这样的特点,即、上述含炔基的含磷化合物经还原反应、酯化反应、酰胺化反应、取代反应、加成反应中的一种或几种反应后,可得到相应的含磷产物。此外,本发明还提供了上述含磷化合物的应用,其特征在于:能作为一种免疫细胞迁徙抑制剂使用。另外,本发明还提供了上述含磷化合物的应用,其特征在于:包含有上述含磷化合物的眼药水,可用于缓解和治疗干眼症。该眼药水制剂的制备方法可以为任何常规制剂法。例如:将上述化合物加入到10-200倍重量的无菌生理盐水中,加入0.01-1倍的碱溶液,搅拌得到透明溶液;再向以上得到的溶液中加入缓冲溶液中直至溶液的ph在6.5-7.5之间;再向得到水溶液加入无菌生理盐水,直到总体积达到原体积的1.5-20倍。再向以上溶液通氮气,鼓泡0.5-10小时,所得溶液密封,放在5℃避光保存。分装到一次性使用的滴眼液袋中待用。其中,上述氢氧化钠和nah2po4饱和水溶液可以被其他缓冲溶液替代。本发明的作用和效果:在本发明中,合成了一类新的含磷化合物,为新型的免疫细胞迁徙抑制剂。其具有很好的亲水性,容易开发成眼药水,对免疫细胞迁徙有很强的抑制能力,可能会缓解大多数干眼症病人的症状。具体实施方式实施例1(2s)-2-(2,6-二氯-4-(2-(羟基(苯基)磷酰基)乙基)苯甲酰胺基)-3-(3-(甲磺酰基)苯基)丙酸具体反应方程式如下所示:步骤a:甲氧基苯基磷酰氯(化合物1.1)称取150mg苯基磷酸二甲酯,加入4ml二氯亚砜,氮气保护,在75度下反应2小时后直接旋干即可。步骤b:2,6-二氯-4-((苯基(甲氧基)磷酰基)乙炔基)苯甲酸甲酯(化合物1.2)将50mg的2,6-二氯-4-乙炔基苯甲酸甲酯溶于1ml四氢呋喃中,氮气保护,并在0度下加入0.2ml的2mol/l的异丙基氯化镁,搅拌20分钟;将化合物1.1溶于0.5ml的四氢呋喃并加入,反应20分钟。用1mol/l的稀盐酸溶液淬灭反应,用30ml乙酸乙酯分三次萃取,合并有机相,旋干,纯化得产物(50mg,60%)。lcmsesi(+)m/z:382.6(m+1).步骤c:2,6-二氯-4-((羟基(苯基)磷酰基)乙炔基)苯甲酸(化合物1.3)将化合物1.2(50mg)和碘化锂(50mg)溶于1ml吡啶中氮气保护,在120度搅拌3个小时,冷却旋干,加入10ml的1mol/l的稀盐酸溶液,用30ml的乙酸乙酯分3次萃取,合并有机相,旋干无需纯化。lcmsesi(+)m/z:354.6(m+1).步骤d:(2s)-2-(2,6-二氯-4-((羟基(苯基)磷酰基)乙炔基)苯甲酰胺基)-3-(3-(甲磺酰基)苯基)丙酸苄酯(化合物1.4)将化合物1.3溶于dmf中,加入(2s)-2-氨基-3-(3-(甲磺酰基)苯基)丙酸苄酯盐酸盐(2eq),后加入dipea(10eq),hatu(2.5eq)。在常温下搅拌4h,加入10ml稀盐酸溶液,用ea萃取3次,合并有机相,旋干。用反相制备纯化,45度减压旋干得目标产物40mg。lcmsesi(+)m/z:669.5(m+1).步骤e:(2s)-2-(2,6-二氯-4-(2-(羟基(苯基)磷酰基)乙基)苯甲酰胺基)-3-(3-(甲磺酰基)苯基)丙酸(化合物1)将化合物1.4溶于1ml的甲醇中,加入pd/c(10%,0.1eq),常压氢化1h,过滤,旋干,反相制备,冻干的产物10mg。lcmsesi(+)m/z:583.6(m+1);1h-nmr(400mhz,dmso)δ9.02(d,j=8hz,1h),7.86(s,1h),7.77(m,3h),7.66(m,1h),7.55(m,2h),7.51(m,2h),7.29(s,2h),4.75(m,1h),3.29(dd,j=15hz,j=4.4hz,1h),3.15(s,3h),3.03(dd,j=15.5hz,j=10.4hz,1h),2.70(m,2h),2.11(m,2h)。实施例2(2s)-2-(2,6-二氯-4-((羟基(3-羟基苯基)磷酰基)乙炔基)苯甲氨基)-3-(3-(甲磺酰基)苯基)丙酸具体反应方程式如下所示:步骤a:(间甲氧基苯基)乙氧基磷酰氯(化合物2.1)称取200mg间甲氧基苯基磷酸二乙酯,加入4ml二氯亚砜,氮气保护,在75度下反应12小时后直接旋干即可。步骤b:2,6-二氯-4-(((间甲氧基苯基)(乙氧基)磷酰基)乙炔基)苯甲酸甲酯(化合物2.2)将100mg的2,6-二氯-4-乙炔基苯甲酸甲酯溶于1.5ml四氢呋喃中,氮气保护,并在0度下加入0.7ml的2mol/l的异丙基氯化镁,搅拌20分钟;将化合物2.1溶于0.5ml的四氢呋喃并加入,反应20分钟。用1mol/l的稀盐酸溶液淬灭反应,用30ml乙酸乙酯分三次萃取,合并有机相,旋干,纯化得产物(100mg,60%)。lcmsesi(+)m/z:426.6(m+1).步骤c:2,6-二氯-4-((羟基(间甲氧苯基)磷酰基)乙炔基)苯甲酸(化合物2.3)将化合物2.2(100mg)和碘化锂(100mg)溶于2ml吡啶中氮气保护,在120度搅拌3个小时,冷却旋干,加入10ml的1mol/l的稀盐酸溶液,用30ml的乙酸乙酯分3次萃取,合并有机相,旋干无需纯化。lcmsesi(+)m/z:384.6(m+1).步骤d:(2s)-2-(2,6-二氯-4-((羟基(间甲氧苯基)磷酰基)乙炔基)苯甲酰胺基)-3-(3-(甲磺酰基)苯基)丙酸苄酯(化合物2.4)将化合物2.3溶于dmf中,加入(2s)-2-氨基-3-(3-(甲磺酰基)苯基)丙酸苄酯盐酸盐(2eq),后加入dipea(10eq),hatu(2.5eq)。在常温下搅拌4h,加入10ml稀盐酸溶液,用ea萃取3次,合并有机相,旋干。用反相制备纯化,45度减压旋干得目标产物80mg。lcmsesi(+)m/z:699.5(m+1).步骤e:(2s)-2-(2,6-二氯-4-((羟基(3-羟基苯基)磷酰基)乙炔基)苯甲氨基)-3-(3-(甲磺酰基)苯基)丙酸(化合物2)将化合物2.4(40mg)溶于1ml的dcm中,氮气保护,在-40度下加入0.2ml三溴化硼(1mol/l),然后在0度下搅拌30分钟。在-40度下加入水淬灭,用30mlea萃取,用无水硫酸钠干燥,旋干,纯化得15mg产物。lcmsesi(+)m/z:595.5(m+1).1h-nmr(400mhz,dmso),δ9.16(d,j=8.4hz,1h),7.86(s,1h),7.76(d,j=7.6hz,1h),7.67(d,j=7.6hz,1h),7.56(dd,j=8hz,j=7.6hz,1h),7.44(s,2h),7.28(m,1h),7.16(m,2h),6.77(m,1h),4.78(m,1h),3.29(m,1h),3.14(s,3h),3.01(dd,j=14,j=10.4,1h).实施例3(2s)-2-(2,6-二氯-4-(2-(羟基(间羟基苯基)磷酰基)乙基)苯甲酰胺基)-3-(3-(甲磺酰基)苯基)丙酸具体反应方程式如下所示:将化合物2.5(10mg)溶于1ml甲醇,加入1mgpd/c(10%),常压氢化1.5h后过滤。旋干纯化得3mg产物。lcmsesi(+)m/z:599.6(m+1).1h-nmr(400mhz,dmso)δ9.72(s,1h),9.04(d,j=8.4hz,1h),7.86(s,1h),7.77(d,j=8hz,1h,),7.67(d,j=7.6hz,1h),7.56(t,j=7.6hz,1h),7.33(m,1h),7.28(s,2h),7.15(m,2h),6.93(m,1h),4.75(m,1h),3.30(m,1h),3.15(s,3h),3.01(dd,j=10.8hz,j=9.6hz,1h),2.69(m,2h),2.04(m,2h).实施例4(2s)-2-(2,6-二氯-4-(2-(甲氧基(苯基)磷酰基)乙基)苯甲酰胺基)-3-(3-(甲磺酰基)苯基)丙酸具体反应方程式如下所示:步骤a:(2s)-2-(2,6-二氯-4-((甲氧基(苯基)磷酰基)乙炔基)苯甲酰胺基)-3-(3-(甲磺酰基)苯基)丙酸苄酯(化合物4.1)将化合物1.4(20mg)溶于0.5ml甲醇中,加入三甲基硅基重氮甲烷(3eq),在常温下搅拌30分钟。加入适量的乙酸淬灭,旋干,加入5ml的稀盐酸溶液,用ea萃取3次,合并有机相旋干即可。lcmsesi(+)m/z:683.6(m+1).步骤b:(2s)-2-(2,6-二氯-4-(2-(甲氧基(苯基)磷酰基)乙基)苯甲酰胺基)-3-(3-(甲磺酰基)苯基)丙酸(化合物4)将化合物4.1溶于甲醇(1ml)中,加入1mgpd/c(10%),常压氢化1h,过滤旋干,纯化得目标产物。lcmsesi(+)m/z:597.6(m+1).1h-nmr(400mhz,dmso)δ9.03(d,j=8.4hz,1h),7.86(s,1h),7.75(m,3h),7.66(m,2h),7.56(m,3h),7.32(s,2h),4.75(m,1h),3.51(d,j=11.2hz,3h),3.28(dd,j=14.4hz,j=3.6hz,1h),3.15(s,3h),3.01(dd,j=14.4hz,j=10.8hz,1h),2.72(m,2h),2.34(m,2h).实施例5(2s)-2-(2,6-二氯-4-(甲氧基(苯基)磷酰基)乙炔基)苯甲酰胺基)-3-(3-(甲磺酰基)苯基)丙酸具体反应方程式如下所示:将化合物4.1溶于dcm中,在-40度下加入1mol/l的三溴化硼(10eq),在0度下搅拌30分钟后在-40度下加水淬灭反应。用ea萃取3次,合并有机相,干燥旋干,纯化得目标产物。lcmsesi(+)m/z:593.6(m+1).1h-nmr(400mhz,dmso)δ9.21(d,j=8.4hz,1h),7.88(m,5h),7.77(m,1h),7.72(m,1h),7.67(m,1h),7.63(m,2h),7.57(m,1h),3.83(d,j=12.4hz,3h),3.30(m,1h),3.15(s,3h),3.03(dd,j=13.6hz,j=10.4hz,1h).实施例6(2s)-2-(2,6-二氯-4-(2-(乙氧基(间羟基苯基)磷酰基)乙基)苯甲酰胺基)-3-(3-(甲磺酰基)苯基)丙酸具体反应方程式如下所示:步骤a:2,6-二氯-4-(((间羟基苯基)(乙氧基)磷酰基)乙炔基)苯甲酸(化合物6.1)将化合物2.2溶于dcm中在低温下加入1mol/l的三溴化硼(10eq),在0度下搅拌30分钟,后在-40度下淬灭反应,ea萃取3次,合并有机相旋干即可。lcmsesi(+)m/z:398.6(m+1).步骤b:(2s)-2-(2,6-二氯-4-((乙氧基(间羟基苯基)磷酰基)乙炔基)苯甲酰胺基)-3-(3-(甲磺酰基)苯基)丙酸苄酯(化合物6.2)将化合物6.1溶于dmf中,加入(2s)-2-氨基-3-(3-(甲磺酰基)苯基)丙酸苄酯盐酸盐(2eq),后加入dipea(10eq),hatu(2.5eq)。在常温下搅拌4h,加入10ml稀盐酸溶液,用ea萃取3次,合并有机相,旋干。用反相制备纯化,45度减压旋干得目标产物。lcmsesi(+)m/z:713.5(m+1).步骤c:(2s)-2-(2,6-二氯-4-(2-(乙氧基(间羟基苯基)磷酰基)乙基)苯甲酰胺基)-3-(3-(甲磺酰基)苯基)丙酸(化合物6)将化合物6.2溶于1ml的甲醇中,加入pd/c(10%,0.1eq),常压氢化1h,过滤,旋干,纯化得产物。lcmsesi(+)m/z:627.5(m+1).1h-nmr(400mhz,dmso)δ9.85(s,1h),9.05(d,j=5.6hz,1h),7.86(s,1h),7.76(d,j=4.8hz,1h),7.66(d,j=4.8hz,1h),7.57(dd,j=5.2hz,j=5.2hz,1h),7.35(m,1h),7.33(s,2h),7.16(m,2h),6.98(m,1h),4.75(m,1h),3.91(m,1h),3.78(m,1h),3.30(m,1h),3.15(s,3h),3.01(m,1h),2.70(m,2h),2.25(m,2h,)1.19(t,j=4.8hz,3h).实施例7(2s)-2-(2,6-二氯-4-((甲氧基(3-羟基苯基)磷酰基)乙炔基)苯甲氨基)-3-(3-(甲磺酰基)苯基)丙酸具体反应方程式如下所示:步骤a:(2s)-2-(2,6-二氯-4-((甲氧基(3-甲氧基苯基)磷酰基)乙炔基)苯甲氨基)-3-(3-(甲磺酰基)苯基)丙酸苄酯(化合物7.1)将化合物2.4(40mg)溶于1ml甲醇中,加入三甲基硅基重氮甲烷(3eq),在常温下搅拌30分钟。加入适量的乙酸淬灭,旋干,加入5ml的稀盐酸溶液,用ea萃取3次,合并有机相旋干即可。lcmsesi(+)m/z:713.5(m+1).步骤b:(2s)-2-(2,6-二氯-4-((甲氧基(3-羟基苯基)磷酰基)乙炔基)苯甲氨基)-3-(3-(甲磺酰基)苯基)丙酸(化合物7)将化合物7.1(30mg)溶于dcm中,在-40度下加入1mol/l的三溴化硼(10eq),在0度下搅拌30分钟后在-40度下加水淬灭反应。用ea萃取3次,合并有机相,干燥旋干,纯化得目标产物15mg。lcmsesi(+)m/z:609.5(m+1).1h-nmr(400mhz,dmso)δ10.05(s,1h),7.85(s,3h),7.76(d,j=8hz,1h),7.67(d,j=7.6hz,1h),7.56(dd,j=8hz,j=7.6hz,1h),7.42(m,1h),7.29(m,1h),7.25(m,1h),7.07(m,1h),4.75(m,1h),3.80(d,j=12.4hz,3h),3.30(m,1h),3.15(s,3h),3.04(m,1h).实施例8(2s)-2-(2,6-二氯-4-(2-(甲氧基(3-羟基苯基)磷酰基)乙基)苯甲氨基)-3-(3-(甲磺酰基)苯基)丙酸具体反应方程式如下所示:将化合物7.2(10mg)溶于甲醇(1ml)中,加入1mgpd/c(10%),常压氢化1h,过滤旋干,纯化得目标产物4mg。lcmsesi(+)m/z:613.6(m+1).1h-nmr(400mhz,dmso)δ9.87(s,1h),9.04(d,j=8.4hz,1h),7.86(s,1h),7.77(d,j=8hz,1h),7.67(d,j=7.6hz,1h),7.56(dd,j=8hz,j=7.6hz,1h),7.37(m,1h),7.34(s,2h),7.15(m,2h),7.00(m,1h),4.75(m,1h),3.50(d,j=11.6hz,3h),3.27(m,1h),3.15(s,3h),3.01(m,1h),2.72(m,2h),2.30(m,2h).实施例9(2s)-2-(2,6-二氯-4-(甲基(苯基)磷酰基)乙炔基)苯甲酰胺基)-3-(3-(甲磺酰基)苯基)丙酸具体反应方程式如下所示:步骤a:甲基苯基磷酰氯(化合物9.1)称取500mg甲基苯基磷酸甲酯,加入10ml二氯亚砜,氮气保护,在75度下反应2小时后直接旋干即可。步骤b:2,6-二氯-4-((苯基(甲基)磷酰基)乙炔基)苯甲酸甲酯(化合物9.2)将200mg的2,6-二氯-4-乙炔基苯甲酸甲酯溶于2ml四氢呋喃中,氮气保护,并在0度下加入0.66ml的2mol/l的异丙基氯化镁,搅拌20分钟;将化合物9.1溶于0.5ml的四氢呋喃并加入,反应20分钟。用1mol/l的稀盐酸溶液淬灭反应,用30ml乙酸乙酯分三次萃取,合并有机相,旋干,纯化得产物(200mg,60%)。lcmsesi(+)m/z:366.6(m+1).步骤c:2,6-二氯-4-((甲基(苯基)磷酰基)乙炔基)苯甲酸(化合物9.3)将化合物9.2(200mg)和碘化锂(200mg)溶于2ml吡啶中氮气保护,在120度搅拌3个小时,冷却旋干,加入10ml的1mol/l的稀盐酸溶液,用40ml的乙酸乙酯分3次萃取,合并有机相,旋干无需纯化(150mg)。lcmsesi(+)m/z:352.6(m+1).步骤d:(2s)-2-(2,6-二氯-4-((甲基(苯基)磷酰基)乙炔基)苯甲酰胺基)-3-(3-(甲磺酰基)苯基)丙酸苄酯(化合物9.4)将化合物9.3溶于dmf中,加入(2s)-2-氨基-3-(3-(甲磺酰基)苯基)丙酸苄酯盐酸盐(2eq),后加入dipea(10eq),hatu(2.5eq)。在常温下搅拌4h,加入10ml稀盐酸溶液,用ea萃取3次,合并有机相,旋干。纯化,得目标产物150mg。lcmsesi(+)m/z:667.5(m+1).步骤e:(2s)-2-(2,6-二氯-4-((甲基(苯基)磷酰基)乙炔基)苯甲酰胺基)-3-(3-(甲磺酰基)苯基)丙酸(化合物9)将化合物9.4(20mg)溶于dcm中在低温下加入1mol/l的三溴化硼(10eq),在0度下搅拌30分钟,后在-40度下淬灭反应,ea萃取3次,合并有机相旋干纯化的目标产物10mg。lcmsesi(+)m/z:577.6(m+1).1h-nmr(400mhz,dmso)δ9.21(d,j=8.4hz,1h),7.91(m,2h),7.86(s,1h),7.80(s,2h),7.77(d,j=4.4hz,1h),7.67(m,2h),7.62(m,2h),7.57(m,1h),4.80(m,1h),3.29(m,1h),3.15(s,3h),3.03(m,1h),2.02(d,j=14.8hz,3h),2.11(m,2h).实施例10(2s)-2-(2,6-二氯-4-(2-(甲基(苯基)磷酰基)乙基)苯甲酰胺基)-3-(3-(甲磺酰基)苯基)丙酸具体反应方程式如下所示:将化合物9.4(10mg)溶于甲醇(1ml)中,加入1mgpd/c(10%),常压氢化1h,过滤旋干,纯化得目标产物3mg。lcmsesi(+)m/z:581.6(m+1).1h-nmr(400mhz,dmso)δ9.04(d,j=8.4hz,1h),7.86(s,1h),7.78(m,3h),7.67(d,j=7.6hz,1h),7.56(m,4h),7.31(s,2h),4.75(m,1h),3.27(m,1h),3.15(s,3h),3.01(dd,j=14hz,10.4hz,1h),2.79(m,2h),2.29(m,2h),1.67(d,j=13.4hz,3h.)。实施例11(2s)-2-(2,6-二氯-4-((甲基(3-羟基苯基)磷酰基)乙炔基)苯甲氨基)-3-(3-(甲磺酰基)苯基)丙酸具体反应方程式如下所示:步骤a:(间甲氧基苯基)甲基磷酸乙酯(化合物11.1)在化合物间甲氧基磷酸二乙酯(2g)加入二氯亚砜(10ml),在75度下搅拌过夜,旋干后在0度下加入3mol/l的甲基氯化镁(5ml),搅拌30分钟后在0度下用稀盐酸溶液淬灭反应,用ea萃取,干燥旋干,纯化得目标产物(1.2g,68%)。lcmsesi(+)m/z:214.6(m+1).步骤b:(间甲氧基苯基)甲基磷酰氯(化合物11.2)在化合物11.1(150mg)中加入二氯亚砜,在70度下搅拌3个小时,旋干即得目标产物。步骤c:2,6-二氯-4-(((间甲氧基苯基)(甲基)磷酰基)乙炔基)苯甲酸甲酯(化合物11.3)将100mg的2,6-二氯-4-乙炔基苯甲酸甲酯溶于1.5ml四氢呋喃中,氮气保护,并在0度下加入0.7ml的2mol/l的异丙基氯化镁,搅拌20分钟;将化合物11.2溶于0.5ml的四氢呋喃并加入,反应20分钟。用1mol/l的稀盐酸溶液淬灭反应,用30ml乙酸乙酯分三次萃取,合并有机相,旋干,纯化得产物(90mg,60%)。lcmsesi(+)m/z:396.6(m+1).步骤d:2,6-二氯-4-((甲基(间羟基苯基)磷酰基)乙炔基)苯甲酸(化合物11.4)将化合物11.3(90mg)溶于2ml的dcm中,氮气保护,在-40度下加入0.4ml三溴化硼(1mol/l),然后在0度下搅拌30分钟。在-40度下加入水淬灭,用30mlea萃取,用无水硫酸钠干燥,旋干,得80mg目标产物esi(+)m/z:368.6(m+1).步骤e:(2s)-2-(2,6-二氯-4-((甲基(3-羟基苯基)磷酰基)乙炔基)苯甲氨基)-3-(3-(甲磺酰基)苯基)丙酸苄酯(化合物11.5)化合物11.4溶于dmf中,加入(2s)-2-氨基-3-(3-(甲磺酰基)苯基)丙酸苄酯盐酸盐(2eq),后加入dipea(10eq),hatu(2.5eq)。在常温下搅拌4h,加入10ml稀盐酸溶液,用ea萃取3次,合并有机相,旋干。用反相制备纯化,45度减压旋干得目标产物70mg。lcmsesi(+)m/z:683.5(m+1).步骤f:(2s)-2-(2,6-二氯-4-((甲基(3-羟基苯基)磷酰基)乙炔基)苯甲氨基)-3-(3-(甲磺酰基)苯基)丙酸(化合物11)将化合物11.5(20mg)溶于1ml的dcm中,氮气保护,在-40度下加入0.5ml三溴化硼(1mol/l),然后在0度下搅拌30分钟。在-40度下加入水淬灭,用30mlea萃取,用无水硫酸钠干燥,旋干,纯化得8mg产物。lcmsesi(+)m/z:593.5(m+1).1h-nmr(400mhz,dmso),δ9.98(s,1h),9.22(d,j=8.4hz,1h),7.86(s,1h),7.79(s,2h),7.77(m,1h),7.67(d,j=8hz,1h),7.58(dd,j=8hz,j=7.6hz,1h),7.40(m,1h),7.31(m,1h),7.26(m,1h),7.02(m,1h),4.80(m,1h),3.32(m,1h),3.15(s,3h),3.03(dd,j=14,j=10.8,1h),1.97(d,j=14.8hz,3h).实施例12(2s)-2-(2,6-二氯-4-((甲氧基(3-甲氧基苯基)磷酰基)乙炔基)苯甲氨基)-3-(3-(甲磺酰基)苯基)丙酸具体反应方程式如下所示:将化合物7.1(10mg)溶于1ml的dcm中,氮气保护,在-40度下加入0.5ml三溴化硼(1mol/l),搅拌30分钟后加入水淬灭,用30mlea萃取,用无水硫酸钠干燥,旋干,纯化得3mg产物。lcmsesi(+)m/z:623.5(m+1).1h-nmr(400mhz,dmso)δ9.20(d,j=7.6hz,1h),7.87(s,2h),7.86(s,1h),7.77(d,j=8hz,1h),7.67(d,j=7.6hz,1h),7.55(m,2h),7.44(m,1h),7.30(m,2h),4.80(m,1h),3.84(d,j=12.4hz,3h),3.83(s,3h),3.30(m,1h),3.15(s,3h),3.03(dd,j=14,j=9.4,1h).实施例13(2s)-2-(2,6-二氯-4-((羟基(3-甲氧基苯基)磷酰基)乙炔基)苯甲氨基)-3-(3-(甲磺酰基)苯基)丙酸具体反应方程式如下所示:将化合物7.1(10mg)溶于1ml的thf中,取氢氧化锂(20mg)溶于0.5ml水中,常温搅拌5分钟。浓盐酸调ph=1旋干,纯化得4mg产物。lcmsesi(+)m/z:609.6(m+1).1h-nmr(400mhz,dmso)δ9.20(d,j=8.4hz,1h),7.85(s,1h),7.77(d,j=8hz,1h),7.66(d,j=9.4hz,1h),7.65(s,2h),7.57(dd,j=8hz,j=7.6hz,1h),7.43(m,1h),7.38(m,1h),7.28(m,1h),7.14(m,1h),4.79(m,1h),3.30(dd,j=14.8hz,j=4.8hz,1h),3.15(s,3h),3.03(dd,j=14.4,j=10.8,1h).实施例14(2s)-2-(2,6-二氯-4-(2-(甲基(3-羟基苯基)磷酰基)乙基)苯甲氨基)-3-(3-(甲磺酰基)苯基)丙酸将化合物11.5(10mg)溶于甲醇(1ml)中,加入1mgpd/c(10%),常压氢化1h,过滤旋干,纯化得目标产物3mg。lcmsesi(+)m/z:597.6(m+1).1h-nmr(400mhz,dmso)δ9.79(s,1h),9.05(d,j=8hz,1h),7.86(s,1h),7.77(d,j=8hz,1h),7.67(d,j=8hz,1h),7.56(t,j=7.6hz,1h),7.34(s,2h),7.33(m,1h),7.17(m,2h),6.93(d,j=7.6hz,1h),4.75(m,1h),3.29(dd,j=14hz,j=4.4hz,1h),3.15(s,3h),3.00(dd,j=14hz,10.4hz,1h),2.78(m,2h),2.23(m,2h),1.97(d,j=13.2hz,3h)。实施例15(2s)-2-(2,6-二氯-4-((甲基(4-羟基苯基)磷酰基)乙炔基)苯甲氨基)-3-(3-(甲磺酰基)苯基)丙酸采用实施例11中完全相同的步骤,将“间甲氧基磷酸二乙酯”替换为“对甲氧基磷酸二乙酯”制备出实施例15。lcmsesi(+)m/z:594.1(m+1).1h-nmr(400mhz,dmso)δ10.39(s,1h),9.21(d,j=8hz,1h),7.86(s,1h),7.77(s,2h),7.71-7.66(m,3h),7.57(t,j=8hz,1h),6.94(d,j=7.6hz,2h),4.79(m,1h),3.29(dd,j=14hz,j=4.4hz,1h),3.15(s,3h),3.02(dd,j=14hz,10.4hz,1h),1.94(d,j=13.2hz,3h)。实施例16(2s)-2-(2,6-二氯-4-((羟基(苯基)磷酰基)乙炔基)苯甲酰胺基)-3-(3-(甲磺酰基)苯基)丙酸苄酯采用实施例13中完全相同的步骤,将“化合物7.1”替换为“化合物1.4”制备出实施例16。lcmsesi(+)m/z:580.1(m+1).1h-nmr(400mhz,dmso)δ9.16(d,j=8hz,1h),7.84(s,1h),7.81-7.76(m,3h),7.66(d,j=8hz,1h),7.59(s,2h),7.57-7.47(m,5h),4.80(m,1h),3.29(dd,j=14hz,j=4.4hz,1h),3.14(s,3h),3.02(dd,j=14hz,10.4hz,1h)实施例17(2s)-2-(2,6-二氯-4-(2-(甲基(3-羟基苯基)磷酰基)乙基)苯甲酰氨基)-3-(2-噻吩酰胺基)丙酸具体反应方程式如下所示:步骤a:3-(2-噻吩酰胺基)-n-[(1,1-二甲基乙氧基)羰基]-l-丙氨酸甲酯(化合物17.1)将((s)-3-氨基-2-((1,1-二甲基乙氧基)酰胺基)丙酸甲酯,hcl盐(2.55g,10mmol)溶解在水(30ml)中,放进冰浴并搅拌。向所得溶液加入thf(20ml),naoh(1.0m水溶液,25ml),2-thiophenecarbonylchloride(11mmol)。反应搅拌10分钟后,向其中加入etoac(100ml),水层分离掉,有机层用水(25ml),饱和nacl水溶液洗,然后用无水mgso4干燥,过滤,旋干得到纯的化合物17.1(3.3g,100%)。lcmsesi(+)m/z:329(m+1).步骤b:(s)-2-氨基-3-(2-噻吩酰胺基)丙酸甲酯(化合物17.2)将化合物17.1(1.0g)溶于dcm(20ml)中,加入hcl-dioxane溶液(4.0m,5ml),反应搅拌2h,旋干,得到的产物(盐酸盐)直接用于下一步反应。lcmsesi(+)m/z:229(m+1).步骤c:2,6-二氯-4-(((间甲氧基苯基)(乙氧基)磷酰基)乙基)苯甲酸甲酯(化合物17.3)将化合物2.2(2.0g)溶于甲醇(20ml)中,加入100mgpd/c(5%),常压氢化2h,过滤旋干,纯化得目标产物2.0g.lcmsesi(+)m/z:401.1(m+1)步骤d:2,6-二氯-4-(((间羟基苯基)(乙氧基)磷酰基)乙基)苯甲酸甲酯(化合物17.4)将化合物11.3(500mg)溶于10ml的dcm中,氮气保护,在-40度下加入3.0ml三溴化硼(1mol/l),然后在0度下搅拌30分钟。在-40度下加入水淬灭,用30mlea萃取3次,用无水硫酸钠干燥,旋干,得450mg目标产物esi(+)m/z:373(m+1).步骤e:(2s)-2-(2,6-二氯-4-(2-(甲基(3-羟基苯基)磷酰基)乙基)苯甲酰氨基)-3-(2-噻吩酰胺基)丙酸甲酯(化合物17.5)化合物17.4(100mg)溶于dmf(3ml)中,加入化合物17.4(2eq),后加入dipea(10eq),hatu(2.5eq)。在常温下搅拌4h,加入10ml稀盐酸溶液,用ea萃取3次,合并有机相,旋干。用反相制备纯化,45度减压旋干得目标产物70mg。lcmsesi(+)m/z:583(m+1).步骤f:(2s)-2-(2,6-二氯-4-(2-(甲基(3-羟基苯基)磷酰基)乙基)苯甲酰氨基)-3-(2-噻吩酰胺基)丙酸(化合物17)将化合物17.5(10mg)溶于1ml的thf中,取氢氧化锂(20mg)溶于0.5ml水中,混合,常温搅拌5分钟。浓盐酸调ph=1旋干,高压液相纯化得5.2mg产物。lcmsesi(+)m/z:569(m+1)1hnmr(400mhz,cd3od):δ7.69-7.67(m,2h),7.42-7.37(m,1h),7.26(s,2h),7.23-7.12(m,3h),7.03(m,j=8.4hz,1h),4.98(m,1h),3.88-3.84(m,2h),2.93-2.86(m,1h),2.77-2.73(m,1h),2.42-2.32(m,2h),1.78(m,j=13.2hz,3h)。实施例18(2s)-2-(2,6-二氯-4-(2-(甲基(3-羟基苯基)磷酰基)乙基)苯甲酰氨基)-3-(1-(甲磺酰胺)-1,2,5,6-四氢吡啶-3-基)丙酸具体反应方程式如下所示:步骤a:(s)-2-((叔丁基氧羰基)氨基)-3-(1-甲基-1,2,5,6-四氢吡啶-3-基)丙酸甲酯)(化合物18.1)化合物:boc-3-(3-吡啶基)-l-丙氨酸甲酯(2.8g,10mmol)溶解在乙醇(40ml)中,向溶液中加入甲基碘(2ml),反应在40度搅拌,直到反应结束。反应温度降低到0度,向溶液中分批加入硼氢化钠(2g)。反应搅拌1小时后,向反应中加入5ml丙酮,加入etoac(100ml)。所得有机溶液用饱和nh4cl水溶液(20ml),水(30ml),饱和食盐水溶液洗。用无水mgso4干燥,过滤,旋干。所得粗产品用硅胶柱纯化(0-10%的meoh/dcm)得到化合物18.1.步骤b:(s)-2-((叔丁基氧羰基)氨基)-3-(1-(甲磺酰胺)-1,2,5,6-四氢吡啶-3-基)丙酸甲酯(化合物18.2)化合物18.1(1.5g,5mmol)溶解在dce(20ml)中,加入1-氯乙基氯甲酸酯(7.5mmol),反应加热到40度2小时,旋干。加入干燥的甲醇(20ml),反应回流1小时,再旋干。向得到的中间产物中加入dcm(20ml),tea(15mmol),降温到0度,向反应中加入甲磺酰氯(7.5mmol)。搅拌1小时候,反应用etoa(80ml)稀释,水洗两次,干燥,过滤,旋干得到化合物18.2步骤c:(s)-2-氨基-3-(1-(甲磺酰胺)-1,2,5,6-四氢吡啶-3-基)丙酸甲酯(化合物18.3)将化合物18.2(100mg)溶于dcm(5ml)中,加入hcl-dioxane溶液(4.0m,1ml),反应搅拌2h,旋干,得到的产物(盐酸盐)直接用于下一步反应。lcmsesi(+)m/z:229(m+1).步骤d:(2s)-2-(2,6-二氯-4-(2-(甲基(3-羟基苯基)磷酰基)乙基)苯甲酰氨基)-3-(1-(甲磺酰胺)-1,2,5,6-四氢吡啶-3-基)丙酸(化合物18)从化合物17.4制备化合物17的同样的方法被用来从17.4制备化合物18,其中化合物17.3被化合物18.2置换掉。实施例19(2s)-3-((r)-n’-氰基-3-羟基四氫吡咯-1-甲脒基)-2-(2,6-二氯-4-(2-(甲基(3-羟基苯基)磷酰基)乙基)苯甲酰氨基)丙酸具体反应方程式如下所示:步骤a:1-氰基-9,9-二甲基-2-(甲硫基)-7-羰基-8-氧基-1,3,6-三氮癸-1-烯-5-羧酸甲酯(化合物19.1)将3-氨基-n-叔丁氧羰基-l-丙氨酸甲酯,hclsalt(2.55g,10mmol)溶解在乙醇(30ml)中,加入n-氰亚胺基-s,s-二硫代碳酸二甲酯(10mmol),dipea(3ml)。反应搅拌6小时后,向其中加入etoac(100ml),用水(25ml),饱和nacl水溶液洗,然后用无水mgso4干燥,过滤,旋干得到纯的化合物18.1,直接用于下一步反应。步骤b:1-氰基-2-((r)-3-羟基四氫吡咯-1-基)-9,9-二甲基-7-羰基-8-氧基-1,3,6-三氮癸-1-烯-5-羧酸甲酯。所得的化合物19.1溶解在乙腈(20ml)中,加入(r)-pyrrolidin-3-ol(20mmol),硝酸银(20mmol)。反应回流8小时,用硅胶过滤,旋干。粗产品用硅胶柱分离,用100/5/1的dcm/meoh/tea分离得到产品。步骤c:(2s)-2-氨基-3-((r)-n’-氰基-3-羟基四氫吡咯-1-甲脒基)苯甲酰氨基)丙酸(化合物19.3)将化合物19.2(100mg)溶于dcm(5ml)中,加入hcl-dioxane溶液(4.0m,1ml),反应搅拌2h,旋干,得到的产物(盐酸盐)直接用于下一步反应。步骤d:(2s)-3-((r)-n’-氰基-3-羟基四氫吡咯-1-甲脒基)-2-(2,6-二氯-4-(2-(甲基(3-羟基苯基)磷酰基)乙基)苯甲酰氨基)丙酸(化合物19)从化合物17.4制备化合物17的同样的方法被用来从17.4制备化合物19,其中化合物17.3被化合物19.3置换掉。lc-ms:m/z595.7(m+h)+.1hnmr(400mhz,cd3od):δ7.40-7.35(m,1h),7.28-7.27(m,2h),7.21-7.12(m,2h),7.05-7.02(m,1h),4.80-4.86(m,1h),4.60-4.29(m,4h),3.45-3.41(m,1h),3.27-3.24(m,1h),3.15-2.71(m,3h),2.44-2.32(m,2h),2.05-1.74(m,5h)。实施例20(2s)-2-(2,6-二氯-4-(乙基(3-羟基苯基)磷酰基)乙炔基)苯甲酰胺基)-3-(3-(甲磺酰基)苯基)丙酸具体反应方程式如下所示:步骤a:乙基(3-甲氧基苯基)磷酸甲酯(化合物20.1)(3-甲氧基苯基)磷酸二甲酯(2.16g,10mmol)溶解在无水thf(30ml)中,溶液冷却到-78度,加入etmgbr(1.0m,10.5ml)。反应渐渐升温到室温(升温过程约2小时),反应用饱和nh4cl水溶液淬灭,加入etoac(100ml),水洗一次,加无水mgso4干燥,过滤,旋干。粗产物硅胶柱分离得到目标产物。步骤b:乙基(3-甲氧基苯基)磷酰氯(化合物20.2)化合物20.1溶解在dce(10ml)中,加入草酰氯(5ml),所得溶液回流5小时,反应溶液旋干,得到目标产物,直接使用在下一步。步骤c:(2s)-2-(2,6-二氯-4-(乙基(3-羟基苯基)磷酰基)乙炔基)苯甲酰胺基)-3-(3-(甲磺酰基)苯基)丙酸(化合物20)制备化合物2的完全相同的步骤用了制备化合物20,其中化合物20.2用来取代化合物2.1。实施例21(2s)-2-(2,6-二氯-4-(乙基(3-羟基苯基)磷酰基)乙基)苯甲酰胺基)-3-(3-(甲磺酰基)苯基)丙酸制备实施例3的完全相同的方法用来制备实施例21,其中化合物20取代化合物2.lcmsesi(+)m/z:612.1(m+1).1h-nmr(400mhz,dmso)δ9.75(s,1h),9.03(d,j=8hz,1h),7.85(s,1h),7.78(d,j=8hz,1h),7.67(d,j=8hz,1h),7.56(t,j=7.6hz,1h),7.43(m,1h),7.41(s,2h),7.16-7.12(m,2h),6.93(d,j=7.6hz,1h),4.75(m,1h),3.29(dd,j=14hz,j=4.4hz,1h),3.15(s,3h),3.00(dd,j=14hz,10.4hz,1h),2.78-2.50(m,2h),2.26(m,2h),1.86(m,2h),0.93(dt,j=13.0hz,7.2hz,3h)。实施例22(2s)-2-(2,6-二氯-4-(环丙基(3-羟基苯基)磷酰基)乙基)苯甲酰胺基)-3-(3-(甲磺酰基)苯基)丙酸制备实施例21的完全相同的方法用来制备实施例22,其中环丙基格氏试剂取代乙基格氏试剂。lcmsesi(+)m/z:624.1(m+1).1h-nmr(400mhz,dmso)δ9.80(s,1h),9.03(d,j=8hz,1h),7.85(s,1h),7.78(d,j=8hz,1h),7.67(d,j=8hz,1h),7.56(t,j=7.6hz,1h),7.41(s,2h),7.40(m,1h),7.18-7.23(m,2h),6.93(d,j=7.6hz,1h),4.75(m,1h),3.29(dd,j=14hz,j=4.4hz,1h),3.15(s,3h),3.02(dd,j=14hz,10.4hz,1h),2.80(m,1h),2.60(m,1h),2.26(m,2h),1.22(m,1h),0.82(m,2h),0.71(m,1h),0.52(m,1h)。实施例23(2s)-2-(2,6-二氯-4-(丁基(3-羟基苯基)磷酰基)乙基)苯甲酰胺基)-3-(3-(甲磺酰基)苯基)丙酸制备实施例21的完全相同的方法用来制备实施例23,其中丁基格氏试剂取代乙基格氏试剂。lcmsesi(+)m/z:630.1(m+1).1h-nmr(400mhz,dmso)δ9.75(s,1h),9.03(d,j=8hz,1h),7.85(s,1h),7.78(d,j=8hz,1h),7.67(d,j=8hz,1h),7.56(t,j=7.6hz,1h),7.42(m,1h),7.41(s,2h),7.18-7.12(m,2h),6.93(d,j=7.6hz,1h),4.75(m,1h),3.29(dd,j=14hz,j=4.4hz,1h),3.15(s,3h),3.00(dd,j=14hz,10.4hz,1h),2.78(m,1h),2.52(m,1h),2.26(m,2h),1.83(m,2h),1.45(m,2h),1.24-1.20(m,3h),0.80(t,j=7.2hz,3h)。实施例24(2s)-2-(2,6-二氯-4-((甲基(苯并呋喃-6-基)磷酰基)乙炔基)苯甲氨基)-3-(3-(甲磺酰基)苯基)丙酸具体反应方程式如下所示:步骤a:苯并呋喃-6-基磷酰酸二乙酯(化合物24.1)化合物6-溴苯并呋喃(2.0g,10mmol)溶解亚磷酸二乙酯(6ml),加入pd(oac)2(200mg),tea(1ml)。反应在微波反应器上加热到200度,30分钟。加入etoac(80ml),水洗两次,干燥,过滤,旋干。粗产物用硅胶柱分离,0-10%的meoh/dcm为流动相,得到目标产物24.1。步骤b:甲基(苯并呋喃-6-基)磷酰酸乙酯(化合物24.2)化合物24.1(1.27g)溶解在thf(20ml)中溶液冷却到-78度,加入memgbr(1.0m,5ml)。反应渐渐升温到室温(升温过程约2小时),反应用饱和nh4cl水溶液淬灭,加入etoac(100ml),水洗一次,加无水mgso4干燥,过滤,旋干。粗产物硅胶柱分离得到目标产物。步骤c:甲基(苯并呋喃-6-基)磷酰氯(化合物24.3)化合物24.2溶解在二氯亚砜中(5ml),所得溶液回流5小时,反应溶液旋干,得到目标产物,直接使用在下一步。步骤d:(2s)-2-(2,6-二氯-4-((甲基(苯并呋喃-6-基)磷酰基)乙炔基)苯甲氨基)-3-(3-(甲磺酰基)苯基)丙酸(化合物24)制备化合物2的完全相同的步骤用来制备化合物24,其中化合物24.3用来取代化合物2.1。lcmsesi(+)m/z:619.4(m+1).1h-nmr(400mhz,dmso)δ9.20(d,j=8.4hz,1h),7.85-7.74(m,5h),7.70-7.63(m,2h),7.59-7.44(m,2h),7.40-7.33(m,1h),7.57-7.47(m,5h),4.80(m,1h),3.30(dd,j=19hz,j=4.8hz,1h),3.14(d,j=3.2hz,3h),3.02(m,1h),2.16(d,j=16hz,3h)。实施例25(2s)-2-(2,6-二氯-4-((甲基(苯并呋喃-6-基)磷酰基)乙基)苯甲氨基)-3-(3-(甲磺酰基)苯基)丙酸制备实施例3的完全相同的方法用来制备实施例2,其中化合物24取代化合物2。lcmsesi(+)m/z:622.1(m+1).1h-nmr(400mhz,dmso)δ9.04(d,j=8hz,1h),8.16(s,1h),8.03(d,j=11hz,1h)7.87(s,1h),7.83(d,j=8hz,1h),7.78(d,j=8hz,1h),7.67(d,j=8hz,1h),7.57(t,j=7.6hz,1h),7.42(s,1h),7.32(s,2h),7.07(s,1h),4.75(m,1h),3.29(dd,j=14hz,j=4.4hz,1h),3.16(s,3h),3.02(dd,j=14hz,10.4hz,1h),2.88(m,1h),2.68(m,1h),2.34(m,2h),1.71(d,j=13.2hz,3h)。实施例26(2s)-2-(2,6-二氯-4-((甲基(苯并呋喃-2-基)磷酰基)乙基)苯甲酰氨基)-3-(3-(甲磺酰基)苯基)丙酸制备化合物25的完全相同的步骤用来制备化合物26,其中2-苯并呋喃用来取代6-苯并呋喃。lcmsesi(+)m/z:623.6(m+1).1h-nmr(400mhz,dmso)δ9.03(d,j=8hz,1h),7.86(s,1h),7.76(d,j=8hz,2h),7.67(t,2h),7.60(s,1h),7.56(t,1h),7.45(t,1h),7.38(s,2h),7.34(t,1h),4.75(m,1h),3.29(dd,j=18.4hz,j=4.4hz,1h),3.01(dd,j=20.4hz,j=10.4hz1h),2.85(m2h),2.39(m,2h),1.84(d,j=14hz,3h)。实施例27(2s)-2-(2,6-二氯-4-((甲基(1h-吲哚-5-基)磷酰基)乙基)苯甲氨基)-3-(3-(甲磺酰基)苯基)丙酸制备化合物25的完全相同的步骤用来制备化合物26,其中1-ms-5-br-indole用来取代6-苯并呋喃。实施例28(2s)-2-(2,6-二氯-4-(((甲基(苯基)磷酰基)氧基)甲基)苯甲酰氨基)-3-(3-(甲磺酰基)苯基)丙酸具体反应方程式如下所示:步骤a:2,6-二氯-(4-羟甲基)苯甲酸甲酯(化合物28.1)2,6-二氯对苯二甲酸二甲酯(2.63g,10mmol)溶解在thf(50ml)中,慢慢加入硼氢化锂(12mmml),反应搅拌1小时后,加入丙酮(1ml),etoac(100ml)。所得溶液水洗二次,无水na2so4干燥,过滤,旋干,粗产物直接用于下一步。步骤b:2,6-二氯-(4-羟甲基)苯甲酸(化合物28.2)化合物28.1溶解在吡啶(20ml)中,加入碘化锂(15mmml),反应回流搅拌5小时后,旋干,粗产物用硅胶柱纯化,流动相95/5/0.5(v/v/v)的dcm/meoh/acoh。步骤c:(s)-2-(2,6-二氯-4-(羟甲基)苯甲酰胺基)-3-(3-(3-(3-(甲磺酰基)苯基)丙酸甲酯(化合物28.3)化合物28.2溶于dmf中,加入(2s)-2-氨基-3-(3-(甲磺酰基)苯基)丙酸甲酯盐酸盐(2eq),后加入dipea(10eq),hatu(2.5eq)。在常温下搅拌4h,加入10ml稀盐酸溶液,用ea萃取3次,合并有机相,旋干。用反相制备纯化,45度减压旋干得目标产物.步骤d:(s)-2-(2,6-dichloro-4-(羟甲基)苯甲酰胺基)-3-(3-(3-(3-(甲磺酰基)苯基)丙酸(化合物28.4)化合物28.3溶于thf中,加入lioh(2eq)。在常温下搅拌4h,加入稀盐酸溶液值得ph约2-3,用ea萃取3次,合并有机相,旋干。得到目标产物,该产物不经纯化,直接用于下一步。步骤e:(2s)-2-(2,6-二氯-4-(((甲基(苯基)磷酰基)氧基)甲基)苯甲酰氨基)-3-(3-(甲磺酰基)苯基)丙酸(化合物28)。化合物28.4溶解在dcm中,冷却的0度,加入tea(10eq),再加入甲基苯基膦酰氯(5eq)。反应在室温搅拌5小时,加水(20eq)淬灭,旋干。粗产物用反相制备hplc纯化,得到目标产物。实施例29(2s)-2-(2,6-二氯-4-(((3-羟基苯基)(甲基)磷酰基)甲基)氨基)苯甲酰胺基)-3-(3-(甲磺酰基)苯基)丙酸具体反应方程式如下所示:步骤a:(氯甲基)(3-甲氧基苯基)(甲基)氧化磷(化合物29.1)氯甲基(甲基)次磷酰氯(10mmol)溶于无水thf(30ml),冷却到-78度,加入(3-甲氧基)苯基锂(1.01eq)。反应搅拌1小时后,在-78度用稀盐酸淬灭。反应回到室温后,加入etoac(80ml),水洗一次,干燥,过滤,旋干。粗产品用硅胶柱纯化,流动相是0-10%meoh/dcm(v/v)。步骤b:2,6-二氯-4-((((3-甲氧基苯基)(甲基)磷酰基)甲基)氨基)苯甲酸甲酯(化合物29.2)化合物29.1(1eq),4-氨基-2,6-二氯苯甲酸甲酯(1.5eq)溶于无水dmf(30ml),加入碘化钠(0.1eq)冷却到0度,加入钠氢(3eq)。反应在室温下搅拌值得化合物29.1消失,在-78度用饱和nh4cl水溶液淬灭。反应回到室温后,加入etoac(80ml),水洗三次,干燥,过滤,旋干。粗产品用硅胶柱纯化,流动相是0-10%meoh/dcm(v/v)。步骤c:2,6-二氯-4-((((3-甲氧基苯基)(甲基)磷酰基)甲基)氨基)苯甲酸(化合物29.3)将化合物29.2溶于dcm中在0度下加入1mol/l的三溴化硼(10eq),在25度下搅拌30分钟,后在-40度下淬灭反应,ea萃取3次,合并有机相旋干。得到的粗产物直接用于下一步。步骤d:(2s)-2-(2,6-二氯-4-((((3-羟基苯基)(甲基)磷酰基)甲基)氨基)苯甲酰胺基)-3-(3-(甲磺酰基)苯基)丙酸甲酯(化合物29.4)化合物11.4溶于dmf中,加入(2s)-2-氨基-3-(3-(甲磺酰基)苯基)丙酸甲酯盐酸盐(2eq),后加入dipea(10eq),hatu(2.5eq)。在常温下搅拌4h,加入10ml稀盐酸溶液,用ea萃取3次,合并有机相,旋干。用反相制备纯化,45度减压旋干得目标产物.步骤e:(2s)-2-(2,6-二氯-4-(((3-羟基苯基)(甲基)磷酰基)甲基)氨基)苯甲酰胺基)-3-(3-(甲磺酰基)苯基)丙酸(化合物29)化合物29.4溶于thf中,加入lioh(3eq)。在常温下搅拌4h,加入稀盐酸溶液值得ph约2-3,用ea萃取3次,合并有机相,旋干。粗产物用反相hplc纯化得到纯的目标产物。实施例30和实施例31手性制备hplc用来拆分实施例14所得的化合物。手性柱为chiralceloz-h型号,流动相为hexane/etoh/tfa,比例60/40/0.1(v/v/v)。两个异构体得到很好的分离。lcms与1hnmr数据同化合物14.实施例32(s,e)-2-(4-(2-(3-羟基苯基)膦酰基乙烯基)-2,6-二氯苯酰胺)-3-(3-(甲磺酰基)苯基)丙酸具体反应方程式如下所示:步骤a:(e)-2,6-二氯-4-(2-(二乙氧基膦酰基)乙烯基)苯甲酸甲酯(化合物32.1)2,6-二氯-4-醛基苯甲酸甲酯1g和亚甲基二磷酸四乙酯2.1g,溶于20mldmf,加入k2co3固体2g,搅拌2h,除去溶剂,纯化得产物。步骤b:(e)-2,6-二氯-4-(2-(氯乙氧基膦酰基)乙烯基)苯甲酸甲酯(化合物32.2)1g化合物32.1溶于10mlsocl2,加热至70度反应4h,除去溶剂,得到产物。步骤c:(e)-4-(2-(3-甲氧基苯基)膦酰基乙烯基)-2,6-二氯苯甲酸甲酯(化合物32.3)1g化合物32.2,溶于20mlthf,降温至0度,加入间甲氧基苯基溴化镁,室温搅拌4h,除去thf,纯化得产物。步骤d:(e)-4-(2-(3-羟基苯基)乙氧膦酰基乙烯基)-2,6-二氯苯甲酸(化合物32.4)200mg化合物32.3,溶于20mlch2cl2,降温至0度,加入bbr3,反应2h后,加入水,用ea萃取后干燥,旋干得产物。步骤e:(s,e)-2-(4-(2-(3-羟基苯基)乙氧膦酰基乙烯基)-2,6-二氯苯酰胺)-3-(3-(甲磺酰基)苯基)丙酸苄酯(化合物32.5)50mg化合物32.4与(2s)-2-氨基-3-(3-(甲磺酰基)苯基)丙酸苄酯盐酸盐40mg和dipea40mg溶于dmf5ml,加入hatu60mg,搅拌过夜,除去dmf,纯化得产物。步骤f:(s,e)-2-(4-(2-(3-羟基苯基)乙氧膦酰基乙烯基)-2,6-二氯苯酰胺)-3-(3-(甲磺酰基)苯基)丙酸(化合物32)15mg化合物32.5溶于1mlthf,加入lioh水溶液0.2ml,搅拌5min,除去溶剂,纯化得产物。lcmsesi(+)m/z:629.5(m+1).1h-nmr(400mhz,dmso)δ9.18(d,j=8.4hz,1h),7.85(s,1h),7.82(s,2h),7.78(d,j=7.6hz,1h),7.68(d,j=7.2hz,1h),7.58(t,1h),7.37(m,2h),7.18(m,3h)7.01(d,j=6hz,1h),4.80(m,1h),3.92(m,2h),3.3(m,2h),3.14(s,1h),1.24(t,j=7.8hz,3h)。实施例33(2s)-2-(2,6-二氯-4-(2-(羟基(4-羟基苯基)磷酰基)乙基)苯甲酰胺基)-3-(3-(甲磺酰基)苯基)丙酸采用实施例14中完全相同的步骤,将“实施例16”转变为实施例33。lcmsesi(+)m/z:597.6(m+1).1h-nmr(400mhz,dmso)δ10.05(s,1h),9.04(d,j=8hz,1h),7.86(s,1h),7.77(d,j=8hz,1h),7.67(d,j=8hz,1h),7.56(m,3h),7.31(s,2h),6.88(d,j=7.6hz,1h),4.75(m,1h),3.29(dd,j=14hz,j=4.4hz,1h),3.15(s,3h),3.02(dd,j=14hz,10.4hz,1h),2.78(m,1h),2.60(m,1h),2.18(m,2h),1.59(d,j=13.2hz,3h).实施例34(2s)-2-(2,6-二氯-4-(2-(甲基(3-羟基苯基)磷酰基)乙基)苯甲酰氨基)-3-(3-羟基苯甲酰胺基)丙酸实施例17中的2-噻吩羧酸置换成3-羟基苯甲酸制得实施例34。lc-ms:m/z579.2(m+h)+1hnmr(400mhz,cd3od):δ7.40-7.30(m,1h),7.26-7.20(m,5h),7.19-7.16(m,1h),7.30(d,j=8.8,1h),7.00(d,j=4.8hz,1h),6.95-6.92(m,1h),4.95(t,j=4.0hz,1h),3.84(d,j=4.4,2h),2.92-2.87(m,1h),2.74-2.71(m,1h),2.38-2.30(m,2h),1.75(d,j=8.4,3h).实施例35(2s)-2-(2,6-二氯-4-(2-(甲基(3-羟基苯基)磷酰基)乙基)苯甲酰氨基)-3-(3,5-二羟基苯甲酰胺基)丙酸实施例17中的2-噻吩羧酸置换成3,5-二羟基苯甲酸制得实施例35。lc-ms:m/z595.2(m+h)+1hnmr(400mhz,cd3od):δ7.41-7.37(m,1h),7.27(s,2h),7.22-7.14(m,2h),7.04-7.01(m,j=5.2hz,1h),6.73(d,j=1.6hz,2h),6.45(t,j=1.6hz,1h),4.97(m,1h),3.80-3.87(m,2h),2.95-2.88(m,1h),2.78-2.71(m,1h),2.43-2.29(m,2h)1.78(d,j=8.8hz,3h)。实施例362-(2,6-二氯-4-(2-(甲基(3-羟基苯基)磷酰基)乙基)苯甲氨基)-3-(3,5-(二甲磺酰基)苯基)丙酸将实施例14和11中的(2s)-2-氨基-3-(3-(甲磺酰基)苯基)丙酸苄酯盐酸盐替换为2-氨基-3-(3,5-(二甲磺酰基)苯基)丙酸苄酯盐酸盐制备得到实施例36。lcmsesi(+)m/z:583.6(m+1)。1h-nmr(400mhz,dmso)δ9.78(d,j=8hz,1h),8.25(d,j=7.6hz,2h),7.34(s,2h),7.18(m,2h),6.95(m,2h),4.89(m,1h),3.45(dd,j=15hz,j=4.4hz,1h),3.29(s,6h),3.22(dd,j=15.5hz,j=10.4hz,1h),2.70(m,2h),2.11(m,2h),1.65(d,j=13.2,3h)。实施例37(2s)-2-(2,6-二氯-4-(2-(甲基(3-羟基苯基)磷酰基)乙基)苯甲氨基)-6-(甲磺酰胺)己酸将实施例14和11中的(2s)-2-氨基-3-(3-(甲磺酰基)苯基)丙酸苄酯盐酸盐替换为(2s)-2-氨基-6-(甲磺酰胺)己酸甲酯盐酸盐制备得到实施例37.lc-ms:m/z578.1(m+h)+1hnmr(400mhz,cd3od):δ7.40(m,1h),7.29(s,2h),7.21-7.17(s,2h),7.22(m,1h),7.17(m,j=8.8hz,1h),7.02(d,j=5.2hz,1h),4.02(m,1h),3.41(t,j=4.4hz,2h),3.96-3.91(m,1h),2.97(s,3h),2.95-2.90(m,1h),2.82-2.72(m,1h),2.47-2.32(m,2h),1.92-1.90(m,1h),1.79(d,j=8.8,3h),1.79(m,5h).实施例38(2s)-2-(2,6-二氯-4-(2-(甲基(3-羟基苯基)磷酰基)乙基)苯甲氨基)-3-(5-(甲磺酰基)吡啶-3-基)丙酸将实施例14和11中的(2s)-2-氨基-3-(3-(甲磺酰基)苯基)丙酸苄酯盐酸盐替换为(2s)-2-氨基-3-(5-(甲磺酰基)吡啶-3-基)丙酸盐酸盐制备得到实施例38.lcmsesi(+)m/z:600.4(m+1).1h-nmr(400mhz,meod)δ8.96(s,1h),8.83(s,1h),8.39(s,1h),7.38(m,h),7.24(s,2h),7.17(m,2h),7.02(d,j=7.6hz,1h),5.08(m,1h),3.52(m,1h),3.20(s,1h),2.88(m,1h),2.74(m,1h),2.33(m,2h),1.79(d,j=13.2hz,3h)实施例39(2s)-2-(2,6-二氯-4-(2-(甲基(3-羟基苯基)磷酰基)乙基)苯甲氨基)-3-(1-(甲磺酰基)-1h-吡咯-3-基)丙酸将实施例14和11中的(2s)-2-氨基-3-(3-(甲磺酰基)苯基)丙酸苄酯盐酸盐替换为(2s)-2-氨基-3-(1-(甲磺酰基)-1h-吡咯-3-基)丙酸盐酸盐制备得到实施例39.实施例40(2s)-2-(2,6-二氯-4-(2-(甲基(3-羟基苯基)磷酰基)乙基)苯甲氨基)-3-(1-(甲磺酰基)-1h-吡唑-3-基)丙酸将实施例14和11中的(2s)-2-氨基-3-(3-(甲磺酰基)苯基)丙酸苄酯盐酸盐替换为(2s)-2-氨基-3-(1-(甲磺酰基)-1h-吡唑-3-基)丙酸盐酸盐制备得到实施例40.实施例41(2s)-2-(2,6-二氯-4-(2-(甲基(3-羟基苯基)磷酰基)乙基)苯甲氨基)-3-(1-(甲磺酰基)-1h-吡唑-4-基)丙酸将实施例14和11中的(2s)-2-氨基-3-(3-(甲磺酰基)苯基)丙酸苄酯盐酸盐替换为(2s)-2-氨基-3-(1-(甲磺酰基)-1h-吡唑-4-基)丙酸盐酸盐制备得到实施例41.实施例42(2s)-2-(2,6-二氯-4-(2-(甲基(3-羟基苯基)磷酰基)乙基)苯甲氨基)-3-(1-(甲磺酰基)吡咯烷-3-基)丙酸将实施例14和11中的(2s)-2-氨基-3-(3-(甲磺酰基)苯基)丙酸苄酯盐酸盐替换为(2s)-2-氨基-3-(1-(甲磺酰基)吡咯烷-3-基)丙酸盐酸盐制备得到实施例42.lc-ms:m/z591.1(m+h)+.1hnmr(400mhz,cd3od):δ7.43-7.37(m,1h),7.30(s,2h),7.25-7.20(m,2h),7.04-7.01(m,1h),4.71-4.63(m,1h),3.68-3.55(m,1h),3.50-3.44(m,1h),3.30-3.28(m,1h),3.05-2.90(m,2h),2.89(d,j=2.0hz,3h),2.88-2.75(m,1h),2.52-2.50(m,1h),2.50-2.10(m,3h),2.09-1.82(m,2h),1.79(d,j=9.2hz,3h),1.69(m,1h)。实施例43(2s)-2-(2,6-二氯-4-(2-(甲基(3-羟基苯基)磷酰基)乙基)苯甲酰氨基)-3-((s)-3-羟基吡咯烷-1-羧酰胺)丙酸实施例17中的2-噻吩羧酸置换成(s)-3-羟基吡咯烷-1-羰酰氯制得实施例43。lc-ms:m/z595.7(m+h)+.1hnmr(400mhz,cd3od):δ7.39-7.35(m,1h),7.26(s,2h),7.19-7.12(m,2h),7.01(d,j=8.4,1h),4.78-4.74(m,1h),4.36-4.40(m,1h),3.66-3.64(m,2h),3.45-3.41(m,3h),3.27-3.25(m,1h),2.95-2.85(m,1h),2.79-2.69(m,1h),2.39-2.27(m,2h),2.05-1.92(m,2h),1.77(d,j=12.4,1h)。实施例44(2s)-2-(2,6-二氯-4-(2-(甲基(3-羟基苯基)磷酰基)乙基)苯甲氨基)-5(甲磺酰胺)戊酸将实施例14和11中的(2s)-2-氨基-3-(3-(甲磺酰基)苯基)丙酸苄酯盐酸盐替换为(2s)-2-氨基-5(甲磺酰胺)戊酸甲酯盐酸盐制备得到实施例44lc-ms:m/z565.1(m+h)+.1hnmr(400mhz,cd3od):δ7.39-7.36(m,1h),7.27(s,2h),7.21-7.17(m,1h),7.14(d,j=8.4hz,1h)7.00(d,j=5.6hz,1h),4.05(m,1h),3.42-3.40(m,2h),2.95(s,3h),2.91-2.87(m,1h),2.74-2.72(m,1h),2.39-2.28(m,2h),2.04-2.02(m,1h),1.81-1.74(m,6h)。实施例45(2s)-3-((反式)-n’-氰基-3,4-二羟基吡咯烷-1-甲脒基)-2-(2,6-二氯-4-(2-(甲基(3-羟基苯基)磷酰基)乙基)苯甲酰氨基)丙酸实施例19中的(r)-3-吡咯烷醇置换成(反式)-3,4-吡咯烷二醇制得实施例45。lc-ms:m/z611.7(m+h)+.1hnmr(400mhz,cd3od):δ7.41-7.39(m,1h),7.30-7.28(m,2h),7.24-7.20(m,2h),7.05-7.03(m,1h),5.11(dd,j=10.4,4.4,1h),4.11-4.18(m,1h),4.04-4.01(m,1h),3.79-3.72(m,1h),3.51-3.56(m,1h),3.26-3.25(m,1h),3.23-3.22(m,1h),3.17-3.13(m,1h),3.07-3.03(m,1h),3.00-2.96(m,1h),2.94-2.86(m,1h),2.77-2.66(m,1h),2.45-2.33(m,2h),1.79-1.75(m,3h)。实施例46(2s)-3-(2-氰基-3,3-二(2-羟基乙基)胍基)-2-(2,6-二氯-4-(2-(甲基(3-羟基苯基)磷酰基)乙基)苯甲酰氨基)丙酸实施例19中的(r)-3-吡咯烷醇置换成二乙醇胺制得实施例46。lc-ms:m/z595.6(m-oh)+.1hnmr(400mhz,cd3od):δ7.38-7.37(m,1h),7.30-7.27(m,2h),7.21-7.17(m,2h),7.01-6.99(m,1h),5.71(dd,j=10.0,4.0,1h),4.07-4.04(m,1h),3.96-3.91(m,1h),3.79-3.43(m,8h),2.99-2.90(m,1h),2.82-2.72(m,1h),2.47-2.36(m,2h),1.75(d,j=12.8,3h)。实施例47(2s)-2-(2,6-二氯-4-((甲氧基(2-羟基苯基)磷酰基)乙炔基)苯甲氨基)-3-(3-(甲磺酰基)苯基)丙酸具体反应方程式如下所示:步骤a:2,6-二氯-4-(((邻甲氧基苯基)(乙氧基)磷酰基)乙炔基)苯甲酸甲酯(化合物47.2)将100mg的2,6-二氯-4-乙炔基苯甲酸甲酯溶于1.5ml四氢呋喃中,氮气保护,并在0度下加入0.7ml的2mol/l的异丙基氯化镁,搅拌20分钟;将化合物47.1溶于0.5ml的四氢呋喃并加入,反应20分钟。用1mol/l的稀盐酸溶液淬灭反应,用30ml乙酸乙酯分三次萃取,合并有机相,旋干,纯化得产物(100mg,60%)。lcmsesi(+)m/z:426.6(m+1).步骤b:2,6-二氯-4-((羟基(邻甲氧苯基)磷酰基)乙炔基)苯甲酸(化合物47.3)将化合物47.3(100mg)和碘化锂(100mg)溶于2ml吡啶中氮气保护,在120度搅拌3个小时,冷却旋干,加入10ml的1mol/l的稀盐酸溶液,用30ml的乙酸乙酯分3次萃取,合并有机相,旋干无需纯化。lcmsesi(+)m/z:384.6(m+1).步骤c:(2s)-2-(2,6-二氯-4-((羟基(邻甲氧苯基)磷酰基)乙炔基)苯甲酰胺基)-3-(3-(甲磺酰基)苯基)丙酸苄酯(化合物47.4)将化合物47.3溶于dmf中,加入(2s)-2-氨基-3-(3-(甲磺酰基)苯基)丙酸苄酯盐酸盐(2eq),后加入dipea(10eq),hatu(2.5eq)。在常温下搅拌4h,加入10ml稀盐酸溶液,用ea萃取3次,合并有机相,旋干。用反相制备纯化,45度减压旋干得目标产物85mg。lcmsesi(+)m/z:699.5(m+1).步骤d:(2s)-2-(2,6-二氯-4-((甲氧基(2-甲氧基苯基)磷酰基)乙炔基)苯甲氨基)-3-(3-(甲磺酰基)苯基)丙酸苄酯(化合物47.5)将化合物47.4(40mg)溶于1ml甲醇中,加入三甲基硅基重氮甲烷(3eq),在常温下搅拌30分钟。加入适量的乙酸淬灭,旋干,加入5ml的稀盐酸溶液,用ea萃取3次,合并有机相旋干即可。lcmsesi(+)m/z:713.5(m+1).步骤e:(2s)-2-(2,6-二氯-4-((甲氧基(2-羟基苯基)磷酰基)乙炔基)苯甲氨基)-3-(3-(甲磺酰基)苯基)丙酸(化合物47)将化合物47.5(30mg)溶于dcm中,在-40度下加入1mol/l的三溴化硼(10eq),在0度下搅拌30分钟后在-40度下加水淬灭反应。用ea萃取3次,合并有机相,干燥旋干,纯化得目标产物15mg。lcmsesi(+)m/z:609.5(m+1).1h-nmr(400mhz,dmso),δ10.57(s,1h),9.21(d,j=8.4hz,1h),7.88(s,1h),7.78(s,2h),7.67(m,2h),7.57(t,j=7.6hz,1h),5.96(m,2h),4.80(m,1h),3.77(d,j=12.4hz,3h),3.30(m,1h),3.15(s,3h),3.03(dd,j=14,j=9.4,1h).实施例48(2s)-2-(2,6-二氯-4-((甲基(4-羟基-3-氯苯基)磷酰基)乙炔基)苯甲氨基)-3-(3-(甲磺酰基)苯基)丙酸采用实施例11中完全相同的步骤,将“间甲氧基磷酸二乙酯”替换为“4-甲氧基-3-氯磷酸二乙酯”制备出实施例48。lcmsesi(+)m/z:628.1(m+1).1h-nmr(400mhz,dmso)δ11.15(s,1h),9.21(d,j=8hz,1h),7.86(s,1h),7.79-7.82(m,4h),7.68(m,2h),7.57(t,j=8hz,1h),7.15(dd,j=7.6hz,4.0hz,1h),4.79(m,1h),3.30(dd,j=14hz,j=4.4hz,1h),3.15(s,3h),3.03(dd,j=14hz,10.4hz,1h),1.99(d,j=13.2hz,3h).实施例49(2s)-2-(2,6-二氯-4-((羟基(苯并呋喃-6-基)磷酰基)乙炔基)苯甲氨基)-3-(3-(甲磺酰基)苯基)丙酸步骤a:2,6-二氯-4-(((苯并呋喃-6-基)(乙氧基)磷酰基)乙炔基)苯甲酸甲酯(化合物49.1)将100mg的2,6-二氯-4-乙炔基苯甲酸甲酯溶于1.5ml四氢呋喃中,氮气保护,并在0度下加入0.7ml的2mol/l的异丙基氯化镁,搅拌20分钟;将化合物24.3溶于0.5ml的四氢呋喃并加入,反应20分钟。用1mol/l的稀盐酸溶液淬灭反应,用30ml乙酸乙酯分三次萃取,合并有机相,旋干,纯化得产物(100mg,60%)。lcmsesi(+)m/z:437.1(m+1).步骤b:2,6-二氯-4-((羟基(苯并呋喃-6-基)磷酰基)乙炔基)苯甲酸(化合物49.2)将化合物49.1(100mg)和碘化锂(100mg)溶于2ml吡啶中氮气保护,在120度搅拌3个小时,冷却旋干,加入10ml的1mol/l的稀盐酸溶液,用30ml的乙酸乙酯分3次萃取,合并有机相,旋干无需纯化。步骤c:(2s)-2-(2,6-二氯-4-((羟基(苯并呋喃-6-基)磷酰基)乙炔基)苯甲酰胺基)-3-(3-(甲磺酰基)苯基)丙酸苄酯(化合物49.3)将化合物49.2溶于dmf中,加入(2s)-2-氨基-3-(3-(甲磺酰基)苯基)丙酸苄酯盐酸盐(2eq),后加入dipea(10eq),hatu(2.5eq)。在常温下搅拌4h,加入10ml稀盐酸溶液,用ea萃取3次,合并有机相,旋干。用反相制备纯化,45度减压旋干得目标产物85mg。lcmsesi(+)m/z:710.1(m+1).步骤d:(2s)-2-(2,6-二氯-4-((羟基(苯并呋喃-6-基)磷酰基)乙炔基)苯甲氨基)-3-(3-(甲磺酰基)苯基)丙酸(化合物49)将化合物49.3(30mg)溶于dcm中,在-40度下加入1mol/l的三溴化硼(10eq),在0度下搅拌30分钟后在-40度下加水淬灭反应。用ea萃取3次,合并有机相,干燥旋干,纯化得目标产物15mg。lcmsesi(+)m/z:620.0(m+1).1h-nmr(400mhz,dmso)δ9.19(d,j=8hz,1h),8.17(s,1h),7.98(d,j=248hz,1h),7.86(s,1h),7.79-7.76(m,2h),7.55-7.66(m,3h),7.57(t,j=8hz,1h),7.07(s,1h),4.79(m,1h),3.30(dd,j=14hz,j=4.4hz,1h),3.15(s,3h),3.02(dd,j=14hz,10.4hz,1h).实施例50(2s)-2-(2,6-二氯-4-(1-羟基2-(羟基(3-羟基苯基)磷酰基)乙基)苯甲酰胺基)-3-(3-(甲磺酰基)苯基)丙酸具体反应方程式如下所示:步骤a:2,6-二氯-4-(1-羟基2-(甲氧基(3-甲氧基苯基)磷酰基)乙基)苯甲酸甲酯(化合物50.1)称取300mg甲基(3-甲氧基苯基)膦酸乙酯溶于10ml干燥四氢呋喃中,氮气保护,冰浴下,加入1.1ml(2m)的lda,在冰浴下搅拌1小时后,加入419mg的2,6-二氯-4-甲酰基苯甲酸甲酯,在常温下搅拌2小时,饱和nh4cl在冰浴下淬灭反应,用30ml乙酸乙酯分三次萃取,合并有机相,旋干,柱纯化得到产物(100mg,23%)。lcmsesi(+)m/z:432.8。步骤b:2,6-二氯-4-(1-羟基2-(羟基(3-羟基苯基)磷酰基)乙基)苯甲酸(化合物50.2)将化合物50.1(100mg)溶于8ml二氯甲烷中氮气保护,-40℃下,加入1ml的三溴化硼,-40℃下搅拌4个小时,加入10ml的水淬灭,用20ml的二氯甲烷分3次萃取,合并有机相,旋干无需纯化,粗品70mg。lcmsesi(+)m/z:390.8(m+1)。步骤c:(2s)-2-(2,6-二氯-4-(1-羟基2-(羟基(3-羟基苯基)磷酰基)乙基)苯甲酰胺基)-3-(3-(甲磺酰基)苯基)丙酸苄酯(化合物50.3)将化合物50.2溶于dmf中,加入(2s)-2-氨基-3-(3,5-(二甲磺酰基)苯基)丙酸苄酯盐酸盐(2eq),后加入dipea(10eq),hatu(2.5eq)。在常温下搅拌4h,加入10ml稀盐酸溶液,用ea萃取3次,合并有机相,旋干。用反相制备纯化,45度减压旋干得目标产物40mg。lcmsesi(+)m/z:705.7(m+1).步骤d:(2s)-2-(2,6-二氯-4-(1-羟基2-(羟基(3-羟基苯基)磷酰基)乙基)苯甲酰胺基)-3-(3-(甲磺酰基)苯基)丙酸(化合物50)将化合物1.3溶于2ml的甲醇和0.3ml的水中,冰浴下加入2eq的一水合氢氧化锂,室温下搅拌1h,1n的盐酸调节ph=6,20ml乙酸乙酯旋分3次萃取,水洗,干燥,旋蒸,反相制备,冻干的产物5mg。lcmsesi(+)m/z:583.6(m+1);1h-nmr(400mhz,cd3od-d4)δ7.95(s,1h),7.86(d,j=5.6hz,1h),7.73(d,j=4.8hz,1h),7.62(t,j=5.2hz,1h),7.31(m,2h),7.26(s,2h),7.21(dd,j=5.2hz,j=5.2hz,1h),7.08(d,j=8.4hz,1h),6.96(t,j=5.2hz,1h),5.10(m,1h),4.91(m,1h),3.50(dd,j=3.2hz,j=3.2hz,1h),3.22(dd,j=2.8hz,j=3.2hz,1h),3.29(s,3h),2.39(m,2h)。实施例51(2s)-2-(2,6-二氯-4-(2-(羟基(间羟基苯基)磷酰基)乙烯基)苯甲酰胺基)-3-(3-(甲磺酰基)苯基)丙酸具体反应方程式如下所示:将化合物32溶于5ml的四氢呋喃中,加入lioh水溶液1ml,室温搅拌5h,旋干,纯化得产物。lcmsesi(+)m/z:599.4(m+1).1h-nmr(400mhz,dmso)δ9.73(s,1h),9.13(d,j=8.8hz,1h),7.87(s,1h),7.77(d,j=8hz,2h),7.69(d,j=7.6hz,1h),7.58(t,j=7.6hz,1h),7.31(m,2h),7.16(m,2h),7.02(m,2h),6.98(m,1h),4.78(m,1h),3.15(s,3h),3.03(m,1h).实施例52(s,e)-2-(4-(2-(二(3-羟基苯基)膦酰基)乙烯基)-2,6-二氯苯酰胺)-3-(3-(甲磺酰基)苯基)丙酸具体反应方程式如下所示:步骤a:(e)-4-(2-(二(3-甲氧基苯基)膦酰基)乙烯基)-2,6-二氯苯甲酸甲酯(化合物52.1)1g化合物32.2,溶于20mlthf,降温至0度,加入5当量间甲氧基苯基溴化镁溶液,室温搅拌4h,除去thf,纯化得产物。步骤b:(e)-4-(2-(二(3-羟基苯基)膦酰基)乙烯基)-2,6-二氯苯甲酸(化合物52.2)160mg化合物52.1,溶于10mlch2cl2,降温至0度,加入bbr3,反应2h后,加入水,用ea萃取后干燥,旋干得产物。步骤c:(s,e)-2-(4-(2-(二(3-羟基苯基)膦酰基)乙烯基)-2,6-二氯苯酰胺)-3-(3-(甲磺酰基)苯基)丙酸苄酯(化合物52.3)50mg化合物52.2,(2s)-2-氨基-3-(3-(甲磺酰基)苯基)丙酸苄酯盐酸盐40mg和dipea40mg溶于dmf5ml,加入hatu60mg,搅拌过夜,除去dmf,纯化得产物。步骤d:(s,e)-2-(4-(2-(二(3-羟基苯基)膦酰基)乙烯基)-2,6-二氯苯酰胺)-3-(3-(甲磺酰基)苯基)丙酸(化合物52)15mg化合物52.3溶于1mlthf,加入lioh水溶液0.2ml,搅拌0.5h,除去溶剂,纯化得产物。lcmsesi(+)m/z:675.5(m+1).1h-nmr(400mhz,dmso)δ9.81(s,2h),7.87(s,1h),7.89(s,2h),7.86(s,1h),7.58(t,1h),7.76(d,j=4.6hz,2h),7.66(m,2h),7.51(t,1h),7.34(m,3h),7.13(m,4h),6.94(d,j=4.4hz,1h),3.29(dd,j=14hz,j=4.4hz,1h),3.15(s,3h),3.01(dd,j=14hz,10.4hz,1h)。实施例53(s,e)-2-(4-(2-(二(3-羟基苯基)膦酰基)乙基)-2,6-二氯苯酰胺)-3-(3-(甲磺酰基)苯基)丙酸具体反应方程式如下所示:12mg化合物52溶于0.5mlmeoh,加入10%钯碳1mg,通入h2,反应3h,过滤,纯化得产物。lcmsesi(+)m/z:677.5(m+1).1h-nmr(400mhz,dmso)δ10.63(s,2h),8.67(s,1h),8.59(d,j=8.4hz,1h),8.50(d,j=8hz,1h),8.40(t,1h),8.18(s,2h),8.16(m,3h),8.01(m,5h),7.75(dd,j=10hz,2hz,2h),3.29(dd,j=14hz,j=4.4hz,1h),3.15(s,3h),3.01(dd,j=14hz,10.4hz,1h),2.81(m,2h),2.11(m,2h).实施例54(s,e)-2-(4-(2-(4-羟基苯基)膦酰基乙烯基)-2,6-二氯苯酰胺)-3-(3-(甲磺酰基)苯基)丙酸制备实施例32的完全相同的方法用来制备实施例54,其中对甲氧基溴化镁取代间甲氧基溴化镁。lcmsesi(+)m/z:629.5(m+1).1h-nmr(400mhz,dmso)δ9.15(d,j=8hz,1h),7.87(s,1h),7.73(t,3h),7.60(d,j=6hz,1h),7.58(d,j=7.2hz,1h),7.58(t,1h),7.18(m,3h),6.91(dd,j=10.4hz,2hz,2h),4.80(m,1h),3.92(m,2h),3.3(m,2h),3.12(s,1h),1.26(t,j=7.8hz,3h)。实施例55(2s)-2-(2,6-二氯-4-(1-羟基2-(甲基(苯并呋喃-3-基)磷酰基)乙基)苯甲酰胺基)-3-(3-(甲磺酰基)苯基)丙酸具体反应方程式如下所示:步骤a:二甲基(苯并呋喃-3-基)氧膦(化合物55.1)将100mg的甲基(苯并呋喃-3-基)膦酰氯溶于2ml四氢呋喃中,氮气保护,并在0度下加入0.7ml的3mol/l的甲基基溴化镁,搅拌20分钟。用1mol/l的稀盐酸溶液淬灭反应,用30ml乙酸乙酯分三次萃取,合并有机相,旋干,纯化得产物(100mg,60%)。lcmsesi(+)m/z:195.1(m+1).步骤b:(2s)-2-(2,6-二氯-4-(1-羟基2-(甲基(苯并呋喃-3-基)磷酰基)乙基)苯甲酰胺基)-3-(3-(甲磺酰基)苯基)丙酸(化合物55)采用实施例50中完全相同的步骤,将“甲基(3-甲氧基苯基)膦酸乙酯”替换为“二甲基(苯并呋喃-3-基)氧膦”制备出化合物55。lcmsesi(+)m/z:638.1(m+1).1h-nmr(400mhz,dmso)δ9.09(d,j=8hz,1h),8.16(s,1h),8.01(t,j=8hz,1h),7.87(s,1h),7.77-7.82(m,2h),7.68(m,2h),7.57(t,j=8hz,1h),7.38(s,2h),7.05(dd,j=7.6hz,4.0hz,1h),4.90(m,1h),4.77(m,1h),3.30(dd,j=14hz,j=4.4hz,1h),3.15(s,3h),3.03(dd,j=14hz,10.4hz,1h),2.40(m,2h),1.80(d,j=13.2hz,3h).实施例56(2s)-2-(2,6-二氯-4-(异丙基(3-羟基苯基)磷酰基)乙基)苯甲酰胺基)-3-(3-(甲磺酰基)苯基)丙酸制备实施例21的完全相同的方法用来制备实施例56,其中异丙基格氏试剂取代乙基格氏试剂。lcmsesi(+)m/z:626.1(m+1).1h-nmr(400mhz,dmso)δ9.76(s,1h),9.03(d,j=8hz,1h),7.86(s,1h),7.77(d,j=8hz,1h),7.67(d,j=8hz,1h),7.57(t,j=7.6hz,1h),7.31-7.35(m,3h),7.12-7.17(m,2h),6.94(d,j=7.6hz,1h),4.75(m,1h),3.29(dd,j=14hz,j=4.4hz,1h),3.15(s,3h),3.01(dd,j=14hz,10.4hz,1h),2.74(m,1h),2.50(m,1h),2.29(m,2h),2.07(m,1h),1.10(dd,j=16hz,7.0hz,3h),0.88(dd,j=16hz,7.0hz,3h).实施例57(2s)-2-(2,6-二氯-4-(环丙基(3-羟基苯基)磷酰基)乙烯基)苯甲酰胺基)-3-(3-(甲磺酰基)苯基)丙酸具体反应方程式如下所示:步骤a:(e)-4-(2-(3-甲氧基苯基)氯膦酰基乙烯基)-2,6-二氯苯甲酸甲酯(化合物57.1)1g化合物32.3,溶于20mlsocl2,80度加热3小时,浓缩得产物。步骤b:(e)-4-(2-(3-甲氧基苯基)环丙基膦酰基乙烯基)-2,6-二氯苯甲酸甲酯(化合物57.2)10毫升1m环丙基氯化镁的thf溶液,加入0.5g氯化铈,再加入1g化合物57.1,室温反应1h后加氯化铵溶液淬灭,萃取纯化后得产物。步骤c:(e)-4-(2-((3-羟基苯基)环丙基膦酰基)乙烯基)-2,6-二氯苯甲酸(化合物57.3)160mg化合物57.2,溶于10mlch2cl2,降温至0度,加入bbr3,反应2h后,加入水,用ea萃取后干燥,旋干得产物。步骤d:(s,e)-2-(4-(2-(3-羟基苯基)环丙基膦酰基)乙烯基)-2,6-二氯苯酰胺)-3-(3-(甲磺酰基)苯基)丙酸苄酯(化合物57.4)50mg化合物57.3,(2s)-2-氨基-3-(3-(甲磺酰基)苯基)丙酸苄酯盐酸盐40mg和dipea40mg溶于dmf5ml,加入hatu60mg,搅拌过夜,除去dmf,纯化得产物。步骤e:(s,e)-2-(4-(2-(3-羟基苯基)环丙基膦酰基)乙烯基)-2,6-二氯苯酰胺)-3-(3-(甲磺酰基)苯基)丙酸(化合物57)15mg化合物57.4溶于1mlthf,加入lioh水溶液0.2ml,搅拌0.5h,除去溶剂,纯化得产物。lcmsesi(+)m/z:622.1(m+1).1h-nmr(400mhz,dmso)δ9.80(s,1h),9.13(d,j=8.8hz,1h),7.87(s,1h),7.82(s,2h),7.78(d,j=8hz,2h),7.69(d,j=7.6hz,1h),7.58(t,j=7.6hz,1h),7.17-7.37(m,5h),6.96(m,1h),4.79(m,1h),3.30(dd,j=14hz,j=4.4hz,1h),3.15(s,3h),3.04(dd,j=14hz,10.4hz,1h),1.25(m,1h),0.66-0.89(m,4h).实施例58(2s)-2-(2,6-二氯-4-(甲基(3-羟基苯基)磷酰基)乙烯基)苯甲酰胺基)-3-(3-(甲磺酰基)苯基)丙酸制备实施例57的完全相同的方法用来制备实施例58,其中甲基格氏试剂取代环丙基格氏试剂。lcmsesi(+)m/z:596.1(m+1).1h-nmr(400mhz,dmso)δ9.80(s,1h),9.14(d,j=8.8hz,1h),7.87(s,1h),7.78(m,3h),7.69(d,j=7.6hz,1h),7.58(t,j=7.6hz,1h),7.38(m,1h),7.25(d,j=20hz,2h),7.15-7.18(m,2h),6.96(m,1h),4.79(m,1h),3.30(dd,j=14hz,j=4.4hz,1h),3.15(s,3h),3.04(dd,j=14hz,10.4hz,1h),1.73(d,,j=13.2hz3h).细胞粘和抑制实验:使用人类t淋巴细胞株jurkat(atcctib-152)进行t-细胞粘附试验:在pbs中将山羊anti-humanigg(fcspecific)(sigmai8885)稀释至10μg/ml,在4℃每孔100ul/96孔板培育12小时.倾倒掉孔板中的液体,用200ul1%的bsa在37℃封闭90分钟,再用用pbs洗板3次。每孔加入50ul的1ug/ml的icam-1(含0.1%bsa,0.01%tween20),在37℃培育3小时。用assay的缓冲液(20mmhepesph7.6,140mmnacl,1mmmgcl2,1mmmncl2,0.2%glucose)洗板3次。jurkat细胞仪100-g离心处理,重新将细胞混悬入37℃的assay的缓冲液(20mmhepesph7.6,140mmnacl,1mmmgcl2,1mmmncl2,0.2%glucose),每ml的细胞悬浮液中加入2μl1mmofbcecf-am。在37℃培育30分钟,培育过程中,每10分钟搅拌一次。培育完后,细胞用37℃的assay缓冲液洗一下。将细胞悬浮到6x106/ml的浓度。在测定缓冲液中将抑制剂稀释至2x终浓度,并在室温下取50ul的化合物溶液和60ul的jurkat细胞混合,在37℃培育30分钟。将100μl/孔的细胞和抑制剂加入到板中并在室温下培养1小时。用荧光仪测量总荧光度:ex:485;em:530;cutoff:530来测量总荧光度。将板用assay缓冲液洗一次,再用荧光仪测量荧光度:ex:485;em:530;cutoff:。得出结果绘成抑制-浓度关系图,并用标准方法计算出ec50。表一显示了用此办法测得的部分ec50值。表一:细胞粘和抑制的ec50实施例ec50(nm)实施例ec50(nm)130217.329.4222238.523614112410.25222563617262377.227na*86.228na*911.829na*1078307.21113.5317.11229323.713293310.8148.53412.5151.8353.8167.23630171537>100018na*38241923039na*20na*40na*表一(继续)实施例ec50(nm)实施例ec50(nm)41na514.24215052744369532244na*549.645>1000551946>1000566347340575.3486.8581.94910.85016*na:没有数据实施例:制剂实施例11所得到的化合物,5.0g加入90ml的无菌生理盐水中,加入0.7g的naoh,搅拌得到透明溶液;向以上得到的溶液中加入nah2po4饱和水溶液,直到溶液的ph在6.75-7.25之间。向得到水溶液加入无菌生理盐水,直到总体积达到100.0ml。向以上溶液通氮气,鼓泡1小时,所得溶液密封,放在5℃避光保存。分装到一次性使用的滴眼液袋中,每个含60ml的制剂溶液。根据具体化合物性质和使用要求的需要,该制剂的方法和具体比例还可按需调整。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 一种端巯基有机含磷‑氮‑硫酯化物及其制备方法和由其制得的阻燃聚酯纤维POY丝与流程
- 超小金属硫族化合物纳米晶、其亲生物合成方法及应用与流程
- 一种端羧基有机含磷‑氮‑硫酯化物及其制备方法和由其制得的阻燃涤纶织物与流程
- 利用钙磷化合物制备HA/β‑TCP复合材料的方法与流程
- 含磷聚酯化合物组成及含磷阻燃环氧树脂固化物的制备方法与流程
- 应用在环氧树脂中含磷氮硫的反应型阻燃剂的制备方法与流程
- 高度有序结构的层状金属硫族化合物/碳纳米管柔性复合薄膜材料及制备的制作方法与工艺
- 基于热释胶带的二维过渡金属硫属化合物转移方法与流程
- 一种含硫物检测试纸的制作方法与工艺
- 对有机含磷化合物有毒气体具有荧光响应的一维有机半导体纳米线/带及其制备方法和应用与流程