幽门螺旋杆菌免疫优势表位肽L79-96及其应用的制作方法
本发明属于生物工程技术,具体是涉幽门螺旋杆菌lpp20的hla限制性cd4+t细胞免疫优势表位肽l79-96及其应用。
背景技术:
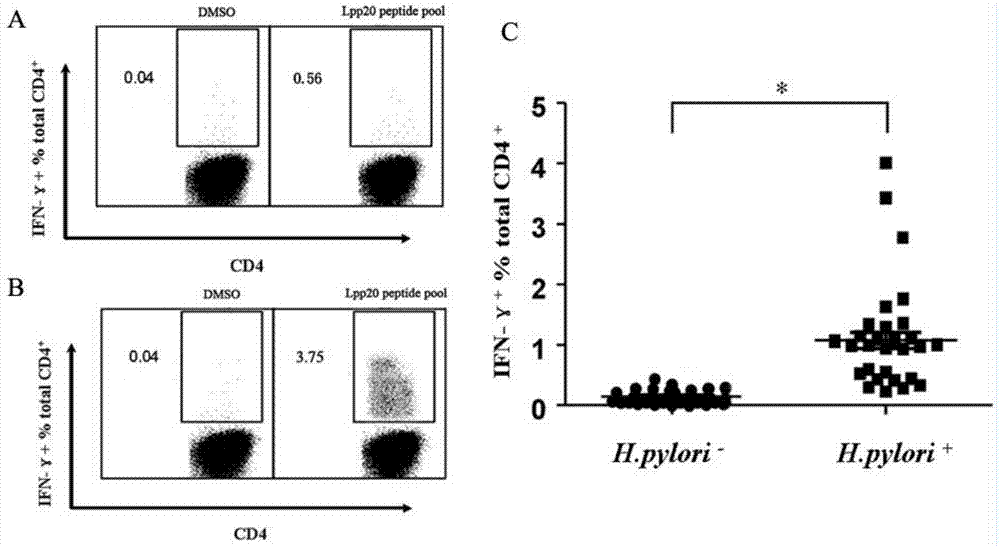
幽门螺杆菌(h.pylori)感染世界50%以上的人口,易导致慢性胃炎、消化性溃疡、胃腺癌和胃粘膜相关淋巴组织淋巴瘤。越来越多的证据表明,cd4+t细胞反应在抗h.pylori感染中扮演一个关键的角色。有研究证实,h.pylori感染增加t细胞在人胃中的浸润并以典型的th1表型存在,急性h.pylori感染主要引起恒河猴th1反应,小鼠疫苗诱发的或宿主抗h.pylori的天然免疫依赖th1型细胞反应。这些研究表明,th1反应参与了宿主抗h.pylori感染的保护性免疫。免疫优势指在免疫或感染的个体中细胞免疫往往针对非常有限的抗原表位。一般来说,免疫优势t细胞不仅普遍存在,而且比亚优势细胞能提供更好的保护作用。因此,免疫优势t细胞被认为是在宿主抗病原体的适应性免疫中发挥更有效和关键的作用,这已经在许多细菌、病毒和肿瘤系统中被证实。许多疫苗研究领域的科学家认为免疫优势cd4+t细胞表位在h.pylori疫苗开发中至关重要。目前,尽管一些h.pylori保护性抗原的免疫优势cd4+t细胞表位已被鉴定,但是许多h.pylori抗原免疫优势特异性cd4+t细胞反应和免疫优势cd4+t细胞表位尚未阐明。lpp20是h.pylori外膜脂蛋白,被认为是一个潜在的疫苗候选抗原。我们先前的研究鉴定了一个lpp20的b细胞表位(l10-119),可诱导小鼠产生抗lpp20血清,还鉴定了两个h-2d限制性cd4+t细胞表位(l58-72和l83-97),可诱发balb/c小鼠分泌th1型细胞因子。此外,以上述三种抗原表位构建的表位疫苗可引起特异性高水平的lpp20抗体和th1型细胞因子,显著降低h.pylori攻毒小鼠的h.pylori的定植,这表明lpp20表位疫苗可能是一个有前途的防治h.pylori感染的疫苗。由于小鼠和人类的mhc分子存在差异,h-2d限制性的cd4+t细胞抗原表位有时不能在人类产生强烈的免疫反应。因此,鉴定lpp20的hla限制性cd4+t细胞表位对人类h.pylori疫苗的设计非常重要。技术实现要素:基于此,本发明的目的之一是提供一种幽门螺旋杆菌hla限制性cd4+t细胞表位的多肽。实现上述目的的技术方案如下:一种幽门螺旋杆菌lpp20的hla限制性cd4+t细胞表位免疫优势肽,其组成如seqidno.14所示。一种幽门螺旋杆菌lpp20的hla限制性cd4+t细胞表位免疫核心肽,其组成如seqidno.36所示。本发明的另一目的是提供上述免疫优势肽或免疫核心肽在制备幽门螺旋杆菌表位疫苗中的应用。本发明的另一目的是提供幽门螺旋杆菌表位疫苗。实现上述目的技术方案如下:幽门螺旋杆菌表位疫苗,其活性成份包括或来自于上述免疫优势肽或免疫核心肽。目前,尽管目前已经鉴定了一些h.pylori保护性抗原的免疫优势表位,但有关许多h.pylori抗原的cd4+t细胞反应还尚不清楚。我们先前的研究鉴定了两个lpp20的h-2d限制cd4+t细胞表位,以此构建的表位疫苗在小鼠预防和治疗性接种中抵抗h.pylori的感染,这种保护与th1型lpp20特异性cd4+t细胞反应密切相关。但是,mhc基因座是哺乳动物中遗传变异最大的编码基因位点,mhc分子的高度多态特性导致不同种类/对象的免疫系统产生针对同一病原/抗原的不同抗原/表位的免疫反应。这就是为什么许多候选疫苗在小鼠实验中取得成功,但在临床试验中失败。因此,本发明致力于寻找lpp20的hla限制性表位,而不是在临床试验中测试h-2d限制性表位。在这项研究中,我们利用h.pylori感染者的pbmc鉴定到lpp20的cd4+t细胞表位。为了系统有效地鉴定免疫优势表位,采用短期体外t细胞扩增的方法提高lpp20特异性t细胞的比例。这种鉴定方法还需要大量的重叠合成肽,比较昂贵和费时,但最终我们找到合适的cd4+t细胞表位(seqidno.14和seqidno.36),可靠、准确。更重要的是还能使我们能够评估所鉴定的表位是免疫优势还是亚优势。本发明不仅有利于进一步理解抗h.pylori感染的保护性免疫机制,更有助于表位疫苗的设计。然而,h.pylori有大量基因组,编码许多保护性抗原。因此,有必要更好地理解cd4+t细胞反应在其他h.pylori编码抗原的特性和鉴定其他hla等位基因限制的免疫优势cd4+t细胞表位。附图说明图1lpp20特异性cd4+t细胞在h.pylori感染者中的反应。分离受试者pbmc,先用0.2μmol/lrlpp20刺激,13天后用lpp20重叠合成肽库(5μmol/l)刺激,ics法检测分泌ifn-γ的cd4+t细胞的比例,dmso刺激作为对照。(a)h.pylori未感染者n1;(b)h.pylori感染者h1。(c)分离30个h.pylori未感染者(-)和30个h.pylori感染者(+)pbmc,用以上所述方法检测分泌ifn-γ的cd4+t细胞的比例。图2lpp20的免疫优势cd4+t细胞表位的筛选和鉴定。分离h.pylori感染者pbmc,先用0.2μmol/lrlpp20刺激,13天后再用27个18mer重叠肽(5μmol/l)分别刺激,ics法检测分泌ifn-γ的cd4+t细胞的比例,a-f分别代表h.pylori感染者h1、h6、h11、h16、h21和h26。图3免疫优势表位l55-72和l79-96的核心序列的筛选和鉴定。分离h.pylor感者h1和h6的pbmc,先用0.2μmol/lrlpp20刺激,13天后用5μmol/l13mer重叠肽刺激,ics法检测分泌ifn-γ的cd4+t细胞的比例。(a)利用步移重叠13mer肽对l55-72的核心序列进行筛选。(b)利用步移重叠13mer肽对l79-96的核心序列进行筛选。(c)滴定l55-72,l57-69和l59-71(5×10-9mol/l~5×10-5mol/l)并比较活性。(d)滴定l79-96,l83-95和l85-97(5×10-9mol/l~5×10-5mol/l)并比较活性。图4免疫优势表位l55-72和l79-96hla限制性的鉴定。分离h.pylori感染者h6和h1的pbmc,体外扩增建立lpp20的特异性t细胞系,加入抗hla-dr,hla-dp或hla-dq抗体处理30min,用l57-69或l83-95刺激,ics法检测分泌ifn-γ的cd4+t细胞的比例。(a)l55-72的hla限制性分析。(b)l83-95的hla限制性分析。(c)含有不同hla分型的一组blcls,用作apc,递呈13mer肽。(d)l55-72的hla-dr亚型分析。(e)l83-95的hla-dr亚型分析。图5l57-69和l83-95被自体dc自然加工和递呈。(a)l57-69、rlpp20、hp-wcl或bsa刺激dc24h,加入莫能霉素,然后与感染者h6的l57-69特异性t细胞共同培养5h,用ics测定分泌ifn-γ的cd4+t细胞的比例。(b)用同样的方法测定感染者h1的l83-95特异性t细胞的反应。图6小鼠免疫l57-69和l83-95的特异性cd4+t细胞反应。(a)小鼠免疫l57-69和l83-95,分离单核细胞,再分别用l57-69、l83-95、rlpp20体外刺激,进行淋巴细胞增殖分析,对照组小鼠免疫pbs,每个实验重复3次,所有数据都用平均数±标准差表示。当si≥2时认为具有统计学意义,用*表示。(b)流式细胞术分析cd3+cd4+t细胞相对百分比。小鼠免疫l57-69和l83-95,分离单核细胞进行染色,对照组免疫pbs。每个实验重复3次,所有数据都用平均数±标准差表示,当p<0.05表示实验组相对于对照组有统计学意义,用*表示。图7免疫优势表位肽刺激cd4+t细胞分泌细胞因子。(a)分离免疫表位肽小鼠cd4+t细胞,与表位肽l57-69和l83-95孵育72h,收集上清,elisa检测ifn一γ和il一4,对照组不加肽。每个实验重复3次,结果用平均数±标准差表示。当实验组与对照组比较具有显著性差异(p<0.05),用*标记。(b)分离免疫表位肽小鼠cd4+t细胞,荧光定量pcr检测cd4+t细胞ifn一γ和il一4的mrna表达,β-actin作为内参,对照组为免疫pbs。每个实验重复3次,结果用平均数±标准差表示。当实验组与对照组比较具有显著性差异(p<0.05),用*标记。具体实施方式以下结合具体实施例对本发明的重组抗原和合成肽,作进一步详细的说明。除非另有定义,本发明所使用的所有的技术和科学术语与属于本发明的
技术领域:
的技术人员通常理解的含义相同。本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不用于限制本发明。本发明所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。为了便于理解本发明,下面将对本发明进行更全面的描述。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本发明的公开内容的理解更加透彻全面。以下实施例中所使用的试剂或原料,如无特殊说明,均来源于市售。实施例11方法和材料1.1患者和血样样本的收集按照广州南方医科大学附属南方医院的人类伦理审查委员会批准的方案进行,所有参与者都给予书面知情同意书。由内窥镜和病理诊断确诊30名胃疾病患者的h.pylori感染状况。收集血样,采用ficoll-hypaque(tbdscience、天津、中国)密度梯度法分离外周血单核细胞(pbmcs),然后储存在液氮中。用pcr-sbt鉴定h.pylori患者pbmc的hla分型,由华大基因研究院(中国深圳)鉴定。1.2重组抗原和合成肽h.pylorinctc11639株的重组lpp20(rlpp20)在e.coli的表达和纯化参照文章[liy,ningys,wangyd,hongyh,luoj,dongwqandlim.productionofmousemonoclonalantibodiesagainsthelicobacterpylorilpp20andmappingtheantigenicepitopebyphagedisplaylibrary.jimmunolmethods.2007;325(1-2):1-8],储存在-70℃。lpp20蛋白的氨基酸序列从ncbi蛋白数据库(no.aaz13599,由我们提交)获得。覆盖lpp20蛋白的18mer合成肽,重叠12个氨基酸(表1),及13mer合成肽,重叠11个氨基酸(表2和表3)由上海glbiochem公司合成和纯化(纯度>95%)。合成肽都溶解在二甲基亚砜(dimethylsulfoxide,sigma,中国上海),存储在-80℃。表1覆盖lpp20蛋白的18mer合成肽表2覆盖l55-72的13mer合成肽locationsequenceseqidnol53-65flvakyekysgvf28l55-67vakyekysgvflg29l57-69kyekysgvflgra30l59-71ekysgvflgraed31l61-73ysgvflgraedli32表3覆盖l79-9613mer合成肽locationsequenceseqidnol77-89dvdystnqataka33l79-91dystnqatakara34l81-93stnqatakaranl35l83-95nqatakaranlaa36l85-97atakaranlaanl371.3体外扩增h.pylori感染者lpp20特异性cd4+t细胞系用0.2μmol/llpp20(或5μmol/l的免疫优势肽)刺激pbmc(1-2×106),在48孔细胞培养板上用rpmi1640(gibco)培养,含5%人类ab血清,2mmol/ll-谷酰胺,5×10-5mol/l2-巯基乙醇(2-mercaptoethanol,2-me)和抗生素(青霉素100u/ml,链霉素100μg/ml)在。第五天,用含10u/ml重组人白介素-2(il-2)的上述培养液换掉50%的培养基,当培养基变黄时用含25u/mlil-2换掉50%的培养基。培养的细胞第10天分裂,第13天收集细胞。1.4系统筛选lpp20cd4+t细胞表位从h.pylori感染者捐赠的200ml血液中分离pbmc,用0.2μmol/lrlpp20刺激,第13天后,筛选lpp20特异性t细胞。随后筛选13mer合成肽,以确定免疫优势cd4+t细胞表位的核心序列。1.5eb病毒转化的b淋巴细胞系(epstein-barrvirustransformedblymphoblastoidcelllines,blcls)的制备和培养利用产eb病毒的b95-8细胞培养上清,在自体pbmc建立blcls,用含10%胎牛血清(gibco),2mmol/ll-谷酰胺,5×10-5mol/l2-巯基乙醇和抗生素(青霉素100u/ml,链霉素100μg/ml)rpmi-1640(gibco)进行培养。1.6胞内细胞因子染色(intracellularcytokinestaining,ics)在18mer和13mer肽的筛选实验中,大量培养的lpp20特异性t细胞与5μmol/l肽在含有莫能菌素(monensin,中国上海bectondickinson公司)的培养基中孵育5h。在测定hla限制性的实验中,先用5μmol/l肽刺激blcls1h,然后加入莫能菌素,blcls和lpp20特异性t细胞按1:10的比例共培养5h。收集细胞,首先在50μl染色缓冲液(pbs含有1%热灭活的fcs)中进行抗cd3-pe和抗cd4-apc(biolegend,北京)染色30min,4℃,用固定/穿透液(bdcat,no.554715)清洗和固定20min,4℃,然后清洗、固定和用抗ifn-γ-fitc(biolegend,北京)染色。facscantoⅱ流式细胞分析仪(bectondickinson)获得1×105细胞,用flowjo软件(treestar,ashland,or)分析数据。在抗体阻断实验中,在加入肽和莫能菌素前,先用抗原提呈细胞(apc)与5μg/mlhla-dp(abcam)、hla-dr(biolegend)和hla-dq(biolegend)孵育30min,随后t细胞激活用ics测定。1.7制备h.pylori完整的细胞裂解物(hpyloriwholecelllysates,hp-wcl)将h.pylorinctc11637株涂在脑心浸液(brain-heartinfusion,bhi)板上,含7%山羊血、多粘菌素b(5μg/ml),甲氧苄氨嘧啶(5μg/ml)和万古霉素(10μg/ml),然后在含5%胎牛血清布氏肉汤中培养,37℃轻摇,微氧(10%co2、5%o2、n210%)。培养1天后,收集活菌,洗涤和裂解细胞,4℃,10000g,离心裂解产物20min,去除完整的细胞和大的碎片,超声上清液即为h.pylori完整的细胞溶解产物(hp-wcl)。用bca蛋白分析试剂盒(beyotime、上海、中国)测定蛋白含量,分装,-20℃储存。1.8树突状细胞(dendriticcells,dc)的制备及与免疫优势表位特异性t细胞共培养解冻pbmc,用cd14+微磁珠(miltenyibiotec,上海,中国)从pbmc中分离cd14+细胞,在含5%人ab血清,10ng/ml白介素4(interleukin-4,il-4)和20ng/ml粒-巨细胞集落刺激因子(granulocyte-macrophagecolony-stimulatingfactor,gm-csf)rpmi1640中培养,5%co2,37℃。第6d后,收集dc,分别用50μg/ml的免疫优势表位(l57-69或l83-95)、rlpp20、hp-wcl和bsa刺激24h。然后洗涤细胞,加入莫能菌素,dc与表位特异性t细胞按1:10的比例共培养5h。1.9rlpp20和免疫优势表位肽免疫balb/c小鼠选择6~8周龄的spf级雌性balb/c小鼠,首次用rlpp20加完全弗氏佐剂(completefreund’sadjuvant,cfa)皮下多点注射免疫,每只小鼠100μg/0.5ml,3周后用同样剂量的rlpp20加不完全弗氏佐剂(incompletefreund’sadjuvant,ifa)加强免疫一次。对照组小鼠用pbs替代rlpp20免疫,免疫程序相同,每组5只小鼠。用l57-69和l83-95分别对balb/c小鼠进行免疫,首次用ifa皮下多点注射免疫,每只小鼠100μg/0.5ml,间隔14天加强免疫一次,共免疫三次,每组5只小鼠。对照组小鼠用pbs替代表位多肽,免疫程序相同,每组5只小鼠。1.10淋巴细胞增殖实验在小鼠末次免疫14天后脱臼处死,无菌取出脾脏,钢网上碾磨制备单细胞悬液,用小鼠淋巴细胞分离液分离单个核细胞,rpmi-1640完全培养基调整细胞数为5×106/ml于96孔培养板,每孔加入100μl细胞,同时加入稀释好的表位多肽l57-69、l83-95(1.25μg/ml)及rlpp20(15μg/ml),阴性对照孔不加任何抗原,终体积为200μl/孔,每组做3个平行孔,37℃、5%co2孵箱培养5天,于结束培养前12h加入3h-tdr,37kbq/孔,继续培养12h后将细胞收集于玻璃纤维滤纸上,烘干后用液闪计数仪测定每分钟脉冲数(cpm),计算3个复孔的均值,结果以刺激指数(si)表示(si=实验组cpm均值/阴性对照组cpm均值,阴性对照指不加抗原刺激的孔),si≥2为阳性。1.11流式细胞分析在小鼠末次免疫14天后脱臼处死,无菌取出脾脏,制备单细胞悬液,用小鼠淋巴细胞分离液分离单个核细胞,用l57-69和l83-95分别刺激72h,收集1×106个细胞,与抗鼠cd16/cd32(clone93,ebiosciensce)孵育10分钟,排除非特异的fc受体介导的结合。用冷pbs(2%牛血清白蛋白)洗涤细胞,再用pe-cd4(clonerm4-5,ebiosciensce)和fitc-cd3(克隆145-2c11)在冰上双染30min,收集样品在流式细胞仪上分析。1.12elisa和荧光定量pcr检测细胞因子在小鼠末次免疫14天后脱臼处死,无菌取出脾脏,制备单细胞悬液,用小鼠淋巴细胞分离液分离单个核细胞,再用磁珠法分离cd4+t细胞,悬浮于24孔培养板,每孔加入cd4+t细胞5×105,丝裂霉素(mitomycin)-c(500μg/ml)处理脾单个核细胞5×105(作为apc),同时加入稀释好的免疫优势表位肽(终浓度1.25μg/mgl),阴性对照孔不加肽,终体积为0.5ml/孔,每组做3个平行孔。刺激72h后收集上清400μl,用elisa试剂盒检测细胞因子ifn一γ和il-4。另外,用tripure试剂提取cd4+t细胞总rna。利用sybrgreen方法,用荧光定量pcr(q-pcr)检测ifn一γ和il-4mrna表达水平,引物如下,β-actin作为内参。ifn一γ:上游引物:5’一aactcaagtggcatagatgtgg—3’seqidno.38下游引物:5’一gacctcaaacttggcaatactc一3’seqidno.39il-4:上游引物:5’一tgtcatcctgctcttctttctc一3’seqidno.40下游引物:5’一tgatgctctttaggctttccag一3’seqidno.41β-actin:上游引物:5’一atccgtaaagacctctatgccaaca一3’seqidno.42下游引物:5’一gtcgccttcaccgttccagttt一3’seqidno.431.13统计分析用配对student’st检验分析两组之间的差异,但当方差不齐时,用非配对welch’st检验。当p<0.05,差异被认为具有统计学意义。2结果2.1lpp20特异性cd4+t细胞在h.pylori感染者中的频率高于h.pylori未感染者为了评估lpp20特异性cd4+t细胞在h.pylori感染者中的反应,从h.pylori感染者血液中分离pbmc,用覆盖lpp20全长的18mer肽刺激后,ics检测lpp20特异性cd4+t的频率。然而,lpp20特异性cd4+t细胞的频率太低,体外难以检测(图1a)。细胞扩大培养通常是低频率反应所必需的,特别是在鉴定表位方面。因此,先用rlpp20刺激pbmcs扩大培养lpp20特异性cd4+t细胞,体外刺激13天后lpp20特异性cd4+t细胞的频率明显升高(图1b)。为了进一步证实h.pylori感染者存在lpp20特异性cd4+t细胞反应而h.pylori未感染者没有,检测30个h.pylori感染者和30个非h.pylori感染者pbmc中lpp20特异性cd4+t细胞反应,结果显示lpp20特异性cd4+t细胞的频率在h.pylori感染组明显高于h.pylori未感染组(图1c)。这些结果表明,在体外rlpp20刺激过的细胞能够识别抗原曾致敏过的cd4+t细胞。2.2lpp20特异性cd4+t细胞主要识别l55-72和l79-96两个表位为了系统地探讨lpp20特异性cd4+t细胞反应的特异性和全面性,分离h.pylori感染者pbmc,先用rlpp20刺激,13天后再用27个18mer重叠肽分别刺激进行筛选免疫优势表位,结果显示lpp20特异性cd4+t细胞主要识别l55-72和l79-96两个表位(图2)。患者h6、h11和h26的lpp20特异性cd4+t细胞主要识别l55-72(图2b,2c和2f),而患者h1,h16和h21的lpp20特异性cd4+t细胞主要识别l79-96(fig.2a,2d和2e)。综上所述,l55-72和l79-96是lpp20免疫优势cd4+t细胞表位。2.3l57-69和l83-95分别是免疫优势表位l55-72和l79-96的核心序列为了进一步确定lpp20的免疫优势cd4+t细胞表位l55-72和l79-96的核心序列,按如上所述的方法扩增培养这两个表位的特异性t细胞,用一组覆盖18mer肽的13mer重叠肽和各种n端和c端扩展或截断的13mer肽(表2和表3)进一步筛选和滴定。对于患者h6,l55-72特异性cd4+t细胞识别两个13mer肽(l57-69和l59-71)。l57-69刺激t细胞的反应比l59-71更强一些,表明这个13mer肽是核心序列(图3a),进一步对l55-72,l57-69和l59-71(5×10-9mol/l~5×10-5mol/l)进行滴定也证实了这个结论(图3b)。对于患者h1,l79-96特异性cd4+t细胞识别两个13mer肽(l83-95和l85-97)。l83-95刺激t细胞的反应比l79-96更强一些,表明这个13mer肽是核心序列(图3c),进一步对l79-96、l83-95和l85-97(5×10-9mol/l~5×10-5mol/l)进行滴定也证实了这个结论。综上所述,lpp20最有效和最小的免疫优势cd4+t细胞表位是l57-69和l83-95。2.4l57-69和l83-95反应性cd4+t细胞的限制性分别是hla-drb1*1501和hla-drb1*1602为了确定l57-69和l83-95分子的hla限制性,用mhc-ii类抗体阻断实验进行鉴定。分离h.pylori感染者h6的pbmc,体外扩增建立lpp20的特异性t细胞系,加入抗hla-dr,hla-dp或hla-dq抗体处理,用l57-69刺激,ics法检测分泌ifn-γ的cd4+t细胞的比例。如图4a所示,抗hla-dr抗体抑制l57-69特异性cd4+t细胞分泌ifn-γ,而抗hla-dp和hla-dq抗体没有这种作用。用同样的方法又确定l83-95的hla限制性,分离h.pylori感染者h1的pbmc,体外扩增建立lpp20的特异性t细胞系,加入抗hla-dr,hla-dp或hla-dq抗体处理,用l83-95刺激,进行ics实验。抗hla-dr抗体抑制l83-95特异性cd4+t细胞分泌ifn-γ,而抗hla-dp和hla-dq抗体没有这种作用(图4b)。因此,表位l57-69和l83-95都是hla-dr限制性。为了进一步明确l57-69的hla-dr亚型,以一组不同dr亚型的blcls(图4c)作为apc,用5μmol/ll57-69刺激,ics法检测l57-69特异性t细胞的反应。如图4d所示,h.pylori感染者h6的自体blcls(表达hla-drb1*08031501)有效激活l57-69特异性t细胞,感染者h11和h26的blcls表达hla-drb1*1501,均可刺激l57-69特异性t细胞,而感染者h22和h27的blcls虽然都表达hla-drb1*0803,但未能递呈l57-69。因此,l57-69的限制性是hla-drb1*1501。又用同样的方法鉴定了l83-95的hla-dr限制性,以一组不同dr分型的blcls(图4c)作为apc,用5μmol/ll83-95刺激,ics法检测l83-95特异性t细胞分泌ifn-γ的反应。h.pylori感染者h1的自体blcls(表达hla-drb1*09011602)有效激活l83-95特异性t细胞,感染者h16和h21的blcls表达hla-drb1*1602,均可刺激l83-95特异性t细胞,而感染者h17和h22的blcl虽然都表达hla-drb1*0901,但未能递呈l83-95。因此,l83-95的限制性是hla-drb1*1602(图.4e)。2.5l57-69和l83-95可以被抗原呈递细胞(apc)自然加工和提呈为了评估l57-69和l83-95是否能被apc递呈,通过apc负载rlpp20或hp-wcl对表位的自然递呈特性进行鉴定。先用rlpp20、hp-wcl、bsa或免疫优势表位肽刺激树突状细胞(dc)24h,然后加入莫能霉素与表位特异性t细胞培养5h,采用ics和流式细胞仪检测表位特异性cd4+t细胞分泌ifn-γ的能力,评估相应表位特异性t细胞识别apc的能力。如图5a所示,被l57-69、rlpp20、hp-wcl刺激的h.pylori患者h6的dc能递呈l57-69,激发l57-69特异性cd4+t细胞反应。然而,被bsa或dmso刺激的dc刺激l57-69特异性cd4+t细胞仅为背景水平。用同样的方法,我们也证实l79-96能被自体dc自然加工和递呈(图5b)。2.6免疫优势表位肽免疫小鼠,刺激cd4+t细胞增殖为了检测免疫优势表位是否能够诱导机体产生特异性的cd4+t细胞免疫应答,并且引发的免疫应答是否针对rlpp20。用l57-69和l83-95分别对balb/c小鼠进行免疫,分离单个核细胞,用3h-tdr方法检测t淋巴细胞增殖实验。如图6a所示,从l57-69和l83-95免疫的balb/c小鼠中分离的单核细胞分别经l57-69和l83-95和rlpp20刺激后能引起增殖反应,而对照小鼠对任何刺激都不反应,表明l57-69和l83-95诱发的淋巴细胞反应识别天然抗原rlpp20。另外,用流式细胞术分析发现l57-69和l83-95分别免疫小鼠后cd4+cd3+比例高于对照组(p<0.05,图6b)。2.8免疫优势表位肽刺激cd4+t细胞向th1细胞分化为了分析筛选出的表位诱导cd4+t细胞的分化方向,分离表位肽免疫小鼠的cd4+t细胞,与表位肽共培养,收集上清,elisa检测ifn一γ和il一4。从图7a结果分析,l57-69和l83-95表位肽主要引起inf-γ的分泌。另外,用荧光定量pcr方法检测cd4+t细胞ifn一γ和il-4的mrna表达水平,如图7b所示,ifn一γ的mrna表达水平高于il-4。以上结果表明免疫优势表位肽刺激cd4+t细胞向th1细胞分化。本发明中,lpp20特异性cd4+t细胞在h.pylori感染组中的比例高于未感染组(图1c)。事实上,在一些h.pylori未感染者样本中发现低水平的lpp20特异性cd4+t细胞反应(图1c)。我们认为这可能由于短暂的或轻微的h.pylori感染者被诊断为假阴性的结果。然后,我们通过体外扩增培养的lpp20特异性t细胞和18mer重叠肽,系统地评估了h.pylori感染者lpp20特异性cd4+t细胞反应程度和强弱,反应主要集中在两个18mer肽(l55-72和l79-96)(图2)。l55-72诱导患者h6,h11,h26产生更多的t细胞反应,l79-96诱导患者h1,h16h21产生更多的t细胞反应(图2)。随后再用13mer重叠肽鉴定l55-72和l79-96的核心序列,分别是l57-69和l83-95(图3)。因为mhc分子在哺乳动物中具有高度多态性,同一物种的mhc等位基因通常递呈不同的肽,更不用说不同物种的mhc等位基因。例如,在所报道的h.pyloriurebcd4+t表位中,没有一个可以同时被鼠和人的cd4+t细胞反应识别。因此,鉴定不同hla限制性的免疫优势t细胞表位对于合理设计h.pylorit细胞疫苗至关重要。然而,目前只有少数hla限制性的ureb和hpaa抗原cd4+t细胞表位被鉴定,不同hla等位基因的个体之间具有不同的免疫优势表位]。等位基因频率网络数据库(http://www.allelefrequencies.net/default.asp)显示hla-drb1*1501的频率在中国汉族人口相对比较高(>10%),而hla-drb1*1404和hla-drb1*0803的频率在中国汉族人口相对低(<1%)。然而,hla-drb1*0803在在其他一些人群比较常见,如澳大利亚土著居民(>20%)、巴布亚新几内亚和台湾本地人(>10%)。chen等证明hpaa88-100特异性cd4+t细胞反应在表达hla-drb1*1501的个体中是免疫优势反应,且与降低严重胃疾病密切相关。有趣的是,hla-drb1*0901特异性cd4+t细胞反应在hla-drb1*1501阴性组中最具免疫优势性。在本发明中,l57-69和l83-95主要能引起hla-dr基因型病人的cd4+t细胞反应,用抗体阻断实验进一步测定hla-dr的分型。用不同hla等位基因的blcls作为apc递呈表位肽,与cd4+t细胞反应,我们发现l57-69和l83-95的限制性分别是hla-drb1*1501和hla-drb1*1602,不仅能识别负载表位肽的自体dc,还能识别负载rlpp20和hp-wcl的dc,表明l57-69和l83-95能被apc自然加工和递呈。因此,hla-drb1*1501限制性的l57-69和hla-drb1*1602限制性的l83-95可能对于h.pylori疫苗的研制具有潜在的应用价值。我们将免疫优势表位肽分别免疫小鼠,发现能引起cd4+t细胞的增殖和分泌ifn-γ,说明表位肽具有很好的免疫原性并促进cd4+t细胞向th1细胞分化。以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。序列表<110>南方医科大学<120>幽门螺旋杆菌免疫优势表位肽l<sub>79-96</sub>及其应用<160>43<170>siposequencelisting1.0<210>1<211>18<212>prt<213>人工序列(artificialsequence)<400>1metlysasnglnvallyslysileleuglymetservalilealaala151015metval<210>2<211>18<212>prt<213>人工序列(artificialsequence)<400>2lysileleuglymetservalilealaalametvalilevalglycys151015serhis<210>3<211>18<212>prt<213>人工序列(artificialsequence)<400>3valilealaalametvalilevalglycysserhisalaprolysser151015glyile<210>4<211>18<212>prt<213>人工序列(artificialsequence)<400>4ilevalglycysserhisalaprolysserglyileserlysserasn151015lysala<210>5<211>18<212>prt<213>人工序列(artificialsequence)<400>5alaprolysserglyileserlysserasnlysalatyrlysgluala151015thrlys<210>6<211>18<212>prt<213>人工序列(artificialsequence)<400>6serlysserasnlysalatyrlysglualathrlysglyalaproasp151015trpval<210>7<211>18<212>prt<213>人工序列(artificialsequence)<400>7tyrlysglualathrlysglyalaproasptrpvalvalglyaspleu151015glulys<210>8<211>18<212>prt<213>人工序列(artificialsequence)<400>8glyalaproasptrpvalvalglyaspleuglulysvalalalystyr151015glulys<210>9<211>18<212>prt<213>人工序列(artificialsequence)<400>9valglyaspleuglulysvalalalystyrglulystyrserglyval151015pheleu<210>10<211>18<212>prt<213>人工序列(artificialsequence)<400>10valalalystyrglulystyrserglyvalpheleuglyargalaglu151015aspleu<210>11<211>18<212>prt<213>人工序列(artificialsequence)<400>11tyrserglyvalpheleuglyargalagluaspleuilethrasnasn151015aspval<210>12<211>18<212>prt<213>人工序列(artificialsequence)<400>12glyargalagluaspleuilethrasnasnaspvalasptyrserthr151015asngln<210>13<211>18<212>prt<213>人工序列(artificialsequence)<400>13ilethrasnasnaspvalasptyrserthrasnglnalathralalys151015alaarg<210>14<211>18<212>prt<213>人工序列(artificialsequence)<400>14asptyrserthrasnglnalathralalysalaargalaasnleuala151015alaasn<210>15<211>18<212>prt<213>人工序列(artificialsequence)<400>15alathralalysalaargalaasnleualaalaasnleulysserthr151015leugln<210>16<211>18<212>prt<213>人工序列(artificialsequence)<400>16alaasnleualaalaasnleulysserthrleuglnlysaspleuglu151015asnglu<210>17<211>18<212>prt<213>人工序列(artificialsequence)<400>17leulysserthrleuglnlysaspleugluasnglulysthrargthr151015valasp<210>18<211>18<212>prt<213>人工序列(artificialsequence)<400>18lysaspleugluasnglulysthrargthrvalaspalaserglylys151015argser<210>19<211>18<212>prt<213>人工序列(artificialsequence)<400>19lysthrargthrvalaspalaserglylysargserileserglythr151015aspthr<210>20<211>18<212>prt<213>人工序列(artificialsequence)<400>20alaserglylysargserileserglythraspthrglulysileser151015glnleu<210>21<211>18<212>prt<213>人工序列(artificialsequence)<400>21ileserglythraspthrglulysileserglnleuvalasplysglu151015leuile<210>22<211>18<212>prt<213>人工序列(artificialsequence)<400>22glulysileserglnleuvalasplysgluleuilealaserlysmet151015leuala<210>23<211>18<212>prt<213>人工序列(artificialsequence)<400>23valasplysgluleuilealaserlysmetleualaargtyrvalgly151015lysasp<210>24<211>18<212>prt<213>人工序列(artificialsequence)<400>24alaserlysmetleualaargtyrvalglylysaspargvalpheval151015leuval<210>25<211>18<212>prt<213>人工序列(artificialsequence)<400>25argtyrvalglylysaspargvalphevalleuvalglyleuasplys151015glnile<210>26<211>18<212>prt<213>人工序列(artificialsequence)<400>26argvalphevalleuvalglyleuasplysglnilevalasplysval151015argglu<210>27<211>19<212>prt<213>人工序列(artificialsequence)<400>27glyleuasplysglnilevalasplysvalargglugluleuglymet151015vallyslys<210>28<211>13<212>prt<213>人工序列(artificialsequence)<400>28pheleuvalalalystyrglulystyrserglyvalphe1510<210>29<211>13<212>prt<213>人工序列(artificialsequence)<400>29valalalystyrglulystyrserglyvalpheleugly1510<210>30<211>13<212>prt<213>人工序列(artificialsequence)<400>30lystyrglulystyrserglyvalpheleuglyargala1510<210>31<211>13<212>prt<213>人工序列(artificialsequence)<400>31glulystyrserglyvalpheleuglyargalagluasp1510<210>32<211>13<212>prt<213>人工序列(artificialsequence)<400>32tyrserglyvalpheleuglyargalagluaspleuile1510<210>33<211>13<212>prt<213>人工序列(artificialsequence)<400>33aspvalasptyrserthrasnglnalathralalysala1510<210>34<211>13<212>prt<213>人工序列(artificialsequence)<400>34asptyrserthrasnglnalathralalysalaargala1510<210>35<211>13<212>prt<213>人工序列(artificialsequence)<400>35serthrasnglnalathralalysalaargalaasnleu1510<210>36<211>13<212>prt<213>人工序列(artificialsequence)<400>36asnglnalathralalysalaargalaasnleualaala1510<210>37<211>13<212>prt<213>人工序列(artificialsequence)<400>37alathralalysalaargalaasnleualaalaasnleu1510<210>38<211>22<212>dna<213>人工序列(artificialsequence)<400>38aactcaagtggcatagatgtgg22<210>39<211>22<212>dna<213>人工序列(artificialsequence)<400>39gacctcaaacttggcaatactc22<210>40<211>22<212>dna<213>人工序列(artificialsequence)<400>40tgtcatcctgctcttctttctc22<210>41<211>22<212>dna<213>人工序列(artificialsequence)<400>41tgatgctctttaggctttccag22<210>42<211>25<212>dna<213>人工序列(artificialsequence)<400>42atccgtaaagacctctatgccaaca25<210>43<211>22<212>dna<213>人工序列(artificialsequence)<400>43gtcgccttcaccgttccagttt22当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1