一种转氨酶突变体及其生产L-草铵膦的应用的制作方法
本发明属于生物工程
技术领域:
,涉及一种转氨酶基因、编码酶、含有该基因的重组载体、该重组载体转化得到的重组基因工程菌和重组酶、以及该ω-氨基转移酶在制备光学纯手性农药L-草铵膦中的应用。(二)
背景技术:
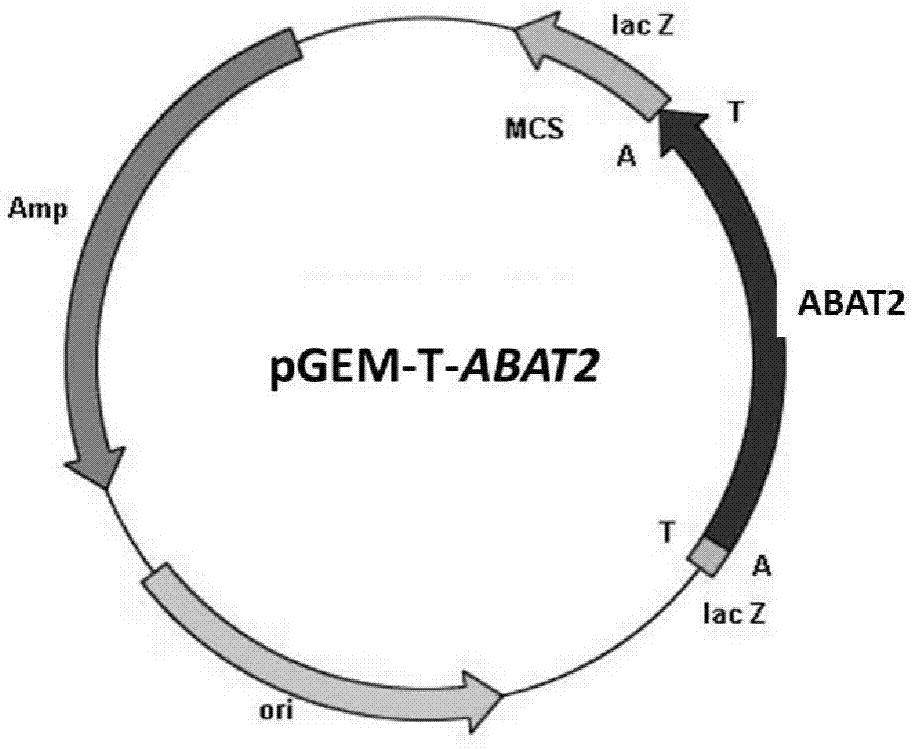
:草铵膦,英文名为:Phosphinothricin(简称PPT),一般是指化合物2-氨基-4-[羟基(甲基)膦酰基]-丁酸或其与碱性化合物形成的盐。是拜耳公司于上世纪80年代开发的一种高效、广谱、低毒的非选择性除草剂,是目前转基因抗性作物理想的除草剂,应用前景非常广阔。草铵膦具有两种对映异构体,但只有L-构型具有植物毒性,且在土壤中易分解,对人类和动物的毒性小,对环境的破坏力小。目前,市场上销售的草铵膦一般都是外消旋混合物。如果草铵膦产品能以L-构型的光学纯异构体形式使用,可使草铵膦的使用量降低50%,这对于提高原子经济性、降低成本、减轻环境压力都具有十分重要的意义。目前生成L-草铵膦的方法主要有化学合成法、发酵法、生物合成法。化学合成法主要包括盖布瑞尔(Gabriel)-丙二酸二乙酯合成法、内博(Neber)重排合成法、阿尔布佐夫(Arbuzov)合成法、高压催化合成法、布赫勒-贝格斯(Bucherer-Bergs)法、Strecker法合成、低温定向合成法、以L-蛋氨酸为原料的合成方法、不对称催化加氢合成法、不对称的氰基加成法、Michael自由基加成法。虽然不对称合成法的原子利用率比较高,但是不对称合成L-草铵膦通常步骤冗长,合成路线复杂,收率低,且不对称合成试剂价格昂贵,导致生产成本偏高,不利于大规模制备L-草铵膦。手性拆分法是通过化学合成手性拆分法是通过化学合成外消旋DL-草铵膦或其衍生物,再利用手性拆分试剂,进行D型和L型异构体的分离,从而制得光学纯的L-草铵膦。此工艺主要存在以下缺点,一是需要使用于性拆分试剂,二是D-草铵膦需要重新消旋再利用,三是单次拆分收率低,四是工艺比较复杂。相比之下,利用生物法具有立体选择性严格、反应条件温和、收率高及产物易分离纯化的优点。因此,生物法生产L-草铵膦具有潜在的产业价值和社会效益。生物合成法涉及到的酶类主要有:蛋白酶、脱乙酰基酶、转氨酶、酰胺酶、酯水解酶、腈水合酶。转氨酶是磷酸吡哆醛(PLP)依赖性酶,属于转移酶类,催化氨基与酮基互换的过程。它广泛存在于自然界中并在细胞的氮代谢过程中发挥着重要的氨基转移作用。转氨酶有很多优点,比如高对映体选择性和区域选择性、高的反应速率和稳定性等。正是因为这些优点,转氨酶成为工业上用于生产天然氨基酸、非天然氨基酸、手性胺、氨基醇和氨基糖等重要农药或医药中间体的常用酶之一。转氨作用是一个可逆反应,2-羰基-4-(羟基甲基膦酰基)丁酸(PPO)可在转氨酶的催化下通过逆反应生成L-草铵膦。美国专利US5221737报道了SchμLzA等人在上世纪90年就利用从E.coliK-12中分离到的转氨酶,以2-羰基-4-(羟基甲基膦酰基)丁酸为底物,L-谷氨酸作为氨基供体,催化转氨反应生产L-草铵膦(图1)。该转氨酶经固定化后安装至生物反应器,产物浓度达76.1g/L,最高产率为50g/(L·h),L-草铵膦的ee值超过99.9%。但这个工艺有两大缺陷,其一是原料PPO不能完全转化为L-PPT,转化率最高只有90%,其二是要使可逆反应向生成L-PPT的方向进行,需要4倍当量以上的L-谷氨酸作为氨基供体,过量的谷氨酸给分离带来了很大的麻烦。解决这一问题的途径之一就是利用L-天冬氨酸代替L-谷氨酸,L-天冬氨酸经转氨作用后生成草酰乙酸,草酰乙酸在水溶液中不稳定、易分解为丙酮酸,从而打破了转氨反应的平衡。鉴于此,美国专利US6335186.B1报道了在上述单酶反应体系下,增加一个草酰乙酸转氨酶,组成双转氨酶偶联反应体系(图5)。然而,在偶联反应中仍然需要使用谷氨酸,谷氨酸与自酮戊二酸的在反应中形成平衡,它们的结构与产品L-PPT极为类似,难以在分离纯化中加以去除,而且还增加了两种需要分离的杂质草酰乙酸和L-天冬氨酸。此外,使用两种酶的过程比使用一种酶更加难以优化。因此,在此工艺中PPO的转化率最高只有85%。BartschK等随后在中国申请的专利(中国专利CN1349561的中又提出了一条新工艺(如图6),他们筛远得到了能够直接利用L-天冬氨酸为氨基供体、特异性地转化2-羰基-4-(羟基甲基膦酰基)丁酸的草酰乙酸转氨酶。但此工艺效率低下,当底物PPO的浓度为552mmol/L、在几乎完全消耗大约700mmol/L的原料L-天冬氨酸的情况下,只生成251.9mmol/L的产物L-PPT,与此同时生成了大约234.5mmol/L的杂质丙酮酸,原料PPO的转化率只有52%。(三)技术实现要素:本发明目的是提供一种ω-转氨酶突变体,以及在合成L-草铵膦中的应用,提高底物转化率。本发明采用的技术方案为:本发明提供一种转氨酶突变体,所述突变体是将SEQIDNO:2所示氨基酸序列第23位的组氨酸取代为谷氨酰胺、第34位的精氨酸取代为脯氨酸、第116位的谷氨酸取代为缬氨酸、第325位的丙氨酸取代为甘氨酸、第397位的亮氨酸取代为谷氨酰胺、第415位的谷氨酸取代为天冬氨酸。本发明还提供一种所述转氨酶突变体的编码基因,所述编码基因的核苷酸序列为SEQIDNO:3所示,以及由编码基因构建的载体和基因工程菌。本发明将转氨酶突变体基因ABAT2-mut1同表达载体pET28a连接,构建了含有转氨酶突变体基因的异源表达重组质粒pET28a-ABAT2-mut1。将表达重组质粒pET28a-ABAT2-mut1转化至大肠杆菌E.coliBL21(DE3)中,获得含有重组质粒pET28a-ABAT2-mut1的重组大肠杆菌E.coliBL21(DE3)/pET28a-ABAT2-mut1。本发明还涉及一种所述转氨酶突变体在生物催化合成L-草铵膦中的应用,所述的应用以含有转氨酶突变体编码基因的重组大肠杆菌经发酵培养获得的湿菌体为生物催化剂,以2-羰基-4-(甲基羟基磷酰基)-丁酸(PPO)为底物,以磷酸吡哆醛(PLP)为辅酶、以氨基供体为辅底物,以6-9缓冲液为反应介质构成反应体系,在温度30-50℃(优选40℃)、搅拌速度150-250r/min(优选180r/min)的条件下进行生物催化反应,反应结束后,将反应液分离纯化,获得L-草铵膦;所述氨基供体为L-谷氨酸、L-天冬氨酸或L-丙氨酸中的一种或两种任意比例的混合。进一步,所述反应体系中,湿菌体用量终浓度为10~200g/L(优选10-60g/L,最优选20g/L),所述底物的加入终浓度为10~500mmol/L(优选20-100mmol/L,最优选20mmol/L),所述辅酶的加入终浓度为0.01~20mmol/L(优选0.6-2mmol/L,最优选1mmol/L),氨基供体加入终浓度为10~1750mmol/L(优选60~80mmol/L,最优选70mmol/L)。进一步,优选所述缓冲液为硼砂-硼酸缓冲液,pH8.0。进一步,优选所述氨基供体为L-丙氨酸。进一步,所述湿菌体按如下方法制备:将含有转氨酶突变体编码基因的工程菌接种至含有终浓度50μg/mL卡那霉素抗性的LB液体培养基,37℃,200rpm下培养12h,再以体积浓度1%接种量接种至新鲜的含有终浓度50μg/mL卡那霉素抗性的LB液体培养基中,于37℃,150rpm下培养至菌体OD600达0.6~0.8,加入终浓度为0.1mM的IPTG,28℃下诱导培养12h后,4℃、8000rpm离心10min,弃去上清液,收集湿菌体。进一步,所述反应液分离纯化的方法为:(1)预处理:取反应液减压浓缩至原体积的10-50%后调节pH值至2-5,获得预处理液;(2)将步骤(1)得到的预处理液,使用钠型001×7阳离子树脂进行离子交换、吸附,离子交换柱高径比为13:1,上样流速为1BV/h,上样后用超纯水冲洗4BV,L-草铵膦不吸附而丙氨酸会吸附,收集水洗液;(3)将步骤(2)收集到的水洗液以0.5BV/h的流速上样,使用氢型001×7树脂进行离子交换、吸附,离子交换柱高径比为13:1,上样后用超纯水冲洗4BV,随后以0.5BV/h的流速用2mol/L氨水洗脱,定时取样进行茚三酮显色反应,收集目标洗脱液(茚三酮反应显紫色的一段时间的洗脱液),获得含L-草铵膦的流出液;(4)将步骤(3)收集到的L-草铵膦流出液减压浓缩至恒重,加入混合溶剂和聚丙烯酰胺,加热使L-草铵膦溶解,在0℃条件下缓慢搅拌12小时使得L-草铵膦结晶析出后,将其置于冷冻真空干燥机内-80℃冷冻干燥,获得L-草铵膦晶体;所述混合溶剂是水/丙酮体积比为1:9的混合,所述混合溶剂体积用量以聚丙烯酰胺重量计为100-1000ml/g,所述聚丙烯酰胺与恒重的L-草铵膦质量比为20-25:1。本发明离子交换法原理为:当溶液pH小于氨基酸的等电点时,氨基酸呈阳离子形态;当溶液pH大于氨基酸的等电点时,氨基酸呈阴离子形态;当溶液pH处于氨基酸的等电点时,氨基酸呈兼性离子形态。通过选择合适的pH对氨基酸进行分离,运用超纯水-氨水控制pH,依次洗脱,收集含L-草铵膦的流出液。本发明的有益效果主要体现在:本发明提供了一种能表达转氨酶突变体及基因序列,该转氨酶突变体基因可与表达载体连接构建得到含该基因的表达重组质粒pET28a-ABAT2-mut1,再转化至大肠杆菌BL21(DE3)中,获得重组大肠杆菌,该大肠杆菌含有重组转氨酶,可以利用重组大肠杆菌作为生物催化剂进行生物催化反应,为L-草铵膦的生物催化合成提供了可供选择的新酶源。本发明重组转氨酶ABAT2突变体1作为生物催化剂,以2-羰基-4-(甲基羟基磷酰基)-丁酸为底物制备L-草铵膦,产物ee>99.9%,4h底物转化率为96.44%,突变前的转氨酶以4-(甲基羟基磷酰基)-2-羰基-丁酸为底物制备L-草铵膦,产物ee>99.9%,4h底物转化率为51.15%;本发明转氨酶突变体ABAT2-mit1在24h转化20mM的4-(甲基羟基磷酰基)-2-羰基-丁酸的转化率高达99.5%,相较于原始菌株pET28a-ABAT1在相同条件下24h转化率仅69.62%有很明显的提高。本发明方法的总收率98%,产物e.e.值达到99%。(四)附图说明图1为克隆载体pGEM-T-ABAT2重组质粒物理图谱。图2为pET28a-ABAT2重组质粒物理图谱。图3为转氨酶基因ABAT2低熔点琼脂糖凝胶(agarose)电泳图;其中,泳道1为DL2000DNAMarker;泳道2为转氨酶ABAT2的基因片段。图4为转氨酶的SDS-PAGE图:泳道M为蛋白质分子量Marker,泳道1为转氨酶ABAT2。图5为转氨酶催化底物4-(甲基羟基磷酰基)-2-羰基-丁酸,在氨基供体L-丙氨酸和辅酶磷酸吡哆醛的作用下,合成产物L-草铵膦的反应方程式。图6为中国专利CN1349561利用L-天冬氨酸为氨基供体、特异性地转化2-羰基-4-(羟基甲基膦酰基)丁酸的草酰乙酸转氨酶的反应方程式。(五)具体实施方式下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:本发明实施例中的各个反应体系,整个反应过程维持最初缓冲液的pH值。实施例1:转氨酶基因ABAT2的扩增假单胞杆菌(PseudomonasfluorescensZJB09-108)是从土壤中分离得到的,保存在中国典型培养物保藏中心(保藏编号CCTCCNO:M2012539,已在专利申请中公开,申请号CN201210593105.3,公开(公告)号CN103131649A)。根据Genbank收录的来自假单胞杆菌(WP_076423369.1)的转氨酶基因测序信息为依据,用核酸快速提取仪提取假单胞杆菌(菌体的总基因组DNA,以该基因组DNA为模板,在引物1(5’-ATGAACACCAACAACGCTC-3’)、引物2(5’-TTAAGCCTGTTTAGCTTC-3’)的作用下进行PCR扩增。PCR反应体系(总体积50μL):10×PfuDNAPolymeraseBuffer5μL,10mMdNTPmixture(dATP、dCTP、dGTP和dTTP各2.5mM)1μL,浓度均为50μM的克隆引物1、引物2各1μL,基因组DNA1μL,PfuDNAPolymerase1μL,无核酸水40μL。采用BioRad的PCR仪,PCR反应条件:预变性95℃5min,95℃变性30s,65℃退火45s,72℃延伸1min,共30个循环,最后72℃延伸10min。PCR反应液用0.9%琼脂糖凝胶电泳检测并切胶回收纯化该片段,利用TaqDNA聚合酶向片段5’端引入碱基A。在T4DNA连接酶作用下将该片段同pMD18-T载体进行连接,得到克隆重组质粒pMD18-T-ABAT2见图1。将该重组质粒转化至大肠杆菌JM109中,利用篮白斑筛选系统进行筛选,随机挑取白色克隆测序,利用软件分析测序结果,结果表明:经引物1和引物2扩增到的核苷酸序列长度为1275bp(ABAT2基因,其核苷酸序列如SEQIDNO:1所示,编码蛋白的氨基酸序列为SEQIDNO:2所示),该序列编码一个完整的开放阅读框。实施例2:重组大肠杆菌BL21(DE3)/pET28b-ABAT2的构建根据实施例1中的ABAT2基因序列设计引物3(5’-CCGCATATGAACACCAACAAC-3)、引物4(5’-TTGCTCGAGTTAAGCCTGTTTAGC-3’),并分别在引物3和引物4中引入了NdeI和XhoI限制性酶切位点(下划线标记)。在引物3和引物4的引发下,利用高保真PfuDNA聚合酶进行扩增,以重组质粒pMD18-T-ABAT2为模板(实施例1中获得),获ABAT2基因序列,测序后利用NdeI和XhoI限制性内切酶(TaKaRa)对扩增片段进行处理,并利用T4DNA连接酶(TaKaRa)将该片段同用相同的限制性内切酶处理的商业化载体pET28b(Invitrogen)进行连接,构建表达载体pET28b-ABAT2(图2)。将构建的表达载体pET28b-ABAT2转化至大肠杆菌BL21(DE3)(Invitrogen)中(42℃,90s),涂布于含有50μg/ml卡那霉素抗性的LB平板,37℃下培养8-12h,随机挑取克隆抽提质粒进行测序鉴定,筛选获得含有表达重组质粒pET28b-ABAT2的重组大肠杆菌BL21(DE3)/pET28b-ABAT2。实施例3:重组转氨酶(ABAT2)湿菌体的制备将实施例2获得的含有表达重组质粒pET28a-ABAT2的重组大肠杆菌E.coliBL21(DE3)/pET28a-ABAT2菌体接种至含有终浓度50μg/mL卡那霉素抗性的LB液体培养基,37℃,200rpm下培养12h,再以1%(v/v)接种量接种至新鲜的含有终浓度50μg/ml卡那霉素抗性的LB液体培养基中,于37℃,150rpm下培养至菌体OD600达0.6-0.8,加入终浓度为0.1mM的IPTG,28℃下诱导培养12h后,4℃、8000rpm离心10min,弃去上清液,收集沉淀,即获得含有表达重组质粒的重组大肠杆菌BL21(DE3)/pET28a-ABAT2湿菌体。该菌体可直接作为生物催化剂或者用于蛋白纯化。实施例4:ABAT2基因突变文库的建立以实施例2中构建质粒pET28b-ABAT2为模板,进行易错PCR。在引物1(5’-ATGAACACCAACAACGCTC-3’)、引物2(5’-TTAAGCCTGTTTAGCTTC-3’)的作用下进行易错PCR。PCR反应体系(总体积50μL):10×PfuDNAPolymeraseBuffer5μL,10mMdNTPmixture(dATP、dCTP、dGTP和dTTP各2.5mM)1μL,浓度均为50μM的克隆引物1、引物2各0.5μM,质粒模板0.8ng/μL,TaqDNAPolymerase2.5U,MnCl20.2mM,去离子水补足50μL。采用BioRad的PCR仪,PCR反应条件:预变性95℃5min,95℃变性30s,65℃退火45s,72℃延伸1min,共30个循环,最后72℃延伸10min。纯化易错PCR产物后,以该产物作为引物、实施例2中构建质粒pET28b-ABAT2为模板进行大引物PCR,获得大引物PCR产物(即突变体文库1)。PCR体系:大引物10ng/μL,质粒模板1ng/μL,PfuDNAPolymerase2.5U。PCR反应条件:去A尾72℃5min,预变性96℃2min,96℃变性30s,60℃退火45s,72℃延伸4min,共25个循环,最后72℃延伸10min。实施例5:基因突变文库筛选获得突变体ABAT2-mut1将实施例4基因突变文库转入大肠杆菌BL21(DE3)的感受态细胞中,转化条件42℃,热击90秒,在含有50μg/ml卡那霉素的LB抗性平板上挑取单克隆11287个,分别接种于含有50μg/ml卡那霉素的LB培养基中进行诱导表达,诱导条件如实施例3,获得11287个含有突变体基因的重组大肠杆菌湿菌体,即突变体湿菌体。在这11287个突变蛋白中,有9786个突变蛋白的活力低于原始蛋白,1476个突变蛋白的活力与原始蛋白相当,仅25个突变蛋白的活力显著高于原始蛋白(增加20%),其中底物的转化率最高的一个突变体pET28b-atal-mut1,转化率为96%,ee>99%得到含有突变蛋白的大肠杆菌后,对0.18g(10mM)草胺磷前体酮进行生物转化,催化体系(10ml)终浓度组成及催化条件如下:突变体湿菌体0.075g,Tris/HCl缓冲液(pH8.0),磷酸吡哆醛0.0248g,L-丙氨酸0.63g。反应条件:温度35℃、搅拌速度150r/min,反应时间24h。同样条件下,以无菌体加入的反应液作为空白对照,以含空载体的大肠杆菌BL21/pET28b湿菌体代替上述突变体湿菌体作为阴性对照。反应结束后,取样进行HPLC检测(50:50乙腈:水,10mM乙酸铵,0.8ml/min流速,268nm检测波长),从11287个蛋白中挑选出底物的转化率最高的一个突变体pET28b-ABAT2-mut1,转化率为97%,ee>99%。突变体pET28b-ABAT2-mut1的核苷酸序列与氨基酸序列如序列表中的SEQIDNo:3和SEQIDNo:4所示。突变体pET28b-ABAT2-mut1是将SEQIDNO:2所示氨基酸第23位的组氨酸取代为谷氨酰胺、第34位的精氨酸取代为脯氨酸、第116位的谷氨酸取代为缬氨酸、第325位的丙氨酸取代为甘氨酸、第397位的亮氨酸取代为谷氨酰胺、第415位的谷氨酸取代为天冬氨酸。将含有表达重组质粒pET28a-ABAT2-mut1的重组大肠杆菌E.coliBL21(DE3)/pET28a-ABAT2-mut1菌体接种至含有终浓度50μg/mL卡那霉素抗性的LB液体培养基,37℃,200rpm下培养12h,再以1%(v/v)接种量接种至新鲜的含有终浓度50μg/ml卡那霉素抗性的LB液体培养基中,于37℃,150rpm下培养至菌体OD600达0.6-0.8,加入终浓度为0.1mM的IPTG,28℃下诱导培养12h后,4℃、8000rpm离心10min,弃去上清液,收集沉淀,即获得含有表达重组质粒的重组大肠杆菌BL21(DE3)/pET28a-ABAT2-mut1湿菌体。该菌体可直接作为生物催化剂或者用于蛋白纯化。实施例6:含转氨酶ABAT2、突变体ABAT2-mut1的重组大肠杆菌活性测定分别以实施例3、实施例5方法制备含转氨酶ABAT2、突变体ABAT2-mut1全细胞,用于催化底物2-羰基-4-(甲基羟基磷酰基)-丁酸。催化体系组成及催化条件如下:10mLTris/HCl缓冲液(100mM,pH8.0)中加入转氨酶ABAT2或突变体ABAT2-mut1全细胞(菌体量终浓度为50g/L),2-羰基-4-(甲基羟基磷酰基)-丁酸(终浓度10mmol/L),PLP(终浓度1mmol/L),L-丙氨酸(终浓度70mM)构成10mL反应体系。35℃,转速180r/min条件下反应6h,取样HPLC检测底物的转化率。表1重组大肠杆菌(含转氨酶ABAT2)的活力测定菌株/质粒底物转化率大肠杆菌BL21(DE3)0大肠杆菌BL21(DE3)/pET28a0大肠杆菌BL21(DE3)/pET28a-ABAT269.62%大肠杆菌BL21(DE3)/pET28a-ABAT2-mut197.11%实施例7:转氨酶ABAT2突变体1在转氨过程中的条件优化以实施例5方法获得的含有表达重组质粒的重组大肠杆菌BL21/pET28a-ABAT2-mut1湿菌体作为生物催化剂,以2-羰基-4-(甲基羟基磷酰基)-丁酸为底物。(1)氨基供体的选择分别以L-天冬氨酸与L-谷氨酸、L-天冬氨酸、L-谷氨酸、L-丙氨酸为氨基供体,转化体系:配Tris-HCl缓冲液90mL,加入0.36g(20mM)PPO(草铵膦酮酸),0.3192g(24mM)L-天冬氨酸,0.00588g(4mM)L-谷氨酸,0.0247gPLP(终浓度1mM),ABAT2-mut1湿菌体量终浓度为50g/L,调pH至8,定容至100mL。将氨基供体分别换成0.3192g(终浓度24mM)L-天冬氨酸、1.176g(终浓度80mM)L-谷氨酸、0.6237g(终浓度70mM)L-丙氨酸。同时在35℃、180rpm下反应24h,分别取样,用超纯水稀释10倍,进行HPLC检测,转化率见表2:表2氨基供体对转化率的影响氨基供体转化率%L-天冬氨酸与L-谷氨酸63.48L-天冬氨酸28.16L-谷氨酸85.62L-丙氨酸89.69(2)缓冲体系的选择分别以磷酸氢二钠-柠檬酸缓冲液、磷酸缓冲液、Tris/HCl缓冲液、氨水、硼砂-硼酸缓冲液、氢氧化钠作为缓冲体系。转化体系1:以磷酸氢二钠-柠檬酸为缓冲液,加入0.18g(20mM)PPO(草铵膦酮酸),0.322g(70mM)L-丙氨酸,0.0124gPLP(1mM)、ABAT2-mut1湿菌体量为50g/L,调pH至6.0、6.5、7.0、7.5、8.0,定容至50mL,35℃、180rpm反应4h,HPLC检测,转化率结果见表3:表3pH对转化率的影响转化体系2:以磷酸氢二钠-磷酸二氢钠为缓冲液,分别加入0.18g(20mM)PPO(草铵膦酮酸),0.322g(70mM)L-丙氨酸,0.0124gPLP(1mM),ABAT2-mut1湿菌体量为50g/L,调pH至6.0、6.5、7.0、7.5、8.0,定容至50mL。35℃、180rpm反应4h,HPLC检测,转化率结果见表4:表4pH对转化率的影响转化体系3:以Tris/HCl为缓冲液,加入0.18g(20mM)PPO(草铵膦酮酸),0.322g(70mM)L-丙氨酸,0.0124gPLP(1mM),ABAT2-mut1湿菌体量为50g/L,调pH至6.0、6.5、7.0、7.5、8.0、8.5、9.0,定容至50mL。35℃、180rpm反应4h,HPLC检测,转化率结果见表5:表5pH对转化率的影响转化体系4:以氨水-L丙氨酸为缓冲液,称取0.18g(20mM)PPO(草铵膦酮酸),0.322g(70mM)L-丙氨酸,0.0124gPLP(1mM)、ABAT2-mut1湿菌体量为50g/L,pH调至7.0、7.5、8.0、8.5、9.0,定容至50mL。35℃、180rpm反应4h,HPLC检测,转化率结果见表6:表6pH对转化率的影响转化体系5:以硼砂-硼酸为缓冲液,加入0.18g(20mM)PPO(草铵膦酮酸),0.322g(70mM)L-丙氨酸,0.0124gPLP(1mM)、ABAT2-mut1湿菌体量为50g/L,pH最终调至7.5、8.0、8.5、9.0,定容至50mL。35℃、180rpm反应4h,转化率见表7:表7pH对转化率的影响转化体系6:以氢氧化钠-L丙氨酸为缓冲液,称取0.18g(20mM)PPO(草铵膦酮酸),0.322g(70mM)L-丙氨酸,0.0124gPLP(1mM),ABAT2-mut1湿菌体量为50g/L,调pH值分别9.0、9.5、10.0,定容至50mL。35℃、180rpm反应4h,HPLC检测,转化率见表8:表8pH对转化率的影响(3)温度优化转化体系:配硼砂-硼酸缓冲液,加入0.72g(20mM)PPO(草铵膦酮酸),1.2474g(70mM)L-丙氨酸,0.0248gPLP(1mM),ABAT2-mut1湿菌体量为50g/L,调pH至8.0,定容至200mL。分别在30℃、35℃、40℃、45℃、50℃的水浴锅下反应4h,HPLC检测,转化率见表9:表9温度对转化率的影响(4)菌体量优化转化体系:配硼砂-硼酸缓冲液,加入0.72g(20mM)PPO(草铵膦酮酸),1.2474g(70mM)L-丙氨酸,0.0248gPLP(1mM),ABAT2-mut1湿菌体用量终浓度分别为10、20、30、40、50、60g/L,调pH至8.0定容至200mL。每10mL反应体系称量0.1g、0.2g、0.3g、0.4g、0.5g、0.6g的菌体量ABAT2-mut1,在40℃、180rpm水浴锅下反应4h,HPLC检测,转化率见表10:表10菌体量对转化率的影响实施例8:辅酶PLP用量的优化转化体系:配硼砂-硼酸缓冲液,0.72g(20mM)PPO(草铵膦酮酸),1.2474g(70mM)L-丙氨酸,0.02mM至2mM梯度的PLP(表11),ABAT2-mut1湿菌体量为20g/L,调pH至8.0,定容至200mL。在40℃、180rpm水浴锅下反应4h,HPLC检测,转化率见表11:表11辅酶PLP用量对转化率的影响PLP量(mM)转化率/%0.0256.190.0461.450.0669.370.0873.160.175.980.278.120.479.320.681.340.885.981.089.451.588.13288.65实施例9:氨基供体L-丙氨酸用量的优化转化体系:配硼砂-硼酸缓冲液,0.72g(20mM)PPO(草铵膦酮酸),不同终浓度L-丙氨酸(见表12),0.0248gPLP(1mM),ABAT2-mut1湿菌体量为20g/L,调pH8.0,定容至200mL,在40℃、180rpm水浴锅下反应4h,HPLC检测转化率见表12:表12氨基供体L-丙氨酸用量对转化率的影响实施例10:转氨酶ABAT2-mut1突变体合成L-草铵膦反应进程配硼砂-硼酸缓冲液,0.36g(20mM)PPO(草铵膦酮酸),0.6237g(70mM)L-丙氨酸,0.0247gPLP(1mM),ABAT2-mut1湿菌体量为20g/L,调pH至8.0,定容至100mL。40℃、180rpm反应1-20h,HPLC检测,转化率见表13:表13时间对转化率的影响反应时间/h转化率/%173.53275.01380.83484.61587.76691.31891.501091.511292.471493.691696.321899.662099.702299.732499.512699.72实施例11:配硼砂-硼酸缓冲液,加入0.54g(100mM)PPO(草铵膦酮酸),0.9355g(350mM)L-丙氨酸,0.03705gPLP(5mM)、ABAT2-mut1湿菌体量为20g/L,调pH至8.0.,定容至30mL。40℃、180rpm反应不同时间,转化率见表14:表14实施例12:配硼砂-硼酸缓冲液,加入1.35g(250mM)PPO(草铵膦酮酸),2.339g(875mM)L-丙氨酸,0.09263gPLP(7.5mM)、ABAT2-mut1湿菌体量为20g/L,调pH至8.0,定容至30mL。40℃、180rpm反应,转化率见表15:表15反应时间/h转化率/%1085.921284.532485.794883.48实施例13:配硼砂-硼酸缓冲液,加入90g(500mM)PPO(草铵膦酮酸),156g(1750mM)L-丙氨酸,6.16gPLP(15mM)、ABAT2-mut1湿菌体量为20g/L,调pH至8.0,定容至1L。40℃、180rpm反应,24h转化率达71.62%。实施例14:从酶转化液中分离提取L-草铵膦的方法,具体步骤如下:1)取实施例13制备的1L酶转化液(主要成分180g/L丙氨酸、50g/LL-草铵膦、无机盐),在60℃条件下减压浓缩至原转化液体积为500mL,用2mol/L氢氧化钠水溶液调节pH至5,获得预处理液;2)将步骤1)得到的预处理液,使用钠型001×7阳离子树脂进行离子交换、吸附,离子交换柱高径比为13:1。上样流速为1BV/h,上样后用超纯水冲洗4BV,L-草铵膦不吸附而丙氨酸会吸附,收集水洗液;3)将步骤2)收集到的水洗液以0.5BV/h的流速上样,使用氢型001×7树脂进行离子交换、吸附,离子交换柱高径比为13:1。上样后用超纯水冲洗4BV,随后以0.5BV/h的流速用2mol/L氨水洗脱,定时取样进行茚三酮显色反应(反应过程为取一滴流出液滴在滤纸上,再滴上一滴2%茚三酮溶液,用吹风机吹干,若滤纸上出现紫色,则表示流出液含有L-草铵膦,若无紫色则表示流出液没有L-草铵膦),收集洗脱液(茚三酮反应显紫色的一段时间的洗脱液),获得含L-草铵膦的流出液;4)将步骤3)收集到的L-草铵膦流出液减压浓缩至恒重(57.9g),加入250ml混合溶剂(水/丙酮体积比为1:9)和2.5g聚丙烯酰胺,加热使L-草铵膦溶解,在0℃条件下缓慢搅拌12小时使得L-草铵膦结晶析出后,将其置于冷冻真空干燥机内-80℃冷冻干燥,获得L-草铵膦晶体。取出晶体后,迅速装入密封袋中,称重49.4g,计算收率为98.8%,纯度为99.0%。由以上实验结果可知,本发明得到的含有转氨酶基因的重组大肠杆菌具有较强的转氨能力,可直接以含酶的菌体细胞为酶源进行生物催化或者转化反应。转氨酶(BL21(DE3)/pET28a-ABAT2突变体1)作为转化用酶,可以利用2-羰基-4-(甲基羟基磷酰基)-丁酸为底物,进行生物转化反应制备高光学纯的农药:L-草铵膦。序列表<110>浙江工业大学<120>一种转氨酶突变体及其生产L-草铵膦的应用<160>4<170>SIPOSequenceListing1.0<210>1<211>1284<212>DNA<213>假单胞杆菌(Pseudomonasfluorescens)<400>1atgaacaccaacaacgctctgatgcagcgtcgtcacaacgctgttccgcgtggtgttggt60cagatccagccgatcttcgctgaacgtgctgaaaactgccctgtttgggacgttgaaggt120cgtgaatacctggacttcgctggtggtatcgctgttctgaacaccggtcacctgcacccg180ggtatcgtttctgctgttgaagctcagctgaaaaaactgtctcacacctgcttccaggtt240ctggcttacgaaccgtacctggctctgtgcgaacgtatgaaccagaaagttccgggtgac300ttcgctaaaaaaaccctgctggttaccaccggttctgaagctgttgtaaacgctgttaaa360atcgctcgtgctgctaccaaacgttctggtgctatcgctttctctggtgcttaccacggt420cgtacccactacaccctgtctctgaccggtaaagttcacccgtactctgctggtatgggt480ctgatgccgggtcacgtttaccgtgctctgtacccgtgcccgctgcacaacatctctgac540gacgacgctatcgcttctatcgaacgtatcttcaaaaacgacgctgctccggaagacatc600gctgctatcatcatcgaaccggttcagggtgaaggtggtttctacgctgcttctccggct660ttcatgcagcgtctgcgtgctctgtgcgaccagcacggtatcatgctgatcgctgacgaa720gttcagtctggtgctggtcgtaccggtaccctgttcgctatggaacagatgggtgttgct780gctgacatcaccaccttcgctaaatctatcgcgggcggcttcccgctggctggcgttacc840ggtcgtgctgacgttatggacgctatcgctccgggtggtctgggtggtacctacgctggt900aacccgatcgcttgcgctgctgctctggctgttcttgacatcttcgaacaggaaaacctg960ctgcagaaaggtaacaccctgggtaacaccctgcgtgacggtctgatggaaatcgctgaa1020acccaccgtgaaatcggtgacgttcgtggtctcggtgctatgatcgctatcgaactgttc1080gaaaacggtgacccgggtaaaccgaacgctgctctgaccgctgacatcgttacccgtgct1140cgtgaaaaaggtctgatcctgctgtcttgcggtccgtactacaacatccagcgtatcctg1200gttccgctgaccatcgaagcttctcagatccgtcagggtctggatatcatcgctcagtgc1260ttcgacgaagctaaacaggcttaa1284<210>2<211>427<212>PRT<213>假单胞杆菌(Pseudomonasfluorescens)<400>2MetAsnThrAsnAsnAlaLeuMetGlnArgArgHisAsnAlaValPro151015ArgGlyValGlyGlnIleGlnProIlePheAlaGluArgAlaGluAsn202530CysProValTrpAspValGluGlyArgGluTyrLeuAspPheAlaGly354045GlyIleAlaValLeuAsnThrGlyHisLeuHisProGlyIleValSer505560AlaValGluAlaGlnLeuLysLysLeuSerHisThrCysPheGlnVal65707580LeuAlaTyrGluProTyrLeuAlaLeuCysGluArgMetAsnGlnLys859095ValProGlyAspPheAlaLysLysThrLeuLeuValThrThrGlySer100105110GluAlaValValAsnAlaValLysIleAlaArgAlaAlaThrLysArg115120125SerGlyAlaIleAlaPheSerGlyAlaTyrHisGlyArgThrHisTyr130135140ThrLeuSerLeuThrGlyLysValHisProTyrSerAlaGlyMetGly145150155160LeuMetProGlyHisValTyrArgAlaLeuTyrProCysProLeuHis165170175AsnIleSerAspAspAspAlaIleAlaSerIleGluArgIlePheLys180185190AsnAspAlaAlaProGluAspIleAlaAlaIleIleIleGluProVal195200205GlnGlyGluGlyGlyPheTyrAlaAlaSerProAlaPheMetGlnArg210215220LeuArgAlaLeuCysAspGlnHisGlyIleMetLeuIleAlaAspGlu225230235240ValGlnSerGlyAlaGlyArgThrGlyThrLeuPheAlaMetGluGln245250255MetGlyValAlaAlaAspIleThrThrPheAlaLysSerIleAlaGly260265270GlyPheProLeuAlaGlyValThrGlyArgAlaAspValMetAspAla275280285IleAlaProGlyGlyLeuGlyGlyThrTyrAlaGlyAsnProIleAla290295300CysAlaAlaAlaLeuAlaValLeuAspIlePheGluGlnGluAsnLeu305310315320LeuGlnLysGlyAsnThrLeuGlyAsnThrLeuArgAspGlyLeuMet325330335GluIleAlaGluThrHisArgGluIleGlyAspValArgGlyLeuGly340345350AlaMetIleAlaIleGluLeuPheGluAsnGlyAspProGlyLysPro355360365AsnAlaAlaLeuThrAlaAspIleValThrArgAlaArgGluLysGly370375380LeuIleLeuLeuSerCysGlyProTyrTyrAsnIleGlnArgIleLeu385390395400ValProLeuThrIleGluAlaSerGlnIleArgGlnGlyLeuAspIle405410415IleAlaGlnCysPheAspGluAlaLysGlnAla420425<210>3<211>1284<212>DNA<213>假单胞杆菌(Pseudomonasfluorescens)<400>3atgaacaccaacaacgctctgatgcagcgtcgtcacaacgctgttccgcgtggtgttggt60cagatccacccgatcttcgctgaacgtgctgaaaactgccgtgtttgggacgttgaaggt120cgtgaatacctggacttcgctggtggtatcgctgttctgaacaccggtcacctgcacccg180ggtatcgtttctgctgttgaagctcagctgaaaaaactgtctcacacctgcttccaggtt240ctggcttacgaaccgtacctggctctgtgcgaacgtatgaaccagaaagttccgggtgac300ttcgctaaaaaaaccctgctggttaccaccggttctgaagctgttgaaaacgctgttaaa360atcgctcgtgctgctaccaaacgttctggtgctatcgctttctctggtgcttaccacggt420cgtacccactacaccctgtctctgaccggtaaagttcacccgtactctgctggtatgggt480ctgatgccgggtcacgtttaccgtgctctgtacccgtgcccgctgcacaacatctctgac540gacgacgctatcgcttctatcgaacgtatcttcaaaaacgacgctgctccggaagacatc600gctgctatcatcatcgaaccggttcagggtgaaggtggtttctacgctgcttctccggct660ttcatgcagcgtctgcgtgctctgtgcgaccagcacggtatcatgctgatcgctgacgaa720gttcagtctggtgctggtcgtaccggtaccctgttcgctatggaacagatgggtgttgct780gctgacatcaccaccttcgctaaatctatcgcgggcggcttcccgctggctggcgttacc840ggtcgtgctgacgttatggacgctatcgctccgggtggtctgggtggtacctacgctggt900aacccgatcgcttgcgctgctgctctggctgttctggacatcttcgaacaggaaaacctg960ctgcagaaagctaacaccctgggtaacaccctgcgtgacggtctgatggaaatcgctgaa1020acccaccgtgaaatcggtgacgttcgtggtctgggtgctatgatcgctatcgaactgttc1080gaaaacggtgacccgggtaaaccgaacgctgctctgaccgctgacatcgttacccgtgct1140cgtgaaaaaggtctgatcctgctgtcttgcggtccgtactacaacatcctgcgtatcctg1200gttccgctgaccatcgaagcttctcagatccgtcagggtctggaaatcatcgctcagtgc1260ttcgacgaagctaaacaggcttaa1284<210>4<211>427<212>PRT<213>假单胞杆菌(Pseudomonasfluorescens)<400>4MetAsnThrAsnAsnAlaLeuMetGlnArgArgHisAsnAlaValPro151015ArgGlyValGlyGlnIleHisProIlePheAlaGluArgAlaGluAsn202530CysArgValTrpAspValGluGlyArgGluTyrLeuAspPheAlaGly354045GlyIleAlaValLeuAsnThrGlyHisLeuHisProGlyIleValSer505560AlaValGluAlaGlnLeuLysLysLeuSerHisThrCysPheGlnVal65707580LeuAlaTyrGluProTyrLeuAlaLeuCysGluArgMetAsnGlnLys859095ValProGlyAspPheAlaLysLysThrLeuLeuValThrThrGlySer100105110GluAlaValGluAsnAlaValLysIleAlaArgAlaAlaThrLysArg115120125SerGlyAlaIleAlaPheSerGlyAlaTyrHisGlyArgThrHisTyr130135140ThrLeuSerLeuThrGlyLysValHisProTyrSerAlaGlyMetGly145150155160LeuMetProGlyHisValTyrArgAlaLeuTyrProCysProLeuHis165170175AsnIleSerAspAspAspAlaIleAlaSerIleGluArgIlePheLys180185190AsnAspAlaAlaProGluAspIleAlaAlaIleIleIleGluProVal195200205GlnGlyGluGlyGlyPheTyrAlaAlaSerProAlaPheMetGlnArg210215220LeuArgAlaLeuCysAspGlnHisGlyIleMetLeuIleAlaAspGlu225230235240ValGlnSerGlyAlaGlyArgThrGlyThrLeuPheAlaMetGluGln245250255MetGlyValAlaAlaAspIleThrThrPheAlaLysSerIleAlaGly260265270GlyPheProLeuAlaGlyValThrGlyArgAlaAspValMetAspAla275280285IleAlaProGlyGlyLeuGlyGlyThrTyrAlaGlyAsnProIleAla290295300CysAlaAlaAlaLeuAlaValLeuAspIlePheGluGlnGluAsnLeu305310315320LeuGlnLysAlaAsnThrLeuGlyAsnThrLeuArgAspGlyLeuMet325330335GluIleAlaGluThrHisArgGluIleGlyAspValArgGlyLeuGly340345350AlaMetIleAlaIleGluLeuPheGluAsnGlyAspProGlyLysPro355360365AsnAlaAlaLeuThrAlaAspIleValThrArgAlaArgGluLysGly370375380LeuIleLeuLeuSerCysGlyProTyrTyrAsnIleLeuArgIleLeu385390395400ValProLeuThrIleGluAlaSerGlnIleArgGlnGlyLeuGluIle405410415IleAlaGlnCysPheAspGluAlaLysGlnAla420425当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1