一种杨梅MrLFY基因及其应用的制作方法
本发明属于植物基因工程技术领域,具体涉及一种杨梅mrlfy基因及其应用。
背景技术
杨梅(morellarubra)是近年来推广较快的果树树种,具有很高的药用、食用和加工价值,其生长特点和环境要求尤其适合南方山地果园的营建。随着杨梅栽培面积的逐步扩大,杨梅童期时间长的特点造成了前期投资较大,严重制约了杨梅的栽培推广,嫁接技术也没有很好的解决这一问题。同时杨梅的花期和果实特点也提出了早花要求,因为杨梅主要分布在南方各省且果实不耐储存易受果蝇侵害,花期的提前可以使杨梅结果期提前,避开梅雨季和果蝇活动高峰期,增加果实品质和有效产量。
因此利用基因工程技术,可以通过克隆分离杨梅成花整合因子基因研究其功能,并通过测试这些基因对植物激素的应答情况研究各种植物激素诱导杨梅成花整合因子基因表达的能力,为应用植物生长调节剂调控杨梅花期提供技术支持。目前在许多具有成熟遗传转化体系的植物(包括果树)上都有转入成花整合因子基因使花期提前的报道,说明成花整合因子基因的作用机制和遗传转化研究可以极大地加速杨梅乃至果树的遗传改良进程,极具研究价值和应用前景。
leafy(lfy)基因是花分生组织特性基因,不但控制具有成花潜力分生组织向花分生组织的转变,还控制开花时间,在由营养生长向生殖生长转变过程中起主要的调控作用。目前已从多种果树如桃、龙眼、苹果、银杏、桉树等中克隆到lfy的同源基因。lfy基因的表达贯穿于花分生组织和花发育的各个阶段,被认为是花发育的主要调控基因。lfy基因的过量表达能使拟南芥花期提前,而转lfy基因杨树的顶端开花时间能够提前几个月。细胞分裂素信号也可以提高白芥中soc1、lfy和ap1同源基因的表达量。而在拟南芥中生长素信号通过其响应转录因子monopteros(mp)基因影响lfy基因的表达影响植物开花。
技术实现要素:
有鉴于此,本发明提出一种杨梅mrlfy基因及其应用。
为实现上述目的,本发明提供的技术方案是:一种杨梅mrlfy基因,所述杨梅mrlfy基因的核苷酸序列如序列表seqidno.1所示。
为实现上述目的,本发明提供的技术方案是:一种杨梅mrlfy基因的表达蛋白,所述杨梅mrlfy基因的表达蛋白的氨基酸序列如seqidno.2所示。
为实现上述目的,本发明提供的技术方案是:一种表达载体,其是在植物表达载体中插入了如序列表seqidno.1所示的核苷酸序列。
为实现上述目的,本发明提供的技术方案是:一种宿主细胞,所述宿主细胞含有如序列表seqidno.1所示的核苷酸序列。
为实现上述目的,本发明提供的技术方案是:一种杨梅mrlfy基因的应用,权利要求1所述的杨梅mrlfy基因在培育开花期提前的转基因植物中的应用。
所述植物为杨梅或拟南芥。
附图说明
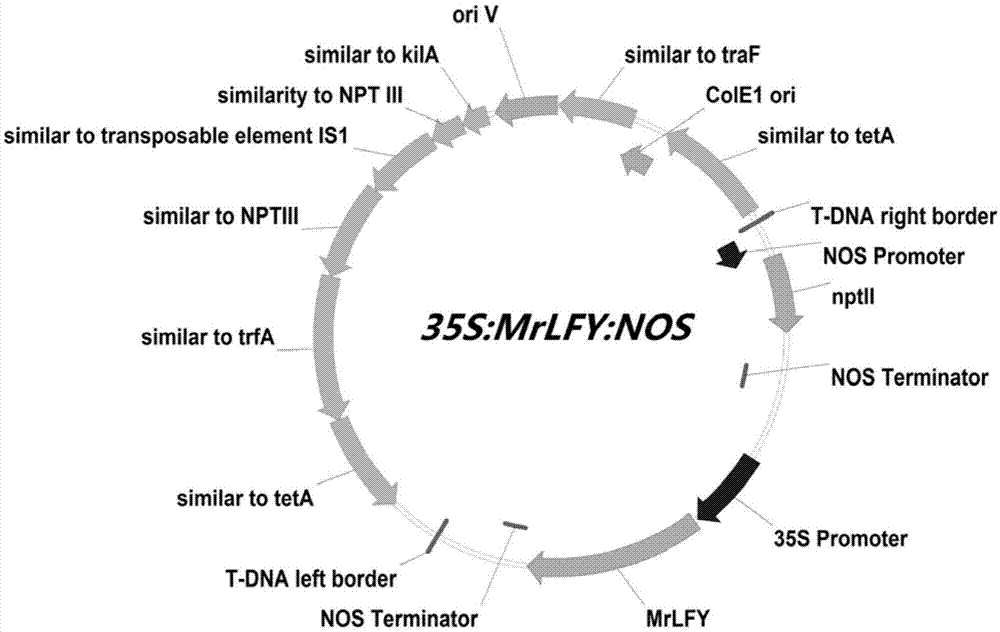
图1是杨梅mrlfy基因的过表达载体图。
图2是转基因阳性植株筛选结果图。
图3是转基因拟南芥植株pcr结果图。1-5为转基因植株用mrlfy基因引物pcr结果;m:dl2000marker;ck+:以载体质粒dna为阳性对照;ck-:野生型dna为阴性对照;水:空白对照;
图4是转mrlfy基因t2代植株与野生型拟南芥植株开花时间比较图,图中wt,野生型拟南芥;1-4,转mrlfy基因t2代的不同株系;测量15株,误差线表示15个重复的标准误差;**表示差异极显著,*表示差异显著。
图5是过表达mrlfy基因的t2代与野生型col拟南芥图(第25天)。
由于上述技术方案运用,本发明与现有技术相比具有的优点是:
与现有技术相比,本发明通过对杨梅mrlfy基因的克隆与鉴定,基因的表达分析,验证其功能,发现转mrlfy基因植株生长发育加速,开花期提前,可见该基因在杨梅和其它经济植物生产、育种中将有广泛的用途。
具体实施方式
以下由特定的具体实施例说明本发明的实施方式,熟悉此技术的人士可由本说明书所揭露的内容轻易地了解本发明的其他优点及功效。
参见图1~5所示,须知,本说明书所附图式所绘示的结构、比例、大小等,均仅用以配合说明书所揭示的内容,以供熟悉此技术的人士了解与阅读,并非用以限定本发明可实施的限定条件,故不具技术上的实质意义,任何结构的修饰、比例关系的改变或大小的调整,在不影响本发明所能产生的功效及所能达成的目的下,均应仍落在本发明所揭示的技术内容得能涵盖的范围内。同时,本说明书中所引用的如“上”、“下”、“左”、“右”、“中间”及“一”等的用语,亦仅为便于叙述的明了,而非用以限定本发明可实施的范围,其相对关系的改变或调整,在无实质变更技术内容下,当亦视为本发明可实施的范畴。
实施例1:一种杨梅mrlfy基因及其应用
本实施例所采用的材料是江苏省太湖常绿果树技术推广中心杨梅种质资源圃荸荠品种杨梅雌花芽,采后速冻于液氮中,超低温冰箱(-80℃)保存。
1)杨梅雌花芽总rna的提取
按照tiangen植物总rna提取试剂盒的说明书进行,具体操作为:在处理过的研钵中加入杨梅雌花芽及液氮,充分研磨后,加入600μl的rlbuffer和10μl的β-巯基乙醇;将研钵中的液体混合物转移至新的离心管中;盖紧管盖后,颠倒混匀数次,在56℃下静置孵育3min。充分裂解后转移至cs过滤柱,12000rpm离心5min,收集管中上清液转移至新的rnase-free离心管中;加入0.5倍体积的无水乙醇,混匀;将混合液移至试剂盒内提供cr3柱子中(下接2ml的收集管),12000rpm离心1min,弃滤液,将柱子放回收集管上;加入350μl的rw1buffer,12000rpm离心1min,弃滤液,将柱子放回收集管上;向柱子上加入80μl的dnasei工作液,室温静置孵育15min,12000rpm离心1min;再一次加入350μlrw1buffer,12000rpm离心1min,弃滤液,将离心柱放回收集管。向cr3吸附柱中加入500μl漂洗液rwbuffer,12000rpm离心1min,弃收集管,重复该步骤1次;将离心柱放入1.5ml的rnase-free离心管中,加入50μl的rnase-freeddh2o,12000rpm离心2min。所得的rna样品,检测其完整性和纯度后,置于-80℃超低温冰箱保存备用。
吸取2µlrna在1%琼脂糖凝胶电泳上进行检测,结果显示28s和18s条带较为清晰。28s条带亮度约为18s的两倍,rna质量较好。用nonodrop2000检测rna纯度,od260/od280为2.01,od260/od230为2.00,完整性较好,可用于反转录。
2)第一链cdna的合成
以所得到的杨梅雌花芽的总rna为模板,使用takara反转录试剂盒进行反转录,使用oligo(dt)作为锚定引物,反转录合成第一链cdna。具体操作如下:
在离心管中配制按照下列模板rna/引物的顺序配制混合物,总量为6μl:模板2μl,oligo(dt)12-18primer(50μm)3μl,rnase-freeddh2o1μl。在pcr仪上,70℃保温10min,后迅速将其置于冰上急速冷却2min以上。离心数秒,使得模板rna/引物的变性溶液聚集于离心管的底部。在上述离心管中配制反转录反应液(10μl):rna/引物的变性溶液6μl,5×m-mlvbuffer2μl,dntpmixture(10mm)0.5μl,rnaseinhibitor(40u/μl)0.25μl,rtasem-mlv(200u/μl)0.5μl,nase-freedh2o0.75μl。pcr仪上,42℃保温1h。pcr仪中,70℃保温15min,然后置于冰上冷却,得到cdna溶液。
3)目的基因引物的设计及克隆
根据现有的杨梅雌花芽转录组测序数据,利用其它物种的lfy基因序列进行blast同源比对。利用oligo7.0,prime5.0设计相应引物,引物序列为:
mrlfy-f:5'-atggatcccgatcctttcact-3',
mrlfy-r:5'-ttagaagcgcaggtcatcac-3'。
以cdna第一链为模板,利用超保真的phusiondna聚合酶进行杨梅基因的克隆。pcr扩增体系(50μl)为:25μl2×phusionmastermix,2μlforwardprimer,2μlreverseprimer,3μltemplatedna,18μlnuclease-freewater。pcr程序为:98℃5min;98℃30s,57℃30s,72℃1min40s,35cycles;72℃7min;4℃forever。
pcr反应完成后,取少量pcr产物(4μl左右)进行琼脂糖凝胶电泳检测,电泳后切割目的片段,凝胶回收纯化pcr目的扩增产物。采用axygen公司的dna凝胶回收试剂盒,进行目的片段纯化回收,具体操作为:在紫外灯下找到含有目的条带片段的琼脂凝胶,用刀片切下后用纸巾吸干表面液体,将其切碎后置于1.5ml离心管中。称量凝胶重量,将该重量作为一个凝胶体积(如100mg=100μl)。向离心管中加入3个凝胶体积的bufferde-a,混匀后置于75℃加热仪上加热,每2-3min间断混合一次,直至凝胶完全融化(时间大约为6-8min)。向离心管中加0.5个bufferde-a体积的bufferde-b,混合均匀;将混合液转移到dna制备管(置于2ml离心管)中,12000×g离心lmin,弃滤液。将制备管放回2ml离心管,加500μlbufferw1,12000×g离心30s,弃滤液。将制备管放回2ml离心管,加700μlbufferw2,12000×g离心30s,弃滤液。以同样方法再用700μlbufferw2洗涤一次,12000×g离心lmin。将制备管放回2ml离心管中,12000×g离心lmin。将制备管置于干净的1.5ml离心管中,在制备膜中央加25-30μleluent去离子水,室温下,静置lmin。12000×g离心lmin,洗脱dna。取2μl回收纯化后的产物,使用1%琼脂糖进行凝胶电泳检测。
4)目的片段与载体连接
克隆载体为takara公司的pmd19-tvector(d102a),进行连接反应,连接体系(10μl):5μlsolutioni,1μlpmd19-tvector,4μlpcr纯化产物(50ng)。轻轻吸打混匀后,使用离心机低速离心,水浴锅中16℃连接过夜。
5)大肠杆菌超级感受态细胞的制备
取置于-80℃超低温冰箱中保存的jm109菌株,用接种环取少量,在不含抗生素的lb培养基上进行划线,37℃培养箱内倒置培养12-16h。参考分子克隆实验指南,采用inoue方法制备大肠杆菌jm109超级感受态细胞,保存于-80℃,备用。
6)连接产物的转化
从超低温冰箱中取出感受态细胞jm109菌株,置于冰上融化。吸取5μl的过夜连接产物加入到100μl感受态细胞中;将离心管置于冰上冰浴30min;42℃水浴锅中水浴,热激90s,期间不要摇动;后立即置于冰上冰浴2min;在超净台中加入800μl无抗生素的液体培养基,37℃、180rpm摇1h复苏;4000rpm离心3min,吸去800μl上清;将沉淀的菌体重悬,涂于lb平板(amp的浓度为100mg/l),37℃培养过夜。
7)重组质粒的筛选及验证
挑取在含有抗生素(amp)的lb固体培养基上过夜生长的单菌落,接种到含有同样抗生素的750μl的lb液体培养基中。250rpm,37℃过夜培养。
pcr扩增体系为:2μl10×pcrbuffer,1.2μlmgcl2(25mm),0.4μldntp(10mm),1μlm13-f/r,2μl菌液,0.2μlrtaq,ddh2o补充到20μl。
pcr程序为:94℃5min;94℃30s,55℃30s,72℃1min40s,36cycles;72℃7min;4℃forever。
吸取10µl的pcr产物进行琼脂糖凝胶电泳检测分析。验证后,将条带大小正确的菌液样品委托上海英骏公司测序,测序引物为通用引物m13f/r。测序结果在ncbi上进行比对分析。
根据对测序结果的分析,最终确定克隆得到1个杨梅leafy基因,命名为mrlfy基因,其核苷酸序列如seqidno.1所示,mrlfy基因,片段长度为1173bp,含有atg起始密码子和taa终止密码子,其中orf全长为1173bp,编码390个氨基酸的蛋白质,该蛋白氨基酸序列如seqidno.2所示。
研究结果表明mrlfy在杨梅主要器官中都有表达。但是该基因在茎中的雌花芽中达量最高,说明花的生长发育中lfy基因表达活跃,在花的形成过程中中起着重要的调控作用。
实施例2
本实施例所用的植物材料为拟南芥(arabidopsisthaliana)col(columbia)野生型种子,由浙江农林大学惠赠。
本实施例所用的大肠杆菌菌株为e.colijm109;农杆菌菌株为eha105,分别用于转化拟南芥;试验中所用植物表达载体为pbi121。所有菌株购自相关生物公司。
1)mrlfy基因的pbi121载体的构建
将实施例1获得的mrlfy基因的orf全长序列与植物表达载体pbi121进行连接,构建的载体如图1。
2)质粒的提取:采用碱裂解法中量提取质粒。所用试剂为:solutioni:50mm葡萄糖,25mmtris-cl,10mmedta,ph8.0,高压灭菌15min,4℃保存。solutionii:10nnaoh2ml,0.1%sds10ml,88mlh2o,配制成100ml,现用现配。solutioniii:5mol/l醋酸钾60ml,醋酸11.5ml,ddh2o28.5ml,配制成100ml,4℃保存,用前冰浴(k+为3mol/l,ac为5mol/l)。
质粒提取的步骤为:取过夜培养的10ml菌液,12000rpm、2min离心,收集菌体;倒掉上清液,尽可能去掉培养基;将菌体重悬于400µlsolutioni中,剧烈震荡,尽可能打散;加800µlsolutionii,快速颠倒离心管(2ml大小的离心管),将混合后的内容物置于冰上;加入600µlsolutioniii,轻轻反复颠倒数次,使细菌裂解物分散后置于冰上3-5min;4℃,14000rpm离心5min,取2×850µl上清到两只洁净离心管中;加入等体积酚氯仿(可用氯仿代替),剧烈震荡混合水相和有机相,14000rpm离心2min,取上层水相到另外一只干净的离心管中(大约800µl);室温下加等体积氯仿:异丙醇,剧烈震荡混合均匀,室温放置2min;在室温下最大转速14000rmp离心5min,收集沉淀;小心去除上清,将离心管倒置于纸上,流干液体,尽量除去管壁上液体;加入1ml70%乙醇,颠倒混匀数次,使沉淀在乙醇中漂浮,室温下14000rmp离心2min;去除酒精,开口使液体完全挥发;用30µl含有rnasea(20µg/µl)的水进行溶解,4℃保存。
3)特异酶切位点的添加
以目的基因与克隆载体pmd19-t所构建的阳性重组质粒为模板,通过pcr方法在目的基因的两侧添加特异性酶切位点。杨梅mrlfy基因两侧添加xbai和saci酶切位点。pcr反应体系、程序及所使用引物如下:
pcr反应体系(20µl):2µl10×pcrbuffer,1.2µlmgcl2(25mm),0.4µldntp(10mm),1µlforwardprimer,1µlrorwardprimer,1µl质粒dna,0.2µlrtaq,13.2µlddh2o。
pcr反应程序:94℃5min;94℃30s,55-59℃30s,72℃1min40s,36cycles;72℃7min;4℃forever。
所使用的引物序列:
mrlfy-f+xbai:5'-tctagagatggatcccgatcctttcact-3',
mrlfy-r+saci:5'-gagctcttagaagcgcaggtcatcac-3'。
将得到的pcr产物用1%琼脂糖凝胶电泳分离,使用axyprepdnagelextractionkit试剂盒进行回收纯化,将回收后的产物与pmd19-tsimple连接,构建含有目的基因的中间载体。
4)双酶切反应
使用相应的内切酶进行酶切反应,得到含有粘性末端并覆盖整个orf的mrlfy基因片段。同时用同样的酶,处理空的pbi121表达载体。mrlfy酶切反应体系:2μl10×mbuffer,0.5μlxbai,0.5μlsaci,1μg回收产物/pbi121空载体质粒,ddh2o补充到20μl。37℃水浴,酶切4-6h。加入10×loadingbuffer缓冲液终止酶切反应。酶切产物用1%琼脂糖凝胶电泳进行分离检测,使用axyprepdnagelextractionkit(axygen)的试剂盒进行回收并纯化酶切产物,将其溶于20μl的ddh2o中。
5)连接反应
琼脂糖凝胶电泳检测酶切后所回收到的目的基因和载体pbi121,根据所检测出的纯度和浓度,按连接体系加入各试剂,16℃过夜连接。其中,目的片段分子数:载体分子数=3:1-5:1,连接反应体系为:2μlt4dnaligasebuffer(10×),2μl经过酶切的表达载体,10μl目的片段,1μlt4dnaligase,ddh2o补充至20μl。
6)连接产物转入大肠杆菌
将目的片段与载体pbi121连接后的产物转入大肠杆菌jm109超感细胞中,方法同实施例1。
7)重组子的鉴定
挑取平板上的单菌落接种到含有抗生素(卡那霉素)的lb液体培养基中,37℃、250rpm震荡培养过夜。使用目的基因全长引物进行菌液pcr,以筛选阳性克隆。筛选后的阳性克隆送上海英骏公司测序。同时使用axyprepplasmidminiprepkit(axygen)提取质粒并进行酶切验证,判断酶切后片段大小是否一致。
8)农杆菌感受态细胞的制备与转化
本实施例利用农杆菌gv3101来制备农杆菌感受态,进行拟南芥的侵染实验;农杆菌感受态制备过程为:挑取已经活化好的农杆菌单菌落,接种于5ml液体lb培养基中,28℃、250rpm摇菌培养20-24h;吸取2ml菌液,接种到含有50ml液体lb培养基的三角瓶中,28℃、250rpm摇菌至od600值为0.8左右;将扩大繁殖后的菌液置于冰上冰浴30min,4℃、5000rpm离心5min,弃上清;加入10ml经预冷的0.1mo1/lcacl2溶液,充分悬浮沉淀的菌体;4℃,5000rpm离心5min,弃去上清;加入1ml预冷的20mmo1/lcacl2溶液充分悬浮菌体,即得到所要制备的gv3101感受态细胞,用离心管将其分装成100µl/管,迅速加入20%的无菌甘油,-80℃放置保存。
重组子的农杆菌转化:冰浴,使农杆菌感受态细胞融化,将1-5µl经回收纯化后的质粒加入到200μl的农杆菌感受态中,轻轻混匀,冰浴30min;使用液氮速冻lmin,37℃水浴锅中热击1-5min,迅速置于冰上1-2min;加入800μl不含任何抗生素的lb培养基,28℃,100rpm复苏2-4h;4000rpm离心3min,吸掉部分培养基;使用移液枪充分混匀剩余的菌液,后涂抹于添加50mg/l卡那霉素和50mg/l链霉素(eha105)或100mg/l的庆大霉素(gv3101)的固体lb培基上;28℃倒置培养30-48h。
农杆菌重组子的鉴定:从平板培养基上挑取长出的单菌落,接种于含有相应抗生素的液体培养基中;28℃,220rpm培养过夜;使用35s-f分别搭配如下引物进行菌液pcr,引物序列为:
mrlfy-f:5'-atggatcccgatcctttcact-3',
mrlfy-r:5'-ttagaagcgcaggtcatcac-3'。
pcr产物经1%琼脂糖凝胶电泳检测,鉴定是否含有目的片段;鉴定出的阳性克隆,扩大培养后,采用碱裂解法提取质粒,进行双酶切验证;鉴定后的阳性克隆加入适量无菌甘油,于-80℃保存备用。
9)农杆菌介导的拟南芥的转化
采用花序侵染法将目的基因转入拟南芥中,具体操作方法为:拟南芥(col野生型)保持健康生长状态至开花;活化携带有目的基因的农杆菌eha105菌株。挑取单菌落,接种于5ml含有卡那霉素和链霉素的lb培养基上,28℃、250rpm摇菌至菌液刚刚变浑浊,约8-10h;吸取1ml菌液,接种到三角瓶中(50ml)摇菌24h,至od值约为0.8左右;将菌液5000rpm在室温下离心5min,去除上清后收集菌体,用5%蔗糖溶液悬浮;浸泡前,加入silwetl-77,浓度为0.05%(500μl/l),晃出泡沫;将拟南芥的地上部分在农杆菌悬浮溶液中浸泡15-30s,期间轻轻晃动;将浸过的拟南芥平躺在托盘中,用保鲜膜覆盖,锡箔纸密封避光,4℃,放置24h;揭开锡箔纸,正长条件下培养,当种子成熟时停止浇水。
5%蔗糖溶液重悬液各成分如下:ms培养基,添加蔗糖50g/l,mes0.5g/l,silwet-77500ul/l。(注意:配制后ph调制5.8,菌液离心重悬后再加入silwetl-77;重悬液和菌液的换算关系为:重悬液用量:菌液od*菌液体积=0.8*重悬液)。
10)转基因植株的筛选
收集的t1代转基因拟南芥的种子,用酒精和升汞进行灭菌,步骤为:取适量获得的转基因种子放置于1.5ml离心管中,用75%酒精浸泡30s;0.1%升汞灭菌2min30s;无菌水冲洗3-4次,第一次冲洗后更换经高压灭菌的新离心管;用0.1%琼脂糖溶液悬浮。
将灭菌后的转基因拟南芥种子播种于含有抗生素(卡那霉素50mg/l和头孢霉素100mg/l)的1/2ms固体培养基上。22℃,光照培养。大约一周后将培养基上可以正常生长的拟南芥移植与土中,继续生长,结果如图2所示。
11)转基因植株的检测
取适量拟南芥和转基因植株的幼嫩叶片,采用ctab法提取dna,具体操作步骤为:将适量叶片置于灭菌处理后的2ml离心管中,加入700µl的ctab溶液,用球磨仪彻底研磨,65℃静置10min;加入等体积的氯仿:异戊醇,数次颠倒使其混合均匀,14000rpm离心10min;将上清移至新的无菌离心管中,加入等体积的异丙醇,颠倒混匀数次,室温静置2min,14000rpm离心10min,倒掉上清;加入70%的无水乙醇,使用移液枪吹打洗涤两次,14000rpm离心1min,弃去上清;吹干表面液体,加入20µlddh2o溶解。取上述提取的转基因和野生型拟南芥的dna,分别用mrlfy基因的特异性引物进行pcr检测。
杨梅mrlfy基因转化拟南芥后,转基因植株的检测使用两对引物,只有两对引物都能扩增出特异性条带才确定植株为转基因植株。共获得11棵拟南芥转mrlfy基因植株系。以重组质粒为阳性对照,以野生型为阴性对照,以水为空白对照,pcr结果如图3所示。
12)表型观察
不同代转基因植株的获得:收获的转基因t1代种子经灭菌,筛选培养后,再移植于营养土中,22℃,16h光照/8h黑暗培养;经检测后保留初步确认的转基因植株,待成熟后收获t1代种子,进行编号,得到t2代;同t1代一样,将t2代种子经灭菌后涂布于含抗生素的筛选培养基上,置于22℃,连续光照;10天左右,对不同编号的t2代种子进行存活率统计,选取存活比例为75%的植株移植与营养土中按照22℃,16h光照/8h黑暗培养,并取叶片进行阳性检测;阳性t2代植株继续进行编号,收集种子,得到t3代种子;将种子灭菌后,用筛选培养基筛选,置于光下连续光照培养;10天左右,观察不同编号的t3代植株,全部存活并且没有出现分离的为t3代纯合植株。
将过表达的杨梅mrlfy基因的35s:mrlfy:nos转入模式植物拟南芥中,观察t2代转基因拟南芥的表型。
对得到的转基因株系分批次进行观察。
选取其中表型明显的4个转基因株系,共60棵转基因的植株和15棵野生型植株进行开花时间统计,并进行数据分析。
对4个转基因株系60棵过表达杨梅mrlfy基因的植株,发现转基因t2代植株的开花时间比野生型植株早(图4),生长发育阶段也早于野生型(图5)。转基因植株开花时间比野生型早3-6d左右。
上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
序列表
<110>江苏省太湖常绿果树技术推广中心
<120>一种杨梅mrlfy基因及其应用
<160>6
<210>1
<211>1173
<212>dna
<213>杨梅
<400>1
atggatcccgatcctttcactgcgagtttgttcaagtgggacccgagaggggtagtccct60
cctccgaaccggctgctagaagcggtggctcctcaagcaccacccccacctccagcagct120
gcggctgcgtcatactcgatgcggccgagggagctgggtgggcttgaggacttattccag180
gcttacgggatcagatactacacggcggcgaggatagcagagctagggttcacggtaagt240
acgctgttggacatgaaggacgatgagctggatgacatgatgaacagcctctctcagata300
ttcaggtgggaccttcttgttggggagagatacggtatcaaagctgcagttagagccgag360
cgcagacgcctcgatgaggaggactctcgccgtcgtcacctgctctccgccgacaccacc420
accaacgctttcgatgctctctcccaagaaggactgtccgaagagcctgtgcaacaggag480
aaggaagtggtgggaagcggaggaggtgggacgtgggaagtggtggcggctggagagaga540
aggagacagcggcggaggaagagccagaggaaggtaccggacgttgattatgattacgag600
ggcgcggacgatgttgacaatggtaatggaaatagcggtggaagtgagagacagcgggag660
catcccttcatagtaacggagcccggtgaggtggcacgaggcaagaagaacggtcttgat720
tacctcttccatctctacgagcagtgtcgtgatttcttgatccaggtccagaatattgca780
aaggagcgcggtgaaaaatgccccactaaggtgacgaaccaagtcttcaggtatgccaag840
aaggctggagcgagctacattaacaaacccaaaatgcgacactacgtgcattgttatgcg900
ctgcactgcatcgacgaggaagtgtccaatgcactgagaggaactttcaaggaaagagga960
gagaatgttggggcgtggaggcaagcatgctacaagcctctggtggccatagcagcacgc1120
caagggtgggacattgatgccattttcaacgcacacccgcgtctatccatttggtatgta1180
ccaaccaaacttcgtcaactttgtcacaccgagcgaaataatgccgcaggttccagctct1240
gtttctgttggcggtgatgacctgcgcttctaa1273
<210>2
<211>390
<212>prt
<213>杨梅
<400>2
mdpdpftaslfkwdprgvvpppnrlleavapqapppppaa40
aaasysmrprelggledlfqaygiryytaariaelgftvs80
tlldmkddelddmmnslsqifrwdllvgerygikaavra120
errrldeedsrrrhllsadtttnafdalsqeglseepvqq160
ekevvgsggggtwevvaagerrrqrrrksqrkvpdvdy200
dyegaddvdngngnsggserqrehpfivtepgevargkk240
ngldylfhlyeqcrdfliqvqniakergekcptkvtnqvf280
ryakkagasyinkpkmrhyvhcyalhcideevsnalrgt320
fkergenvgawrqacykplvaiaarqgwdidaifnahpr360
lsiwyvptklrqlchternnaagsssvsvggddlrf390
<210>3
<211>21
<212>dna
<213>人工序列
<223>mrlfy-f
<400>3
atggatcccgatcctttcact
<210>4
<211>20
<212>dna
<213>人工序列
<223>mrlfy-r
<400>4
ttagaagcgcaggtcatcac
<210>5
<211>28
<212>dna
<213>人工序列
<223>mrlfy-f+xbai
<400>5
tctagagatggatcccgatcctttcact
<210>6
<211>26
<212>dna
<213>人工序列
<223>mrlfy-r+saci
<400>6
gagctcttagaagcgcaggtcatcac
- 还没有人留言评论。精彩留言会获得点赞!