用于提取游离DNA的试剂盒和方法与流程
本发明属于生物医学检测领域,涉及核酸纯化技术,特别涉及用于提取游离dna的试剂盒和方法,更特别涉及用于提取血浆或血清中游离dna的试剂盒和方法。
背景技术:
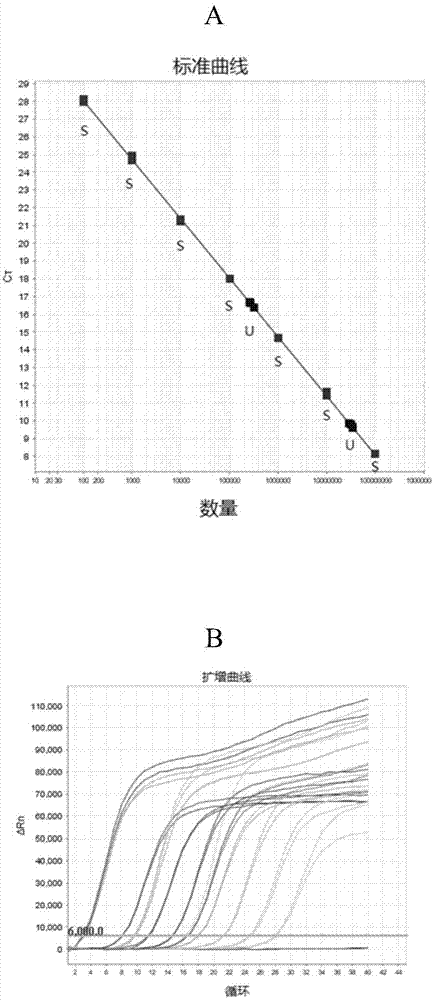
游离dna是指循环血中游离于细胞外的、部分降解了的机体内源性dna。游离dna大部分都是双链dna分子,其片段长度远小于基因组dna,集中在0.18~21kb之间。因为游离dna在机体内的含量是机体健康状态的一个重要指标,对疾病的早期诊断、预后、检测都具有重要的意义,因此近年来人们对于游离dna特性的研究越来越深入。这一切都对游离dna的提取技术提出了更高的要求。在游离dna的提取中,需要得到满足的原则一般有:1.保证核酸一级结构的完整性;2.将其他生物大分子的污染降到最低程度;3.应当尽量去除其他核酸分子如rna;4.得到的核酸样品中不应当存在对酶有抑制作用的有机溶剂和过高浓度的金属离子,从而对下游的进一步处理不会带来不良的影响。大多数核酸提取方法一般都包括了细胞裂解、酶处理、核酸分离与纯化等几个主要步骤。每一个步骤又可由多种不同的方法单独或联合实现。细胞裂解可以通过机械作用、化学作用、酶作用的方式来实现。机械作用包括低渗裂解、超声裂解、微波裂解、冻融裂解和颗粒破碎等物理裂解方法。化学作用包括在一定ph环境和变性条件(如加热、表面活性剂、强离子剂等)下使细胞破裂、蛋白质变性沉淀、核酸被释放到水相。酶作用主要是通过加入溶菌酶或蛋白酶使细胞破裂、核酸释放。在核酸提取过程中,可以通过加入适当的酶使不需要的物质降解,以利于核酸的分离与纯化。如在裂解液中加入蛋白酶可以降解蛋白质,灭活核酸酶dnase和rnase。对核酸的分离与纯化而言,传统的酚-氯仿提取法成本较低,但是效率差、重复性差,更是有不可避免的毒性。硅胶柱法简便快捷、纯度较高,但是不适合较小的片段。目前常用的磁珠法能够自动化操作,也适用于小片段,但是提取纯度低、有盐分残留,也不适合微量提取。另外,目前游离dna提取的试剂盒大多是国外进口的试剂盒,其虽然提取效果较好,但是价格昂贵,为消费者带来了沉重的经济负担。本领域急需能够经济、高效、稳定实现游离dna提取的更优方案。技术实现要素:本发明提供了用于提取游离dna的试剂盒和方法,更特别地提供了用于提取血浆或血清中游离dna的试剂盒和方法。本发明的试剂盒和方法通过其特定的试剂组合,以高提取效率、低提取下限和优良的稳定性实现了对样品中、特别是血浆或血清中游离dna的可靠提取。本发明的试剂盒主要包含以下组分:核酸提取试剂(2),其包含异硫氰酸胍35-45g/100ml,曲拉通(tx-100)5%-20%(v/v),柠檬酸0-2g/l,柠檬酸钠0-15g/l,mgcl20-2g/l,异丙醇10%-40%,ph4.0-7.0;核酸提取试剂(4),其包含异硫氰酸胍10-40g/100ml,tris碱5-15g/l,曲拉通(tx-100)5-20%(v/v),edta0-10g/l,ph6.0-8.0,任选地还含有无水乙醇50-80%(v/v);核酸提取试剂(5),其包含tris碱0-15g/l,ph8.0-10.0,任选地还含有无水乙醇50-80%(v/v);和核酸提取试剂(6),其包含tris碱0-2g/l,ph7.0-9.0。本发明的核酸提取试剂(2)中柠檬酸的含量为0-2g/l,优选1-2g/l,更优选1.5-2g/l。核酸提取试剂(2)中柠檬酸钠含量为0-15g/l,优选0-10g/l,更优选5-10g/l。核酸提取试剂(2)的ph为4.0-7.0,优选4.0-6.0,更优选4.0-5.0。在本发明的试剂盒的一个优选的实施方式中,核酸提取试剂(2)包含异硫氰酸胍40-45g/100ml,曲拉通15-20%(v/v),柠檬酸1-2g/l,柠檬酸钠0-10g/l,mgcl21-2g/l,异丙醇30%-40%,ph4.0-6.0。本发明的核酸提取试剂(4)中,tris碱含量为5-15g/l,优选10-15g/l,更优选12-15g/l。核酸提取试剂(4)的ph为6.0-8.0,优选7.0-8.0,更优选7.0-7.5。在本发明的试剂盒的一个优选的实施方式中,核酸提取试剂(4)优选地包含异硫氰酸胍20-40g/100ml,tris碱10-15g/l,曲拉通(tx-100)10-15%(v/v),edta5-10g/l,ph7.0-8.0,任选地还含有无水乙醇50-60%(v/v)。本发明的核酸提取试剂(5)中,tris碱含量为0-15g/l,优选10-15g/l,更优选10-13g/l。核酸提取试剂(5)的ph为8.0-10.0,优选9.0-10.0,更优选9.0-9.5。在本发明的试剂盒的一个优选的实施方式中,核酸提取试剂(5)优选地包含tris碱10-15g/l,ph9.0-10.0,任选地还含有无水乙醇60-80%(v/v)。在本发明的试剂盒的一个优选的实施方式中,无水乙醇在使用前添加至核酸提取试剂(4)和核酸提取试剂(5)中。本发明的试剂盒还可以包含核酸提取试剂(1),通常为细胞裂解试剂。例如在一个实施方式中,本发明的试剂盒还包含作为核酸提取试剂(1)的蛋白酶k。在一个优选的实施方式中,核酸提取试剂(1)为10-40mg/ml的蛋白酶k。在一个更优选的实施方式中,核酸提取试剂(1)是20mg/ml的蛋白酶k。本领域技术人员可以理解,在其他实施方式中,本发明的试剂盒还可1以使用其他种类的细胞裂解试剂,例如溶菌酶,或者甚至不使用细胞裂解试剂,而是采用其他机械或物理方式来来裂解细胞。本发明的试剂盒还可以包含核酸提取试剂(3),通常是核酸分子结合试剂。本领域技术人员熟知的核酸分子结合试剂包括本领域公知适用于磁珠法提取核酸的任何磁珠,包括可商购的各种磁珠,如硅基包被磁珠、氨基包被磁珠、羧基包被磁珠等。例如在一个实施方式中,本发明的试剂盒为磁珠法核酸提取试剂盒,其包含作为核酸提取试剂(3)的磁珠。在一个优选的实施方式中,核酸提取试剂(3)为10-50mg/ml的磁珠。在一个更优选的实施方式中,核酸提取试剂(3)为25mg/ml的磁珠。本发明还涉及使用本发明的核酸提取试剂盒提取样品中游离dna的方法,特别是提取血浆或血清中游离dna的方法。在一个优选的实施方式中,使用所述试剂盒提取游离dna的流程如下:a)向1.5ml低吸附离心管中加入20μl核酸提取试剂(1),10μl核酸提取试剂(3),400μl血浆样本,涡旋混匀。b)向离心管中加入550μl核酸提取试剂(2),室温颠倒混匀15min。c)瞬离离心管,将离心管置于磁力架上2min。d)去上清,向离心管中加入500μl加了无水乙醇的核酸提取试剂(4),涡旋混匀15s。e)瞬离离心管,将离心管置于磁力架上2min。f)去上清,向离心管中加入500μl加了无水乙醇的核酸提取试剂(5),涡旋混匀15s。g)瞬离离心管,将离心管置于磁力架上2min。h)去上清,瞬离离心管,将离心管置于磁力架上1min,用10μl枪头吸尽残液,室温干燥两分钟。i)向离心管中加入30-50μl核酸提取试剂(6),涡旋混匀10s,60℃温育10min。j)将温育完成的离心管置于磁力架2min。k)转移上清到新的1.5ml离心管中备用。若不及时使用,应将提取的核酸保存于-20℃以下。本发明的试剂盒中使用的试剂组合提高了游离dna提取的回收效率和可重复性,相对于现有技术具有长足的进步。附图说明图1展示了adh100bp基因片段的定量结果(标准曲线和扩增曲线,阈值6000)。图1a:target:target1;slope:-3.318;y-inter:34.646;r2:1;eff%:100.168。s:standard;u:unknown;uf:unknown(flagged)。图2展示了使用配方a(本发明的maccura试剂盒)、配方b(mapurecirculatingdnakit(0.4ml))和配方c定量结果的比较(标准曲线和扩增曲线,阈值0.4)。图2a:target:target1;slope:-3.506;y-inter:34.527;r2:1;eff%:92.849。图2b:2e1浓度样本扩增曲线。图2c:2e2浓度样本扩增曲线。图2d:2e3浓度样本扩增曲线。图2e:2e4浓度样本扩增曲线。图3展示了配方a(本发明的maccura试剂盒)和配方b(mapurecirculatingdnakit(0.4ml))提取下限的比较(标准曲线和扩增曲线,阈值0.4)。图3a:target:target1;slope:-3.506;y-inter:34.527;r2:1;eff%:92.849。图4展示了配方a(本发明的maccura试剂盒)提取稳定性的验证(标准曲线和扩增曲线,阈值0.4)。图4a:target:target1;slope:-3.454;y-inter:34.781;r2:1;eff%:94.788。本文还包括以下的实施例,用于以例证的方式更清楚、明确地阐述本发明的技术方案。本领域技术人员根据本文的公开应当理解,可以在所公开的特定的实施方式中进行许多改变但是仍然获得相似或类似的结果,而不偏离本发明的思想和范围。本发明的具体实施方式仅用于解释本发明,而非意图通过任何方式限制本发明。具体实施方式材料与方法1.仪器:生物安全柜(bsc-1300iib2),干式恒温器(k30),掌上离心机,漩涡震荡仪(mx-s)、垂直混匀仪(hs-3),磁力架(invitrogendynamag-2),荧光定量pcr仪(abisteponeplus)2.耗材:10ml离心管、1.5ml离心管3.样本:名称批号(接收日期)来源血浆样本样本组adh-100双链dna生工合成4.试剂:名称批号来源核酸提取试剂(2)031816maccura核酸提取试剂(1)031816maccura核酸提取试剂(3)2016052402上海奥润微纳新材料科技有限公司核酸提取试剂(4)031816maccura核酸提取试剂(5)031816maccura核酸提取试剂(6)031816maccura乙醇成都科龙adh100扩增试剂1031816maccuraadh100扩增试剂2031816maccura实施例1100bp双链dna的合成及荧光定量pcr定量1.100bp双链dna的合成由生工生物商业合成100bp双链dna(拟南芥adh基因),用无酶水稀释102、104倍。按照下表体系配制扩增反应体系:反应体系名称测试用量(μl/测试)adh100扩增试剂117.5adh100扩增试剂20.5配好后,按18μl/测试分装。每个测试加入2μl稀释好的双链dna。按下表设置上机程序,上机。荧光通道选择:reporter:fam,反应体积:20μl。2.100bp双链dna的定量标准曲线和扩增曲线展示于图1中。扩增ct值统计:合成的基因片段定量线性关系良好,定量比较准确。实施例2血浆游离dna提取试剂的制备分别制备以下三种配方,用于提取样品中的血浆游离dna。配方a:本发明的maccura试剂盒按照如下配比配制提取体系。配方b:购自magen(美基生物)公司的mapurecirculatingdnakit(0.4ml),货号12919w(96preps)。配方c:核酸提取试剂(1):蛋白酶k20mg/ml;核酸提取试剂(2)(裂解液):盐酸胍573.18g/l,曲拉通(tx-100)200ml/l,柠檬酸1.68g/l,柠檬酸钠7.35g/l,ph为4.4±0.1;核酸提取试剂(3):磁珠,100%;核酸提取试剂(4)(洗涤液i):盐酸胍382.12g/l,柠檬酸1.05g/l,柠檬酸钠11.76g/l,异丙醇400ml/l,ph为5.4±0.1;核酸提取试剂(5)(洗涤液ii):氯化钠5.84g/l,曲拉通(tx-100)10ml/l;核酸提取试剂(6):矿物油100%(v/v);核酸提取试剂(7):1mtris(ph8.0)10ml/l,0.5medta(ph8.0)2ml/l。实施例3血浆游离dna的提取及定量用2e5(2×105拷贝/μl)浓度的双链dna按10倍比例用血浆稀释为2e4(2×104拷贝/μl)、2e3(2×103拷贝/μl)、2e2(2×102拷贝/μl)、2e1(2×101拷贝/μl)模拟临床样本,分别使用实施例2中制得的配方a(本发明的maccura试剂盒)、配方b(mapurecirculatingdnakit(0.4ml))和配方c提取,每个浓度两个重复,对比提取效果。1、核酸提取方法a、使用配方a(本发明的maccura试剂盒)的核酸提取在如实施例2中所述制备的配方a的核酸提取试剂(4)中加入60%的无水乙醇,在如实施例2中所述制备的配方a的核酸提取试剂(5)中加入75%的无水乙醇。通过如下流程进行核酸提取:a)向1.5ml低吸附离心管中加入20μl核酸提取试剂(1),10μl核酸提取试剂(3),400μl血浆样本,涡旋混匀;b)向离心管中加入550μl核酸提取试剂(2),室温颠倒混匀15min;c)瞬离离心管,将离心管置于磁力架上2min;d)去上清,向离心管中加入500μl加了无水乙醇的核酸提取试剂(4),涡旋混匀15s;e)瞬离离心管,将离心管置于磁力架上2min;f)去上清,向离心管中加入550μl加了无水乙醇的核酸提取试剂(5),涡旋混匀15s;g)瞬离离心管,将离心管置于磁力架上2min;h)去上清,瞬离离心管,将离心管置于磁力架上1min,用10μl枪头吸尽残液,室温干燥两分钟;i)向离心管中加入30μl核酸提取试剂(6),涡旋混匀10s,60℃温育10min;j)将温育完成的离心管置于磁力架2min;k)转移上清到新的1.5ml离心管中备用。b、使用配方b(mapurecirculatingdnakit(0.4ml))的核酸提取按照mapurecirculatingdnakit(0.4ml)试剂盒说明书操作进行核酸提取。c、使用配方c的核酸提取通过如下流程进行核酸提取:a)2.0ml离心管,每管加入20μl核酸提取试剂(1);b)每管加入400μl待测样本,盖上管盖,振荡混匀5秒,瞬时离心;c)每管加入1200μl核酸提取试剂(2)以及10μl核酸提取试剂(3),盖上管盖,振荡混匀10秒,室温静置10分钟;d)瞬时离心,将离心管置于磁性分离器上,3分钟后缓慢将溶液吸出(注意不要碰到吸附于管壁的棕色物);e)每管加入800μl核酸提取试剂(4),振荡混匀5秒,瞬时离心后将离心管再次置于磁性分离器上,3分钟后缓慢将溶液吸出(注意不要碰到吸附于管壁的棕色物);f)每管加入700μl核酸提取试剂(5)和100μl核酸提取试剂(6),振荡混匀5秒,瞬时离心后将离心管再次置于磁性分离器上;g)约3分钟后,上清液分为两层,将吸头伸入离心管底部,从底部开始缓慢将液体完全吸出丢弃;瞬时离心30秒后将离心管置于磁性分离器上;h)约3分钟后,将管底残余液体完全吸出丢弃;i)每管加入30μl核酸提取试剂(7),振荡混匀使离心管壁的棕色残留物完全洗脱于溶液中,60℃温浴10分钟;j)瞬时离心,将离心管置于磁性分离器上静置3分钟,上清液用于后续实验。2、核酸的扩增及定量按照下表体系配制反应体系:反应体系名称1测试用量(μl/测试)adh100扩增试剂117.5adh100扩增试剂20.5配好后,按18μl/测试分装。每个测试加入2μl稀释好的双链dna。按下表设置上机程序,上机。荧光通道选择:reporter:fam,反应体积:20μl。3、实验结果标准曲线与扩增曲线展示于图2中。扩增ct值统计:由上表和图2可以看出,配方a和配方b对于对2e1至2e4浓度的模拟样本的提取效果显著优于配方c,配方c可能不适用于血浆游离dna的提取。同时,配方a提取效果略优于配方b,其对游离dna的提取能力在国产血浆游离dna提取试剂盒中处于领先地位。实施例4血浆游离dna提取下限的比较将2e1(2×101拷贝/μl)浓度样本用血浆做10倍梯度稀释,分别标记为j1、j2、j3、j4,如实施例2和3所述分别用配方a(本发明的maccura试剂盒)和配方b(mapurecirculatingdnakit(0.4ml))提取,每个梯度两个重复。标准曲线和扩增曲线展示于图3中。ct值及拷贝数统计见下表。配方b的检出下线为j4浓度模拟样本,配方a提取j4浓度的模拟样本时检出率为100%,平均ct值31.12,低于配方b的31.82。由此可见,配方a的检出下限与配方b至少持平,甚至更低。实施例5血浆游离dna提取的稳定性为了检验本发明的试剂盒提取血浆游离dna的稳定性,如实施例2和3所述用配方a(本发明的maccura试剂盒)提取20份j4浓度样本,并进行qpcr扩增定量。标准曲线和扩增曲线展示于图4中。根据上表计算20次检测的标准偏差仅为0.72,说明多个重复的实验结果非常稳定。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1